- 研究
- 开放访问
- 发表:
基因表达的差异Fusarium oxysporum亚麻抗性和敏感基因型的感染(Linum Usitatissimum.l .)
BMC植物生物学体积17.文章编号:253.(2017)
抽象的
背景
亚麻(Linum Usitatissimum.)是一种用于生产纤维和油脂的作物。虽然已经开发出了潜在的高产亚麻品种,但环境胁迫显著降低了亚麻产量。在生物应激中,Fusarium oxysporumf . sp。利尼被认为是最疣的亚麻病原体之一。它导致枯萎病是全球亚麻生产的主要限制因素之一。抗亚麻品种的育种和培养F. oxysporum.是控制枯萎病的最有效方法。虽然亚麻反应的机制镰刀目前,关于植物对感染和抗性候选基因的反应的研究非常有限。
结果
2个抗病品种和2个感病品种对枯萎病的转录组及2个抗病品种BC的转录组2F5.种群,在控制条件下或接种F. oxysporum.利用Illumina平台进行测序。基因在表达上的变化F. oxysporum.分别鉴定了抗病和感病亚麻基因型。我们观察到涉及防御反应的许多基因的主要过度表达。这在抗性品种中更加明显。在敏感的品种中,响应于以下观察到涉及细胞壁组织或生物发生的基因的显着下调。F. oxysporum..抗性基因型中NAD(P)H氧化酶活性相关基因表达上调。许多基因,包括编码β -1,3-葡聚糖酶的基因,在品种和BC中显著上调2F5.抗镰刀枯萎病的人群比在易感品种中抗腐败F. oxysporum.感染。
结论
使用高通量测序,我们确定了涉及早期防御响应的基因l . usitatissimum对真菌F. oxysporum..回应F. oxysporum.在感染过程中,我们检测到发病相关蛋白编码基因和参与ROS产生或与细胞壁生物发生相关基因的表达变化。此外,我们还鉴定了在亚麻抗枯萎病基因型中特异性上调的基因。我们认为鉴定的基因在抗病品种和BC中均有表达2F5.显示诱导表达的群体响应F. oxysporum.感染是最有希望的抗药基因候选。
背景
亚麻(Linum Usitatissimum.L.)是一种广泛分布的作物,用于纤维和石油生产[1].遗传多态性l . usitatissimum相关物种具有很好的特征[2那3.那4.那5.那6.那7.]并且可用于改善品种的繁殖。尽管先前已经开发出潜在的高产亚麻品种,但生物和非生物胁迫可显着降低亚麻生产。因此,亚麻反应下面的分子机制被深入研究了不利环境。在这方面,在非生物胁迫下在亚麻植物中检测到应激响应基因和微大稻草表达的变化,例如干旱[8.]、盐度及碱度[9.那10.,营养不平衡[11.],高浓度的铝离子[12.那13.].
在生物应激中,Fusarium oxysporumf . sp。利尼被认为是最毁灭性的亚麻病原体之一。它会导致枯萎病,这是全球大多数亚麻籽生长区域的亚麻生产的主要限制因素之一。该疾病的流行病可以产生80%至100%的收益率[14.].抗亚麻品种的育种和培养F. oxysporum.是控制枯萎病的最有效的方法,在这方面,对血清枯萎病的抗血糖种质的评价已经揭示了育种计划中具有潜在效用的过程[15.].此外,搜索赋予抵抗力的基因镰刀通过对一个由双单倍体系衍生的亚麻定位群体的扩增片段长度多态性(AFLP)分析,已经鉴定出两个与抗枯萎病相关的数量性状位点[16.].但是,定义耐受性的基因镰刀在一些亚麻中,基因型仍然未知。
亚麻属植物发生的变化镰刀已经积极研究了感染,并且在某些情况下,阐明了依赖性反应的分子机制。伴随的病因相关(PR)蛋白(PR)蛋白的作用,包括几丁质酶和β-1,3-葡聚糖酶,响应于镰刀一直显示。几丁质酶基因在亚麻中已被鉴定F. oxysporum.感染 [17.].具有β-1,3-葡聚糖酶基因异位表达的亚麻线或内源性β-1,3-葡聚糖酶基因的过表达显示出增强的抗性F. oxysporum.和F. Culmorum.[18.那19.].此外,具有过表达β-1,3-葡聚糖酶的那些亚麻植物具有增加的抗氧化剂,酚类和多胺的含量,以及细胞壁生物聚合物组合物的改变[18.那19.那20.].在转基因亚麻植物中也观察到通过增加抗氧化活性的增强的抗性,具有增加的黄酮类化合物,类胡萝卜素或其他三萜胶质植物[21.那22.那23.].此外,抗氧化剂和细胞壁组分的参与在亚麻响应中镰刀已经被证明在不同的植物材料,包括细胞培养,种子,和幼苗。亚麻细胞内的氧化爆发、脂质过氧化激活和苯丙素代谢在互作作用下被观察到F. oxysporum.[24.].苯丙烷丙醇抗氧化剂潜力的贡献,其在种子中积聚,果胶含量造成血管含量镰刀也被确定了[25.],如亚麻籽幼苗中的果胶代谢的变化镰刀感染 [26.].在亚麻植物的早期阶段检测到参与应激反应,防御响应,代谢调节的基因表达,防御反应,代谢调节的变化,以及苯丙砜途径镰刀感染 [27.研究表明,亚麻植株中水杨酸甲酯水平的升高是对黄萎病的响应F. oxysporum.与苯丙砜途径的激活有关[28.].多胺响应的角色镰刀也被揭露[29.].感染后亚麻植物的RNA-SEQF. oxysporum.允许鉴定参与信号转导、转录调节、激素信号、活性氧(ROS)调节、次级代谢和其他过程的基因表达的变化[17.].因此,已经有各种定地确定了PR-蛋白,抗氧化剂和细胞壁部件参与亚麻响应镰刀感染。
在本研究中,我们采用高通量测序的转录组来评估亚麻基因表达的变化F. oxysporum.抗病和感病亚麻品种和BC2F5.群体,后者是由抗病品种和感病品种杂交获得,然后选择抗病品种和感病品种F. oxysporum.与易感亲本表型相似数代。这种方法使我们能够识别具有抗性的候选基因F. oxysporum.感染L. Usitatissimum。
方法
植物材料
具有抗性和易感性的亚麻形式鉴定的实验F. oxysporum.以前在全俄罗斯亚麻(Torzhok,俄罗斯)研究所进行过。基于所得的结果,选择两个抗性(达科他州和#3896)和两个易感(AP5和TOST)品种用于考试在本研究中。此外,耐粮杂种抗性和易感性F. oxysporum.在同一研究所获得。易感品种AP5与耐药品种(Dakota和#3896)交叉,由此产生的f1植株回交至AP5。随后,选择对刺激性背景(土壤接种的隔离Fusarium oxysporumf . sp。利尼已经进行了并且选择了抗性但与AP5品种相似的抗性的植物。然后选择进一步的回流,并再次选择与AP5类似的耐药植物。此后,BC的自我授粉2F1对表型与AP5相似的抗性个体和抗性家族进行5代筛选。结果,BC2F5.人口抵抗F. oxysporum.分别为#3896 × АР5(复发父母АР5)和Dakota × АР5(复发父母АР5)。
因此,两种具有抗性(达科他州和#3896)的品种和两种具有易感性(AP5和TOCT)的品种病圃,以及抗BC2F5.在我们的研究中使用了人群(#3896×Ар5和达科他××ар5)。将种子最初在70%乙醇中灭菌1分钟,在1%次氯酸钠中灭活20分钟,然后在无菌去离子水中冲洗15次。在22°C的生长室内在Murashige-skoog培养基上以22°C和8 H晚上8小时生长在生长室中的无菌16mm×150mm玻璃管上生长。
Fusarium oxysporumf . sp。利尼来自植物疗法的植物疗法组合的植物病理学研究所在接种前5天生长在马铃薯右旋糖浆中。这是与在达科他达托和AP5和#3896和AP5之间交叉后选择抗性家族的相同的分离物。七天血胡麻植物接种1毫升105.每mL制备F. oxysporum.孢子(真菌感染)或用1毫升无菌水(对照)。48小时后,当根本的坏死出现时,收集并在液氮中收集并冷冻最初发生的感染的根尖(长度为5mm)。它以前表明F. oxysporum.显示亚麻的根尖清晰的偏好。接种后两天,真菌主要分布在根尖周围,在伸长区和侧枝中具有显着较低的存在[30.].因此,在研究感染早期阶段,我们选择根尖作为最理想的实验材料。总共获得了大约120株感染植株和120株在对照条件下生长的植株2F5.人口。
文库制备和转录组测序
使用Rneasy植物迷你套件(USA)从合并的植物样品中提取总RNA。每个游泳池包括每种品种/种群的10-12株,控制条件或真菌感染。因此,在真菌感染或控制条件下,在两种重复中提取24个RNA样品:达科他州,#3896,AP5,TOCT,BC2F5.#3896×ар5和bc2F5.达科他×ар5。使用Qubit 2.0荧光计(Life Technologies,USA)和Agilent 2100 Bioanalyzer(Agilent Technologies,USA)评估RNA浓度和质量。使用Truseq Slarded总RNA文库制备试剂盒(USMINA,USA),使用高质量的RNA样品(RNA完整性数字不小于8.0)与基于PolyA的mRNA捕获的cDNA文库制备。使用Agilent 2100 BioAnalyzer评估24个获得的文库的质量。使用NextSeq 500高通量测序仪(Illumina)测序文库,并获得配对末端读取(80 + 80个核苷酸)。
高通量测序数据分析
Illumina阅读被修剪和过滤使用Trimmomatic [31.] 接着F. oxysporum.通过映射到F. oxysporum.参考基因组和转录组(NCBI组装/WGS标识符ASM14995v2/AAXH01)使用bowtie2。其余reads使用Trinity 2.4.0和默认参数进行转录组组装[32.].每种品种/人口的每种品种/人口(1)进行组件(1),每个BC2F5.与相应的父母共同的人口,以及所有测序的亚麻样品在一起。
使用QUAST 4.5和三位一体公用事业使用N50,EXN50和L50统计评估组件的质量。从随后的分析中排除了少于200个核苷酸的Trasncripts。还通过Busco分析了转录物,以评估组件的完整性[33.].然后使用三羧酸管道对组装的转录本进行注释(http://trinotate.github.io./)。分析衍生的转录物用于使用TransDecoder的开放阅读帧(ORF)的存在[34.].转录本和预测蛋白分别使用blastx和blastp与UniProt数据库进行比对。使用HMMER对蛋白序列进行扫描以确定PFAM结构域的存在[35.那36.].在这些数据的基础上,构建了一个本地SQLite数据库并转移到Trinotate。最后,使用Gene Ontology (GO)、KEGG和COG数据库对转录本进行注释。
然后reads被映射到组装的转录本(所有9个组装),并使用bowtie2 [37.]和rsem [38.].计算每个转录本和每个基因的读计数。使用edgeR分析导出的读计数数据[39.].使用TMM方法进行归一化后,我们试图识别以下基因反应:
- 1。
抗病基因型的上调和下调F. oxysporum.(达科他州,#3896,#3896×ap5,达科他×ap5)回应F. oxysporum.感染;
- 2。
在亚麻基因型中升级和下调易感F. oxysporum.(AP5和TOST)的回应F. oxysporum.感染;
- 3.
引起对F. oxysporum.在抗病品种和BC中感染2F5.群体中的种群,但在易感品种中没有(或更少)。
只有一个基因CPM对于至少三个样品大于2.0,用于进一步分析。这t测试用于确定P.值。错误发现率(FDR)值是使用Benjamini-Hochberg p值调整程序得出的。利用Goseq进行GO数据的基因集富集分析(GSEA) [40].在这项分析中,我们分别使用了前50、100、200、500、1000和2000个上调或下调基因的列表。当我们使用不同的顶级差异表达基因序列时,不同的GO术语被富集。
结果
亚麻植物的高通量测序
我们测序了亚麻栽培品种的转录组,显示抗性(达科他州和#3896)和敏感性(AP5和TOCT)对镰刀菌枯萎病,其暴露于控制条件或接种F. oxysporum..我们还测序了BC的转录组2F5.人口(#3896 × АР5,复发父母АР5;Dakota × АР5,轮回父母АР5)与抵抗病圃。为每种品种或BC产生45.7至5570万读2F5.控制条件下的人口或F. oxysporum.感染。对于接种了病原菌样本的植物,30%-46%的reads被定位到F. oxysporum.基因组和转录组。在对照植物中,只有不到0.2%的reads被映射到F. oxysporum.序列(这些reads大部分来源于rrna),这可以用一些亚麻和亚麻的相似性来解释镰刀序列。滤波后的反F. oxysporum.基因组和转录组,进行以下转录组组件:(1)每种品种和BC2F5.人口分别;(2)每个BC2F5.与相应父母共同的人口;(3)适用于所有品种和BC2F5.人口在一起。每种品种和BC源集约107-111,000名与52-55万基因相关的转录物2F5.人口。对于BC.2F5.人口与相应的父母和所有分析的样品相结合,鉴定了更多数量的基因和转录物(表1).在转录本的注释中,大约50%的转录本使用blastx成功映射到UniProt。几乎60%的转录本都识别出了长orf。大约有23000份成绩单通过了考试CPM阈值,用于差异表达分析。为了评估转录组组装的完整性,我们将转录本映射到带有BUSCO的胚胎植物的单拷贝同源数据库中。由完整的reads库(所有样本)以及包括敏感或抗性品种和群体的组合得到的组合具有同样良好的完整性:91%-92%的完整同源性存在。只有一个品种/群体的组合值略低(85% ~ 88%)。
胁迫下亚麻植株基因表达的变化F. oxysporum.感染
通过表达分析,鉴定表达量上调和下调的基因F. oxysporum.感染。评价所鉴定的转录物的表达水平,对所有接受的组件进行控制条件,并在以下基团中接种后48小时:(1)分别用于研究各种品种和BC2F5.人口;(2)耐粮池(Dakota和#3896)和品种群体易感(AP5和TOST)到镰刀菌枯萎;(3)耐粮池和衍生BC2F5.人口(达科他州和达科他达×ар5;#3896和#3896×ар5);(4)耐塑料池和BC2F5.人口(Dakota, #3896, Dakota × АР5, #3896 × АР5)。对于所有装配变异,顶级差异表达基因大多是相似的。此外,还给出了对所有样本进行组装的表达式分析的结果。
基因在表达上的变化F. oxysporum.分别鉴定了抗病和感病亚麻基因型。对前100个上调和下调基因进行GO分析。在亚麻基因型中具有抗性F. oxysporum.抗性品种与BC2F5.群体),前100个上调基因与NAD(P)H脱氢酶活性,氧化还原酶活性,呼吸链复合物I和线粒体零件有关(表2).在敏感品种中,前100个上调基因与翻译、核糖体、生物合成过程和胞质部分相关3.).对前100个下调基因的GO分析也揭示了抗性和敏感基因型之间的差异:抗性基因型中,与微管、驱动蛋白复合物、细胞骨架部分、细胞连接、网格蛋白外壳和腺苷酸结合相关的基因(表)4.);在易感基因型中,基因与细胞壁,外部包封结构,转移酶活性,转移糖基,多糖代谢过程,水通道活性,膜的内在成分和木糖葡聚糖代谢过程有关(表5.).
亚麻抗性基因型中基因特异性上调F. oxysporum.
用于鉴定抗病候选基因F. oxysporum.在亚麻中,我们搜索了在耐药品种和BC上调或下调的基因2F5.下的数量F. oxysporum.但在感病品种中表达无变化(或变化较小)。完整的结果显示在附加文件中1表格中呈现在表格中的前30个差异表达基因(不包括两个未知基因)的结果6..
SRG1(衰老相关基因1)蛋白、udp -糖基转移酶73C3 (UGT73C3)、AAA-ATPase ASD、线粒体(AATPA)、葡聚糖内切酶-1,3- β -葡萄糖苷酶、MYB转录因子、ERD脱氢酶、生长素反应蛋白SAUR等基因表达上调。我们认为鉴定的基因具有特异性诱导表达F. oxysporum.抗性品种和抗性BC的感染2F5.种群是最有希望的抗性候选基因。
GO术语在亚麻抗病和感病基因型间差异最大,相关基因表达谱见附加文件2.在耐药品种和群体中,参与生物刺激和应力,防御反应,抗氧化活性和细胞壁组织或生物发生的基因比易感品种更强烈地升高。
讨论
植物的反应机制镰刀感染包括PR蛋白和抗菌化合物的合成、ROS的产生和细胞壁结构的改变[41.那42.那43.那44.那45.].在目前的研究中,我们评估了基因表达的变化响应F. oxysporum.在抗病和感病亚麻品种和抗BC的感染2F5.人口。我们研究的优势是使用这两个BC2F5.从检查的抗性和易感品种之间的交叉中获得的群体,并且抵抗力F. oxysporum.但在表型上与易感父母相似。这种方法使我们能够比较在F. oxysporum.抗性和易感基因型的感染,并鉴定抗亚麻植物特异性诱导的基因响应于感染。
响应于以下检测涉及细胞壁组织或生物发生的基因的显着下调。F. oxysporum.感病品种(AP5和TOST)。然而,我们在抗病品种和群体中没有观察到类似的趋势。这可能表明,在感病品种中,质外体结构的变化响应F. oxysporum.更明显。细胞壁化合物在亚麻反应中的作用[26.那46.]和其他植物物种[47.那48.那49.)F. oxysporum.已被披露。然而,本研究首次确定了亚麻品种和BC细胞壁组织或生物发生相关基因的差异表达2F5.患有不同抗性镰刀菌的人口。
抗性品种的许多前100个上调基因与NAD(P)H氧化酶活性有关。在易感品种中,我们还揭示了NAD(P)H氧化酶相关基因的上调;然而,这些中的大部分都不包括在前100个上调基因中。NAD(P)H氧化酶参与植物中的ROS信号和应力反应,是响应于病原体攻击并通过氧化爆发涉及早期防御反应的ROS的源之一[45.那50.那51.那52.那53.那54.那55.那56.那57.].在抗性香蕉品种中,NADPH氧化酶上调和早期氧化爆发已被揭示F. oxysporum.感染 [56.那58.那59.].在亚麻植株中,我们观察到类似的趋势。与NAD(P)H氧化酶相关的ROS信号转导可能是NAD(P)H氧化的机制之一l . usitatissimum防御反应病圃。因此,我们认为NAD(P)H氧化酶可能是有希望的候选蛋白,参与防御反应F. oxysporum.在亚麻。
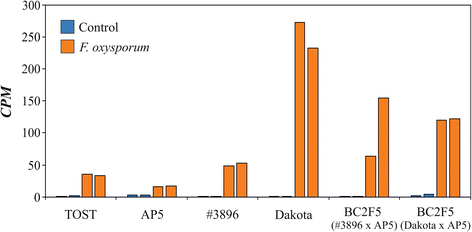
与易受敏感的基因型相比,在亚麻的抗性基因型中更强烈地诱导的基因响应于F. oxysporum.侵染参与了重要的生物学过程,包括转录调控、生长素信号转导、胁迫反应和光合作用。其中,SRG1蛋白、UGT73C3、AATP5、葡聚糖内切酶、-1-3- β -葡萄糖苷酶(beta-1-3-glucanase)和表皮特异性分泌糖蛋白EP1的基因表达上调最为显著。在这些蛋白质中,β -1-3-葡聚糖酶是亚麻中最著名的真菌响应蛋白。这种酶水解真菌细胞壁的-1,3-葡聚糖,这种蛋白在植物防御病原体中的作用是众所周知的[60那61那62那63那64].在亚麻中,增加了抗性F. oxysporum.和F. Culmorum.已在含有马铃薯β-1,3-葡聚糖酶基因的转基因亚麻系中观察到,并在过表达β-1,3-葡聚糖酶基因的植物中[18.那19.].我们还发现该基因在亚麻植株中表达上调F. oxysporum.感染,并且在品种和BC中观察到变化更强大2F5.群体显示对镰刀菌枯萎病的血液(图。1).在抗性基因型下F. oxysporum.感染,与易感基因型相比,β-1,3-葡聚糖酶表达的诱导更加明显(P.< 0.01, Mann-Whitney检验)。此外,在胁迫条件下,β -1,3-葡聚糖酶在抗性品种和群体中的表达量显著升高(P.< 0.05),而在对照条件下,抗性基因型与敏感基因型之间差异不显著。
因此,响应于F. oxysporum.我们发现了PR蛋白编码基因表达的改变,以及参与ROS产生和细胞壁结构改变的基因。此外,我们还鉴定了亚麻抗枯萎病基因型中特异性上调的基因。在进一步寻找抗性候选基因时,应特别注意这些基因。我们的工作补充了以前获得的亚麻反应的结果F. oxysporum.感染并为亚麻防御机制对镰刀菌枯萎的详细研究提供了基础。
结论
在本研究中,我们使用高吞吐量测序来搜索参与早期防御响应的基因l . usitatissimum防止真菌感染F. oxysporum..为此,我们首先使用抗病和感病亚麻品种病圃,抵抗BC2F5.群体是从抗性和易感亚麻品种之间的交叉获得的群体。基因表达分析显示抗性和易感亚麻基因型的差异表达基因的不同模式。响应生物刺激和应力,防御反应,抗氧化活性和细胞壁组织或生物发生的基因在抗性基因型中比易感基因型更强烈地升高。此外,我们鉴定了在抗腐败枯萎病的基因型中特异性诱导的基因响应于F. oxysporum.感染。这些基因是赋予抵抗力最有希望的基因候选者F. oxysporum.感染l . usitatissimum.
参考文献
- 1。
Marchenkov A,Rozhmina T,Uschapovsky I,Muir广告。亚麻栽培。在:Muir AD, Westcott ND,编辑。亚麻:Linum属。新耶克:泰勒&弗朗西斯;2003.74-91。
- 2。
Galindo-Gonzalez L, Mhiri C, Grandbastien MA, Deyholos MK. Ty1-copia元素揭示了与亚麻(Linum Usitatissimum L.)遗传多态性相关的不同插入位点。BMC基因组学。2016;17(1):1002。
- 3.
Bolsheva NL, Zelenin AV, Nosova IV, Amosova AV, Samatadze TE, Yurkevich OY等。利用分子细胞遗传学标记和RAPD分析揭示亚麻属(亚麻科)Syllinum部分的核型和基因组多样性。《公共科学图书馆•综合》。2015;10 (4):e0122015。
- 4.
Kumar S,You FM,Duguid S,Booker H,Rowland G,Cloutier S. QTL用于脂肪酸成分和亚麻籽的产量(Linum Usitatissimum L.)。标记理论和应用的遗传学Theoretische und Angewandte Genetik。2015; 128(5):965-84。
- 5。
通过分子多样性和关联分析,揭示淡色亚麻作为栽培亚麻遗传变异来源的潜力。摩尔品种。2014;34(4):2091 - 107。
- 6.
Melnikova NV,Kudryavtseva AV,Zelenin Av,Lakunina Va,Yurkevich Oy,Speranskaya As,等。基于转回的分子标记,用于分析Linum属内的遗传多样性。BioMed Res Int。2014; 2014年:231589。
- 7.
Choudhary SB,Sharma HK,Kumar AA,Maruthi RT,Mitra J,Chowdhury I等。基于SSR和形态特性的130种不同亚麻(Linum Usitatissimum L.)涂抹的人口结构分析。Comptes Rendus Biologies。2017; 340(2):65-75。
- 8.
曹颖,贾娜妮,杨志伟,张晓东,等。干旱诱导亚麻基因表达变化的全基因组分析。转基因作物和食品。5(2): 106 - 2014; 19。
- 9。
俞y,黄某,陈开,吴g,元h,歌曲x等。用数字基因表达鉴定亚麻(Linum Usitatisimum L.)亚麻(Linum Usitatisimumlimumlimumlimumlimum的差异表达基因。基因。2014; 549(1):113-22。
- 10。
于宇,吴刚,袁浩,程磊,赵东,黄伟,等。亚麻(Linum Usitatissimum)在盐、碱和盐-碱胁迫下的mirna和靶标的鉴定和特性植物学报。2016;16(1):124。
- 11.
Dmitriev AA, Kudryavtseva AV, Krasnov GS, Koroban NV, Speranskaya AS, Krinitsina AA,等。土壤胁迫下亚麻(Linum Usitatissimum L.)基因表达分析。BMC Plant Biol. 2016;16(supl 3):927。
- 12.
Dmitriev AA,Kudryavtseva AV,Bolsheva NL,Zyablitsin Av,Rozhmina Ta,Kishlyan NV,等。MiR319,MiR390和MiR393参与亚麻铝反应(Linum Usitatissimum L.)。BioMed Res Int。2017; 2017年:4975146。
- 13。
Dmitriev AA, Krasnov GS, Rozhmina TA, Kishlyan NV, Zyablitsin AV, Sadritdinova AF, et al。谷胱甘肽s -转移酶和udp -糖基转移酶参与了亚麻对铝胁迫的反应。植物学报2016;7:1920。
- 14。
拉希德肯塔基州。亚麻的主要病害。在:Muir AD, Westcott ND,编辑。亚麻:亚麻属。博卡拉顿:CRC出版社;2003.9.2–123.
- 15。
Diederichsen A,Rozhmina Ta,Kudrjavceva LP。基于评价对抗镰刀菌枯萎病,炭疽病和粉刺的评估,53亚麻(Linum Usitatissimumlimumlimuml1)的变异模式。植物遗传资源:表征和利用。2008; 6(1):22-32。
- 16.
Spielmeyer W,Green Ag,Bittiisnich D,Mendham N,Lagudah Es。鉴定亚麻(Linum Usitatisimum)的致枯草枯萎病导向镰刀菌抗性的定量性状抵抗力。标记理论和应用的遗传学Theoretische und Angewandte Genetik。1998年; 97:633-41。
- 17.
Galindo-Gonzalez L,Deyholos MK。亚麻(Linum Usitatissimum L.)对致病真菌镰刀菌F的RNA-SEQ转录组响应。sp。利尼。前植物SCI。2016; 7:1766。
- 18.
Wrobel-Kwiatkowska M, Lorenc-Kukula K, Starzycki M, Oszmianski J, Kepczynska E, Szopa J.表达β -1,3-葡聚糖酶增加亚麻对真菌的抗性。植物学报(自然科学版)2004;65(5):245-56。
- 19.
Wojtasik W,Kulma A,Boba A,Szopa J.寡核苷酸处理通过基因体甲基化的变化导致亚麻β-葡聚糖酶上调。BMC植物BIOL。2014; 14:261。
- 20.
Wojtasik W,Kulma A,Dyminska L,Hanuza J,Zebrowski J,Szopa J.来自亚麻的纤维过度发达的β-1,3-葡聚糖酶显示出增加的果胶和酚类的积累,从而提高抗氧化能力。BMC Biotechnol。2013; 13:10。
- 21。
Lorenc-Kukula K,Wrobel-Kwiatkowska M,Starzycki M,Szopa J.工程亚麻,具有增加的类黄酮含量,从而增加了镰刀菌。Physiolmol植物P. 2007; 70(1-3):38-48。
- 22。
acta optica sinica, 2010, 31 (4): 457 - 461 . acta optica sinica, 2010, 31 (4): 457 - 461 . acta optica sinica, 2010, 31(4): 457 - 461。应用GT家族1茄多糖糖基转移酶SsGT1的工程亚麻提高了对镰刀菌感染的抗性。中国农业科学。2009;57(15):6698-705。
- 23。
Boba A, Kulma A, Kostyn K, Starzycki M, Starzycka E, Szopa J.类胡萝卜素生物合成修饰对亚麻镰孢镰刀菌抗性的影响。acta botanica yunnanica(云南植物研究);2011;76(1):39-47。
- 24。
Hano C,Addi M,Fliniaux O,Bensaddek L,Duverger E,Mesnard F等人。镰刀镰刀菌镰刀菌与镰刀菌相容相互作用诱导的细胞死亡的分子表征。sp。Linii和亚麻(Linum Usitatisimumumumumum)细胞。植物理性生物化学。2008; 46(5-6):590-600。
- 25。
Zeitoun Am,Preisner M,Kulma A,Dyminska L,Hanuza J,Starzycki M,等。种子中的生物聚合物组合物是否有助于对镰刀菌感染的亚麻抗性?Biotechnol Prog。2014; 30(5):992-1004。
- 26。
黄志强,王志强,王志强,等。镰刀菌侵染亚麻后果胶代谢的变化。植物生理学与生物化学。2011;49(8):862-72。
- 27。
Kostyn K, Czemplik M, Kulma A, Bortniczuk M, Skala J, Szopa J.在亚麻对镰刀菌攻击的早期反应中,苯丙素途径的基因被激活。植物科学。2012;190:103-15。
- 28.
Boba A,Kostyn K,Kostyn A,Wojtasik W,Dziadas M,Preisner M等。血糖血管感染后亚麻水溶生水平增加亚麻水溶液与苯丙烷型途径激活相关。前植物SCI。2016; 7:1951。
- 29.
Wojtasik W,Kulma A,Namysl K,Preisner M,Szopa J.在亚麻中的多胺代谢,响应于致病和非致病性镰刀菌菌株治疗。前植物SCI。2015; 6:291。
- 30.
关键词:尖孢镰刀菌(Fusarium oxysporum f.Sp.),亚麻(Linum Usitatissimum),根腐病利尼。植物病理学杂志。1998;104(7):725-36。
- 31.
Trimmomatic:用于Illumina序列数据的灵活微调器。生物信息学。2014;30(15):2114 - 20。
- 32.
Grabherr Mg,Haas Bj,Yassour M,Levin Jz,Thompson Da,Amit I等。来自RNA-SEQ数据的全长转录组件没有参考基因组。NAT BIOTECHNOL。2011; 29(7):644-52。
- 33。
Simão FA, Waterhouse RM, Ioannidis P, Kriventseva EV, Zdobnov EM. BUSCO:用单拷贝同源性评估基因组组装和注释完整性。生物信息学,2015,31(19):3210 - 2。
- 34。
Haas BJ, Papanicolaou A, Yassour M, Grabherr M, Blood PD, Bowden J,等。利用trinity平台从RNA-seq中重建从头转录本序列,进行参考文献的生成和分析。Nat Protoc。2013;8(8):1494 - 512。
- 35。
Finn Rd,Clended J,Arndt W,Miller Bl,Wheeler TJ,Schrei派F等人。HMMER Web服务器:2015更新。核酸RES。2015; 43(W1):W30-8。
- 36。
Punta M, Coggill PC, Eberhardt RY, Mistry J, Tate J, Boursnell C,等。Pfam蛋白家族数据库。核酸Res. 2012;40(数据库版):D290-301。
- 37。
Langmead B,Salzberg SL。与Bowtie 2. NAT方法的快速喷射读取对齐。2012; 9(4):357-9。
- 38。
李斌,杜威出版社。RSEML:从有或没有参考基因组的RNA-Seq数据中准确的转录本定量。BMC生物信息学。2011; 12:323。
- 39。
罗宾逊医学博士,麦卡锡DJ,史密斯GK。edgeR:用于数字基因表达数据差异表达分析的生物导体包。生物信息学,2010,26(1):139 - 40。
- 40.
年轻MD,Wakefield MJ,Smyth GK,Oshlack A. RNA-SEQ的基因本体分析:选择偏差。基因组生物学。2010; 11,p。R14。DOI:10.1186 / GB-2010-11-1-R14。
- 41.
陈YC,Kidd BN,Carvalhais LC,Schenk PM。根系和根际对抗镰刀菌的分子防御反应。植物信号表现。2014; 9(12):E977710。
- 42.
Berrocal -Lobo M,Molina A.拟南芥防范镰刀菌的防御反应。趋势植物SCI。2008; 13(3):145-50。
- 43.
Slavokhotova AA, Shelenkov AA, Korostyleva TV, Rogozhin EA, Melnikova NV, Kudryavtseva AV等。利用高通量下一代测序预测Stellaria培养基防御肽库。Biochimie。2017;135:15-27。
- 44.
陈YC,Wong Cl,Muzzi F,Vlaardingerboek I,Kidd BN,Schenk PM。针对镰刀菌的根防御分析揭示了新的调节剂赋予抵抗力。SCI REP。2014; 4:5584。
- 45。
关键词:尖孢镰刀菌,抗性基因型,抗性基因型足底。2014;239(4):735 - 51。
- 46。
Wojtasik W,Kulma A,Dyminska L,Hanuza J,Czeplik M,Szopa J.亚麻细胞壁聚合物在感染的镰刀菌病原菌菌株中的血管骨质聚合物意义的评价。BMC植物BIOL。2016; 16:75。
- 47。
香蕉对枯萎病的耐受性与根中细胞壁增强基因的早期上调有关。植物学报。2007;8(3):333-41。
- 48。
Lionetti V, Giancaspro A, Fabri E, Giove SL, Reem N, Zabotina OA, et al.;细胞壁性状是提高硬粒小麦对赤霉病抗性的潜在资源。BMC Plant Biol. 2015;15:6。
- 49。
de Farias Viegas Aquije GM, Zorzal PB, Buss DS, Ventura JA, Fernandes PM, Fernandes AA。抗镰孢病和感病菠萝品种叶片的细胞壁变化。植物学报2010;29(10):1109-17。
- 50.
托雷斯马,琼斯JD,Dangl JL。反应性氧气物种响应病原体的信号传导。植物理性。2006; 141(2):373-8。
- 51.
Amirsadeghi S,Robson Ca,Vanlerberghe GC。线粒体在植物对生物应激的反应中的作用。physiol platararum。2007; 129(1):253-66。
- 52.
莫勒我。植物线粒体与氧化应激:电子传递、NADPH转换和活性氧代谢。植物生理学报2001;52:561-91。
- 53.
Grabelnych Oi,Borovik OA,Tauson El,Pobezhimova TP,Katyshev Ai,Pavlovskaya ns,等。线粒体能量消散系统(替代氧化酶,解偶丁蛋白和外部NADH脱氢酶)涉及冬小麦幼苗冻胀的发展。生物化学。Biokhimiia。2014; 79(6):506-19。
- 54.
Kamal Ah,小松S.在洪水应力下大豆植物根系中的活性氧物种和线粒体蛋白的参与。J蛋白质组。2015; 14(5):2219-36。
- 55.
朱庆华,王志强,王志强,等。利用RNA-seq鉴定拟南芥中对尖孢镰刀菌感染应答的防御转录组。基因。2013;512(2):259 - 66。
- 56.
Li Cy,邓通用州,杨杰,viljoen A,Jin Y,Kuang RB等。用镰刀镰刀菌接种后,抗性和易感腔内的转录组谱分析。sp。立方体热带比赛4. BMC基因组学。2012; 13:374。
- 57。
刘海云,戴JR,冯博士,刘波,王海波,王建峰。一个新的车前草Asr基因的特性,MpAsr,在响应尖孢镰刀菌f. Sp. cubense的感染和非生物胁迫中受到调控。acta botanica sinica(云南植物研究),2010;52(3):315-23。
- 58。
Dowd C,Wilson Iw,McFadden H.基因表达谱系康根和幼杆组织的变化响应镰刀菌F的感染。sp。血染液。分子植物微生物相互作用:MPMI。2004; 17(6):654-67。
- 59。
李文,钱厘米,莫yw,yl h,xie jh。对镰刀菌枯萎的香蕉的耐受性与根中的早期H2O2积累有关。AFR J BIOTECHNOL。2011; 10(55):11378-87。
- 60。
沃德尔,Payne GB,Moyer MB,Williams SC,Dincher SS,Sharkey KC等。β-1,3-葡聚糖酶信使RNA响应病原体感染的差异调节。植物理性。1991; 96(2):390-7。
- 61.
引用本文:王志强,王志强。植物β -1,3-葡聚糖酶的反义转化研究进展。基因。1996;179(1):97 - 103。
- 62.
Chang Mm,Hadwiger La,Horovitz D.诱发镰刀菌和壳聚糖攻击诱导的豌豆β-1,3-葡聚糖酶的分子表征。植物mol biol。1992年; 20(4):609-18。
- 63.
黄萎病镰刀菌(Fusarium verticillioides)产生的毒素Fumonisin B1可调节玉米β -1,3-葡聚糖酶活性,参与防御反应。足底。2012;235(5):965 - 78。
- 64.
Balasubramanian V,Vashisht D,Cletus J,Sakthivel N.植物Beta-1,3-葡聚糖酶:它们对植物疗法真菌的生物学功能和转基因表达。Biotechnol Lett。2012; 34(11):1983-90。
致谢
作者感谢全俄罗斯研究所的亚麻,用于选择和提供亚麻籽和F. oxysporum.隔离。这项工作是使用Engelhardt分子生物学研究所的“基因组”中心(http://www.eimb.ru/rus/ckp/ccu_genome_c.php).
资金
这项工作得到了俄罗斯科学基金会的财务支持,授予16-16-00114。出版成本由俄罗斯科学基金资助,授予16-16-00114。
可用性数据和材料
在当前的研究中生成的数据集可在序列阅读存档- SRP119227中获得。
关于这个补充
本文已作为一部分发布BMC植物生物学2017年第17卷增刊2:2017年Belyaev会议植物生物学文章选集。该补充剂的完整内容可在//www.cinefiend.com/articles/supplements/volume-17-supplement-2网站上找到。
作者信息
隶属关系
贡献
广告,TR和NM构思和设计了这项工作;TR,RN,AS,MF,OY,NB和NM执行实验;AD,GK,OM,NB,AK和NM分析了数据;广告,GK和NM写了稿件。所有作者阅读并认可的终稿。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
两位作者宣称他们没有相互竞争的利益。
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
权利和权限
开放访问本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Dmitriev,A.A.,Krasnov,G.S.,Rozhmina,T.A.等等。基因表达的差异Fusarium oxysporum亚麻抗性和敏感基因型的感染(Linum Usitatissimum.L.)。BMC植物BIOL.17,253(2017)。https://doi.org/10.1186/s12870-017-1192-2
关键词
- Linum Usitatissimum.
- 亚麻
- 生物应力
- Fusarium oxysporum
- 高吞吐量排序
- 罗斯
- 1, 3-beta-glucanase
- 细胞壁