- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
拟南芥的分化调控gydF4y2Ba阿富汗二月gydF4y2Ba基因:一个重点gydF4y2BaSAUR10gydF4y2Ba进化枝gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba17gydF4y2Ba,文章号:gydF4y2Ba245gydF4y2Ba(gydF4y2Ba2017gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
小生长素上调RNAgydF4y2Ba(gydF4y2Ba阿富汗二月gydF4y2Ba)基因编码生长调节剂,诱导细胞伸长。拟南芥含有70多种gydF4y2Ba阿富汗二月gydF4y2Ba促进生长功能的基因已经在幼苗中被揭示,而它们在其他组织中的作用在很大程度上仍然未知。在这里,我们主要研究拟南芥的调控区域gydF4y2Ba阿富汗二月gydF4y2Ba基因,以预测他们发挥作用的过程,并了解植物生长的动态。gydF4y2Ba
结果gydF4y2Ba
在本研究中,我们详细地描述了整个gydF4y2BaSAUR10gydF4y2Ba进化枝:gydF4y2BaSAUR8gydF4y2Ba,gydF4y2BaSAUR9gydF4y2Ba,gydF4y2BaSAUR10gydF4y2Ba,gydF4y2BaSAUR12, SAUR16gydF4y2Ba,gydF4y2BaSAUR50gydF4y2Ba,gydF4y2BaSAUR51gydF4y2Ba而且gydF4y2BaSAUR54gydF4y2Ba.过表达分析表明,不同的蛋白具有相似的功能gydF4y2Ba阿富汗二月gydF4y2Ba表达模式高度多样化,在植物发育的各种组织中都有表达。此外,不同基因对不同激素的反应也有很大差异。这些组织特异性和激素特异性反应可能与硅晶分析中使用的转录因子结合位点有关。这些分析也支持两组的存在gydF4y2Ba阿富汗二月gydF4y2Ba拟南芥:I类基因可由ARF-BZR-PIF转录因子组合作用诱导,II类基因不受生长素调控。gydF4y2Ba
结论gydF4y2Ba
SAUR10 -gydF4y2Ba分支基因通常诱导细胞伸长,但表现出不同的表达模式和对激素的反应。我们的实验和硅晶分析表明,参与植物发育的转录因子决定了不同基因的组织特异性表达gydF4y2Ba阿富汗二月gydF4y2Ba基因,而这种表达的幅度往往可以由激素反应转录因子控制。这使得植物能够根据内部和外部信号对各种组织的生长进行微调。gydF4y2Ba
背景gydF4y2Ba
植物的生长是高度灵活的,可以根据发育和环境因素进行调整。控制这些信号的因子,如转录因子(tf),光反应因子和激素,可以激活或抑制生长调节剂,将不同的信号整合到生长反应中。一组重要的生长调节剂是由小生长素上调的rna (SAURs)组成的,SAURs最初被发现是作为响应生长素而迅速上调的小转录本[gydF4y2Ba1gydF4y2Ba].在缺乏生长诱导信号的情况下,SAUR活性可以迅速降低,因为转录物和蛋白质的半衰期被发现非常短[gydF4y2Ba2gydF4y2Ba].使用各种拟南芥的过表达研究gydF4y2Ba阿富汗二月gydF4y2Bas揭示了它们诱导细胞伸长和生长的一般能力,而敲除研究几乎没有结果,这可能是由于79种拟南芥之间的高度冗余gydF4y2Ba阿富汗二月gydF4y2Ba基因(gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba].SAURs可通过与PP2C-D磷酸酶相互作用诱导细胞伸长,从而抑制其磷酸酶活性,防止质膜H脱磷酸化gydF4y2Ba+gydF4y2Baatp酶。在活性磷酸化形式下,HgydF4y2Ba+gydF4y2Ba- atp酶引起细胞壁酸化,导致细胞伸长[gydF4y2Ba10gydF4y2Ba].最近的两份报告表明,生长素诱导的生长需要SAUR蛋白,并通过激活HgydF4y2Ba+gydF4y2Ba- atp酶,且SAUR蛋白的过表达足以激活HgydF4y2Ba+gydF4y2Ba-生长素独立的atp酶[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba11gydF4y2Ba].因此,SAURs作用于生长素下游,当被生长素以外的其他因素激活时,也能够诱导生长。gydF4y2Ba
虽然gydF4y2Ba阿富汗二月gydF4y2Ba最早被发现是生长素诱导基因,最近的报道表明,它们的调控更加多样化,不仅依赖于生长素,还依赖于多种因素,包括不同的激素、光反应因子和其他转录因子。拟南芥gydF4y2Ba阿富汗二月gydF4y2Ba在生长素反应因子ARF5、ARF6、ARF7、ARF8或ARF19下游的某些组织和功能中,约三分之二的基因对生长素有反应[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba].然而,一些gydF4y2Ba阿富汗二月gydF4y2Bas也受其他激素的调节,如脱落酸(ABA)、乙烯、赤霉素酸(GA)和油菜素内酯(BR) [gydF4y2Ba7gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba].此外,gydF4y2Ba阿富汗二月gydF4y2Bas已被确定为光响应转录因子光敏色素相互作用因子3 (PIF3)和PIF4的直接靶点[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba22gydF4y2Ba], BR反应因子布辛唑耐药1 (BZR1) [gydF4y2Ba22gydF4y2Ba], mads域TF FRUITFULL (FUL) [gydF4y2Ba3.gydF4y2Ba].由此可见,SAUR蛋白通常可以通过激活HgydF4y2Ba+gydF4y2Ba- atp酶,但激活和/或抑制的不同gydF4y2Ba阿富汗二月gydF4y2Ba基因取决于不同基因特有的顺式元件的组合。gydF4y2Ba
SAURs的生长诱导能力在幼苗中表现得最好。Sun和合作者最近表明SAURs既负责下胚轴在黑暗中的伸长,也负责将幼苗转移到光照下时子叶的扩张[gydF4y2Ba9gydF4y2Ba].在两种组织中,都有大量的gydF4y2Ba阿富汗二月gydF4y2Ba这些基因对光有反应,或通过生长素途径在下胚轴中被抑制,或通过PIFs在子叶中诱导[gydF4y2Ba9gydF4y2Ba].结果是这个倍数gydF4y2Ba阿富汗二月gydF4y2Ba基因可以同时对特定的生长诱导信号做出反应gydF4y2Ba阿富汗二月gydF4y2Ba在不同的组织中很难通过淘汰研究来评估。在双敲除后,已在幼苗中检测到细微的生长反应[gydF4y2Ba9gydF4y2Ba],但尚未从其他组织中报道,因为这些不太容易精确监测。然而,最近的报道描述了具体的上调gydF4y2Ba阿富汗二月gydF4y2Ba拟南芥茎背面的基因[gydF4y2Ba3.gydF4y2Ba]和向日葵[gydF4y2Ba25gydF4y2Ba],表明SAURs也可以负责其他组织的动态生长反应。这表明,与其他各种组织需要通过细胞伸长快速生长的事实一起,SAURs介导了整个植物的生长反应。然而,SAURs在不同组织中的作用以及它们的作用有多重要尚不清楚。gydF4y2Ba
为了进一步揭示SAURs在整个植物中的作用,我们将其划分为8个分支gydF4y2Ba阿富汗二月gydF4y2Ba拟南芥基因:gydF4y2BaSAUR8gydF4y2Ba,gydF4y2BaSAUR9gydF4y2Ba,gydF4y2BaSAUR10gydF4y2Ba,gydF4y2BaSAUR12gydF4y2Ba,gydF4y2BaSAUR16gydF4y2Ba,gydF4y2BaSAUR50gydF4y2Ba,gydF4y2BaSAUR51gydF4y2Ba而且gydF4y2BaSAUR54gydF4y2Ba.我们进行了过表达和敲除实验,研究了它们的表达模式,并研究了它们对不同激素应用的反应。此外,我们对所有拟南芥的调控区进行了硅晶分析gydF4y2Ba阿富汗二月gydF4y2Ba以便更好地预测它们在植物生长动态中的不同作用。gydF4y2Ba
结果gydF4y2Ba
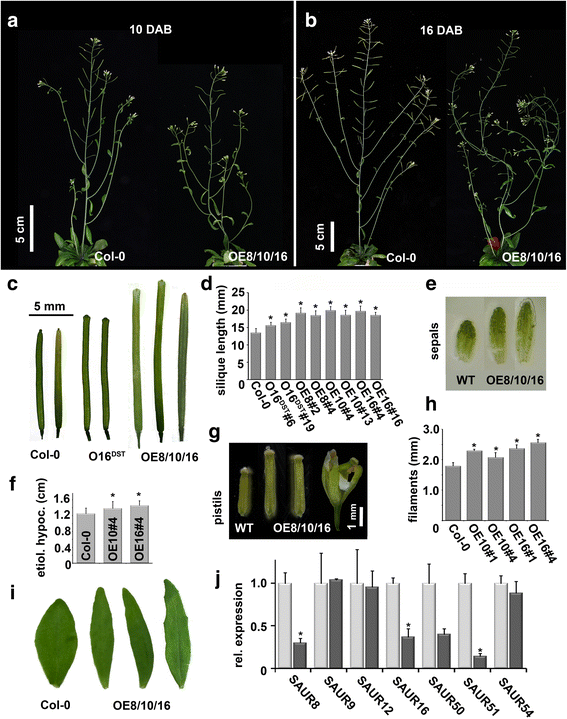
SAUR8/10/16gydF4y2Ba过表达系表现出相似的生长相关表型gydF4y2Ba
我们之前发现gydF4y2BaSAUR10gydF4y2Ba作为茎生长过程中mads结构域因子FRUITFULL的靶标[gydF4y2Ba3.gydF4y2Ba].gydF4y2BaSAUR10gydF4y2Ba属于8种亲缘关系密切的拟南芥gydF4y2Ba阿富汗二月gydF4y2Ba基因,包括gydF4y2BaSAUR8gydF4y2Ba,gydF4y2BaSAUR9gydF4y2Ba,gydF4y2BaSAUR10gydF4y2Ba,gydF4y2BaSAUR12gydF4y2Ba,gydF4y2BaSAUR16gydF4y2Ba,gydF4y2BaSAUR50gydF4y2Ba,gydF4y2BaSAUR51gydF4y2Ba而且gydF4y2BaSAUR54gydF4y2Ba,以下简称gydF4y2BaSAUR10gydF4y2Ba进化枝。根据它们的蛋白质序列,该分支的成员可以分为4对,每对2个平行序列(SAUR8/SAUR50, SAUR12/SAUR16, SAUR51/SAUR54和SAUR9/SAUR10)(见附加文件)gydF4y2Ba1gydF4y2Ba:图S1),它们具有高度相似的序列,范围从最远序列(SAUR9/SAUR54)的64%识别率到最相似序列(SAUR12/SAUR16)的93%识别率。尽管它们具有密切的同源性,但根据以前的出版物推断,这些基因对激素应用的反应不同(见附加文件)gydF4y2Ba2gydF4y2Ba:表S1) [gydF4y2Ba8gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba26gydF4y2Ba].为了获得关于sau10支系所有成员的假定功能的更多信息,并增加对SAUR功能的一般理解,我们对所有8个基因进行了表征。我们从确定saur10分支中不同SAURs的蛋白质功能开始,并为三个序列相同程度相对较低的分支成员生成过表达结构,gydF4y2BaSAUR8gydF4y2Ba,gydF4y2BaSAUR10gydF4y2Ba(亦载于[gydF4y2Ba3.gydF4y2Ba])和gydF4y2BaSAUR16gydF4y2Ba(在72%到75%之间)。因为DST区域(为下游元素)中的3'UTRgydF4y2Ba阿富汗二月gydF4y2Ba基因已被证明与转录稳定性有关[gydF4y2Ba27gydF4y2Ba],我们生成gydF4y2BaSAUR16gydF4y2Ba构造不包括DST区域(gydF4y2Ba35 s: SAUR16gydF4y2Ba而且gydF4y2Ba35 s: SAUR16DSTgydF4y2Ba,分别)来测试这是否会影响转录本的积累。对于所有结构,我们生成了大约100个转基因株系。两组之间的异常表型频率有明显差异gydF4y2Ba35 s: SAUR16DSTgydF4y2Ba行和gydF4y2Ba35 s: SAUR8/10/16gydF4y2Ba行。从100开始gydF4y2Ba35 s: SAUR16DSTgydF4y2Ba只有9个株系表现出轻度表型,这仅限于角果(见下文)。另一方面,超过50%的gydF4y2Ba35 s: SAUR8gydF4y2Ba,gydF4y2Ba35 s: SAUR10gydF4y2Ba而且gydF4y2Ba35 s: SAUR16gydF4y2Ba株系表现出轻度至重度表型畸变。的gydF4y2Ba35 s: SAUR8gydF4y2Ba,gydF4y2Ba35 s: SAUR10gydF4y2Ba而且gydF4y2Ba35 s: SAUR16gydF4y2Ba所有的系都表现出相似的生长相关表型,包括较长的黄化下胚轴、花丝、萼片、茎生叶和波浪状茎(图2)。gydF4y2Ba1gydF4y2Ba).雌蕊也明显更长,通常必须人工授粉,因为花药没有到达柱头。有效的施肥导致了非常长的角果(图。gydF4y2Ba1 cgydF4y2Ba而且gydF4y2BadgydF4y2Ba).所有表型畸变均在三种过表达结构的株系中共享,未观察到结构特异性表型。表型特征如图所示。gydF4y2Ba1gydF4y2Ba是用最有力的线条表演的。相比之下gydF4y2Ba35 s: SAUR16gydF4y2Ba行,gydF4y2Ba35 s: SAUR16DSTgydF4y2Ba表型仅限于形状异常的“凹凸不平的”角果,比野生型更长(图。gydF4y2Ba1 cgydF4y2Ba而且gydF4y2BadgydF4y2Ba).这些数据表明gydF4y2Ba35 s: SAUR16DSTgydF4y2BaConstruct的效果远不如gydF4y2Ba35 s: SAUR16gydF4y2Ba构造,可能是因为DST区域的存在导致转录不稳定,因此更低gydF4y2BaSAUR16gydF4y2Ba的水平。我们的结果表明,不同的saur10分支蛋白可以以类似的方式影响植物不同部位的生长。gydF4y2Ba
表型的过表达gydF4y2BaSAUR8gydF4y2Ba,gydF4y2BaSAUR10gydF4y2Ba而且gydF4y2BaSAUR16gydF4y2Ba超表达。gydF4y2Ba一个gydF4y2Ba-gydF4y2BabgydF4y2Ba具有代表性的Col-0和gydF4y2Ba35 s: SAUR8/10/16gydF4y2Ba超表达。由于来自三种不同结构的表型具有可比性(同一结构的株系之间的变异比结构之间的变异多),这里只显示了两种具有代表性的植物。过表达系的主茎和侧枝呈波浪状,雌蕊长,育性降低,叶根结构不规则。gydF4y2Ba一个gydF4y2BaCol-0和gydF4y2Ba35 s: SAUR10 # 4gydF4y2Ba在栓接后10天(DAB)。gydF4y2BabgydF4y2BaCol-0和gydF4y2Ba35 s: SAUR8 # 2gydF4y2Ba锚固后16天(DAB)。gydF4y2BacgydF4y2Ba不同过表达系的角果明显长于野生型角果,且呈“凹凸肩”。O16gydF4y2BaDSTgydF4y2Ba=gydF4y2Ba35 s: SAUR16gydF4y2Ba包括夏令时区域;OE8/10/16 =gydF4y2Ba35 s: SAUR8/10/16gydF4y2BaOE8/10/16系均表现出相似的角果表型,少数具有代表性的角果出现。gydF4y2BadgydF4y2Ba不同过表达系角锥长度的定量分析。从每个构造中,选取角锥最长的线进行量化。O16gydF4y2BaDSTgydF4y2Ba#6 = 35S:SAUR16DST line 6;OE8#2 = 35S:SAUR8 line 2;等。gydF4y2BaegydF4y2Ba-gydF4y2Ba我gydF4y2Ba各种器官都较长gydF4y2Ba阿富汗二月gydF4y2Ba超表达。来自不同结构的表型非常相似,同一结构的株系之间比不同结构之间的变异更多,因此记为OE8/10/16 (35S:SAUR8, 35S:SAUR10或35S:SAUR16)。从最强的系显示表型。gydF4y2BaegydF4y2Ba第13阶段花的萼片长度。gydF4y2BafgydF4y2Ba分层后7天下胚轴黄化长度。gydF4y2BaggydF4y2Ba第13期花的雌蕊长度。gydF4y2BahgydF4y2Ba第13阶段花的花丝长度。gydF4y2Ba我gydF4y2Ba茎生叶的长度和形状。gydF4y2BajgydF4y2Ba表达gydF4y2BaSAUR10gydF4y2Ba-分枝基因在茎gydF4y2Ba35 s: SAUR10gydF4y2Ba行,相对于野生型茎的表达。差异显著(t检验,gydF4y2BapgydF4y2Ba< 0.05)用星号表示gydF4y2Ba
单T-DNA和双T-DNA突变系不表现突变表型gydF4y2Ba
来考察不同的作用gydF4y2BaSAUR10gydF4y2Ba进一步,我们寻找可用的T-DNA插入突变体。我们鉴定了八个基因中的每一个(见附加文件)gydF4y2Ba3.gydF4y2Ba:图S2),但不能确认T-DNA插入的存在gydF4y2Basaur50gydF4y2Ba(SALK_022758)和gydF4y2Basaur10-1gydF4y2Ba(FLAG_590D09)。此外,其他4个系可以通过基因分型确认,但T-DNA插入第一个外显子上游或仅显示部分转录减少(gydF4y2Basaur10-2gydF4y2BaSM_3_1724;gydF4y2Basaur9-2gydF4y2BaSALK_054423;gydF4y2Basaur12gydF4y2BaSALK_09008C0;gydF4y2Basaur54gydF4y2BaSALK_054420)。其余几行显示了明显的下调记录(gydF4y2Basaur8gydF4y2BaSALK_003272;gydF4y2Basaur9gydF4y2BaSALK_054423;gydF4y2Basaur16gydF4y2BaSALK_003390;gydF4y2Basaur51gydF4y2Ba, FLAG_496D01)在植物发育过程中表现出野生型表型。我们生成了几个双突变和三突变组合,以进一步搜索突变表型(见附加文件)gydF4y2Ba3.gydF4y2Ba:图S2),但在观察幼苗生长、莲座和茎叶形状、植株结构、花表型和雌蕊/角果大小时,只观察到野生型表型。a的分析gydF4y2Basaur50saur16gydF4y2Ba使用CRISPR/Cas9系统产生的双突变体最近在幼苗中发现了轻微的生长迟缓[gydF4y2Ba9gydF4y2Ba],确认的作用gydF4y2BaSAUR16gydF4y2Ba而且gydF4y2BaSAUR50gydF4y2Ba细胞伸长。在我们的分析中突变表型的缺乏很大程度上可能是由于高水平的冗余gydF4y2Ba阿富汗二月gydF4y2BaS和缺乏像样的淘汰台词。然而,当进行非常详细的测量或特定的分析(对光/激素的反应)时,有可能检测到轻度表型。gydF4y2Ba
此外,表型效应gydF4y2Ba阿富汗二月gydF4y2Ba淘汰可以通过反馈机制来平衡,这种机制允许对某些淘汰进行补偿gydF4y2Ba阿富汗二月gydF4y2BaS通过上调其他基因,导致表型上的无效效应。以确定是否gydF4y2Ba阿富汗二月gydF4y2Ba表达对他人的上调或下调有反应gydF4y2Ba阿富汗二月gydF4y2BaS,我们测试了所有的表达式gydF4y2BaSAUR10gydF4y2Ba-分枝基因gydF4y2Ba35 s: SAUR10gydF4y2Ba过度表达线条,发现gydF4y2BaSAUR8gydF4y2Ba,gydF4y2BaSAUR16gydF4y2Ba,gydF4y2BaSAUR50gydF4y2Ba而且gydF4y2BaSAUR51gydF4y2Ba有明显的表情减少的反应gydF4y2BaSAUR10gydF4y2Ba超表达(无花果。gydF4y2Ba1 jgydF4y2Ba),表明SAUR反馈循环的存在可以补偿去监管gydF4y2Ba阿富汗二月gydF4y2Ba表达式。gydF4y2Ba
SAUR10gydF4y2Ba-支基因有不同的表达模式gydF4y2Ba
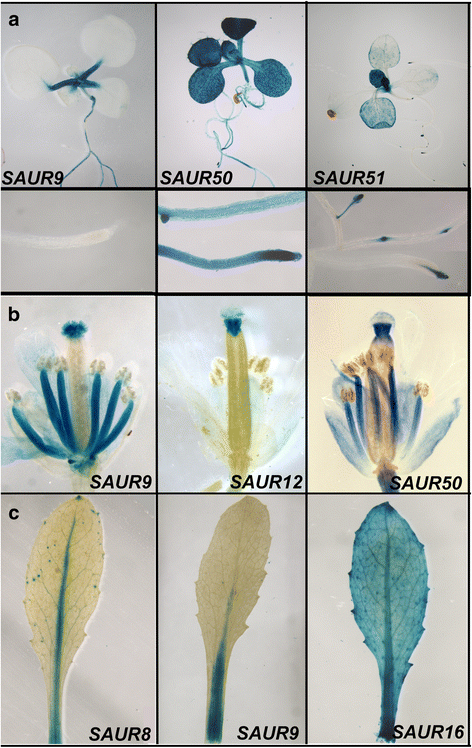
不同SAURs的蛋白质功能似乎相似,但它们在植物生长发育过程中的作用可能非常不同,这取决于它们调控区域的变化,这些变化可以带来特定的表达模式和对上游因子的反应。研究这八种基因的表达模式gydF4y2BaSAUR10gydF4y2Ba-支基因,我们生成启动子:每个基因含有大约3 KB的上游序列融合到β-葡萄糖醛酸酶(gydF4y2Ba格斯gydF4y2Ba)报告基因,并比较了在植物不同部位观察到的表达模式(图;gydF4y2Ba2gydF4y2Ba和附加文件gydF4y2Ba4gydF4y2Ba:图S3)。对于每个构造,提出了大约20条线,其中有两条强线被详细描述。这为使用相同报告构造生成的所有行生成了一致的模式,除了gydF4y2BapSAUR54:格斯gydF4y2Ba在不同的组织中,这些细胞系在信号的存在或不存在时表现出一定的可变性。有趣的是,不同结构的GUS表达模式高度不同,这表明gydF4y2Ba阿富汗二月gydF4y2BaSgydF4y2BaSAUR10gydF4y2Ba-分支根据它们表达的组织履行不同的功能。例如,我们观察到不同的表达gydF4y2BaSAUR54gydF4y2Ba毛状体,gydF4y2BaSAUR51gydF4y2Ba在原基,gydF4y2BaSAUR9gydF4y2Ba在叶柄和gydF4y2BaSAUR12gydF4y2Ba在风格。然而,在大多数组织中,有两个或两个以上的gydF4y2BaSAUR10gydF4y2Ba-分支基因被发现共表达,这表明该基因具有冗余功能gydF4y2BaSAUR10gydF4y2Ba基因进化枝。gydF4y2Ba
的gydF4y2BaSAUR10gydF4y2Ba-支基因表现出不同的表达模式。选择显示不同组织表达的图片。GUS染色过夜。整套图片见附加文件gydF4y2Ba4gydF4y2Ba:图S3。gydF4y2Ba一个gydF4y2Ba的表达gydF4y2BapSAUR9:格斯gydF4y2Ba,gydF4y2BapSAUR50:格斯gydF4y2Ba而且gydF4y2BapSAUR51:格斯gydF4y2Ba在14天大的幼苗中。下面的面板显示了在幼苗根部的染色图案的放大。gydF4y2BabgydF4y2Ba的表达gydF4y2BapSAUR9:格斯gydF4y2Ba,gydF4y2BapSAUR12:格斯gydF4y2Ba而且gydF4y2BapSAUR50:格斯gydF4y2Ba在开放的花朵中。gydF4y2BacgydF4y2Ba的表达gydF4y2BapSAUR8:格斯gydF4y2Ba,gydF4y2BapSAUR9:格斯gydF4y2Ba而且gydF4y2BapSAUR16:格斯gydF4y2Ba在成熟的茎生叶中gydF4y2Ba
一些gydF4y2Ba阿富汗二月gydF4y2Ba基因,比如gydF4y2BaSAUR16gydF4y2Ba而且gydF4y2BaSAUR50gydF4y2Ba,在广泛的组织中表达。在子叶、莲座叶、茎生叶、花和角果中均有GUS染色。其他gydF4y2Ba阿富汗二月gydF4y2Ba显示了更具体的表达模式(图;gydF4y2Ba2gydF4y2Ba和附加文件gydF4y2Ba4gydF4y2Ba:图S3)。gydF4y2BapSAUR9:格斯gydF4y2Ba例如,在叶柄和叶片中脉有特异性表达,而在花中仅在花丝和柱头乳突有表达。gydF4y2BapSAUR12:格斯gydF4y2Ba在花中显示高度特异性染色,仅在13-16期花的风格中表达。的表达模式gydF4y2BapSAUR8:格斯gydF4y2Ba在叶中仅限于中脉和叶柄,类似于gydF4y2BaSAUR10gydF4y2Ba而且gydF4y2BaSAUR9gydF4y2Ba,而成熟花的图案与gydF4y2BapSAUR16:格斯gydF4y2Ba.最后,gydF4y2BaSAUR51gydF4y2Ba而且gydF4y2BaSAUR54gydF4y2Ba再次显示了不同的表情模式。它们在膨大的莲座叶和茎生叶中几乎没有表达gydF4y2BapSAUR51:格斯gydF4y2Ba在根原基、叶原基和花原基高度活跃,而gydF4y2BapSAUR54:格斯gydF4y2Ba是唯一的gydF4y2BaSAUR10gydF4y2Ba该基因在新生叶片的毛状体中表现出高表达。gydF4y2Ba
SAUR10gydF4y2Ba-分支启动子包含多个TF结合位点gydF4y2Ba
的不同表达模式gydF4y2BaSAUR10gydF4y2Ba-分支基因在植物发育过程中可能是由不同的tf调控的结果。gydF4y2Ba阿富汗二月gydF4y2Ba已被确定为参与生长发育的不同转录因子的靶点,如mads域转录因子SEPALLATA3 (SEP3) [gydF4y2Ba28gydF4y2Ba], aptala1 (ap1) [gydF4y2Ba29gydF4y2Ba],和FUL [gydF4y2Ba3.gydF4y2Ba],以及TCP(大刍草分枝1 /CYCLOIDEA/ proliferation CELL FACTOR1)家族蛋白TCP20 [gydF4y2Ba30.gydF4y2Ba].为了更深入地了解可以直接调节的tfgydF4y2BaSAUR10gydF4y2Ba-分支基因,我们搜索了植物DHS数据库(gydF4y2Bahttp://plantdhs.org/gydF4y2Ba) [gydF4y2Ba31gydF4y2Ba],其中包含来自26个不同TF的ChIP-seq数据gydF4y2BaSAUR10gydF4y2Ba-分支启动子(见表gydF4y2Ba1gydF4y2Ba).我们发现gydF4y2Ba阿富汗二月gydF4y2Bas普遍存在于不同tf的ChIP-seq数据中,特别是APETALA2 (AP2),以及参与开花和花器官发育的mads域tf AGL15、AP1和SEP3,以及在生物钟控制过程中起作用的伪反应调控因子(伪反应调控因子)PRR5和PRR7。因此,的表达gydF4y2BaSAUR10gydF4y2Ba-支基因在花序和花器官中的表达可能主要受mads结构域tf和AP2的控制,其表达幅度可能受生物钟的调控。有趣的是,广泛表达gydF4y2BaSAUR16gydF4y2Ba而且gydF4y2BaSAUR50gydF4y2Ba基因也表现出最多的TF结合事件。某些特异的tf结合也可以被鉴定出来,例如参与光敏色素通路的FAR-RED ELONGATED下胚轴3 (FHY3)的结合gydF4y2BaSAUR16gydF4y2Ba和雌蕊(PI),具体参与花瓣和雄蕊发育,上游gydF4y2BaSAUR16gydF4y2Ba而且gydF4y2BaSAUR51gydF4y2Ba编码区域。这些结果表明gydF4y2Ba阿富汗二月gydF4y2Ba的确是tf控制植物发育和生长的共同目标。gydF4y2Ba
SAUR10 -gydF4y2Ba分支基因对激素的反应不同gydF4y2Ba
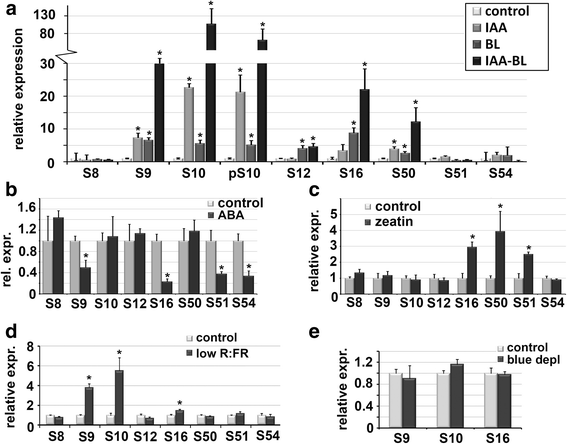
高通量转录组分析揭示了不同的gydF4y2Ba阿富汗二月gydF4y2Ba基因可以对各种激素信号如生长素、BR和ABA作出反应(见[gydF4y2Ba8gydF4y2Ba]和附加文件gydF4y2Ba2gydF4y2Ba:概述见表S1)。然而,一些gydF4y2Ba阿富汗二月gydF4y2Ba基因似乎对这些激素中的任何一种都没有反应。为了更详细地研究对激素的反应gydF4y2BaSAUR10gydF4y2Ba我们用14日龄的幼苗进行了几次激素诱导实验。gydF4y2BaSAUR10gydF4y2Ba在添加生长素的液体培养基中孵育4 h后高度诱导(5 μM IAA [gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba14gydF4y2Ba]),以及gydF4y2BaSAUR16, SAUR9gydF4y2Ba而且gydF4y2BaSAUR50gydF4y2Ba结果表明,施用生长素后,其表达量显著增加(图;gydF4y2Ba3gydF4y2Ba).我们测试了对各种其他激素的反应,并证明相同的基因也对油菜素类固醇(BR)有反应(图2)。gydF4y2Ba3gydF4y2Ba),正如之前报道的那样gydF4y2Ba阿富汗二月gydF4y2Ba年代,包括gydF4y2BaSAUR10gydF4y2Ba[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba24gydF4y2Ba].gydF4y2BaSAUR12gydF4y2Ba对BR的反应也有4倍的诱导。同时应用IAA和BR时,gydF4y2BaSAUR9gydF4y2Ba而且gydF4y2BaSAUR10gydF4y2Ba表现出强烈的协同反应,转录水平上升到对照条件的100倍,而且gydF4y2BaSAUR16gydF4y2Ba而且gydF4y2BaSAUR50gydF4y2Ba表现出增强的反应。这说明许多生长素受到调节gydF4y2Ba阿富汗二月gydF4y2Ba也受到BR的组合调节。然而,事实是gydF4y2BaSAUR12gydF4y2Ba只有响应BR表明响应也可以解耦。为了研究IAA-BR诱导的动态,我们还测试了IAA-BR诱导的下降gydF4y2BaSAUR9gydF4y2Ba而且gydF4y2BaSAUR10gydF4y2Ba去除诱导介质后,发现转录水平在一小时内下降(附加文件gydF4y2Ba5gydF4y2Ba:图S4),说明了的快速分解gydF4y2Ba阿富汗二月gydF4y2Ba转录本和生长反应的动态性质。gydF4y2Ba
SAUR10gydF4y2Ba-支基因对不同激素的应用反应不同。gydF4y2Ba一个gydF4y2Ba表达gydF4y2BaSAUR10gydF4y2Ba用生长素、油菜素内酯或两者的组合处理4小时后,幼苗的-分枝基因。x轴上的数字代表不同gydF4y2Ba阿富汗二月gydF4y2Bap10代表基因gydF4y2BapSAUR10:格斯gydF4y2Ba,其中gydF4y2Ba格斯gydF4y2Ba监测表达。gydF4y2BabgydF4y2Ba表达gydF4y2BaSAUR10gydF4y2Ba-分枝基因在ABA处理4 h后相对于模拟处理幼苗的表达。gydF4y2BacgydF4y2Ba的表达gydF4y2BaSAUR10gydF4y2Ba玉米素处理4 h后,幼苗中-分枝基因的表达相对于模拟处理的幼苗。gydF4y2BadgydF4y2Ba表达gydF4y2BaSAUR10gydF4y2Ba与对照条件下生长4小时的幼苗相比,在降低R:FR条件下生长4小时的幼苗中直接收获-分支基因。gydF4y2BaegydF4y2Ba的表达gydF4y2BaSAUR9gydF4y2Ba,gydF4y2BaSAUR10gydF4y2Ba而且gydF4y2BaSAUR16gydF4y2Ba在弱蓝光条件下生长4小时后的幼苗。误差条表示基于三到四个生物副本的SE。差异显著(t检验,gydF4y2BapgydF4y2Ba< 0.05)用星号表示gydF4y2Ba
与生长素和BR相比,非生物胁迫相关激素ABA对生长有负向影响,这可能是通过抑制ABA来调节的gydF4y2Ba阿富汗二月gydF4y2Ba还有基因。事实上,非生物胁迫响应的转录因子AZF1(拟南芥锌指蛋白1)和AZF2下调了许多ABA和渗透胁迫抑制基因,也抑制了一些ABA和渗透胁迫抑制基因gydF4y2Ba阿富汗二月gydF4y2Ba[gydF4y2Ba20.gydF4y2Ba].我们测试了表达式gydF4y2BaSAUR10gydF4y2Ba100 μM ABA处理4 h后,-分枝基因的表达显著下调gydF4y2BaSAUR9gydF4y2Ba,gydF4y2BaSAUR16gydF4y2Ba,gydF4y2BaSAUR51gydF4y2Ba而且gydF4y2BaSAUR54gydF4y2Ba(无花果。gydF4y2Ba3 bgydF4y2Ba),支持SAURs在aba诱导的生长迟缓中的作用。我们还研究了对细胞分裂素(1 μM Zeatin)的反应gydF4y2BaSAUR16gydF4y2Ba,gydF4y2BaSAUR50gydF4y2Ba而且gydF4y2BaSAUR51gydF4y2Ba在细胞分裂素的作用下上调(图;gydF4y2Ba3 cgydF4y2Ba),用于gydF4y2BaSAUR50gydF4y2Ba而且gydF4y2BaSAUR51gydF4y2Ba与它们在根尖的表达有很好的相关性(见图。gydF4y2Ba2gydF4y2Ba).GA治疗没有导致转录水平的重大变化,但gydF4y2BaSAUR9gydF4y2Ba表达减少了2倍,而gydF4y2BaSAUR54gydF4y2Ba转录水平被轻度上调(附加文件gydF4y2Ba6gydF4y2Ba:图S5)。综上所述,激素应用实验表明gydF4y2BaSAUR10gydF4y2Ba-支基因对各种激素的反应非常不同。gydF4y2Ba
报告基因模式与激素诱导的表达相关gydF4y2Ba
几个gydF4y2Ba阿富汗二月gydF4y2BaSgydF4y2BaSAUR10gydF4y2Ba-分枝显示暗诱导表达下胚轴(附加文件gydF4y2Ba4gydF4y2Ba:图S3)。特别是gydF4y2BaSAUR9gydF4y2Ba,gydF4y2BaSAUR10gydF4y2Ba而且gydF4y2BaSAUR16gydF4y2Ba,在浅色生长的下胚轴中未表现出任何GUS信号,而在深色生长的下胚轴中表现出非常明显的GUS信号。这与IAA-BR实验相吻合,实验表明gydF4y2BaSAUR9gydF4y2Ba,gydF4y2BaSAUR10gydF4y2Ba而且gydF4y2BaSAUR16gydF4y2Ba对这些激素的反应最高。这些数据表明,对生长素和BR的反应发生在启动子水平,正如已报道的那样gydF4y2BaSAUR15gydF4y2Ba[gydF4y2Ba21gydF4y2Ba].此外,gydF4y2Ba格斯gydF4y2Ba表达式gydF4y2BapSAUR10:格斯gydF4y2Ba线可以诱导到类似的水平gydF4y2BaSAUR10gydF4y2BaIAA-BR联合处理后(图;gydF4y2Ba3gydF4y2Ba;[gydF4y2Ba3.gydF4y2Ba]),表示归纳所需的所有元素gydF4y2BaSAUR10gydF4y2BaIAA和BR在启动子片段中存在。为了进一步研究这一点,我们还测试了IAA/BR是否诱导gydF4y2Ba阿富汗二月gydF4y2Ba表达异位发生,或发生在内源性表达的位置。gydF4y2BapSAUR:格斯gydF4y2Ba反应最强的幼苗,gydF4y2BaSAUR9gydF4y2Ba,gydF4y2BaSAUR10gydF4y2Ba而且gydF4y2BaSAUR16gydF4y2Ba与之前一样,用Mock或IAA/BR处理,随后染色GUS活性(附加文件)gydF4y2Ba7gydF4y2Ba:图S6)。GUS信号仅在内源性表达的位置观察到增加(附加文件)gydF4y2Ba4gydF4y2Ba:图S3和附加文件gydF4y2Ba7gydF4y2Ba:图S6),表明IAA/BR只能在基因已经活跃的组织中增强启动子活性。gydF4y2Ba
除了下胚轴的生长外,雄蕊丝的伸长也依赖于生长素和BR [gydF4y2Ba15gydF4y2Ba,gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba].有趣的是,gydF4y2BaSAUR10gydF4y2Ba-分枝基因对生长素和BR有明显的反应,gydF4y2BaSAUR9gydF4y2Ba,gydF4y2BaSAUR10gydF4y2Ba,gydF4y2BaSAUR16gydF4y2Ba而且gydF4y2BaSAUR50gydF4y2Ba,均在丝伸长后期高表达(图2)。gydF4y2Ba2gydF4y2Ba和附加文件gydF4y2Ba4gydF4y2Ba:图S3),并已被确定为ARF6/ARF8和BZR1的直接目标(附加文件gydF4y2Ba2gydF4y2Ba:表S1;[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba22gydF4y2Ba])。这些数据强化了这样一种观点gydF4y2BaSAUR9gydF4y2Ba,gydF4y2BaSAUR10gydF4y2Ba,gydF4y2BaSAUR16gydF4y2Ba而且gydF4y2BaSAUR50gydF4y2Ba可能在生长素和BR下游发挥作用,以调节例如雄蕊丝的生长。gydF4y2Ba
在减R:FR光下,SAUR9, SAUR10和SAUR16上调gydF4y2Ba
为了应对荫蔽条件,植物调整其生长程序,并表现出改变的形态,包括茎伸长、叶柄扩张和低垂叶运动,统称为避荫综合征(SAS) [gydF4y2Ba34gydF4y2Ba].当R:FR光比降低或蓝光耗竭时,SAS反应由生长素和BR共同调节gydF4y2Ba阿富汗二月gydF4y2Ba基因也是[gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba].最近,表达gydF4y2BaSAUR10gydF4y2Ba在低R:FR光条件下确实被上调[gydF4y2Ba3.gydF4y2Ba].我们测试了所有的表达水平gydF4y2BaSAUR10gydF4y2Ba通过将14天大的幼苗转移到低R:FR光照条件下,并与对照条件下的幼苗进行基因表达比较。gydF4y2BaSAUR9gydF4y2Ba而且gydF4y2BaSAUR10gydF4y2Ba在低R:FR光照射4 h后,其表达显著增加,而在低R:FR光照射4 h后,其表达有轻微但显著的增加gydF4y2BaSAUR16gydF4y2Ba.另一个gydF4y2Ba阿富汗二月gydF4y2Ba分枝的突变体对光照条件的变化没有反应(图。gydF4y2Ba3 dgydF4y2Ba).我们还测试了gydF4y2BaSAUR9gydF4y2Ba,gydF4y2BaSAUR10gydF4y2Ba或gydF4y2BaSAUR16gydF4y2Ba对蓝光消耗的反应,因为对这种光照条件的反应已被证明与生长素和油菜素类固醇的结合有关[gydF4y2Ba35gydF4y2Ba],但表达水平与对照条件相似(图;gydF4y2Ba3 egydF4y2Ba).回应gydF4y2BaSAUR9gydF4y2Ba对模拟阴影条件的影响尤其有趣,因为它在叶柄中的特定表达可能与SAS响应中的作用密切相关。gydF4y2Ba
存在的AuxRE和BZR图案在gydF4y2Ba阿富汗二月gydF4y2Ba启动子与其生长素反应性相关gydF4y2Ba
激素诱导研究和表达分析结果表明gydF4y2Ba阿富汗二月gydF4y2Ba基因有特定的表达模式,对不同激素的应用有不同的反应。根据我们的结果和之前发表的高通量研究,gydF4y2Ba阿富汗二月gydF4y2Ba基因可分为两类:I)gydF4y2Ba阿富汗二月gydF4y2Ba应用生长素诱导的基因,II)gydF4y2Ba阿富汗二月gydF4y2Ba对生长素应用无反应的基因(见附加文件)gydF4y2Ba2gydF4y2Ba:表S2)。的gydF4y2BaSAUR10gydF4y2Ba进化枝的基因,gydF4y2BaSAUR9gydF4y2Ba,gydF4y2BaSAUR10gydF4y2Ba,gydF4y2BaSAUR16gydF4y2Ba而且gydF4y2BaSAUR50gydF4y2Ba属于生长素诱导组(Class I),而gydF4y2BaSAUR8gydF4y2Ba、SAUR12和gydF4y2BaSAUR54gydF4y2Ba不受生长素(II类)的调控。I类生长素的诱导性gydF4y2BaSAUR10gydF4y2Ba-支基因可以被ARFs调节,这可以通过事实说明gydF4y2BaSAUR10gydF4y2Ba被下调了gydF4y2Baarf5gydF4y2Ba突变体(gydF4y2Ba17gydF4y2Ba),gydF4y2BaSAUR9gydF4y2Ba在这两个gydF4y2Baarf5gydF4y2Ba而且gydF4y2Baarf7/19gydF4y2Ba突变体(gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba),而gydF4y2BaSAUR10gydF4y2Ba,gydF4y2BaSAUR16gydF4y2Ba而且gydF4y2BaSAUR50gydF4y2Ba在ChIP-seq实验中已被确定为直接ARF靶标[gydF4y2Ba22gydF4y2Ba].在我们的实验中,gydF4y2BaSAUR51gydF4y2Ba生长素对幼苗没有反应,但之前的研究表明gydF4y2BaSAUR51gydF4y2Ba由根中的生长素诱导[gydF4y2Ba12gydF4y2Ba],因此我们补充gydF4y2BaSAUR51gydF4y2Ba变成I类基因我们在附加文件中总结了以往研究的结果gydF4y2Ba2gydF4y2Ba表S1,并发现50gydF4y2Ba阿富汗二月gydF4y2Ba基因属于I类(生长素诱导),而20个基因在任何实验中都对生长素无反应,归为II类[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba19gydF4y2Ba](见附加文件gydF4y2Ba2gydF4y2Ba:表S2)。这表明,尽管他们的名字,后一组gydF4y2Ba阿富汗二月gydF4y2Ba基因受生长素以外的其他因素调控。gydF4y2Ba
为了研究这些群体是否也可以根据其调控区域中某些顺式元件的存在来区分,我们在所有的3 kb上游区域中寻找生长素相关的顺式元件gydF4y2Ba阿富汗二月gydF4y2Bas. ARFs绑定到AuxRE motif (TGTCTC/GAGACA [gydF4y2Ba37gydF4y2Ba]或TGTCGG/CCGACA [gydF4y2Ba38gydF4y2Ba],几乎在所有的gydF4y2Ba阿富汗二月gydF4y2Ba监管序列;在I类和II类启动子之间,也在所有saurs (I类和II类一起)和随机对照组之间,单个AuxRE基序的丰度没有显著差异。然而,arf是绑定的gydF4y2Ba在足底gydF4y2Ba通常作为两个AuxRE元件的外翻重复的同二聚体,由特定的间距隔开[gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba].这个结合位点的共识可以记为TGTC[x]gydF4y2Ba11 - 13gydF4y2BaGACA,其中TGTC和GACA代表核心AuxRE结合位点,而[x]gydF4y2Ba11 - 13gydF4y2Ba表示中间核苷酸的数目。我们用三种不同的间距变体测试了这个基序,发现在I类(生长素诱导的)启动子中有明显的过度表达。含有该基序的I类启动子的比例为0.22(其中11 / 50)gydF4y2BaSAUR10gydF4y2Ba而且gydF4y2BaSAUR51gydF4y2Ba),而II类启动子的这一比例为0(0 / 20),对照组为0.07。I类启动子与II类启动子之间的差异(p~0.02)以及I类启动子与对照组之间的差异(p~0.02)均显著。这种联合共识主题的变体已经发表(例如GGTC[x]gydF4y2Ba11gydF4y2BaGACA [gydF4y2Ba38gydF4y2Ba]),而且某些arf的间隔可以更灵活[gydF4y2Ba38gydF4y2Ba],表明更大比例的gydF4y2Ba阿富汗二月gydF4y2Ba在测试更轻松的主题时,s可能与合并的AuxRE主题相识别。例如,gydF4y2BaSAUR16gydF4y2Ba启动子包含GGTC[x]gydF4y2Ba9gydF4y2BaGACA motif,可能与ARF5结合[gydF4y2Ba38gydF4y2Ba].然而,测试更宽松的基序也增加了II类基因中合并AuxRE基序的发生。有趣的是,与II类启动子相比,BZR1结合基序(CACGTG)在I类启动子中表达过多(10/50 vs 0/20, p~0.03),并且在b类启动子中被识别gydF4y2BaSAUR10gydF4y2Ba,gydF4y2BaSAUR12gydF4y2Ba而且gydF4y2BaSAUR16gydF4y2Ba,但不是在非br响应gydF4y2BaSAUR10gydF4y2Ba进化枝gydF4y2Ba阿富汗二月gydF4y2Ba证实了生长素与BR调控之间的一定联系gydF4y2Ba阿富汗二月gydF4y2Ba[gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba].这些硅数据支持这一发现,并不是所有gydF4y2Ba阿富汗二月gydF4y2Bas可由生长素诱导,提示ⅱ类缺乏生长素反应性gydF4y2Ba阿富汗二月gydF4y2Ba基因的缺失是由结合的AuxRE元件的缺失引起的,这伴随着较低比例的BZR1基序。gydF4y2Ba
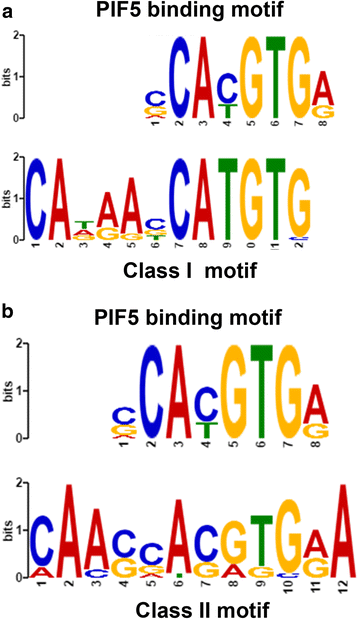
从头motif搜索揭示了一个包含motif的PIF5结合位点gydF4y2Ba
确定其他转录因子是否可以被鉴定为gydF4y2Ba阿富汗二月gydF4y2Ba基因,我们进行了从头开始的母题搜索。这揭示了一类特定的主题gydF4y2Ba阿富汗二月gydF4y2Ba促销员,以及另一个二类略有不同的主题gydF4y2Ba阿富汗二月gydF4y2Ba启动子(见图;gydF4y2Ba4gydF4y2Ba).使用TOMTOM,我们检查了两个基序中已知结合位点的出现,并发现了与PIF5基序的单一匹配。因此,两者都在集合中gydF4y2Ba阿富汗二月gydF4y2Ba在受生长素调控和不受生长素调控的情况下,发现了一个PIF5样基序,尽管它们彼此有些不同,并且与已知的典型PIF5结合位点相比有所扩展。为了进一步研究这一点,这两个母题的一致版本在两组中都进行了测试。motif CAxxxxCATGTG(图中所示motif的一致版本)。gydF4y2Ba4gydF4y2Ba)存在于生长素诱发的50例中有28例gydF4y2Ba阿富汗二月gydF4y2Ba(其中gydF4y2BaSAUR10gydF4y2Ba),在20个二类中只有2个gydF4y2Ba阿富汗二月gydF4y2Ba;后者类似于在500个随机选择的启动子中出现56个。调控序列和非调控序列之间的差异是显著的(gydF4y2BapgydF4y2Ba= 0.0003)。因此,pif5样基序CAxxxxCATGTG显然更多地出现在I类中gydF4y2Ba阿富汗二月gydF4y2Ba比第二类要少gydF4y2Ba阿富汗二月gydF4y2BaS和对照启动子。替代CA[AC]xxAxGTG(图中所示motif的一致版本)。gydF4y2Ba4 bgydF4y2Ba)在第一类之间的发生没有显著差异gydF4y2Ba阿富汗二月gydF4y2Ba第II类gydF4y2Ba阿富汗二月gydF4y2Ba或者随机背景。gydF4y2Ba
所有pif优先绑定到g -box (5 ' -CACGTG-3 ') [gydF4y2Ba39gydF4y2Ba], PIF5也与I类基序5 ' -CATGTG-3 '结合[gydF4y2Ba40gydF4y2Ba].核心g -box (PIF4/5结合位点)非常丰富,存在于所有的细胞中gydF4y2BaSAUR10gydF4y2Ba基因进化枝。据此,许多人gydF4y2Ba阿富汗二月gydF4y2Ba已被确定为PIF4的直接靶点,包括gydF4y2BaSAUR9gydF4y2Ba,gydF4y2BaSAUR10gydF4y2Ba,gydF4y2BaSAUR12gydF4y2Ba,gydF4y2BaSAUR16gydF4y2Ba,gydF4y2BaSAUR50gydF4y2Ba而且gydF4y2BaSAUR51gydF4y2Ba[gydF4y2Ba22gydF4y2Ba],以及PIF5 [gydF4y2Ba40gydF4y2Ba](见附加文件gydF4y2Ba2gydF4y2Ba:表S1)。PIF5是否在I类SAURs的调控中起特定作用仍有待研究。的下调gydF4y2BaSAUR9gydF4y2Ba,gydF4y2BaSAUR10gydF4y2Ba而且gydF4y2BaSAUR16gydF4y2Ba的下胚轴gydF4y2BapifqgydF4y2Ba四突变体(gydF4y2Bapif1gydF4y2Ba,gydF4y2Bapif3gydF4y2Ba,gydF4y2Bapif4gydF4y2Ba而且gydF4y2Bapif5gydF4y2Ba) [gydF4y2Ba9gydF4y2Ba]至少表明了光响应gydF4y2BaSAUR10gydF4y2Ba进化枝gydF4y2Ba阿富汗二月gydF4y2Ba均受pif调控。此外,Hornitschek等人的一项研究[gydF4y2Ba40gydF4y2Ba),gydF4y2BaSAUR10gydF4y2Ba而且gydF4y2BaSAUR16gydF4y2Ba是唯一的gydF4y2Ba阿富汗二月gydF4y2Ba这些都被大幅下调了gydF4y2Bapif4pif5gydF4y2Ba幼苗,而且只有gydF4y2BaSAUR10gydF4y2Ba被下调了gydF4y2Bapif5gydF4y2Ba单突变苗。这将是有趣的研究CAxxxxCATGTG基序的作用gydF4y2BaSAUR10gydF4y2Ba其pif5依赖性调节的启动子。此处长基序的鉴定可能指向靠近PIF的第二个转录因子的结合。我们的内硅分析强调了pif的重要性gydF4y2Ba阿富汗二月gydF4y2Ba调控一般,但也揭示了生长素诱导组间的差异gydF4y2Ba阿富汗二月gydF4y2BaS和非生长素组调节gydF4y2Ba阿富汗二月gydF4y2Bas.除了一些富A/ t伸展的富集gydF4y2Ba阿富汗二月gydF4y2Ba启动子序列中,没有发现其他结合位点在gydF4y2Ba阿富汗二月gydF4y2Ba启动子与对照启动子的比较。gydF4y2Ba
讨论gydF4y2Ba
SAURs允许植物在各种组织中微调生长gydF4y2Ba
这里是8gydF4y2BaSAUR10gydF4y2Ba-支基因可能具有相似的蛋白质功能,但表现出明显不同的表达模式。因此,我们预计所有saur10分支蛋白都能够通过诱导细胞壁酸化来促进细胞伸长,就像SAUR9和SAUR50所显示的那样[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba],而每个基因上游区域的不同顺式元件组合允许非常特定的活动。与之前的结果一致,我们发现了一些gydF4y2Ba阿富汗二月gydF4y2BaS对激素有高度反应,而其他人则完全没有反应。我们的数据与先前发表的生长素反应基因列表的比较[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba19gydF4y2Ba揭示了在不同的实验中对生长素的反应是相当一致的,并且gydF4y2BaSAUR9gydF4y2Ba,gydF4y2BaSAUR10gydF4y2Ba,gydF4y2BaSAUR16gydF4y2Ba而且gydF4y2BaSAUR50gydF4y2Ba一般对生长素有反应,而gydF4y2BaSAUR8gydF4y2Ba,gydF4y2BaSAUR12gydF4y2Ba,gydF4y2BaSAUR54gydF4y2Ba永远不会做。这表明部分gydF4y2Ba拟南芥阿富汗二月gydF4y2Ba基因对生长素没有反应能力,可能以生长素独立的方式调节生长,尽管我们不能排除其中一些基因,如gydF4y2BaSAUR51gydF4y2Ba在特定组织中由生长素特异性诱导。无反应基因的生长素不敏感性得到了我们的硅晶片数据的支持,这表明在生长素诱导的基因组中,AuxRE组合元素的比例过高。然而,非诱导组中的基因仍可能对细胞伸长起重要作用,因为SAUR蛋白的过表达足以激活HgydF4y2Ba+gydF4y2Ba-生长素独立的atp酶[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba11gydF4y2Ba],以及其他几个gydF4y2Ba阿富汗二月gydF4y2Ba基因表现出不同的表达模式。例如,gydF4y2BaSAUR8gydF4y2Ba不是由生长素或油菜素类固醇诱导的,而是gydF4y2Ba35 s: SAUR8gydF4y2Ba过表达系具有明显的细胞伸长表型,而过表达系具有明显的细胞伸长表型gydF4y2BapSAUR8gydF4y2Ba:GUS报告系在不同组织中有不同的表达。同样的,gydF4y2BaSAUR51gydF4y2Ba在根尖和膨胀的叶中特异性表达(图;gydF4y2Ba2gydF4y2Ba和附加文件gydF4y2Ba4gydF4y2Ba:图S3)。具体的表达有一些gydF4y2Ba阿富汗二月gydF4y2Ba细胞外延伸域,如表达gydF4y2BaSAUR51gydF4y2Ba在根分生组织中,这是有趣的,可能指出SAURs除了细胞伸长之外的其他功能。gydF4y2Ba
由此可见gydF4y2Ba阿富汗二月gydF4y2Ba一般来说,基因对细胞伸长很重要,但每个基因都受到一组特定的上游因子的调控,使植物能够根据内部和外部信号对各种组织的生长进行微调。然而,我们的数据也表明gydF4y2BaSAUR10gydF4y2Ba进化枝gydF4y2Ba阿富汗二月gydF4y2Ba具有重叠的表达模式,与Sun等的数据一致。[gydF4y2Ba9gydF4y2Ba],用以识别gydF4y2Ba阿富汗二月gydF4y2Ba下胚轴和子叶对光照条件反应相似的基因。这表明,每个组织的生长反应是由一组相似的调控gydF4y2Ba阿富汗二月gydF4y2Ba,而不是单一基因。识别gydF4y2Ba阿富汗二月gydF4y2Ba突变表型,高阶突变体可能因此更好地产生基于基因的表达模式,而不是他们的同源性。gydF4y2Ba
组合响应gydF4y2Ba阿富汗二月gydF4y2Bas与生长素、BR和光照条件有关gydF4y2Ba
那gydF4y2Ba阿富汗二月gydF4y2BaS对生长素和油菜素内酯均有反应,此前已有报道[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba19gydF4y2Ba],以及Walcher和Nemhauser [gydF4y2Ba21gydF4y2Ba的生长素反应gydF4y2BaSAUR15gydF4y2Ba取决于功能性油菜素类固醇途径。我们在这里也展示了gydF4y2BaSAUR9gydF4y2Ba,gydF4y2BaSAUR10gydF4y2Ba,gydF4y2BaSAUR16gydF4y2Ba而且gydF4y2BaSAUR50gydF4y2Ba植物生长素与BR的联合作用可诱导表达水平提高,说明植物的基因间可能存在协同作用gydF4y2Ba阿富汗二月gydF4y2Ba家庭。这也得到了我们的发现的支持,与非调控基因相比,AuxRE和BZR结合基序在生长素诱导的基因组中高度过度代表。有趣的是,我们还发现PIF5结合位点仅在生长素诱导的类中出现过多,这表明pif定向调控也可能与生长素和BR响应因子共同发生。Oh等人发现ARF6、PIF4和BZR1之间存在物理上的相互作用,共同调控大量的共同靶基因,这与三者之间普遍存在的相互依赖性是一致的[gydF4y2Ba22gydF4y2Ba,gydF4y2Ba41gydF4y2Ba].我们在这里提出的硅数据与实际的响应性相关得很好gydF4y2BaSAUR10gydF4y2Ba-向生长素、BR和光进化。所有三个结合基序(ARF, BZR和PIF)的组合仅存在于蛋白的启动子中gydF4y2BaSAUR10gydF4y2Ba,gydF4y2BaSAUR16gydF4y2Ba而且gydF4y2BaSAUR50gydF4y2Ba,而gydF4y2BaSAUR12gydF4y2Ba缺乏ARF结合位点(基于我们的结果和之前发表的ChIP-seq数据;参见附加文件gydF4y2Ba2gydF4y2Ba:表S1)。尽管归纳了gydF4y2BaSAUR9gydF4y2Babij BR中,我们没有发现BZR结合基序gydF4y2BaSAUR9gydF4y2Ba推动者,也没有gydF4y2BaSAUR9gydF4y2Ba被Oh等人检测为BZR1目标[gydF4y2Ba22gydF4y2Ba],表明br诱导gydF4y2BaSAUR9gydF4y2Ba不会通过BZR1发生,或者涉及到一个遥远的增强子基序。我们的比较gydF4y2Ba阿富汗二月gydF4y2Ba用转录组数据进行分类gydF4y2BapifqgydF4y2Ba突变体(gydF4y2Ba9gydF4y2Ba],支持PIF和ARF调控之间的联系,因为14个基因中有12个在ARF中上调gydF4y2BapifqgydF4y2Ba突变体属于I类gydF4y2Ba阿富汗二月gydF4y2Ba只有2人是二类人gydF4y2Ba阿富汗二月gydF4y2Ba.因此,我们的数据为ARF-BZR-PIF之间的相互作用提供了更多的证据,研究这种相互作用的进一步要求将是有趣的,例如不同顺式元件之间的一定间距。结合的AuxRE元素和BZR1结合位点gydF4y2BaSAUR10gydF4y2Ba启动子大约相距100bp(−1538/−1640),但这些是否与真正的功能结合位点有关,以及这种间隔是否重要仍有待研究。gydF4y2Ba
阿富汗二月gydF4y2Ba监管是高度动态的gydF4y2Ba
我们在这里展示了gydF4y2Ba阿富汗二月gydF4y2BaS不仅在幼苗中表达,而且在整个植物中都有特定的表达模式,并且在很大程度上受到发育调控。此外,许多gydF4y2Ba阿富汗二月gydF4y2Ba基因对不同的激素有动态反应。除了生长素和BR,gydF4y2Ba阿富汗二月gydF4y2BaS对乙烯有正或负的反应[gydF4y2Ba23gydF4y2Ba], ga [gydF4y2Ba7gydF4y2Ba](附加文件gydF4y2Ba5gydF4y2Ba:图S4), ABA(图;gydF4y2Ba3 bgydF4y2Ba;[gydF4y2Ba20.gydF4y2Ba)和细胞分裂素(图;gydF4y2Ba3 cgydF4y2Ba).对环境和激素因素的动态反应可能是由两者的快速分解所保证的gydF4y2Ba阿富汗二月gydF4y2Ba转录本和SAUR蛋白([gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba]和附加文件gydF4y2Ba5gydF4y2Ba:图S4)。一旦刺激消失,SAUR水平就会下降,植物就会回到默认的生长模式。如表所示gydF4y2Ba1gydF4y2Ba的上游区域,存在不同tf的结合位点参与植物发育gydF4y2BaSAUR10gydF4y2Ba基因进化枝。这些tf可能决定了不同的组织特异性表达gydF4y2Ba阿富汗二月gydF4y2Ba基因,而这种表达的幅度可能由对激素信号转录因子的反应控制。gydF4y2Ba
动态调节可以使T-DNA突变体的表型分析复杂化,因为很可能在应用某些刺激后,突变表型只能被短暂观察到。我们的分析还表明,SAUR反馈循环可能会缓冲其他调控的上调或下调gydF4y2Ba阿富汗二月gydF4y2Ba(无花果。gydF4y2Ba1 jgydF4y2Ba),可能也阻碍了突变表型的鉴定。最近建立的植物CRISPR技术[gydF4y2Ba42gydF4y2Ba]将有望促进突变表型的发现,因为小的编码区域可以直接靶向,更容易在一个转化事件中产生两倍或三倍的突变体。gydF4y2Ba
结论gydF4y2Ba
阿富汗二月gydF4y2Ba基因编码的生长调节剂对植物的生长发育非常重要,并允许植物动态地对其环境做出反应。到目前为止,这种反应主要在幼苗中进行研究,但我们在这里表明,拟南芥gydF4y2BaSAUR10 -gydF4y2Ba进化枝的基因gydF4y2BaSAUR8gydF4y2Ba,gydF4y2BaSAUR9gydF4y2Ba,gydF4y2BaSAUR10gydF4y2Ba,gydF4y2BaSAUR12gydF4y2Ba,gydF4y2BaSAUR16gydF4y2Ba,gydF4y2BaSAUR50gydF4y2Ba,gydF4y2BaSAUR51gydF4y2Ba而且gydF4y2BaSAUR54gydF4y2Ba在整个植物中表达,每个都显示特定的表达模式。虽然过表达研究表明它们的蛋白质功能相似,但它们对激素的不同反应和不同的表达模式表明了这一点gydF4y2Ba阿富汗二月gydF4y2Ba基因使植物能够对各种组织的生长进行微调,以响应内部和外部的线索。在硅片中,顺式调节元件分析进一步揭示了所有gydF4y2Ba阿富汗二月gydF4y2BaS在其上游序列中包含不同的顺式元素集。此外,拟南芥gydF4y2Ba阿富汗二月gydF4y2Ba根据生长素的反应性可分为两类:I类基因受生长素诱导,通常具有AuxRE、BR和PIF结合元件,II类基因对生长素无反应。的特征gydF4y2Ba阿富汗二月gydF4y2Ba本研究提出的基因调控对理解植物生长动态具有重要意义。gydF4y2Ba
方法gydF4y2Ba
植物材料和生长条件gydF4y2Ba
在Col-0背景下生成过表达和报告线。索尔克(gydF4y2Ba43gydF4y2Ba]及JIC SM [gydF4y2Ba44gydF4y2Ba从NASC获得T-DNA系,FLAG T-DNA系[gydF4y2Ba45gydF4y2Ba都是从凡尔赛的IJPB收到的。所有用于T-DNA插入系基因分型的引物都可以在附加文件中找到gydF4y2Ba2gydF4y2Ba:表S3。植物在22°C的长日气候室(16/8)中生长在用HYPONeX®溶液(1.5 g/l)浇灌的岩棉块上。生长室中LED照明的光照条件为87.6 μmol mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba光合有效辐射(PAR);R:FR比= 30.1)。添加FR (730 nm)辐照可降低R:FR, PAR为83.5 μmol mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba, R:FR比为1.15。通过一层LEE Medium Yellow 010滤光片滤除蓝光,PAR为70.4 μmol mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba,在蓝光光谱(400-500 nm)中含有1.06789E-02 W/(sqm*nm)的辐照度,而在对照条件下为3.84107E-01 W/(sqm*nm)。gydF4y2Ba
转基因株系的生成gydF4y2Ba
的编码序列生成过表达式结构gydF4y2BaSAUR8gydF4y2Ba,gydF4y2BaSAUR10gydF4y2Ba而且gydF4y2BaSAUR16gydF4y2Ba从基因组DNA中扩增(见附加文件gydF4y2Ba2gydF4y2Ba:表S3为所有引物序列),通过BP反应重组成pDONR221 (Gateway技术,Invitrogen公司),随后重组成二元载体pK2GW7 [gydF4y2Ba46gydF4y2Ba]使用LR反应。记者构造为八gydF4y2BaSAUR10gydF4y2Ba-分支基因通过扩增约。基因组DNA上游3 kb区域。将这些片段重组成pDONR221,再重组成二进制载体pBGWFS7 [gydF4y2Ba46gydF4y2Ba].所有的构建都转化为农杆菌,并用花浸法导入Col-0植物。gydF4y2Ba
激素治疗和qPCR分析gydF4y2Ba
激素处理时,将8-14天大的幼苗从2.2 g/l Murashige和Skoog (MS)培养基、10%蔗糖、0.9%琼脂中取出,在2.2 g/l MS含激素的液体培养基或模拟(对照)培养基中孵育4 h。激素浓度为5 μM IAA(根据[gydF4y2Ba14gydF4y2Ba]), 1 μM Zeatin [gydF4y2Ba19gydF4y2Ba], 100 μM GA3, 100 μM ABA, 5 μM Brassinolide, 5 μM IAA + 5 μM Brassinolide。孵育后,将幼苗冷冻在液氮中,并在−80°C下储存,然后分离RNA。RNA使用CTAB/LiCl协议或InviTrap®Spin Plant RNA Mini试剂盒(Stratec Molecular)提取,DNase使用Ambion Turbo DNase (AM1907)处理,并使用iScript cDNA合成试剂盒(BioRad)逆转录。qPCR反应采用BioRad公司的iQ SybrGreen supermix在BioRad iCycler上进行。gydF4y2Ba
在硅分析中gydF4y2Ba
Motif搜索使用TAIR的大数据检索工具获得的3 kb上游启动子序列,基于TAIR10 (gydF4y2Bahttp://www.arabidopsis.org/tools/bulk/sequences/index.jspgydF4y2Ba).第I类(gydF4y2Ba阿富汗二月gydF4y2Ba生长素诱导)和第II类(gydF4y2Ba阿富汗二月gydF4y2Ba根据附加文件选择不受生长素调控的)基因gydF4y2Ba2gydF4y2Ba:表S1(见附加文件gydF4y2Ba2gydF4y2Ba:表S2)。除第一类和第二类外gydF4y2Ba阿富汗二月gydF4y2Ba,使用背景启动子集。这包括500个随机选择的拟南芥启动子序列(不包括gydF4y2Ba阿富汗二月gydF4y2Ba启动子)。gydF4y2Ba
MEME [gydF4y2Ba47gydF4y2Ba]在第一类集合、第二类集合和包含所有的集合中进行从头motif搜索gydF4y2Ba阿富汗二月gydF4y2Ba启动子序列。利用MEME包中的fasta-get-markov工具从随机选取的500个启动子序列中生成二阶马尔可夫模型背景。MEME设置包括-mod anr和-revcomp。最大motif数为20个,motif宽度为6 ~ 18个。TOMTOM [gydF4y2Ba48gydF4y2Ba]使用“完全评分”(将不匹配的部分考虑在内)应用于得到的MEME motif,并将MEME motif与JASPAR Core植物motif数据库进行比较[gydF4y2Ba49gydF4y2Ba],以及CIS-BPgydF4y2Ba拟南芥gydF4y2Ba数据库(gydF4y2Ba50gydF4y2Ba].gydF4y2Ba
除了de novo motif搜索之外,我们还从文献中获得了一组潜在相关的现有motif [gydF4y2Ba38gydF4y2Ba,gydF4y2Ba51gydF4y2Ba]和JASPAR数据库(BZR1, MA0549.1;(gydF4y2Bahttp://jaspar.genereg.netgydF4y2Ba).将这些数据转换为MAST格式,并使用MEME包中的MAST工具在序列数据集中获得motif命中。对共识模式的搜索使用ps_scan [gydF4y2Ba52gydF4y2Ba].为了检验不同序列集间基序出现差异的显著性,采用fisher精确检验。R的精确函数[gydF4y2Ba53gydF4y2Ba].gydF4y2Ba
缩写gydF4y2Ba
- 阿坝:gydF4y2Ba
-
脱落酸gydF4y2Ba
- 东盟地区论坛:gydF4y2Ba
-
生长素反应因子gydF4y2Ba
- AuxRE:gydF4y2Ba
-
生长素反应元件gydF4y2Ba
- BR:gydF4y2Ba
-
brassinosteroidsgydF4y2Ba
- BZR:gydF4y2Ba
-
BRASSINAZOLE-RESISTANTgydF4y2Ba
- DST:gydF4y2Ba
-
下游的元素gydF4y2Ba
- 遗传算法:gydF4y2Ba
-
赤霉酸gydF4y2Ba
- 国际宇航科学院:gydF4y2Ba
-
Indole-3-acetic酸gydF4y2Ba
- MEME:gydF4y2Ba
-
多重Em Motif ElicitationgydF4y2Ba
- 票面价值:gydF4y2Ba
-
光合作用的有效辐射gydF4y2Ba
- 论坛:gydF4y2Ba
-
光敏色素相互作用因子gydF4y2Ba
- 存在:gydF4y2Ba
-
实时定量聚合酶链反应gydF4y2Ba
- 情景应用程序:gydF4y2Ba
-
避阴综合症gydF4y2Ba
- 阿富汗二月:gydF4y2Ba
-
小生长素上调RNAgydF4y2Ba
- TF:gydF4y2Ba
-
转录因子gydF4y2Ba
参考文献gydF4y2Ba
杨晓东,张晓东,张晓东,等。一类可诱导的大豆聚腺苷酸小分子rna的研究。植物分子生物学,1987;9:611-23。gydF4y2Ba
Knauss S, Rohrmeier T, Lehle L.生长素诱导玉米基因ZmSAUR2编码一种在伸长组织中表达的短命核蛋白。中国生物化学杂志,2003;gydF4y2Ba
Bemer M, van Mourik H, Muiño JM, Ferrándiz C, Kaufmann K, Angenent GC。FRUITFULL控制SAUR10的表达,调控拟南芥的生长和结构。中国科学(d辑),2017;gydF4y2Ba
蔡凯,艾萨克斯CG,里夫斯PH,马洛尼GS,穆迪GK,纳格帕P,里德JW。拟南芥SMALL生长素UP RNA63促进下胚轴和雄蕊丝伸长。植物学报(英文版);gydF4y2Ba
Spartz AK, Lee SH, Wenger JP, Gonzalez N, Itoh H, Inzé D, Peer WA, Murphy AS, Overvoorde PJ, Gray WM。SMALL生长素UP RNA基因SAUR19亚家族促进细胞扩张。植物杂志:细胞和分子生物学。2012; 70:978 - 90。gydF4y2Ba
斯巴茨AK,洛VS, Ren H,奥尔舍夫斯基NE,米勒ND,吴g,斯伯丁EP,格雷WM。拟南芥SMALL生长素UP RNA19 (SAUR19)在番茄中的本构表达使下胚轴伸长与生长素无关。植物学报。2017;173:1453-62。gydF4y2Ba
拟南芥SMALL Auxin UP RNA36在光照下调节下胚轴伸长。植物细胞,2013;32:759-69。gydF4y2Ba
Ren H, Gray William M, protein SAUR。在植物生长中作为激素和环境信号的效应器。植物学报2015;8:1153-64。gydF4y2Ba
孙楠,王杰,高志,董健,何辉,Terzaghi W,魏楠,邓小文,陈宏,拟南芥SAUR。对不同器官发育的差异光调节至关重要。中国科学(自然科学版)2016;gydF4y2Ba
Spartz AK, Ren H, Park MY, Grandt KN, Lee SH, Murphy AS, Sussman MR, Overvoorde PJ, Gray WM, Inhibition SAUR。拟南芥中PP2C-D磷酸酶激活质膜H+- atp酶促进细胞扩张。《植物科学》2014;26:2129-42。gydF4y2Ba
杨晓明,杨晓明,张晓明,等。TIR1/AFB-aux/IAA生长素感知介导拟南芥下胚轴快速酸化和生长。elife。2016; 5: e19048。gydF4y2Ba
Paponov IA, Paponov M, Teale W, Menges M, Chakrabortee S, Murray JAH, Palme K.拟南芥生长素反应的综合转录组分析。植物学报。2008;1:21 - 37。gydF4y2Ba
Chapman EJ, Greenham K, Castillejo C, Sartor R, Bialy A, Sun T-p, Estelle M.下胚轴转录组揭示生长素通过ga依赖和非依赖途径调控生长促进基因。科学通报。2012;7:e36210。gydF4y2Ba
Bargmann BOR, Vanneste S, Krouk G, Nawy T, Efroni I, Shani E, Choe G, Friml J, Bergmann DC, Estelle M, Birnbaum KD。细胞类型特异性生长素反应图。Mol Syst bio . 2013;9 n/a-n/agydF4y2Ba
Nagpal P, Ellis CM, Weber H, Ploense SE, Barkawi LS, Guilfoyle TJ, Hagen G, Alonso JM, Cohen JD, Farmer EE,等。生长素反应因子ARF6和ARF8促进茉莉酸的产生和花的成熟。发展。2005;132:4107-18。gydF4y2Ba
Okushima Y, Overvoorde PJ, Arima K, Alonso JM, Chan A, Chang C, Ecker JR, Hughes B, Lui A, Nguyen D,等。拟南芥生长素反应因子基因家族成员的功能基因组分析:ARF7和ARF19的独特和重叠功能《植物科学》2005;17:444-63。gydF4y2Ba
Schlereth A, Moller B, Liu W, Kientz M, Flipse J, Rademacher EH, Schmid M, Jurgens G, Weijers D.单翅teros通过调节移动转录因子控制胚胎根启动。大自然。2010;464:913-6。gydF4y2Ba
Delker C, Pöschl Y, Raschke A, Ullrich K, Ettingshausen S, Hauptmann V, Grosse I, Quint M.拟南芥转录生长素反应网络的自然变异。《植物科学》2010;22(4):366 - 366。gydF4y2Ba
Goda H, Sawa S, Asami T, Fujioka S, Shimada Y, Yoshida S.拟南芥生长素调控和油菜素类固醇调控基因的综合比较。植物物理学报。2004;134:1555-73。gydF4y2Ba
Kodaira K-S, Qin F, Tran L-SP, Maruyama K, Kidokoro S, Fujita Y, Shinozaki K, Yamaguchi-Shinozaki K.拟南芥Cys2/His2锌指蛋白AZF1和AZF2在非生物胁迫条件下负调控脱落酸抑制和生长素诱导基因。植物学报。2011;157:742-56。gydF4y2Ba
Walcher CL, Nemhauser JL。生长素反应所需的二部启动子元件。植物科学学报,2012;gydF4y2Ba
吴娥,朱建勇,白明英,Arenhart RA,孙勇,王志勇。在拟南芥下胚轴中,细胞伸长是通过相互作用的转录因子的中央回路调节的。elife。2014; 3: e03031。gydF4y2Ba
李志刚,陈华文,李庆涛,陶建军,卞晓红,马波,张文凯,陈世勇,张建生。在拟南芥中,SAUR76、SAUR77和SAUR78三个SAUR蛋白促进植物生长。科学通报2015;5:12477。gydF4y2Ba
油菜素内酯信号与光敏色素抑制因子B4-#3聚合影响SMALL生长素UP RNA基因表达和下胚轴生长植物学报2017;89:1133-45。gydF4y2Ba
Atamian HS, Creux NM, Brown EA, Garner AG, Blackman BK, Harmer SL.向日葵向日性、花向和传粉者访问的昼夜调节。科学。2016;353:587 - 90。gydF4y2Ba
杨晓明,李志刚,李志强,等。油菜素内酯对拟南芥生长素信号通路的影响。公共科学图书馆。2004;2:e258。gydF4y2Ba
纽曼TC, Ohme-Takagi M,泰勒CB,格林PJ。DST序列在植物SAUR基因中高度保守,是烟草快速腐烂的靶报告转录本。《植物科学》1993;5:701-14。gydF4y2Ba
考夫曼K, Muiño JM, Jauregui R, Airoldi CA, Smaczniak C, Krajewski P, Angenent GC。MADS转录因子SEPALLATA3的靶基因:拟南芥花发育和激素通路的整合公共科学图书馆。2009;7:e1000090。gydF4y2Ba
Kaufmann K, Wellmer F, Muino JM, Ferrier T, Wuest SE, Kumar V, Serrano-Mislata A, Madueno F, Krajewski P, Meyerowitz EM. APETALA1花起始的编曲。科学。2010;328:85-9。gydF4y2Ba
Danisman S, van der Wal F, Dhondt S, Waites R, de Folter S, Bimbo A, van Dijk AD, Muino JM, Cutri L, Dornelas MC,等。拟南芥I类和II类TCP转录因子拮抗调控茉莉酸代谢和叶片发育。植物物理学报,2012;gydF4y2Ba
张涛,马建平,蒋娟。植物DNase I超敏位点数据库的建立。核酸研究,2016;44:D1148-53。gydF4y2Ba
Cecchetti V、Altamura MM、Falasca G、Costantino P、Cardarelli M.生长素调控拟南芥花药开裂、花粉成熟和花丝伸长。植物学报。2008;20:1760-74。gydF4y2Ba
叶青,朱伟,李玲,张松,尹勇,马红,王霞。油菜素类固醇通过调控拟南芥花药和花粉发育关键基因表达控制雄性育性。自然科学进展(英文版),2010;gydF4y2Ba
刘志刚,刘志刚,刘志刚。邻避阴影反应的生理调节及其功能意义。植物学报。2010;5:655 - 658。gydF4y2Ba
Keuskamp DH, Sasidharan R, Vos I, Peeters AJM, Voesenek LACJ, Pierik R.拟南芥幼苗对蓝光介导的避荫需要生长素和油菜素类固醇激素的联合作用。植物学报(英文版);2011;gydF4y2Ba
Pierik R, Djakovic-Petrovic T, Keuskamp DH, de Wit M, Voesenek LACJ。在拟南芥中,生长素和乙烯调节邻近邻近信号的伸长反应,而不依赖于赤霉素和DELLA蛋白。植物科学与工程学报。2009;29(2):344 - 344。gydF4y2Ba
吴国强,李国强,李国强。生长素反应因子的二聚和DNA结合。植物学报1999;19:309-19。gydF4y2Ba
Boer DR, Freire-Rios A, van den Berg Willy AM, Saaki T, Manfield Iain W, Kepinski S, López-Vidrieo I, Franco-Zorrilla Jose M, de Vries Sacco C, Solano R,等。生长素依赖性ARF转录因子DNA结合特异性的结构基础。细胞。2014;156:577 - 89。gydF4y2Ba
Hornitschek P, Lorrain S, Zoete V, Michielin O, Fankhauser C.通过形成非dna结合的bHLH异二聚体抑制遮阴反应。杨晓明,2009;gydF4y2Ba
Hornitschek P, Kohnen MV, Lorrain S, Rougemont J, Ljung K, López-Vidriero I, Franco-Zorrilla JM, Solano R, Trevisan M, Pradervand S,等。光敏色素相互作用因子4和5通过直接控制生长素信号通路控制幼苗在光照条件变化下的生长。植物学报,2012;gydF4y2Ba
Bemer M, van Dijk ADJ, Immink RGH, Angenent GC。跨家族转录因子相互作用:基因调控的另一层。植物科学进展,2017;22:66-80。gydF4y2Ba
Belhaj K, Chaparro-Garcia A, Kamoun S, Patron N, Nekrasov V.利用CRISPR/Cas9编辑植物基因组。生物技术,2015;32:76-84。gydF4y2Ba
Alonso JM, Stepanova AN, Leisse TJ, Kim CJ, Chen H, Shinn P, Stevenson DK, Zimmerman J, Barajas P, Cheuk R,等。全基因组插入突变gydF4y2Ba拟南芥gydF4y2Ba.科学。2003;301:653-7。gydF4y2Ba
蒂西尔AF, Marillonnet S, Klimyuk V, Patel K, Torres MA, Murphy G, Jones JDG。拟南芥中多重独立缺陷的抑制突变转座子插入:功能基因组学的工具。植物细胞,1999;11:1841-52。gydF4y2Ba
Samson F, Brunaud V, Balzergue S, Dubreucq B, Lepiniec L, Pelletier G, Caboche M, Lecharny a . FLAGdb/FST:拟南芥T-DNA转化子的侧面插入位点(FSTs)映射数据库。核酸Res. 2002; 30:94-7。gydF4y2Ba
杨晓明,杨晓明,杨晓明,等。农杆菌介导植物转化的研究进展。植物科学进展,2002;7:193-5。gydF4y2Ba
贝利,TL, Elkan C.通过期望最大化拟合混合物模型以发现生物聚合物中的基序。过程Int Conf智能系统Mol生物学1994:28-36。gydF4y2Ba
Bailey TL, Boden M, Buske FA, Frith M, Grant CE, Clementi L, Ren J, Li WW, Noble WS。MEME套件:motif发现和搜索的工具。核酸研究,2009;37:W202-8。gydF4y2Ba
Mathelier A, Fornes O, Arenillas DJ, Chen C-y, Denay G, Lee J, Shi W, Shyr C, Tan G, Worsley-Hunt R,等。JASPAR 2016:转录因子结合谱开放获取数据库的一次重大扩展和更新。核酸研究,2016;44:D110-5。gydF4y2Ba
Weirauch MT, Yang A, Albu M, Cote A,黑山-蒙特罗A, Drewe P, Najafabadi HS, Lambert SA, Mann I, Cook K,等。真核转录因子序列特异性的测定与推断。细胞。2014;158:1431-43。gydF4y2Ba
李国强,李国强,李国强。Aux/IAA蛋白抑制含有天然和高活性合成生长素反应元件的报告基因的表达。植物细胞,1997;9:1963-71。gydF4y2Ba
Gattiker A, Gasteiger E, Bairoch A. ScanProsite: PROSITE扫描工具的参考实现。生物工程学报。2002;1:107-8。gydF4y2Ba
R:一种用于统计计算的语言和环境。R统计计算基础2014:URLgydF4y2Bahttp://www.R-project.org/gydF4y2Ba.gydF4y2Ba
确认gydF4y2Ba
不适用。gydF4y2Ba
资金gydF4y2Ba
MB由荷兰科学研究组织(NWO)的NWO veni赠款支持。HvM由NWO Vidi-grant支持,授予Kerstin Kaufmann。资助机构没有参与研究的设计,也没有参与数据的收集、分析和解释或手稿的撰写。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
支持本文结论的所有数据集都包含在本文(及其附加文件)中。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
MB和GCA监督该项目;HvM和MB进行实验;NS和ADJvD进行了硅内分析。MB撰写手稿,GCA、ADJvD和NS投稿;并且,所有作者都编辑并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们之间没有利益冲突。gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
附加文件gydF4y2Ba
附加文件1:图S1。gydF4y2Ba
拟南芥SAUR蛋白的UPGMA树。(PDF 146kb)gydF4y2Ba
附加文件2:表S1。gydF4y2Ba
已发表的显示拟南芥个体反应的数据概述gydF4y2Ba阿富汗二月gydF4y2Ba生长素和BR。gydF4y2Ba表S2。gydF4y2Ba类的gydF4y2Ba阿富汗二月gydF4y2Ba附加文件2:表S1。gydF4y2Ba表S3。gydF4y2Ba引物序列。(xlsx38kb)gydF4y2Ba
附加文件3:图S2。gydF4y2Ba
T-DNA插入线分析。(PDF 209kb)gydF4y2Ba
附加文件4:图S3。gydF4y2Ba
的表达模式gydF4y2BapSAUR:格斯gydF4y2Ba行。(PDF 869kb)gydF4y2Ba
附加文件5:图S4。gydF4y2Ba
IAA/BR诱导动力学(PDF 132kb)gydF4y2Ba
附加文件6:图S5。gydF4y2Ba
的反应gydF4y2BaSAUR10gydF4y2Ba-分枝基因对GA应用。(PDF 196kb)gydF4y2Ba
附加文件7:图S6。gydF4y2Ba
经IAA-BR处理后,GUS的表达位置没有改变。(PDF 373 kb)gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文根据创作共用属性4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)除另有说明外,适用于本条所提供的资料。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
范·穆里克,H.,范·戴克,a.d.j.,斯托滕贝克,N.。gydF4y2Baet al。gydF4y2Ba拟南芥的分化调控gydF4y2Ba阿富汗二月gydF4y2Ba基因:一个重点gydF4y2BaSAUR10gydF4y2Ba进化枝。gydF4y2BaBMC植物生物学gydF4y2Ba17日,gydF4y2Ba245(2017)。https://doi.org/10.1186/s12870-017-1210-4gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-017-1210-4gydF4y2Ba
关键字gydF4y2Ba
- 阿富汗二月gydF4y2Ba
- 激素gydF4y2Ba
- 增长gydF4y2Ba
- 细胞伸长gydF4y2Ba
- 监管区域gydF4y2Ba
- 生长素gydF4y2Ba
- BrassinosteroidsgydF4y2Ba
- 阿坝gydF4y2Ba
- 树荫下反应gydF4y2Ba