- 方法论的文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
可变角度荧光显微镜表征植物细胞质膜附近的蛋白质动态gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba18gydF4y2Ba,文章号:gydF4y2Ba43gydF4y2Ba(gydF4y2Ba2018gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
蛋白质复合物的组装和组成脂质模式共同作用,赋予细胞所需的可塑性,以维持相对于单个蛋白质的组成异质性。因此,蛋白质定位和动态成像的应用要求较高的精度,特别是在高时空水平上。gydF4y2Ba
结果gydF4y2Ba
本文为变角度荧光显微镜(VAEM)在植物细胞蛋白质动力学分析中的应用提供了实验数据。基于veem的共定位分析考虑了侵彻深度和入射角。除了双色荧光信号的直接重叠外,还结合点状距离和蛋白质接近指数的计算方法进行定量共定位分析。此外,同时对细胞骨架动力学的VAEM跟踪,为肌动蛋白丝和微管的协调反应提供了更多的见解。此外,通过计算扩散系数和kymograph分析膜蛋白的横向运动性,这是检测蛋白质运动性的另一种方法。gydF4y2Ba
结论gydF4y2Ba
本研究提供了利用VAEM跟踪和解剖完整植物细胞蛋白质动力学、解剖内体动力学、细胞结构组装、膜微结构域和蛋白质动力学的实验证据。gydF4y2Ba
背景gydF4y2Ba
与其他细胞膜一样,质膜(PMs)是一种高度组织的结构,在不同的功能域上划分为亚区,它们包含一组复杂的蛋白质和脂类,对细胞形态发生和模式形成至关重要[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba].PM提供了一种大分子有效相互作用的环境,包括通过蛋白质-蛋白质或蛋白质-脂质相互作用将蛋白质聚集在低聚物复合体中,蛋白质复合体的对接和锚定用于调节反应和其他精确编排的过程[gydF4y2Ba1gydF4y2Ba].此外,信号感知与细胞骨架结构和细胞内第二信使的耦合也必然涉及穿过PM的转导。因此,利用最先进的技术,对PM附近潜在细胞事件进行功能解剖是当务之急。gydF4y2Ba
全内反射荧光(TIRF),也称为倏逝波荧光,利用倏逝波选择性地激发玻璃/样品界面和附近的荧光团(100-200 nm) [gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba].作为全内反射(TIR)的结果,倏逝波形成并立即在细胞表面下传播,仅激发倏逝场范围内的荧光团。相比之下,在这个范围之外的荧光粒子仍未被激发,这使得这项技术特别适合于解剖PM附近的分子和细胞事件[gydF4y2Ba4gydF4y2Ba].TIRF已有效用于动物细胞中蛋白质动态成像,如表皮生长因子动态[gydF4y2Ba5gydF4y2Ba],细胞骨架动力学[gydF4y2Ba6gydF4y2Ba]和离子通道活性[gydF4y2Ba7gydF4y2Ba].然而,这取决于样品的能力,以坚持覆盖,并保持在由幻灭场定义的成像区域。gydF4y2Ba
然而,在植物中,植物细胞壁对这些事件的实时动态跟踪具有较高的时空精度,这严重阻碍了植物细胞研究的努力。我们感兴趣的一些目标,如各种植物和真菌的细胞,要么不能很好地粘附在覆盖层上,要么有很厚的壁,倏灭场不能很好地穿透[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba],这使得TIFM在植物和真菌细胞中的应用更加复杂。然而,TIRF显微镜的穿透深度取决于照明的入射角,从而产生了一个可用深度范围[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba].变角度荧光显微镜(VAEM)允许激光束以小于临界角度的亚临界角度穿透细胞壁[gydF4y2Ba10gydF4y2Ba].当光束以一个陡峭的角度折射时,就会产生倾斜的光“片”。这种技术还产生了比epifluorescence照明对比度更高的图像。无一例外,所有使用TIRF、VAEM或高倾斜叠层光学薄片(HiLo)显微镜对植物细胞进行的单分子研究[gydF4y2Ba11gydF4y2Ba都是基于这一原则进行的。gydF4y2Ba
在这里,我们提出了实验证据,显示了VAEM在跟踪蛋白质动力学中涉及的细胞器动力学、细胞骨架结构组装、膜微域组织和蛋白质动力学的应用广度。这些应用跨越了整个植物科学界,除了揭示与PM相关的过程的潜在机制外,它们无疑将激发新的研究方向。gydF4y2Ba
方法gydF4y2Ba
pABP1:ABP1-YFP二元表达载体的构建gydF4y2Ba
用引物5’- caccaatcttcattctttacctgcac -3’和5’- AAGCTCGTCTTTTTGTGATTCTTG-3’从基因组DNA样本中扩增出AT4G02980基因组片段和1500-bp的上游序列,亚克隆到pENTR/SD/D-TOPO载体(Invitrogen)中,然后通过LR重组反应亚克隆到目的载体pMDC107中。gydF4y2Ba拟南芥gydF4y2Ba用荧光标记的ABP1构建物对生态型哥伦比亚野生型植物进行转化gydF4y2Ba根癌土壤杆菌gydF4y2Ba-介导的花浸法[gydF4y2Ba12gydF4y2Ba].抗卡那霉素转基因植株在含50 μg/mL卡那霉素的固体培养基(1%琼脂)、1/2 MS培养基上培养[gydF4y2Ba13gydF4y2Ba].35S:FLOT1a-GFP用mCherry替换GFP构造[gydF4y2Ba14gydF4y2Ba].gydF4y2Ba
植物材料和生长条件gydF4y2Ba
拟南芥幼苗如前所述[gydF4y2Ba15gydF4y2Ba].35S:FLOT1a-GFP转化拟南芥[gydF4y2Ba14gydF4y2Ba], pCLC:CLC-GFP [gydF4y2Ba16gydF4y2Ba], 35S:LTi6a-GFP [gydF4y2Ba17gydF4y2Ba], 35S:GFP-fABD2及35S:mCherry-TUA5 [gydF4y2Ba18gydF4y2Ba], 35s: bor1-gfp [gydF4y2Ba19gydF4y2Ba), pSKU5: SKU5-GFP /gydF4y2Basku5gydF4y2Ba[gydF4y2Ba20.gydF4y2Ba], 35S:StREM-GFP [gydF4y2Ba21gydF4y2Ba], 35s:眼镜蛇- gfp [gydF4y2Ba22gydF4y2Ba], 3s:AtREM1.2-YFP [gydF4y2Ba23gydF4y2Ba], pREM1.2:AtREM1.2-YFP [gydF4y2Ba24gydF4y2Ba已经被描述过了。通过交叉授粉获得表达GFP、mCherry和YFP融合蛋白组合的转基因植株,并使用F1或F2代进行显微观察。种子用70%乙醇、0.1% Triton X-100 / 95%乙醇消毒,并在半强度Murashige和Skoog培养基(1/2 MS) + 1%琼脂上接种,分层2 - 3天,在22±2℃、7000-10,000 lx照度下垂直生长16小时/天。gydF4y2Ba
激光扫描共聚焦显微镜(LSCM)gydF4y2Ba
拟南芥幼苗采用Olympus FV1000 MPE多光子激光扫描共聚焦显微镜(60×水浸物镜;数值孔径,1.35)。用488 nm激光激发GFP和FM4-64。荧光发射光谱用560LP二向色镜分离。在495 ~ 540 nm范围内收集到GFP荧光,在570 ~ 650 nm范围内收集到FM4-64的荧光。mRFP和mCherry用543 nm激光成像,mRFP的发射荧光在580 ~ 620 nm范围内,mCherry的发射荧光在600 ~ 650 nm范围内。使用WCIF ImageJ强度相关分析插件(gydF4y2Bahttp://wwwfacilities.uhnresearch.ca/wcif/imagejgydF4y2Ba) [gydF4y2Ba25gydF4y2Ba].获得的图像使用Adobe Photoshop, version 7进一步处理。gydF4y2Ba
变角度荧光显微术gydF4y2Ba
将4 ~ 5天大的拟南芥幼苗安装在配备Andor TIRF光源的倒置Olympus IX71显微镜下观察。样品制备时,将幼苗浸泡在1/2 MS的载玻片上(BRAND Gmbh, Wertheim,德国;gydF4y2BangydF4y2Ba, 1.52±0.01;厚度,0.13-0.17 mm)。另一个覆盖玻璃被放置在样品上,这个三明治被轻轻地压紧,使幼苗紧紧地附着在玻璃表面。位于物镜上游的Andor附件由一组可调反射镜组成,控制激光进入100 ×油浸TIRF物镜的路径(Olympus;数值孔径= 1.45)。利用二极管激光器(长春新工业光电科技有限公司)的473−/561 nm激光线分别激发GFP和mCherry荧光团。物镜收集荧光信号,并通过两个滤波器,BA 510IF长通滤波器(Chroma)和HQ525/50带通滤波器(Chroma),然后使用背光EMCCD摄像机(ANDOR iXon DV8897D-CS0-VP, ANDOR Technology)和高质量滤波器(带通525/545和609/654 nm)进行引导。在所有成像实验中,除非另有说明,我们将EMCCD相机的em增益设置为433。图像曝光时间为100ms(除非另有说明),使用Image J软件(NIH)进行分析。根据Wan等人报道的方法调整和校准入射角[gydF4y2Ba10gydF4y2Ba],在实验过程中,详细内容也包含在附加文件中gydF4y2Ba1gydF4y2Ba.使用WCIF ImageJ强度相关分析插件(gydF4y2Bahttp://www.facilities.uhnresearch.ca/wcif/imagej/colour_analysis.htmgydF4y2Ba) [gydF4y2Ba25gydF4y2Ba].gydF4y2Ba
通过偏度分析得到捆扎程度,以每张显微照片中GFP-fABD2信号的占比计算丝密度[gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba].显微照片用ImageJ (gydF4y2Bahttp://rsb.info.nih.gov/ij/gydF4y2Ba)使用Higaki的宏,可在[gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba].gydF4y2Ba
抑制剂的药理研究gydF4y2Ba
TyrA23和isobaxen购自Sigma-Aldrich。将抑制剂溶解在100% DMSO中作为原液,并在1/ 2ms中进一步稀释,用于表皮细胞的VAEM成像。DMSO在所有工作溶液中的最终浓度均为0.1%或更低。将4 ~ 5 d龄垂直生长的幼苗从1%琼脂板转移到12孔板的孔中,12孔板中最终工作浓度为4 mL, 1/2 ms。待培养时间结束后,将幼苗转移到含有100 μL抑制剂溶液的载玻片上,盖上玻璃盖,进行如上成像。gydF4y2Ba
单粒子跟踪和数据分析gydF4y2Ba
单粒子跟踪采用空间和时间全局粒子赋值,使用MATLAB完成,详见[gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba],只保留长度超过十帧的轨迹作进一步分析。对于每条轨迹,均方位移(MSD)由公式计算:gydF4y2Ba
在哪里gydF4y2BangydF4y2Ba=gydF4y2BatgydF4y2Ba/gydF4y2Ba△gydF4y2BatgydF4y2Ba, L为轨迹长度(帧数)gydF4y2BargydF4y2Ba(gydF4y2Ba年代gydF4y2Ba)为粒子在坐标系中的二维位置gydF4y2Ba年代gydF4y2Ba(gydF4y2Ba年代gydF4y2Ba= 0对应轨迹的起点)[gydF4y2Ba30.gydF4y2Ba].为了从弹道中确定扩散系数,用一条直线拟合MSDgydF4y2BangydF4y2Ba从1到小于等于的最大整数gydF4y2BalgydF4y2Ba/ 4 (gydF4y2Ba31gydF4y2Ba].粒子的扩散系数通过线性拟合(MSD = 4Dt + c)计算MSD随时间的变化(MSD-t),扩散系数的分布被绘制成带有对数间隔箱的直方图。对采集到的数据进行高斯拟合,峰值的位置作为各总体的特征扩散系数。根据蛋白质接近指数法定量CLC和AtFLOT1a的共定位[gydF4y2Ba29gydF4y2Ba,gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba].gydF4y2Ba
荧光相关光谱(FCS)gydF4y2Ba
FCS分析在徕卡TCS SP5 FCS显微镜上进行,配有488 nm氩激光、内部耦合相关器和雪崩光电二极管,采用点扫描模式。激光聚焦在细胞的质膜上,记录SKU-GFP分子在焦点体积内扩散和扩散过程中荧光强度的波动。然后,按照前面描述的程序计算SKU5-GFP密度[gydF4y2Ba4gydF4y2Ba].gydF4y2Ba
结果gydF4y2Ba
VAEM是解剖细胞器特性和动力学的理想工具gydF4y2Ba
由于PM和细胞内隔室组成了一个功能相关的网络,我们热衷于研究VAEM在跟踪内膜成分动态方面的稳健性。为此,我们研究了生长素结合蛋白1 (ABP1)。ABP1最初被认为具有结合生长素和影响PM超极化的能力,但其功能仍存在争议[gydF4y2Ba34gydF4y2Ba].为了获得研究ABP1亚细胞定位的实验线索,我们在其天然启动子控制下生成了ABP1- yfp转基因株系,并分别在LSCM和VAEM下检测了ABP1在子叶中的定位。根据先前的报道,在LSCM下可见,ABP1主要定位于PM和高度动态的细胞内结构(图2)。gydF4y2Ba1gydF4y2Ba).不幸的是,在LSCM下不容易辨别用荧光标记的细胞内结构,但在VAEM下,很明显它们与内质网(ER)和一些可移动的细胞内隔室有关。由于天然启动子下的表达水平较低,用宽视场epifluorescence获得的图像不能清楚地区分有或没有荧光的区域(图。gydF4y2Ba1 bgydF4y2Ba).相比之下,我们很高兴地发现ABP1-YFP荧光定义的细胞内区室与mCherry-HDEL标记的ER在时间序列中具有良好的相关性,它们部分与高尔基体共定位(n -乙酰氨基葡萄糖酰(NAG)转移酶mcherry),但与线粒体标记(mcherry -ssβ atp酶)不一致(图2)。gydF4y2Ba1 cgydF4y2Ba-gydF4y2BadgydF4y2Ba).值得注意的是,在内质网附近可以观察到一些明亮的点状结构,可能是囊泡或其他内体结构,或沿着延伸的内质网小管运输(图。gydF4y2Ba1 dgydF4y2Ba),进一步暗示了这些abp1标记的结构在er -核内体关联中的重要作用。在时间序列中还发现点状结构与高尔基体共扩散(图2)。gydF4y2Ba1 egydF4y2Ba),进一步表明ABP1参与了胞内体转运和胞内/胞外活动。如图所示。gydF4y2Ba1gydF4y2Ba在VAEM下,低背景荧光使我们能够在高时间分辨率(200 ms)下轻松跟踪用荧光蛋白表征的子叶表皮细胞的ER动态,这是用传统的LSCM无法实现的。类似地,其他功能相关的细胞器显示高移动性,即高尔基体和线粒体,也可见NAG转移酶gfp和mcherry -ssβ atp酶转基因系(附加文件)gydF4y2Ba2gydF4y2Ba:图S1,附加文件gydF4y2Ba3.gydF4y2Ba而且gydF4y2Ba4gydF4y2Ba) [gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba].gydF4y2Ba
以生长素结合蛋白1 (ABP1)为例,双色VAEM荧光与细胞器标记共定位是解剖细胞皮层蛋白质定位和动态的理想方法。利用MATLAB进行时空全局粒子赋值,对VAEM图像中的点状结构进行跟踪。HDEL-GFP幼苗的入射角在63.03°~ 66.64°之间,穿透深度分别为120 nm(66.64°)~ 250 ~ 300 nm(63.03°),具体取决于幼苗的粘附情况。gydF4y2Ba一个gydF4y2Ba表达ABP1:ABP1-YFP的转基因拟南芥(ABP1:ABP1-YFP / Col-0)显示亚细胞定位于质膜和胞内结构,圆圈表示YFP荧光标记的点状结构;gydF4y2BabgydF4y2Ba表达ABP1的转基因拟南芥:ABP1- yfp荧光模糊,在进口处显示相应的亮场图像;gydF4y2BacgydF4y2Ba转基因拟南芥ABP1:ABP1- yfp在VAEM下呈均匀ER和点状分布;gydF4y2BadgydF4y2Ba点状结构部分共定位于高尔基体,但不共定位于线粒体;gydF4y2BaegydF4y2Ba一些ABP1-YFP标记的点状结构经常与高尔基体共扩散。每4张图像显示时间序列。Bars = 200 μm (gydF4y2Ba一个gydF4y2Ba), 7 μm (gydF4y2BabgydF4y2Ba-gydF4y2BadgydF4y2Ba), 5 μm (gydF4y2BaegydF4y2Ba).帧之间的间隔= 200毫秒gydF4y2Ba
除了子叶表皮细胞的成像外,VAEM也适用于其他组织的表皮细胞。我们进一步利用转基因HDEL-GFP株系分别对下胚轴表皮细胞、根表皮细胞、莲座丛幼叶和气孔中的ER动态进行了跟踪研究,进一步证明了VAEM在植物细胞研究中的广泛适用性。同样,下胚轴表皮细胞由于其相对较大的尺寸和平面形状很容易成像(附加文件)gydF4y2Ba2gydF4y2Ba:图S2)。内质网小管在根中密度较低。然而,由于部分小管不在成像平面内,叶铺装细胞的可变和非平面形状只能让我们在这些细胞中紧密粘附载玻片的有限区域观察ER动态(附加文件)gydF4y2Ba2gydF4y2Ba:图S1和附加文件gydF4y2Ba5gydF4y2Ba).由于细胞壁和较大尺寸的标本在观察植物细胞时不可避免地会形成物理障碍,因此为了能更好地将标本粘附在载玻片上,总是选择新鲜脱落的组织,这尤其适用于子叶和幼叶的观察。gydF4y2Ba
内吞事件和细胞内运输可以在VAEM下进行gydF4y2Ba
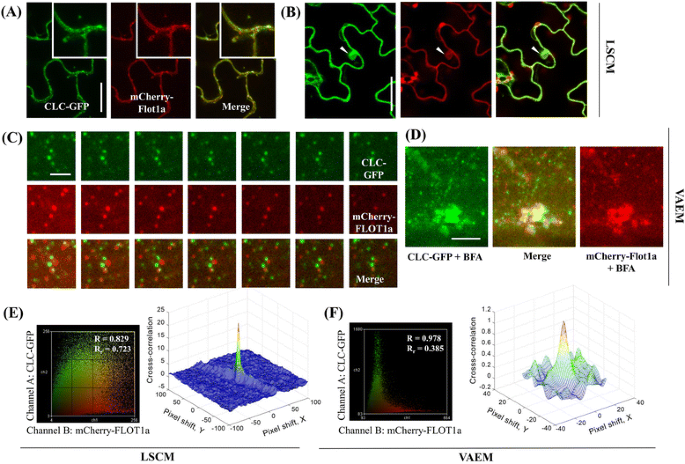
考虑到内吞囊泡作为最小的单位,在连接不同的内吞体成分中起着关键作用,网格蛋白在细胞外物质内化中的作用已经得到了很好的研究,因为它在PM组装并启动内吞事件[gydF4y2Ba37gydF4y2Ba].在本研究中,TIRF系统配备了一个千分尺,允许空间滤波器组件的连续横向调整,这样物镜后孔径处的光束位置可以被调制,以在TIRF和epifluorescence模式之间切换。在表观荧光照射下,只发现模糊的荧光与PM有关,而在VAEM下,网格蛋白轻链(CLC)-GFP在PM处形成离散的病灶或被组织成小簇,有助于在该部位形成内吞复合体(图。gydF4y2Ba2gydF4y2Ba和附加文件gydF4y2Ba2gydF4y2Ba:图S3)。在PM处的CLC-GFP焦点可以很容易地区分,尽管CLC-GFP也可以标记一些更明亮的、焦外的细胞内结构,对应于不同的入射角和穿透深度[范围约为100 nm(67.73°)和130 nm(65.69°)](补充文件)gydF4y2Ba2gydF4y2Ba:图S3和附加文件gydF4y2Ba1gydF4y2Ba,箭头所示),可能是高尔基体或跨高尔基网络(TGN)。当激光入射角从亚临界角减小到零度时,在细胞器定位CLC-GFP信号和细胞质CLC-GFP信号产生的背景信号中焦点丢失。类似地,AtFLOTTILIN1a (FLOT1a)被认为是独立于网格蛋白介导途径的内吞活动的另一个候选者[gydF4y2Ba14gydF4y2Ba].因为之前有报道称它是一种潜在的筏定位蛋白[gydF4y2Ba14gydF4y2Ba],也在VAEM下检测了FLOT1a的动力学。正如预期的那样,mCherry-FLOT1a被发现与PM显著相关,并被组织成点状结构。flot1a阳性的点状结构在PM附近是动态的,但与CLC-GFP线中观察到的点状结构相反,一些点状结构是横向移动的(图。gydF4y2Ba2摄氏度gydF4y2Ba和附加文件gydF4y2Ba6gydF4y2Ba),可能是个体结构从PM萌发并进入细胞质。在BFA存在的情况下,一种能够抑制高尔基体COPI囊泡形成的特定药理学制剂[gydF4y2Ba38gydF4y2Ba], CLC-GFP和mCherry-FLOT1a在形成过程中主要集中在bfa诱导的腔室中,而细胞质中仍有一些明显相关的绿色和红色斑点(图。gydF4y2Ba二维gydF4y2Ba).gydF4y2Ba
VAEM允许在单颗粒水平上对候选蛋白质进行可靠的共定位分析。gydF4y2Ba一个gydF4y2Ba网格蛋白轻链(CLC -GFP)和mCherry-FLOT1a在LSCM下均定位于PM和细胞内点状结构;近距离入口显示CLC-GFP和mCherry-FLOT1a共定位于PM和细胞内结构;gydF4y2BabgydF4y2BaBFA处理诱导CLC-GFP和mCherry-FLOT1a聚集到BFA区室中,表明网格蛋白和FLOT1a都参与了活跃的内吞事件;gydF4y2BacgydF4y2Ba共表达CLC-GFP和mCherry-FLOT1a的转基因拟南芥,其特征定位为大量分离的点状结构;gydF4y2BadgydF4y2Babfa诱导房室形成的VAEM观察。gydF4y2BaegydF4y2Ba利用ImageJ强度相关分析插件和蛋白质接近指数(PPI)对LSCM图像进行共定位分析(gydF4y2Ba一个gydF4y2Ba)表明网格蛋白和FLOT1a共定位的比例很高;gydF4y2BafgydF4y2Ba利用ImageJ强度相关分析插件和PPI分析对VAEM图像进行共定位分析(gydF4y2BacgydF4y2Ba)表明网格蛋白和FLOT1a是相关的,而不是共定位的。Bars = 20 μm (gydF4y2Ba一个gydF4y2Ba-gydF4y2BabgydF4y2Ba), 3 μm (gydF4y2BacgydF4y2Ba-gydF4y2BadgydF4y2Ba);帧之间的间隔= 200毫秒gydF4y2Ba
由于CLC-GFP和mCherry-FLOT1a都对brefeldin A (BFA)处理敏感(图。gydF4y2Ba2 a - bgydF4y2Ba),我们很好奇clc涂层的囊泡和flot1a标记的囊泡在内化后是否共定位。因此,我们采用基于荧光的共定位分析来研究这两种蛋白在特定细胞位置上的功能相关性。我们共表达了CLC-GFP和mCherry-FLOT1a,然后分别使用LSCM图像和VAEM时间序列图像分析了它们的空间相关性。FLOT1a和CLC都被报道为膜相关蛋白,如图所示。gydF4y2Ba2gydF4y2Ba, CLC-GFP和mCherry-FLOT1a均被发现定位于PM和一些细胞内结构。进一步的近距离LSCM观察表明,CLC-GFP和mCherry-FLOT1a点位是共定位或紧密相关的,与高重叠系数R相关gydF4y2BargydF4y2Ba= 0.723,如散点图所示(图;gydF4y2Ba2gydF4y2Ba然而,与LSCM的发现相反,VAEM时间序列显示,事实上大多数CLC-GFP和mCherry-FLOT1a点并没有共定位(图5)。gydF4y2Ba2摄氏度gydF4y2Ba).因此,重叠系数RgydF4y2BargydF4y2Ba由时间序列图像计算得到的为0.385(图;gydF4y2Ba2 fgydF4y2Ba(本研究中为10个连续帧),表明这两种候选蛋白的共定位比例较低,进一步表明VAEM时间序列可以提供更可靠的细胞内结构共定位分析。作为共定位的定量测量,强调共定位发生在显微镜分辨率的长度尺度上[gydF4y2Ba33gydF4y2Ba],并计算蛋白质接近指数(Protein Proximity Index, PPI)进行比较,如3D相互相关图所示(图2)。gydF4y2Ba2 egydF4y2Ba和f), [VAEM的PPI = 0.25±0.05 (GFP通道)和0.41±0.06 (mCherry通道),LSCM的PPI = 0.53±0.17 (GFP通道)和0.72±0.22 (mCherry通道)]。此外,转基因gydF4y2Ba拟南芥gydF4y2Ba交叉生成的共表达CLC-GFP / mCherry-FLOT1a、GFP-FLOT1a / mCherry-FLOT1a和CLC-GFP /动力蛋白相关蛋白1C (DRP1C)-mOrange的细胞株,分别进行VAEM观察,然后进行单粒子跟踪(SPT),计算捕获的双色标记点状结构之间的距离(图2)。gydF4y2Ba3gydF4y2Ba).在对照组(GFP- flot1a和mCherry-FLOT1a)中,约50%的GFP信号被归类为共定位,超过40%的GFP信号被归类为相关。在检测的候选蛋白中,CLC被发现与DRP1C共定位(约30%)或密切相关(50%),这与它们在囊泡形成和内化方面的协同作用一致;此外,大约80%的clc阳性点被分类为与mCherry-FLOT1a相关,而分别只有8%或12%的GFP信号与mCherry-FLOT1a点共定位或独立于mCherry-FLOT1a点,进一步证实了基于vem的SPT用于推定相关蛋白的共定位分析的适用性(图。gydF4y2Ba3 bgydF4y2Ba-gydF4y2BacgydF4y2Ba).gydF4y2Ba
利用基于vem的单粒子跟踪对感兴趣蛋白质进行共定位分析。gydF4y2Ba一个gydF4y2Ba对共表达CLC-GFP / DRP1C-mOrange、GFP-FLOT1a / mCherry-FLOT1a和CLC-GFP / mCherry-FLOT1a转基因拟南芥进行VAEM单粒子跟踪,并计算捕获的双色标记的点状结构之间的距离。gydF4y2BabgydF4y2Ba我们将得到的距离分为三类:(i)共焦:两个中心之间的距离低于物镜的分辨率限制(本研究为0.24 μm);(ii)相关:小于两个点状结构半径之和的距离(本研究< 0.96 μm);(iii)独立:大于两个点状结构半径之和的距离(> 0.96 μm)。D为两个相邻点的中心点之间的距离,用于分析。gydF4y2BacgydF4y2Ba候选蛋白的共定位、相关和独立点状蛋白的百分比gydF4y2Ba
细胞骨架动力学中协调行为的VAEM观察gydF4y2Ba
幸运的是,使用亚临界角度的VAEM成像也允许跟踪带有gfp标记的Fimbrin2的F-Actin结合域(GFP-fABD2)的皮质肌动蛋白丝(AFs)(图2)。gydF4y2Ba4gydF4y2Ba,附加文件gydF4y2Ba2gydF4y2Ba:图S4和附加文件gydF4y2Ba7gydF4y2Ba).如附加文件所示gydF4y2Ba2gydF4y2Ba:图S4,下胚轴延长的表皮细胞中可见广泛的纵向肌动蛋白束阵列和动态的AFs网络。几根细丝迅速地捆绑成单丝,但也有单独的细丝参与了多个细丝的创建,所有这些都利用了相同的拉链状运动(由箭头指示)。为了跟踪表皮细胞微管(MTs)的动态,我们还对表达mCherry-α-tubulin 5亚型(TUA5)的植物表皮下胚轴细胞进行了成像。MTs在亚临界角度下清晰可见,显示了之前描述的野生型苗的所有典型配置:篮子、纵向、斜向和横向阵列(附加文件)gydF4y2Ba2gydF4y2Ba:图S5)。在mcherry - tua5表达细胞的延时图像中(附加文件gydF4y2Ba8gydF4y2Ba),虽然微管生长明显,但在200 Ms的时间分辨率下,微管没有表现出明显的组装和拆卸事件。gydF4y2Ba
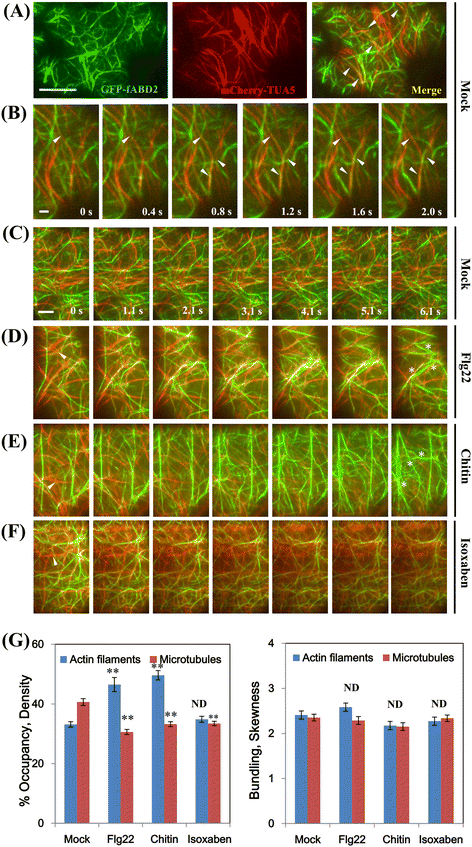
双色VAEM显示,PAMP显著改变了细胞骨架结构和动力学。为了研究这两种细胞骨架结构是否协调地相互作用,通过杂交生成了表达绿色荧光蛋白(GFP)-F-actin结合域fimbrin2 (fABD2)和mCherry-α-tubulin 5亚型(TUA5)的幼苗。分别对幼苗进行LSCM和VAEM。gydF4y2Ba一个gydF4y2Ba来自野生型细胞的模拟处理表皮细胞中的AFs和MTs,箭头表示肌动蛋白片段与MTs暂时重合;gydF4y2BabgydF4y2Ba从GFP-fABD2和mCherry-TUA5双标记线的时间序列中选取帧;gydF4y2BacgydF4y2Ba野生型表皮细胞中的AFs和MTs。gydF4y2BadgydF4y2Ba来gydF4y2BaegydF4y2Baflg22和几丁质处理后AFs含量增加,横向MT组织逐渐转变为纵向碎片。1 μM flg22和10 μM甲壳素处理的表皮细胞与模拟处理相比,AF丰度显著增加。gydF4y2BafgydF4y2Ba为了解决上述诱导物触发的细胞骨架成分重组的特异性,我们使用50 μM异沙本(一种纤维素合成抑制剂)对幼苗进行处理。MTs在孵育后出现明显紊乱,而AFs在密度和强度上没有明显变化。gydF4y2BaggydF4y2Ba对从子叶表皮细胞中采集的图像进行平均丝密度(占比)分析。与模拟处理细胞相比,1 μM flg22和10 μM甲壳素处理后房颤密度显著增加;几丁质和flg22处理显著降低MT密度,异沙本处理显著降低MT密度而不影响AF密度;测量了纤维束的程度或偏度。各处理间无显著差异。给出的值为平均值±标准差。(gydF4y2BangydF4y2Ba=每处理10个子叶100个细胞;**gydF4y2BaPgydF4y2Ba< 0.001;ND,无显著性差异;学生的学习任务)。Bars = 10 μm。帧间间隔= 200 ms,“0 s”为相应处理后5 min的时间点gydF4y2Ba
同时跟踪两种类型的细胞骨架成分使用稳定转换系双色报告可能提供了一个强大的工具,揭示协调行为和阐明潜在的机制。对双标记表皮细胞的VAEM观察表明,皮质AFs和MTs在许多位点协同排列(图2)。gydF4y2Ba4gydF4y2Ba-gydF4y2BabgydF4y2Ba),主要存在于细胞皮层横向或斜向AFs与MTs之间。皮质AFs的矫直和弯曲事件,如先前报道[gydF4y2Ba39gydF4y2Ba],也偶尔观察到在几秒钟内发生在协同位点(图。gydF4y2Ba4 bgydF4y2Ba).一些研究表明,细胞外刺激对一种细胞骨架成分的扰动可以改变另一种的组织[gydF4y2Ba18gydF4y2Ba].在这里,我们观察到在病原体相关分子模式(PAMP) (flg22和几丁质)暴露后,横向MT组织逐渐改变为无序配置,导致AFs和MTs之间的协同排列减少(图2)。gydF4y2Ba4 dgydF4y2Ba-gydF4y2BaegydF4y2Ba).为了量化子叶中的细胞骨架重塑,我们测量了皮层肌动蛋白结构的密度和偏度,这两个指标分别用于估计细胞骨架成分的占用百分比和捆扎程度[gydF4y2Ba26gydF4y2Ba,gydF4y2Ba40gydF4y2Ba].如图所示。gydF4y2Ba4 dgydF4y2Ba-gydF4y2BaegydF4y2Ba而且gydF4y2BaggydF4y2Ba, 1 μM flg22或10 μM甲壳素处理5 min后,皮质阵列房颤密度显著增加(gydF4y2BaPgydF4y2Ba< 0.001),这与之前关于暗生长下胚轴细胞的结果一致[gydF4y2Ba40gydF4y2Ba].然而,MTs在聚焦平面密度显著降低(P < 0.001),进一步表明MTs可能在病原微生物的感知中发挥特定作用。总的来说,这些数据表明子叶表皮细胞中的皮层肌动蛋白阵列在几分钟内对几种不同的pamp做出反应,导致房颤密度显著增加。为了检验上述诱导物触发的细胞骨架成分重组的反应特异性,我们将纤维素合成抑制剂异沙本应用于幼苗。正如预期的那样,在孵育后,MTs明显无序,几乎变成了纵向片段,进一步证实了微管/微原纤维范式;相反,肌动蛋白丝在强度和密度上没有明显变化(gydF4y2BaPgydF4y2Ba> 0.05)(图gydF4y2Ba4 fgydF4y2Ba-gydF4y2BaggydF4y2Ba).这些结果说明了AFs和MTs在响应PAMP诱导时协调行为的特异性,但其潜在机制需要进一步研究。gydF4y2Ba
LSCM和VAEM膜区隔的比较分析gydF4y2Ba
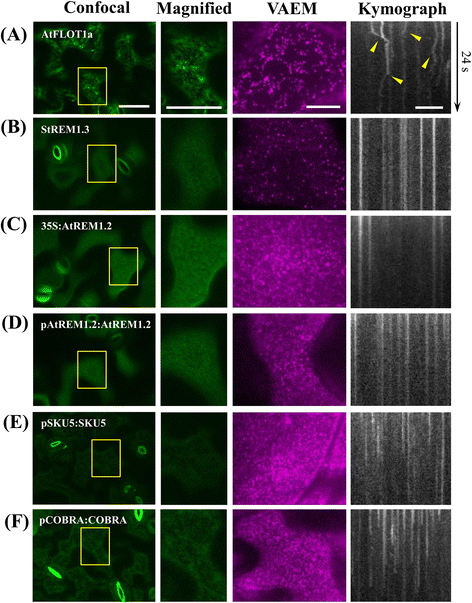
与酵母和动物细胞一样,植物细胞同样具有亚区室化的PM,其中膜微域已被证明可调节内吞事件和信号起始[gydF4y2Ba24gydF4y2Ba,gydF4y2Ba41gydF4y2Ba].如图所示。gydF4y2Ba5gydF4y2Ba,转基因gydF4y2Ba拟南芥gydF4y2Ba在LSCM和VAEM下分别生成和检测了表达几种先前鉴定的微域定位蛋白(StREM1.3, AtREM1.2和AtFLOT1a)的幼苗。还选择了两种特征良好的糖基磷脂酰肌醇(GPI)锚定蛋白SKU5和COBRA,因为在动物和酵母细胞中广泛报道GPI蛋白主要位于膜筏[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba42gydF4y2Ba].为了获得膜结构域的详细视图,使用LSCM对3 ~ 4日龄植物子叶表皮细胞的上表面平面进行成像。对先前鉴定的两种雷默蛋白(rem)和gpi锚定蛋白观察到PM弥散但均匀分布的荧光标记,然而,未检测到荧光强度显著增加的微域(图2)。gydF4y2Ba5 bgydF4y2Ba-gydF4y2BafgydF4y2Ba),而AtFLOT1a-GFP在细胞表面的定位不均匀(图。gydF4y2Ba5gydF4y2Ba).gydF4y2Ba
LSCM和VAEM对PM细分的比较分析。为了获得膜域的详细视图,首先使用LSCM成像子叶表皮细胞的上表面平面;利用VAEM和kymograph分析来捕获PM上的蛋白质动态。gydF4y2Ba一个gydF4y2BaAtFlot1a在LSCM下显示明显的不均匀定位,在VAEM下显示高水平运动,箭头表示关节运动曲线偏离;(gydF4y2BabgydF4y2Ba-gydF4y2BadgydF4y2Ba35S:StREM、35S:AtREM1.2、pREM1.2:AtREM1.2的PM荧光标记弥散但分布均匀,但在VAEM下形成低水平运动的小点;(gydF4y2BaegydF4y2Ba-gydF4y2BafgydF4y2Ba) pSKU5:SKU5-GFP和pCOBRA:COBRA-GFP表现出与rem相似的分布模式,但表现出相对较高的横向运动能力。bar = 50 μm (LSCM), 10 μm (VAEM);帧之间的间隔= 200毫秒gydF4y2Ba
相比之下,由于VAEM允许在PM附近发生的细胞事件的高信噪比(SNR)下进行观测,AtREM1.2和StREM1.3都分离成不同的微域,如预期的那样,在延时图像中显示相对较低的运动性(图2)。gydF4y2Ba5 bgydF4y2Ba-gydF4y2BadgydF4y2Ba).值得注意的是,在内源性启动子控制下表达的GFP-AtREM1.2形成了静态点状结构,如图所示。gydF4y2Ba5度gydF4y2Ba-gydF4y2BadgydF4y2Ba),与35S启动子控制下的表达无显著差异,说明gydF4y2BaAtREM1.2gydF4y2Ba过表达未显著改变膜微域的表达模式和信号强度。为了评估这些微域的时间稳定性,对时间序列图像进行了延时记录和kymograph分析。正如预期的那样,与rem相比,SKU5和COBRA在荧光分布和点状运动方面表现出相似的模式,因为结果清楚地表明,对于大多数点状结构,rem、SKU5和COBRA都表现出无法检测到的横向稳定性(图5)。gydF4y2Ba5 e-fgydF4y2Ba).有趣的是,另一种先前发现的微域定位蛋白AtFLOT1a-GFP显示出高运动性,并显示出点状大小的可变性,这可能对应于哺乳动物细胞中的内吞囊泡或不同的寡聚化状态,正如先前报道的那样(图。gydF4y2Ba5gydF4y2Ba) [gydF4y2Ba14gydF4y2Ba].与上面描述的StREM1.3和AtREM1.2不同,它在PM中没有定位到相对稳定的微域,这进一步暗示了不同微域的异质性和体内膜分区化的生物学复杂性。gydF4y2Ba
膜蛋白的动力学特性通过VAEM和单粒子跟踪解析gydF4y2Ba
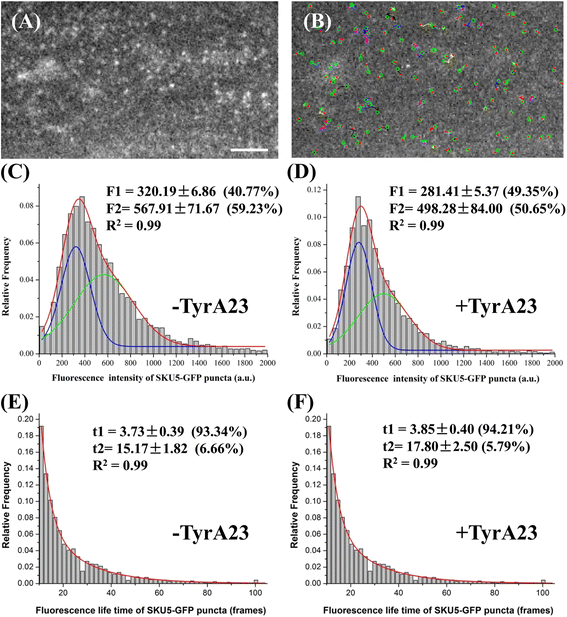
PM提供了足够的空间,其中大分子相互作用可以有效地发生,包括蛋白质在低聚物复合物中的聚类和蛋白质的横向扩散。到目前为止,在目前鉴定的植物细胞中gpi锚定蛋白中,SKU5-GFP已被实验证明与PM相关并定位于细胞内结构[gydF4y2Ba20.gydF4y2Ba],被发现与fm4 - 64染色的PM和囊泡有很好的共定位(附加文件gydF4y2Ba2gydF4y2Ba:图S6)。膜蛋白的运动性是其相互作用能力和功能的关键决定因素。利用基于vem的单粒子跟踪,我们能够在单粒子水平上记录和分析代表SKU5-GFP斑点动力学的动力学参数,包括单个斑点的荧光强度、保留时间、运动范围、速度、轨迹和扩散系数。以单个斑点的荧光强度和保留时间为例,用MATLAB软件进行分析(图。gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
VAEM捕获的SKU5-GFP点的单粒子跟踪与计算分析。gydF4y2Ba一个gydF4y2BaSKU5-GFP标记斑点的延时图像代表帧gydF4y2BabgydF4y2Ba面板中sku5 - gfp标记点的跟踪轨迹(gydF4y2Ba一个gydF4y2Ba);gydF4y2BacgydF4y2Ba在高斯拟合后,基于荧光强度的直方图分析中,跟踪的SKU5-GFP标记斑点向两个种群倾斜,表明两个种群的聚类模式不同;gydF4y2BadgydF4y2BaTyrA23治疗显著改变了两个群体的比例(gydF4y2BaPgydF4y2Ba< 0.05);gydF4y2BaegydF4y2Ba指数拟合后,根据寿命进行直方图分析,SKU5-GFP点与两个种群对齐,表明两个种群存在不同的关联状态;gydF4y2BafgydF4y2BaTyrA23处理后,两个SKU5-GFP斑点虫种群的寿命没有显著变化(gydF4y2BaPgydF4y2Ba> 0.05)。Bars = 50 μm;gydF4y2BaPgydF4y2Ba< 0.05时,采用student t检验检验tyrA23处理后两个种群SKU5-GFP斑点蛋白比例差异的意义;帧之间的间隔= 200毫秒gydF4y2Ba
值得注意的是,SKU5-GFP点状蛋白表现出不同类型的动态行为,其中荧光强度和保留时间是表征这种gpi锚定蛋白的运动性和低聚状态的两个主要参数。gydF4y2Ba6 a - bgydF4y2Ba).荧光强度累积直方图呈倾斜不对称分布(gydF4y2BangydF4y2Ba= 1813)。五分之二(40.77%)的粒子强度在100到500 a.u之间,大约是控制细胞中衍射受限单体GFP分子的范围(附加文件)gydF4y2Ba2gydF4y2Ba:图S7),表明这些颗粒主要由SKU5-GFP单体组成。相比之下,剩余的点可以被认为是由两个或两个以上SKU5分子组成的簇,因为累积直方图可以拟合到另一个高斯峰(59.23%)(图。gydF4y2Ba6摄氏度gydF4y2Ba).此外,这些颗粒从出现到消失在膜表面的停留时间(以帧数表示)为10 ~ 70帧(2.3 s ~ 16.5 s),寿命的累积直方图可以较好地拟合为二阶指数曲线(τ1 = 3.73±0.39,93.34%;τ2 = 15.17±1.82,6.66%)。gydF4y2Ba6 egydF4y2Ba).此外,当指数分量增加到3个时,拟合度并没有进一步提高,这进一步表明,就其在PM上的寿命而言,SKU5-GFP分子主要以单体形式存在或组织成低聚物。为了验证网格蛋白介导的内吞作用是否在SKU5-GFP的膜动力学中发挥作用,考虑到SKU5-GFP在细胞内结构中与FM4-64共定位,用50 μM tyrphostin A23 (tyrA23)处理pSKU5:SKU5-GFP幼苗,这是一种网格蛋白依赖的内吞抑制剂。结果发现,pSKU5:SKU5-GFP斑点两个亚群的比例差异显著(281.41±5.37,49.35%;498.28±84.00 (50.65%)(gydF4y2BangydF4y2Ba= 1760,gydF4y2BaPgydF4y2Ba与对照组相比< 0.05),而SKU5-GFP斑点的保留时间无明显变化(τ1 = 3.85±0.40,94.21%;τ2 = 17.80±2.50,5.79%)(gydF4y2BangydF4y2Ba= 1760,gydF4y2BaPgydF4y2Ba> 0.05)(图gydF4y2Ba6 dgydF4y2Ba而且gydF4y2BafgydF4y2Ba),进一步表明网格蛋白介导的内化参与了两个SKU5-GFP亚群的膜动力学。重要的是,TyrA23显著降低了两个亚群的荧光强度,也降低了表现出更高荧光强度的亚群的百分比(图2)。gydF4y2Ba6摄氏度gydF4y2Ba-gydF4y2BafgydF4y2Ba).进一步的荧光相关光谱(FCS)分析也表明,SKU5-GFP的密度较低(38.4±4.1分子mm)gydF4y2Ba−2gydF4y2Ba;在44.6±3.4分子mm处较对照细胞减少14.9%gydF4y2Ba−2gydF4y2Ba;gydF4y2BaPgydF4y2BaTyrA23治疗后,t检验< 0.05gydF4y2Ba2gydF4y2Ba:图S8)。gydF4y2Ba
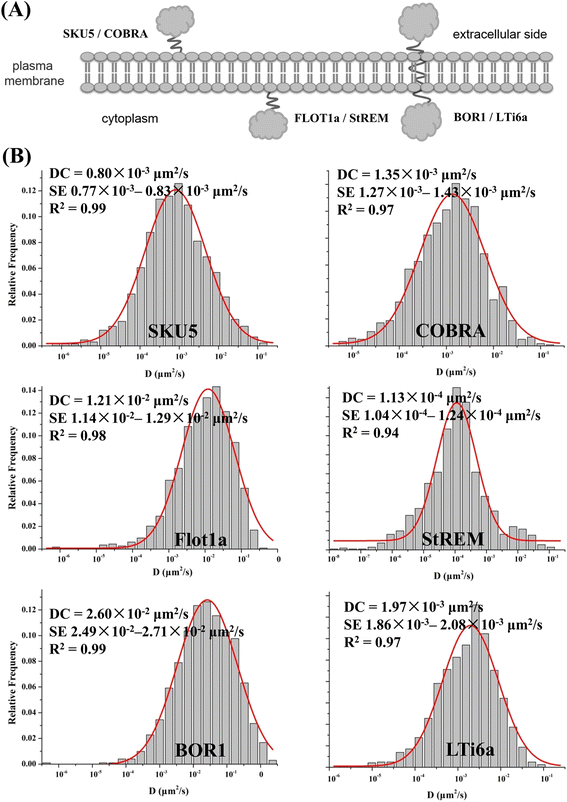
据预测,高等植物蛋白质组中超过25%为膜相关蛋白,根据其拓扑结构的不同,包括整体膜蛋白或外周膜蛋白[gydF4y2Ba43gydF4y2Ba(图。gydF4y2Ba7一个gydF4y2Ba).考虑这一点,我们进一步选择SKU5和眼镜蛇,BOR1 LTi6a, FLOT1a StREM1.3,,分别为特征的代表GPI-anchored蛋白质外传单的点,作为积分代表膜蛋白转运蛋白,与内部相关的蛋白质传单的点分别通过转录后修饰(如S-acylation)。由于这些蛋白在VAEM下均表现出相似的点状结构,荧光强度不同,因此我们利用SPT对其动态特性进行了更详细的研究,并利用MATLAB软件对其动态参数进行了进一步分析。gydF4y2Ba
扩散系数(DC)是从单个粒子的轨迹获得的,单轨迹扩散系数的统计分布可能是有用的膜的异质性的衡量(附加文件gydF4y2Ba2gydF4y2Ba:图S9) [gydF4y2Ba28gydF4y2Ba].SKU5和COBRA都是植物细胞中特征良好的gpi锚定蛋白,预计它们优先位于膜微域[gydF4y2Ba41gydF4y2Ba].结果表明,SKU5和COBRA的扩散系数分布在一个扩散行为亚群内(DC = 0.80 × 10)gydF4y2Ba−3gydF4y2BaμmgydF4y2Ba2gydF4y2Ba/秒,gydF4y2BangydF4y2Ba= 1321, se 0.77 × 10gydF4y2Ba−3gydF4y2Ba- 0.83 × 10gydF4y2Ba−3gydF4y2BaμmgydF4y2Ba2gydF4y2Ba/ s, rgydF4y2Ba2gydF4y2Ba(dc =1.35 × 10gydF4y2Ba−3gydF4y2BaμmgydF4y2Ba2gydF4y2Ba/秒,gydF4y2BangydF4y2Ba= 1227, se 1.27 × 10gydF4y2Ba−3gydF4y2Ba- 1.43 × 10gydF4y2Ba−3gydF4y2BaμmgydF4y2Ba2gydF4y2Ba/ s, rgydF4y2Ba2gydF4y2Ba= 0.97)。gydF4y2Ba7 bgydF4y2Ba).与SKU5相似,LTi6a-GFP点的DC偏斜为1.97 × 10gydF4y2Ba−3gydF4y2BaμmgydF4y2Ba2gydF4y2Ba/秒(gydF4y2BangydF4y2Ba= 1228, se 1.86 × 10gydF4y2Ba−3gydF4y2Ba- 2.08 × 10gydF4y2Ba−3gydF4y2BaμmgydF4y2Ba2gydF4y2Ba/ s, rgydF4y2Ba2gydF4y2Ba= 0.97),这与两种gpi锚定蛋白的结果相当;相比之下,真正的内吞货物跨膜蛋白BOR1-GFP也以点状分布,由VAEM观察到[gydF4y2Ba19gydF4y2Ba].DC为2.60 × 10gydF4y2Ba−2gydF4y2BaμmgydF4y2Ba2gydF4y2Ba/秒(gydF4y2BangydF4y2Ba= 1013, se 2.49 × 10gydF4y2Ba−2gydF4y2Ba-2.71 × 10gydF4y2Ba−2gydF4y2BaμmgydF4y2Ba2gydF4y2Ba/ s, rgydF4y2Ba2gydF4y2Ba= 0.99)。gydF4y2Ba7 bgydF4y2Ba),扩散系数离散度较大,大多在2.49 × 10之间gydF4y2Ba−2gydF4y2BaμmgydF4y2Ba2gydF4y2Ba/s和2.71 × 10gydF4y2Ba−2gydF4y2BaμmgydF4y2Ba2gydF4y2Ba/s,表明这些蛋白质的运动性是异质的,正如kymograph分析所显示的那样(附加文件gydF4y2Ba2gydF4y2Ba:图S10)。所得到的直方图由一个或两个高斯峰拟合,识别为具有不同扩散系数的不同亚种群。而位于AtFLOT1a的内小叶则表现出明显的高活动性,其DC为1.21 × 10gydF4y2Ba−2gydF4y2BaμmgydF4y2Ba2gydF4y2Ba/秒(gydF4y2BangydF4y2Ba= 1137, se 1.14 × 10gydF4y2Ba−2gydF4y2Ba- 1.29 × 10gydF4y2Ba−2gydF4y2BaμmgydF4y2Ba2gydF4y2Ba/ s, rgydF4y2Ba2gydF4y2Ba= 0.98),进一步暗示其可能参与了先前报道的内吞事件。值得注意的是,StREM1.3-GFP的DC是所有候选蛋白质中最低的,它们加在一起的范围相对较广,从10gydF4y2Ba−8gydF4y2BaμmgydF4y2Ba2gydF4y2Ba/s ~ 10gydF4y2Ba−2gydF4y2BaμmgydF4y2Ba2gydF4y2Ba/s, 1.13 × 10gydF4y2Ba−4gydF4y2BaμmgydF4y2Ba2gydF4y2Ba/秒(gydF4y2BangydF4y2Ba= 1102, se 1.04 × 10gydF4y2Ba−4gydF4y2Ba- 1.24 × 10gydF4y2Ba−4gydF4y2BaμmgydF4y2Ba2gydF4y2Ba/ s, rgydF4y2Ba2gydF4y2Ba= 0.94)为中值;这进一步表明,StREM1.3-GFP点状蛋白在膜微域的维持和信号传导过程的启动中具有低活力和大量的脚手架功能,如先前报道的那样。gydF4y2Ba
讨论gydF4y2Ba
随着新型荧光蛋白和成像技术的最新进展,现在可以在亚细胞水平上,甚至在单颗粒水平上,将接近PM的生物过程可视化。TIRFM最初应用于植物研究,用于体外研究AF和MT动力学,以及缺乏细胞壁的原生质体的ER动力学[gydF4y2Ba44gydF4y2Ba].由于产生的倏逝波呈指数衰减,TIRFM应用于植物和真菌细胞的研究并不简单,这受到厚细胞壁和玻璃表面粘附性差的阻碍。VAEM适用于植物中不同类型的表皮细胞。VAEM在植物细胞中的首次应用可以追溯到对百合花粉管中分泌囊泡运输的尝试,最初将这种技术描述为倏逝波显微镜[gydF4y2Ba8gydF4y2Ba].Konopka和Bednarek进一步将该方法定义为“变角度epifluorescence microscopy”(VAEM),以减少背景噪声并解决TIRF的一些缺点[gydF4y2Ba9gydF4y2Ba].在机械上,在TIRF或VAEM模式下进行显微镜检查的唯一区别是TIRF仪器中反射镜的方向变化,其中TIRF使用单一的临界角度,而VAEM确保使用各种次临界角度。因此,在VAEM中不会产生倏灭场,只会产生非常薄的光照带。gydF4y2Ba
基本上,皮质细胞器的近距离VAEM检查可以显著促进细胞器身份的表征,如本研究中细胞内结构的双色标记。针对ABP1生物学功能的争议,VAEM为进一步探索ABP1标记的细胞内结构与内膜系统的功能相关性提供了另一种途径。由于ER是绝大多数蛋白质和脂质运输到不同细胞间室的通道,ABP1在ER中的定位意味着ABP1在与其他细胞器的各种接触位点上的潜在作用。Von Wangenheim等人报道了不同的组织和运动行为,以及核内体的相互作用与特定的根毛区和发育阶段有关[gydF4y2Ba45gydF4y2Ba].有趣的是,与高尔基体密切相关的囊泡结构或内体隔室可能积极参与生长素信号的内吞和外胞活动。尽管局部定位很重要,但亚细胞定位与细胞器功能之间的精确联系往往还不完全清楚。gydF4y2Ba
囊泡是内质网、高尔基体和其他内体区室之间的最小单位,而依赖网格蛋白的内吞作用已在植物细胞中得到广泛研究[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba32gydF4y2Ba,gydF4y2Ba46gydF4y2Ba].Konopka等利用VAEM比较了细胞皮层中动态相关蛋白1 (dynamic -related protein 1, DRP1)和网格蛋白动力学,并进一步分析了DRP1A和DRP1C在植物发育过程中的功能冗余。该结果进一步推进了我们对网格蛋白介导的内吞作用及其调控的理解,并证实了VAEM在植物细胞单颗粒水平上解剖蛋白质动力学的稳健性[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba46gydF4y2Ba].最近,AtFLOT1a被认为参与了一个不依赖网格蛋白的内吞事件,该事件在大小和动态性质上与网格蛋白包被的囊泡有很大不同[gydF4y2Ba8gydF4y2Ba].借鉴中野实验室在网格蛋白和细胞内核内体共定位中采用的方法[gydF4y2Ba32gydF4y2Ba],我们能够根据单个点之间的距离将大量荧光标记的CLC-GFP和FLOT1a点划分为不同的亚群(图。gydF4y2Ba3.gydF4y2Ba).在本研究中,lc - gfp和FLOT1a-mCherry在LSCM下看似共定位的荧光信号被证实不是共定位的,但在VAEM的延时观察中,重叠系数和蛋白质接近指数的结果显示,确实只有部分相关(图2)。gydF4y2Ba2gydF4y2Ba而且gydF4y2Ba3.gydF4y2Ba).值得注意的是,重叠系数已被广泛接受为评价共定位百分比的指标[gydF4y2Ba32gydF4y2Ba].可以直接导入序列VAEM序列计算重叠系数(本研究最多可计算10个序列帧,取决于计算机内存),与传统的LSCM相比,在共定位分析中更加精确和令人信服。gydF4y2Ba
VAEM的另一个优点是对最接近覆盖层的荧光标记结构进行成像[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba44gydF4y2Ba].在VAEM下跟踪细胞骨架组分可能为解析坐标行为提供了一个强有力的工具。正如Staiger实验室详细叙述的那样,AFs不仅在细胞的物理组织中起着核心作用,而且在应对病原体感染时,在细胞器、蛋白质和大分子的动态(重新)定位中也起着核心作用[gydF4y2Ba40gydF4y2Ba,gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba].此外,作为病原体感知后防御信号成分组装和运动的轨迹,AFs逻辑上代表了病原体的毒力目标。然而,最近的一份报告显示,一种iii型效应子(T3E)蛋白从gydF4y2Ba两gydF4y2Ba, HopZ1a靶向MTs,从而损害分泌途径并抑制细胞壁介导的防御[gydF4y2Ba49gydF4y2Ba].同样,AFs在被致病性或互惠性细菌感染期间通过肌动蛋白的单泛素化而稳定,但对应激或病毒感染没有反应[gydF4y2Ba50gydF4y2Ba].这意味着在同一时间尺度内细胞骨架的连续重排可能代表了一种对病原体的监测机制。在本研究中,野生型Col-0植物经flg22或几丁质处理后,AF密度显著增强,这可能促进植物细胞模式识别受体(PRRs)的内吞作用和下游信号传导[gydF4y2Ba40gydF4y2Ba].MTs在PAMP刺激下的重定向和破碎可能归因于细胞骨架组分之间相互作用的破坏,因为PAMP降低了AFs和MTs之间协同排列的频率。此外,超分辨率成像方法,如结构照明显微镜(SIM),也已应用于植物细胞的研究,例如不同细胞类型的微管动力学,网状细胞与原始胞间连丝和ER的相关性。这可能进一步扩大成像方法在解决关键生物学问题方面的潜力[gydF4y2Ba51gydF4y2Ba,gydF4y2Ba52gydF4y2Ba,gydF4y2Ba53gydF4y2Ba,gydF4y2Ba54gydF4y2Ba].gydF4y2Ba
在膜亚区化方面,䲟蛋白(Rem)首先是PM中所谓的膜筏或微域的最真正的标记蛋白,最近在鉴定活细胞中不同功能微域方面的进展证明了这一点[gydF4y2Ba21gydF4y2Ba,gydF4y2Ba24gydF4y2Ba].在这里,我们发现StRem1.3、AtRem1.2和两个gpi锚定蛋白在LSCM下以扩散的方式均匀分布在PM上,而进一步的VAEM观察显示相对静态的点状结构在PM上表现出极低或仅无法检测到的横向运动,这表明这些蛋白质的微域是暂时稳定的,如kymograph分析中的垂直线所示。来自光漂白后荧光恢复(FRAP)实验的类似结果也显示,光漂白后DsRed2::AtRem 1.3几乎没有光恢复,这表明这些微域蛋白质在PM内的低迁移率[gydF4y2Ba21gydF4y2Ba].然而,另一种先前报道的微域相关蛋白FLOT1a [gydF4y2Ba14gydF4y2Ba],显示明显的横向运动,这可能代表了活跃的内吞事件。这些结果可能为研究不同微畴的异质性及其共存的复杂性增加了额外的价值。gydF4y2Ba
膜内蛋白质在信号感知和转导、溶质分配和分泌中起着至关重要的作用[gydF4y2Ba41gydF4y2Ba,gydF4y2Ba55gydF4y2Ba].由于在许多gpi锚定蛋白中发现的长链饱和脂质锚可以促进它们与有序脂质微域或纳米簇的结合,我们一直期待SKU5和COBRA可能由于gpi锚定的空间效应而表现出有限的运动,而像BOR1这样的完整蛋白可能局限于相对有限的区域。值得注意的是,蛋白质在PM上的扩散系数没有显著差异,与膜锚的存在无关。因此,在这种情况下,GPI-anchor或其他糖链并不一定会产生空间效应来影响蛋白质动力学的动力学参数,而蛋白质动力学的性质可能与其在特定生物学环境中的功能直接相关。有趣的是,与其他检测的蛋白相比,Flot1a显示出相对较高的横向运动能力,这与之前关于其在本构或配体诱导的内吞作用中的功能的报道一致[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba19gydF4y2Ba].微域也可能作为结构单元,在空间上分离蛋白质,从而避免在没有特定刺激的情况下发生意外的串扰。gydF4y2Ba
结论gydF4y2Ba
总之,VAEM为探测PM和细胞皮层附近的蛋白质动力学和其他细胞内事件提供了一种强大的方法。它可以进一步推进我们对特定环境下膜运输、细胞骨架组织和膜亚区系化的认识,提高空间和时间精度。随着VAEM、SPT和计算方法的广泛应用和日益普及,未来将为那些有兴趣揭示蛋白质动力学、相互作用和功能如何定义细胞特异性轮廓以响应发育线索或环境刺激的人带来兴奋。gydF4y2Ba
缩写gydF4y2Ba
- a.u。gydF4y2Ba
-
任意单位gydF4y2Ba
- 转化:gydF4y2Ba
-
生长素结合蛋白1gydF4y2Ba
- AFs:gydF4y2Ba
-
肌动蛋白丝gydF4y2Ba
- :gydF4y2Ba
-
拟南芥gydF4y2Ba
- 论坛:gydF4y2Ba
-
Brefeldin一gydF4y2Ba
- BOR1:gydF4y2Ba
-
硼转运体1gydF4y2Ba
- CLC:gydF4y2Ba
-
网格蛋白轻链gydF4y2Ba
- DC:gydF4y2Ba
-
扩散系数gydF4y2Ba
- DRP1C:gydF4y2Ba
-
动力蛋白相关蛋白1CgydF4y2Ba
- EMCCD:gydF4y2Ba
-
电子倍增电荷耦合装置gydF4y2Ba
- 呃:gydF4y2Ba
-
内质网gydF4y2Ba
- fABD2:gydF4y2Ba
-
fimbrin2的丝状-肌动蛋白结合域gydF4y2Ba
- FCS:gydF4y2Ba
-
荧光相关光谱gydF4y2Ba
- FLOT1a:gydF4y2Ba
-
FLOTTILIN1agydF4y2Ba
- 收紧:gydF4y2Ba
-
光漂白后荧光恢复gydF4y2Ba
- 绿色荧光蛋白:gydF4y2Ba
-
绿色荧光蛋白gydF4y2Ba
- 谷歌价格指数:gydF4y2Ba
-
糖基磷脂酰肌醇gydF4y2Ba
- 小矿脉显微镜:gydF4y2Ba
-
高倾斜和层压光学片显微术gydF4y2Ba
- LSCM:gydF4y2Ba
-
激光扫描共聚焦显微术gydF4y2Ba
- LTi6a:gydF4y2Ba
-
低温诱发6agydF4y2Ba
- mGFP:gydF4y2Ba
-
单体绿色荧光蛋白gydF4y2Ba
- mRFP:gydF4y2Ba
-
单体红色荧光蛋白gydF4y2Ba
- 默沙东公司:gydF4y2Ba
-
均方位移gydF4y2Ba
- MTs:gydF4y2Ba
-
微管gydF4y2Ba
- 下午:gydF4y2Ba
-
等离子体膜gydF4y2Ba
- PRRs:gydF4y2Ba
-
模式识别受体gydF4y2Ba
- 雷姆:gydF4y2Ba
-
RemorinsgydF4y2Ba
- SIM卡:gydF4y2Ba
-
结构照明显微术gydF4y2Ba
- 圣:gydF4y2Ba
-
茄属植物tuberosumgydF4y2Ba
- T3E:gydF4y2Ba
-
iii型效应gydF4y2Ba
- TGN:gydF4y2Ba
-
Trans-Golgi网络gydF4y2Ba
- TIRF:gydF4y2Ba
-
全内反射荧光gydF4y2Ba
- TUA5:gydF4y2Ba
-
微管蛋白5gydF4y2Ba
- VAEM:gydF4y2Ba
-
变角度荧光显微术gydF4y2Ba
- WCIF:gydF4y2Ba
-
莱特细胞成像设备gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
久umi A,藤原TK,查达R,谢m, Tsunoyama TA, Kalay Z, Kasai RS,铃木KG。调节信号转导的质膜的动态组织原则:纪念辛格和尼科尔森的流体镶嵌模型四十周年。细胞发育生物学。2012;28:215-50。gydF4y2Ba
- 2.gydF4y2Ba
Malinsky J, Opekarova M, Grossmann G, Tanner W.植物和真菌中的膜微域,筏和抗洗涤剂膜。植物学报,2013;gydF4y2Ba
- 3.gydF4y2Ba
葛尔C,伯恩特M, Enderlein J, Diez STIRF。使用倾斜荧光微管的显微消逝场校准。中国科学(d辑),2009;gydF4y2Ba
- 4.gydF4y2Ba
李晓霞,林杰,李晓霞。基于单分子水平的质膜动力学研究。植物科学进展,2013;18:617-24。gydF4y2Ba
- 5.gydF4y2Ba
Leonard D, Hayakawa A, Lawe D, Lambright D, Bellve KD, Standley C, Lifshitz LM, Fogarty KE, Corvera S.质膜上EGF和转铁蛋白的分类以及通过货物特异性信号传递到eea1富集的核内体。中国生物医学工程学报(英文版);2008;gydF4y2Ba
- 6.gydF4y2Ba
Webb RL, Rozov O, Watkins SC, McCartney BM。使用全内反射荧光(TIRF)显微镜观察果蝇合胞胚胎的皮层肌动蛋白和微管。开发动态。2009;238:2622-32。gydF4y2Ba
- 7.gydF4y2Ba
Smith IF, Parker I. Ca过程中单个IP3R通道活性的量子子结构成像gydF4y2Ba2 +gydF4y2Ba完整哺乳动物细胞中的泡芙。中国科学院学报(自然科学版),2009;gydF4y2Ba
- 8.gydF4y2Ba
王霞,滕勇,王强,李霞,盛霞,郑明,Samaj J, Baluska F,林杰。植物花粉管动态分泌囊泡的成像gydF4y2Ba云杉meyerigydF4y2Ba使用倏逝波显微镜。植物物理学报。2006;41:1591 - 603。gydF4y2Ba
- 9.gydF4y2Ba
Konopka CA, Bednarek SY。变角度荧光显微镜:一种观察植物细胞皮层蛋白质动力学的新方法。植物学报,2008;26(2):344 - 344。gydF4y2Ba
- 10.gydF4y2Ba
万勇,陈文敏,范玲,陈志强,陈志强,林杰。全细胞全内反射荧光显微技术的研究进展gydF4y2Ba拟南芥gydF4y2Ba.植物科学。2011;7:27。gydF4y2Ba
- 11.gydF4y2Ba
Tokunaga M, Imamoto N, Sakata-Sogawa K.高倾斜薄照明使细胞清晰的单分子成像。Nat Methods. 2008; 5:159-61。gydF4y2Ba
- 12.gydF4y2Ba
花浸法:农杆菌介导转化植物的一种简化方法gydF4y2Ba拟南芥gydF4y2Ba.植物学报(英文版);1998;gydF4y2Ba
- 13.gydF4y2Ba
Murashige T, Skoog FA。烟草组织培养快速生长和生物测定的修正培养基。物理植物。1962;15:473-97。gydF4y2Ba
- 14.gydF4y2Ba
李锐,刘鹏,万勇,陈涛,王强,Mettbach U, Baluska F, Samaj J,方X, Lucas WJ,等。一种膜微域相关蛋白,拟南芥Flot1,参与了网格蛋白独立的内吞途径,是幼苗发育所必需的。植物学报。2012;24:2105-22。gydF4y2Ba
- 15.gydF4y2Ba
杜晓霞,王晓明,黄晓明,王晓明,王晓明,等。拟南芥pinn生长素外排载体的结构内吞作用研究。生物学报,2007;17:520-7。gydF4y2Ba
- 16.gydF4y2Ba
科诺普卡CA,巴克斯SK, Bednarek SY。拟南芥动力相关蛋白1C和质膜网格蛋白轻链的动态。《植物科学》2008;20:1363-80。gydF4y2Ba
- 17.gydF4y2Ba
卡特勒SR,埃哈特DW,格里菲斯JS,萨默维尔CR,随机GFP。cDNA融合能够在拟南芥细胞中以高频率显示亚细胞结构。自然科学学报。2000;97:3718-23。gydF4y2Ba
- 18.gydF4y2Ba
Sampathkumar A, Lindeboom JJ, Debolt S, Gutierrez R, Ehrhardt DW, Ketelaar T, Persson S.活细胞成像揭示了拟南芥中肌动蛋白和微管细胞骨架之间的结构关联。植物学报。2011;23:2302-13。gydF4y2Ba
- 19.gydF4y2Ba
Takano J, Tanaka M, Toyoda A, Miwa K, Kasai K, Fuji K, Onouchi H, Naito S, Fujiwara T.拟南芥硼转运蛋白通过不同转运途径的极性定位和降解。自然科学学报。2010;107:520 - 5。gydF4y2Ba
- 20.gydF4y2Ba
sedrbrook JC, Carroll KL, Hung KF, Masson PH, Somerville CR.拟南芥SKU5基因编码一种参与定向根生长的胞外糖基磷脂酰肌醇锚定糖蛋白。《植物科学》2002;14:1635-48。gydF4y2Ba
- 21.gydF4y2Ba
Demir F, Horntrich C, Blachutzik JO, Scherzer S, Reinders Y, Kierszniowska S, Schulze WX, Harms GS, Hedrich R, Geiger D,等。拟南芥纳米域划定的ABA信号通路调控阴离子通道SLAH3。中国科学院学报(自然科学版),2013;gydF4y2Ba
- 22.gydF4y2Ba
Roudier F, Fernandez AG, Fujita M, Himmelspach R, Borner GH, Schindelman G, Song S, Baskin TI, Dupree P, Wasteneys GO,等。COBRA是一种拟南芥细胞外糖基磷脂酰肌醇锚定蛋白,通过参与纤维素微纤维定向,特异性地控制高度各向异性的膨胀。《植物科学》,2005;17(4):489 - 497。gydF4y2Ba
- 23.gydF4y2Ba
Hemsley PA, Weimar T, Lilley KS, Dupree P, Grierson CSA。蛋白质组学方法在拟南芥中鉴定出许多新的棕榈酰化蛋白。新植物,2013;197:805-14。gydF4y2Ba
- 24.gydF4y2Ba
Jarsch IK, Konrad SS, Stratil TF, Urbanus SL, Szymanski W, Braun P, Braun KH, Ott T.在拟南芥和拟南芥中,质膜被细分为大量共存和不同的微域gydF4y2Ba烟草benthamianagydF4y2Ba.植物学报。2014;26:1698-711。gydF4y2Ba
- 25.gydF4y2Ba
李强,刘安,李志强,郭林,Fordyce CB, Stanley EF。突触素1,Galpha(o)和n型钙通道复合物在突触前神经末梢:定量免疫共定位分析。神经科学杂志2004;24:4070-81。gydF4y2Ba
- 26.gydF4y2Ba
Higaki T, Kutsuna N, Sano T, Kondo N, Hasezawa S.植物细胞中肌动蛋白骨架结构的定量和聚类分析:肌动蛋白束在拟南芥保护细胞日周期气孔运动中的作用。植物学报,2010;gydF4y2Ba
- 27.gydF4y2Ba
Li J, Henty-Ridilla JL, Staiger BH, Day B, Staiger CJ。Capping蛋白整合了多种MAMP信号通路,在植物先天免疫过程中调节肌动蛋白动态。Nat Commun. 2015;6:7206。gydF4y2Ba
- 28.gydF4y2Ba
Jaqaman K, Loerke D, Mettlen M, Kuwata H, Grinstein S, Schmid SL, Danuser G.活细胞延时序列的鲁棒单粒子跟踪。南京大学学报(自然科学版),2008;gydF4y2Ba
- 29.gydF4y2Ba
威泽,舒茨,GJ。追踪活细胞质膜中的单个分子——该做的和不该做的。方法。2008;46:131-40。gydF4y2Ba
- 30.gydF4y2Ba
古莲M,西蒙SM。追踪细胞内的单个蛋白质。中国生物工程学报,2000;49:488 - 488。gydF4y2Ba
- 31.gydF4y2Ba
萨克斯顿乔丹。单粒子跟踪:扩散系数的分布。中国生物工程学报(自然科学版),2000;gydF4y2Ba
- 32.gydF4y2Ba
Ito E, Fujimoto M, Ebine K, Uemura T, Ueda T, Nakano A.拟南芥网格蛋白动态行为的实时成像。植物学报(英文版);2012;gydF4y2Ba
- 33.gydF4y2Ba
吴艳,王晓霞,王晓霞,等。基于蛋白质接近指数和相关系数的荧光标记空间相关性分析。Nat protocol . 2011; 6:1554-67。gydF4y2Ba
- 34.gydF4y2Ba
高艳,张颖,张东,戴霞,Estelle M,赵艳。生长素结合蛋白1 (ABP1)在生长素信号通路和拟南芥发育过程中都不是必需的。中国科学院学报(自然科学版)2015;gydF4y2Ba
- 35.gydF4y2Ba
Grebe M, Xu J, Mobius W, Ueda T, Nakano A, Geuze HJ, Rook MB, Scheres B.拟南芥固醇内吞作用涉及肌动蛋白介导的ara6阳性早期核内体转运。生物学报,2003;13:1378-87。gydF4y2Ba
- 36.gydF4y2Ba
Logan DC, Leaver CJ。线粒体靶向GFP突出了活植物细胞内线粒体形状、大小和运动的异质性。中国科学(d辑),2000;gydF4y2Ba
- 37.gydF4y2Ba
范玲,郝辉,薛艳,张玲,宋凯,丁铮,Botella MA,王宏,林娟。拟南芥AP2 sigma亚基在网格蛋白介导的胞吞作用和植物发育中的动态分析。发展。2013;140:3826-37。gydF4y2Ba
- 38.gydF4y2Ba
Ritzenthaler C, Nebenfuhr A, Movafeghi A, Stussi-Garaud C, Behnia L, Pimpl P, Staehelin LA, Robinson DG。用表达高尔基靶向绿色荧光蛋白和COPI抗血清的烟草亮黄2细胞重新评价勃莱菲丁a对植物细胞的影响。《植物科学》2002;14:237-61。gydF4y2Ba
- 39.gydF4y2Ba
Staiger CJ, Sheahan MB, Khurana P, Wang X, McCurdy DW, Blanchoin L.拟南芥皮层阵列中肌动蛋白丝动态以快速生长和切断活性为主。中国生物医学工程学报(英文版);2009;gydF4y2Ba
- 40.gydF4y2Ba
Henty-Ridilla JL, Li J, Day B, Staiger CJ。肌动蛋白解聚因子4在拟南芥先天免疫信号转导过程中调控肌动蛋白动态。植物学报。2014;26:340-52。gydF4y2Ba
- 41.gydF4y2Ba
Keinath NF, Kierszniowska S, Lorek J, Bourdais G, Kessler SA, Shimosato-Asano H, Grossniklaus U, Schulze WX, Robatzek S, Panstruga R. PAMP(病原体相关分子模式)诱导的质膜区隔化变化揭示了植物免疫的新成分。中国生物化学杂志,2010;gydF4y2Ba
- 42.gydF4y2Ba
Schindelman G, Morikami A, Jung J, Baskin TI, Carpita NC, Derbyshire P, McCann MC, Benfey PN。COBRA编码一个假定的gpi锚定蛋白,该蛋白在拟南芥中是极性定位的,是定向细胞扩张所必需的。基因开发,2001;15:1115-27。gydF4y2Ba
- 43.gydF4y2Ba
Schwacke R, Schneider A, van der Graaff E, Fischer K, Catoni E, Desimone M, Frommer WB, Flugge UI, Kunze R. ARAMEMNON,拟南芥整体膜蛋白数据库。植物物理学报,2003;gydF4y2Ba
- 44.gydF4y2Ba
曲霞,张慧,谢艳,王娟,陈楠,黄松。拟南芥绒毛蛋白促进花粉管尖端肌动蛋白的翻转,促进肌动蛋白颈圈的构建。《植物科学》2013;25:1803-17。gydF4y2Ba
- 45.gydF4y2Ba
von Wangenheim D, Rosero A, Komis G, Samajova O, Ovecka M, Voigt B, Samaj J.根毛生长过程中的内体相互作用。中国植物科学,2015;6:1262。gydF4y2Bahttps://doi.org/10.3389/fpls.2015.01262gydF4y2Ba.gydF4y2Ba
- 46.gydF4y2Ba
Konopka CA, Bednarek SY。拟南芥动态相关异构体DRP1A和DRP1C在植物发育过程中的动态和功能冗余比较植物学报。2008;147:1590-602。gydF4y2Ba
- 47.gydF4y2Ba
Day B, Henty JL, Porter KJ, Staiger CJ。病原体-肌动蛋白连接:植物防御信号的平台。植物病理学杂志。2011;49:483-506。gydF4y2Ba
- 48.gydF4y2Ba
Henty-Ridilla JL, Shimono M, Li J, Chang JH, Day B, Staiger CJ。植物肌动蛋白细胞骨架对来自微生物相关分子模式的信号作出反应。科学通报,2013;9:e1003290。gydF4y2Ba
- 49.gydF4y2Ba
Lee AH, Hurley B, Felsensteiner C, Yea C, Ckurshumova W, Bartetzko V, Wang PW, Quach V, Lewis JD, Liu YC,等。一种细菌乙酰转移酶破坏植物微管网络并阻断分泌。科学通报。2012;8:e1002523。gydF4y2Ba
- 50.gydF4y2Ba
Dantan-Gonzalez E, Rosenstein Y, Quinto C, Sanchez F.植物对病原体和共生体的反应诱导肌动蛋白单泛素化。植物与微生物相互作用。2001;14:1267-73。gydF4y2Ba
- 51.gydF4y2Ba
王鹏,王志刚,王志刚,王志刚,王志刚,王志刚。网状细胞在胞间连丝形成过程中的作用。植物科学进展。2015;gydF4y2Ba
- 52.gydF4y2Ba
Komis G, Mistrik M, Samajova O, Doskocilova A, Ovecka M, Illes P, Bartek J, Dynamics SJ。超分辨结构照明显微镜显示皮层微管的组织。植物科学进展。2014;gydF4y2Ba
- 53.gydF4y2Ba
高志伟,李志强,李志强,李志强。植物细胞超分辨实时成像技术的研究进展。网络学报。2015;10:1248-63。gydF4y2Ba
- 54.gydF4y2Ba
李志强,李志强,李志强。超分辨率显微技术在植物细胞成像中的应用。植物科学进展2015;20:834-43。gydF4y2Ba
- 55.gydF4y2Ba
Robert S, Kleine-Vehn J, Barbez E, Sauer M, Paciorek T, Baster P, Vanneste S, Zhang J, Simon S, Covanova M,等。ABP1介导生长素抑制拟南芥网格蛋白依赖的内吞作用。细胞。2010;143:111-21。gydF4y2Ba
确认gydF4y2Ba
作者感谢dr。Sebastian Bednarek, Niko Geldner, Thomas Ott, Akihiko Nakano, Takashi Ueda, Ines Kreuzer, Staffan Persson, John Sedbrook和Toru Fujiwara提供材料。gydF4y2Ba
资金gydF4y2Ba
国家自然科学基金(31530057,31672210,31670183)和中国科学技术部(2015BAD16B01-3)资助。资助机构在研究设计、数据收集、分析和解释以及撰写手稿方面没有发挥任何作用。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
本研究中使用和/或分析的数据集可根据合理要求从通讯作者处获得。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
TC进行实验并撰写手稿;DC进行实验;SP监督了研究并撰写了手稿。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用gydF4y2Ba
发表同意书gydF4y2Ba
不适用gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明,这项研究是在没有任何商业或财务关系的情况下进行的,这些关系可能被解释为潜在的利益冲突。gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
附加文件gydF4y2Ba
附加文件1:gydF4y2Ba
确定入射角和穿透深度的方法。(PDF 569 kb)gydF4y2Ba
附加文件2:gydF4y2Ba
图S1。gydF4y2Ba在VAEM下,能以高时空的方式解析器官动力学。gydF4y2Ba图S2。gydF4y2BaVAEM适用于幼苗不同组织的表皮细胞。gydF4y2Ba图S3。gydF4y2BaCLC-GFP标记的点状结构对应于网格蛋白包被的囊泡和高尔基体,这取决于入射光的角度。gydF4y2Ba图S4。gydF4y2Ba肌动蛋白周转用VAEM解决。gydF4y2Ba图S5。gydF4y2Bavem显示微管组织。gydF4y2Ba图S6。gydF4y2BaSKU5-GFP定位于质膜和细胞内结构。gydF4y2Ba图S7。gydF4y2Ba衍射受限单晶pCLC2-肉豆汤酰- mgfp的荧光强度分布gydF4y2BaA206KgydF4y2Ba斑点。gydF4y2Ba图S8。gydF4y2Ba荧光相关光谱(FCS)检测TyrA23处理后的荧光波动。gydF4y2Ba图S9。gydF4y2Ba对不同弹道的MSD进行分析,并将其划分为不同的扩散体系。gydF4y2Ba图S10。gydF4y2BaBOR1和Lti6a的代表性kymograph。(PDF 1148kb)gydF4y2Ba
附加文件3:gydF4y2Ba
质膜附近高尔基体的动力学。(AVI 23044 kb)gydF4y2Ba
附加文件4:gydF4y2Ba
质膜附近线粒体的动态。(AVI 23044 kb)gydF4y2Ba
附加文件5:gydF4y2Ba
内质网(ER)小管在质膜附近的动态。(AVI 23044 kb)gydF4y2Ba
附加文件6:gydF4y2Ba
双色VAEM显示网格蛋白轻链(CLC -GFP)和mCherry-Flot1a显示特征定位于分离的点状结构。(avi127kb)gydF4y2Ba
附加文件7:gydF4y2Ba
转基因fABD2-GFP拟南芥幼苗在质膜附近肌动蛋白丝的快速翻转。(avi1151kb)gydF4y2Ba
附加文件8:gydF4y2Ba
VAEM显示的微管组织的延时记录。(avi1072 kb)gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文根据创作共用属性4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)除另有说明外,适用于本条所提供的资料。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
陈涛,季东,田舒。植物细胞质膜附近蛋白质动态的变角度荧光显微镜研究。gydF4y2BaBMC植物生物学gydF4y2Ba18日,gydF4y2Ba43(2018)。https://doi.org/10.1186/s12870-018-1246-0gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-018-1246-0gydF4y2Ba
关键字gydF4y2Ba
- Endosomal动力学gydF4y2Ba
- MicrodomaingydF4y2Ba
- 等离子体膜gydF4y2Ba
- 变角度荧光显微术gydF4y2Ba