摘要
背景
固有的特点和水稻的生理,因为它达到耐盐性影响水稻种子的殖民细菌内生群落的变化。这些植物内生菌传播也成为了工厂的微生物群落的来源,同时对主机和环境条件作出反应。本研究探讨水稻主机的影响,以及土壤盐分对水稻种子细菌内生菌的群落结构和多样性具有不同的对盐胁迫的影响。内生细菌多样性是通过培养依赖技术和终端 - 限制性片段长度多态性(T-RFLP)分析研究。
结果
结果揭示了水稻种子内部的细菌内心细胞的多样化社区。基于16S rRNA分析的克隆和分离株的籼稻种子的整体内生细菌群落由Phylumogeobacteria之后的抗菌菌和迫使。社区型材显示在代表潜在核心微生物群的籼型亚种类的所有品种中发现的常见核科。铜段,黄芪,肠杆菌属,Xanthomonas.,草螺菌,小细菌属和Stenotrophomonas..聚类分析表明,寄主基因型主要影响不同水稻品种的种子内生植物群落。在盐胁迫条件下,耐盐和耐盐水稻品种的内生菌群落优势转移到属细菌群黄芪,Pantoea,肠杆菌属,小细菌属,Kosakonia和铜段.
结论
籼稻种子内生菌群的形成受寄主基因型、对盐胁迫的生理适应和系统发育关系的影响。在盐胁迫条件下,一些细菌群落变得显著,导致细菌多样性和优势度的改变。
背景
在植物结构中,内生细菌群落是非常多样化的。植物的种群密度和内生细菌的变异一般从根到茎和叶递减[1,2,3.,4].多种内生细菌群落也在许多植物的种子中茁壮成长[5,6,7,8].种子内生菌是因为其内在特性,允许他们定居工厂内部结构,包括植物的生殖部分特别有趣。潜在种子内生菌的最令人感兴趣的特性是它们垂直传播和养护到下一代的植物[6,8,9].
大米(奥雅萨苜蓿L.)Harbors各种植物Endophytes。主要在各种水稻品种中彻底调查了重氮脱节性社区[10.,11.].作为细菌内心细胞殖民和在水稻胸骨层中,它们将受到生物和非生物因素引起的植物生理变化的影响。稻米内体的几项研究已经表明,种子成熟期间的变化也导致态度的细菌组合物[12.].态度的内体是微生物,其由于其固有的特征和适应而在植物endosphere中成功殖民和存活[13.].在更大的程度上,基因型确定水稻品种不同内生细菌群落的组成[14.].植物的种子也包括在植物的根、茎和叶内部结构中发现的主要细菌群。它们主要属于α-、β-和γ-变形菌门、厚壁菌门、拟杆菌门和放线菌门[15.],从不同的种子来源分离出来[9,表明种子内生菌广泛存在。Hardoim等人[8[还表明,传播水稻种子内体细胞,种子归播的内心细胞应对外部环境的变化和宿主植物的生长条件。
土壤盐碱化是由于盐的积累,特别是氯化钠的积累,即使在灌溉景观下,也会影响农田及其植被[16.].对于植物来说,它们对盐度有时间依赖性的反应,从水分胁迫效应开始,最终导致开花时间改变,种子产量减少,甚至生长终止[17.].一般来说,水稻对盐的敏感性中等,但一些品种具有一定的耐盐性,使它们能够在盐胁迫条件下维持生长[18.].敏感品种比耐受品种更快地积聚离子[17.耐受耐受机制,涉及排除或减少Na吸收和增加的k的吸收增加[18.].盐敏感型和耐盐型水稻在生理上存在差异,但在高盐和长时间暴露条件下,盐敏感型和耐盐型水稻在生理上仍受影响。在提高生理耐盐性的探索中,高产盐敏感水稻和耐盐但产量低的水稻杂交产生的杂种优势是一种有效的选择[19.].建立杂种细菌内生菌的群落结构和多样性模式,也有助于我们了解寄主耐性与其内生菌群之间是否存在潜在的相关性。
将种子相关的微生物社区一般来说。甚至更少的研究表明,将种子的内生细菌与其宿主的基因型相关,生理适应盐胁迫和宿主系统发育相关性。还没有关于盐胁迫对传播种子内科群落的影响到这一日期的研究,特别是对盐度不同程度的水稻品种。在这项研究中,通过T-RFLP分析和克隆文库的T-RFLP分析和16S rRNA测序来完成种子细菌群落的综合分析,并在六种水稻品种内进入种子内食体多样性的洞察。还研究了在不同土壤盐度水平下生育的生理不同品种的种子的种子对盐胁迫的影响。目的是比较几种籼簇稻米种子中细菌内心细胞的结构和多样性,因为受其宿主特征的固有差异的影响,然后通过外部因素特别是盐胁迫的影响。
方法
研究6个水稻品种种子细菌群落的种子样本
为了比较不同水稻品种的群落结构和多样性,以及寄主特性对种子内生菌群落的潜在影响,选择了6个水稻品种。本研究中使用的6个不同品种的所有种子均来自韩国农村发展管理局(RDA)(附加文件)1:表S1)。研究共包含6个基因型,代表不同的品种。筛选出5个耐盐品种,分别为IR669646-3R-178-1-1 (FL478)、CSR 28 (IC27)、IR55179-3B-11-3 (IC31)、IR58443-6B-10-3 (IC32)、IRRI154 (IC37)和1个盐敏感品种(IR29)。IC27、IC31、IC32和IC37为耐盐性试验品种。IR29是一个钠积累系,在植物生长发育的早期和成熟阶段对盐敏感。FL478是盐敏感品系IR29和一种耐盐钠(不包括Pokkali)的杂种[20.].IC27和IC31有一个共同的亲本,IR4630-22-2-5-1-3,也是Pokkali的远亲。IC32的父母之一也可以追溯到Pokkali。IC37具有不同于其他品种的亲本。本研究中所有品种均属于oryza sativa ssp。indic.种子萌发于2014年5月开始,6月份进行了幼苗移植。所有种子样本从8月到2014年9月初收获。每种水稻品种的复合样品由生长在田地生长的收获植物制成。用于DNA和细菌分离的所有种子都是新鲜的。种子也在4℃下储存而没有任何种子处理以进一步使用。
水稻种子表面消毒
还通过依赖于培养依赖性方法评估来自六种品种的水稻种子的细菌群落。根据Hardoim等人进行水稻种子的表面灭菌。[8].在无菌条件下,净化钳是用来消除水稻种子的外壳(1 g)。随后surface-sterilization 30°C 25分钟完成一个轨道瓶(200 rpm), 50毫升溶液含0.12%次氯酸钠(NaClO)和盐(氯化钠0.1%的碳酸钠,3%,0.15%的氢氧化钠)(21.].通过用50mL 2%硫代硫酸钠洗涤实现表面粘附的NaClO [22.]重复两次,30°C,轨道振动(200转/分)10分钟。用无菌蒸馏水冲洗种子5-8次,室温下用100毫升高压灭菌去盐水复水至少1小时。将100 μL的最终漂白剂涂布于R2A琼脂平板上,在28℃下孵育7天,验证其杀菌效果。
可耕种的微生物种群
表面消毒的种子用蒸压的研钵和杵磨碎。可栽培的种子内生细菌的数量是由计数集落形成单位(CFU) R2A (DB - Difco)板使用扩散板技术系列稀释后均质表面消毒种子样本(1.0 g)。十倍系列稀释了100μl整除被传播到三R2A琼脂每次稀释复制。平板在28°C孵育。每24 h计数一次,连续6 d。根据菌落的颜色和形态,从每个培养皿中选择独特的细菌。通过16S rRNA基因序列分析鉴定细菌分离株。
盐胁迫条件下盐敏感和耐盐水稻种子细菌内生菌的研究
从六种水稻品种中,选择三个以代表水稻宿主,具有不同水平的盐胁迫的生理耐受性:盐敏感,IR29;适度耐盐,IC32;高度耐盐,IC37。除了对盐胁迫的生理耐受性,还选择了三种品种,因为它们具有最多样化的内生群体,并且它们不会通过父母血统直接联系。如上所述,水稻种子的表面灭菌。种子在4.405 g l中无菌地萌发- 1Murashige和Skoog培养基(Duchefa)添加4 g L- 1植tagel (Sigma) 3天。将发芽的种子转移到苗盘或苗床上。播种后约21天至1个月,将5株秧苗放入装有4.5 kg水稻土(化学特性:pH 6.1;电导率(EC) 0.65 dS m- 1;有机物1.28克公斤- 1干燥的土壤;阳离子交换容量(CEC) 1.53 cmol (p+);全氮含量0.03%;可用P2O531.34毫克公斤- 1干燥的土壤;K 0.3 CMOL kg- 1干燥的土壤;加利福尼亚州2+0.21 cmol kg- 1干燥的土壤;Mg 0.44 CMOL kg- 1干燥的土壤和Na 0.11 CMOL公斤- 1干土)。这些土壤是从韩国忠北国立大学的稻田中收集的。对未蒸压的水稻土也进行了N、P处理2O5和K.2O根据RDA的水田施肥量(n110 kg hm2)- 1;P2O545公斤哈- 1和K.2o 57 kg ha- 1).这些植物被保存在忠北大学的温室里。移栽两周后,秧苗减薄到每盆3株。保持水位在离土1cm左右。营养生长3个月后,对水稻进行2个水平的盐胁迫,4 dS m- 1(~ 40 mM NaCl) and 8 dS m- 1(~ 80 mM NaCl)。盐浓度是根据土壤使用量计算的。例如,在4.5 kg土壤中添加10.5174 g NaCl,达到40 mM NaCl浓度。为避免渗透休克,每天在每个锅中加入10 mM NaCl,逐渐加入盐溶液,80 mM NaCl, 8天后达到期望的盐浓度。用一升水使每个罐子里的土壤完全饱和。在盐胁迫过程中,土壤的水饱和点全天保持不变。为试验准备了每个品种、每个盐水平5个重复盆。从复制花盆中采集成熟种子的复合样本,在阳光直射下干燥3天,并在4°C下保存用于提取DNA。2016年4月开始种子萌发,7月施盐,8月底至9月初收获种子。
16S rRNA基因序列分析
对内生细菌的纯培养物进行16S rRNA序列分析。在营养琼脂平板上生长分离物。提取基因组DNA,使用PCR使用引物27F:5'-Aga GTT TGA TCC TCC TCC底漆和1492R:5'-GTT TAC CTT GTT ACG作用T-3'作为反向引物[23.],然后通过荧光染料终止子法(ABI Prism™Bigdye™terminator cycle sequencing ready reaction kit v.3.1),使用PCR-direct sequencing鉴定16S rRNA核苷酸序列。使用Millipore-Montage染料去除试剂盒对产品进行纯化,并在ABI3730XL毛细管DNA测序仪中使用50cm毛细管进行测序。将获得的16S rRNA序列在EzTaxon服务器(https://www.ezbiocloud.net/)[24.].系统发育分析使用MEGA version 6进行[25.],由CLUSTAL W对数据进行多次比对[26.].根据jukes和cantor模型进行DNA取代[27.]使用邻接方法进行聚类[28.].节点的统计置信度通过使用1000次重复的bootstrapping估计[29.].16S rRNA基因的核苷酸序列保存在GenBank®数据库中,登录号为KY393309-KY393357。
总DNA提取
根据Johnston-Monje和Raizada的研究,种子的总基因组DNA提取已经完成[6]每种基因型的1克表面灭菌种子在高压灭菌研钵和杵中研磨。1毫升50毫米Na2HPO4添加每克种子干重的缓冲液。按照制造商的协议,使用DNeasy Plant Mini Kits(美国Qiagen)从0.1 g提取物中提取总基因组DNA。还使用Nanodrop2000(Thermo Scientific)对DNA浓度进行定量。
PCR扩增为T-RFLP
根据Johnston-Monje和Raizada [6].使用以下组分进行PCR MasterMix:2.0μL标准Taq缓冲液,0.8μl25mm,每个DNTP混合,0.5μl10μm27f-degen引物,序列Agrrttygatytytyag [30.](其中r = A + G,Y = C + T,M = A + C),0.5μl10μm1492R引物,序列GGTTACCTTGTTACGACTT [30.],0.25μL标准Taq,20ng总DNA,最终体积高达20μL,具有双蒸水。使用以下程序进行PTC200 DNA热循环仪(MJ Scientific,USA)中的25个循环进行扩增:96℃,3分钟,25×(94℃,30s,48°C,30 s,72°C1分钟30 s),72℃7分钟。
为了增加总DNA扩增量,第二次巢式PCR的反应混合体积为50 μl。反应液由标准Taq缓冲液5.0 μl、dNTP混合物25 mM各4.0 μl、799f引物2.0 μl、1492R引物2.0 μl、标准Taq 0.3 μl、10 μl 2.0 μl组成- 1PCR产物从第一个PCR反应,并双蒸馏水总共高达50.0μL。对于嵌套的PCR,底漆799F,序列aacmggattagatackg [31.](其中M = A + C,K = G + T)用6FAM标记,1492R引物,序列GGTTACCTTTGTACGACTT [30.使用了。被选择的正向引物799f,因为它是强烈反对放大叶绿体的16S rRNA [偏置31.];更大的线粒体18S片段经过扩增和限制后在硅胶中去除。在PTC200 DNA热循环仪(MJ Scientific, USA)中扩增25个循环,程序如下:95°C 3 min, 25×(94°C 20 s, 53°C 40 s, 72°C 40 s), 72°C 7 min。
种子细菌16S rRNA克隆文库的建立和测序
Fifty μL of each PCR product was run on an electrophoresis gel, and the 730 bp (bacterial 16S) and the ~ 850 bp (mitochondrial DNA) were gel extracted and ligated to PCR cloning vector (T-Blunt, Solgent) according to the manufacturer’s instructions. Thirty clones from each transformation were screened by colony PCR using plasmid primers M13 Forward and M13 Reverse, combined with amplified ribosomal DNA restriction analysis (ARDRA) [32.和DdeI和HhaI。将具有明显限制性内切模式的克隆进行M13正向和M13反向菌落PCR测序,测序后与细菌分离株进行鉴定和分析。将克隆序列提交到Genbank,登录号为KY862075 - KY862113。为了从克隆和培养中预测片段大小,将序列提交给in silicon T-RFLP分析程序TRiFLe [33.].
限制性内切酶消化
PCR纯化产物分别用DdeI、HaeIII和HhaI三种限制性内切酶进行酶切。酶切量为4 U各0.8 μl, 10×缓冲液(缓冲液C分别用于HaeIII和HhaI) 2 μl, 10× BSA和MilliQ水2 μl,根据PCR纯化产物(1.0 μg/μl)的体积调整,总体积为20 μl。用HaeIII、HhaI和DdeI酶在37℃下消化16 h。所有酶和试剂均来自美国Promega。酶解产物采用2% qa琼脂糖TM凝胶电泳分离检测。在琼脂糖凝胶上负载5 μl酶解产物和6×染料。
分级
为了确定终端限制片段(T-RFS)的精确长度,将1.5μL摘要与9μLHI-DI™甲酰胺(ABI)和0.6μL尺寸标准(500ROx,生物绒)混合。将样品在95℃下变性3分钟,然后在冰上置于冰上5分钟。在自动ABI 3130DNA测序仪(Applied Biosystems,USA)上测定限制性片段的尺寸。通过使用GeneMapper,Ver检测和分析荧光标记的5'T-RFS。3.7(应用生物系统),带大小映射器(500 ROX)。对六种水稻品种的所有种子样品重复DNA提取,扩增,限制和分析,并将结果合并在一起。盐胁迫效果的T-RFLP分析仅进行一次。
分析
对从单个T-RFLP谱中识别的T-RF峰进行汇编、整理和调整以进行统计分析。为了补偿样品间PCR产物数量和T-RFLP谱线强度的差异,我们将每个样品的峰面积除以对应样品的所有峰面积之和来计算相对丰度[34.].丰富度(S)由电图中是否存在RF波段来决定。利用公式确定Shannon多样性指数(H’)H'=-σ(P.一世)(ln.P.一世), Shannon均匀度(J ')计算为J ' = H ' /ln(S), Simpson指数(1/D) = 1/∑pi2。在这些等式中,P.一世为T-RFs的相对丰度,ln为自然对数,S为物种数,D为辛普森优势度指数,辛普森优势度指数与多样性成反比。采用单因素方差分析(one-way ANOVA)和SAS (ver9.4) Tukey检验比较各处理间的多样性指数。采用美国Statsoft公司的STATISTICA (version 8.0)统计软件包,分别采用Shapiro-Wilk检验和Levene’s检验对数据进行正态性和同方差检验。一些数据经过了能量转换(从Y2玩具4)为了满足ANOVA所需的差异的均匀性的假设。当数据不符合数据转换时,使用统计数据的统计包和DUNN的测试分析平均值之间的差异。尽管数据转换,数据不符合ANOVA的假设。
使用Primer V.6软件包通过非化多维多维缩放(NMDS)分析T-RFLP数据集。简而言之,将每个T-RFLP数据集导入引物V.6,并且使用Bray Curtis系数计算相似性矩阵。然后使用MDS过程来符号100随机开始后的相似性数据。使用Kruskal的压力配方计算良好或压力:压力 = √ΣH,一世(d你好——ď你好)2/Σh,我D.2你好), 在哪里,D.你好是样本之间的符合距离H和一世, 和ď是从回归预测的距离。Anosim(相似性分析;底漆6)用于评估型材组合物的显着差异。为每种消化酶进行NMDS armination和相关的Anosim试验。使用Matrix2Png接口进行使用热带的相对丰度的可视化(http://www.chibi.ubc.ca/matrix2png/bin/matrix2png.cgi).
结果
在不同品种水稻种子内生社区
根据其特征选择并收获在RDA(韩国)实验领域的正常土壤条件下生长的六种水稻品种。使用培养依赖性技术以及独立于T-RFLP培养的技术,研究了种子内生成的组成和多样性,以植物基因型,宿主系统发育相关性和盐度耐受性。
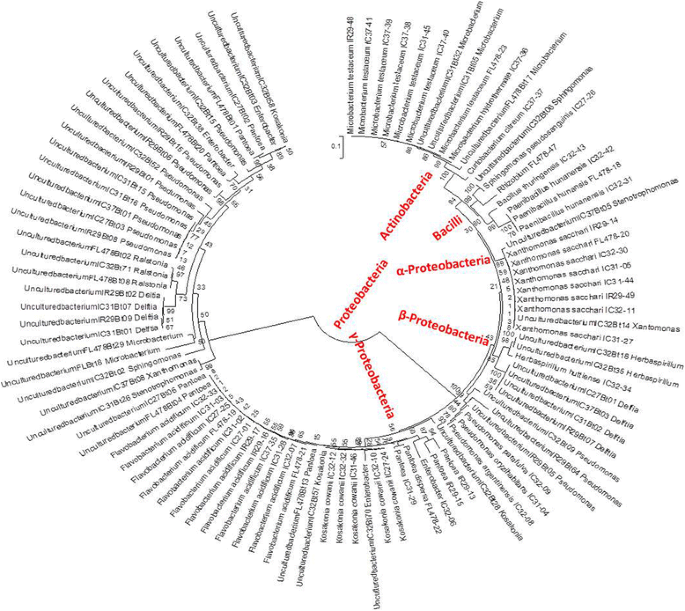
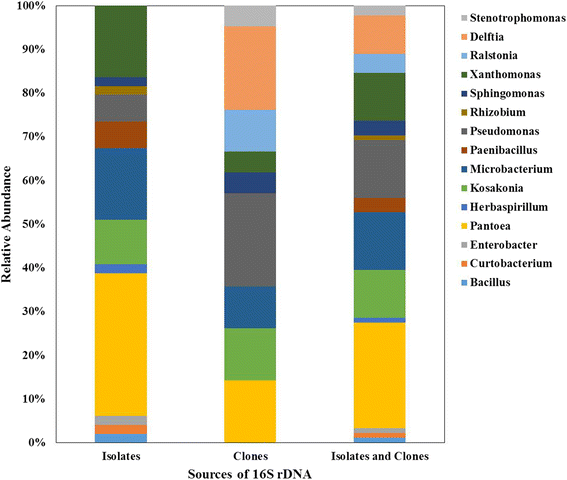
在耐盐和盐敏感品种中评估了水稻种子内生细菌群落的数量(附加文件)2:表S2)。变形菌纲、放线菌纲和杆菌纲共12属18种。结合两种菌株和克隆文库,籼稻种子内生细菌群落以变形菌门(82%)为主,其次是放线菌门(14%)和厚壁菌门(4%)。1).在属水平上,Pantoea主导(22%),然后是假单胞菌(16%),小细菌属(13%),Kosakonia(10%)和Xanthomonas.(10%)(图。2).
水稻种子内生菌的T-RFLP分析显示其细菌多样性相当复杂,与DdeI、HaeIII和HhaI三种限制性内切酶产生的群落谱相比较,它们的多样性相当复杂。品种间多样性指数各不相同,但在所有T-RFLP图谱中表现出大致相似的趋势1)DdeI、HaeIII和HhaI消化的丰富度分别为5-15、8-11和11-15 T-RFs,其中盐敏感菌株IR29的核糖型数量通常高于大多数其他耐盐品种。中等和强耐盐水稻之间的多样性不太可预测,并且很可能是attr这是由于品种间的内在差异,而不是对盐胁迫的生理适应,尽管品种间存在显著差异。
常见核型和基因型特异性核型在不同品种、系统发育相关的寄主和对盐胁迫生理适应差异的寄主之间的发生
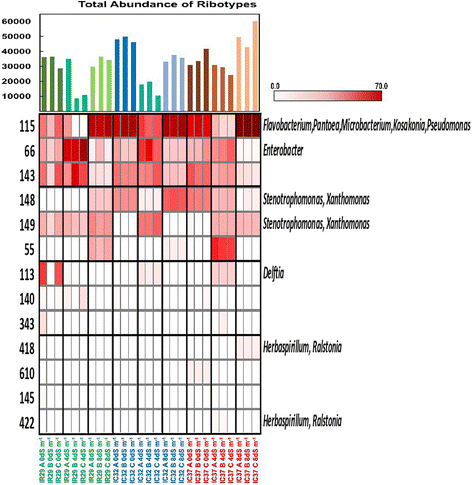
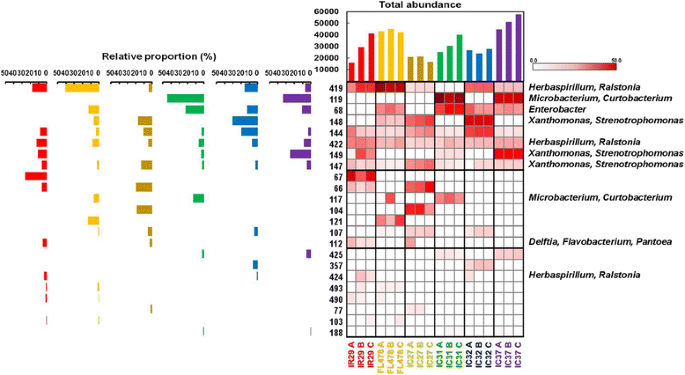
使用Ddei,Haeiii和Hhai限制酶的稻种子的T-RFLP分析显示出常见的T-RFS或核糖或核糖的常见特异性T-RFS的模式,系统血症相关宿主和宿主的生理耐受性差异盐胁迫(图。3.,附加文件3.:图S1,附加文件4:图S2)。常见的核查似乎是独立于不同因素,并出现在本研究中被考虑的籼型亚种。另一方面,独特的核科人的出现主要归因于米的特定基因型在观察到的地方。
T-RFLP图谱显示,在所有三种限制性内切酶中,品种间观察到共同的T-RFs。在所有水稻品种中,DdeI有3个(64,506,355),HaeIII有3个(144,422,147),HhaI有3个(353,322,189)常见核型。利用扩增16S rRNA基因的可培养库和克隆库追踪T-RFs的身份表明,共同的T-RFs是属成员铜段(506),Xanthomonas.(347和346)和Delftia(64)使用DDEI限制酶。在Haeiii消化中,T-RF 422属于草螺菌T-RF 147归因于Xanthomonas.和Stenotrophomonas..在HHAI概况中观察到的常见T-RF,353归因于Xanthomonas.和小细菌属.另一方面,黄芪/Pantoea在除IC31之外的大多数品种中单独检测信号(图。3.,附加文件3.:图S1,附加文件4:图S2)在不同的T-RFLP配置文件中;虽然黄芪分离自IC31的菌株(图。1).
与生物相关的品种相比,在耐盐性水稻品种的较高出现中观察到常用的T-RFs的存在。仅在耐盐品种中发现的候选核髓培养物包括T-RFS 240和347(DDEI)归因于Pantoea,黄芪和Xanthomonas.;识别为T-RF 68 (HaeIII)肠杆菌属;T-RFs 75和177 (HhaI)属于Sphingomonas和假单胞菌,分别。
在HHA I(T-RF 82)中的父子粥样格式(IR29和FL478)之间只有一个纤维型在半兄弟(IC27和IC31)之间。在包括T-RFS 104和148和T-RF的461的Pokkali(FL478,IC27和IC32)的后代品种中也存在少数核髓型,尽管在另一个Pokkali后代IC31中未观察到它们。
唯一T-RFs的出现是该品种的一个特征,可能是由于更复杂的因素(见表)2).在基于不同限制性内切酶的T-RFLP图谱中,IR29始终具有最多的独特T-RFs, DdeI、HaeIII和HhaI中分别有40%、33.3%和33.3%的独特T-RFs。中等耐盐品种的特异T-RFs范围为0 ~ 42.9%,高度耐盐品种的特异T-RFs范围为0 ~ 21.4%。虽然T-RFs的发生可能受到宿主系统发育亲缘关系和对盐胁迫的生理适应等因素的影响,但每个基因型似乎都获得了自己的基因型特异性T-RFs。它们的发生可能是由于品种的内在差异,而不考虑寄主的系统发育关系、生理相似性或其他归属因素。
种子细菌内生菌的群落结构与优势T-RFs有关
基于丰度的分布和等于丰度的不同T-RFS的分布和等同表示的细菌内心细菌的群落结构在各种品种下显着不同(表1).一些品种如IC32和IC27一致地表现出核糖型的均匀分布,并且其各个T-RFS的丰度并不极端。IC31始终显示出显着降低的均匀性,表明存在在丰度方面具有更大的T-RF。与大多数研究中的大多数品种相比,IC37也显示出在Haeiii和Hhai T-RFLP型材中显着降低的均匀性。无花果。3., S1图和S2图主要根据片段或核型的丰度进行排列。最丰富的T-RFs可能是每个品种的优势菌群,并可能影响宿主植物的发育过程。有趣的是,在所有不同的品种中也发现了一些占优势的T-RFs,如片段64 (Delftia), 144(身份不明)和422 (草螺菌)在Haeiii和353(Xanthomonas.,小细菌属在河海(不明))和322(不明)。还有几种T-RFS在特定品种上是独特的,占主导地位。
水稻种子内科群落受基因型影响,生理适应盐胁迫和宿主发育相关性
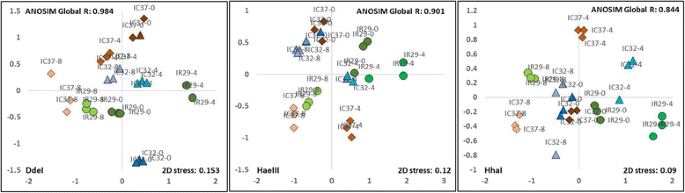
为了根据T-RFLP图谱和丰度比较不同水稻品种内生细菌种群的总体相似性和差异性,进行了NMDS分析和聚类分析(图。4和额外的文件5:图S3)。NMDS秩序中点之间的距离反映了样品中细菌群体的相对相似性。更相似的品种符合较近的植物。用限制性酶Ddei,Haeiii和Hhai的消化表现出所有品种中内生细菌社区的独特分离。对于所有水稻样本的全球R的值1或接近1的值以及品种之间的R值表明组之间的异化,并表明细菌结构对个体基因型或品种的依赖性。在所有T-RFLP配置文件中,克鲁斯的应力值低于或等于0.1,表明NMDS矩阵点之间的关系的公平表示。通过对不同品种的T-RFLP谱相似性的相似性试验分析,还明确建立了基于品种的细菌群落的不同分离。
结合NMDS和聚类分析的结果显示水稻品种分组的模式(图。4和额外的文件5:图S3)。每种品种形成明显的簇,表明基因型是形成籼型种子的内生细菌群落的主要效应器。在某些品种中也可以看出宿主发育相关性的影响,但是在一些品种时也可以在与研究中包括的品种的家谱相比时不如当时的那样一致。IR29和FL478的父母效应仅在HHA I中观察到,在那里他们统一地统一。与其他品种相比,表兄弟FL478和IC32始终统一,显示其常见的父母谱系(Pokkali)和生理相似性与盐胁迫耐受性的潜在贡献。另一方面,半兄弟姐妹IC27和IC31始终彼此统一,而不是由于他们的共同父母,IR460-22-2-5-1-3导致他们具有更高的相似性。生理适应对盐胁迫的影响似乎对基因型后对水稻品种的聚类和排序表现出更大的贡献。基于DDE的T-RFLP轮廓我表明,用IC27作为异常值更为严格地符合IC27的中等耐受品种IC32,FL478和IC31。Haeiii和Hai社区型材的排序显示基于盐度耐受的品种分离,其中品种通常根据其盐度耐受性作为盐敏感,适度耐受性和高耐受品种。P在P(%) = 0.1时,对DdeI、HaeIII和HhaI的ansim值是显著的6).
虽然每种水稻品种具有不同一组内心种子细菌群落,但它们的微生物群的整体聚类和相似性表明,本研究中包含的籼稻的籼稻具有高度的共性。DDEI和HAEIII T-RFLP概况的群体相似度高于30%,而河海档案总体相似性大于40%(附加文件5:图S3)。
土壤盐分对水稻种子内生植物群落的影响
来自盐度不同程度的品种的稻种具有细菌内心细胞,当他们的宿主植物经历不同水平的土壤盐度时,响应不同。盐敏感品种IR29的种子内心细胞的多样性下降4 ds m- 1和8ds m- 1与非应力条件相比(表3.).另一方面,中度耐受IC32和高度耐受IC37的细菌内生菌表现出不同的反应。中度土壤盐分胁迫在4ds m- 1似乎诱导了细菌丰度的更均匀分布,尽管IC32中物种丰度没有显著变化。这可能导致IC32在中等盐度下的多样性指数较高,部分在HaeIII和HhaI群落剖面中观察到。高耐盐品种IC37在中等盐度下总体表现出显著的丰富度、均匀度和Shannon指数。8 dS m高盐度- 1降低了耐盐水稻品种IC32和IC37种子内生真菌的均匀性和多样性指数(表4和表格5).
盐敏感型和耐盐型水稻在不同盐胁迫条件下的核型或T-RFs显性模式存在普遍差异(图2)。5,附加文件7:图S4,附加文件8:图S5)。如在Haeiii,Hhai和部分在Ddei T-RFLP型材中观察到的,盐敏感品种IR29在正常情况下在少量核髓型之间具有更高的丰富。当盐胁迫被诱导到土壤中时,在4 ds m观察到的单个玻璃型有丰富的大部分- 1和8 ds m- 1.例如,在HhaI图谱中,327型核糖体几乎同样占优势(小细菌属,黄芪,Pantoea, 和Kosakonia), 322 (肠杆菌属),部分由353型核糖体产生。在4和8ds m- 1,细菌群落由单个核型分别为322和327主导。同样的情况也可以在HaeIII概要文件中描述。中等耐盐和高耐盐品种IC32和IC37的种子内生菌反应不同。一般来说,非胁迫条件下的显性核型也是盐胁迫条件下的显性核型。IC32以115型核糖体为主(黄芪,Pantoea,小细菌属,Kosakonia)在0和8ds m- 1,部分和部分在4 ds m- 1如HaeIII配置文件所示。在HhaI图谱中,IC32也以327型核糖体为主(小细菌属,黄芪,Pantoea,Kosakonia)第二,第二次(肠杆菌属)这也是盐胁迫条件下的显性核科。对于高耐盐性品种,IC37也观察到相同的一般图案。
除了含有土壤中种子的群落结构的细菌内心细胞的相对丰度的一般波动之外,社区的较少的占优势(丰富)成员也可能在盐胁迫条件下未被发现。在诱导盐胁迫下也存在几种较少的显性核髓型。对于不同限制酶谱的所有品种观察到这些。例如,在IR29的HAEIII分布中(图。1),在正常条件下检测到核糖型140和145,但在盐胁迫条件下消失。相反,在正常情况下未检测到核髓型55,但在8 ds m下检测到- 1.
在不同盐胁迫条件下生长的三种水稻品种中细菌群体的NMDS分析表明,基因型和土壤盐度的相互作用是影响种子内心细胞群落结构的主要因素(图。6).种子细菌群落的聚类表明,基于在某些盐胁迫条件下生长的特异性品种,然后是土壤的盐度水平。P在P(%) = 0.1时,对DdeI、HaeIII和HhaI的ansim值是显著的9).
讨论
本研究旨在了解水稻的生态学、群落结构和多样性。奥雅萨苜蓿L.过磷酸钙。indic)种子内生菌。利用培养依赖和培养独立的方法,我们获得了水稻寄主基因型、生理和寄主系统发育亲缘关系影响内生细菌多样性的复杂图像。通过T-RFLP分析,我们发现水稻种子内生菌的群落结构和多样性主要由其共同的内生菌和基因型特异的内生菌组成。3.,附加文件3.:图S1和附加文件4:图S2)。这些常见的内心内体代表了潜在的“核心内生微生物群”,其在所有品种中存在,而不管宿主植物的固有特征。宿主因子有助于水稻种子的内生细菌群落作为基因型,生理适应盐胁迫和宿主系统发育关系在塑造内生成的社区中起作用。(无花果。4和额外的文件5:图S3)。当在不同的盐胁迫条件下生长时,观察到土壤盐度的效果影响种子细菌内心细胞,因为核髓型在不同的土壤盐度条件下的相对丰度波动(图。5,附加文件7:图S4和附加文件8:图S5)和基于基因型和盐度的细菌群落(图5)。6).
水稻品种的主要种子细菌内心群
在不同种子中发现的细菌内心细胞的群落结构和多样性似乎主要取决于宿主的特异性种类或基因型,并通过多种因素塑造,最终导致相对不同的内生社区独特地与宿主的内心区别。每种水稻品种都有自己的细菌,甚至或更大的群体和不同的多样性发展到相对富裕的群体中。每个品种的结构和多样性可能是独一无二的,但主要种子细菌内心细胞似乎遵循比例的一般趋势。γ曲线杆菌占大多数细菌内心细胞(63%),然后是betaproteobaction(15%),actinobacteria(14%)和少数alphaproteobacteria(4%)和杆菌(4%)的少数代表。在Endophytes的其他研究中也观察到这些主要细菌组[15.]还有水稻的根部[35.].测序细菌的荟萃分析还表明,细菌内生菌在很大程度上是在四个主要细菌门即变形菌,放线菌,硬壁菌和拟杆菌[表示36.].
有大米籼亚种间存在核细菌内生微生物
本研究中的水稻品种属于oryza sativa ssp。indic,所有这些都经历了重复的近亲繁殖,以便从原始杂种中创造纯粹的自交系。它们是人杂交方法的产品,其目的是获得所需的特征,通常是耐盐性和高产率,其中父母还属于籼簇(Irri,RDA)。尽管选择和育种具有导致基因型的差异,但对盐胁迫和分支父母的生理耐受性,籼型种子保持了一种有关细菌的共用细菌,可能存在于其他籼稻和相关水稻物种中。T-RFLP对种子内体的分析表明,有几种细菌内心细胞,每个属潜在含有所有水稻品种共同的细菌种类。这些包括Xanthomonas.,铜段,草螺菌,小细菌属,Delftia和Stenotrophomonas..这在培养的细菌分离中也是一致的,特别是黄芪,Xanthomonas.和小细菌属其中类似的细菌菌株来自众多品种的隔离。表征和从不同水稻品种这些培养的细菌内生菌的基因指纹指出在几个个别细菌物种与来自所有水稻品种分离的菌株[37.].这些共享或共同的细菌物种的存在也表明核心微生物群是保守的,并从它们的祖先系垂直地代代传递到现代宿主品种[6]。在其他研究中,这些核心微生物群落也被视为常见的水稻种子内生菌:Xanthomonas.[38.],铜段[8,39.],小细菌属,Stenotrophomonas.[8];但可能不会被排除在种子中,因为它们也会殖民地殖民地障碍。类似细菌社区的发生indic亚种与其他亚种相比较已被部分观察到奥雅萨苜蓿[14.],并且有细菌内生菌的垂直传播从种子到幼苗[8]和寄主植物的不同谱系[6]以及水稻叶片中强相关内生菌的发生[40]本研究的结果表明,所有籼稻品种中都存在核心微生物群,这可能表明内生真菌从种子到成熟寄主植物以及从祖先寄主植物到许多现代籼稻品系的高度传播。这解释了水稻核心内生菌的持久性和保守性,而不是从土壤中选择寄主。本研究还部分观察到内生真菌在下一代寄主植物种子间的传播。在IR29、IC32和IC37的原始种子中检测到的细菌内生菌群也是对土壤盐分变化作出反应的群体,当种子复垦后,施加盐胁迫。一般来说,籼稻种子含有相同的细菌内生菌群,其相对丰度随着环境条件的变化而变化。其中一些类群可能是水稻的核心微生物内生菌。内生菌的持续存在和垂直传播也表明了其与宿主的共生或良性寄生的进化形式[41].所有品种中核心微生物群的普遍丰度也表明了它们在不同品种间潜在的功能和共同进化的重要性。
在水稻品种中据报道不同内圈地区的内生多样性,但为我们自己的知识,这是第一份提出核心微生物群的报告oryza sativa ssp。indic居住在种子里。在本研究中,核心内生菌通常存在于籼稻种子中,无论基因型、寄主系统发育相关性和对盐胁迫的生理耐受性如何。这些核心内生菌也可能与水稻有较高的关联,并能在水稻寄主中持续传递和保存。这表明,有必要研究核心内生菌与寄主的相互作用机制,以了解内生菌如何在植物内层持续存在并持续调节植物的生长和健康。阐明植物与内生菌的相互作用也有助于我们利用内生菌作为生物接种剂,自然地、可持续地促进水稻等重要农作物的生长和产量。
细菌群落和水稻种子的多样性受其宿主基因型的影响,生理适应盐度应力和宿主系统发育相关性
细菌内生菌的群落和多样性是由多种因素决定的,包括生物和非生物因素,最终决定植物的群落结构、种群、多样性和不可分离的微生物区系的功能[42].需要很大考虑的重要因素是宿主植物:其基因型,生理学,发育阶段和内心病原体 - 宿主相互作用尚待考虑。尽管植物宿主因素推出了重要性,但对这些因素的直接影响的研究有限,宿主植物因素,非生物因素及其对常规内心和社区结构的相互作用的整体知识远未完成。本研究表明,在类似的正常环境条件下,水稻的种子细菌内合体主要由宿主基因型,生理适应盐胁迫,部分通过宿主发育相关性。在不同的研究中,基因型是在同一物种的品种中确定不同细菌群落的关键因素[14.],在系统发育相关的宿主中[6],在寄主植物的不同条件下[43]并跨越不同植物物种受时间和空间环境变化的影响[44].本身,宿主植物的类型对群落结构和内心体的多样性具有累积影响。即使在籼簇内的高度相关的宿主植物之间观察到这一点,其中每种品种都会发展与其他品种相关的细菌群体,而是彼此独特地表明。此外,尚未彻底研究了生理差异对相关宿主植物之间的种子内科多样性和结构的影响。我们的研究表明,不同品种的盐度的生理耐受性对水稻种子的群落结构具有添加剂。宿主的生理差异似乎还赞美细菌内心细胞调整到宿主的生理学,如病原体和易感马铃薯的情况下[45]高营养利用效率水稻品种免受较低营养利用效率品种[14.].在这项研究中,仅存在耐盐品种的几个T-RFS。然而,常见核型的发生程度越高,无论生理差异如何表明,栖息种子圈居住的大多数内心体都适应高渗透压[12.[通常能够存活高于或等于6%盐浓度的耐盐剂也是耐盐剂[37.].
居住在种子中的细菌内心内体反应变化的土壤盐度条件
盐胁迫不是奇异的应力,而是由影响植物的互联因子组成。它会导致盐毒性,这是纳的不成比例存在+在植物的细胞和细胞外隔室中[17.,渗透性问题[46[反应性氧物质的诱导和积累[47],以及对必需营养素摄取的干扰[46].这些相互联系的盐胁迫条件可直接或间接地影响水稻的内心细胞,因此也决定了种子细菌群落。此外,在盐胁迫条件下,驻留在水稻内部层间的种子细菌内心细胞通过宿主植物和土壤盐度水平的基因型形状。种子细菌内心内体对其变化的环境条件造成的土壤盐度及其对宿主植物生理学的影响。在植物中,在特定的土壤和环境条件生长的植物中也观察到,导致内心过度响应并成为能力[8]以及芦苇和它们的古菌内生菌群落[48].由于盐胁迫损害的生长,内心的根系细菌社区也大大改变了多样性指数,社区结构和丰富Medicago Truncatula.[49].这些研究表明,随着寄主对不同环境条件的响应,特别是对土壤的响应,内生菌受到寄主生理的影响。不同的土壤可以直接影响寄主植物,也可以是植物内生菌的来源。由于寄主植物在不同的土壤中种植,这可能导致寄主的内生植物组成发生变化,但种子内生植物对这些变化作出响应[8使它们有可能通过种子传播和保存[6]种子内生菌也因所用土壤的不同而部分受到缓冲[50允许种子传播内生真菌,即使在不同的土壤或生态地理位置。
一些内生细菌群落在盐胁迫条件下也变得更加突出和显着。这表明它们对其他细菌群体的潜在重要性或适应性能力,因为它们成为关键的参与者,直接影响其宿主植物的存活率在压力条件下。关于内心细胞的一些研究还表明,存在与特定应力条件相关的社区变化[8,44,45].在这项研究中,某些群体在数量上的优势发生了变化,包括黄芪,Pantoea,铜段,小细菌属,Kosakonia和肠杆菌属.也存在一致的存在Stenotrophomonas.和Xanthomonas.尽管它们的丰度在不同的盐度水平下有所保持。分离物的特性[37.]表明了黄芪,Pantoea,Kosakonia和小细菌属当与其他内心基团和其生理特性相关时,应变通过它们的耐盐性,渗透耐受性和IAA产生。Yaish等人。[49表明,在盐胁迫条件下出现了一些内生菌,其中包括Flavobacteria,链霉菌素,肠杆菌属和假单胞菌在根的根源Medicago Truncatula..在我们的研究中,盐胁迫下的优势菌群在正常条件下已经存在,尽管它们的丰度较低。在生境诱导的胁迫下,环境刺激对真菌内生菌群落优势的影响也被观察到[51].
结论
籼稻种子内层内生细菌群落结构由寄主的基因型、对盐胁迫的生理适应和部分系统发育关系决定。本研究中所有水稻品种的群落组成也表明存在与水稻相关的潜在核心微生物群,它们最有可能通过种子传播。在土壤盐分条件下,盐敏感和耐盐品种的细菌多样性和优势度波动黄芪,Pantoea,铜段,小细菌属,Kosakonia和肠杆菌属一般成为主导团体Stenotrophomonas.和Xanthomonas.似乎在正常和盐胁迫条件下保持其丰富。本研究表明,水稻种子的内生型群落由宿主植物和外部环境进行调节。
参考
- 1。
植物根际和内层的植物促生菌:它们的作用、定植、作用机制及其利用前景。土壤生物化学。2010;42:669-78。
- 2。
McInroy JA, Kloepper JW。甜玉米和棉花内生细菌的种群动态。Can J Microbiol. 1995a; 41:895-901。
- 3.
关键词:棉花,玉米,内生细菌,土壤微生物土壤植物。1995 b; 173:337-42。
- 4.
Quadt-Hallmann A, Kloepper JW。棉花内生菌的免疫学检测与定位enterobacter asburiae.JM22在不同植物中的分布。微生物学杂志1996;42:1144-54。
- 5.
Mundt jo,hinkle nf。胚珠和种子内的细菌。申请环境微生物。1976年; 32:694-8。
- 6。
Johnston-Monje D,Raizada Mn。养护和多样性种子相关的内心体玉蜀黍属跨越进化,民族志法和生态学的界限。Plos一个。2011; 6(6):E20396。
- 7。
刘y,左路,徐L,邹y,宋W.杂交玉米种子中内生细菌群落多样性及其父母排。拱微生物。2012; 194:1001-12。
- 8.
Hardoim PR,Hardoim CP,面包车Overbeek LS,面包车Elsas JD。早期植物生长阶段的种子传播的内生大米的动力。Plos一个。2012; 7(2):e30438。
- 9.
王志强,王志强,王志强,等。植物种子内生真菌的种类、垂直传播及其与植物间的相互作用。环境Microbiol。2015;7:40-50。
- 10.
Barraquio WL,Revilla L,Ladha JK。湿地米饭中内生真正植物细菌的分离。植物土壤。1997年; 194:15-24。
- 11.
Elbeltagy A,西冈K,佐藤T,铃木H,叶B,滨田T,石和T,三井H,南泽K.内生殖和在植物中固氮由草螺菌sp。与野生稻种的隔绝。申请环境微生物。2001; 67:5285-93。
- 12.
Okunishi S,Sako K,Mano H,Imamura A,Morisaki H.细菌植物中栽培稻的成熟种子(奥雅萨苜蓿).微生物环境。2005;20:168–77.
- 13。
Hardoim Pr,Van Overbeek LS,Van Elsas JD。细菌内心细胞的性质及其在植物生长中的提出作用。趋势微生物。2008; 16:463-71。
- 14.
Hardoim PR, Andreote FD, Reinhold-Hurek B, Sessitsch A, van Overbeek LS, van Elsas JD。水稻根相关细菌:对10个品种群落结构的洞察。微生物生态学杂志。2011;77:154-64。
- 15.
关键词:细菌,内生菌,微生物,相互作用植物与微生物的互动。2006;19:827-37。
- 16。
Rengasamy P.世界盐碱化,重点在澳大利亚。J Exp Bot. 2006; 57:1017-23。
- 17。
Munns R,Husain S,Rivelli A,James R,Condon A,Lindsay M,Lagudah e,Schachtman D,野兔R.用于提高农作物耐受性的途径,以及基于生理学的选择特征的作用。植物土壤。2002; 247:93-105。
- 18。
水稻耐盐性的筛选。IRRI讨论论文系列。1997;22:1-30。
- 19.
鲜花tj。改善作物耐盐性。J Exp Bot。2004; 55:307-19。
- 20。
刘雪梅,刘雪梅,刘雪梅,徐建军,崔雪梅。盐胁迫下两种水稻基因型转录水平的比较分析。植物杂志。2005;139(2):822 - 35。
- 21。
Hurek T,Reinhold Hurek B,Vanmantagu M,Kellenberger E.植物的根定殖和系统传播azoarcus.草属BH72菌株。J Bacteriol。1994;176:1913-23。
- 22.
米凯L,用次氯酸钠水稻种子表面灭菌的Balandreau J.对接种Burkholderia Vietnamiensis..Appl Environ Microb。2001; 67:3046-52。
- 23.
德隆EF。古沿海海洋环境。Proc Natl Acad Sci USA。1992; 89:5685-9。
- 24。
介绍EzTaxon-e:一个具有系统类型的原核16S rRNA基因序列数据库。国际微生物学杂志。2012;62:716-21。
- 25。
Tamura K, Stecher G, Peterson D, Filipski A, Kumar S. MEGA6:分子进化遗传学分析版本6.0。生物学杂志。2013;30:2725-9。
- 26.
Thompson JD,Higgins DG,Gibson TJ。CLUSTAL W:通过序列加权,位置特异性空位罚分和加权矩阵选择提高渐进多序列比对的灵敏度。核酸RES。1994; 11:4673-80。
- 27.
jukes th,cantor cr。蛋白质分子的进化。在:Munro HN,编辑。哺乳动物蛋白质代谢。纽约:学术出版社;1969. p。21-132。
- 28。
Saitou N,Nei M.邻居加入方法:一种重建系统发育树的新方法。mol Biol Evol。1987; 4:406-25。
- 29。
系统发育的置信限:一种使用bootstrap的方法。进化。1985;39:783 - 91。
- 30.
Frank Ja,Reich Ci,Sharma S,Weisbaum Js,Wilson Ba,Olsen GJ。常用于扩增细菌16S rRNA基因的两个引物的关键评价。苹果envir microbiol。2008; 74:2461-70。
- 31。
Chelius MK, Triplett EW。古生菌和细菌的多样性与植物的根有关Zea Mays.L. microb Ecol。2001; 41:252-63。
- 32。
Gich FB,阿梅尔E,菲格拉斯JB,Abella联系CA,巴拉格尔MD,由扩增的核糖体DNA的限制性分析(ARDRA)微生物群落结构变化POCH M.评价。int microbiol。2000; 3:103-6。
- 33。
Junier P,Junier T,Witzel KP。Trifle:具有用户定义序列集的Silico T-RFLP分析的程序。申请环境微生物。2008; 74:6452-6。
- 34.
Barbendreier D,Joller D,Romeis J,Biger F,Widmer F.蜜蜂肠的细菌群落结构及其对两种杀虫蛋白的反应。有限元微生物ECOL。2007; 59:600-10。
- 35.
Sessitsch, Hardoim P,多尔J, Weilharter,克劳斯,Woyke T,米特B, Hauberg-Lotter L,弗里德里希·F, Rahalkar M, Hurek T, Sarkar, Bodrossy L, van Overbeek L, Brar D, van Elsas JD Reinhold-Hurek B功能特征的内生植物社区殖民水稻根系所揭示的宏基因组分析。微生物与植物的互动。2012;25:28-36。
- 36。
Hardoim Pr,Van Overbeek LS,Berg G,Pirttila Am,Compant S,Campisanto A,Dorling M,Sessitch A.植物中的隐藏世界:用于定义微生物内心细胞功能的生态和进化考虑。Microbiol Mol Biol Rev. 2015; 79:293-320。
- 37。
DI Walitang,Kim K,Madhaiyan M,Kim YK,Kang Y,Sa T.表征水稻种子内生细菌的内生能力和植物生长促进。BMC微晶体。2017;17:209.
- 38.
水稻植物内生细菌的研究。微生物环境。2008;23:109-17。
- 39.
Ruiz D,Agaras B,De Werrab P,Wall Lg,Valverde C.从阿根廷栽培的水稻种子中分离的细菌植物益生菌特征的表征及筛选。J microbiol。2011; 49:902-12。
- 40。
Ferrando L, Mañay J, Scavino A.分子和培养依赖分析揭示了三种水稻(奥雅萨苜蓿)品种。微生物生态学杂志。2012;80:696-708。
- 41.
ewald pw。寄生互相争夺连续箱的传输模式与演变。Ann N Y ACAD SCI。1987年; 503:295-306。
- 42.
Hallmann J,Quadt-Hallmann A,Mahaffee Wf,Kloepper JW。农业农作物中的细菌内心细胞。可以j microbial。1997年; 43:895-914。
- 43。
Andreote FD,Rocha联合国,AraújoWL,Azevedo JL,Van Overbeek LS。细菌接种,植物基因型和发育阶段对土豆根系相关和内生细菌群落的影响(马铃薯).雷文霍克。2010; 97:389-99。
- 44。
关键词:植物内生细菌,群落末端限制性片段长度,多样性,动态变化BMC Microbiol。2013;十三1。
- 45。
Sessitsch A,Reiter B,Pfeifer U,Wilhelm E.基于16S RRNA基因的细菌和放线菌特异性PCR的三种马铃薯品种中的细菌内心细胞培养的培养群体分析。有限元微生物ECOL。2002; 39:23-32。
- 46.
花tj,花朵sa。为什么盐度对植物育种者构成了这么难的问题?农业水管理。2005; 78:15-24。
- 47.
穆德加尔V,Madaan N,在植物耐盐性的穆德加尔A.生化机制:一个评论。诠释J植物学。2010; 6:136-43。
- 48。
马B,吕X,Warren A,龚J.普通芦苇根、茎和叶组织内生细菌和古细菌多样性和群落结构的变化,芦苇澳大利亚人,沿着盐度梯度,在中国北方的海洋潮汐湿地。安东尼·范·列文虎克。2013;104:759-68。
- 49。
Yaish MW,Al-Lawati A,Jana Ga,Vishwas Patankar H,Glick Br。土壤盐度对哈里发军团根源鉴定的细菌内生群体结构的影响(Medicago Truncatula.).Plos一个。2016; 11(7):E0159007。https://doi.org/10.1371/journal.pone.0159007.
- 50。
约翰斯顿-梦耶d,穆萨WK,Lazarovits G,Raizada MN。上的内生社区交换土壤的影响预驯养,古代和现代玉米。BMC植物BIOL。2014; 14:233。
- 51。
罗志强,李志强,李志强,等。植物环境适应共生对植物抗逆性的影响。ISME j . 2008; 2:404-16。
确认
我们要感谢郑光勇博士帮助我们获得韩国农村发展局(RDA)的种子。
资金
这项研究是由基础研究发展计划通过韩国国家研究基金会(NRF)由教育部,科学技术部(2015R1A2A1A05001885)资助的支持。
数据和材料的可用性
本研究中产生或分析的所有数据均包含在本文(及其补充信息文件)中,或在合理要求下可从通信作者处获得。
作者信息
隶属关系
贡献
DW和TS构思和设计了实验;DW - 进行实验并分析数据;DW和TR写了稿件;CGK - 进行多元分析以及多样性指数的正常性和同性恋测试;YKK - 稿件的关键修订;DW,KK,YKK,YK和TS-手稿准备和编辑。所有作者阅读并认可的终稿。
通讯作者
伦理宣言
伦理批准和同意参与
不适用
同意出版物
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
附加文件
附加文件1:
表S1。六(6)米品种的特征(奥雅萨苜蓿L.过磷酸钙。indic)来评估与种子相关的细菌群落。(多克斯15 kb)
额外的文件2:
表S2。耐盐和耐盐品种种子中的细菌种群分布oryza sativa ssp。indic.(DOCX 16 KB)
附加文件3:
图S1。DdeI消化后不同水稻品种籽粒核型(T-RF’s)的热图、相对丰度和总丰度。IR29为盐敏感品种,FL478、IC27、IC31和IC32为中耐盐品种,IC37为高耐盐品种。T-RFs在热图的左侧,T-RFs的身份是基于对该研究分离株和克隆的16S rRNA序列的硅预测。热图是根据总体丰度的减少来排列的。(JPEG 137 kb)
附加文件4:
图S2。Heat map, relative abundance and total abundance of ribotypes (T-RF’s) present in the different seeds rice cultivars after digestion with Hha I. IR29 is a salt-sensitive cultivar, FL478, IC27, IC31 and IC32 are moderately salt-tolerant cultivars and IC37 is highly salt-tolerant rice cultivar. T-RFs are on the left side of the heat map and the identities of the T-RFs were based on in-silico prediction of 16S rRNA sequences of isolates and clones from the study. The heat map is arranged according to decreasing overall abundance. (JPEG 135 kb)
额外的文件5:
图S3。基于Bray-Curtis的栽培品种植入性细菌群体T-RFLP数据的相似性分析与限制酶DDE I,Hae III和HHA I.(JPEG 70 KB)
附加文件6:
表S3。分析不同的籼稻品种展示全球和配对试验的种子内生细菌群落的相似性(ANOSIM)的。(DocX 14 KB)
附加文件7:
图S4。结果表明,在正常生长条件下(0 dS m), IR29(盐敏型)、IC32(中度耐受型)、IC37(高度耐受型)3个水稻品种的种子中,DdeI消化后的核型(T-RF’s)热图、相对丰度和总丰度分别为:IR29(盐敏型)、IC32(中度耐受型)和IC37(高耐受型)- 1)、中等盐度胁迫(4ds m .- 1)和高盐度胁迫(8 dS m- 1).(JPEG 129 KB)
附加文件8:
图S5。以耐盐性(IR29 -盐敏感型、IC32 -中度耐盐性、IC37 -高度耐盐性)为指标,分析了HhaI消化后的核型(T-RF’s)的热图、相对丰度和总丰度- 1)、中等盐度胁迫(4ds m .- 1)和高盐度胁迫(8 dS m- 1).(JPEG 110 kb)
附加文件9:
表S4。盐敏(IR29)中种子内生细菌群体的相似性(Anosim)分析,适度耐盐(IC32)和高耐盐剂(IC37)水稻品种在正常情况下生长(0ds / m),中等盐度(4ds / m)和高土壤盐度(8ds / m)。(DocX 14 KB)
权利和权限
开放访问本文根据知识共享署名4.0国际许可的条款分发(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
Walitang,D.I.,Kim,Cg。,金,K。等宿主基因型及盐胁迫对盐敏和耐盐水稻品种种子内科群落的影响。BMC植物杂志18,51(2018)。https://doi.org/10.1186/s12870-018-1261-1
已收到:
接受:
发表:
关键词
- 群落结构与多样性
- 米种子
- 细菌内心细胞
- 盐胁迫
- 耐盐碱
- T-RFLP


 IR29(红色),
IR29(红色), FL478(橙色),
FL478(橙色), IC27(黄金),
IC27(黄金), IC31(绿色),
IC31(绿色), IC32(蓝色),
IC32(蓝色), IC37(紫色)。通过分析相似性(Anosim)来计算全局R值。P在P(%) = 0.1时,对DdeI、HaeIII和HhaI的ansim值显著
IC37(紫色)。通过分析相似性(Anosim)来计算全局R值。P在P(%) = 0.1时,对DdeI、HaeIII和HhaI的ansim值显著