摘要
背景
在植物中,小块土地基因参与各种调节途径,例如植物生长和生物和/或非生物应激反应。虽然中国白梨('Dangshansuli')的基因组已被释放,但有关梨的ERF家族的知识,例如基因功能,进化历史和表达模式仍然有限。
结果
在我们的研究中,共鉴定了155个ERF家族的成员。Pyrus bretschneideri).KA和KS值表明全基因组重复(WGD)和分散的重复有效地促进了梨ERF家族的扩展。基因结构和系统发育分析除以PBRERF.家庭成12组,以及它们的基因的功能,通过比较分析预测。qRT-PCR的进行在三个关键发育阶段来验证的7种基因在III组使用野生和栽培梨水果的相对表达水平。野生样品具有这些基因比栽培样品的更高的表达,特别是在放大水果阶段。进行脱水处理梨苗的转录数据进一步显示,7种基因的4响应干旱条件。
结论
这AP2 / ERF.梨的基因家族大大扩展。比较分析表明…的可能性小块土地在多种途径中表现功能角色的基因。野生栽培样品中梨果发育的不同阶段的表达分析表明,III组中的基因可能参与非生物和/或生物应激。进一步转录的关于经干旱治疗的幼苗的转录组数据验证了潜在的作用小块土地这些结果将为理解ERF家族在高等植物中的功能和进化提供有价值的参考。
背景
这AP2 / ERF.超家族,植物特异性转录因子,其特征在于具有很大的功能性发散的成员。成员包含一个或几个保守的AP2 / ERF.在DNA结合区域中由大约60至70个氨基酸组成的结构域。基于保守域的数量,超家族可以分为三种类型,AP2,ERF,和rav.基因家庭[1].在里面AP2家族中,每个蛋白质序列包含两个AP2 / ERF.域。在里面小块土地家人,只有一个单身AP2 / ERF.结构域出现在每个蛋白质序列中,而结构域的成员rav.家庭不仅包含一个AP2 / ERF.结构域,但也是B3结构域——存在于其他植物特异性转录因子中的保守DNA结合结构域小块土地家庭可以分为两个主要的亚科西米亚,CBF / DREB.和小块土地[2].在里面小块土地亚家族,GCC盒的保守核苷酸序列AGCGCC [3.]在发病机制相关(PR)基因的启动子区域中发现,其调节抗病抗性抗障碍中的基因表达[4.].在里面含有DREB家庭,保守的结合序列CCGAC通常与顺式作用元件结合,并参与反应对非生物应激(冷和干旱)和调节植物激素,如ABA和乙烯[5.那6.通过调控基因表达。先前的研究表明AP2基因可能调节植物器官生长和发展途径,如花发育和种子大小的测定[7.那8.那9.].基因的rav.预计家庭参与对乙烯的反应[10]和对生物和/或非生物胁迫[11那12].
高通量测序数据的发布使得在全基因组水平上识别和分析基因家族成为可能。迄今为止,全基因组鉴定和分析小块土地基因家族在许多物种中都有表现,如蓖麻[13],拟南芥[14],杨树[15],葡萄[16], 白饭 [17)、小麦(18],黄瓜[19]和大豆[20]梨是蔷薇科最重要的水果之一,在世界范围内广泛分布小块土地梨科品种仍严重受限。最近完成的梨基因组测序和组装[21]为我们提供了一个识别和解剖的机会AP2 / ERF.家庭。这项研究将提供深入了解的功能和演变AP2 / ERF.家庭梨。
在我们的研究中,我们利用梨的基因组序列数据来探索AP2 / ERF.共有191个单基因被鉴定为该基因的候选成员AP2 / ERF.家庭,包括155个小块土地unigenes,26AP2unigenes,九rav.unigenes。为该系统进行了系统发育,基因结构和预测函数AP2 / ERF.家族,基因表达模式。这些结果为今后的探索奠定了坚实的基础小块土地梨的基因功能。
方法
鉴定AP2 / ERF基因家族
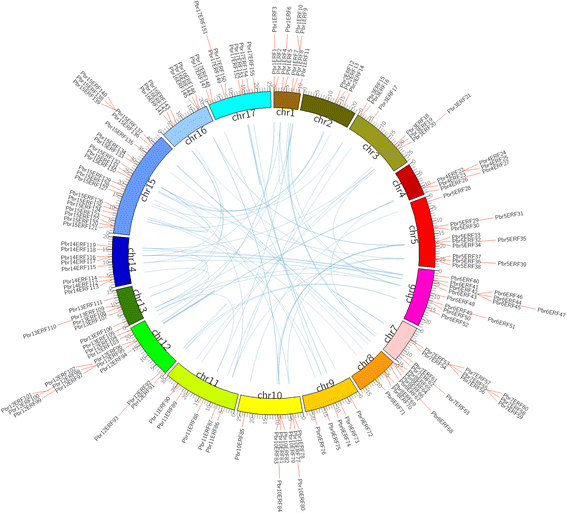
基于梨基因组计划(http://peargenome.njau.edu.cn/)[21],我们下载了所有蛋白质序列以识别成员AP2 / ERF.基因家庭。这拟南芥AP2 / ERF在先前的研究中鉴定基因[22[从植物转录因子数据库(PlantTFDB)下载它们的氨基酸序列(http://planttfdb.cbi.pku.edu.cn.).我们使用两种方法获得小块土地家庭Pyrus bretschneideri.首先,使用具有AP2域的HMM配置文件来执行隐马尔可夫模型搜索(HMMSearch)(PF00847)。其次,使用针对所有梨蛋白序列的BLASTP对齐来对候选人进行广泛的搜索AP2 / ERF.基因使用小块土地烟草和拟南芥作为疑问。对于使用这两种方法搜索的所有序列,我们首先删除了冗余序列和不完整的序列。然后,我们使用了智能工具(http://smart.embl-heidelberg.de/)以及InterProScan工具(http://www.ebi.ac.uk/tools/pfa/iprscan/)检测候选蛋白序列中AP2/ERF结构域是否存在。具有一个或多个AP2/ERF结构域的蛋白序列被鉴定并作为推测的成员保留AP2 / ERF.用于后续分析的族。每个梨的位置信息AP2 / ERF.基因来源于梨基因组数据库。然后,使用Circos软件绘制图表显示数据[23].
系统发育,基因结构和主题分析
使用MEGA6.0构建了无根系统发育树[24使用邻居加入(NJ)标准并使用最大似然(ML)方法验证,基于梨和梨中所有AP2 / ERF基因的全长氨基酸(AA)序列的多个对准进行1000个引导复制。拟南芥使用ClustalW [25].通过对CDS序列与相应的全基因组序列的比对,分析了其基因结构AP2 / ERF.使用在线网站显示家庭:基因结构显示服务器(GSD)(http://gsds.cbi.pku.edu.cn/).在梨中也发现了保守的基序AP2 / ERF.使用图案分析工具MEME的家庭成员(http://meme-suite.org/tools/meme)的默认参数,除了两个:motif站点分布,任意数量的重复;最大数量的主题,30。
Synteny分析与KA和KS值的计算
我们使用了不同于基因组复制数据库(PGDD)中使用的方法(http://chibba.agtec.uga.edu/duplication/) [26]首先,确定候选同源基因对(E < 1e-5,前5个匹配),在整个基因组中进行BLASTP比对。然后将确定的潜在同源基因对加载到软件MCScanX中,并使用默认参数[27那28]以确定同线链。我们还使用MCScanX进一步区分WGD /节段性,分散近端,和串联重复事件类型在小块土地基因家庭。
此外,使用从相同的Synteny块识别的候选同源基因对用作软件Kaks_calculator 2.0的输入[29]计算KA和KS值。软件参数设置如下:Yn作为方法(-m)和标准代码作为遗传代码表(-c)。然后,我们使用内部写入的Python脚本来获取所识别的同期基因的KA和KS值。
基因表达分析
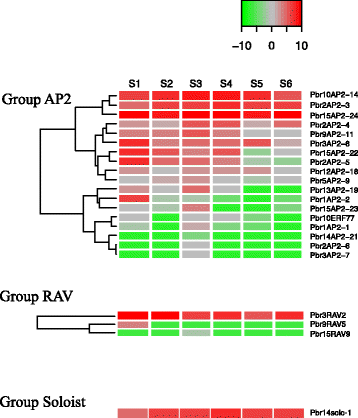
RNA-SEQ关于我们以前的研究中获得的“Dangshansuli”的数据[21]从梨基因组的网站上下载(http://peargenome.njau.edu.cn)用于分析表达PbrAP2 /小块土地结果表明:S1 (15 DAF)、S2 (36 DAF)、S3 (80 DAF)、S4 (110 DAF)、S5 (145 DAF)和S6 (167 DAF)在梨果实发育的6个不同阶段均有表达。下载了之前研究中获得的梨幼苗五种不同脱水处理的RNA-Seq数据[30].使用基于对数(log2)的热线图2功能在R中绘制r绘制的热量。每个千兆碱基(RPKM)值的每个千字节读数AP2 / ERF.基因。
RNA提取和cDNA合成
我们采集了6份梨种质,其中包括3份梨的野生种质p . pyrifolia那‘Matanggengzi’ (‘MTGZ’), ‘Baitanggengzi’ (‘BTGZ’), and ‘Tiantanggengzi’ (‘TTGZ’), and three cultivated accessions, ‘Huanghuali’ (‘HH’), ‘Lipuxueli’ (‘LPXL’), and ‘Liuchengfengshan’ (‘LCFS’)那在三个果实发育阶段(小水果阶段,52个DAF;增大果汁阶段,94个DAF;成熟的果汁阶段,128个DAF)用于QRT-PCR分析。首先,我们将梨果样品混合来自野生或栽培基因型的相同发育阶段。然后,使用植物总RNA隔离套件加(前法律有限公司)从梨果的混合样品中提取总RNA。在此过程中,我们进行了一项改进的步骤,在我们之前的研究中提出[31].为了在发育晚期的梨果中获得高质量的RNA,用高含水量,使用较少的水(40μL)从过滤柱中洗脱RNA。然后,将总RNA调节至相同的浓度,并基于调节的RNA,使用转肌型单步GDNA去除和cDNA合成超混(Transgen Biotech Co. Ltd.)合成第一链cDNA。
实时荧光定量PCR (qRT-PCR)
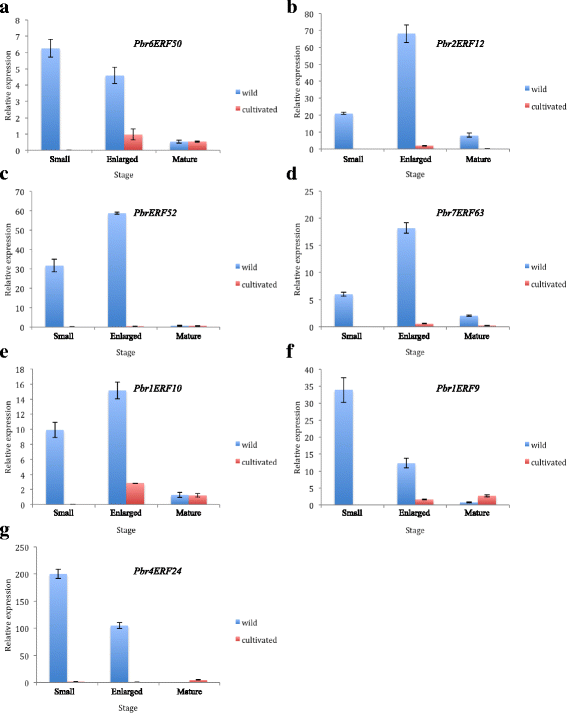
七对最可靠的底漆(附加文件1)旨在使用来自NCBI的在线软件(国家生物技术信息中心)()()旨在扩增七个候选基因序列(https://www.ncbi.nlm.nih.gov/tools/primer-blast/).根据之前一项研究中描述的方法[31],采用LightCycler 480 SYBR GREEN I Master (Roche)进行qRT-PCR分析。构建了一个20 μl的混合反应体系,每个体系包含100 ng模板cDNA,每个引物0.5 μM, 10 μl LightCycler 480 SYBR GREEN I Master。所有反应在96孔板上进行,每个cDNA样品有4个重复。我们将qRT-PCR条件设置为:95℃预孵育5min, 95℃3 s, 60℃10 s, 72℃30 s, 55个循环,72℃延长3min。最后,在60℃下进行荧光信号数据采集步骤。Pyrus actin.(加入号码AF386514)和PYRUS GAPDH.用作内部对照基因。使用计算机上显示的运行结果计算每个cDNA样品的平均阈值循环(CT)。同时,使用2计算七种基因的相对表达水平-ΔΔct在以前的研究中描述的方法[32].
结果
梨基因组AP2 / ERF基因的鉴定
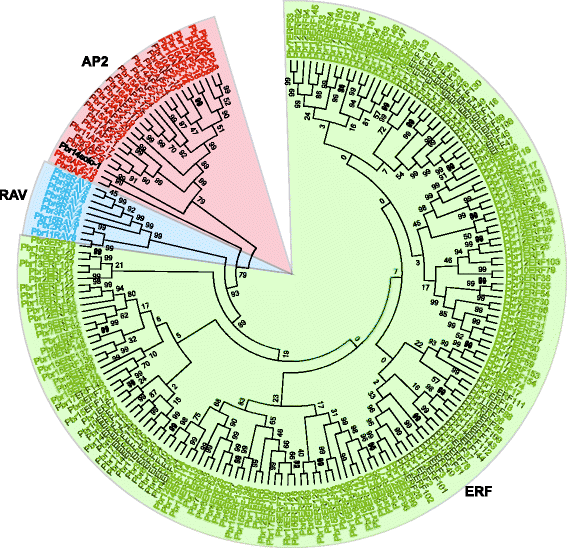
的成员AP2 / ERF.在中国白梨(p . bretschneideri使用HMM轮廓AP2域(PF00847)和BLASTP搜索使用隐马尔可夫模型搜索(HMMsearch):使用两种策略)的基因组小块土地来自烟草的蛋白质和拟南芥作为疑问。共有240个序列与候选人匹配AP2 / ERF.整个基因组的基因。在这些候选人中,我们删除了41名AP2 / ERF.基因位于未定居的支架,以及两种(Pbr039133.1和PR002083.1.)分别包含一个AMB_ALL域和一个X8域。同时,由于结构域不完全除去六个基因。因此,191非冗余和完整AP2 / ERF.在我们的研究中调查了基因。基于他们的域结构,AP2 / ERF.超家族基因分为三个家族:小块土地(一个AP2域),AP2(两个AP2域),和rav.(1个AP2域和1个B3域)。在这191个基因中,22个基因被分配到AP2并编码含有两个重复AP2/ERF结构域的蛋白。有趣的是,尽管基因PBR038562.1.包含两个AP2 / ERF域,它与ERF类型密切相关(图。1).8个基因被分配给rav.基因家族和被预测编码一个AP2 / ERF域和一个B3域。同时,161个基因编码仅包含单个AP2 / ERF结构域蛋白。这些161个基因中,155被分配到小块土地家族。在剩下的六个基因中,Pbr033071.1(Pbr2AP2-3),Pbr025458.1(PBR10AP2-14),PBR023949.1.(Pbr1AP2–1), 和PBR022083.1.(Pbr1AP2–2)也编码一个AP2/ERF域,但不同于ERF家族,而是聚集在AP2家族。因此,我们将这6个基因进一步分析为AP2基因(附加文件2).同样,基因Pbr030666.1(PBR9rav7.)编码AP2 / ERF域,但更类似于RAV系列。最后,基因Pbr002042.1(Pbr14solo-1)被分配了作为一个独奏,具有低同源性的其他AP2 / ERF.基因,虽然它包括AP2 / ERF样结构域序列。先前的研究表明更多AP2 / ERF.基因苹果进行鉴定,其中有51个AP2基因,六rav.基因,195小块土地基因和七名独奏者[33],支持巨大的扩张AP2 / ERF.梨和苹果的家族。为了区分每个家族成员,我们根据家族的分类和染色体位置的顺序来命名这些基因(附加文件)2).例如,基因小块土地家庭被命名为PBR1ERF1到PBR17ERF155.此外,每个基因的位置信息用于显示分布PBRERF.梨基因组中的基因。结果显示,所有155个PBRERF.基因通过17分布在染色体1如图。2.
系统发育,基因结构和保守的主题分析
目的:探讨191种植物之间的进化关系AP2 / ERF.梨中鉴定的基因,我们使用Mega 6.0构建了系统发育树,基于122的多个序列比对拟南芥小块土地从先前的研究中获得的基因[7.]和191梨AP2 / ERF.基因。由此产生的系统发育树使我们可以将AP2 / ERF.家庭进入了来自I到XB-L的12个不同的行动,这被引导值强烈支持,如图4所示。3..根据分类的基础AP2 / ERF.家庭拟南芥[7.], 这含有DREB亚家族和亚家族小块土地亚家族清楚地分开,分别由疏水片I-IV和v-Xb-1组成。除此之外AP2亚家族在梨中包含26名成员;思工rav.亚家族包括九名成员;独奏者被分开了(表1;无花果。4A).此外,我们发现大多数的片状和亚洲包括来自梨和梨的基因拟南芥AP2 / ERF家庭,表示AP2 / ERF.基因是同源的,从梨和梨之间的共同祖先演变拟南芥.
基因结构分析提供了进一步证据支持基因家族的系统发育拓扑分类,并显示成员AP2家族有6到10个内含子,8个成员rav.家庭失去了所有内含子,PBR9rav7.有一个。大多数成员小块土地亚科只有一个外显子和两个UTR区,但基团Ⅴ的大多数成员,VII,和X有两个外显子和一个内含子。与此同时,这是Pbr14solo-1基因包含7个内含子和八个外显子。此外,发现内含子的位置在是保守AP2家庭,虽然内含子的数量不同。同样,大部分小块土地家族成员具有相同或相似的内含子模式,大多数内含子位于AP2/ERF域区域,如图所示。4B.一般来说,在转录因子的蛋白质序列中可以检测到许多保守基序,并可能作为潜在的DNA结合位点参与激活基因表达。在以前的研究中,已经在水稻和水稻中发现了多种保守基序拟南芥,它们的功能已经被研究过[15那22].从氨基酸序列中表征潜在的保守基序AP2 / ERF.成员,我们使用了多个EM for图案elicitation(MEME)工具[34]分析191年AP2 / ERF.梨氨基酸序列。检测到总共30个保守的基序并命名为1-30(参见图1-304C).结果表明,每个组的大多数成员都含有相同的基序。基因结构为支持和验证以前的系统发育分类提供了可靠的证据。
PbrERF基因家族中各组的功能预测
以前的研究预测了每组的函数小块土地家庭拟南芥[22].在我们的研究中,系统发育分析允许我们识别推定的直向性和副寄生小块土地梨和梨的基因拟南芥.一般来说,同源基因具有相似的基因结构,并聚集在同一支系中,这些基因具有相似的功能。预测梨各类群的基因功能小块土地通过比较基因组学方法构建系统发育树,确定梨和梨的ERF类群拟南芥(无花果。3.).在群体中,虽然全部的功能拟南芥小块土地基因是未知的At1g78080蛋白质和蛋白质WXP1蛋白质具有保守的基序和基因的过表达WXP1已被报道为调节蜡合成的激活剂Medicago Truncatula.[35].因此,我们预测了这一点小块土地群体中的基因也可能在梨中的蜡积累中发挥重要作用。职能拟南芥组三小块土地已经广泛研究了基因,并包括对寒冷,干旱和盐胁迫的反应中可能的至关重要的功能作用[36那37那38].尽管梨中III组蛋白的功能未知,但这些蛋白质也可以基于类似和保守的主题区域参与非生物应激反应作为转录活化剂。在第四组,DREB2A(At5g05410) 和DREB2B(AT3G11020)已被报道作为转录因子调控drec介导的转录[37和基因AtERF#052(ABI4)参与ABA信号[39]和糖响应途径[40那41].在V组中,基因的过表达WIN1 / SHN1(AT1G15360)有助于叶表皮蜡的积累[42那43),和基因SHN2(AT5G11190) 和SHN3(AT5G25390.)具有相似的功能。V组的所有基因都有一个保守的基序结构。因此,其他梨小块土地V组基因也可能在蜡质积累途径中发挥重要作用。此外,越少PBRERF.梨比苹果的V组基因[33(4个基因vs. 19个基因)可能是由于其在控制蜡质积累方面的功能冗余。VI组的蛋白质共享n端区域的保守基序。在之前的研究中,烟草TSI1蛋白质(44]和番茄Pti6蛋白质(45]表现出类似的特征基因结构特征,包括六组和基因TSI1和Pti6通过调节该途径中的关键基因的表达已经被报道对非生物和/或生物胁迫响应。在基团VI-L,所有的蛋白质也有两个保守基序表征组VI。在第VII组,该基因AtEBP(AT3G16770)被鉴定为与之相互作用的关键基因bZIP转录因子OBF4在体外,尽管这种相互作用的功能仍然未知[46].此外,基因结构分析显示,VII组的所有基因均只有一个内含子,且AP2/ERF结构域5 ' -侧翼区域的基序完全一致(图5)。4.).在第八组中,AtERF4(AT3G15210) 和AtERF7(AT3G20310)结果表明,在ABA、茉莉酸和乙烯的作用下,它们对基因表达具有负调控作用[47.那48.那49.].此外,基因LEP(AT5G13910) [50.),ESR1 / DRN(AT1G12980) [51.那52.[参加器官分化和植物开发的调节。因此,我们假设VIII组中的其他梨基因可能具有相似的功能。在X组,拟南芥ABR1(AT5G64750)报道在先前的研究中,参加ABA响应的抑制,而敲除基因ABR1导致根生长和种子萌发过程中对ABA的兴奋性反应[53.].
PBroRF基因家族中的基因复制和同步分析
在一个基因组中可以检测到5种基因复制类型,包括全基因组复制(WGD)、单例复制、串联复制、近端复制和分散复制。这些复制事件是基因家族扩展的主要驱动力[54.].因此,探索重复基因的起源PBRERF.在基因家族中,我们解剖了每个基因成员的复制类型PBRERF.通过使用软件包MCScanX建立家庭。每个基因PBRERF.家族被分配到五种基因复制类型中的一种。其中,梨66.45% (103)PBRERF.基因从WGD或节段性重复事件中保留,与串联的5.16%(8)相比,来自分散的19.35%(30),从近端复制事件中的9.03%(14)(附加文件3.).
为进一步提供WGD事件作为促进地球膨胀的主要力量的额外证据PBRERF.基因家族,从植物基因组重复数据库(PGDD)中使用的方法进行了一种方法,用于鉴定整个梨基因组的同时性嵌段。在我们的分析中,共有75个重复的基因对(附加文件4.)被发现在PBRERF.基因家庭。每对的相似性范围为30.22%〜100.00%。同时,考虑到北端常常在进化过程中保留等同的功能,我们检查了局部关系小块土地梨和梨之间的基因拟南芥使用相同的方法。梨总共84个基因,除了独奏者之外,有一个或多个推定的直脑拟南芥(附加文件5.).与此同时,他们又被细分为同一组拟南芥,这进一步支持了系统发育分析的结果。在这84个基因中,八个属于AP2家庭,75到小块土地家里只有一个人rav.以前的一项研究没有报道拟南芥orthologs的rav.梅花的家族基因[55.]共线性分析可以有效地为通过系统发育分析发现的假定的同源或同源基因提供有力的支持。
估计进化的日期和驱动力
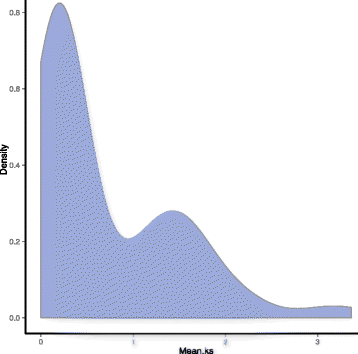
通常用每个位点的同义替换率,即Ks值来估计WGD事件的演化日期。前人研究报道梨基因组经历了两次WGD事件:一次古WGD (Ks ~ 1.5 ~ 1.8),推测发生了~ 140 MYA [56.],近期WGD (Ks ~ 0.15 ~ 0.3),推测发生在30 ~ 45 MYA [21].因此,我们估计了扩展的日期PBRERF.在我们的研究中,我们通过计算Ks值来计算家庭的Ks值PBRERF.共线区WGD重复的基因对,范围从0.01到3.37,见附加文件4..此外,在两个Ks值峰处分布65(86.6%)对重复的基因对(图。5.).因此,这些重复的基因对可能来自于相同的最近(30 ~ 45 MYA)和古老(~ 140 MYA)的WGDs,导致了WGDs的扩展PBRERF.基因家庭。
积极选择(达尔文选择)通过积累新的有利突变来推动动植物的进化,然后这些突变在种群中传播。相反,负选择,即净化选择,是一种去除有害突变的进化过程[57.].为了进一步确定一个或两个选择过程是否推动了这方面的演变PBRERF.梨中的家庭,使用基因的编码序列(CDS)计算,同源的KA值(每位站点的非唯一取代)和同源物的ka / ks比率。PBRERF.家庭。的方向和选择的大小可以使用嘉/ Ks率来衡量:值小于一个指示负选择,等于一个表示中性的选择,和大于一表示正选择[58.]在这些分析中,除基因对外,所有75个基因对的Ka/Ks比率均小于1PBR017391.1-PBR030208.1.,其KA / KS比率大于1,暗示净化选择已驱动PBRERF.同时,我们也提出了基因Pbr017391.1和Pbr030208.1可能在植物表型性状(如果实大小、糖或酸含量)的进化中发挥重要作用。
AP2/ERF基因在梨中的表达分析
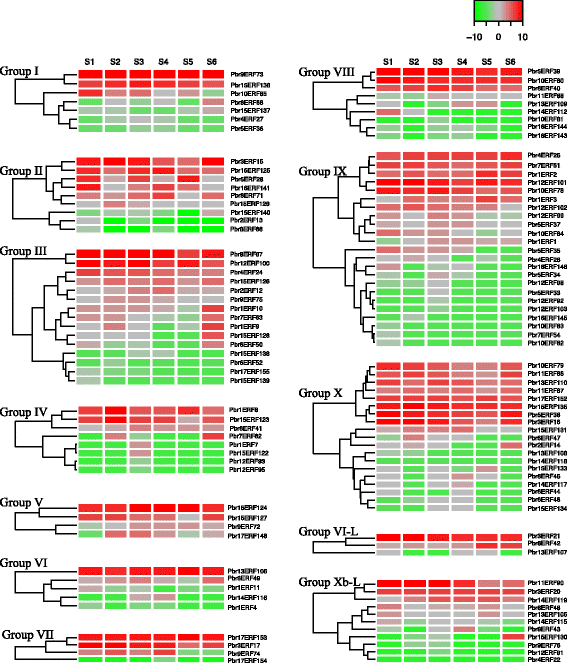
从我们的梨基因组数据库中下载了党山苏梨六个不同发育阶段的转录组测序(RNA-Seq)数据。http://peargenome.njau.edu.cn) [21].191梨的表达模式AP2 / ERF.基因如图所示。6.(小块土地家庭)和无花果。7.(AP2和rav.家庭,独奏者)。在这些191个基因中,在51个基因的任何阶段未检测到表达,并且在至少一个梨果阶段表达140个基因。在所有六个阶段检测到七十八基因,尽管并非所有表达水平都很高(附加文件6.).
梨的水平表达热图AP2那rav.,独奏者基因。的表达式级别AP2那rav.,独奏者通过RNA-Seq分析在六个不同阶段测量基因:15 DAF(S1)、36 DAF(S2)、80 DAF(S3)、110 DAF(S4)、145 DAF(S5)和167 DAF(S6)Color scale at the top right represents RPKM normalized by log2. Light green indicates a low expression level, gray indicates a medium level, and red indicates a high level. The graph was plotted in R using the heatmap.2 function
表达模式PbrAP2 /小块土地即使在一个群体中,基因也是多种多样的。例如,IX组可以根据表达模式分为三个子组。五个基因(PBR4ERF25那Pbr7ERF61那PBR1ERF2那Pbr12ERF101,PBR10ERF78.)构成一个亚群,其中所有基因在所有六个阶段都高度表达,并聚在一起。六个基因(PBR1ERF3.那Pbr12ERF102那Pbr12ERF99那Pbr5ERF37那PBR10ERF84,PBR1ERF1)构成第二个亚群,其中所有基因在每个阶段都以低水平表达。然而,其余的基因可以聚集在一起,并在一到四个阶段低水平表达。有趣的是,在所有的组中,我们总能在果实的所有发育阶段检测到一到六个高表达基因。
通常,野生植物具有比栽培植物更高的抗性。为了验证我们的功能聚类分析是否可靠,我们选择了七组基因,预计涉及非生物和/或生物应激反应,在三种不同的发育阶段(小水果阶段)的野生和栽培梨子中的QRT-PCR分析52天开花(DAF);果阶段扩大,94个DAF;成熟的果阶段,128个DAF)。结果表明,这七种基因在野生和栽培梨中显着不同地表达,特别是在小型和放大的果阶段(图。8.),野梨中的表达水平远高于栽培梨。因此,我们可以得出结论,III组中的基因通过阳性调节调节非生物应激响应途径,并且在果实成熟过程中逐渐失去其抵抗力相关的基因。
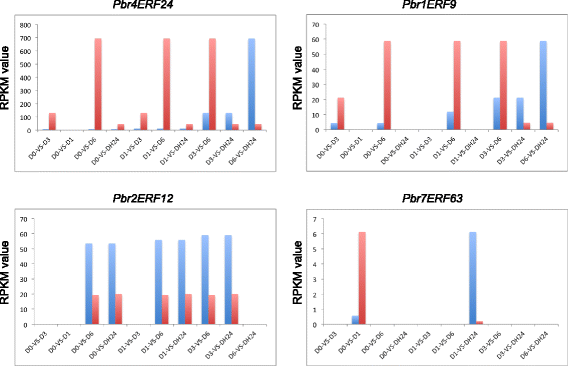
我们还使用来自脱水治疗的转录组数据[30],其中梨幼苗在26℃下脱水0(D0),1(D1),3(D3)和6(D6)小时,然后在26℃下在水中回收24小时(DH24),验证这七个候选相关基因。结果表明,来自五种文库的两种或更多种比较,七种基因中的四种差异表达。如图1所示。9.,该基因PBR4ERF24在9个比较中均有差异表达,且其表达量在幼苗脱水6 h时达到峰值。基因PBR1ERF9在六个比较,D0-VS-D3,D0-VS-D6,D1-VS-D6,D3-VS-D6,D3-VS-DH24和D6-VS-DH24中差异表达。其基因表达峰也出现在六小时的脱水处理中。基因Pbr2ERF12在D0-VS-D6、D0-VS-DH24、D1-VS-D6、D1-VS-DH24、D3-VS-D6和D3-VS-DH24 6个比较中均有差异表达,而Pbr7ERF63仅在D0-VS-D1和D1-VS-DH24比较中差异表达。这些结果强烈支持参与小块土地基因在梨响应干旱胁迫。
讨论
作为一种重要的植物特异性转录因子,AP2/ERF基因家族在许多植物中得到了广泛的研究拟南芥[14],杨树[15],葡萄[16],和水稻[17].不过,梨比较少小块土地基因在以往的研究进行了调查。在此,AP2 / ERF的191名超家族成员是从梨基因组鉴定,包括来自家庭ERF 155名成员。以前的研究已经表明,成员有类似的数据在植物种类已确定,共有AP2 / ERF的202名超家族成员包括杨树ERF家族的169名成员,和AP2 / ERF的180名超家族成员包括ERF家族的145个成员白饭。同时,这三个品种具有类似的基因组大小,527 MB的梨,480 MB的杨树和466 MB的大米,表明成员的AP2 / ERF数量超家族密切相关的基因组大小的三个品种。在本研究中,一些非锚定的ERF基因和具有不完整的域名被拆除。虽然这在ERF家族梨减少成员的潜在数量,这让候选基因ERF更可靠。
大部分的PBRERF.在梨ERF家族中发现了广泛分散的重复基因。最近的一个谱系特异性WGD事件(30~ 45 MYA) [21]可能有助于更高的WGD型比例PBRERF.在梨中观察到基因重复。同时,它还表明,WGD事件在进化和扩展中发挥了重大作用PBRERF.梨的基因家庭。有趣的是,先前的分析表明,最近的基因复制似乎参与了ERF家庭在Apple中的扩展[22],还在梨和苹果中还支持ERF家族的类似膨胀模式。进一步支持ERF基因对的KS的计算小块土地来自同一个最近和古代WGD活动的基因。此外,发现六(8.00%)重复的基因对(1.92-3.37)发现较高的Ks值(1.92-3.37),发现较低的Ks值(0.004-0.01),四个(5.33%)基因对(附加文件4.),这表明发生了其他重复事件,以推动梨中ERF家族的演变。
梨中ERF全长氨基酸序列的系统发育树和拟南芥揭示了ERF家族中的大多数亚组包括来自梨的基因和拟南芥,表示这些小块土地基因预先定义物种分歧。同一亚组中的基因共享类似的基因结构,其决定类似的基因功能。因此,与已知功能的比较小块土地基因在拟南芥可以帮助识别候选梨的候选基因,并预测其基因功能。作为之前的研究报告说大多数亚组拟南芥被预测在植物生长和胁迫应答[涉及22是一种没有果实的植物。它的使用相对有限拟南芥小块土地基因作为系统发育树的疑问,以鉴定梨果生长和发育中的功能基因。但是,RNA-SEQ数据为我们提供了完整的表达概况小块土地不同果实发育阶段的基因,其显示至少一种基因,在所有亚组中,在所有阶段高度表达。基因表达还可以为我们提供重要的线索来执行基因函数预测[59.].功能预测分析表明了大部分AP2 / ERF.基因家族成员参与非生物和/或生物应激反应。因此,我们预测,在整个生长和发展中高度表达的每组的基因可能在压力反应中发挥更重要的作用。QRT-PCR分析表明,III组中的七种基因确实在野生和栽培梨之间表达不同。此外,来自脱水治疗的转录组数据[23]验证了四个中的四个PBRERF.基因在不同的处理中差异表达,而剩余的三个基因可能在其他应激反应中起着更重要的作用。
结论
这是第一次全面的研究AP2 / ERF.梨的基因家族旨在帮助澄清基因功能,进化和表达模式。这AP2 / ERF.梨的基因家族有很大的扩展,其中WGD事件起着重要的作用。重复基因之间的功能预测和表达差异表明小块土地基因参与多种调控途径,多种证据支持III组基因可能参与对非生物胁迫的反应。这些研究结果将为进一步了解生物多样性的功能及其演变奠定重要的基础小块土地梨和其他相关物种的基因家族。
参考文献
- 1.
Riechmann JL,听到J,Martin G,Reuber L,Jiang C,Keddie J,Adam L,Pineda O,Ratcliffe OJ,Samaha Rr等。拟南芥转录因子:真核生物全基因组比较分析。科学。2000;290(5499):2105 - 10。
- 2.
yoh s,qiang l,约瑟夫gd,hiroshi a,kazuo s,kazuko y-s。ERF / AP2结构域的DNA结合特异性rapidopsis drebs.,参与脱水和冷诱导基因表达的转录因子。中国生物化学学报。2002;29(3):998-1009。
- 3.
乙烯诱导DNA结合蛋白与乙烯反应元件相互作用。植物细胞。1995;7(2):173 - 82。
- 4.
郝d,奥默-高木M,由在植物乙烯 - 反应元件结合因子(ERF域)DNA结合结构域GCC盒识别撒莱A.独特模式。J Biol Chem。1998; 273(41):26857-61。
- 5。
一种新颖的顺式作用元素拟南芥基因参与对干旱、低温或高盐胁迫的反应。植物细胞。1994;6(2):251–64。
- 6。
Chao J,IU B,Singh J. CCGAC CIS作用元件冷诱导的要求BN115来自冬天的基因芸苔栗鸟.植物学报。1996;30(3):679-84。
- 7。
Elliott Rc,Betzner As,Huttner E,Oakes MP,Tucker WQ,Gerentes D,Perez P,Smyth Dr。Aintegumenta.,一个APETALA2样基因拟南芥具有胚珠发育和花式器官生长的含有肺炎作用。植物细胞。1996; 8(2):155-68。
- 8。
Jofuku KD, Omidyar PK, Zorana G, Okamuro JK。花同源基因APETALA2对种子质量和产量的控制。中国科学院院刊2005;102(8):3117-22。
- 9。
Nole-Wilson S,Krizek Ba。DNA结合特性拟南芥花发育蛋白AINTEGUMENTA。核酸RES。2000; 28(21):4076-4082(4077)。
- 10
Alonso JM,Stepanova An,OiseSe TJ,Kim CJ,Huaming C,Paul S,Stevenson DK,Justin Z,Pascual B,Rosa C.基因组宽的插入诱变拟南芥.科学。2003; 301(5633):653-7。
- 11
关键词:辣椒,病原菌,转录因子,表达RAV1在细菌疾病抗性和干旱和盐胁迫耐受性。植物mol biol。2006; 61(6):897-915。
- 12
李嘉文、吕智S、邱平C、苏娟Y、蔡洪H、杜俊C、明仔C.番茄rav.转录因子是涉及AP2 / ereBP介导的防御途径的枢轴调节剂。植物理性。2011; 156(1):213-27。
- 13
徐W,Li F,Ling L,Liu A.基因组的调查和表达概况AP2 / ERF.蓖麻家族(萝藦L。).BMC基因组学。2013;14(5):600 - 1。
- 14
杨志强,李强,杜布泽,A浩,Kazuo S, Kazuko YS。ERF / AP2结构域的DNA结合特异性拟南芥DREBS,参与脱水和冷诱导基因表达的转录因子。中国生物化学学报。2002;29(3):998-1009。
- 15.
景志,蔡斌,彭瑞华,博志,金晓峰,永旭,冯刚,付学勇,田永永,魏哲AP2 / ERF.基因家庭杨树trichocarpa《生物化学Biophys Res Common》,2008;371(3):468-74。
- 16。
李考西F,乔治FM,Zenoni S,Osti F,Pezzotti M,Perta P.基因和转录组学分析AP2 / ERF.中的超家族vitis Vinifera.BMC基因组学。2010;11(51):719。
- 17。
徐勇。AP2 / ERF.大米转录因子:单焦和销售之间的基因组帆布和同义性关系。Evol生物信息学在线。2012; 8(4):321-55。
- 18。
壮吉,陈杰,姚QH,熊q,太阳CC,周XR,张j,雄根。发现和表达概况分析AP2 / ERF.来自小麦.分子生物学代表2011; 38(2):745-53。
- 19。
胡丽,刘胜。水稻基因组鉴定与系统发育分析小块土地黄瓜基因家族。基因分子Biol。2011; 34(4):624-33。
- 20。
张克,明C,陈X,徐Z,山G,Li LC,Li A,Guo J,Long M,MA Y.系统发育,基因结构和表达模式小块土地大豆基因家族(大豆。)。J Exp Bot。2008; 59(15):4095-107。
- 21。
吴军,王铮,史志,张胜,明瑞,朱胜,马可汗,陶胜,Korban SS,王洪Pyrus Bretschneideri Rehd.。)。Genome Res。2013; 23(2):396-408。
- 22。
Toshitsugu N,Kaoru S,Tatsuhito F,Hideaki S.全基因组分析拟南芥和稻米的ERF基因家族。植物理性。2006; 140(2):411-32。
- 23.
Krzywinski M,Schein J,Birol I,Connors J,Gascoyne R,Horsman D,Jones SJ,Marra Ma。电讯:对比较基因组学的信息审美。Genome Res。2009; 19(9):1639-45。
- 24.
MEGA7:用于更大数据集的分子进化遗传学分析7.0版本。[J]中国寄生虫学与寄生虫病杂志,2016;33(7):1870。
- 25.
Larkin Ma,Blackshields G,Brown NP等人。Clustal W. Clustal X 2.0 [J]。生物信息学。2007; 23(21):2947-8。
- 26.
李天华,唐华,王旭,AH Paterson。PGDD:植物基因和基因组复制数据库。核酸学报2013;41(D1): D1152-8。
- 27.
唐清,王X,鲍德·杰,明河,阿拉姆米,帕特森啊。通过繁殖的高血管植物基因图解开古老的六倍倍性。Genome Res。2008; 18(12):1944-54。
- 28.
王Y,Tang H,Debarry JD,Tan X,Li J,Wang X,T-H L,Jin H,Marler B,Guo H. McScanx:一种工具包,用于综合征和共同性基因的检测和进化分析。核酸RES。2012; 40(7):E49。
- 29.
王东,张勇,张震,朱建军,于建军。kachs_calculator 2.0:一个集成了伽玛级数方法和滑动窗口策略的工具箱。基因组,proteom bioinformat。2010; 8(1): 77 - 80。
- 30.
李克,徐XY,黄奇。鉴定差异表达基因与脱水耐脱水抗性,Pyrus entulaefolia,通过RNA-SEQ。Plos一个。2016; 11:e0149352。
- 31.
李X,薛C,李江,等。全基因组鉴定,进化和在中国白梨(白梨)的MYB转录因子功能分化[J]。植物细胞生理。2016; 57(4):824-47。
- 32
Livak KJ, Schmittgen TD。利用实时荧光定量PCR技术分析相关基因表达数据-ΔΔct方法[J]。方法。2001;25(4):402 - 8。
- 33
Girardi CL, Rombaldi CV, Cero JD,等。苹果AP2 / ERF超家族的全基因组分析及ERF参与黑星病发病的转录证据[J]。Sci Hortic。2013;151(2):112 - 21所示。
- 34
贝里·TL,威廉姆斯N,米斯利C,李WW。模因:发现和分析DNA和蛋白质序列基序。核酸研究。2006;34(补充资料2):W369-73。
- 35
张建勇,布罗克林CD,布兰卡福EB,斯莱奇MK,萨姆纳LW,王智WXP1,假定Medicago Truncatula.含AP2结构域转录因子基因,增加转基因苜蓿表皮蜡积累,增强抗旱性(苜蓿).工厂J. 2005; 42(5):689-707。
- 36
Gilmour SJ, Zarka DG, Stockinger EJ, Salazar MP, Houghton JM, Thomashow MF。低温调节拟南芥CBF.家庭AP2转录活化剂作为冷诱导的早期步骤天哪基因的表达。工厂J. 1998; 16(4):433-42。
- 37
Liu Q,Kasuga M,Sakuma Y,Abe H,Miura S,Yamaguchi Shinozaki K,Shinozaki K.两种转录因子,DREB1.和Dreb2.通过一个EREBP/AP2 DNA结合域,分别在干旱和低温响应基因表达中分离两条细胞信号转导途径拟南芥.植物细胞。1998年; 10(8):1391-406。
- 38
Haake V, Cook D, Riechmann J, Pineda O, Thomashow MF, Zhang JZ。转录因子CBF4干旱适应的调节器在吗拟南芥.植物理性。2002; 130(2):639-48。
- 39。
王曼丽,林毅夫,饶思,古德曼。这拟南芥脱落酸反应位点ABI4编码Apetala2结构域蛋白质。植物细胞。1998; 10(6):1043-54。
- 40。
作者简介:许杰瑟(1996 -),男,河北人,博士,主要研究方向为神经网络拟南芥蔗糖脱开-6-基因与之相同脱落酸INSENSITIVE-4:脱落酸在糖反应中的参与。工厂J. 2000; 23(5):577-85。
- 41。
Arenas-Huertero F,Arroyo A,Zhou L,Sheen J,Leon P.分析拟南芥葡萄糖不敏感突变体,gin5和gin6,揭示了植物激素ABA在糖调控植物营养发育中的核心作用。基因Dev。2000;14(16):2085 - 96。
- 42。
Aharoni A, Dixit S, Jetter R, Thoenes E, van Arkel G, Pereira A拟南芥.植物细胞。2004;16(9):2463 - 80。
- 43。
蒋志忠,李志强。WIN1,一种表皮蜡积累的转录激活物拟南芥.Proc Natl Acad Sci U S A. 2004; 101(13):4706-11。
- 44。
Park JM, Park C-J, Lee S-B, Ham B-K, Shin R, pak - h。烟草的过度表达TSI1基因编码一个AP2 / EREBP型转录因子增强烟草对病原菌侵袭和渗透胁迫的抗性。植物细胞。2001;13(5):1035 - 46。
- 45。
周军,唐旭,马丁GB。具有番茄斑点病抗性的Pto激酶与与致病相关基因的顺式元件结合的蛋白质相互作用。EMBO j . 1997; 16(11): 3207 - 18。
- 46。
büttnerm,singh kb。拟南芥乙烯反应元件结合蛋白(AtEBP),一种乙烯诱导的GCC盒DNA结合蛋白与OCS元素结合蛋白相互作用。PROC NATL ACAD SCI。1997年; 94(11):5961-6。
- 47.
McGrath KC, Dombrecht B, Manners JM, Schenk PM, Edgar CI, Maclean DJ, Scheible W-R, Udvardi MK, Kazan K. Repressor-and activator-type ethylene response factors functioning in jasmonate signaling and disease resistance identified via a genome-wide screen of拟南芥转录因子基因表达。植物理性。2005; 139(2):949-59。
- 48.
Yang Z,Tian L,Latoszek-Green M,棕色D,Wu K. Arabidopsis ERF4是能够调节乙烯和脱落酸反应的转录压缩机。植物mol biol。2005; 58(4):585-96。
- 49.
宋C-P,阿加瓦尔男,太田男,郭Y,Halfter U,王平,朱J-K·。一中的作用拟南芥AP2 / EREBP- 型转录抑制剂在脱落酸和干旱应激反应中。植物细胞。2005; 17(8):2384-96。
- 50.
van der Graaff E, Dulk-Ras A, Hooykaas P, Keller b多叶的叶柄基因对小麦叶柄发育的影响拟南芥.发展。2000;127(22):4971 - 80。
- 51.
班野H,池田Y,牛庆伟,蔡宁华。过度的拟南芥ESR1诱导芽再生的起始。植物细胞。2001;13(12):2609-18。
- 52.
Kirch T,Simon R,GrünewaldM,WERR W.该DornrÖschen /芽再生增强剂1基因拟南芥在术语中的控制中的控制。植物细胞。2003; 15(3):694-705。
- 53.
潘迪GK, Grant JJ,张耀华,Kim BG,李丽,栾淑娟。ABR1,一种APETALA2结构域转录因子,在细胞中作为ABA反应的阻遏因子发挥作用拟南芥《植物生理学》2005;139(3):1185-93。
- 54.
Maher C,Stein L,洁具D.进化拟南芥microRNA家族通过重复事件。基因组研究》2006;16(4):510 - 9。
- 55.
杜东,郝瑞,程涛,潘华,杨伟,王静,张强AP2 / ERF.基因家庭李属却已.植物mol biol报告。2013; 31(3):741-50。
- 56
福西特JA, Maere S, Van de Peer Y.具有双基因组的植物可能有更好的机会在白垩纪-第三纪灭绝事件中存活下来。中国科学:地球科学(英文版)2009;106(14):5737-42。
- 57
Starr Tk,Jameson Sc,Hogquist Ka。阳性和阴性选择T细胞。Annu Rem Immunol。2003; 21(1):139-76。
- 58
杨志。PAML 4:最大似然法的系统发育分析。中国生物医学工程学报。2007;24(8):1586-91。
- 59
彭X,赵y,李X,吴米,柴w,盛l,王义,东q,姜h,程b。玉米Nac型基因家族的基因组鉴定,分类和分析。J Genet。2015; 94(3):377-90。
致谢
感谢樊菁博士和胡红菊教授为我们的工作提供了野生和栽培的沙梨材料。感谢南京农业大学作物遗传与种质创新国家重点实验室梨工程技术研究中心的小组成员。
基金
国家自然科学基金项目(no . 31672111);国家农业科研体系专项资金(no . CARS-28);江苏省杰出青年科学基金项目(no . BK20150025);
数据和材料的可用性
有关梨的所有序列资料可于梨基因组数据库(http://peargenome.njau.edu.cn/).所有拟南芥蛋白质序列均从拟南芥信息资源(TAIR)下载(https://www.arabidopsis.org.).转录组测序(RNA-SEQ)关于六种不同发育阶段的梨果水果阶段的数据已经发布,可以从我们的网站下载(http://peargenome.njau.edu.cn).本研究期间生成或分析的所有数据都包含在本文中及其补充信息文件中。从武汉农业科学院的水果和茶研究所提供从野生和栽培阶段收集的六种水果样品,湖北省武汉院校的水果和茶研究所提供。
作者信息
隶属关系
贡献
XL进行的实验,数据分析,并且图准备和起草的手稿。ST和MM进行RNA提取和定量RT-PCR分析。SW和SZ提供了宝贵的建议和讨论这份手稿。和XH从脱水处理梨树苗提供的转录组数据。JW管理和设计研究。
通讯作者
道德宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
利益争夺
提交人声明他们没有竞争利益。
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
权利和权限
开放存取本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
李,X.,陶,S,魏,S.等等。采矿和进化调查AP2 / ERF.梨中的基因(Pyrus).BMC植物BIOL.18,46(2018)。https://doi.org/10.1186/s12870-018-1265-x
收到了:
公认:
发表:
关键词
- ERF家族
- 进化
- 表达式模式
- 非生物胁迫