摘要
背景
硅(Si)可以赋予植物抗非生物和生物应力。在本研究中,Si在水稻上的启动作用(水稻cv Nipponbare)的根结线虫有graminicola和植物防御机制的组织化学和分子的影响进行了评估。
结果
添加Si显著降低了水稻根系线虫的数量,延缓了线虫的发育,但对巨细胞没有明显的负面影响。水稻抗性增加与防御相关基因转录水平升高相关(oserf.1,OsEIN2和OsACS1)在乙烯(ET)途径中。SI修正案在具有增强的ET信号传导中显着降低了水稻植物中的线虫数量,但在植物中缺乏ET信号传导没有效果,表明Si的引发效果依赖于ET途径。在Si修正的植物中的线虫攻击后在水稻根中观察到较高的酚类化合物的愈合和积聚的含量比对照组。
结论
这些发现表明,引发效果可以部分取决于酚类化合物和过氧化氢的产生。需要进一步的研究来模拟在Si-Plant-Nematrode相互作用系统中发生的乙烯信号转导途径,并在水稻中更好地了解SI诱导的防御。
背景
大米(水稻)是大多数人类的重要主食作物,是单子叶植物的模式生物[35.那36.].对这种作物最具破坏性的线虫是根结线虫有graminicola,根腐线虫潜根霉和囊肿线虫异皮线虫属spp。5.].到目前为止,M.禾本科是三者中最重要的一种,在世界主要稻米生产国普遍存在[1那14.那28.].M.禾本科可以在水稻幼苗中诱发大量的生长迟缓,并在东南亚和其他地区导致有氧水稻,低地和深水稻的80%屈服损损失[5.那14.那37.].轮作与双子叶植物和休耕季节可以减少线虫种群,提高水稻产量[44.].化学界亚族毒品(Carbofuran,Phorpyrate)已被用作种子处理或土壤应用以进行管理M.禾本科在田野中,达到了这种线虫的粘土,蛋产和土壤种群的显着抑制[26.那41.].许多拮抗菌及真菌(荧光荧光素,博士霉素据报道,促进植物生长并产生抑制线虫卵孵化或杀死线虫的物质[42.].然而,对环境和人类的化学杀线虫剂的潜在负面影响,导致上全面禁止或限制使用这些化学品。轮作的缺点,如增加专业知识和专门的设备和不同的管理办法的要求,限制了它的应用。随着环保控制方法和化学杀线虫剂用量的减少种植者越来越感兴趣,诱导抵抗(IR)已被提议作为近年来这种破坏性线虫新的管理策略。
IR是由天然或合成试剂引发的增强的防御能力的物理状态,其激活植物防御系统免受特定的生物应力(例如真菌,细菌,病毒和线虫)或非生物应激(例如那盐,温度,干旱和化学品)[10.那12.那48.].植物防御系统包括预先存在的物理和化学障碍以及诱导型防御反应,在病原体感染后被激活[22.].在病原体感染后,在不同植物中观察到植物藻素,加强细胞壁的加强和产生抗真菌蛋白的生产。发现水杨酸(SA),茉莉酸(JA),乙烯(ET)和其他信号传导途径在不同植物的防御反应调节中起关键作用[16.那47.].
硅在赋予对非生物和生物胁迫的植物抗性的作用(Si)的已收到越来越多的关注[7.那11.那30.那40那53].几项研究表明,土壤应用的Si可以在许多植物中诱导不同病原体的系统性防御。用可溶性Si进行黄瓜植物的修复导致胰蛋白酶活性的显着刺激和感染后的过氧化物酶的快速激活蟒蛇spp。9.].根施加的Si显着增加了黄瓜中苯丙氨酸氨酶活性的活性,并降低了粉末状霉菌疾病指数[30.].添加Si至营养溶液显着降低了水稻中爆炸进化曲线下的病变尺寸和面积7.].用硅酸钙修饰植物,可显著减少各种植物的根瘿和卵的数量meloidogyne.在豆,番茄和咖啡[13.].向Si缺陷的土壤中加入硅酸钙显着降低了胆汁和鸡蛋的数量M. exigua.增加了咖啡的木质素 - 硫代糖酸衍生物的浓度[43.].根据Guimarães等。[19.]硅酸钾有效减少线虫卵数M.Incognita.在甘蔗。硅处理对爪哇根结线虫大豆,普通豆类和稻米的发展,减少了稻根的线虫渗透[32.].但不施硅处理影响了玉米线虫的发育和渗透。到目前为止,Si对植物线虫的保护机制还没有完全阐明。一些作者提出Si在细胞壁中形成物理屏障,阻止真菌菌丝或线虫茎突侵入宿主组织[40].其他人认为,通过生产酚样化合物,Si可能与植物抗性的抗性增加有关;在Phytoalexins的水平;在过氧化物酶(POX),多酚氧化酶(PPO)和苯丙氨酸(PAL)的活性增加;通过强烈的发病相关(PR)基因的强烈激活[19.那30.那43.].然而,在这些实验中,Si对随后疾病抑制的影响仅在接种叶片或根部的情况下评估,而不评估整个植物。此外,没有对修正SI对水稻防御相关基因的影响进行了深入的研究。因此,仍然未知是否可以诱导防御反应M.禾本科感染。
本文分析了水稻根施硅对水稻抗病的启动效应M.禾本科,以及水稻诱导抗性的防御机制。结果表明,硅能减少水稻线虫的侵染。这一现象可能与ET途径以及水稻根中酚类化合物和过氧化氢的产生有关。
结果
SI对线虫行为没有毒性影响
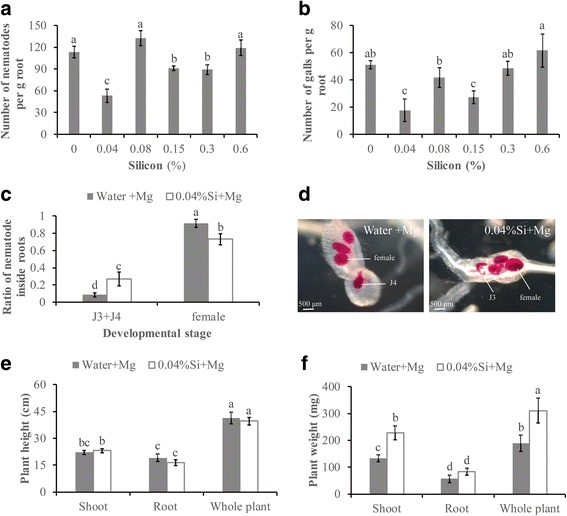
以确定硅是否对根的吸引力有直接影响M. Graminicola,我们观察了Si和水处理的根尖周围被吸引的线虫数量。接种后6 h, si处理根尖(16.5±3.1)和对照根尖(18.7±3.8)对线虫的吸引率无显著差异(图3)。图1A和1B).这一结果表明,所测硅液并不能阻止水稻根系对水稻的吸引力M.禾本科.
为了确定Si是否对线虫的感染性直接影响,监测用Si或水接种在水稻根上预处理的线虫的渗透和发育。在接种后14天(DPI)后,大多数线虫已经发展到第四阶段(J4)和女性。在培养和水孵化基团之间的J4或成人女性的数量中没有观察到显着差异(图。1C和D.).这些数据表明,在SI中孵育线虫既不禁止渗透率也不会延迟发展M.禾本科在稻根里面。
为了进一步评估硅是否对线虫的行为产生负面影响,M.禾本科不同浓度的硅溶液(4.7±0.4)和水(4.5±0.3)在0.04%至0.6%的剂量范围内(图4),线虫死亡率没有显著差异。1E).这些数据表明,研究剂量的硅对线虫没有杀线虫作用M.禾本科长达72小时。
SI修正案诱导米盾M.禾本科
为了评估Si的潜在启动效果,将不同浓度的Si修正为植物生长底物,并在初步实验中在14 dpi下评估植物感染率。根据观察结果,对0.04%Si的修订是最有效的剂量诱导米饭防范M.禾本科,对该浓度进行了进一步的研究。在14 dpi时,添加0.04% Si的线虫数量显著减少(53.1±7.8%)(图2)。2A).由于J3/J4线虫会启动瘿瘤的形成,Si的添加也导致根瘿瘤显著减少(65.5±3.1%)(图14 dpi)。2B.).因此,这一结果表明,植物的防御在硅处理后的触须和线虫数量的减少中起着一定的作用。此外,与未处理的对照相比,硅处理的线虫发育略有延迟。在14 dpi,成年女性的比率在0.04% Si-treated植物(0.73±0.06)显著低于摘要植物(0.92±0.08),而一个更高比例的第三和处于第四阶段的青少年:(J3 +阁下s)(0.27±0.04)在Si-treated根比摘要根(0.08±0.05)(图2 c和d).对水稻植株高度和鲜重的测量表明,Si修正案没有限制植株生长。施硅处理植株株高与未施硅处理植株株高无显著差异。2e).Si治疗的线虫接种植物中芽的重量显着高于未处理的接种植物(图。2f.)但没有观察到根重的显着差异。这些数据表明SI修正案可以促使米盾M.禾本科,可缓解线虫对植物生长的影响。Si降低了感染M.禾本科并延迟线虫开发在根内而不抑制植物生长。
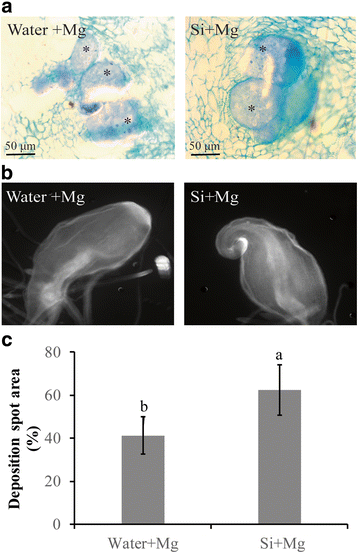
对取食部位的显微观察表明,硅改性根与未改性根的巨细胞数量特征无显著差异。硅改性根的巨细胞数与未改性根的巨细胞数相似(图2)。3A).这些数据表明,硅修饰剂对巨细胞发育没有明显的负面影响。
硅是对线虫感染的基本防御
为了进一步研究Si的加入是否激活了水稻的基础防御,胼胝质、过氧化氢(H2O.2)和木质素在线虫诱导瘿组织进行了研究。在7DPI时(图中虽然Si的修正虫瘿的突出和胼胝质斑点的密度不高于显著更高的非修正虫瘿。3B.),与未修正的植物相比,Si修正的植物的血液沉积点的平均面积增加了21.3%(图。3 c).这些数据显示,根胆管中的呼应沉积可以是水稻植物中抗血液抗性的驱动器之一。
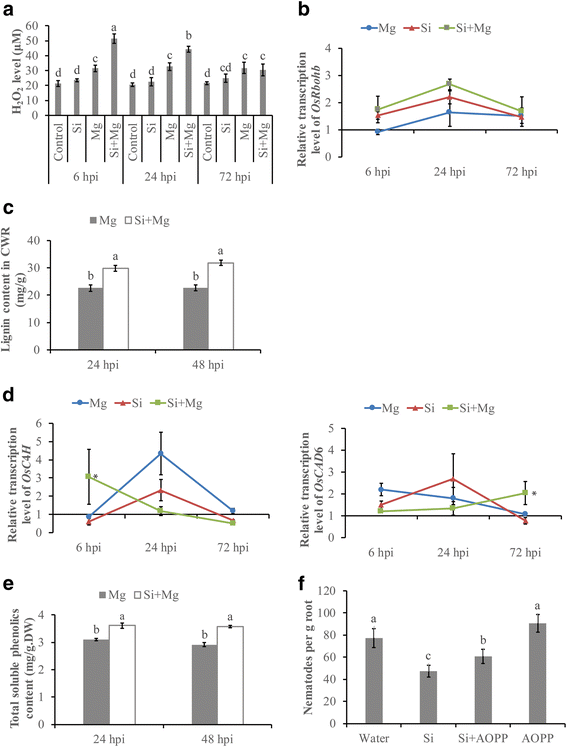
H2O.2在植物的早期防御响应中执行多个重要功能[54].为了研究硅是否能够在水稻中产生活性氧(ROS)M.禾本科互动,H2O.2在不同的时间点分析水平的水稻根。单独的si没有触发h2O.2水稻根部的反应在H没有显着差异2O.2与对照根相比,Si处理后的72 hpi水平被观察到。然而,在线虫胁迫下,硅处理植株表现出诱导H2O.2积累与未处理的植物相比,在6hpi的6 hpi下±15.1%的比较,24 hpi的116.7%±9.8%,但H没有显着差异2O.2Si单独处理和Si处理接种植株在72 hpi水平之间观察到的水平(图。4).此外,表达水平奥斯罗布b,一个h2O.2已知合成基因参与植物免疫反应[55[使用QRT-PCR研究。在SI治疗后,虽然奥斯罗布B基因在所有测试时间内显示出在Si处理的接种处理中的最高表达,与其他治疗相比,在Si治疗的接种治疗中没有检测到显着差异(P. > 0.05) (Fig.4 b).这些数据表明,添加Si可能激活活性氧的快速生成,诱导对根结线虫侵染的防御。
分析H2O.2Si治疗后酚类和木质素。一种H2O.2使用390nm的UV分光光度计测量每克根部的含量。条形为四个重复的平均值,每个都包含六个根池。不同的字母表示显着差异(Duncan的多个范围测试P.≤0.05).B.的定量RT-PCR分析osrbohb.与h相关的基因2O.2生产。C使用ACBR测定法在280nm处测定细胞壁残余物(CWR)中的木质素含量。D.的定量RT-PCR分析OsC4.H和OsCAD苯丙通路中的6个基因。相对转录水平OsC4.H和OsCAD在接种后6,24和72小时分析6次,并标准化为三个内部参考基因,Osexp.那OsEif5.C和Osexpnarsai..数据显示为与对照相比,根相对转录物水平(表达水平设定为1)。条形代表平均值的表达水平±SE从两个独立的生物学重复和三个技术重复,各自含有6株植物的一个池。一个sterisks indicate significant differential expression (Duncan’s multiple range test with P ≤ 0.05).E.使用紫外分光光度计在725nm下测量干重的总溶解酚含量(DW)的根部。在硅修正(Si + Mg)或水处理(Mg)后,在接种后24,48小时进行测量。条形是表示6植物木质素含量的平均值±SE。不同的字母表示显着差异。Fl -2-氨基氧基-3-苯基丙酸(AOPP,一种苯丙类生物合成抑制剂)对线虫侵染的影响。接种前1天,分别在2周龄的水稻根上施用AOPP (100 μM)。接种后14 d,对根内线虫数量进行统计。条形代表来自两个独立的生物复制的数据平均值,每个复制包含六种植物。不同字母表示差异显著(邓肯多重范围检验P≤0.05)
脾气赋予植物细胞壁的机械强度,以增强对病原体入侵的宿主防御[3.那39.那52].在Si-Memeded接种植物中在24和48 HPI下观察到更高水平的木质素,而不是在未修改的接种植物中(图。4摄氏度),表明Si修饰可促进细胞壁木质素化。记录的分析OsC4.H和OsCAD6、苯丙类分子的生物合成途径,进一步证实了这一结果。增强的转录水平OsC4.H和OsCAD与未处理对照相比,硅处理植株在6 hpi和24 hpi下分别观察到6 hpi。4 d).可溶性酚菌可以掺入木质素前体中,并且细胞壁的跛足可以防止宿主通过病原体渗透。在接种后,在两个测试时间点的Si修正的植物中也观察到较高水平的可溶性酚菌素(图。4 e).进一步探讨苯丙砜途径在SI诱导的防御中的作用M.禾本科在水稻中,在接种线虫前24 h,用l -2-氨基-3-苯基丙酸(AOPP)抑制剂对水稻进行抑制。AOPP处理增强了线虫侵染,降低了si介导的防御效果M.禾本科(无花果。4 f).这些结果表明,苯丙素的生物合成参与了硅诱导的防御M.禾本科Si修饰可诱导木质素强化细胞壁。
Si-induced防御M.禾本科是由ET途径介导的
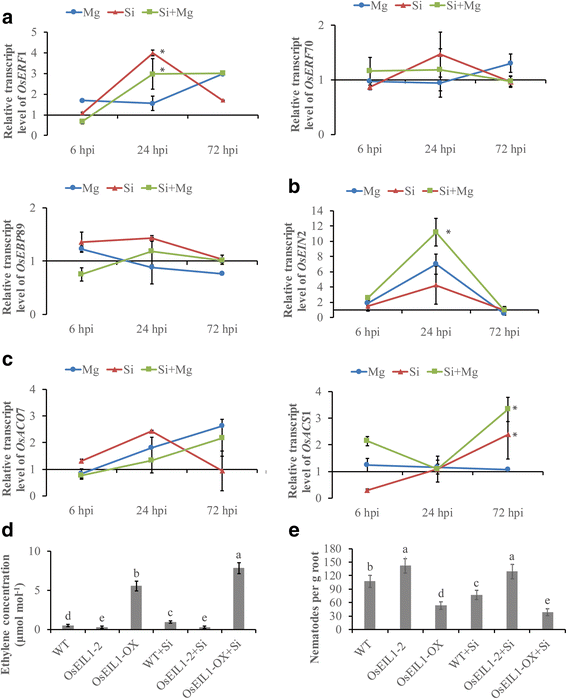
乙烯参与介导植物反应对各种生物和非生物胁迫[25.].为了调查ET途径是否参与SI诱导的水稻rkns,涉及ET生物合成的基因的表达水平(OsACS1,OsACO7)、ET信号(OsEIN2)及ET反应(oserf.70年,OsERF1那Osebp.89)在不同的时间点分析。ET响应基因的转录oserf.在24 hpi时,si修饰的植株中1基因的表达显著高于未修饰的植株。5).该ET信令基因的转录OsEIN与未处理对照相比,si处理后2增加了24 hpi(图2)。5 b).表达没有显着差异OsACOet -生物合成基因7,在任何测试时间都能观察到。的显著增强OsACS1表达在硅处理过的植物上观察到在72 HPI相比于未处理的对照(图1中的表达水平。5度).
乙烯途径中基因的定量RT-PCR分析。一种在ET-反应基因的相对转录水平oserf.1,oserf.70年和Osebp.89。B.et信号基因的相对转录水平OsEIN2。Cet生物合成基因的相对转录水平OsACS1,OsACO7.分析接种后6、24和72 h的基因表达水平,并将3个内参基因归一化。Osexp.那OsEif5.C和Osexpnarsai..数据显示为与对照相比,根相对转录物水平(表达水平设定为1)。条形代表平均值的表达水平±SE从两个独立的生物学重复和三个技术重复,各自含有6株植物的一个池。一个sterisks indicate significant differential expression (Duncan’s multiple range test with P ≤ 0.05).D.水稻植物中的乙烯浓度。乙烯短暂敏感性3样1基因,OsEIL1-2-缺失ET信号的RNAi系和过表达转基因系OsEIL1-OX将加硅或不加硅的改良后的菌体移植到密封的有机玻璃瓶中,各接种100株J2 s。每个有机玻璃箱内的空气样品用24 hpi的气相色谱仪进行分析。E.硅修饰剂对乙烯突变体线虫侵染的影响。乙烯insensitive3-like1gene,OsEIL1-2-缺失ET信号的RNAi系和过表达转基因系OsEIL1-OX分别接种100个J2 s,在14 dpi下对水稻根内线虫进行研究。一个japonica.野生型(WD),Taijing394,作为对照。条形表示来自两个类似实验的数据的手段,每个实验含有10个单独的植物。不同字母表示差异显著(邓肯多重范围检验P≤0.05)
Oseil1.参与乙烯信号转导途径,是水稻乙烯反应的正调控因子[31.].为了进一步探讨对于Si引起的防御ET反应的作用M.禾本科,两个转基因植物中的乙烯水平和线虫感染,OsEIL1-2-RNAi那导致ET信号传导不足,以及OsEIL1-OX,这增加了由ET 15至信令20倍[56,在不同的时间点进行调查。硅处理的乙烯浓度较高OsEIL1-OX在24 hpi时,植株的生长速率比未处理的植株高(图。5 d).在野生型植物中也观察到类似的结果。而si处理组间无显著差异OsEIL1-2-RNAi植物比在测试时间点处于未处理的植物。在14dpi时,在中观察到更多的线虫OsEIL1-2-RNAi植物比在野生型植物中(图。5 e).然而,si处理与未处理之间没有显著差异OsEIL1-2-RNAi植物。转基因株系的线虫数量显著降低OsEIL1-OX而不是在野生型植物中。观察到更少的线虫OsEIL1-OXSi处理后的转基因植株。因此,硅的启动效应仅在过表达的转基因株系中存在,而在不敏感株系中不存在。这些结果表明,ET信号通路参与了硅诱导的防御M.禾本科在大米。
讨论
在本研究中,我们已经证明,水稻根系与硅的修正案由RKN减少感染M.禾本科.该Si诱导的防御与多方面防御反应的引发相关联的,包括增强ET-途径表达的,胼胝质的沉积,和H的累积2O.2和酚类化合物。引发是通过施用低水平的所谓“引发剂”诱导的独特生理状态,这使得植物细胞能够以比非灌注细胞更快速和稳健的方式响应病原体侵袭的挑战[10.].我们的结果表明,0.04% Si的添加量比0.08%或更高的添加量产生的根瘿数量最少。在我们之前的研究中,1.2%的生物炭添加量比5%的生物炭添加量减少了水稻根中线虫的数量[20.].Ji等[24.发现,由低水平的β-氨基丁酸(巴巴)诱导的引发能够诱导对根结线虫的快速且有效的防御反应。
在植物和线虫之间的兼容相互作用中,线虫感染引发了一组围绕受感染的宿主细胞的局部响应[18.].这些反应包括氧化突发,细胞壁组合物的变化和致病相关基因的表达的激活。许多这些响应是通过交叉通信信号转导途径调节,在这种反应途径内,植物激素满足中枢角色。H2O.2已被证明能抑制多种微生物病原体的生存能力,其氧化电位在植物-病原体相互作用中有助于植物壁的加强[54].我们的研究表明,H2O.2在早期阶段中的Si-修正根中观察到,表明由硅上的线虫诱导的氧化突发介导的启动效应。先前的研究表明,增加的产量为h2O.2通过过氧化物酶引起单木质素的聚合,继而形成木质素[4.].结果表明,改性后的植物中木质素和可溶性酚类物质的含量显著高于未改性的植物。施硅可增加叶表皮硅化泡状细胞的密度,有助于提高水稻对稻瘟病的抵抗力[27.].根据Rodrigues等人[39.而硅介导的水稻对稻瘟病的抗性与酚类化合物的积累有关。罗德里格斯等[39.还发现,葡聚糖酶,过氧化物酶和PR-1转录物的差异积累与Si提供的水稻植物中较高浓度的酚类化合物和木质素有关。在植物防御反应期间,发现细胞壁中的木质素或木质素样酚类化合物积累在各种植物微生物相互作用中发生,因此,通过侵入性病原体考虑了对成功渗透的第一行防御[3.].
RKN有能力用毛头扇穿透细胞壁并获得对细胞营养的进入[29.].然而,线虫面临着早期侵袭性防御的许多障碍,包括细胞壁瘫痪和ROS的快速积累,然后是代谢和激素谱的变化[3.那21.].胼胝质是在生长和分化的特定阶段的细胞壁相关结构的组成部分。损伤、病原体感染和其他生理应激均可诱导胼胝质沉积[46.].本研究结果表明,硅修饰剂可促进水稻植株线虫侵染后胼胝质沉积。Ji等[24.]还观察到,防御激活分子β氨基丁酸(BABA)诱导的RKN感染后在胼胝质沉积一个显著增加水稻根部。在拟南芥胼胝质沉积的增强增强了合胞体对包囊线虫的防御能力H. Schachtii.[2].然而,在我们之前的研究中,接种RKN后,生物炭添加物并没有诱导根瘤中胼胝质沉积[20.].这些结果表明,由于不同的引发剂,植物中的防御机制可以不同。
植物需要广泛的防御机制,有效地打击微生物侵犯,包括预先存在的物理和化学障碍,合成植物鞘素,增强加强细胞壁,以及抗真菌蛋白的产生[47.].以往的研究表明,植物激素乙烯在许多植物的防御反应中起着关键的调节作用。斯波卡斯等人[45.]观察到从生物炭修正的土壤诱导植物抗性的外源ET生产到不同的病原体。Fudali等人。[15.表明et过量产生的拟南芥对植物的吸引力较小M. hapla..Nahar等人。[34.]发现,外源ET供体诱导水稻产生强烈的系统防御反应,JA途径在ET诱导的防御中起关键作用。然而,外源油菜素内酯被发现能够通过JA途径抑制水稻对根结线虫的防御[35.].本研究表明,ET在硅诱导水稻根结线虫系统防御中起关键作用。ET反应基因oserf.与非修正的未感染植物相比,在与未修正的感染植物相比,不仅在Si修正的未感染植物中显着诱导了1。与未修正的受感染植物相比,在Si修正的受感染植物中。ET反应基因的增强转录可能有助于防止水稻植物,并降低SI处理植物中的线虫感染。此外,SI对不敏感线没有影响OsEIL1-2-RNAI,而在转基因系中观察到显着抑制的反应Oseil1-ox,进一步证实ET在调控水稻抗rkn防御反应中的作用。在我们之前对水稻生物炭诱导抗性的研究中也得到了类似的结果。外源生物炭增加et反应基因的表达oserf.1,Osebp.89水稻和RKN的感染减少M.禾本科[20.].这些结果表明Si对水稻植物的影响取决于ET信号。
结论
我们展示了稻谷中的SI修正案强调了对RKN的启动防御反应M.禾本科.这种硅诱导的抗性与ET反应的激活、胼胝质的沉积、H的积累有关2O.2线虫攻击后的酚类化合物。需要进一步的研究来模拟在Si-Plant-Nematode系统中诱导的乙烯信号转导途径,并在水稻中更好地了解SI诱导的防御。
方法
植物材料和硅
可溶性硅肥(SIO2≥99.8%,颗粒直径10 - 20nm, pH 4-6),由中国衡水中科奇润生物有机肥公司提取,密封塑料容器保存使用。合成吸水性聚合物(SAP)底物是用1:400 (w: v)的沙子和SAP的混合物制备的[21.那38.].在播种之前,在不同浓度(0,0.04,0.08,0.15,0.3和0.6%)的不同浓度(0,0.04,0.08,0.15,0.3和0.6%)混合硅肥料。
米种子(水稻简历。Nipponbare)从美国农业部(GSOR-100)获得,并于中国湖南省汉州县培育。一个转基因OsEIL1-2-缺失ET信号的RNAi系和转基因EIL.过表达(15- 20倍)线OsEIL1-OX由Yang等人构建[56培育于河北省廊坊市实验基地。水稻种子浸泡在5.25%次氯酸钠5 - 10分钟,在28°C 4 d发芽。一个双生的种子播种在每个聚氯乙烯(PVC)包含SAP管。稻秧维持在26°C温室与相对湿度70 - 75%和16 h / 8 h光明/黑暗政权和灌溉用20毫升的霍格兰溶液两次per week.
线虫提取和文化
M.禾本科由湖南省汉州县的田地收集,并在26-28°C的温室中维护了Nipponbare。接种后一个月,在显微镜下将Nematode卵与根胆中分离,并在26℃下孵化48小时。将二阶幼年(J2)悬浮液过滤通过25μm筛过滤并重新悬浮在蒸馏水中,浓度为每毫升约100个线虫[6.].
Si对线路线虫行为的直接影响
将硅肥分别溶于0.04、0.08、0.15、0.3和0.6% (w: v)的蒸馏水中24 h,悬浮液10000 g离心3 min,收集上清液分析硅对线虫的毒性。大约100j2 s被放置在含有1ml Si溶液或蒸馏水的6孔培养板(直径3.5 cm)中。72h后,在溶液中加入1n NaOH,在体视显微镜下计数死线虫/活线虫[8.].试验共进行3次,每次6个重复。
为了测试Si对…的吸引力的直接影响M.禾本科对于米根,23克Pluronic F-127粉末(Sigma-Aldrich,China)在4℃下溶于100ml无菌水中[21.].2周龄植株的根用20ml 0.04%硅渗出液或水浸湿。24小时后,切下1厘米长的根尖,放入含有约100 J2 s和1 mL Pluronic凝胶的培养板中。离根尖5 mm范围内吸引的线虫数为6 hpi。试验共进行3次,每次6个重复。
确定Si对线虫感染性的直接影响,M.禾本科j2s在Si溶液中孵育48 h后接种。对照线虫在蒸馏水中培养。将两周龄水稻植株接种100 J2 s,在温室中保持。在14 dpi时,根样本被洗干净,并在0.6% NaOCl中浸泡5分钟。根样本分别用微布包裹,用酸性品红染色3分钟,如Nahar等人所述[34.].在4%酸化甘油中脱离3-4天后,在立体显微镜下计算每个发育阶段的根内的线虫。为了计算线虫的比例,不同寿命中的线虫数量(雌性或J3 / J4)的数量除以使用Microsoft Excel 6.0(Redmond,华盛顿,美国)的根源中线虫总数。
SI诱导的抗性M.禾本科
为了测试添加硅是否能诱导水稻防御M.禾本科,以约100J2秒为接种在适当浓度的Si中维持的每个2周龄植物。在14 dpi下,测量植物高度和鲜重量。然后,计算根胆汁,并如Nahar等人所述染色根样品。[34.].统计了根内线虫种类及其发育阶段。试验共进行3次,每次6个重复。
为了更详细地了解ET响应在SI诱导的防御对RKN的作用的理解,OsEIL1-2-RNAi细胞系缺失ET信号,转基因细胞系过表达OsEIL1-OX[56]用Si或水处理并接种100 J2 s。一个japonica.野生型,Taijing394,作为对照。在24 hpi下,Gil等人分析了水稻植株中的乙烯浓度[17.稍作修改。有一段时间,水稻被移植到一个有机玻璃瓶里。这些瓶子在接种线虫后用塑料胶带密封。用1毫升注射器抽取每个有机玻璃盒中的空气样本。采用气相色谱仪(GC-8000系列,Fison Instruments, Rodano,意大利米兰),配备FID检测器和Boraplot Q柱(Chrompack毛细管柱,Varian公司,Walnut Creek, California, USA)分析乙烯气体浓度。在14dpi时,对根内线虫进行计数。整个实验共进行两次,每次10株。
巨细胞和胼胝质沉积的显微镜观察
如由Ji等人所述进行巨细胞的显微观察。[23.].实验重复两次,每次复制时10甲。每个2周龄植物接种100 J2 S,并在7 dpi收集根胆。在将1×管缓冲液中固定过夜后,用根胆汁在几种乙醇稀释液中脱水,并嵌入Technocit 7100进行2周。将嵌入的胆组织与10μm切片分成10μm切片,用冷冻杆NX50低温恒温器(Thermo Fisher Scientific,MA,USA),并用0.05%甲苯胺蓝染色5分钟。使用IX83研究倒置显微镜(Olympus光学公司,东京,日本)以40放大率进行显微镜观察。
根据Millet等人的方法检测胼胝质沉积[33.].的稻植物保持在0.04%的Si或在2周的控制条件,并用100 J2 s各自接种。来自每个治疗十根虫瘿固定在乙醇乙酸溶液过夜,然后在乙醇中稀释脱水。根虫瘿用0.01%苯胺蓝溶液染色。胼胝质沉积,使用一个Eclipse钛落射荧光显微镜(Nikon Tec的。公司,东京,日本)在UV光下检查并使用ImageJ软件定量。
量化H2O.2、木质素和总可溶性酚类物质
每个两周的稻米植物保持在SAP中,用0.04%Si添加或模拟溶液,并接种100 J2 S。在接种后接种并在几个时间点接种之前M.禾本科,为H收集根样品2O.2、木质素和总可溶性酚类物质的定量分析。
H的积累2O.2在Planta.采用Velikova等人所述的三氯乙酸(TCA)方法测定[51].在6,24和72hpi,从六植物的池中收集0.1g新鲜根样品,并如Ji等人所述处理。[24.].实验进行了两次,每次重复四次。
木质素定量使用乙酰溴(AcBr)方法,如Vanholme等人所述[49.].在24和48 HPI下,收集来自六种单独植物的新鲜根,并在速度下在-20℃下干燥3天。干燥的根部被研磨并用一系列水,乙醇,氯仿和丙酮萃取。在280nm下测量木质素吸光度,并如Vega-Sánchez等人所述计算。[50].每个实验进行2次,每次4个重复。
如罗德里格等人所述量化总可溶性酚类。[39.].在24和48 HPI下,收集根并冷冻干燥3天。干燥的根部被研磨并以一系列甲醇,folin-phenol和碳酸钠萃取。在725nm下测量样品的吸光度,并如Zierslin和Ben-zaken中所述计算[57].试验共进行2次,每个处理3个重复。
进一步研究木质素合成相关的苯基丙素途径在硅诱导防御中的作用M.禾本科,100μM的L-2-氨基氧基-3-苯基丙酸(AOPP),苯丙烷化生物合成的抑制剂,在线虫接种前与0.04%Si 24h组合施加到根部。然后,将植物分别用100J2 S接种并如上所述在14dPI下研究。
QRT-PCR的转录分析分析
为了分析不同植物防御相关基因的转录水平,用RNeasy plant Mini试剂盒从6株单株植物的根样品中提取RNA,用SuperScript®II逆转录酶试剂盒(Invitrogen公司,上海,中国)合成cDNA。用于防御相关基因和内参基因qRT-PCR分析的引物序列如表所示1.所有QRT-PCR分析都是通过7500快速的实时PCR系统(Thermo Fisher Scientific,北京中国)进行三份,这是两个独立的生物重复,如Huang等人所述。[21.].与非修正的非接种对照植物相比,防御相关基因的相对表达水平作为折叠变化,其设定为1。
统计分析
采用SAS软件8.0版本(SAS Institute, Cary, NC)对数据的平均值和标准误差进行统计分析。显著差异(P.≤0.05)B.E.tween the treatments were determined according to Duncan’s multiple range test.
缩写
- DPI:
-
接种后的日子
- 等:
-
乙烯
- H2O.2:
-
过氧化氢
- HPI:
-
接种后的小时
- 红外:
-
诱导阻力
- JA:
-
茉莉酸
- 朋友:
-
苯丙氨酸
- 痘:
-
过氧化物酶
- PPO:
-
多酚氧化酶
- PR:
-
发病机制相关
- PVC:
-
聚氯乙烯
- RKN:
-
根结线虫
- SA:
-
水杨酸
- SAP:
-
合成吸水聚合物
- 特别行政区:
-
系统获得性耐药
参考
- 1。
王志强,王志强,王志强,等。根结线虫寄生与寄主反应的分子基础研究。植物学报2003;4:217-24。
- 2。
转录因子RAP2.6的过表达增强了合胞体的胼胝质沉积,增强了对甜菜包囊线虫的抗性heterodera schachtii.在拟南芥根。BMC植物BIOL。2013; 13:47。
- 3.
Bhuiyan NH,Selvaraj G,魏Y,在植物防御木质化王J.作用。植物信号表现。2009; 4:158-9。
- 4.
Boerjan W,Ralph J,Baucher M. Lignin生物合成。Annu Rev植物Biol。2003; 54:519-46。
- 5.
桥梁J,PlowRight Ra,Peng D.米的线虫寄生虫。在:Luc M,Sikora Ra,Bridge J,编辑。亚热带和热带农业的植物寄生线虫。瓦莱德福:CAB INTERINATIONS;2005. p。87-130。
- 6.
关键词:土壤,线虫,快速浮选筛分技术。植物Dis报告。1966;50:954-7。
- 7.
Cacique是,Domiciano GP,RodriguesFá,FXRD V.硅和锰耐水稻抗爆。Bragantia。2012; 71:239-44。
- 8.
陈思义,迪克森DW。一种测定活的第二阶段幼体的技术Heterodera甘氨酸.J Nematol。2000;32:117-21。
- 9.
Chérifm,asselin a,bélangerr.由concumber根中可溶性硅引起的防御反应Pythium spp..植物病理学。1994;84:236-42。
- 10。
Conrath U,Beckers GJ,Flors V,Garcia-Agustin P,Jakab G,Mauch F等人。启动:准备战斗。Mol植物微生物相互作用。2006; 19:1062-71。
- 11.
Datnoff LE,罗德里格斯楼Seebold KW。硅和植物病害。在:Datnoff LE,埃尔默WH,胡贝尔DM,编辑。矿质营养与植物病害。明尼苏达州圣保罗:美国植物病理学会;2007年第233-46。
- 12.
董欣。系统获得性抗性。植物病理学杂志2004;42:185-209。
- 13。
Dutra Mr,Garcia Ala,Paiva Brtl,Rocha FS,Camposvp。efeito dosilícioaplicado na semeadura do feijoeiro noberte de nematoide de galha。Fitopatol胸罩。2004; 29:172。
- 14。
Dutta TK,Gangquency Ak,Gaur Hs。水稻根结线虫的全球地位,有graminicola.AFR J Microbiol Res。2012; 6:6016-21。
- 15.
王灿,王福达,威廉姆森VM。乙烯信号通路调节寄主根对根结线虫的吸引力meloidogyne hapla..植物与微生物互动学报2013;26:75-86。
- 16.
Gheysen G,Mitchum Mg。线虫如何操纵植物开发途径进行感染。CurrOp植物BIOL。2011; 14:415-21。
- 17.
叶海涛,王海涛,王海涛,等。油梨根系缺氧对叶片气孔导度、ABA和乙烯含量的影响。植物信号学报。2009;4(2):100-8。
- 18.
透过,Smant G.寄生线虫的植物先天免疫激活和抑制。ANU Rev Phytopatho。2014; 52:243-65。
- 19.
GuimarãesLMP,Pedrosa EMR,Coelho RSB,Couto EF,MaranhãoSrvl,Chaves A. EyividadeEnzimáticaelicitada Por Metil Jasmonato E Silicato dePotássioMECAMCana-de-AçúcarParasitada Por有隐姓埋名的女人.总结Phytopathol。2010;36:11-5。
- 20。
黄文凯,季海林,黄文凯,黄文杰,黄文杰。盆栽培养基对水稻根结线虫侵染敏感性的影响。BMC Plant Biol. 2015;15:267。
- 21。
黄早世,吉汉姆,Gheysen G,Kyndt T.硫胺素诱导的水稻根结线虫感染的启动涉及褐化和过氧化氢。莫尔植物途径。2016; 17:614-24。
- 22。
杰克逊AO,泰勒CB。植物微生物相互作用:界面的生死。植物细胞。1996年; 8:1651-68。
- 23。
Ji H,Gheysen G,Denil S,Lindsey K,Topping JF,Nahar K,等人。通过诱导巨细胞RNA测序的转录分析有graminicola在稻根。J Exp Bot。2013; 64:3885-98。
- 24。
β-氨基丁酸诱导水稻对根结线虫的抗性以增强基础防御为基础。微生物与植物的相互作用。2015;28:519-33。
- 25。
乙烯气体信号转导途径的分子研究。Annu Rev Genet 1998; 32:227-54。
- 26。
杀线虫剂防治水稻根结有graminicola.Phytopathol Mediterr。2012;51:298 - 306。
- 27。
金志成,金志成,王志强,等。硅诱导水稻叶片细胞壁增强水稻抗稻瘟病能力的细胞机制。植物病理学。2002;92:1095 - 103。
- 28.
Kyndt T,Fernandez D,Gheysen G.植物 - 寄生线虫在水稻中的感染:分子和细胞见解。Annu Rev phytopathol。2014; 52:135-53。
- 29.
Kyndt T,Vieira P,Gheysen G,De Almeida-Engler J.Nematode饲养地点:植物根的独特器官。Planta。2013; 238:807-18。
- 30.
梁YC,Sun Wc,Si J,RömheldV.叶面和根应用硅对增强抗白粉病抗性的影响Cucumis sativus.植物病理学。2005; 54:678-85。
- 31。
毛C,王某,贾Q,吴P.Oseil1.,稻米同源物拟南芥EIN3将乙烯反应调节为阳性组分。植物mol biol。2006; 61:141-52。
- 32。
关键词:硅灰石,硅fort, rocksil,渗透,渗透性能meloidogyne javanica在禾本科和豆科中。J Phytopathol。2017;165:91-7。
- 33。
陈志强,陈志强,陈志强,等。先天免疫反应在拟南芥根与微生物相关的分子模式。植物细胞。2010;22:973 - 90。
- 34。
黄志刚,王志刚,王志刚,等。水稻根结线虫的系统防御机制研究进展[j]。植物杂志。2011;157:305-16。
- 35。
油菜素内酯通过拮抗茉莉酸途径抑制水稻对根结线虫的防御作用。植物与微生物相互作用。2013;26:106-15。
- 36。
Nguyen N.全球气候变化和稻米粮食安全。罗马:粮农组织;2002年。
- 37。
Padgham JL, Duxbury JM, Mazid AM, Abawi GS, Hossain M.造成的产量损失有graminicola在孟加拉国的低地雨水米饭。J Nematol。2004; 36:42-8。
- 38。
Reversat G,Boyer J,Sannier C,Pando-Bahuon A.使用沙子和吸水性合成聚合物的混合物作为植物 - 植物 - 寄生线虫在实验室中的族培养。线虫学。1999; 1:209-12。
- 39。
RodriguesFá,茱莉克WM,Datnoff Le,Jones JB,Rollins Ja。硅会影响兼容和不相容的米饭中的细胞学和分子事件 -稻瘟病菌互动。physiol mol植物疗法。2005; 66:144-59。
- 40.
samuel AL, Glass ADM, Ehret DL, Menzies JG。硅在黄瓜植株中的迁移和沉积。植物学报。1991;14:485-92。
- 41。
N.功效假单胞菌荧光和拟青霉属lilacinus反对有graminicola在水稻集约化制度下侵染水稻。植物病理学杂志2011;44:1467-82。
- 42。
西迪基ZA。PGPR:植物病原体的潜在生物防治剂。在:西迪基ZA,编辑。PGPR:生物防治和生物施肥。荷兰:斯普林格;2006年第111-42。
- 43。
Silva RV,Oliveira Rdl,Nascimento KJT,Rodrigues Fa。咖啡耐力的生化反应Meloidogyne exigua.由硅。植物病理学研究。2010;59:586 - 93。
- 44。
索里亚诺IR的Reversat G.管理有graminicola菲律宾南吕宋岛旱稻产量。线虫学。2003; 5:879-84。
- 45。
Spokas Ka,Baker JM,Reicosky DC。乙烯:生物炭修正案的潜在关键。植物土壤。2010; 333:443-52。
- 46。
石ba,克拉克ae。(1-3)-β-D-葡聚糖的化学与生物学。维多利亚州:拉罗贝大学出版社;1992年。
- 47。
吨J,van Pelt Ja,Van Loon Lc,Pieterse cm。依赖水杨酸盐依赖性和含茉莉/乙烯依赖性抗性的差异效果拟南芥.植物与微生物的相互作用。2002;15:27-34。
- 48。
Vallad Ge,Goodman Rm。常规农业中的全身获得性能和诱导全身性抗性。农作物科学。2004; 44:1920-34。
- 49。
Vanholme B,Cesarino I,Goeminne G,Kim H,Marroni F,Van Acker R等。含有罕见缺陷等位基因(BRDA)的繁殖:自然Populus nigra.HCT突变体改性的木质素作为个案研究。新植物。2013; 198:765-76。
- 50.
Vega-Sánchez ME, Verhertbruggen Y, Chen X, Sharma V, Varanasi P, et al.。纤维素合成酶样F6功能的丧失影响了混合连接葡聚糖沉积、细胞壁力学特性和水稻营养组织的防御反应。植物杂志。2012;159:56 - 69。
- 51.
陈志强,王志强,王志强,等。酸雨对大豆幼苗氧化应激和抗氧化系统的影响。植物科学。2000;151:59 - 66。
- 52.
vonRöpenacke,Parr A,Schulze-Lefert P.溶解和细胞壁结合酚醛植物的结构分析和动力学在大麦粉状霉菌的广谱抗性中。J Biol Chem。1998年; 273:9013-22。
- 53。
关键词:大麦,白粉病,渗透胁迫,硅,渗透胁迫植物营养与土壤学报,2005;168:269-74。
- 54。
Wu G, Shortt BJ, Lawrence EB, Leon J, Fitzsimmons KC, Levine EB等。通过增加H2O.2在转基因植物。植物杂志。1997;115:427-35。
- 55。
黄海林,林志强,黄志强,等。Rac GTPase结合水稻NADPH氧化酶的n端延伸调控。植物细胞。2007;19:4022-34。
- 56。
杨超,马斌,何淑娟,熊强,段克新,尹春成,等。毛虎子6/ETHYLENE INSENSITIVE3-LIKE1和ETHYLENE INSENSITIVE3-LIKE2调控水稻根和胚芽鞘的乙烯反应,并对水稻耐盐性产生负面影响。植物杂志。2015;169:148 - 65。
- 57。
玫瑰花梗中过氧化物酶活性和酚类物质的存在。植物生理生化。1993;31:33 - 9。
资金
国家自然科学基金项目(no . 31571986);国家重点基础研究发展计划项目(no . 2013CB127502)。关键词:岩石力学,裂隙发育,裂隙发育,数值模拟
数据和材料的可用性
本研究中产生或分析的所有数据均包含在本文中。
作者信息
隶属关系
贡献
WKH和DLP构思了研究并监督所有实验。LPZ进行了大部分实验。HP,LAK和YL参与了线虫接种实验和QRT-PCR分析。SML和DLP有助于起草稿件。WKH和LPZ讨论了结果并写了稿件。所有作者阅读并认可的终稿。
通讯作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
利益争夺
两位作者宣称他们没有相互竞争的利益。
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
权利和权限
开放访问本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
詹,LP。那P.E.ng, DL., Wang, XL.et al。根施加硅对根结线虫抗性抗性增强的启动效果有graminicola在大米。BMC植物杂志18,50(2018)。https://doi.org/10.1186/s12870-018-1266-9
已收到:
公认:
发表:
关键字
- 硅
- 有graminicola
- 乙烯途径
- 木质素
- 召唤
- 诱导防御