摘要
背景
以前,转基因的带毛的叶子芸苔属植物显著直线表示拟南芥GL3基因(AtGL3+) [1)或AtGL3基因结合RNAi结构下调基因表达TTG1(K-5-8行)(2)开发。与非转基因的半无毛叶片相比,这些品种的叶片表现出不同的昆虫取食(跳蚤甲虫)和产卵(小菜蛾)行为显著简历。西星。有趣的是,这些线的子叶仍然是无毛的,但也显示出蚤甲虫的食性减少。在这里,我们研究了这些转基因株系的无毛子叶的组成和整体转录组,以确定这一意外现象背后的机制。
结果
各毛系子叶中约有7500个基因表达上调,低于30个基因表达下调。上调的基因包括细胞壁合成、次生代谢产物生产、氧化还原、应激和激素相关反应,这些基因有可能影响宿主植物对害虫的防御反应。特别是硫代葡萄糖苷生物合成和降解基因在两毛叶系无毛子叶中的表达发生了显著变化。转录组数据由芥子油苷和子叶细胞壁组成谱支持。与K-5-8系相比,AtGL3+系的基因表达变化在多样性和强度上都更为极端。
结论
该研究为这些毛叶系无毛子叶中抗虫化合物和蛋白的分离和鉴定提供了思路。它也证实了错误表达的影响GL3和TTG1除了与毛有关的代谢类型。最后,大量上调基因编码热休克蛋白、PR蛋白、蛋白酶抑制剂、硫代葡萄糖苷合成/分解因子、非生物应激因子、氧化还原蛋白、转录因子、生长素代谢所需的蛋白质也表明,这些子叶现在已经准备好抵抗其他形式的生物和非生物胁迫。
背景
植物具有各种生化和形态防御,旨在阻止昆虫食草和产卵。防御既可在攻击时诱发,也可局限于攻击地点,也可是全身性的,或两者兼而有之(见[3.])。寄主植物抗性分为三大类:1)抗生作用,导致昆虫死亡率增加、寿命缩短或繁殖减少;Ii)抗异种病,影响昆虫的行为,通常表现为相对于易感植物而言,不偏爱抗性植物;iii)耐受性,指植物在类似条件下抵抗虫害或从虫害中恢复的能力,并比易受虫害影响的植物表现得更好[4].具有抗虫性的作物可以减少有害化学残留在环境中的积累,并为农民和种子生产者提供经济效益。
无毛(光滑)和半无毛(少数毛状体)的线芸苔属植物显著l .,芸苔属植物拉伯油菜和芸苔属蔬菜作物易受许多特殊和一般害虫的侵害。蚤甲虫(FBs) [Phyllotreta十字花科(Goeze)和Phyllotreta striolata(Fab))专家芸苔属植物包括加拿大在内的世界几个地区的害虫[5,印度和东欧[6,7].FBs在关键的苗期和成熟期(如叶片和绿豆荚的发育)均发生,降低种子产量和品级。本地兽疫局已对用于控制其疾病的杀虫剂产生抗药性(在[8,9])。这突出了开发抗虫品种以减少使用化学保护方法的重要性。
毛状体(叶毛)已进化成一种物理防御,以抵御食草动物的进食和产卵[10,毛的密度和长度都对许多昆虫的这一过程产生负面影响。毛状体在拟南芥L.在发育叶片的远端发育,从而保护叶片中更柔软、更年轻的部分,这些部分是小菜蛾产卵的首选部位,也更容易受到FB和Psylloides喂养损害[11,12].成熟的芸苔属植物摘要叶子有非常高的毛密度(约4000厘米−1),也不会受到田间FB的伤害,因为这些昆虫会避开树叶[13].
几个拟南芥无毛(缺乏毛状体)突变体也缺乏次级代谢物的产生,最明显的是花青素。毛状体形成和次级代谢物产生之间的联系是通过Myb/bHLH/TTG1 (MBW)转录调节复合物的成分共享而实现的。在毛状体形成过程中,基本的螺旋-环-螺旋转录因子GL3,或类似的因子GL3的ENHANCER,与R2R3-MYB因子GL1和WD-repeat蛋白TTG1形成一个调控复合物,并与GL3和EGL3相互作用。该调控复合物激活编码GL2、TTG2和SIM等次级转录因子的基因表达,诱导毛状体形成。此外,至少有6个其他R3 MYB蛋白(CPC、TRY、ETC1、ETC2、ETC3和TCL1)可以替代GL1扰乱和/或改变调控复合物的特异性[14,15,16].参与花青素生物合成后期阶段的基因编码酶由一个类似的复合物TTG1和GL3调控,但MYB因子不同[17].
早些时候,我们证明了异位表达答:芥GL3显著增加毛状体的形成显著但会影响植物的发育[1].当内源性表达时,毛状体的产生进一步增强,而发育异常得到缓解TTG1基因通过引入RNAi结构而减少[2].像毛b .摘要,转基因毛叶植物幼苗FB摄食减少显著行(1,2,18]因为昆虫不会开始在毛状体增强的叶子上进食探针[2,19].这些株系的叶子在它们的转录组和生长模式上表现出很大的变化[2].奇怪的是,无毛的子叶从毛叶转基因显著线也显示高度减少FB喂养(30-50%)[18].这表明,抗异种效应可能是由于转基因植株的结构发生了改变,因为在植株发育过程中,这两种转基因植株的子叶最初都是垂直取向的,然后逐渐变为水平取向。然而,他们不能排除生化成分的变化也参与的可能性。FBs对取食的吸引和刺激主要由宿主植物的硫代葡萄糖苷和/或它们的分解产物控制[20.].这提示了该基因的组成和表达模式AtGL3转基因无毛子叶也可能被改变,从而影响FB的行为。在这里,我们检查了两个转基因有毛的无毛子叶的组成显著线条:一条毛茸茸的叶线表示AtGL3基因(AtGL3+)和超毛叶系(K-5-8)表达AtGL3和表达下调BnTTG1基因。结果表明,这些品系的子叶次生代谢物(花青素和硫代葡萄糖苷)和木质素含量发生了变化,次生代谢物生物合成和降解、细胞壁生物合成、激素和木质素基因的表达也发生了变化。以及氧化还原蛋白,这些蛋白可能导致宿主植物对害虫的线索发生变化。
方法
植物材料
本研究采用三种植物的未处理种子:半无毛叶显著简历。Westar(亲本),纯合子多毛叶AtGL3转基因显著从一份简历发展而来。Westar亲本(系AtGL3+, 1)和纯合子超毛转基因叶片显著(K-5-8行)高度还原的BnTTG1表达式中AtGL3+显著背景(2].种子灭菌后,放在MS固体培养基上。在无杀虫剂的条件下,在22/18的受控植物生长室中,品红罐子中(10个种子/重复)培养了3个重复的7天龄幼苗,用于芥子油苷(GS)、细胞壁成分分析和RNA测序oC;16 h光周期;60 - 80μmoles.m−2.s−1).用于毛状体基因qRT-PCR的子叶生长在22/24o光周期为16 h,光功率为400 μE。米−2.s−1.在400 μE连续光照条件下培养10 d,测定子叶表型变化、花青素含量和花青素基因qRT-PCR。米−2.s−1).
子叶成分分析
根据AOCS官方方法Ak 1-92提取7日龄子叶,将硫代葡萄糖苷(GS)转化为硫代葡萄糖苷(DS-GS)。特别是冻干子叶(~ 0.1 g)与钢筋激动(25×8毫米)的埃伯往复摇动10分钟在280 rpm,然后3毫升的甲醇和1毫升的0.2毫米苄GS添加和震动持续了60分钟。在2300 g离心后15分钟,将3 ml上清液上载于0.3 ml预膨胀DEAE-Sephadex树脂(~ 30 mg),在Bio-Spin微柱(Bio-Rad, Mississauga Canada)中。用1.5 ml 2%乙酸、1.8 ml水、1.2 ml 20 mM醋酸钠(pH 4.0)冲洗树脂,再加入100 μl纯化的硫酸酯酶溶液,封闭微柱,20℃孵育过夜。DS-GS用1.2 ml水洗脱,用Waters UPLC-PDA-TQD系统和BEH Shield RP18色谱柱(2.1 × 50 mm;(100%水,0.8 mL/min)浸泡0.3 min,然后以0% ~ 25%乙腈(v通过MS/MS恒定中性损失扫描监测162.2个质量单位的特征损失来识别DS-GS在229 nm处的定量。
细胞壁碳水化合物和木质素在纯化细胞壁残渣(CWR)上的测定方法参照UpdeGraff [21, Brinkman等[22,以及昂等人[23].用Triton X-100在磷酸盐缓冲液中提取10 mg 7日龄子叶。基于硫代乙醇酸-碱性水解法测定木质素含量22],并在280 nm下使用UV/VIS分光光度法进行定量,并用商业木质素绘制了校准曲线(Sigma-Aldrich, Oakville, ON, Canada)。根据Theander等人的方法,在去除糖和淀粉后,使用商业纤维素标准(Sigma-Aldrich)和蒽酮试剂分光光度法从CWR中测定总酸释放纤维素葡萄糖[24].
子叶RNA序列
使用RNAeasy Mini Kit从7日龄幼苗的子叶中提取总RNA,使用RNAse-free DNAse™(Qiagene Inc., ON Canada)去除污染的gDNA。使用安捷伦2100生物分析仪™(Agilent Technologies, Palo Alto, CA USA)中的RNA6000纳米分析技术对RNA样本进行定量和RNA完整性测定。使用Illumina TrueSeq RNA样品制备平台v.2进行RNA库的制备和测序,该平台具有多重标记,符合制造商的协议。cDNA文库的开发、RNA测序和数据分析的细节与Alahakoon等人发现的相同[2].与cv相比,转基因毛叶株系子叶基因表达发生了变化。然后将weststar子叶表达导入MAPMAN,分配到36个功能条形码索引编号(BIN)类目[25].
定量逆转录PCR (qRT-PCR)分析
对10日龄子叶进行qRT-PCR检测AtGL3表达和所有同源物的总合转录为每五个显著监管基因(BnGL1,BnGL2,BnGL3,BnTTG1和BnTRY)编码已知参与毛状体MYB-的蛋白质βAlahakoon等人提出的HLH - WD40三蛋白起始复合物[2].
统计分析
子叶成分和qRT-PCR数据采用SAS 9.2的MIXED模型进行单因素或双向方差分析[26或t检验。采用正态性检验(Shapiro-Wilk)、等方差检验(Brown Forsythe)和Levenes检验对方差分析假设进行检验。在SAS 9.2中,使用Tukey检验或Dunn方法进行两两比较,处理在P≤0.05,趋势宣布在P≤0.1。使用Cufflinks软件包中的Cuffdiff对RNA-seq数据进行读取计数和统计分析[27].
结果
子叶构成
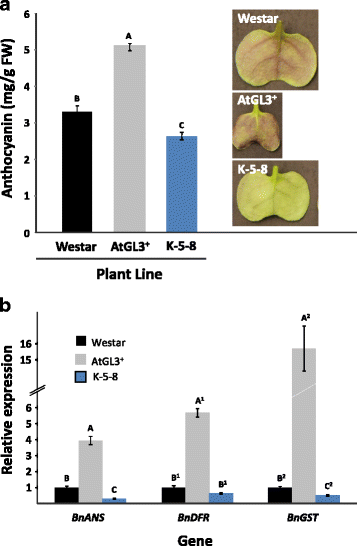
与真叶一样,无毛的AtGL3+子叶比Westar和K-5-8子叶小得多(图5)。1插入),反映出AtGL3+株系身材较小,活力较低,而K-5-8株系子叶大得多,随后植株活力较高[2,18].我们比较了表达的子叶的生化组成AtGL3以确定特定的次生代谢物或聚合物是否有助于细胞强化可能与改变的昆虫行为相关。花青素在幼嫩植物中作为昆虫防御的一种手段特别有用,因为它们改变了植物的光谱特性,可能使其不那么可见,并增加了它们的酚含量[28].AtGL3+子叶的背面也比weststar子叶表现出更多的红色,而K-5-8子叶在室内连续光照胁迫子叶时,背面呈绿色(图5)。1插入)。红色是由于花青素增加(图。1)和三个花青素基因的转录增加(BnANS,BnDFR和BnGST)在AtGL3+子叶中与其他两种品系比较(图。1 b).
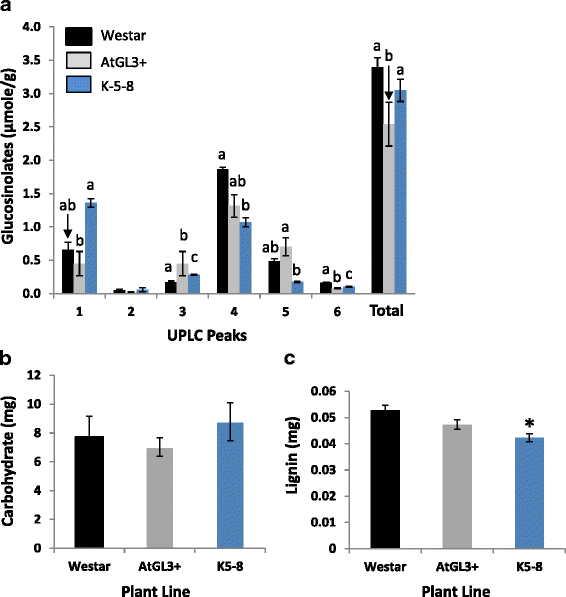
硫代葡萄糖苷是硫连接的糖苷,常见于十字花科/十字花科的物种中[29].十字花科专家(如FB)的摄食起始受到来自寄主植物的硫代葡萄糖苷及其分解产物的影响[20.].2个转基因品系和Westar的无毛子叶中GSs的水平比种子中GS的水平低1000倍(数据未显示)。K-5-8子叶的总GS水平与Westar无显著差异,而AtGL3+系的总GS水平较低(图2)。2).GS廓线的表达AtGL3也被发现与西星不同,而且彼此不同。子叶GSs以Progoitrin (2-OH-3-butenyl-GS)、4-羟基-3-吲哚甲基- gs和吲哚-3-甲基- gs含量最高。progoitrin在转基因株系中的水平与Westar相似,但在K-5-8株系中的水平显著高于AtGL3+。葡萄糖苷(3-丁烯基- gs)在转基因品系中显著升高,在AtGL3+品系中进一步升高。K-5-8品系的4-羟基芥菜素水平仅为西施达的60%,降低了4-羟基芥菜素水平。转基因品系的甘蓝型油菜素水平与Westar相似;而K-5-8子叶的GS含量显著低于AtGL3+。两种转基因子叶中4-甲氧基-芥菜素(4-甲氧基-吲哚-3-甲基- gs)的水平均低于Westar,而AtGL3+的水平甚至低于K-5-8。
7日龄无毛子叶组成。一个硫配糖体。UPLC峰代表:1,progoitrin (2-OH-3-butenyl-GS);2, glucoraphanin (4-methylsulfinylbutyl-GS);3, 3-butenyl-GS;4, 4-hydroxy-3-indolylmethyl-GS;5, 4-methoxy-3-indolylmethyl-GS;6, 4-methoxy-glucobrassicin (4-methoxy-indol-3-ylmethyl-GS)。不同字母表示各复合类型内每行平均值的两两显著性差异(±SD) (p< 0.05)。b细胞壁残渣碳水化合物。c细胞壁残余木质素。星号(*)表示平均值(±SD)相对于cv的显著性差异。向西(p< 0.05)
植物细胞壁成分(例如纤维素、半纤维素、果胶和木质素)的改变可强化植物组织,使它们更难以食用,也更难以从中提取营养[30.].转基因株系子叶细胞壁碳水化合物含量与cv相近。西星(无花果。2 b).从细胞壁残渣中提取的木质素与AtGL3+细胞系相似,但在K-5-8子叶中显著降低(图2)。2摄氏度).
与昆虫寄主线索、代谢和调控相关的子叶转录组
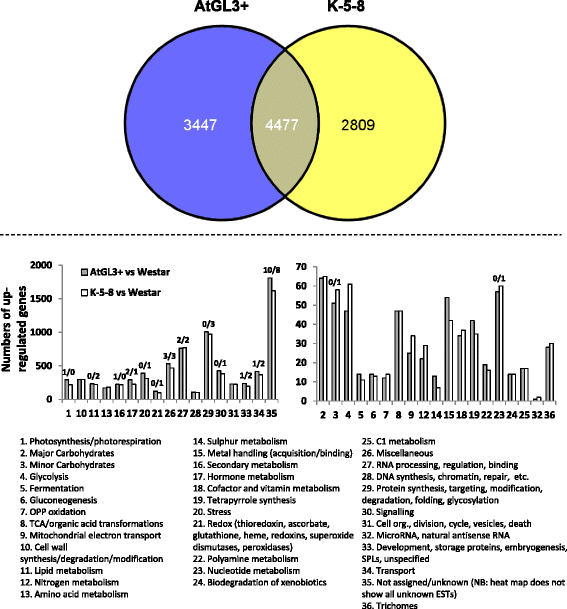
K-5-8和AtGL3+系的无毛子叶对FB摄食的抗性与杀虫剂处理的Westar [18].为了进一步研究这些现象,我们进行了RNA-Seq分析,以确定可能影响昆虫行为的子叶转录模式。在AtGL3+系和K-5-8子叶中,相对于Westar子叶,分别有7924个和7286个基因表达上调,其中常见的有4477个(图5)。3.).奇怪的是,相对于Westar而言,毛系或超毛系中下调的基因不到30个。3.;额外的文件3.:图S1和附加文件4:图S2)。这些基因可以被组织在36个MAPMAN功能类别(BINS)中,其中上调基因数量最多的是在17个功能类别中(图1)。3.;额外的文件1:表S1)。与Westar子叶相关的适度(约20-200)上调基因的类别,包括光合作用(BIN #1)、碳水化合物(BIN # 2,3)、糖酵解(BIN #4)、TCA/有机酸转化(BIN #8)、细胞壁合成(BIN #10)、脂质和氨基酸代谢(BIN #11、13)、金属处理(BIN #15)、次要代谢(bin# 16)、激素(bin# 17)、应激(bin# 20)、氧化还原(bin# 21)、核苷酸相关(bin# 23)、dna相关(bin# 28)、信号转导(bin# 30)、细胞组织等(bin# 31)、发育(bin# 31)和运输(bin# 34)(图1)3.;额外的文件3.:图S1和附加文件4:图S2)。有大量上调基因(> 500)的类别包括无已知功能(bin# 26)、rna相关(bin# 27)、蛋白质相关(bin# 29)和杂项功能(bin# 35;例如细胞色素P450酶,碳水化合物酶,脂肪酶)(图。3.).此外,在转基因子叶中有25%的基因表达模式不一致(BIN #35)。
在上述功能类别中,一套基因可能涉及昆虫抗性和指定组织韧性(蜡质、细胞壁碳水化合物/蛋白质和木质素合成)、金属处理、类黄酮糖基化,以及苯基丙氨酸、生物碱和氰苷合成,与Westar子叶相比,AtGL3+毛叶系和K-5-8超毛叶系在无毛子叶中的表达均显著上调(表1额外的文件1S1:表;额外的文件5:图S3)。GS生物合成和降解相关基因在两种转基因子叶中均上调,但这些基因在AtGL3+子叶转录组中的表达量要比在K-5-8子叶中的表达量大得多(图5)。4;额外的文件2:表S2)。特别是涉及蛋氨酸基、吲哚和苄基GSs核心生物合成的蛋白质编码基因,包括细胞色素p450和磺基转移酶(SOT18)和MYB因子,在AtGL3+系中> 2倍上调,尽管基因编码SOT18在K-5-8细胞系中,一种脂肪族accitase被高度上调(图。4;额外的文件1:表S1和附加文件2:表S2)。此外,大量的基因参与GS退化,包括编码芥子酶,许多myrosinase-associated蛋白质(MAP),一个芥子酶结合蛋白(MBP),一个AOP1氧化还原酶,蛋白质和nitrile-specifier epithio-specifier也上调AtGL3 +线(图更强烈。4).最后,两种转基因子叶中大量胁迫响应基因表达上调,包括生物胁迫、干旱胁迫和盐胁迫应答基因、致病相关蛋白编码基因、致病相关蛋白酶抑制剂、热休克蛋白编码基因、和已知的氧化还原蛋白,以协助保护对抗活性氧物种(ROS),以及那些涉及生长和发育的激素控制(附加文件2S2:表;额外的文件6:图S4和附加文件1:表S1)。在AtGL3+和K-5-8子叶中,编码多种代谢和转录因子或参与蛋白质修饰和降解的酶的基因都被强烈上调(附加文件)6:图S4和附加文件7:图S5)。
总体而言,AtGL3+系比K-5-8系相对于Westar有更多的基因上调,例如激素(bin# 17)、应激(bin# 20)、杂项(bin# 26)、蛋白质(bin# 29)、信号转导(bin# 30)、发育(bin# 33)和运输(bin# 34)(图3)。3.;额外的文件1:表S1)。两种毛叶株系均有上调基因,在AtGL3+株系中的表达水平通常高于在K-5-8株系中的表达水平(表)1,2,3.).这包括涉及细胞壁合成(细胞壁蛋白、果胶酸裂解酶和木质素合成)的基因,以及编码叶绿素酶(COR1)、PR蛋白酶抑制剂和a衰老相关基因而相同基因在K-5-8子叶中仅中度上调。AtGL3+和K-5-8子叶特有的上调基因与硫代谢、金属处理、次级代谢(花青素、二氢黄酮醇、类胡萝卜素、非甲戊酸异戊二烯、生物碱、苯丙素、木质素、GS合成和降解)、激素(生长素、油菜素内酯、细胞分裂素、乙烯、赤霉素和茉莉酸),应激反应(一般,生物,PR蛋白,蛋白酶抑制剂,防御素,热休克,接触或伤害,干旱和盐,非指定的非生物胁迫)(附加文件1:表S1)。此外,相对于Westar, AtGL3+子叶中有更多可能影响活性氧(ROS)水平的氧化还原相关基因上调,尽管K-5-8子叶中唯一上调的氧化还原相关基因具有非常强的转录反应。此外,在K-5-8子叶中,发育、脂质代谢、氨基酸代谢、光合作用、热休克和冷反应等相关基因的上调频率较高,上调幅度也较大1:表S1)。
毛状体基因在毛叶系和超毛叶系无毛子叶中的表达
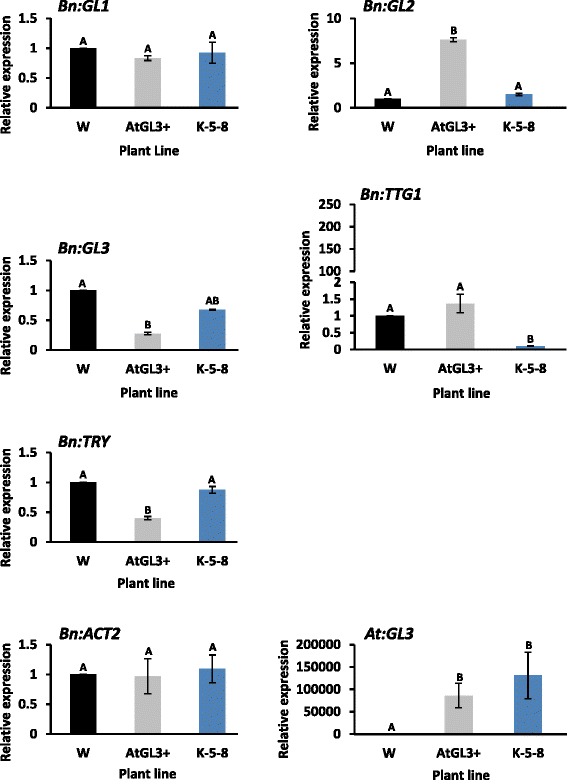
转基因子叶在表达AtGL3或与操纵BnTTG1因此,将所有已知毛状体基因在两种转基因子叶中的转录水平与cv进行了比较。西星。RNA测序结果显示,与cv相比,无毛转基因子叶中没有毛状体基因下调。大多数转录本的上调涉及毛状体基因,这应该会影响毛状体的结构(表)3.).总体而言,相对于简历,成绩单水平的变化最大。西星子叶包括两个暹罗(SIM卡)基因(bra009451和bo9g178890)表明多细胞毛状体在AtGL3+细胞系中也比在K-5-8细胞系中高表达3.).,两个胚胎缺陷3009编码毛状体酰基转移酶的基因(EMB3009)在AtGL3+系中高度上调SAC1(影响毛状体大小),SHAVEN3,MYB16 MIXTA在该系中基因也上调(表3.).这是BrRGA1该基因在AtGL3+子叶中唯一上调RGA1在这两种转基因株系中,基因普遍上调。
已知的编码MBW三蛋白起始复合物的毛状体基因在7日龄子叶中没有差异表达。只有一种众所周知的毛状体调节基因,ANGUSTIFOLIAAtGL3+和K-5-8子叶的转录谱与cv有显著差异。西星(表3.).对10日龄子叶进行qRT-PCR检测,发现5个已知MBW毛状体基因弱表达。虽然BnGL2与K-5-8和Westar子叶相比,AtGL3+子叶中trichome起始基因的表达水平较高,BnGL3和BnTRY在较低水平表达,而BnTTG1(经过处理)只发生在K-5-8株系(图5)。5像预期的那样)。
讨论
本研究考察了引种的毛叶系无毛子叶的组成AtGL3基因(系AtGL3+)转化为显著[1和由压制而来的超多毛的叶线BnTTG1在AtGL3 +显著背景(行K-5-8) [2].的表达AtGL3诱导这些线幼叶上毛状体的形成[1,2降低了昆虫与寄主植物物理互动的能力,减少了FB的取食损害;然而,这些品系的无毛子叶也阻止FB取食[21].子叶生理特性和组成的比较(表4)提供了一些线索,以确定抗异种共生的共同机制。综上所述,AtGL3+的子叶外观异常,与本系的营养组织一致,但在K-5-8系中由于受到抑制而发育正常BnTTG1(2)野生型的子叶是水平方向的;然而,这两个转基因品系的子叶都是垂直方向的,这表明这种方向可能不太适合FBs开始取食行为[19].与野生型相比,AtGL3+株系的花青素含量显著增加,而K-5-8株系的花青素含量降低。两种品系细胞壁碳水化合物含量相似;而细胞壁木质素在K-5-8细胞系中降低。在AtGL3+转基因株系中,总GS含量降低,葡萄糖酸苷含量升高,4-甲氧基-芸苔素含量降低。
次生代谢产物在子叶抗性中的作用
对许多十字花科专家来说,GS含量对饲喂影响很大;然而,对于哪些GSs会刺激喂养,哪些会阻止喂养,人们几乎没有共识。与本研究中子叶中发现的GSs相关,萝卜硫苷的减少和孕激素的增加与FB摄食增加相关Sinapis阿尔巴[31].在广泛的研究中芸苔属植物种类,促孕激素水平也与FB喂养刺激相关[32];然而,这并不能解释FB在本研究中对转基因子叶的摄食减少,因为progoitrin和glucoraphanin的水平与野生型相似。同样的研究和研究FB (Psylliodes chrysocephala) [33,34报道葡萄糖酸钠也是一种喂养兴奋剂;而在本研究中,这两种转基因株系的子叶中均有升高。有趣的是,glucobrassicin是研究中测试的GS中最具刺激性的p . chrysocephala[33,但转基因株系和野生株系的GS含量相同。据我们所知,没有研究表明4-甲氧基-糖衣甘蓝素影响FB的摄食活动。未来的实验似乎需要检查个体的GS,以确定是否应用葡萄糖苷进一步增加抗性,或添加4-甲氧基-油菜素是否能恢复转基因子叶中的野生型FB捕食。
很难推断在实验室研究中对单个GSs对现场发生的损害的反应[35,36],因为这受到其他谷胱甘肽和其他植物次生代谢物的存在,以及大量谷胱甘肽衍生的挥发物的影响,这些挥发物是在组织破坏时由芥子酶和相关芥子酶指示蛋白释放而产生的[37].在评估寄主易感性时,还必须考虑同种昆虫的传播和招募。在野外,由GS sinagrin衍生的异硫氰酸烯丙酯是一种强FB引诱剂[38].这种挥发物还增强了胎牛血清对聚集信息素的反应[39],只在有特定寄主植物挥发物存在时起作用[40].黄酮类化合物在宿主识别和被许多成虫接受中的作用也有报道[41,42].此外,花青素已知会影响昆虫的进食[28].由于AtGL3+子叶中花青素的生成发生了改变,因此还应测试它们对FB摄食的影响。
的影响AtGL3子叶转录组上的表达
AtGL3+的子叶大小和颜色(小,背面暗红色)与K-5-8或Westar不同,AtGL3+植株较小,生长不旺盛[2,18].与K-5-8子叶(两者相对于weststar子叶转录组)相比,AtGL3+植物子叶转录组的变化更为极端(无论是转录多样性还是表达强度)。相比之下,K-5-8子叶转录组的变化则不那么极端(相对于AtGL3+子叶而言),这可能反映了与Westar子叶大小相似的健康子叶,表现出更旺盛的生长[2,18].K-5-8子叶的细胞壁木质化程度也较低,说明K-5-8子叶可能处于比AtGL3+子叶更旺盛的生长期。转录组数据表明,在连续光照下生长的AtGL3+子叶中存在的红色花青素可能是更强、更多样化的胁迫响应的一部分。除了直接参与花青素生产的基因上调外,与K-5-8相比,AtGL3+子叶中参与激素合成或信号转导的基因(茉莉酸、生长素、赤霉素、油菜素内酯和乙烯)的上调也更强烈,而参与发育、脂质合成、K-5-8对氨基酸代谢和光合作用的调控更强。这些数据表明,AtGL3+子叶受到损害,促进生长的能力较弱,而K-5-8子叶则具有更好的生长特性,可能更能忍受FB的损害。
毛状体形成相关基因的表达
株系表达的子叶AtGL3仍无毛;然而,RNA测序显示,这两种转基因子叶中涉及毛状体合成的许多基因的转录本水平都有所提高。SIM卡,编码一个周期素依赖的蛋白激酶抑制剂,指定多细胞毛状体,在这些子叶中上调。此外,AtGL3+系的转录因子水平也有所升高EMB3009它指定毛状体的形状,AUGUSTIFOLIA这与毛状体的形成有关MIXTA指定负毛状体分支,SAC1其中指定毛的大小,而SHAVEN3指定毛的数量。这些差异可能是AtGL3+线上更小的毛状体存在的基础[2].此外,还有一段BrRGA1基因在AtGL3+子叶中唯一上调RGA1两种转基因株系子叶中基因表达均上调。RGA1 (gibberlic acid 1的阻遏因子)是一种对ga不敏感的DELLA阻遏蛋白,对毛状体转录激活因子的活性有负面影响[43].因此,这种阻遏因子的诱导可能是转基因子叶即使在高浓度下仍保持无毛的原因之一AtGL3转录水平。感应的RGA1这也表明它可能是一个子叶特异性基因,因为这些阻遏因子在转基因株系或cv的叶片转录组中都没有出现。西星(2].该数据暗示AtGL3这两个转基因株系中的基因可能通过刺激这种毛状体抑制因子的过度表达来进行积极控制,以确保子叶将继续作为幼苗的营养来源,而不是变成带有毛状体的叶状器官。与MBW起始复合物相关的5个毛状体调控基因在子叶中仅弱表达,这一事实支持了这一观点。
MBW调节复合物中的共享成分连接毛状体的形成和花青素的生物合成。在毛状体形成过程中,GL3或GL3的增强子与TTG1和MYB蛋白GL1形成复合物。这个复合物激活基因编码转录因子的表达,进而诱导毛状体的形成。花青素生物合成由TTG1和GL3组成的复合物调控,但有不同的MYB因子[17].在目前的研究中,化学谱和基因表达的变化在子叶表达AtGL3单独(AtGL3+)或伴有减少BnTTG1表达(K-5-8)表明其他次级代谢物的产生,如GSs,可能受到类似类型的调控。至少有6个其他MYB蛋白(CPC、TRY、ETC1、ETC2、et3和TCL1)可以替代GL1,改变调控复合物的特异性[15].未来,我们将有兴趣确定是否有某种MBW复合物也调节GS的产生,以及哪些MYB蛋白(s)可能参与其中。
结论
操纵的表达所产生的意想不到的结果AtGL3和BnTTG1基因是子叶对FB的抗性,尽管事实上这个组织仍然是无毛的[18,19].因此,这些无毛子叶转录组代表了鉴别抗虫化合物和特性的路线图。宿主相互作用的改变反映了影响GSs、其他次生代谢产物和组织结构成分合成的基因的大量上调,包括细胞壁碳水化合物、木质素、蜡、金属处理系统、黄酮类、酚类和吲哚生物碱。槲皮素(黄酮类)和绿原酸(酚类)衍生物在十字花科植物的子叶中大量积累亚麻荠漂白亚麻纤维卷,保护它们不受FB的捕食[41),而显著子叶通常只积累这些化合物的痕迹(Gruber未发表)。十字花科植物的种子Lunnaria青蒿l . (l . bioennis)积累有毒月芳碱/月芳碱生物碱[44,而生物碱已被证明可以阻止昆虫。在十字花科植物中积累某些金属的植物也可以对特定的昆虫更具抵抗力[45,46,47,48,49,50,51].最后,大量应激反应基因(指定创伤、非生物和生物应激反应)的诱导,如编码热休克蛋白、PR蛋白、蛋白酶抑制剂、硫代葡萄糖苷合成/分解因子、非生物应激因子、氧化还原蛋白、转录因子、生长素代谢所需的蛋白质表明,这些子叶可能已经准备好抵抗其他形式的生物和非生物胁迫。
参考文献
- 1.
Gruber MY, Wang S, Ethier S, Holowachuk J, Bonham-Smith PC, Soroka J, Lloyd A.“毛油菜籽”-拟南芥GL3在上生出浓密的毛状体覆盖芸苔属植物显著幼苗。植物学报。2006;60:679-98。
- 2.
Alahakoon U, Taheri A, Naghabushana N, Bonham-Smith PC, Gruber MY。毛油菜籽再次出现:下调TTG1在一个AtGL3-增强毛叶背景改善生长、叶毛盖度和代谢物基因表达多样性。BMC Plant Biol. 2016a;16:e12。https://doi.org/10.1186/s12870-015-0680-5.
- 3.
凯斯勒A,鲍德温IT。植物对昆虫食草性的反应:新兴的分子分析。《植物生物学》2002;53:299-328。
- 4.
画家RH。作物抗虫性研究纽约:麦克米伦。
- 5.
加拿大油菜籽委员会。跳蚤甲虫。油菜百科全书。加拿大油菜籽委员会。http://www.canolacouncil.org/canola-encyclopedia/insects(2月10日。2015]。
- 6.
农作物保护纲要。Phyllotreta十字花科.CABI。http://www.cabi.org/cpc/datasheet/40780(2015年2月10日)。
- 7.
农作物保护纲要。Phyllotreta striolata.CABI。http://www.cabi.org/cpc/datasheet/40784(2015年2月2日)。
- 8.
Tansey JA, Dosdall LM, Keddie BA, Sarfraz RM的差异Phyllotreta十字花科和Phyllotreta striolata(鞘翅目:蝶科)对新烟碱种子处理的响应。昆虫学报。2008;101:159-67。
- 9.
王志强,王志强,王志强,等。油菜抗拟除虫菊酯病的研究进展。生物防治学报2012;69:209-16。https://doi.org/10.1002/ps.3351.
- 10.
伍德曼RL,费尔南德斯GW。不同的机械防御:草食、蒸发蒸腾和叶毛。Oikos。1991;60:11-9。
- 11.
李志强,李志强,李志强,等。拟南芥毛状体间距和数量的调控。发展。1996;122:997 - 1005。
- 12.
王志强,王志强,王志强,等。植物体表毛密度的变化及其对一种昆虫的抗性拟南芥.生态Entomol。2005;305:284 - 92。
- 13.
Palaniswamy P, Bodnaryk RP。野生芸苔属植物来自西西里岛的细菌可以抵抗跳蚤甲虫,Phyllotreta十字花科(Goeze)(鞘翅目:叶甲科)。可以Entomol。1994;126:1119-30。
- 14.
张飞,劳合社。GL3编码一种bHLH蛋白,调节毛状体的发育拟南芥通过与GL1和TTG1相互作用。遗传学。2000;156:1349 - 62。
- 15.
张飞,冈萨雷斯A,赵敏,佩恩CT,劳埃德AMA。所有ttg1依赖通路中冗余bHLH蛋白的网络拟南芥.发展。2013;130:4859 - 69。
- 16.
Pesch M, Schultheib I, Klopffleisch K, Uhrig JF, Koegl M, Clemen CS, Simon R, Weidtkamp-Peters S, Hulskamp M. TRANSPARENT TESTA GLABRA1和GLABRA1在GLABRA3中竞争结合拟南芥.植物杂志。2015;168:584 - 97。
- 17.
Gonzalez A, Zhao M, Leavitt JM, Lloyd AM。TTG1/bHLH/Myb转录复合物对花青素生物合成途径的调控拟南芥幼苗。植物j . 2008; 53:814-27。
- 18.
王志强,王志强,王志强,等。转甘蓝型油菜(Brassicaceae)毛状体数量转基因油菜的田间生长特性及其与昆虫寄主的相互作用。可以Entomol。2016 b; 1:1-13。https://doi.org/10.4039/tce.2016.9.
- 19.
Soroka JJ, Holowachuk JM, Gruber MY, Grenkow LF。蚤甲虫取食(鞘翅目:金龟子科;Phyllotreta油菜籽(芸苔属植物显著),毛状体密度增加。中国昆虫科学(英文版)2011;104:125-36。
- 20.
黄小龙,李志强,李志强,等。十字花科植物对跳甲取食的敏感性[J]。昆虫学报。2013;106:2557-67
- 21.
生物材料中纤维素的半微量测定。学生物化学肛门。1969;32:20-4。
- 22.
Brinkmann K, Blaschke L, Polle AJ。不同木质素测定方法的比较作为近红外光谱定标和木质素蛋白意义的基础。化学学报2002;28:2483-501。
- 23.
MicroRNA156是一种很有前途的苜蓿改良工具。中国生物技术学报(英文版);2015;
- 24.
总膳食纤维测定为中性糖残基、糖醛酸残基和克拉森木质素(乌普萨拉方法):合作研究。采用AOAC公认的Int。1995;78:1030-44。
- 25.
MAPMAN:一种用户驱动的工具,用于在代谢途径和其他生物过程的图表上显示基因组学数据集。植物j . 2004; 37:914-39。
- 26.
SAS Institute, SAS user's guide, version 9.2, SAS Institute. 2008;卡里。https://support.sas.com/documentation/cdl/en/statugintroduction/61750/PDF/default/statugintroduction.pdf
- 27.
Trapnell C, Roberts A, Goff L, Pertea G, Kim D, Kelley DR, Pimentel H, Salzberg SL, Rinn JL, Pachter L. TopHat和袖扣RNA-seq实验的差异基因和转录表达分析。Nat Prot。2012;7:562 - 78。
- 28.
幼时红色的重要性:花青素和对幼叶的保护Quercus coccifer从昆虫食草和过量的光。树杂志。2006;26:613-21。
- 29.
石田,田原。芥子油苷的代谢、功能及育种改良。育种科学。2014;64:48-59。
- 30.
桑蒂戈R,巴罗斯-里奥斯J,马尔瓦尔R。细胞壁组成对玉米抗病虫害的影响。中华医学杂志。2013;14:6960-80。
- 31.
王志强,王志强,王志强,等。植物对蚤类取食的敏感性研究。Phyllotretaspp。(鞘翅目:叶甲科)。昆虫学报。2013;106:2557-67
- 32.
Bohinc T, Kosir IJ, Trdan s芸苔属植物防止白菜蚤甲虫(Phyllotretaspp)攻击。Zemdirbyste-Agriculture。2013; 100:199 - 204。
- 33.
Barlet E, Parsons D, Williams IH, Clark SJ。硫代葡萄糖苷和糖对甘蓝茎蚤甲虫取食的影响Psylloides chrysocephala.昆虫素应用1994;73:7-83。
- 34.
改性油菜叶片硫代葡萄糖苷含量的影响芸苔属植物显著spp。识别鉴定),研究其与特殊害虫和普通害虫的相互作用。Ann Appl Biol. 1995; 126:347-63。
- 35.
巴特利特,威廉姆斯。限制菜茎蚤甲虫取食的因素(Psylliodes chrysocephala).昆虫素应用1991;60:233-8。
- 36.
巴莱特E,米森R,克拉克SJ。食白菜茎蚤甲虫Psylloides chrysocephala高硫代葡萄糖苷和低硫代葡萄糖苷油菜品种研究。昆虫素应用1996;80:87-9。
- 37.
Hopkins RJ, van Dam NM, van Loon JJA。硫代葡萄糖苷在昆虫-植物关系和多营养相互作用中的作用。Annu Rev Entomol. 2009; 54:57-83。
- 38.
范妮,陈志强,陈志强。蚤甲虫与芥菜油:寄主植物的特异性Phyllotreta十字花科和p . striolata成年人(鞘翅目:叶甲科)。昆虫学报1970;63:832-41。
- 39.
Soroka JJ, Bartelt R, Zilkowski BW, Cosse AA。蚤甲虫反应Phyllotreta十字花科在田间试验中合成聚集信息素组分和寄主植物挥发物。J Chem Ecol. 2005; 31:1829-43。
- 40.
Beran F, Mewis I, Srinivasan R, Svoboda J, Vial C, Mosimann H, Boland W, Buttner C, Ulrichs C, Hansson BS, Reinecke A. MalePhyllotreta striolata(f)产生聚集信息素:雄性特异性化合物的鉴定和与寄主植物挥发物的相互作用。J Chem Ecol. 2011; 37:85-97。
- 41.
Onyilagha JC, Gruber MY, Hallett RH, Holowachuk J, Soroka JJ。本构类黄酮可阻止蚤甲虫捕食亚麻荠漂白亚麻纤维卷acta Biochem Syst Ecol. 2012; 42:128-33。
- 42.
西蒙兹MSJ。黄酮类化合物在昆虫-植物相互作用中的重要性:取食和产卵。植物化学。2001;56:245-52。
- 43.
甘玉华,彭建军。.DELLA蛋白对拟南芥毛状体发育的遗传和分子调控。植物杂志。2007;145:1031-42。
- 44.
韩德胜,陈家强。月神碱的药理作用月经biennis.美国制药协会1950;39:516-9。
- 45.
Broadhurst CL, Chaney RL, Angle JS, Erbe EF, Maugel TK。镍超累积体叶片中镍的定位及其对土壤镍含量增加的响应香雪球murale有售.土壤植物。2004;265:225-42。
- 46.
利用分析电子显微镜和x射线光谱显微镜对植物样品中镉的定位和化学形态进行了研究。Acta spectrochimica sinica . 2006; 61:1242-52。
- 47.
Küpper H, Lombi E, Zhao FJ, Wieshammer G, McGrath SP. .镍在超蓄电池中的细胞分隔香雪球lesbiacum,香雪球bertolonii和菥goesingense.实验机器人。2001;52:2291-300。
- 48.
Küpper H ., Lombi E ., Zhao FJ ., McGrath SP. . effects of cadmium and zinc in cell enrichment in superaccumulator [j] .环境科学与技术,2017,36 (6):537 - 541拟南芥halleri.足底。2000;212:75 - 84。
- 49.
McNear DH Jr, Peltier E, Everhart J, Chaney RL, Sutton S, Newville M, Rivers M, Sparks DL。定量荧光和吸收边缘计算机微层析成像技术在金属区隔成像中的应用香雪球murale有售.环境科学与技术。2005;39:2210-8。
- 50.
Nagabushana N, Tan Y, Taheri A, Li X, Bjorndahl TC, Nowak J, Wishart DS, Hegedus D, Gruber MY。芸苔属植物摘要,一种研究芸苔属非腺毛状体和基因的系统。植物学报。2014;65:519 - 39。
- 51.
中国农业大学学报(自然科学版)。植物杂志。1995;109:1427-33。
确认
作者感谢Wesley Soroka在种子清洗和L. Grenkow在统计培训方面的帮助。我们感谢帕金分享了来自b . oleracea发表之前的基因组。
资金
资金来自萨斯喀彻温省政府农业发展基金和萨斯克油菜籽。N. Nagubushana和A. Taheri获得加拿大政府的访问奖学金。
数据和材料的可用性
原始测序数据文件作为登录号SRP065063存放在NCBI中。本研究中使用的三个品系的种子来自D. Hegedus。
作者信息
从属关系
贡献
MG和PB-S监督实验。AU, AT, NN, MYG, RZ进行了实验和数据分析。PB-S、MG和DD撰写并编辑了手稿。AS提供了RNA测序的资源和仪器。AH为分析子叶结构组成提供了资源。RZ提供资源并进行硫代葡萄糖苷分析。所有作者阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
附加文件
额外的文件2
表S2。指定硫代葡萄糖苷及其降解产物的基因。AtGL3+和K-5-8子叶基因表达上调显著简历。威斯达参与硫代葡萄糖苷的生物合成或降解。(多克斯27 kb)
额外的文件3
图S1。K-5-8无毛子叶基因表达变化的MAPMAN功能概述10日龄毛叶(K-5-8)无毛子叶基因表达变化的MAPMAN功能概述显著直线相对于cv。西星。36个BINs代表MAPMAN亚细胞功能类别。[8037个差异表达基因中有7497个是用这种方法绘制的,少数基因被绘制成多个类别。大多数的变化都与上调的基因有关。蓝色块代表个体上调基因。红色块代表29个下调基因。第35类基因的全谱(未知)太大了,不适合这个数字。相对表达强度标度为log2,其中最暗的颜色强度表示log2相对于weststar较高/(+ 5)或较低(−5)。(PPT 484 kb)
额外的文件4
图S2。AtGL3+无毛子叶基因表达变化的MAPMAN功能概述10日龄毛叶(AtGL3+)无毛子叶基因表达变化的MAPMAN功能概述显著直线相对于cv。西星。36个BINs代表MAPMAN亚细胞功能类别。[在8841个差异表达基因中,有8186个是用这种方法绘制的,其中一些基因被绘制成多个类别。大多数的变化都与上调的基因有关。蓝色块代表个体上调基因。红色块代表29个下调基因。第35类基因的全谱(未知)太大了,不适合这个数字。相对表达强度标度为log2,其中最暗的颜色强度表示log2相对于weststar较高/(+ 5)或较低(−5)。(PPT 293 kb)
额外的文件5
图S3。无毛子叶胁迫响应基因的MAPMAN热图。(A) 10日龄毛叶(AtGL3+)和(B)超毛叶(K-5-8)无毛子叶胁迫响应基因MAPMAN热图显著相对于cv的直线。西星。蓝色和红色的块代表个体上调和下调的基因。相对表达强度量表以对数表示2其中±4表示±log24或更高。(PPT 401 kb)
额外的文件6
图S4。无毛子叶代谢基因的MAPMAN热图。(A)毛叶AtGL3+无毛子叶代谢基因MAPMAN热点图显著(B)超毛叶K-5-8显著,相对于西星。图谱显示了ESTs的数量和表达强度。蓝色区域代表上调基因。红色块代表个体下调基因。相对表达强度量表以对数表示2,其中±5表示±log25或更高。(PPT 287 kb)
额外的文件7
图S5。无毛子叶中基因调控和蛋白相关基因的MAPMAN热图。(A) AtGL3+无毛子叶中基因调控及蛋白相关基因的MAPMAN热图显著(B)相对于西星的K-5-8。地图显示了改变的ESTs数量和表达强度。蓝色块代表个体上调基因。红色块代表个体下调基因。相对表达强度量表为log2,其中±5表示±log24或更高。(PPT 279 kb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
格鲁伯(M. Gruber),阿拉哈昆(U. Alahakoon),塔赫里(A. Taheri)。et al。子叶的生化组成和转录组芸苔属植物显著表达AtGL3转录因子并表现出减少食虫量的细胞系。BMC植物杂志18,64(2018)。https://doi.org/10.1186/s12870-018-1277-6
收到了:
接受:
发表:
关键字
- 芸苔属植物显著
- 毛状体
- 子叶
- 硫配糖体
- 跳蚤甲虫
- RNA序列