摘要
背景
存储根部是一种生态和农业上重要的植物特质,在被子植物中已经发展了许多次数。存储根主要是将碳水化合物存储地下作为常年物种的储备。在早晨的辉煌中,储存根部的特征在于薯类甘薯,其中淀粉积聚在储存根部。该淀粉储存组织增殖,根部变稠以适应额外的组织。在早晨的荣耀中,储存根部已经发展了许多次数。本研究的主要目标是了解这是通过平行的进化,物种使用常见的遗传机制来实现储存根部,或通过会聚的进化,其中使用不同的基因形成远端相关物种中的储存根。一对形式的物种,一种形式的存储根,另一个没有从早晨的两个部落中取样,荣耀家族,iPomoeeae和Merremieae。检查了储存根部和细根中的根解剖学。此外,我们在这些物种中从储存根部和细根测序总mRNA并分析差异基因表达。
结果
解剖结果表明,甘薯等地瓜类植物的贮藏根积累的淀粉与Merremieae类植物相似,但维管组织结构不同。与细根相比,贮藏根中有更多的基因表达上调。在贮藏根和细根中,有57个同源基因在贮藏根和细根中有差异表达。这些基因主要参与淀粉生物合成、淀粉生物合成调控和转录因子活性。
结论
总之,这些结果表明,早上辉煌部落的物种的储存根部是解剖学不同的,但利用储存根部形成的常见核心基因组。这与平行进化的模式一致,从而突出了将解剖学与基因表达一起检查解剖学以了解生态和经济上重要的植物性状的进化起源。
背景
综合形态特征的平行和趋同演变长期以来对进化生物学家感到兴趣,他已经注意到在无关的谱系中独立地演化的功能和形态学相似的表型。表征独立表型演化的遗传基础的研究得出结论,许多特征在于趋于演变,出现表型和功能相似但利用不同的遗传机制。[1,2,3.].另外,平行进化的特征具有相同的遗传基础[4,5,6].通常,区分这些不同的进化场景是很困难的。对一个性状的形态学、解剖学、基因表达和其他方面的比较研究可以帮助我们了解一个性状是趋同进化还是并行进化。
牵牛花提供了一个理想的系统,其中以关于趋同与平行进化假说地址。在牵牛花,贮藏根的形成已被丢失或被独立地为至少10倍获得的,并存储根在许多不同牵牛花谱系发现例如含有那些一、甘薯,即lindheimeri, 和Distimake dissectus;然而,目前还不清楚是否所有的牵牛花的祖先都能形成储存根[7].对甘薯贮藏根发育特征的研究表明,贮藏根仅仅是主根、不定根和/或一个或多个侧根的修饰,从而使根形成层扩展,贮藏淀粉组织增生[8,9,10,11,12].淀粉储存组织的增殖膨胀了根,使得储存根部的直径远大于根部,其在长期淀粉储存中不起作用。分析甘薯贮藏根系基因表达差异(番薯甘薯)发现淀粉生物合成途径中的基因表达量高,而木质素生物合成基因在贮藏根中的表达量低于细根[8].研究还涉及三种基因在发育储存根部,其中两种是疯箱转录因子[13,14]另一种是α-扩展蛋白基因[15].然而,这些研究严格限于甘薯。比较研究可能揭示与远亲物种贮藏根系形成有关的基因。
贮藏根除了具有进化意义外,还具有经济和生态意义。地瓜(番薯甘薯(L.)林。]是人类十大最重要的营养作物之一。2014年,全球甘薯产量超过1亿吨[16].大型储存根部是发展中国家碳水化合物和维生素A的重要来源[17].更一般地,储存根部在植物的生命历史和生态策略中发挥着关键作用,随着常年物种倾向于全年调动淀粉,从而形成储存根,但每年只在几个月后停止淀粉动员[18].此外,在切割或大规模事件之类的情况下,Root碳水化合物储备是在诸如火灾之类的大规模事件之后进行重新施用19,20.,21.].
鉴于关于储存根部的发育生物学和解剖学所知的内容,形成存储根部的谱系可能代表会聚或平行演进的情况。在这项研究中,我们的目标是:1)了解早晨辉煌的储存根部的解剖结构,2)在储存根部的早期阶段表征基因表达。如果观察到远远相关的夏季丝网的存储根部是讽刺相似并共享重叠的差异表达的正交基因集,这将提供有证据支持储存根在早晨辉煌多样化之前进化的假设,随后丢失了谱系不形成存储根(并行进化)。然而,如果我们观察到储存根部是解剖学差异并且少于没有差异表达的正交基因,则这将支持该假设,即储存根部在储存根形成谱系中独立进化(会聚的演化)。使用这种比较方法,我们可以更好地了解遗传机制和储存根部的进化起源。通过这项工作,我们最终寻求了解储存根部形成的遗传基础,以及独立谱系是否在早晨辉煌系统发育中使用相同或不同的遗传机制。
方法
植物材料
从牵牛花系统发育过程中选择了三对密切相关的物种,其中一对物种中的一种产生贮藏根和细根,另一种只产生细根。三种贮藏生根种为番薯甘薯(L.)林。(甜点),即lindheimeri答:灰色和Distimake dissectus(Jacq)。Simoes & Staples(原Merremia dissecta),只有产生细根的物种是即trifida不,即零(l)罗斯,d . quinquefolius(L.)Simoes和Staples(以前Merremia Quinquefolia.).所有三对物种都被用于解剖观察。四个物种,一、甘薯,即trifida,d . dissectus和d . quinquefolius,用于转录组测序,从而可以直接对比观察到的不同根结构的基因表达。植物材料从外部来源获得,包括美国农业部GRIN、种子公司和R. Miller和J. Ekrut的种子收集(补充文件)1:表S1)。每个物种选择三个生物重复,除了即trifida,其中一个样本的RNA-seq库始终失败。地瓜(一、甘薯)是六倍体,并且即trifida是二倍体[22.].倍性的d . dissectus和d . quinquefolius没有被预先确定;因此,我们试图根尖南瓜,但没能得到计数染色体之间的分离。基因组大小的估计常常被用来推断某些物种倍;然而,由于染色体的数目从未在这些物种确定,基因组大小相同ploidal水平的牵牛花有很大的差异[22.,23.,24.,我们不能用这种方法来确定倍性。
甘薯是植物繁殖,所以插枝种植的三个品种(Beauregard, Jewel,和Tinian)与三个真正的叶子。其他五个物种的种子在播种前都要用砂纸涂抹。种子和插条种植在Fafard 3B中,混合在4个″方形花盆中。种子在佐治亚大学温室中发芽1周。然后在8 h的光周期和30°/25°C的昼夜温度下将植株移入生长室[14].以前的研究发现,在甘薯种植后的4至六周内发生储存根部形成[8,25.];因此,在取样之前,本研究的植物在六周内生长六周。使用以下步骤取样根源:从培养基中除去根,在自来水中洗涤,并在无核酸酶的分子生物学级水中冲洗最后的时间。将原始根部从整个植物中解剖,然后从原母根部中解剖细侧根。将新鲜根组织闪蒸在液氮中冷冻,随后在-80℃下储存直至RNA分离。或者,立即使用新的根组织以解剖学观察。
解剖观察
新鲜的根组织用剃须刀片手工切片。这一研究的主要目的是观察淀粉在根横截面上的空间沉积;因此,新鲜切片是必要的,因为在标准组织清除过程中淀粉被去除[26.].从细根和主根或贮藏根的两个地方取连续切片:1)第4侧根后,2)第10侧根后。切片用Lugol碘染色,这是一种碘和碘化钾溶液,表明淀粉的存在,或间苯三酚- hcl染色木质素[27.,紧接在分段之后。染色切片置于过滤的20% CaCl中2解决方案(28.].用Zeiss Axio显微镜观察安装的部分,其中附接相机在2.5×或10×物镜下。在多个图像中捕获在单个视野中以在单个视野中观看的部分,然后在多个图像中使用图像拼接插件缝合在一起Imagej的斐济分布[29.,30.,31.].使用标准显微镜刻度测定视觉长度的领域,并将比例条加入imomeJ中的图像中。
RNA分离和文库构建
总RNA使用Trizol试剂标准协议(Life Technologies)中从冷冻根组织中分离。RNA是在分子生物学等级H洗脱20后隔离。使用TURBO无DNA试剂盒(Thermo Fisher Scientific)去除DNA。在构建文库之前,使用Agilent Bioanalyzer 2100使用RNA 6000纳米试剂盒(Agilent Technologies, Santa Clara, CA)评估RNA质量。使用NEBNext Poly(A) mRNA Magnetic Isolation Module (New England Biolabs, Inc.)从总RNA中分离mRNA。使用推荐的总RNA输入进行的第一次mRNA分离产生了低的mRNA浓度。因此,mRNA分离方案中总RNA的添加量增加到5 μg,这是推荐RNA输入量的最大值。使用NEBNext Ultra Directional RNA Library Prep Kit for Illumina (New England Biolabs, Inc.)构建文库,采用略有修改的标准协议。用15个PCR循环扩增文库。库的初始测试集显示了适配器二聚体峰值;因此,适配器被稀释1.25 μM而不是标准的1.5 μM,这消除了未来库中的适配器二聚体峰。 The library preparation protocol used in this experiment implements the dUTP method [32.]产生搁浅的图书馆。
在测序之前使用定量实时PCR定量文库。将文库稀释至10nm以进行测序。在测序之前合并条形码和稀释的文库。所有图书馆在Georgia Genomics设施上测序Illumina NextSeq平台,配对150 BP读数。用于组装转录om的Illumina序列数据已经在Bioproject PrJNA448837下沉积到Genbank序列读取归档数据库。
转录组分析
每个物种的Reads分别用Trinity软件套件版本r20140717组装成转录本[33.].在物种内转录组组件和分析遵循开发的三位一体管道[33.,34.].阅读质量采用FastQC进行评估。在组装之前,读取是由Trimmomatic在Trinity包中实现的。在读取的开始和结束时,phred分数小于5的垒被删除。此外,摘除长度小于50 bp的读数。在Trinity(−-normalize_reads)中,每个库的读取被数字规范化到最大50×覆盖率(- -normalize_reads),以加速组装过程。在程序集中,读被认为是对端,其中对的第一次读被认为是反向读,第二次是正向读(−-SS_lib_type RF)。
然后,我们过滤组件,以去除差支持的异构体和污染物。我们使用RSEM版本1.2.20 [35.来估计基因和转录本丰度,如Trinity包中实现的那样(align_and_estimate_abundance.pl脚本)。使用Bowtie 2将非标准化reads映射到每个转录组装配[36.].除了从两种或多种生物学复制的基因的总读数的少于30%的同种型被移除,因为这些代表了可能的组装伪像。使用Trinity软件包中的Perl脚本Filter_Fasta_by_rsem_values.pl进行过滤[34.].为了去除污染物,我们向Trinotate中的组装转录om注释了[34.对Uniprot数据库使用已筛选程序集的blastx。带有e值大于1e-5和40%身份的Viridiplantae以外的任何分类单元注释的转录本作为潜在污染物被删除。最后,程序DeconSeq版本0.4.2 [37.用来进一步过滤任何残留的细菌、病毒和人类污染序列。
RSEM [35.]和领结[36.]再一次被用来将从单个文库读取的信息映射到过滤过的转录组集合,并计算转录组丰度。磨边机(38.然后用于评估储存根部和甘薯的细根之间的差异表达基因Distimake dissectus使用来自Trinity分析管道的perl脚本[34.].编辑为每个物种单独运行,并针对每个组织类型掺入生物重复。每个库的FPKM值由库大小标准化。该归一化过程被称为“M-VALUE的修剪平均值”,或TMM,归一化[39.].仅使用tmm标准化的FPKM值进行差异表达分析(附加文件2:表S2,附加文件3.:表S3,附加文件4:表S4和附加文件5:表S5)。以小于0.05的假发现率(FDR)显着表达转录物和2(附加文件6:表S6和附加文件7:表S7)。然后生成转录本和文库之间的欧氏距离,并利用欧氏距离矩阵上的完全连锁聚类方法对edgeR中的转录本和文库进行聚类。
蛋白编码区是从使用程序Transdecoder [最终过滤组件标识34.].蛋白质序列短于50个氨基酸残基,长度不在最终一组肽序列中。功能注释利用标准的Trinotate管道[34.[将组装的转录物的Blastx搜索与UniProt数据库的组装成绩单结合在一起,并对从TransDecoder对Uniprot数据库推断的肽序列的BLASTP搜索。使用Trinotate将UNIPROT中最佳基因匹配的最佳基因匹配的基因本体(GO)术语注释结合到SQLITE数据库中[34.)(附加文件8:表S8,附加文件9:表S9,附加文件10:表S10和附加文件11:表S11)。
来自所有四种物种最终过滤组装的肽序列被OrthoFinder分类为基因家族[40以确定四个物种的转录本之间的同源性。从OrthoFinder中估计的基因家族编码序列在SATé-II中进行了比对[41.].基因树估计在raxml中[42.],并使用500个引导复制来确定节点支持。
结果
根解剖学
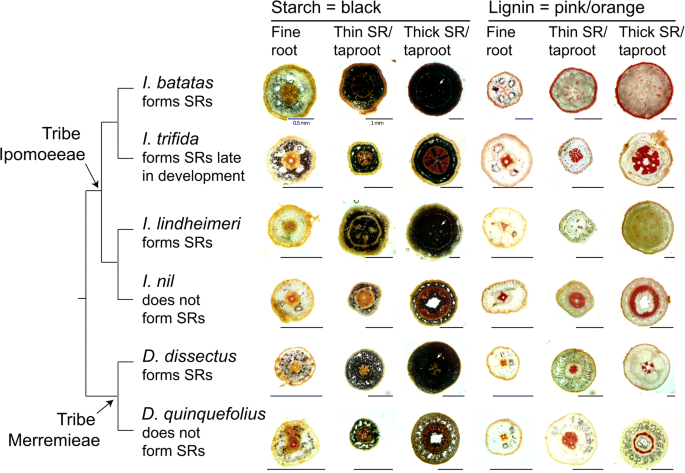
根系解剖观察结果如图所示。1.这有三个主要结果。首先,所有六种物种的细根都是解剖学上相似的,并且在中心和较大的皮质中表现出具有高度有组织的血管组织的典型淘汰根系解剖学。其次,我们发现,不形成储存根部的物种的根尖看起来相似,积累了很少的淀粉,并没有显示出淀粉积聚细胞的增殖证据。第三,三个储存根形成物种的储存根部显示出类似的淀粉积累,具体地,淀粉累积细胞的增殖在内胚层的范围内发生。最后,甘薯储存根系的血管组织和即lindheimeri在视觉上看起来很相似,聚集淀粉的细胞破坏了维管组织的组织。与之相反,贮藏根的维管组织Distimake dissectus显示出明显的不同,血管组织紧密组织在横切面的中心。
转录组组装统计
最终的数据集包括来自两对牵牛花的17个RNA-seq文库。转录组装配统计如表所示1.过滤之前,Distimake Quinquefolius.转录组有最多的转录本,并且即trifida转录组具有最少的组装转录物。转录N50从952到1277nt。然后,我们通过同种型百分比和FPKM过滤了原始组件,这导致组装中的转录物数量减少42-70%(表2).此步骤删除了重新映射读取不支持的潜在错误文本。使用Swiss-prot注释和DeconSeq进一步过滤细菌、真菌、藻类和病毒转录本,可以从每个组装中去除额外的约3900-5700转录本。只有通过异构体百分比和FPKM过滤并去除污染物的转录组被用于下游分析。
物种内差异基因表达
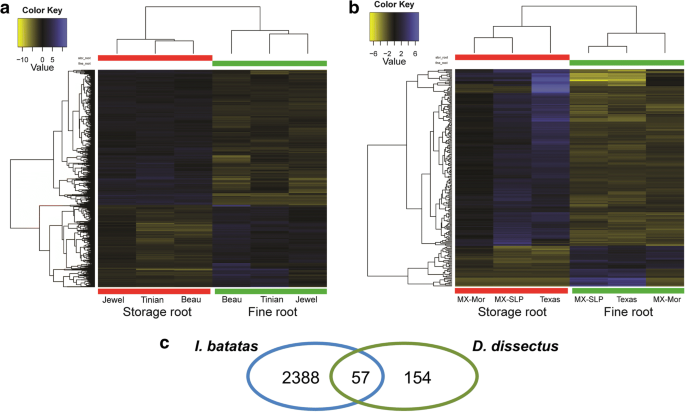
我们评估了甘薯和细根之间的差异基因表达和Distimake dissectus分别地。在核算多重比较后,在甘薯和219个基因的储存根和细根之间存在2643个基因差异表达(DE)d . dissectus在FDR < 0.05时(图。2a,b).在两种植物中,贮藏根中转录本的高表达量均高于细根。一般来说,上调转录本是指贮藏根中较细根表达量高的转录本,下调转录本是指贮藏根中较细根表达量低的转录本。在甘薯中,有1642个转录本上调,1001个转录本下调。在Distimake dissectus,有178名上调的转录物和41个下调的转录物。
甘薯和差异表达基因的前十个最丰富的基因本体学注释d . dissectus载于附表3..当我们比较SwemetPotato的Genes De的最丰富的GO答案d . dissectus,我们发现其中8个GO项重叠。此外,许多最丰富的氧化石墨烯术语参与转录或被注释为具有转录因子活性(表)3.).
物种间差异基因表达
为了比较不同物种的直肠之间的基因表达,我们将转录物分类为具有矫正器的正交组[40].然后,我们对甘薯的贮藏和细根之间的已知转录本差异表达(DE)的同源组进行了查询Distimake dissectus.我们发现两种植物的贮藏根和细根之间有57个同源基因DE(图。2C).然后我们检查了一组同源DE转录本的GO术语注释(表4).研究发现,在共享的DE转录本中,以淀粉体或淀粉生物合成活性注释的转录本在总氧化石墨烯注释中所占的比例大于甘薯和玉米的DE转录本d . dissectus分别分析(表3.,4).同样,我们检测了这些转录本的功能注释,发现一些DE基因与转录因子、α -膨胀蛋白基因、淀粉生物合成途径和淀粉降解途径中的基因具有密切的同源性。
物种间差异基因表达
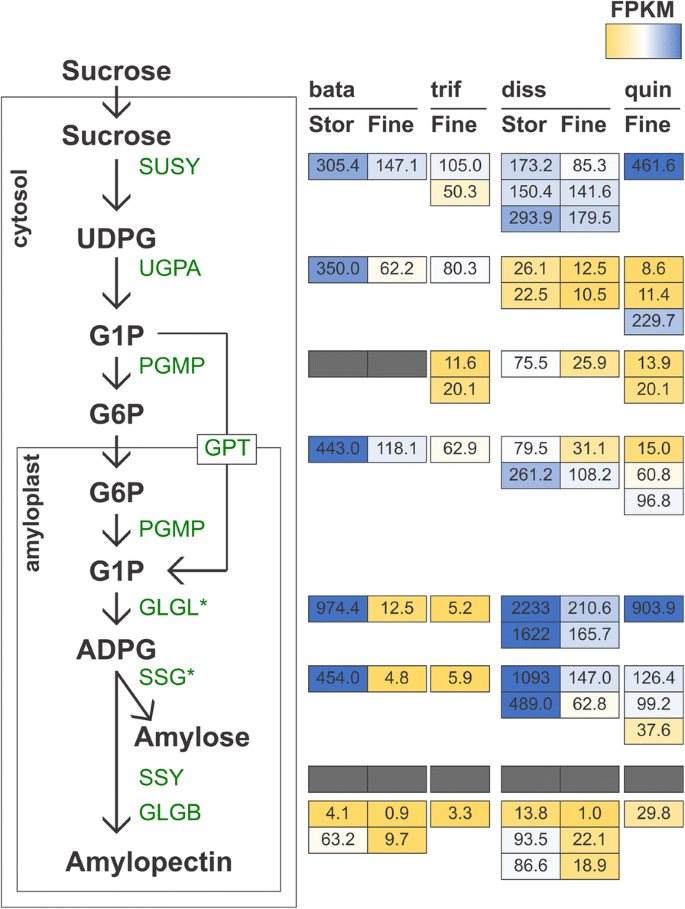
然后,我们想检查淀粉生物合成途径中基因的表达(图。3.).在淀粉生物合成途径中,大多数基因的表达量降低。然而,GLGL1和SSG1的同源基因在甘薯和甘薯中有显著差异表达Distimake dissectus(无花果。3.).这些基因在贮藏根中表达量高,而在细根中表达量低d . quinquefolius(无花果。3.).此外,我们检测了具有转录因子活性的转录本的表达,其中同源基因在甘薯和甘薯中均有差异表达d . dissectus(无花果。4).在所有情况下,共用差异表达的转录因子的直向同时在储存根部比细根更高度表达(图。4).
讨论
根解剖学
根系解剖研究结果表明,甘薯族和甘薯族的贮藏根明显高于甘薯族和甘薯族即lindheimeri)与储存根部是统一的Distimake dissectus她是姐妹部落merremiae的一员。淀粉积累细胞在所有三种贮藏生根物种中增殖;但木质部组织结构差异较大d . dissectus与其他两种物种的储存根相比(图。1).我们的研究结果与其他研究检查SweetPOTATO的根解剖结构一致[8,9,10,11,12].但是,我们对本研究中包含的所有其他物种的根部解剖学没有先验期望,因为这是第一个文件根系解剖学即lindheimeri,即零,即trifida,d . dissectus, 和d . quinquefolius.
基因表达的所有物种的比较
根据解剖结果,我们可以对转录组实验产生预期。三种植物贮藏根的淀粉积累情况相似;贮藏根的木质部组织结构差异较大d . dissectus.因此,很可能参与淀粉合成和细胞增殖的基因将被差异存储和细根之间在这两个物种中表达,但参与木质部组织的基因可能不会显示物种之间相同的基因表达模式。
在更广泛的水平上,与甘薯和细根相比,贮藏根中有更多的基因上调d . dissectus.有趣的是,这一结果与之前在甘薯中进行的RNA-seq研究相反,该研究发现,与细根相比,贮藏根中上调和下调的基因数量大致相同[8].与Firon等人相比,我们在种植后六周抽出了根源。(2013),四周内采样的根。鉴于我们在稍后的增长阶段进行抽样,也许我们正在捕获本研究中的存储根膨胀的更积极的阶段。将来,在储存根部的早期阶段的早期阶段接近解剖学和基因表达的变化将提供进一步的见解,进一步了解这种特征的发展。
淀粉生物合成途径
淀粉生物合成作为复合物和动态途径的一部分发生,并且所涉及的酶和转运蛋白在很大程度上依赖于合成淀粉的组织。该过程在光合和异养组织中不同[43.].因此,我们专注于来自巴哈吉等人的马铃薯块茎的淀粉途径。[43.[因为它是与甘薯密切相关的物种中异养组织中最良好的淀粉生物合成途径。
在光合组织中,蔗糖在淀粉合成之前被分解为果糖和葡萄糖,而在异营养组织中,蔗糖在淀粉生物合成之前直接转化为udp -葡萄糖[43.].此外,udp -葡萄糖向淀粉中间体的下游转化在双子叶和单子叶异养组织中是不同的。udp -葡萄糖通过udp -葡萄糖焦磷酸化酶(UGPA)转化为葡萄糖-1-磷酸。葡萄糖-1-磷酸盐要么从胞浆运输到淀粉体,要么在胞浆中被磷酸葡萄糖合成酶(PGMP)转化为葡萄糖-6-磷酸盐。葡萄糖-6-磷酸通过转运蛋白葡萄糖-6-磷酸转运体(GPT)运输到淀粉体中,在那里它又通过PGMP转化回葡萄糖-1-磷酸。葡萄糖-1-磷酸通过adp -葡萄糖焦磷酸化酶(GLGL)的作用转化为adp -葡萄糖,这需要ATP的输入。然后,adp -葡萄糖通过颗粒结合淀粉合成酶(SSG)转化为淀粉的主要成分,生成直链淀粉或淀粉合成酶(SSY)和淀粉分支酶(GLGB),生成支链淀粉。
在本研究的背景下,我们发现,与甘薯和甘薯的细根相比,淀粉生物合成中涉及淀粉生物合成的两种基因的直肠表现明显更高。Distimake dissectus(无花果。3.).在本研究中,GlG11和SSG1在甘薯的储存根和细根之间显着差异表达d . dissectus(无花果。3.).Glgl在途径下行,直接在SSG上游,这参与了淀粉糖的合成[43.].通常,甘薯栽培品种的直链淀粉含量高,范围为总淀粉含量的20-33%[44.,45.]远高于其他富含淀粉的根和块茎作物,如木薯[46.].
必须采用该检查,即通过甘薯和马铃薯的不同机制发生淀粉积累和膨胀。首先,SweetPotato存储根和马铃薯块茎来自不同的组织类型;来自根组织和来自茎组织的块块的储存根部[47.].此外,马铃薯块茎的形成受开花位点T (SP6A)的同源基因控制,块茎的起始过程依赖于光周期[47.].然而,实验证据表明,甘薯贮藏根系发生在长日和短日两种情况下[48.].需要涉及SweetPotato及其密切亲属的未来功能基因组研究,以阐明淀粉生物合成和储存的确切机制。
转录因子
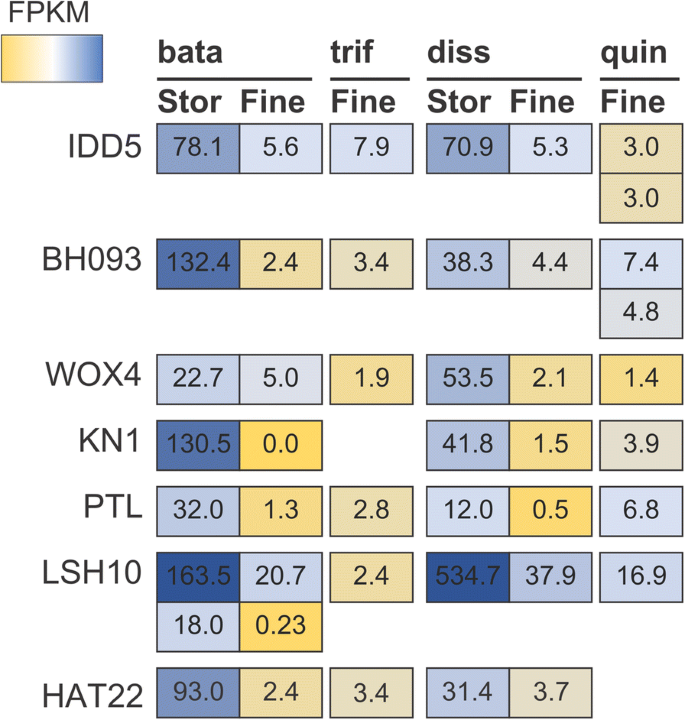
在储存根部和细根之间差异表达的五十七种外科基因,七个被注释为具有转录因子活性(图。4).当我们进一步研究这些基因的注释功能时,有两个基因作为贮藏根形成的潜在调控因子脱颖而出。
IDD5,也被称为RAVEN,已被证明正向调节淀粉合酶拟南芥蒂利亚纳[49.].此外,IDD5是一个更大的调控网络的一部分,除其他功能外,通过不对称的细胞分裂调节根组织的空间模式[49.,50,51].IDD5属于一个更大的调控网络,它的许多成员在甘薯的SRs和FRs之间有差异表达。佐治亚航空公司和徐树公司[8,52],建议IDD5和该监管网络成员在存储根部形成中的可能作用。
同样,WOX4同源基因在甘薯贮藏根和细根之间都有DEd . dissectus.该基因已被证明在血管增生和次生生长中发挥关键作用拟南芥蒂利亚纳,特别是在茎和根的岩石中专门的功能[53,54].也许该基因在甘薯贮藏根中所观察到的淀粉贮藏组织的增殖中发挥了作用d . dissectus。
结论
解剖结果表明,储存根与淀粉含量,沉积和血管系统图案中的细根不同。如预期的那样,我们发现在储存根部形成物种中直接在淀粉生物合成中涉及的基因的显着提高,IDD5的表达增加,称为淀粉生物合成的转录因子拟南芥[49.].同样,我们发现WOX4的显着上调,已知参与脉管系统的基因拟南芥[53,54].考虑到贮藏根和细根之间存在大量的同源基因DE,我们假设,在牵牛花部落Ipomoeeae和Merremieae分化之前,贮藏根的起源是单一的,因为研究的物种的贮藏根在表面解剖上是不同的,但以相似的方式储存淀粉。为了进一步支持这一假设,我们发现许多相同的基因在甘薯贮藏根和细根之间存在差异表达Distimake dissectus.然而,另一种假设,即储存根使用相同的遗传机制独立进化多次,不能被这些结果直接否定。因此,必须做更多的工作来检验这些假设在一个严格的框架。这些发现为理解一种植物性状的进化和发展迈出了第一步,这种植物性状迄今为止很少受到关注,但在经济和生态上具有重要意义。这些结果进一步证明了比较研究的力量,以更深入的方式理解一个特征的发展及其进化,而不是检查单一的物种。
缩写
- 德:
-
差异表达
- 罗斯福:
-
错误发现率
- FPKM:
-
每千碱基的转录片段每百万映射读取
- GLGB:
-
淀粉分支酶
- GLGL:
-
ADP-glucose焦磷酸化酶
- 走:
-
基因本体论
- GPT:
-
葡萄糖-6-磷酸盐镀膜器
- IDD5:
-
蛋白质indeterminate-domain 5
- PGMP:
-
Phosphoglucomutase
- RNA-seq:
-
RNA测序
- 公司:
-
颗粒状淀粉合酶
- SSY:
-
淀粉合成酶
- TMM:
-
M-值尾均值
- UGPA:
-
UDP葡萄糖焦磷酸化酶
- WOX4:
-
Wuschel相关的Homeobox 4
参考
- 1.
吴杰,史密斯SD。茄科植物中通过交替的生化途径广泛的花颜色收敛。新植醇。2015;209:407-17。
- 2。
Yoon H-S, Baum DA。植物形态进化中平行性的转基因研究。中国科学院院刊2004;101:6524-9。
- 3.
Wittkopp PJ,Williams BL,Selegue Je,Carroll SB。果蝇色素沉着演化:潜在的收敛表型下面的分歧基因型。PROC NATL ACAD SCI。2003; 100:1808-13。
- 4.
Haas o,Simpson GG。分析一些系统发育术语,尝试重新定义。Proc Am Philos SoC。1946; 90:319-49。
- 5.
苏格兰RW。并行性是什么?另一个星球Dev。2011;13:214-27。
- 6.
在Ipomoea中蜂鸟授粉花起源的多个层次上的平行进化。进化。2010;64:2044-54。
- 7.
acta botanica sinica(云南植物研究中心),2010,34(5):558 - 563。中国生物医学工程学报。2014;101:92-103。
- 8.
Firon N,Labonte D,Villordon A,Kfir Y,Solis J,Lapis E等。甘薯的转录剖析(番薯甘薯贮藏根形成初期木质素生物合成下调,淀粉生物合成上调。BMC基因组学。2013;14:460。
- 9.
Artschwager E.关于甘薯的解剖学,带有内部分解的笔记。JAGRIC RES。1924年; 27:157-66。
- 10.
Lowe SB, Wilson LA。6种甘薯(番薯甘薯(l) lam)品种。1.块茎启动,块茎生长和孤立的分区。Ann Bot。1974年; 38:307-17。
- 11.
Lowe SB, Wilson LA。6种甘薯(番薯甘薯(l) lam)品种。2.块茎形状与产量的相互关系。安机器人。1974;38:319-26。
- 12.
Wilson La,Lowe SB。西印度红薯根系的解剖学(番薯甘薯(l) lam)品种。安机器人。1973;37:633-43。
- 13。
Noh SA, Lee H-S, Huh EJ, Huh GH, Paek K-H, Shin JS,等。SRD1参与生长素介导的贮藏根初始增厚生长,通过增强甘薯后生木质部和形成层细胞的增殖(番薯甘薯).J Exp Bot. 2010; 61:1337-49。
- 14。
顾爱婷,黄永胜,王永胜,马迪,叶桂伟。IbMADS1 (番薯甘薯MADS-box 1基因(MADS-box 1)参与甘薯块根起始(番薯甘薯).安机器人。2008;102:57 - 67。
- 15.
卢SA,李H-S,金Y型S,白南舜K-H,申JS,裴JM。甘薯的IbEXP1基因增强的存储根系发育的下调。J Exp Bot。2013; 64:129-42。
- 16.
粮农组织。联合国粮食及农业组织,2016。www.fao.org..
- 17.
何志强,罗尔奇,德·勃劳,等。大规模的干预措施在莫桑比克农村地区引进橙色甘薯,增加了儿童和妇女的维生素A摄入量。中国农业科学(英文版)2012;
- 18.
棉花中碳水化合物的分配(gossypium hirsutumL.)。J Exp Bot。1987年; 38:1211-8。
- 19.
王涛。根系淀粉储备对扦插后植株再生的影响Lotus对虾.《公共科学图书馆•综合》。2014;9:1-7。
- 20。
Bowen BJ, Pate JS。根系淀粉对再生植株火后枝条恢复的意义Stirlingia latifoliaR.Br。(proteaceae)。Ann Bot。1993; 72:7-16。
- 21.
李志刚,李志刚。植物根系结构与淀粉分布的关系。植物学报。安机器人。1996;77:357 - 64。
- 22.
Ozias-Akins P, jarrett RL。属的核DNA含量和倍性水平番薯.acta Hortic sinica, 1994; 119:110-5。
- 23.
琼斯:染色体编号番薯和相关的属。j hered。1968年; 59:99-102。
- 24。
属的染色体数目番薯.j .她。1964;55:216-9。
- 25。
一种甘薯晚贮藏生根突变体的生理和解剖特性。acta Hortic sinica, 2002; 127:178-83。
- 26。
詹森佤邦。植物组织化学:原理与实践。旧金山:W. H.弗里曼;1962.
- 27.
主要化学成分为柑橘类木材,特别是木质素。植物杂志。1942;17:558 - 81。
- 28.
赫尔JM。氯化钙溶液作为安装介质的新用途。生物技术Histochem。1992;67:9-13。
- 29.
基于全局最优拼接的三维显微图像采集方法。生物信息学。2009;25:1463-5。
- 30.
Schindelin J,Arganda-Carreras I,Frize E,Kaynig V,Longair M,Pietzsch T等人。斐济:用于生物图像分析的开源平台。NAT方法。2012; 9:676-82。
- 31。
Schindelin J, Rueden CT, Hiner MC, Eliceiri KW。Mol rered Dev. 2015; 82:518-29。
- 32。
Parkhomchuk D, Borodina T, Amstislavskiy V, Banaru M, Hallen L, Krobitsch S, et al.;通过互补DNA的链特异性测序进行转录组分析。核酸学报2009;37:e123。
- 33.
Grabherr MG, Haas BJ, Yassour M, Levin JZ, Thompson DA, Amit I,等。没有参考基因组的RNA-Seq数据的全长度转录组组装。生物科技Nat》。2011;29:644-52。
- 34.
Haas BJ, Papanicolaou A, Yassour M, Grabherr M, Philip D, Bowden J,等。RNA-Seq的从头转录本序列重建:参考文献的生成和trinity分析。Nat Protoc。2013;8:1-43。
- 35.
Li B,杜威CN。RSEM:具有或不具有参考基因组的RNA-SEQ数据的准确转录物定量。BMC生物信息学。2011; 12:323。
- 36。
Langmead B, Salzberg SL.快速间隙读对齐与领结2。Nat方法。2012;9:357-9。
- 37。
从基因组和宏基因组数据集快速识别和去除序列污染。《公共科学图书馆•综合》。2011;6 (3):e17288。
- 38。
罗宾逊医学博士,麦卡锡DJ,史密斯GK。edgeR: Bioconductor包,用于数字基因表达数据的差异表达分析。生物信息学。2010;26:139-40。
- 39.
Robinson M,Oshlack A.一种缩放标准化方法,用于RNA-SEQ数据的差异表达分析。基因组Biol。2010; 11:R25。
- 40.
Emms DM, Kelly S. OrthoFinder:解决全基因组比较中的基本偏差极大地提高了orthogroup推理的准确性。基因组医学杂志。2015;16:157。
- 41.
Liu K, Warnow TJ, Holder MT, Nelesen SM, Yu J, Stamatakis AP, et al.;非常快速和准确的同时估计多个序列比对和系统发育树。系统医学杂志。2012;61:90 - 106。
- 42.
Stamatakis a . RAxML版本8:系统发育分析和大系统发育后期分析的工具。生物信息学。2014;30:1312-3。
- 43。
李建军,李建军,李建军,等。淀粉的生物合成、调控和提高作物产量的生物技术途径。Biotechnol放置2014;32:87 - 106。
- 44。
Waramboi JG, Dennien S, Gidley MJ, Sopade PA。巴布亚新几内亚和澳大利亚甘薯的特性:物理化学、糊化和糊化特性。食品化学。2011;126:1759 - 70。
- 45.
干湿型甘薯淀粉的流变学和物理化学性质。农业食品化学学报2000;48:2937-42。
- 46.
25个木薯品种的根粉淀粉含量、直链淀粉含量和体外淀粉酶敏感性。中国农业科学(英文版),2012;
- 47.
徐旭,潘胜,程胜,张博,穆东,倪鹏,等。块茎作物马铃薯的基因组序列分析。大自然。2011;475:189 - 95。
- 48.
Loretan PA, Bonsi CK, Mortley DG, Wheeler RM, Mackowiak CL, Hill WA,等。几种环境因子对甘薯生长的影响。Adv . 1994;14:27 - 80。
- 49。
Ingkasuwan P,Netrphan S,Prasitwattanasere S,Tanticharoen M,Bhumiratana S,Meechai A等。推断转录基因调控网络淀粉代谢拟南芥蒂利亚纳叶使用图形高斯模型。BMC Syst Biol. 2012;
- 50。
Welch D, Hassan H, Blilou I, Immink R, Heidstra R, Scheres B。拟南芥JACKDAW和MAGPIE锌指蛋白通过限制短根作用划定不对称细胞分裂和稳定组织边界。基因Dev。2007;21:2196 - 204。
- 51.
JACKDAW控制表皮图案在拟南芥根分生组织通过非细胞自主机制。发展。2010;137:1523-9。
- 52.
Tao X,Gu Y-H,王H-Y,Zheng W,Li X,Zhao C-W等人。基于甘薯的综合De Novo转录组合组装的数字基因表达分析[番薯甘薯lam) (l)。《公共科学图书馆•综合》。2012;7:e36234。
- 53.
WOX4诱导植物生长素对形成层细胞的响应拟南芥.植物细胞。2011;23:3247-59。
- 54.
Etchells JP,Provost CM,Mishra L,Turner SR。WOX4和WOX14在PXY受体激酶的下游作用,以调节植物血管增殖,独立于血管组织中的任何作用。发展。2013; 140:2224-34。
确认
我们是从社会迷迭香格兰特奖演进,从UGA植物生物学系,格兰特在研究援助协会对综合与比较生物学和美国农业部帕尔弗里奖的研究资助表示感谢。我们要感谢克雷格Yencho,仲瑞仔,常淑梅,拉塞尔Malmberg,里克·米勒,Saravanaraj阿伊耶姆帕拉耶姆和Leebens - 麦克实验室的成员对实验设计和数据分析有益的讨论。我们要感谢Magdy Alabady与RNA分离和文库制备和贝丝·理查森,碧姬布伦斯和郑华烨与显微镜援助援助。最后,我们从UGA温室工作人员的协助维持植物感激。
资金
这个项目的资金是通过来自进化研究学会的罗斯玛丽奖、佐治亚大学植物生物学系的帕尔弗里奖、综合与比较生物学学会和美国农业部的研究资助基金获得的。这些机构都没有参与这项研究的设计或实施。
数据和材料的可用性
在本研究中生成和分析的数据可从BIOPROJECT PRJNA448837下的GenBank序列读取归档数据库中获得。支持数据已作为补充文件提供。
作者信息
从属关系
贡献
Le,RJ和JL-M设计了这项研究。LE执行所有数据收集和分析。LE和JL-M解释了重大结果并准备了稿件出版物。所有作者都阅读并批准了这份手稿。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
相互竞争的利益
JL-M是BMC Plant Biology的编委会成员。
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
附加文件
额外的文件1:
表S1。本实验所用植物材料的附加资料。(XLSX 10 kb)
额外的文件2:
表S2。中细根样本的tmm归一化FPKM值番薯甘薯.统计数据由edgeR分析输出。(XLSX 4456 kb)
附加文件3:
表S3。中细根样本的tmm归一化FPKM值番薯trifida.统计数据由edgeR分析输出。(XLSX 1833 kb)
额外的文件4:
表S4。中细根样本的tmm归一化FPKM值Distimake dissectus.统计数据由edgeR分析输出。(XLSX 4129 kb)
额外的文件5:
表S5。中细根样本的tmm归一化FPKM值Distimake Quinquefolius..统计数据由edgeR分析输出。(XLSX 5130 kb)
附加文件6:
表S6。贮藏根与细根基因表达差异番薯甘薯.Edger对成绩单的统计数据发现,在存储根和细根之间显着表达番薯甘薯.(XLSX 142 kb)
附加文件7:
表S7。贮藏根与细根基因表达差异Distimake dissectus.Edger对成绩单的统计数据发现,在存储根和细根之间显着表达Distimake dissectus.(XLSX 23 kb)
额外的文件8:
表S8。基因和转录物的功能诠释番薯甘薯从Trinotate。(XLSX 12149 kb)
额外的文件9:
表S9。基因和转录物的功能诠释番薯trifida从Trinotate。(XLSX 10975 KB)
额外的文件10:
表S10。基因和转录物的功能诠释Distimake dissectus从Trinotate。(XLSX 13051 kb)
额外的文件11:
表S11。基因和转录物的功能诠释Distimake Quinquefolius.从Trinotate。(XLSX 23712 KB)
权利和权限
开放访问本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
Eserman,L.A.,Jarret,R.L.&Leebens-Mack,J.H.储存根部在早晨辉煌的平行演变(圆润vulaceae)。BMC植物杂志18,95(2018)。https://doi.org/10.1186/s12870-018-1307-4
已收到:
接受:
发表:
关键字
- 比较转录组
- 基因表达
- 番薯
- 番薯甘薯(甜点)
- 并行进化
- 根解剖学
- 存储根部