摘要
背景
硅(Si)是已知的保护生物营养和半生物营养植物病原体;然而,它发挥预防作用的机制仍然未知。为了获得Si作用模式的独特见解,我们对大豆进行了完整的比较转录组分析(大豆)植物及疫霉突变这是一种半生物营养体,其毒性严重依赖效应器。
结果
施硅接种植株可有效地预防p .突变在整个实验过程中(21天)。我们的结果表明,Si-free (Si−早期(4 dpi)表现为防御相关基因的高表达,包括植物受体,随着时间的推移,这些基因随着病原体进入根部而消退。感染与效应因子的高表达同步p .突变随着时间的推移,其性质发生了变化。相比之下,Si喂养的转录组反应+)植物明显不受p .突变,病原菌效应子编码基因的表达量显著降低。
结论
鉴于外质体是效应物与植物防御和受体相互作用的关键位点p .突变我们的结果表明Si可能干扰了两者之间的信号网络p .突变而植物,阻止或减少效应物到达植物受体的释放,从而产生一种不相容的相互作用形式。
背景
大豆(大豆l稳定。在经济和农业上,豆科植物是世界上最重要的豆科植物,但其产量受到许多生物和非生物因素的影响。最重要的是,疫霉突变Kaufm。和gre。[27]可导致美国年产量损失高达2亿美元,全球损失达20亿至20亿美元[31].疫霉突变是一种土传植物病原体,属卵菌属,寄主范围有限,以大豆为主要寄主。它会导致根和茎腐烂,以及出现前和出现后的潮气,特别是在洪水泛滥的土壤中,由于其鞭毛状的游动孢子,病原体很容易传播[45].它被描述为一种半生物致病菌,它分泌效应蛋白(编码由Avr的基因)在感染的初始生物营养阶段操纵和侵入活的宿主细胞。在植物-病原体相互作用中,效应子被认为是重要的毒力因子,病原体利用效应子抑制植物中的PAMPs(病原体相关分子模式)触发免疫(PTI)和效应子触发免疫(ETI)或改变寄主代谢,使其易于在植物组织中定植[12,50].因此,大豆可以携带抗性基因p .突变(石头剪刀),编码或预测编码核苷酸结合富亮氨酸重复序列(NB-LRR)型蛋白[19,26],它们能够识别Avr的效应蛋白p .突变并诱发适当的防御反应[10,18].相互作用的结果石头剪刀基因和Avr的基因通常决定相容或不相容的相互作用。
许多研究强调了硅(Si)施肥的预防作用[3.,16,20.]以寻找其他方法来防止兼容交互情况下的损失。有趣的是,Si似乎对生物营养型和半生物营养型真菌/卵菌病原体特别有效[5,46].以大豆为例,Arsenault-Labrecque等人[1]的研究结果表明,Si处理对生物真菌引起的大豆锈病有效Phakopsora pachyrizi.此外,Deshmukh等人[9]在大豆中发现了Si转运蛋白,从而证实了该物种对Si的接受性和吸收能力。
硅的预防特性的内在机制多年来一直困扰着科学家们。最初,有人认为硅沿细胞壁沉积形成了一个物理屏障,阻止了真菌渗透到植物中[47].然而,更多的研究将Si的存在与不同的植物防御反应联系起来,从而表明Si可能在诱导获得性抗性中发挥作用[6,7,16,17,53].在最近的一项研究中拟南芥缺乏水杨酸(SA)合成的突变体,Vivancos等。[46]表明Si对突变型和野生型植物都有保护作用(Erisyphe cichoracearum).这使得作者认为,Si作为无定形凝胶沉积在外质体中可能会阻止真菌效应物到达它们的目标,从而改变病原体的发展。这个假设在p .突变-大豆相互作用,根据最近的结果。的确,Ma等人。34最近的研究表明p .突变采用一种带效应器的异体诱骗策略对大豆进行攻击。辛等。[52]进一步提出,水质体是致病性所必需的,而不是免疫抑制,这种情况可以通过硅的存在而改变。最后,Wang等人。[50],根据最近的研究结果p .突变,描述了一个主要战场之间的病原体效应物和宿主异位体监测系统。
自p .突变是一种严重依赖效应物的半生物营养型病原体吗p .突变-大豆致病系统被认为非常适合验证和研究Si沉积改变毒力因子释放的假设p .突变.在此背景下,确定了两个主要目标:1)评估大豆植株的抗性p .突变2)分析与毒力相关的显著基因的表达p .突变以及大豆的防御机制,以评估不同的反应是否与Si的预防作用有关。
结果
表型反应
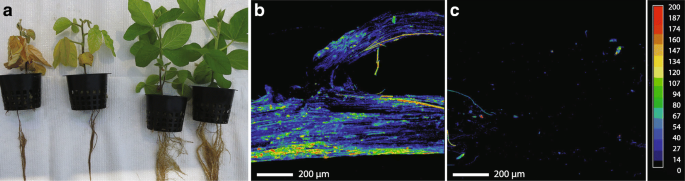
用大豆植株的游动孢子接种p .突变在循环水培系统中饲喂含1.7 mM Si和不含1.7 mM Si的营养液,以比较与Si相关的表型差异。根褐变最早出现在接种后4天(dpi)。在Si中,在数天内出现发育迟缓和叶片变色,第一例死亡记录在15 dpi−治疗。Si和Si之间的区别−,如果+随着处理时间的增加,Si植株增加21 dpi+处理后的植株明显比未处理的植株健康(图;1).在干重方面,未接种的植株与未接种的植株无显著差异−(8.4±0.5)和Si+(8.7±0.4)株。但是,接种p .突变显著降低植株干重,但Si的预防作用非常明显,植株的Si含量显著增加+(5.0 g±1.9)−(2.0 g±1.0)治疗。大豆的x射线显微分析作图证实了Si在整个大豆根部的积累+植物(图。1 b),而在没有Si修正的情况下,没有观察到Si沉积的明确证据(图。1 c).
双RNA-seq分析p .突变Si存在时-大豆相互作用
一个完整的比较转录组分析大豆根和p .突变分别在0、4、7和14 dpi进行分析,得到大豆和p .突变以响应Si的应用。
大豆根系转录组
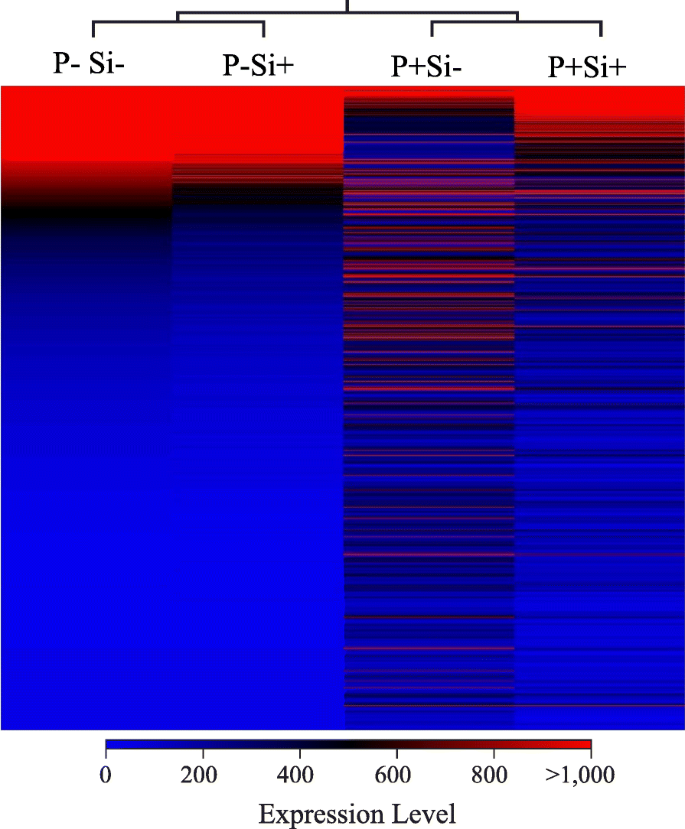
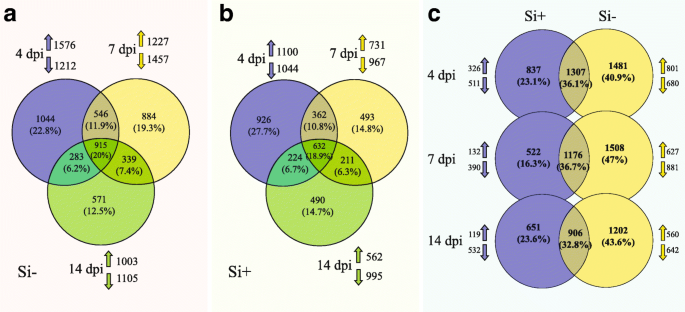
从根部到大豆基因组的加工reads的图谱显示,未接种或未施Si处理的样品(对照)的Mapping reads比例非常高。在对照植株中,大豆Si位点的reads分别为81%和90%−,如果+分别治疗。在接种4 dpi的植株中,有61%和76%的reads定位于大豆Si−,如果+,分别(附加文件1:表S1)。有趣的是,在分析的56045个基因中,未施硅处理的对照植物之间的差异表达基因(deg)数量被限制在50个,并且都在Si中下调+(Fold-change≥4,FDR .p值≤0.01)。另一方面,植物对接种有反应p .突变(如果−P+与硅−P−3294个基因的差异表达(附加文件2:表S2)。大多数因感染而表达差异的基因(Si−P+与硅−P−)恢复到更接近Si中对照植物的表达模式+治疗(如果+P+与硅−P+)如热图所示(图。2).
中deg的功能分类p .突变这些基因主要属于以下几类:防御相关基因、次生代谢基因、激素代谢基因、初级代谢基因和无功能标注的无本体基因。
与国防有关的基因
大多数已知的可以激活植物PTI的模式识别受体(PRRs)分为两类受体:跨膜受体激酶和受体样激酶(RLK;[10,29,32])。在我们的研究中,46个deg属于受体激酶家族,24个RLK在Si中在4 dpi处表达较高−治疗(附加文件3.图S1 a, b). PRR激活后,下游信号通路通过丝裂原活化蛋白激酶(MAPKs)和钙(Ca2 +).MAPKs是普遍存在的信号转导成分,在PTI和ETI中都有涉及。我们的结果表明,在9个差异表达的MAPKs中,有5个在Si中有较高的4 dpi表达−治疗(附加文件3.:图S1c)。类似地,33ca2 +依赖蛋白激酶(CDPKs)在4 dpi高度表达(附加文件)3.:图S1d,附加文件4:表S3)。
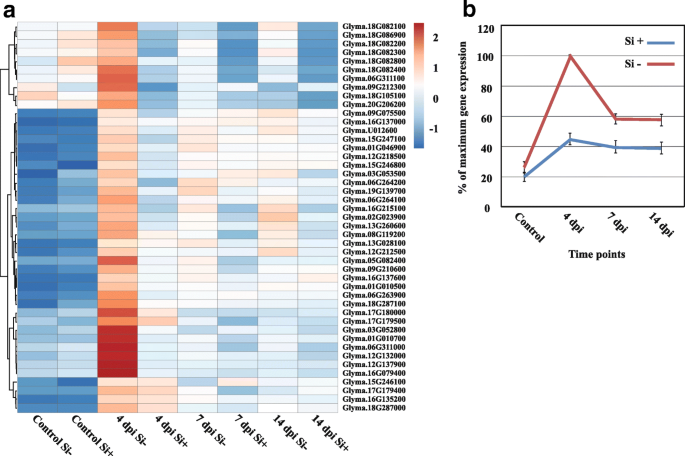
NB-LRR蛋白质。在80个微分表达中NB-LRR(Fold-change≥4,FDRp-value≤0.01),45在Si中4 dpi表达量最高−植物。热图结果清楚地显示了没有表达的表达模式NB-LRR在未接种的植株(对照)中,无论施硅与否,在施硅4 dpi时,基因均急剧增加−植物。虽然在7和14 dpi时表达量降低,但在Si中表达量仍显著升高−植物(图。3.,附加文件5:表S4)。
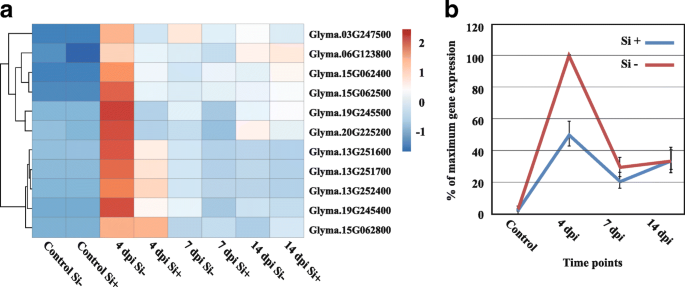
致病相关蛋白(PRs)。基于聚类分析,11公关基因至少在一个时间点存在差异表达(Fold-change≥4,FDRp值≤0.01)。顺便说一下,热图结果清楚地表明,4 dpi是分化Si的关键时间点−,如果+就植物而言公关-基因表达(图;4,附加文件6:表S5)。随着时间的推移(7和14 dpi),表达下降到处理之间相似的水平。
与防御表达相关的转录因子。在至少一个时间点的67个差异表达的WRKY转录因子中,大多数在Si中表达较高−4 dpi时,有20个基因在Si中表达量较高−治疗(附加文件7:图S2,附加文件8:表S6)。
各种防御反应。其他与防御反应相关的基因也表现出类似的表达模式,它们在Si中以4 dpi的速度快速上调−植物退化到与Si中观察到的水平相似+植物。例如,在至少一个时间点的16种差异表达的植物蛋白酶抑制剂中,13种在Si中表现出较高的表达−4 dpi处理。类似地,在至少一个时间点上差异表达的7种多酚氧化酶中,有5种在Si中表现出较高的4 dpi表达−治疗(附加文件9:图S3,附加文件10:表S7)。
次生代谢
我们观察到31个与类黄酮代谢相关的基因在Si中在4 dpi处有较高的表达−治疗。我们还观察到9个参与异黄酮代谢的基因和15个参与类异戊二烯代谢的基因,这些基因在Si中均在4 dpi处有较高的表达−治疗(附加文件11:图S4,附加文件12:表S8)。
激素代谢
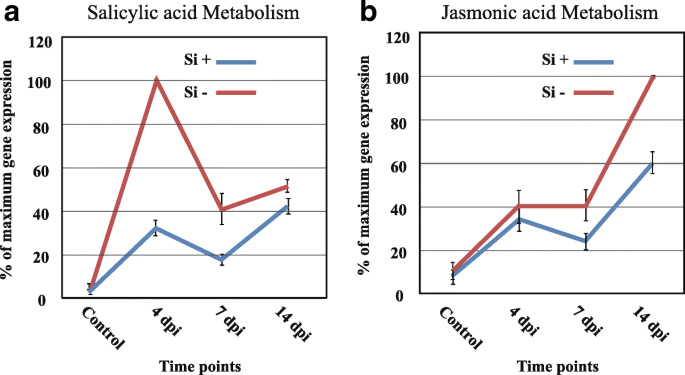
在我们的系统中,5个参与SA代谢的基因在Si的4 dpi处有较高的表达−治疗,与生物营养期同步进行p .突变,13个参与JA代谢的基因在相同处理下,在14 dpi时表达量较高(图2)。5,附加文件13:表S9),这一时期与病原体的坏死性发展更为一致。
初级代谢
根据功能分类,初级代谢中含有DEGs的种类最多。参与初级代谢的580个deg中p .突变Si感染−治疗中,70%上调,30%下调。在Si中+处理后,deg数量减少到420个,且上调和下调比例相近。转录本上调与能量产生过程相关,如碳水化合物代谢、TCA循环、糖异生、线粒体电子传递、ATP生物合成和氨基酸生物合成,以及脂质代谢的生物合成(附加文件)14:图S5)。
疫霉突变转录组
90%以上的处理读自五种生物复制p .突变体外培养后映射到p .突变基因组(附加文件)15:表S10)。为了确定哪些基因在与大豆相互作用过程中表达差异,我们比较了基因表达在足底用无菌样品。中deg的数目p .突变Si含量更高−与硅相比+条件(图。6).每个处理的deg数量最高(Si−或如果+)的dpi为4,并且这个数字随着时间的推移而不断下降。
注释
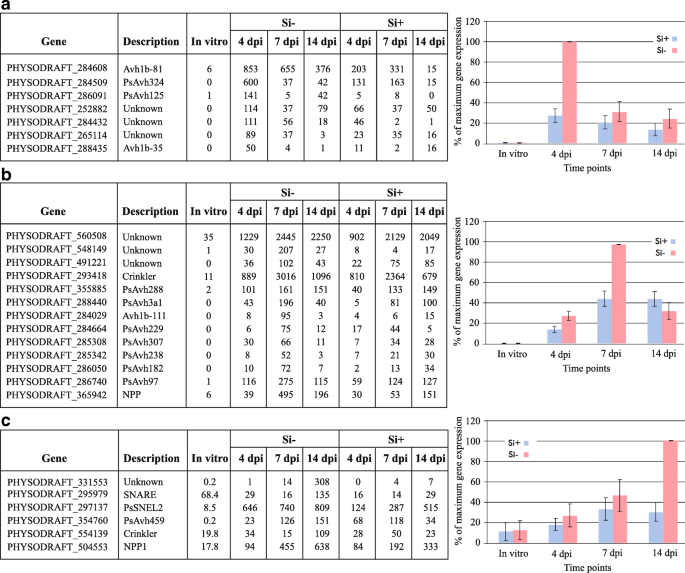
当观察前100个上调的deg时p .突变在所有的时间点和治疗中,大多数与假设的蛋白质有关,而这些蛋白质的功能注释是不可用的(附加文件16:表S11)。一个明显的例外是avh1b - 81,该基因在Si中4和7 dpi的表达量最高−治疗。
效应器的表达式p .突变期间如果−,如果+治疗
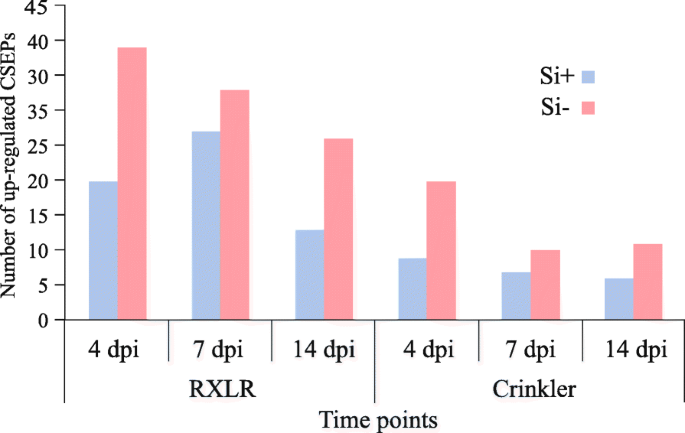
在卵菌中,许多效应子以RxLR基序为特征[11].的348个RxLR效应基因p .突变,104个基因至少在一个时间点存在差异表达(Fold-change≥4,FDRp值≤0.01;无花果。7).时间序列分析表明,Si中RxLR效应子在4 dpi时上调的数量更多−植物,与大豆植物的初步症状相一致。另一方面,Si +植株在7 dpi时RxLR效应子的表达量高于4 dpi时。
Crinkler效应器(CRN)是另一类重要的分泌效应器p .突变.在226个CRN效应基因中p .突变(Fold-change≥4,FDRp值≤0.01;无花果。7).聚类比较显示Si中上调的CRN效应子数量较多−植物与硅相比+植物,特别是在4 dpi。有趣的是,最近报道的异体效应子PsXEG1而它的诱饵(PsXLP1;[34])在我们的实验条件下没有表达。
进行分层聚类分析p .突变候选分泌效应蛋白(CSEPs),以识别在不同时间点具有相似表达谱的基因。我们的结果表明,一些CSEPs在4 dpi时明显表达更多,特别是在Si中−治疗(图。8).以同样的方式,其他CSEPs优先表达在7 dpi(图。8 b),而另一些则处于感染后期(图。8 c),高表达总是与Si有关−治疗。值得注意的是,这些CSEPs在无菌培养中没有表达。有趣的是,只有带有RxLR基序的CSEPs在4 dpi时高表达,而CRN效应子和其他组的成员,如坏死诱导蛋白,在7和/或14 dpi时高表达(图2)。8).
讨论
一个完整的比较转录组分析Si对p .突变本研究表明Si可能通过干扰病原体效应子和植物防御受体之间的对话来保护植物,从而阻止相容的相互作用。迄今为止,硅对各种植物病原体的保护作用已得到充分证明[3.,16,46,但许多关于它如何在植物防御中发挥作用的问题仍然没有答案。阻碍真菌渗透的机械屏障是Si保护作用的第一个解释。47],但这一假设已被慢慢抛弃,即基于施用Si后叶片韧性没有充分增加以延缓真菌渗透的结果[7,54].谢里夫等人。[6,8]首次报道了Si对黄瓜根系施药后木质素、酚类化合物和植物抗毒素等防御反应的诱导腐霉属最后,这一观察结果后来在其他宿主-病原体相互作用中得到了再现[16,17,20.,40].然而,Vivancos等人。46]最近报道,无法通过SA途径进行防御反应的突变拟南芥仍能抵御白粉病(Erisyphe cichoracearum)当喂食Si时。这表明,与Fawe等人提出的机制不同。17], Si的作用并不仅仅与防御反应的激活有关,正如本研究的结果所支持的那样。
我们的数据清楚地表明,Si处理能很好地保护大豆植株免受p .突变,证实了Guérin等人先前的报告。[21].从实用的角度来看,生物营养和半生物营养(如p .突变)的病原菌在Si控制的病原菌列表中占主导地位,而且与报道的坏死性病原菌相比,这种影响似乎更持久,更不短暂。鉴于前者病原体通常在其宿主范围内具有更强的物种特异性,这导致Vivancos等人。[46,表明Si可能会以某种方式干扰宿主识别。
感染过程的比较转录组分析p .突变在大豆上,由于Si的影响,揭示了两者复杂的基因表达模式p .突变以及对硅保护植物的机制的前所未有的深入了解。从一开始,有趣的是,Si对对照植物的影响可以忽略不计,大约56000个大豆转录本中只有50个表达差异。考虑到大多数Si都被下调,但没有明显的通路受到影响,这加强了Si的有益作用在本质上是严格保护或与压力相关的概念。这些结果证实了前人对拟南芥的研究白粉菌属cichoracearum[15)、小麦-小麦黑麦[5]和米[51],在没有应力的情况下Si的影响为零或最小。另一方面,他们反驳了其他声称单纯施硅可以促进植物生长的研究[24,33,35,48),尽管这一概念正受到包括本研究在内的许多研究的挑战。
大豆植株感染p .突变表现出活跃的转录组,其中超过3000个基因与对照植物相比有差异表达,特别是在初级代谢和胁迫防御类别中。这些观察结果与最近一项关于大豆的研究相一致尖孢镰刀菌由Lanubile等人。[29],他们发现大部分的deg被分配给了这两类。虽然初级代谢作为能量提供者的作用是不可否认的,但它在植物防御反应调节中的作用已在许多研究中得到了充分的记录[41].参与初级代谢的基因的高表达可能与半生物致病菌劫持植物代谢为自己的利益有关,因此需要从植物消耗更多的能量。初级代谢的上调与以往对小麦的研究结果一致小麦黑麦在Si−治疗(5],作者将这种上调与生物营养性病原体的存在联系起来,在大豆-的情况下尖孢镰刀菌互动(29]时,初级代谢的高激活与诱导防御相关基因的能量需求增加有关。
在受感染的植物中,防御相关基因的高表达提供了大豆植物试图抵御病毒的证据p .突变在侵染早期(4 dpi),随着病原菌在根内的发展,其表达在7和14 dpi时降低。同样的结果已被观察到的反应,致病性分离尖孢镰刀菌在感染后的最初几天,大豆积累了更多的防御反应转录物,而这些反应最终消退[29].这一连串的事件在以前的研究中已经报道过,包括大豆p .突变互动(36),拟南芥,大肠cichoracearum[15)、小麦-小麦黑麦[5]和大豆-镰刀菌素virguliforme[38],其中提出,植物对病原体的第一反应是激活一系列与防御相关的基因,即使在兼容相互作用的情况下也是如此。以同样的方式,在Si的4 dpi−在植物中,NB-LRR受体(被称为效应剂触发免疫(ETI)反应的激活标记)的更高激活程度导致了与Si相反的兼容相互作用+植物。这表明,防御相关基因的表达不一定转化为抵抗反应。例如,在亲和大豆中也报道了NB-LRRs的较高激活镰刀菌素virguliforme互动(38].与防御反应相关的其他途径的表达模式相似,其中Si在4 dpi时的高表达一致−植物。与此模式一致,我们的结果证明了参与次级代谢和信号转导的多个基因的转录诱导。在大豆中也有相同的观察结果p .突变[36),f . virguliforme[38),而病圃[29].我们的工作进一步表明,感染p .突变在侵染早期触发SA代谢,而在侵染后期激活JA代谢,尤其是Si−植物。这种基因表达模式在植物和半生物致病菌之间的相互作用中已经报道过,如油菜籽和Leptosphaeria maculans,大豆和p .突变[21,36,42].
用1.7 mM Si处理大豆植株,可提供较强的抗p .突变,这一结果得到了表型和热图的支持,即Si处理的受感染植物的总体转录组反应与对照植物有些相似。这些结果证实了Chain等人的研究结果。5],他的研究表明,硅处理过的植物基本上对硅的存在没有反应大肠cichoracearum.
为了更好地理解这一现象,转录组反应p .突变控制和Si+随着时间的推移,对植物进行了跟踪和比较。据许多研究报道,半生物营养病原体会在植物细胞的外质体区分泌CSEPs,这些CSEPs可以直接作用于外质体,也可以转运到细胞中,以中和生物营养期的植物防御反应,并在坏死期诱导坏死[49].差异表达的聚类比较p .突变不同时间点的CSEPs在Si中表现出系统较高的数值−植物与硅相比+在Si中,特定CSEPs在4 dpi时表达较高−治疗,这一结果证实了NB-LRRs在同一时间点的较高表达。例如,Avh324,以前报道作为一种效应参与的生物营养期p .突变[49],是我们研究中4 dpi表达最高的CSEPs之一。有趣的是,我们的研究结果表明,与Si-植物相比,Si +植物中RxLR效应子上调的数量较少,并且在Si +植物中上调的模式延迟了4到7天。这些结果与先前的大量报道完全一致,这些报道表明Si将延迟疾病的发作并降低其程度[6,7,15,20.,22].其他被归类为坏死诱导效应物的效应物,如Avh238 [49],在Si感染后期高表达−植物。在拟南芥不亲和互作中CSEPs的相对下调已被报道-蓝角草[25].这些结果与Si之间的表型差异很好地吻合−,如果+植物。
我们的研究结果清楚地表明,在大豆植株接种硅7天之前接种硅p .突变导致大豆根系对感染的保护和Si的系统性沉积(见图2)。1).已充分证明,Si将以非晶硅的形式沉积在植物中,主要是在植物细胞的异体区[2,55].如前所述,外质体是分泌的CSEPs最初释放或活动的特权位点[37].外质体在植物-病原体相互作用中起着至关重要的作用,因为它将根据病原体效应物与植物防御和受体之间的相互作用来决定病原体的建立或抑制[4,50,52].此外,丝状病原体/卵菌通常最初在外质体中释放效应子,然后在细胞内易位,在细胞内与其他受体(如NLRs)相互作用[37].沿着这些路线,最近的报告强调了异体区域对肿瘤发展的特别重要性p .突变.最值得注意的是,Ma等人。34表明p .突变采用异体诱骗策略Avr的基因产物逃避受体的识别,从而抑制防御反应。此外,Xin等。[52]提出,外质体中的水分可用性在随后的感染中发挥了关键作用p .突变.综上所述,我们的结果表明,Si的饲喂导致大豆和大豆之间存在一种不相容的相互作用p .突变并表明外质体中Si的存在可能与其预防特性有关。作为第一个证据,已知外质体中硅的聚合会减少自由水的丰度[19],这将改变细胞外植体环境,使其不那么有利于p .突变发展。其次,沿质膜的无定形Si的存在可能是a)限制了诱导细胞分化和表达必要致病性基因所需的信号从植物向病原体的传递,b)干扰了信号的传递p .突变而植物,阻止或减少,例如,释放效应物到达植物受体,c)干扰效应物进入植物细胞的转运和d)限制营养物质从宿主向半生物型病原体的转变,导致一种形式的非宿主抗性[28,44].顺便提一下,Vivancos等人。46].结果表明,即使是sa缺乏的拟南芥突变体在喂食Si时也能抵抗白粉病,并表明抑制效应物释放可以解释这一结果。
结论
我们的工作对Si沉积影响宿主-病原体相互作用结果的机制作用提出了新的见解。更具体地说,结果表明硅处理能很好地保护大豆植株免受p .突变.转录组分析显示,si处理的植物的防御反应比si剥夺的植物低得惊人p .突变Si+植物。这些结果支持了Si干扰植物与生物营养/半生物营养病原体之间的信号传递过程以引起不相容相互作用的假设。
方法
为了评估大豆植株对Si处理的表型反应,我们使用了Guérin等人开发的方法。[21].植物在水培系统中种植,有四种不同的处理:大豆植株接种p .突变以硅酸钾的形式在含硅和不含硅的条件下生长(pH值7.0),对照植物(不含硅)p .突变)生长在有硅和没有硅的情况下。在所有实验中,Si的浓度都被调整为1.7 mM,因为这是溶液中硅酸的最高浓度,也是测试Si预防作用的标准程序[46].每个处理包括两个独立的槽,喂食营养液。对于每个处理和槽,5株,每个处理共10株。
植物生长条件
大豆(大豆简历。从GRIN (PI 372415)中获得的Hikmok吸液是基于几代观察到的一致表型特征以及其吸收Si的能力和缺乏Si的能力而选择的石头剪刀基因(1,22].本研究中使用的基因型是在拉瓦尔大学开发的。在RNA-seq和疾病检测中,从拉瓦尔大学温室种植的植物中收集的种子在确保遗传纯度后使用。将种子浸泡在5%次氯酸钠中1分钟,然后用蒸馏水冲洗三次。然后,将种子种在绿洲立方体中,在温室中种植4-5天。下胚轴和根出现后,每个含有一株植物的绿洲立方体都转移到水培系统中。植物接受2天的水,在第三天,含有宏观和微量营养素的溶液被添加到槽中(见下文),Fe Na EDTA和硅酸钾(Kasil #6, 23.6% SiO)形式的Si2;国家硅酸盐,魁北克,QC,加拿大)。7天后,游动孢子p .突变被添加到储罐中。宏量营养素(KNO3.,氯化钾,氯化钙2K2HPO4, MgSO4h·72O, MgCl26小时2O)制备为30X溶液;微量元素(H3.薄3., MnSO4·H2O, CuSO4h·52O, ZnSO4h·72O, NaMoO4h·22啊,公司没有3.)2h·62O)为5000倍溶液;FeNa-EDTA(13.2%)分别配制为3000X溶液。将含有2 l宏量营养素、12 ml微量营养素和19.8 ml Fe-EDTA的50 l溶液调至pH 6.5加入60 l槽中。
疫霉突变接种
为p .突变接种时,我们遵循Lebreton等人最近描述的程序。[30.].孤立的p .突变是由A. Xue在渥太华AAFC收集和维护的银行获得的。片从“长期接种”p .突变分离的ont-42-1 (1a, 1c, 1d, 1k和7)转移到含有V8琼脂的培养皿中,用伞膜密封,28°C孵育。6天后,将60个菌丝塞(直径9毫米)浸泡在培养皿(150 × 150毫米)中,加入60毫升无菌自来水和15毫升无菌Agromix土壤提取物。用Parafilm密封5个平板,室温下在摇轨器上轻轻摇18-24小时。显微镜下观察游动孢子,计数游动孢子和包囊游动孢子。取1 μl滴在载玻片上,在100倍显微镜下观察。用10次观察来确定悬浮液中动物孢子的浓度,培养范围为103.到104以游动孢子/ml接种。五盘菌丝塞提供约350毫升的虫孢子悬浮液,收集在500毫升的瓶子中,并直接添加到60升罐中的营养液中。在将幼苗转移到水培系统7天后,将孢子悬浮液或等量的水添加到对照植物的水箱中。
每天对植物进行监测以记录症状发展。21天后,收获植株,在65°C下干燥24 h,以确定其干重。
用于无菌培养p .突变将玻璃纸放在含有培养皿的V8琼脂上,并从相同的“长期接种物”中分离p .突变分离的ont-42-1在V8琼脂培养基中转移到纸上,用伞膜密封,28℃孵育。6天后,菌丝体形成p .突变从纸中取出,冻干,研磨,提取RNA。
显微和x射线分析
利用x射线显微分析作图来定位添加和不添加硅的大豆根系中的硅沉积。根据Guével等人的描述,每个处理至少制备5个根样品。[23].简单地说,根被冻干并涂上金和钯以提供样品的导电性。使用CAMECA SX-100通用EPMA显微镜(CAMECA instruments Inc.,www.cameca.com),电压为15千伏,电流为20纳。
RNA提取,文库构建和测序
在水培系统中,每个处理分别种植5株大豆(生物复制)。对于每个处理,从每个处理植株上采集3厘米的顶根样本,并在每个时间点重复这一过程。在初步实验中,结果表明最初的症状[30.]第一个p .突变在水培系统中4天后,读数始终可检测到。我们的采样方案也相应地进行了调整。根组织被放置在液氮中,直到转移到实验室,并保存在−80℃。从四个时间点收集的根样本的五个生物重复中提取总RNA。[接种前0 d,接种后4、7、14 d], 5个生物重复p .突变在无菌培养中培养,使用TRIzol和RNeasy mini kit (Qiagen),包括按照制造商的说明进行DNAse处理。RNA质量和浓度通过琼脂糖凝胶电泳、分光光度法(Nanodrop ND-1000)检查,最终由Agilent 2100 Bioanalyzer™(Agilent Technologies)检查。
RNA-seq文库根据制造商协议(Illumina Inc.)使用Lexogen®RNA-seq样品制备试剂盒生成。Lexogen®设计用于从聚腺苷酸RNA生成Illumina兼容文库,并且每个转录本只生成一个片段。cDNA文库的效率由Agilent 2100 Bioanalyzer™测量,测序在Illumina HiSeq™2000平台上进行。
RNA-Seq数据分析
原始reads处理和高质量reads对准参考基因组
在进一步处理之前,使用CLC Genomics Workbench V.9.5.4 (CLC Bio, Aarhus, Denmark)的RNA-seq分析工具以FASTQ格式从Illumina reads中剔除Poly-A、适配器序列污染物和低质量碱基(Q < 15)。所有长度为40 bp的清洗reads >与PLANAT核糖体RNA序列对齐,以消除reads中意外的核糖体RNA;然后将其余未映射的reads与大豆参考基因组(大豆Wm82.a2。V1)然后对p .突变参考基因组(疫霉突变V3)。用于映射唯一序列读取的标准包括:错配代价为2,插入代价为3,删除代价为3,最小长度分数为0.9,最小相似分数为0.8。
基因表达,差异基因表达分析和聚类
取归一化表达值估计表达水平。差异表达基因(DEGs)是使用CLC Genomics Workbench中实现的EdgeR算法识别的,该算法利用了Robinson和Smyth开发的精确测试[39].的p-value阈值由错误发现率(FDR)确定,以说明多重显著性检验。为了判断植物与病原菌相互作用过程中基因表达、变化的显著性,采用FDR阈值≤0.01。使用相对于对照条件的log2 (Fold change) > 4的绝对值来选择上调和/或下调基因。为了识别交互过程中的一般趋势,还为每个条件生成了特征的层次聚类(Si+/如果−)使用规范化的表达式值。鉴于每个处理的RNA-seq分析重复超过3次,qPCR验证被认为是不必要的[14].
功能注释与基因本体
基于web的Blast2GO和AgriGO工具[13]用于获得基因本体论(GO)注释,并进行奇异富集分析(FDRp-value≤0.05)p .突变在相互作用中有差异的表达。采用Mapman对氧化石墨烯类别和墨卡托箱进行显著富集测试[43来可视化感染期间被激活的通路。
缩写
- Avr的:
-
无毒性
- CDPKs:
-
Ca2 +-依赖蛋白激酶
- CRN:
-
起皱
- CSEPs:
-
候选分泌效应蛋白
- 度:
-
差异表达基因的数量
- dpi:
-
接种后天数
- 指数:
-
Effector-Triggered免疫力
- 罗斯福:
-
错误发现率
- 走:
-
基因本体论
- 是:
-
茉莉酸
- MAPKs:
-
丝裂原活化蛋白激酶
- NB-LRR:
-
核苷酸结合富亮氨酸重复序列
- p .突变:
-
疫霉突变
- pamp:
-
病原体相关分子模式
- PRRs:
-
模式识别受体
- PRs:
-
Pathogenesis-Related蛋白质
- PTI:
-
PAMPs -触发免疫
- RLK:
-
受体激酶
- 石头剪刀:
-
抗性基因p .突变
- 山:
-
水杨酸
- 如果:
-
硅
参考文献
- 1.
arsenult - labrecque G, Menzies JG, Bélanger RR。硅吸收对不同品种大豆对肿根巨噬菌抗性的影响。植物科学,2012;96:37-42。
- 2.
鲍尔P,埃尔鲍姆R,韦斯IM。陆生植物钙硅矿化:转运、结构与功能。植物科学进展(英文版);2011;30(4):344 - 344。
- 3.
Bélanger王永明,王永明,王永明。硅在小麦抗白粉病(Blumeria graminis f. sp. tritici)中积极作用的细胞学证据。植物病理学。2003;93:402-12。
- 4.
Bozkurt TO, Schornack S, Banfield MJ, Kamoun S。卵菌,效应器,等等。植物学报,2012;15:483-92。
- 5.
链F, Côté-Beaulieu C, Belzile F, Menzies JG, Bélanger RR。在控制和病原体胁迫条件下硅对小麦植株影响的综合转录组分析。植物与微生物相互作用。2009;22:1323-30。
- 6.
Chérif M,阿塞林A, Bélanger RR。黄瓜根受毕氏菌感染后可溶性硅诱导的防御反应。1994;84:236-42。
- 7.
Chérif M, Benhamou N, Menzies JG, Bélanger RR。硅诱导黄瓜植株对通灵的抗性。植物病理学杂志,1992a; 41:11 - 25。
- 8.
Chérif M,孟齐斯JG, Benhamou N, Bélanger RR。硅在黄瓜损伤和毕氏菌侵染植株中的分布研究。植物病理学杂志,1992b; 41:371-85。
- 9.
Deshmukh RK, Vivancos J, Guérin V, Sonah H, Labbé C, Belzile F, Bélanger RR。利用拟南芥和水稻主要内在蛋白的比较基因组学鉴定大豆中硅转运蛋白的功能特征。中国生物医学工程学报,2013;
- 10.
Dodds PN, Rathjen JP。植物免疫:植物-病原体相互作用的综合观点。Nat Rev Genet. 2010; 11:539-48。
- 11.
董s, Yu D,崔l, Quitob D, Tedman J, Kale SD, Tyler B, Wang Y, Gijzen M, Yang CH.大豆疫霉菌RxLR效应子Avr3a/5序列变异的差异识别Rps3a而且Rps5在大豆。PLoS One, 2011;6:7。
- 12.
窦D, Kale SD,王X,蒋ryy, Bruce NA, Arredondo FD,张x, Tyler BM。rxlr介导的大豆疫霉菌效应物Avr1b进入大豆细胞不需要病原体编码机制。植物细胞。2008;20:30 - 47。
- 13.
杜震,周旭,凌云,张志,苏哲。AgriGO:面向农业社区的GO分析工具包。核酸工程学报,2010;38:W64-70。
- 14.
方智,崔霞。rna序列实验的设计和验证问题。《生物科学》2011;12:280-7。
- 15.
Fauteux F, Chain F, Belzile F, Menzies JG, Bélanger RR。硅在拟南芥-白粉病病理系统中的保护作用。《美国国家科学院学报》上。2006; 103:17554-9。
- 16.
Fauteux F, Rémus-Borel W, Menzies JG, Bélanger RR。硅植物对病原真菌的抗病能力。微生物学杂志,2005;249:1-6。
- 17.
马建平,杨建平,杨建平,Bélanger。硅介导的黄瓜类黄酮植物抗毒素的积累。植物病理学。1998;88:396 - 401。
- 18.
李志强,李志强,李志强。大豆β -葡聚糖激发子受体中隐藏的一种古老的酶结构域可能在广泛宿主抗性过程中对病原体相关分子模式的感知中发挥积极作用。中国生物医学工程学报,2004;29(2):342 - 344。
- 19.
高海燕,李志强,李志强。大豆抗疫霉基因Rps1-k的克隆与鉴定。植物微生物相互作用。2005;18:1035-45。
- 20.
Ghanmi D, McNally DJ, Benhamou N, Menzies JG, Bélanger RR。拟南芥的白粉病:探索硅在植物-微生物相互作用中的作用的病理系统。《植物病理学杂志》2004;64:189-99。
- 21.
对生物营养性和坏死性病原体防御机制的比较。植物学报。2005;43:205-27。
- 22.
Guérin V, Lebreton A, Cogliati EE, Hartley SE, Belzile F, Menzies JG, Bélanger RR。用动物孢子接种大豆疫霉的方法评价硅对大豆品种的防治作用。植物学报2014;98:1632-8。
- 23.
Guével MH,孟席斯JG, Bélanger RR。根、叶施可溶性硅对小麦白粉病防治及生长的影响。植物病理学杂志,2007;19:429 - 36。
- 24.
Gunzter F Keller C Meunier JD。植物硅对作物的益处综述。农业可持续发展,2012;32:201-13。
- 25.
Hacquard S, Kracher B, Maekawa T, Vernaldi S, schulzer - lefert P.大麦白粉病病原基因组的镶嵌结构及其转录程序的保存。中国生物医学工程学报,2013;29(2):344 - 344。
- 26.
Jones JDG, Dangl JL。植物免疫系统。大自然。2006;444:323-9。
- 27.
考夫曼MJ,格德曼JW。大豆疫霉菌(Phytophthora sojae)引起的大豆根茎腐烂。植物病理学。1985;48:201-8。
- 28.
非寄主抗性:我们了解多少?植物科学进展2004;9:97-104。
- 29.
Lanubile A, Muppirala UK, Severin AJ, Marocco A, Munkvold G.大豆(Glycine max)根系受致病性和非致病性枯萎菌胁迫的转录组分析。BMC Genomics. 2015;16:1089。
- 30.
Lebreton A, Labbé C, De Ronne M, Xue A, Marchand G, Bélanger RR。建立了一种简单的水培试验来研究大豆的垂直和水平抗性以及大豆疫霉菌的病原类型。植物科学,2018;102:114-23。
- 31.
林飞,赵敏,道格拉斯。比较转录组学显示了10个大豆近等基因系对大豆疫霉菌的分子响应。BMC Genomics. 2014;15:18。
- 32.
刘鹏,魏伟,欧阳生,张建军,陈淑云,张伟科。大豆中表达受体样激酶(RLKs)的分析。中华基因工程学报。2009;36:611-9。
- 33.
马俊峰,西村K,高桥。硅对不同生育期水稻植株生长的影响。土壤科学与工程学报,1989;
- 34.
马Z,林芝,天桥c S,杨伟,齐Z,叶强X,敏Q,亚春L,海洋L,梁k,玉峰F,文武Y,严伟,索梦D,晓波Z, Brett T,元超W。一种副相诱骗物保护大豆疫霉菌除瘤效应子PsXEG1免受宿主抑制剂的影响。科学。2017;355:710-4。
- 35.
Meena VD, Dotaniya ML, Coumar V, Rajendiran S, Ajay S, Kundu S, Rao AS。用硅肥提高热带土壤作物产量的案例。印度国家科学研究院B. 2014; 84:505-18。
- 36.
杨晓明,李志刚,李志刚,李志刚。大豆疫霉菌侵染大豆的基因表达模式。植物微生物相互作用。2004;17:1051-62。
- 37.
丝状病原体如何将效应蛋白传递到植物细胞?《公共科学图书馆·生物学》2014;12:e1001801。
- 38.
刘勇,刘志军。大豆根系对镰刀菌响应的转录分析,猝死综合症的偶然诱因植物与微生物相互作用。2011;24:958。
- 39.
Robinson MD, Smyth GK。负二项离散度的小样本估计及其在SAGE数据中的应用。生物统计学。2008;9:321-32。
- 40.
Rodrigues FÁ, McNally DJ, Datnoff LE, Jones JB, Labbé C, Benhamou N, Bélanger RR。硅增强了水稻二萜类植物抗爆素的积累:这是水稻抗稻瘟病的潜在机制。植物病理学。2004;94:177 - 83。
- 41.
Rojas CM, Senthil-Kumar M, Tzin V, Mysore KS。植物与病原菌相互作用时植物初级代谢的调节及其对植物防御的贡献。中国植物科学,2014;5:17。
- 42.
Sonah H, Zhang X, Deshmukh RK, Borhan H, Fernando D, Bélanger RR。黄斑细螺旋体与油菜亲和和不亲和相互作用时毒力因子的转录组比较分析。前沿植物学报2016;7:1784。
- 43.
Thimm O, Blaesing OE, Gibonv Y, Nagel A, Meyer S, Krueger P, Selbig J, Mueller LA, Rhee SY, Stitt M. MAPMAN:一种用户驱动的工具,可以将基因组数据集显示到代谢途径和其他生物过程的图表上。植物学报,2004;37:914-39。
- 44.
对非宿主抗性过程的新见解。植物学报,2003;6:351-7。
- 45.
泰勒BM。大豆疫霉菌:大豆根腐病病原菌和模式卵菌。植物病理学杂志2007;8:1-8。
- 46.
Vivancos J, Labbé C, Menzies JG, Bélanger RR。硅介导的拟南芥对白粉病的抗性涉及水杨酸(SA)依赖防御途径以外的机制。植物病理学杂志,2015;16:572-82。
- 47.
瓦格纳(Wagner F.)“在世界的世界”Kieselsäure für“文化的世界”Nährstoffhaushalt和“文化的世界”Anfälligkeit“文化的世界”。植物病理学家。1940;12:27 - 27。
- 48.
王海林,李超,梁玉春。中国硅的农业利用。在:Datnoff LE, Synder GH, Kornodorfer GH,编辑。农业中的硅。阿姆斯特丹:爱思唯尔;2001.343 - 52页。
- 49.
王强,韩超,Ferreira AO, Yu W, Tripathy S, Kale SD, Gu B, Sheng Y, Sui Y, Wang X, Zhang Z, Cheng B, Dong S, Shan W, Zheng X, Dou D, Tyler B, Wang Y.大豆疫霉RxLR效应库的转录编程和功能相互作用。植物细胞,2011;23:2064-86。
- 50.
王艳,王艳。不招待就捣蛋:微生物病原体进化出的外体效应体调节植物对感染的易感性。植物微生物相互作用,2018;31:6。
- 51.
Watanabe S, Shimoi E, ohhkama N, Hayashi H, Yoneyama T, Yazaki J, Fujii F, Shinbo K, Yamamoto K, Sakata K, Sasaki T, Kishimoto N, Kikuchi S, Fujiwara T. Si营养调控水稻基因的鉴定。土壤科学。2004;50:1273-6。
- 52.
辛晓峰,野村K,昂K, Velásquez AC,姚军,Boutrot F,常建华,Zipfel C,盛阳H.细菌在植物中建立的水生活空间对毒力至关重要。大自然。2016;539:524-9。
- 53.
叶敏,宋勇,龙杰,王锐,Baerson SR,潘震,Zhu-Salzman K,谢军,蔡凯,罗松,曾睿。硅对茉莉酸介导的水稻抗草食动物防御反应的启动作用。中国生物医学工程学报,2013;29(3):344 - 344。
- 54.
水稻稻瘟病抗性性质的研究。九州小鬼大学,1941;9:277-307。
- 55.
张超,王磊,张伟,张峰。水稻叶表皮硅细胞中细胞壁的木质化和硅化先于硅沉积吗?植物学报,2013;
确认
作者要感谢Devrim Coskun博士对手稿的严格审查。
资金
该项目由加拿大自然科学与工程研究理事会(NSERC)、Québec -自然与技术基金会(FRQNT)和加拿大研究主席资助,这些基金全部或部分支持参与该项目和材料的学生和研究人员的工资。作者声明,这项研究是在没有任何商业或财务关系的情况下进行的,这些关系可能被解释为潜在的利益冲突。
数据和材料的可用性
在当前研究中生成和分析的数据集可在NCBI SRA存储库中获得,在生物项目PRJNA412201下。此外,在本研究中通过RNAseq数据分析获得的读计数包含在附加文件中。
作者信息
从属关系
贡献
AR进行样本采集、RNA提取RNA- seq实验和转录组学分析,参与数据解读并撰写稿件。CL参与RNA-Seq实验和转录组分析。HS参与RNA提取和生物信息学分析。RD和HS参与实验设计和样品采集。FB和JM参与了数据的解读和稿件的撰写。RRB构思了这项研究,参与了数据的解释和文章的撰写。所有作者均已阅读并批准最终稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
附加文件
附加文件1:
表S1。从大豆植株中获得的读取数摘要疫霉突变在未处理过硅(Si)的植物上进行接种实验。总读取数和读取数对齐到大豆和p .突变基因组以百万±SE表示。(docx14kb)
附加文件2:
表S2。大豆根中差异表达基因的归一化表达疫霉突变。总共有3294个基因差异表达p .突变接种后第4天感染(P+如果−).归一化平均值(n= 5)的差异表达转录本(Fold-change≥4,FDRp-value≤0.01)+)或否(P−),p .突变(Si)+)或否(Si−)与硅。(xlsb215kb)
附加文件3:
图S1。信号相关基因的表达谱.基因表达显示,高表达的受体激酶家族基因有46个(a), 24个RLK基因(b), 5个MAPKs基因(c), 33个cdpkks基因(d)疫霉突变在Si下以4 dpi接种大豆植株−与硅相比+治疗。图中显示了每个基因的最高表达水平为基础的每个时间点的平均相对(%)表达量,以显示表达动态的趋势。柱状表示均值的标准误差(n= 5)。(TIF 371kb)
附加文件4:
表S3。信号相关基因表达数据。归一化平均值(n= 5),折叠变化和FDRp分别在0、4、7、14 dpi用硅(Si)处理(Si+)或不处理(Si-)的大豆植株中,46个受体激酶家族基因(表1)、24个RLK基因(表2)、5个MAPKs基因(表3)和33个CDPKs基因(表4)的-值疫霉突变。(xlsx65kb)
附加文件5:
表S4。表达式数据NB-LRRs基因。归一化平均值(n= 5),折叠变化和FDRp- 45受体的值(NB-LRR在0、4、7、14 dpi分别用硅(Si)处理(Si+)和不处理(Si-)大豆植株的基因疫霉突变.(xlsx22 kb)
附加文件6:
表S5。表达式数据公关基因。归一化平均值(n= 5),折叠变化和FDRp- 11与致病相关的值(公关在0、4、7、14 dpi分别用硅(Si)处理(Si+)和不处理(Si-)大豆植株的基因疫霉突变.(xlsx12kb)
附加文件7:
图S2。WRKY转录因子基因表达谱。基因表达中,有20个WRKY基因表达较高疫霉突变在Si下以4 dpi接种大豆植株−与硅相比+治疗。图中显示了每个基因的最高表达水平为基础的每个时间点的平均相对(%)表达量,以显示表达动态的趋势。柱状表示均值的标准误差(n= 5)。(TIF 86 kb)
附加文件8:
表S6。表达式数据WRKY转录因子基因。归一化平均值(n= 5),折叠变化和FDRp-value为20WRKY在0、4、7和14 dpi分别用硅(Si)处理(Si+)和不处理(Si-)大豆植株的基因疫霉突变.(xlsx16kb)
附加文件9:
图S3。a)蛋白酶抑制剂和b)多酚氧化酶的表达谱。基因表达显示13个蛋白酶抑制剂基因(a)和5个多酚氧化酶基因(b)表达较高疫霉突变在Si下以4 dpi接种大豆植株−与硅相比+治疗。图中显示了每个基因的最高表达水平为基础的每个时间点的平均相对(%)表达量,以显示表达动态的趋势。柱状表示均值的标准误差(n= 5)。(TIF 163kb)
附加文件10:
表S7。表达式数据A)蛋白酶抑制剂基因b)多酚氧化酶基因。归一化平均值(n= 5),折叠变化和FDRp-value为13蛋白酶抑制剂基因(表1)和五个多酚氧化酶在0、4、7和14 dpi分别用硅(Si)处理(Si+)和不处理(Si-)的大豆植株的基因(图2)疫霉突变.(xlsx37 kb)
附加文件11:
图S4。次生代谢相关基因表达谱。在基因表达中,有31个参与类黄酮代谢的基因(a), 9个参与异黄酮代谢的基因(b)和15个参与类异戊二烯代谢的基因(c)表达较高疫霉突变在Si下以4 dpi接种大豆植株−-与硅相比+治疗。图中显示了每个基因的最高表达水平为基础的每个时间点的平均相对(%)表达量,以显示表达动态的趋势。柱状表示均值的标准误差(n= 5)。(TIF 261kb)
附加文件12:
表S8。次生代谢相关基因表达数据。归一化平均值(n= 5),折叠变化和FDRp在0、4、7和14 dpi分别用硅(Si)处理(Si+)和不用硅(Si-)处理的大豆植株中,31个涉及类黄酮代谢的基因(表1)、9个涉及异黄酮代谢的基因(表2)和15个涉及类异丙二烯代谢的基因(表3)的-值疫霉突变.(xlsx48kb)
附加文件13:
表S9。激素相关基因表达数据。归一化平均值(n= 5),折叠变化和FDRp在0、4、7和14 dpi分别用硅(Si)处理(Si+)和不处理(Si-)的大豆植株中,5个参与SA代谢的基因(表1)和13个参与JA代谢的基因(表2)的-值疫霉突变.(xlsx36kb)
附加文件14:
图S5。参与初级代谢的差异表达基因热图。热图显示了大豆根接种(P+)或否(P−-),p .突变(Si)+)或否(Si−-),而硅的基因在p .突变,受感染的植物。每个基因对应一条彩色线,表示归一化平均值(n= 5)的差异表达转录本(Fold-change≥4,FDRp-value≤0.01)。(TIF 205kb)
附加文件15:
表S10。从五种生物复制获得的读数摘要疫霉突变在无菌培养中。总读数和读数对齐p .突变基因组是以百万为单位的。(docx13kb)
附加文件16:
表S11。百强名单上调疫霉突变4、7、14 dpi与大豆植株亲和互作过程中的基因。(docx86 kb)
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
拉苏利扎德,A., Labbé, C.,索纳,H.。et al。硅可以保护大豆植物免受疫霉突变通过干扰效应受体的表达。BMC植物生物学18日,97(2018)。https://doi.org/10.1186/s12870-018-1312-7
收到了:
接受:
发表:
关键字
- 转录组
- 大豆
- 植物受体
- 效果器
- 防御基因