摘要
背景
BcGs1是一种细胞壁降解酶(CWDE)葡萄孢菌.我们以前的研究表明,BcGs1可能引发对各种病原体的防御反应和保护植物。我们研究了防御反应机制,番茄这种BcGs1启发底层。
结果
我们发现这两个区域对于BcGs1的完全坏死活性是必需的。通过对基于itraq的定量蛋白质组方法筛选的上调蛋白和基因进行实时定量PCR分析,推测氧化代谢和苯丙代谢参与了bcgs1诱导的番茄防御反应。BcGs1诱导活性氧(ROS)爆发,提高苯丙氨酸解氨酶(PAL)和过氧化物酶(POD)活性,增加木质素积累。此外,组织化学分析表明,与未处理植株相比,BcGs1在番茄叶片中的渗透表现出细胞壁增厚。
结论
提示BcGs1激活基础防御反应,其中木质素代谢参与BcGs1诱导的抗性葡萄孢属。灰质番茄感染。
背景
在复杂的自然环境中,植物与各种微生物病原体密切地相互作用。为了保护自己免受微生物的侵袭,植物进化出了多种防御机制,包括结构性和诱导抗性策略。大多数潜在的病原体是通过预先形成的物理和化学屏障或诱导一系列复杂的防御反应而被阻止的。为了启动植物的相关抗性系统,需要一个特定的受体来识别病原体,同时可能涉及植物细胞壁衍生分子[1].以下病原体识别,这是由病原体相关分子模式(PAMP),微生物相关分子模式(MAMP)-triggered免疫(PTI)或效应触发免疫(ETI)通过免疫识别系统识别[2,3.,4,蛋白激酶就会被激活,活性氧就会积累[5,6].作为连锁反应,包括防御相关基因和PR蛋白在内的下游信号将被激活[7,8].通过使用特定识别系统来防止渗透和限制病原体的生长,例如细胞死亡,氧化爆发,防御基因,PR蛋白表达,植物脂蛋素,胼舌素,荨麻植物和细胞壁厚度,植物依赖基底防御反应2].
为了克服植物细胞壁的屏障,植物疗法真菌分泌各种CWDE,如纤维素,果胶酶,半纤维素酶,CUTIN酶和蛋白酶。这些酶中的大多数不仅降低了细胞壁组分以获得病原体生长的碳源,但也可以引发多种植物防御反应。
在感染期间,坏死营养病原体首先杀死宿主细胞和/或以死亡组织为食。necrotrophic病原体葡萄孢菌通常分泌非宿主选择性毒素、cwde和蛋白酶,以促进宿主细胞死亡[9].虽然由生物营养和坏死营养病原体感染导致的植物细胞死亡在多种防御反应中发挥着核心作用,但它在植物对坏死营养物质和依赖于植物-病原互作的生物营养物质的反应中具有明显不同的作用。在植物免疫中,由坏死营养病原体引起的细胞死亡比生物营养病原体引起的细胞死亡更为复杂,因为坏死营养真菌具有更微妙的致病策略[10.].多种基础防御机制的差异被认为是宿主对坏死营养病原体敏感性差异的基础。虽然真菌的基因组是众所周知的葡萄孢菌生物学已被广泛研究[11.,12.,对植物响应的生物学过程的理解葡萄孢菌也是非常有限的。两个激发子从葡萄孢菌,即Botrycin和cinerein,导致坏死性病变的形成,在葡萄树中编码苯丙醇途径的酶的基因的快速转录激活,并且在葡萄树中映射不同的丝粉膜活化蛋白激酶(MAPK)(葡萄L) (13.].然而,大多数分泌诱导子的机制来自于葡萄孢菌触发植物防御反应的原因尚不清楚。
CWDEs刺激多种植物免疫反应和发挥病原体宿主植物的相互作用特殊的作用,但其作用机制是非常复杂的。触发防御反应有些CWDEs与它们的降解酶的活性有关,但也有一些不相关的酶的活性[14.].葡萄孢菌真菌木聚糖酶(Xyn11A)和多聚半乳糖醛酸酶(PGs)可诱导植物抗毒素、乙烯和致病相关蛋白的合成,并表现出免疫抵抗葡萄孢菌[14.,15.,16.,17.].目前的证据表明,这些真菌CWDE通过感知损伤相关分子模式(DAMPs)和通过CWDE降解产生的植物细胞壁碎片直接或间接触发典型的PTI [10.].PTI激活基础防御反应,如抗菌次级代谢产物(如植物抗毒素)的生物合成和防御相关蛋白的表达,包括致病相关蛋白(PR)、细胞壁木质素化、蛋白酶抑制剂表达和激素生物合成[18.,19.].最终,植物表现出对真菌,细菌和病毒的广谱抗性[16.].
葡萄孢菌,灰霉病是世界上最具破坏性的疾病之一,是一种典型的营养坏死性病原体,导致番茄、草莓、葡萄、黄瓜、大豆和向日葵发生灰霉病[20.].尽管遗传抵抗是有效和可持续的保护植物,但抗性育种措施尚未成功达到僵尸疾病。Elictors可以改善植物对病原体的抗性,并且是减少植物病的替代策略[21.].了解坏死营养病原体和寄主植物的相互作用将为诱导子的应用提供一个思路。然而,包括BcGs1在内的许多单一纯化蛋白诱导子引发的植物基础防御反应尚不清楚。在本研究中,我们首先用iTRAQ方法描述了差异显示防御蛋白。基于整体差异蛋白,推测苯丙素代谢参与了bcgs1诱导的番茄防御反应葡萄孢菌.以往的研究表明苯丙烷代谢棉花诱导抗性中发挥了重要作用,V. Dahlia.[22.].同时,在后期实验中验证了bcgs1诱导的植株在蛋白表达、木质素代谢水平、细胞壁增厚等方面与对照植株存在明显差异。本研究将有助于了解坏死性真菌病原体与寄主植物之间的相互作用,并为通过诱导子激活植物免疫来防治灰霉病提供理论依据。
方法
真菌病原培养和植物培养
葡萄孢菌菌株BC-98原自北京地区番茄病害组织。在马铃薯葡萄糖琼脂(PDA)培养基上培养,在Czapek-Dox液体培养基上旋转摇瓶25°C培养。番茄幼苗(中杂9号,购于中国农业科学院蔬菜花卉研究所)在24-28℃、相对湿度70-80%、暗光比10/14 h的温室中栽培。
BcGs1的坏死活性
BcGs1蛋白通过Zhang等人描述的方法获得[23.].以Tris-HCl缓冲液(50 mM)作为对照,用1 μM BcGs1注射器注射番茄、烟草、黄瓜和豌豆叶片12 h后观察其诱导坏死活性。
bcgs1诱导番茄抗病的生物测定
六至八个番茄植物的叶子用250nM的BcGs1蛋白质溶液(10μL)和Tris-HCl缓冲液(50mM)注射。相同的生长叶子用酒精消毒,然后用蒸馏水在48,72,96,120和168小时后BcGs1喷射分别漂洗。两个叶片放置在皮氏培养皿用湿滤纸和叶柄是保湿用湿脱脂棉。葡萄孢菌将培养皿置于叶片上,在连续光照、100%湿度、25℃的室内培养48 h,用游标卡尺测量病变直径。诱导抗病性计算公式为:减病率(%)=[(对照叶损伤面积-诱导子处理叶损伤面积)/对照叶损伤面积]× 100,用统计分析软件对结果进行分析。每个处理和对照各用15株番茄,每株取3片叶片。重复了三次。
BcGs1功能域的识别
生物学信息分析表明,BcGs1包含两个结构域Glyco-hydro 15 (GH15)和CBM20_glucoamylase (CBM20)。为了鉴定其活性结构,我们用含有荧光蛋白的瞬时表达载体pYBA1152表达BcGs1、GH15和CBM20蛋白,该载体可以融合蛋白的my蛋白/结构域尼古利亚娜·宾夕法尼亚州通过农杆菌介导的方法。采用荧光共聚焦显微镜和western blot检测重组蛋白在注射后48 h的表达农杆菌属.同时,用肉眼观察到坏死活性。
Western印迹
样品叶尼古利亚娜·宾夕法尼亚州在注射农杆菌属分别构建携带his标签的BcGs1、GH15和CBM20基因序列。分别用植物总蛋白提取试剂(购自生物技术公司)从样品中提取树蛋白。总蛋白经浓度测定和煮沸后,经三道SDS-PAGE检测。SDS-PAGE后用PEVD膜载蛋白胶,用电转移仪1 h将蛋白转移到PEVD膜上。用TBST缓冲液冲洗PEVD膜后,用封闭液再孵育2小时。加入Anti-His Tag Mouse Monoclonal Antibody并与his Tag结合,孵育2小时,然后将HRP标记的Anti-His Tag Mouse Monoclonal Antibody与Anti-His Tag Mouse Monoclonal Antibody结合1小时。BCIP/NBT在PEVD膜上混合均匀以获得颜色。最后,将薄膜放入仪器中进行曝光和拍照。
差异显示蛋白分析
6 ~ 8株番茄叶片注射1 μM BcGs1蛋白溶液(10 μL),以Tris-HCl缓冲液(50 mM)作为对照。处理24 h后采集番茄叶片,用iTRAQ进行蛋白质组学检测(邦飞生物技术,北京,中国)。每个样本重复三次。蛋白质比> 1.3或< 0.77和P-value < 0.05视为差异表达。应用基因本体论(GO)分析方法对蛋白质功能进行预测,并计算功能类别分布频率。进行KEGG分析,分析功能蛋白注释。
定量实时PCR
番茄叶子用BcGs1和Tris-HCl缓冲液注射。总RNA提取在0,6,12,24,48,72,96小时根据植物RNA试剂盒(天根生化科技,北京,中国)的协议后处理。首先链cDNA使用超混合液用于qPCR(TransGen生物技术,北京,中国)的总RNA合成。该应用Biosystems7500实时PCR系统,以利用SYBR Green超进行放大。引物(表1)由Beacon Designer 8.1设计。以肌动蛋白作为内参,对每个反应中的cDNA进行归一化。所有qPCR重复3次,计算平均值进行定量。分析每个反应的熔体曲线,并对每个反应进行无cDNA模板的阴性对照,以评价引物的特异性。通过ΔΔCt法计算基因表达量的平均值。
H2O2番茄叶中的积累和形成
H2O2用1 μM BcGs1或Tris-HCl缓冲液处理6 - 8个番茄叶片,分别在2,4,6 h进行产量测定。将叶片置于添加0.01% Triton-X-100和1 mg/mL硝基3,3 ' -二氨基联苯胺(DAB)的水中;然后将溶液在低真空压力下浸泡5 min,在室温下培养过夜。然后,在室温下用酒精乳酚(95%乙醇:乳酸:苯酚,2:1:1)清除叶子,直到叶子不含叶绿素,然后用水冲洗。H2O2可以由通过聚合与DAB形成的棕红色沉淀来可视化。
H2O2使用H在叶子中检测到内容2O2在0、2、4、6、12和24 h处理后检测试剂盒(建城生物技术,中国南京)。150mg样品用研磨机研磨,并在提取缓冲液(0.05 mM磷酸盐缓冲液,pH 7.2)中均质。收集上清液进行H2O24℃10000 g离心10min后检测。试剂盒提供的试剂按照制造商的说明与初始溶液一起孵育。H2O2在405 nm波长下检测含量。每个实验重复三次。
酶活性测定
The leaves treated with 1 μM BcGs1 and Tris-HCl buffer (as a control) were collected at 0, 12, 24, 48, 72, and 96 h, frozen in liquid nitrogen immediately and then stored at − 80 °C. One hundred to two hundred mg leaf samples were ground and homogenized in extraction buffer (1.0 mM Phosphate buffer, pH 7.4). The supernatant was collected for defense enzyme determination following the extraction kit. PAL activity was detected using a PAL Extraction Kit (Jiancheng Biotechnology, Nanjing, China) following the kit’s protocol. The supernatant applied to detect POD activity was collected at 3500 g for 10 min. POD activity was detected at 420 nm after mixture incubation.
木质素番茄叶片含量检测
巯基乙酸(TGA)法,先前描述的方法与修改[24.,用于评价3个生物复制木质素含量。以1 μM BcGs1或Tris-HCl缓冲液处理番茄叶片,分别于BcGs1处理后12、24、48、72、96、120和144 h收集番茄叶片。样品均质,用20 ml磷酸盐缓冲液(pH 7.8)洗涤,5000 g离心10 min,重复三次。将颗粒在80℃下干燥24 h,称取1 ~ 2毫克残渣,与1.5 ml 2hcl和0.3 ml TGA混合,混合好后在95℃下孵育4 h。将混合物用冰迅速冷却,10000 g离心10分钟。用1ml蒸馏水洗涤3次。用1ml 0.5 N NaOH重新悬浮小球,在室温下200 rpm摇晃18 h, 15000 g离心10 min。然后将悬浮液转移到新的管中,用0.5 ml 0.5 N NaOH再次洗涤小球。离心后将两种上清混合,与0.3 ml浓盐酸混合。混合物在4°C下孵育4 h,沉淀木质素硫代乙醇酸衍生物。离心后用1ml 0.5 N NaOH溶解。在280 nm处测量所得溶液的吸光度。
细胞壁形态的改变
采用上述方法对6 - 8株叶番茄植株的叶片样品进行了包埋,并进行了一些修改[25.].在诱导后3 d和5 d分别摘取bcgs1诱导的坏死点周围的部分叶片。三盐酸缓冲液作为对照。然后样品在室温下固定在1.0 ml含2%戊二醛的磷酸盐缓冲液(pH 7.2)中48 h,并在分级的一系列乙醇水溶液(30、50、70、80、90、95和100%乙醇)中脱水15分钟。切片在室温下干燥过夜,安装在铝根上,并在真空下溅射金钯合金2分钟。最后,使用透射电子显微镜(Hitachi H-7500)观察切片。
统计分析
本研究提供的所有数据均来自至少三个独立的重复。采用SAS 8.1软件进行方差分析,确定处理与对照之间的显著差异。使用Tukey的HSD测试对这些平均值进行了比较。
结果
BcGs1引起坏死活性和抗阻葡萄孢菌茄
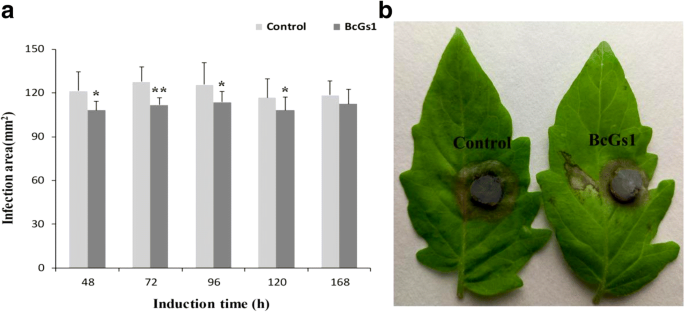
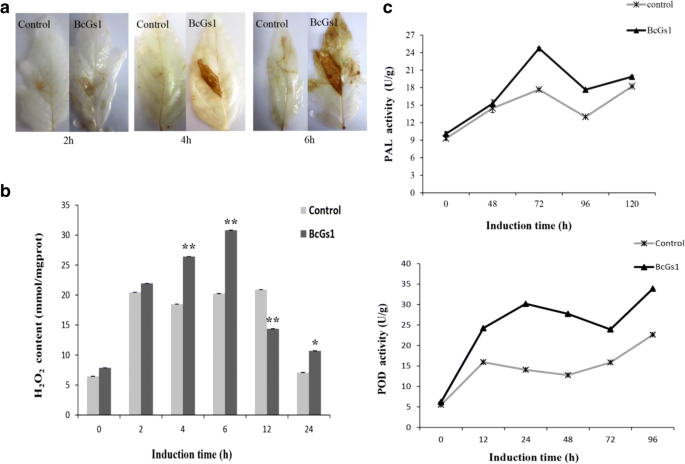
为了研究不同寄主植物的坏死活性,我们首先通过发酵获得了BcGs1蛋白葡萄孢菌根据Zhang等人的方法[23.].纯化的BcGs1相对表观分子量为72 kDa,在SDS-PAGE中显示为单条带(附加文件)1:图S1A)。BcGs1可诱导番茄、烟草、黄瓜和豌豆叶片在BcGs1渗透12 h后的坏死活性1:图S1B),表明BcGs1具有在宿主植物快速坏死活性。为了分析适当的诱导时间为疾病抵抗葡萄孢菌用0.25 μM BcGs1溶液在番茄中心静脉两侧浸渍,以Tris-HCl缓冲液作为对照。葡萄孢菌盘物在BcGs1诱导后48,72,96,120和168ħ接种在离体叶片。在不同的诱导时间的病变区域进行使用交叉方法测量。番茄叶片BcGs1处理显示,引起病变面积显著减少葡萄孢菌与Tris-HCl缓冲液相比。72 h病变面积最小,较对照组减少23.3%。结果表明,72 h是诱导BcGs1的最佳时间(图2)。1a,b).因此,我们的研究表明,BcGs1诱导了显著的抗性葡萄孢菌在番茄中具有明显的坏死活性。
BCGS1全坏死活性需要两个甘油 - Hydro 15(GH15)和CBM20_GLUCOMYLA酶(CBM20)的结构域
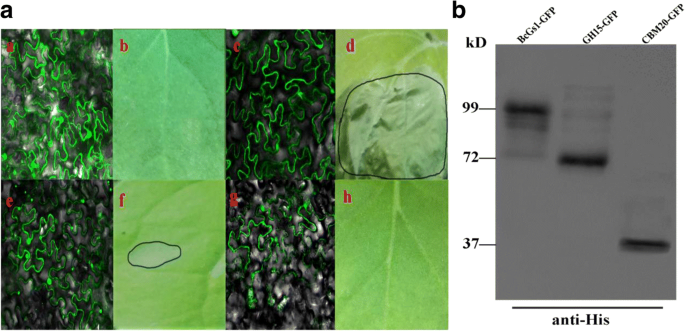
BcGs1包含一个Glyco-hydro 15 (GH15)结构域和一个CBM20_glucoamylase (CBM20)结构域。为了识别坏死活性的功能域,BcGs1、截断的GH15和CBM20在细胞中瞬时表达尼古利亚娜·宾夕法尼亚州通过农杆菌介导的瞬时表达系统。共聚焦荧光显微镜下可见明显荧光,western blot显示BcGs1、截断的GH15和CBM20表达于尼古利亚娜·宾夕法尼亚州树叶。BCGS1的瞬时表达可以诱导强烈的坏死,而GH15诱导淡淡的坏死反应,CBM20没有坏死的反应(图。2).结果表明,这两个区域是BcGs1完全坏死活性所必需的。
iTRAQ的差异表达蛋白分析
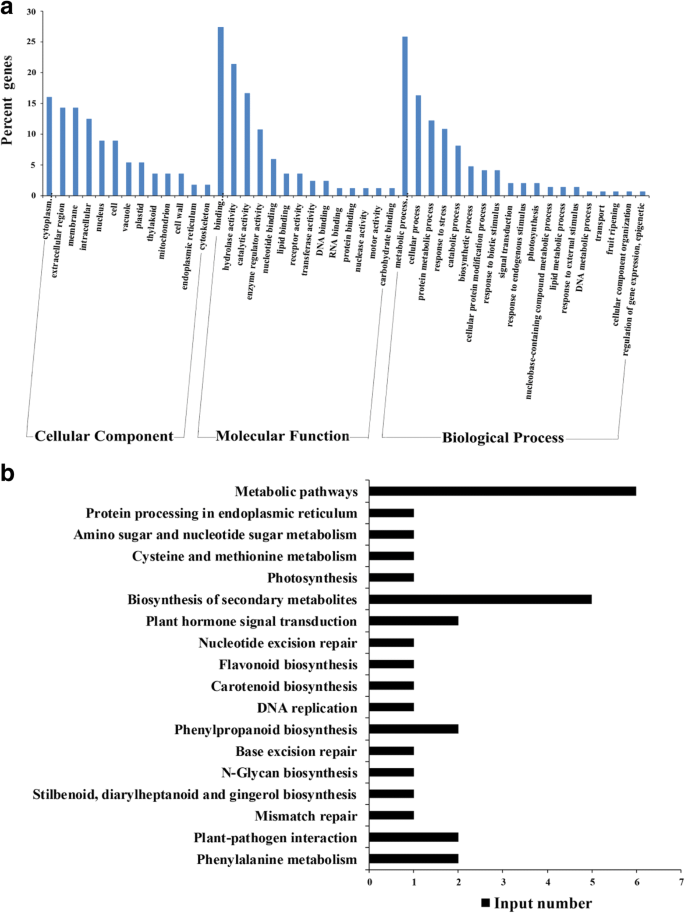
为了研究bcgs1诱导的番茄防御反应机制,利用iTRAQ技术进行了差异蛋白质组学研究。共积累了109个蛋白质。其中71个上调蛋白> 1.3(P< 0.05)和38个下调蛋白,其变化倍数< 0.77(P < 0.05) were identified, while there were 66 function-known proteins (Table2).基于GO的分类采用InterPro和GO注释的Protein accession进行。氧化石墨烯功能分析表明,富集蛋白参与了结合、水解酶活性和催化活性等分子功能,参与了生物代谢过程、细胞蛋白修饰过程、转运、基因表达调控、应激和刺激反应、生物合成过程、分解代谢过程等生物学过程。信号转导等(图。3).KEGG途径分析显示,这些差异蛋白富集于代谢途径、次生代谢产物的生物合成、苯丙氨酸的生物合成、苯丙氨酸的代谢、植物与病原菌的相互作用和植物激素信号转导(图1)。3 b).
差异展示蛋白基因表达谱的QRT-PCR分析
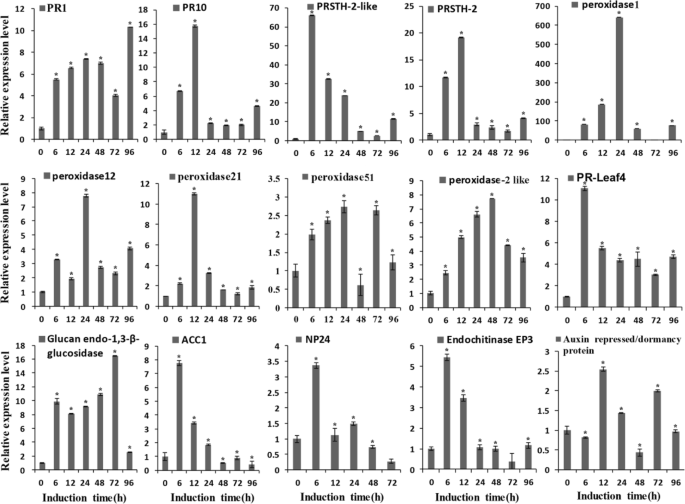
基于bcgs1诱导的差异蛋白组学分析,筛选致病相关蛋白、过氧化物酶、几丁质、苯丙类生物合成相关蛋白、次生代谢相关蛋白的生物合成,并采用qPCR进行生物学独立实验定量验证。15个基因的相对表达量如图所示。4.PR1基因和PR10上调5-8-fold在6 - 12 h。PRSTH-2-like蛋白上调6 h, 60 ~ 70倍,PRSTH-2上调~ 20倍在氧化物酶12 h。我们测试有一个老年病4-10-fold 6 - 48 h,尤其是peroxidase1 (K4D1W6),这是上调600倍在24 h。3-β-葡聚糖酶和几丁质酶在6 h时分别上调10倍和5倍。生长素抑制基因上调2.5倍。抗真菌蛋白NP24在6 h时上调3.5倍,乙烯合成相关蛋白ACC1在6 h时上调8倍。这些结果表明,大多数编码防御反应蛋白的基因都上调了,这与蛋白质组学数据一致。这些蛋白和基因的上调表明BcGs1激活了番茄的基础防御反应,并诱导了苯丙烷代谢途径。
BCGS1激活苯丙基丙基代谢物途径
活性氧的产生是病原菌攻击后信号转导级联和介导植物防御反应的重要组成部分[26.].我们发现H2O2用DAB染色法在接种部位积累。在BcGs1渗透后2、4和6 h,番茄叶片中均有褐色沉淀形成。5).定量分析显示h2O2bcgs1诱导的番茄叶片在处理后2、4、6、12和24 h的积累量显著高于对照,在6 h达到最大值,增加了1.5倍。5 b).根据这些数据,我们认为BcGs1促进了番茄细胞内H2O2,提高了细胞外过氧化物酶的活性,并进一步产生单酚苯氧自由基自发耦合形成木质素聚合物。
苯丙酸代谢途径是植物基础防御的重要指标。PAL和POD酶的活性参与了苯丙醛合成木质素的途径。因此,BcGs1浸润后测定PAL和POD(图。5度).结果表明,与未处理相比,PAL和POD活性分别提高了1.5倍和2倍。结果表明,番茄中可能激活了苯丙素通路,并发挥了防御作用。
BCGS1增强了木质素的二次合成,并加强了细胞壁
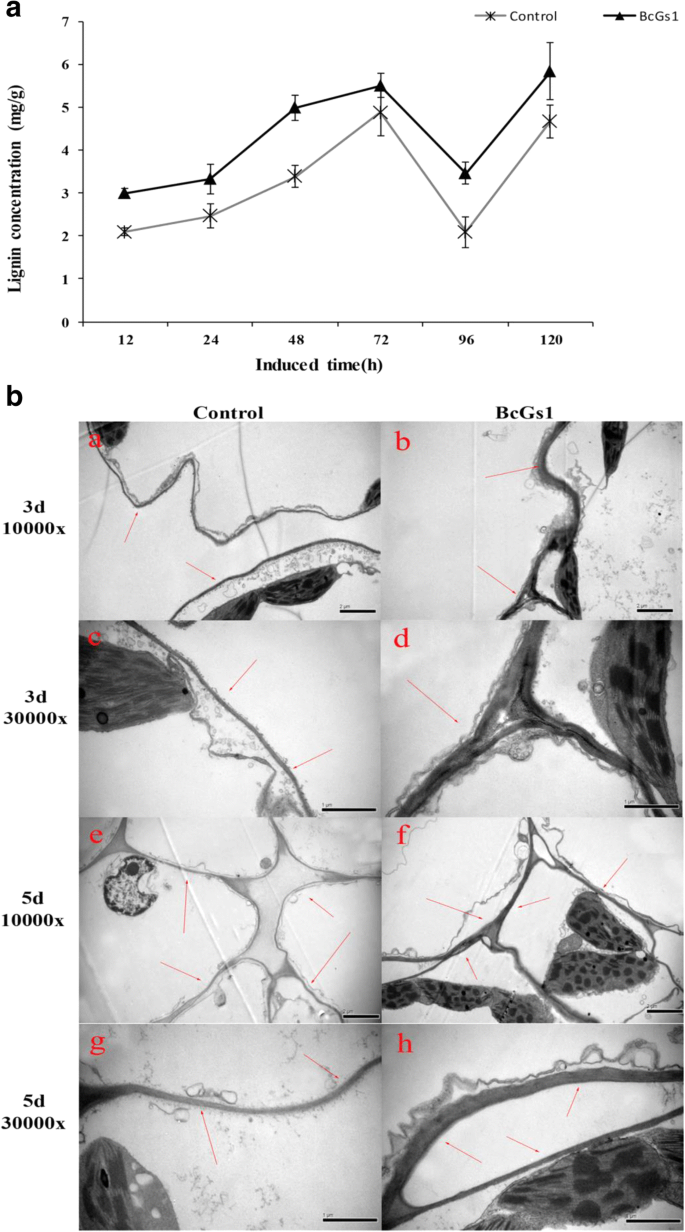
木质素在植物应对病原体感染发挥了关键作用。合成和木质素沉积被假定为是真菌穿透过程中所作的细胞壁以机械压力更耐物理屏障[25.,27.].在诱导子处理48小时后,BcGs1诱导子处理的植物木质素沉积比对照增加了1.5倍(图)。6).
细胞壁强化在植物抗病中起着重要作用[25.].我们的研究结果表明,在BcGs1处理的叶子的细胞壁与3天至5天的图的Tris-HCl控制(相比明显增厚。6 b).高水平的木质素和细胞壁厚度可以增强细胞壁的韧性和机械强度,保护分化的细胞,降低细胞间隙,导致对病原体感染的抗性[22.,27.].
讨论
成功的病原体感染必须打破植物的物理屏障和化学防御。无论是生物营养型还是坏死营养型病原体,植物细胞壁都是抵御病原体攻击的重要屏障。为了克服植物的防御,病原菌会分泌各种类型的CWDEs来降解植物细胞壁。CWDEs在广泛的病原体中是保守的,被认为是引发PTI的PAMPs或DAMPs。BcGs1,分泌自葡萄孢菌,可诱导防御反应,提高抗病能力葡萄孢菌在番茄23.].然而,机制尚不清楚。为研究BcGs1处理植物与对照植物防御反应的差异,采用蛋白质组学方法对差异蛋白进行分析。46个蛋白表达上调,20个蛋白表达下调。通过Go分析和KEGG分析富集了PR蛋白、几丁质酶、过氧化物酶、1,3 -β-葡聚糖酶和次级代谢相关蛋白。
致病相关蛋白(PR)已被用作植物防御反应的生物标志物[28.],并已在植物中[被辨别为系统获得性抗性(SAR)实体29.].基于PRs的功能特性和结构,我们对17个不同的PR蛋白家族进行了表征,这些PR家族具有从使细胞壁更加坚硬到信号转导和抗菌活性等广泛的功能[30.].在我们目前的研究中,16种PR蛋白,包括PR1,PR5,PRP2,PR10,PRSTH-2 / PRSTH-2样蛋白,几丁质酶和葡聚糖1,3-β葡糖苷酶,均显著在番茄叶BcGs1处理诱导的。PR1蛋白在番茄和烟草抗真菌活性,但其机制仍不清楚[31.].PR5蛋白质包括硫霉素,卵黄素和相关蛋白质,其中许多也具有抗微生物活性[32.].该PRP2蛋白,富含脯氨酸的蛋白家族中的一员,是一个结构性细胞壁的蛋白质和响应真菌病原体攻击和积累大孢霉激发子[33.,34.].H2O2介导PRP2蛋白进入细胞壁结构的氧化交联。此外,PRP2蛋白还调节细胞壁特性,参与发育和防御[35.].prth -2属于PR-10家族,受真菌诱导子、植物激素和防御相关信号分子的调控[30.,36.].几丁质酶在病原菌感染早期释放,当菌丝穿过细胞间隙时,几丁质酶水解真菌细胞壁,抑制其生长[37.].葡聚糖1,3 -β-葡萄糖苷酶属于PR-2蛋白家族,具有水解β- 1,3 -葡聚糖的功能,β- 1,3 -葡聚糖是真菌细胞壁的主要结构化合物[38.].PR蛋白信息表达量的增加表明BcGs1诱导番茄的基础防御,包括细胞壁增强、抗菌植物抗毒素和植物激素的生物合成。
过氧化物酶分为两类:I类和III类;I类是细胞内的,而III类分泌到细胞壁或周围介质[39.].第III类包括分泌型植物过氧化物酶,具有多种组织特异性功能,如从叶绿体和细胞质中去除过氧化氢、细胞壁生物合成和伤人防御反应[40].在我们的实验中,我们检测到了8种不同的过氧化物酶,包括过氧化物酶(K4D6T3)、过氧化物酶1、过氧化物酶12、过氧化物酶21、过氧化物酶cevi16、过氧化物酶2 like、过氧化物酶7和过氧化物酶51,它们都属于III类。过氧化物酶可防止H2O2,去除H.2O2调和很多H2O2相关的防御反应[26.].过氧化物酶也参与酚代谢和从肉桂醇和其他聚合物木质素的生物合成[41,42,43].在转基因番茄植株中过表达一种碱性过氧化物酶的木质素含量高于野生型植株[44,45].个人拟南芥过氧化物酶(AtPrx)基因家族也参与各种组织类型的细胞生长和木质素化,包括茎、叶和根[46,47,48,49].过氧化物酶的防御作用可能伴随着其他防御酶的激活,如β- 1,3 -葡聚糖酶和几丁质酶[39.].虽然过氧化物酶的功能尚不明确,但过氧化物酶在ROS解毒和木质素化以及这两个过程的有效耦合中的作用已被承认[44].因此,我们的结果表明,在BcGs1胁迫下,过氧化物酶的积累通过木质素化降低了细胞壁的可塑性。
活性氧的产生是植物与病原菌相互作用中对病原菌入侵最早的防御反应之一[50,51].H2O2病原侵染部位的积累已被证明对番茄与病原相互作用的结果起决定性作用[52].它可以直接破坏病原体,引发细胞超敏死亡,激活防御反应相关基因,或作为植物细胞系统信号网络的二级信使[50,53,54,55].此外,H2O2也被发现是确定番茄对枝孢属fulvum、炭疽病菌及白粉病菌[56,57,58].H2O2过氧化物酶在表皮细胞层的积累伴随着细胞外过氧化物酶活性的增加,过氧化物酶介导了许多H2O2- 相关防御应答和引起细胞壁修饰[26.].H2O2BcGs1处理番茄叶片中木质素含量在24 h时增加了1.5倍,在6 h时增加了1.5倍。这些结果表明,BcGs1激活H2O2相关的防御反应,导致木质素积累。
次生代谢产物相关蛋白质的生物合成
次生代谢物在植物对抗病原体感染的斗争中起着基本作用。基于生物合成底物和途径,苯丙烷丙醇,含氮物质和三萜途径分类[59].萜类和醌类化合物可增强植物的抗病能力。苯丙素途径的多个分支已经被报道在多种模式植物中,包括番茄、水稻、拟南芥和豆科植物[60,61,62].许多苯基丙醇表现出广谱抗菌活性并帮助植物进行抗击微生物疾病。在我们的研究中,关键蛋白质4-香豆素-CoA连接酶2(4Cl)和钴酰基CoA O-甲基转移酶1(CCOamT1)在鉴定苯基丙醇硅酮途径的分支中合成G-lignin单体。以前的结果发现CCOAMT下调规则紫花苜蓿导致的G木质素单元[还原63].BcGs1渗透后两种必需蛋白和编码基因显著上调,说明BcGs1激活了番茄中的苯丙素通路。
木质素形成与细胞壁组织化学定位
木质素是植物次生细胞壁的主要成分,是抵御入侵病原体渗透的重要组成部分[64,65,66].木质素能提高机械强度,改变细胞壁的压缩性和孔隙度,形成抵抗病原体感染的屏障[64,67,68,69].在本研究中,分析了BCGS1-处理和Tris-HCl缓冲处理叶之间的木质素含量的差异,结果表明,与对照相比,BCGS1处理叶中的木质素含量显示出1.5倍的增加,表明它可能会限制葡萄孢菌在番茄中传播。此外,在番茄叶中诱导BCGS1之后检测到该途径中涉及的关键酶,例如PAL,POD,4CL和CCOAMT1。与对照相比,通过PAL,POD 4CL和CCOAMT1基因的转录上调表达证实了这些观察结果。此外,组织化学定位表明,与对照相比,BCGS1处理叶片的细胞壁显着增厚。细胞壁增厚增强了机械强度和改善的疾病抵抗力葡萄孢菌感染。
结论
BCGS1可以显着激活抗病抗性葡萄孢菌在诱导后72小时。BCGS1全坏死活动需要两个域。使用蛋白质组学方法在番茄植物中鉴定差异表达蛋白。Pr蛋白,过氧化物酶,葡聚糖肠胃1,3-β-葡糖苷酶,几丁酶,乙烯合成相关蛋白和二次代谢物的生物合成,参与了BCGS1诱导的抗性。BCGS1渗透番茄植物表现出H.2O2关键酶PAL和POD的调控水平升高,苯丙酸途径木质素终产物的积累,细胞壁增厚。根据BcGs1诱导的PR差异表达蛋白、过氧化物酶和次生代谢产物的生物合成,探讨了BcGs1诱导抗病的机制葡萄孢菌总结如下。BcGs1诱导H2O2生产,这不仅增加了过氧化物酶活性的同时也引起细胞壁加强和木质素积累。同时,许多与国防有关的蛋白质的表达上调,包括永久居民,葡聚糖内切1,3-β糖苷酶和几丁质酶。通过结合生物化学和组织化学的数据,我们建议的苯丙素途径相关的基因和蛋白质,酶的活性,木质素高级别和细胞壁厚度的那BcGs1触发上调,并最终生成番茄的抗病性。总体而言,木质素代谢中发挥了关键作用,并参与了番茄BcGs1引起的防御反应。
缩写
- 4 cl:
-
4-coumarate-CoA连接酶2
- CCoAMT1:
-
Caffeoyl-CoA O-methyltransferase 1
- CWDE:
-
细胞wall-degrading酶
- 轻拍:
-
硝基3,3 ' -diaminobenzidine
- 朋友:
-
phenylalanine-ammonia裂合酶
- PAMP:
-
病原体相关的分子模式
- 圆荚体:
-
过氧化物酶
- 公关:
-
pathogenesis-related蛋白质
- PTI:
-
微生物相关的分子模式(MAMP) - 触发的免疫力
- ROS:
-
活性氧
- TGA:
-
硫代醇酸
参考
- 1。
eder j,cosio,例如。植物防御反应的elictors。INT转速cytol。1994年; 148:1-36。
- 2。
Jones JD, Dangl JL。植物的免疫系统。大自然。2006;444(7117):323。
- 3.
Pieterse CM,夏勒A,锚赫 - 摩尼B,Conrath U.信号在植物抗性反应:发散和防御途径的串扰。在:多基因并诱导植物系统抗性。波士顿:斯普林格;2006年,166-96。
- 4.
pamp引发免疫的早期分子事件。植物生态学报。2009;12(4):414-20。
- 5.
Blumwald E,阿哈GS,林BC。早期的信号转导途径在植物病原体相互作用。趋势植物科学。1998; 3(9):342-6。
- 6.
植物免疫反应中的信号传递。植物科学进展。2001;6(8):372-9。
- 7.
陈志强,陈志强,陈志强,等。植物抗微生物蛋白的研究进展。[j] .免疫学杂志,1998;10(1):16-22。
- 8.
植物中的病原体防御——生物复杂性的一个范例。植物科学进展,1998;3(3):86-90。
- 9.
Williamson B, Tudzynski B, Tudzynski P, van Kan JA。灰霉病:引起灰霉病的原因。植物学报。2007;8(5):561-80。
- 10.
Mengiste T.植物免疫到坏死性。Annu Rev phytopathol。2012; 50:267-94。
- 11.
葡萄孢菌属及其在农业系统中引起的疾病——导论。葡萄孢病:生物学,病理学和对照。多德雷赫特:施普林格;2007:1-8。
- 12.
范菅直人农协。许可致死:一种坏死营养植物病原体的生活方式。植物科学进展,2006;11(5):247-53。
- 13。
雷普卡五早期防御反应诱导从葡萄叶和细胞悬浮液的Botrytis cinerea得出两个截然不同的诱发剂。生物学植物。2006; 50(1):94-106。
- 14.
Poinssot B, Vandelle E, Bentéjac M, Adrian M, Levis C, Brygoo Y, Garin J, Sicilia F, Coutos-Thévenot P, Pugin A.番茄灰霉病菌(Botrytis cinerea)的内多聚半乳糖醛酸酶1激活与酶活性无关的葡萄防御反应。植物与微生物学报。2003;16(6):553-64。
- 15.
Brutus A, Sicilia F, Macone A, Cervone F, De Lorenzo G.一种结构域交换方法揭示了植物壁相关激酶1 (WAK1)作为寡半乳糖醛酸酯受体的作用。中国科学院院刊。2010;107(20):9452-7。
- 16.
拟南芥诱导子对番茄灰霉病的抗性与水杨酸、乙烯或茉莉酸信号无关,但需要植物抗毒素缺陷3。植物杂志。2007;144(1):367 - 79。
- 17.
灰葡萄孢木聚糖酶Xyn11A的毒力与坏死活性有关,而与催化活性无关。植物学报。2010;10(1):38。
- 18.
关键词:拟南芥,OGs, Flg22诱导子,防御反应途径,拟南芥摩尔。2008;1(3):423 - 45。
- 19.
拟南芥低半乳糖醛酸酯诱导的atrbohd介导的氧化爆发对于激活对番茄灰霉病的防御反应是必不可少的。植物杂志。2008;148(3):1695 - 706。
- 20。
陈志强,陈志强,陈志强,等。番茄灰霉病诱导抗性机制的研究。出版:Prusky D, Gullino ML,编辑。采后病理变化。荷兰多德雷赫特:施普林格;2010.13-30页。
- 21.
Khan Nu,Liu M,Yang X,邱D.真菌Elicitor Mohrip2诱导稻叶中的抗病性,引发应力相关的途径。Plos一个。2016; 11(6):E0158112。
- 22.
基于RNA-Seq-dependent转录分析和组织化学研究表明,木质素代谢在棉花对黄萎病菌(Verticillium dahliae)的抗性中起核心作用。中国生物医学工程学报。2011;62(15):5607-21。
- 23。
关键词:番茄灰霉病,BcGs1蛋白,防御反应,抗病性生物化学学报。2015;457(4):627-34。
- 24。
厄德A,波兰特B,Sibout R,待办事项C-T,Seguin的A,拉皮埃尔C,Jouanin L.证据AtCAD 1的伸长的木质化作用茎拟南芥。Planta。2006; 225(1):23-39。
- 25。
卜波,邱丹,曾华,郭磊,袁军,杨晓霞。一种真菌蛋白诱导子PevD1对棉花抗黄萎病的作用。植物学报2014;33(3):461-70。
- 26。
Asselbergh B, Curvers K, França SC, Audenaert K, Vuylsteke M, Van Breusegem F, Höfte M.对番茄灰霉病抗性sitiens,一个脱落酸缺乏的番茄突变体,涉及到表皮中及时产生过氧化氢和细胞壁修饰。植物杂志。2007;144(4):1863 - 77。
- 27.
斯密特·F,杜贝里IA。棉花下胚轴对黄萎病诱导子的细胞壁强化反应。植物化学,1997;44(5):811 - 5。
- 28.
Mitsuhara I, Iwai T, Seo S, Yanagawa Y, Kawahigasi H, Hirose S, Ohkawa Y, Ohashi Y. 12个水稻PR1家族基因对病原菌感染、伤害和防御相关信号化合物响应的特性表达(121/180)。基因组学杂志。2008;279(4):415-27。
- 29.
Prins TW, Tudzynski P, von Tiedemann A, Tudzynski B, Ten Have A, Hansen ME, Tenberge K, van KanJA。灰葡萄孢及相关坏死营养病原体的感染策略。真菌病理学。荷兰:施普林格;2000:33 - 64。
- 30.
刘俊-J,Ekramoddoullah AK。它们的结构,监管和功能响应生物和非生物胁迫:植物病程相关蛋白家族10。physiol mol植物疗法。2006; 68(1):3-13。
- 31。
刘志强,刘志强,刘志强。六倍体小麦(Triticum aestivum L.)致病相关蛋白1 (PR-1)基因家族的分子特征及基因组定位。中国生物医学工程学报。2011;28(6):491 - 497。
- 32。
PR5基因家族的系统发育和结构关系揭示了一个古老的多基因家族保存在植物和选择动物类群中。中国科学(d辑:地球科学)(英文版)。
- 33.
布拉德利DJ,Kjellbom P,羔羊CJ。激发剂和伤口诱导的富含脯氨酸的植物细胞壁蛋白的氧化交联:一种新型的,快速的防御反应。细胞。1992; 70(1):21-30。
- 34.
陈志强,陈志强,陈志强,等。双生病毒侵染和粉虱侵染对番茄致病相关蛋白积累的影响。昆虫生物化学学报。2002;49(4):203-14。
- 35。
结构细胞壁蛋白。植物杂志。1993;101(4):1127。
- 36。
致病相关蛋白的家族、活性及PR-1型蛋白的比较分析。植物病理学杂志。1999;55(2):85-97。
- 37。
Kasprzewska A.植物几丁质酶,调节和功能。细胞分子生物学快报。2003; 8(3):809-24。
- 38。
flerl S, Majcherczyk A, Possienke M, Feussner K, Tappe H, Gatz C, Feussner I, Kües U, Polle A.拟南芥黄萎病菌侵染对叶片质外体蛋白组、代谢组和细胞壁特性的影响。《公共科学图书馆•综合》。2012;7 (2):e31435。
- 39.
植物过氧化物酶是如何修饰细胞壁的。植物科学进展。2004;9(11):534-40。
- 40.
平贺S,佐佐木K,伊藤H,大桥Y,松井H.一个大家族III类植物过氧化物酶。植物细胞生理。2001; 42(5):462-8。
- 41.
Barceló AR.植物细胞壁木质素化。Int Rev Cytol. 1997; 176:87-132。
- 42.
Blee Ka,Choi JW,O'Connell AP,Schuch W,Lewis Ng,Bolwell GP。烟草中的一种木质素特异性过氧化物酶,其反义抑制导致血管组织改性。植物化学。2003; 64(1):163-76。
- 43。
李Y,朱音S,川井S,片山Y,Morohoshi N.在转基因白杨的阴离子过氧化物酶的下调及其对木质素特性的影响。j植物res。2003; 116(3):175-82。
- 44。
陈志强,王志强,王志强,等。辣椒幼苗对铜胁迫的响应及其与木质素化的关系[J]。植物科学。2001;161(1):179 - 88。
- 45.
El Mansouri I, Mercado JA, Santiago-Dómenech N, Pliego-Alfaro F, Valpuesta V, Quesada MA。过表达碱性过氧化物酶转基因番茄植株的生化和表型特征。杂志。1999;(4)106:355 - 62。
- 46.
陈志强,陈志强。拟南芥中苯基丙酸途径的研究进展。《拟南芥丛书》2011;9(e0152):e0152。
- 47。
拟南芥III类过氧化物酶大基因家族的分析与表达。基因。2002;288(1):129 - 38。
- 48。
Valerio P, Pereira MM, Goes AM, Leite MF。生物活性玻璃溶解离子产物对成骨细胞增殖和胶原蛋白生成的影响。生物材料。2004;25(15):2941 - 8。
- 49。
Welinder KG, Justesen AF, Kjærsgård IV, Jensen RB, Rasmussen SK, Jespersen HM, Duroux L.拟南芥III类过氧化物酶的结构多样性和转录。2月j . 2002; 269(24): 6063 - 81。
- 50.
活性氧:代谢、氧化应激和信号转导。植物学报2004;55:73 - 99。
- 51.
羊肉c,dixon ra。植物疾病抗性的氧化爆发。Annu Rev植物Biol。1997年; 48(1):251-75。
- 52.
Khatun S, Cakilcioglu U, Chakrabarti M, Ojha S, Chatterjee NC。传统药用植物慈姑枯病的生化防御。植物学报。2011;2(2)。
- 53.
Bestwick CS,布朗IR,曼斯菲尔德JW。在过氧化物酶的活性的局部变化在莴苣一个非寄主超敏反应的开发过程中伴随过氧化氢产生。植物理性。1998; 118(3):1067至78年。
- 54.
莱文A,Tenhaken R,狄克逊R,羔羊C. H 2 O 2从氧化猝发编排植物过敏性疾病抗性反应。细胞。1994; 79(4):583-93。
- 55。
Møller K, Møller K, Gregersen PL, Jørgensen HL。过氧化氢与抗性小麦赤霉病限制性因子的关联。植物学报。2003;62(6):333-46。
- 56。
Borden S, Higgins VJ。过氧化氢在番茄对黄分枝杆菌的防御反应中起着关键作用。植物病理学杂志。2002;61(4):227-36。
- 57.
Mellersh DG, Foulds IV, Higgins VJ, Heath MC. H2O2在三种不同的植物-真菌相互作用中扮演不同的角色。植物j . 2002; 29(3): 257 - 68。
- 58.
Mlíčková K, Luhová L, Lebeda A, Mieslerová B, Peč P.番茄种活性氧生成和过氧化物酶活性的研究。植物生理生化学报。2004;42(10):753-61。
- 59。
植物化学物质在一些不太知名的植物中的生物活性及其在畜牧和水产养殖生产系统中的作用和潜在应用。的动物。2007; 1(9): 1371 - 91。
- 60.
AZAIEZ A,博伊尔B,堤防V,Seguin的A.转录谱与杨栅锈菌杂交白杨以下相互作用。Mol植物微生物相互作用。2009; 22(2):190-200。
- 61.
Uppalapati SR, Marek SM, Lee H-K, Nakashima J, Tang Y, Sledge MK, Dixon RA, Mysore KS。截形紫花苜蓿-瘤毛菌杂食菌相互作用的全球基因表达谱揭示了茉莉酸、乙烯和类黄酮通路在疾病发展中的作用。植物与微生物学报。2009;22(1):7-17。
- 62.
Zabala G, Zou J, Tuteja J, Gonzalez DO, Clough SJ, Vodkin LO。甘氨酸max苯丙素通路对丁香假单胞菌感染的转录组变化植物学报。2006;6(1):26。
- 63.
Robbins Ml,Roy A,Wang P-H,Gaffoor I,Sekhon Rs,Sekhon Rs,玛西娅·莫,罗格拉JS,Chopra S. Dige和Itraq的比较蛋白质组学分析提供了对玉米苯丙醇的调节的洞察力。J蛋白质组。2013; 93:254-75。
- 64.
基于β-氨基丁酸诱导水稻对根结线虫的抗性是基于基础防御的。植物与微生物相互作用学报。2015;28(5):519-33。
- 65.
木质素的发生、演化与降解。植物学报,1990,41(1):455-96。
- 66.
Nicholson RL,Hammerschmidt R.酚类化合物及其在抗病性中的作用。Annu Rev phytopathol。1992; 30(1):369-89。
- 67。
黄柏对症状前黄松韧皮部阿魏酸苷和木质素的系统效应及其对树皮甲虫相关真菌的潜在影响。化学学报。2003;29(5):1167-82。
- 68。
王志强,王志强。植物-线虫相互作用的分子机制研究。植物nematol。2006:234-54。
- 69.
Miedes E,Vanholme R,Boerjan W,在对病原体的植物抗性的次生细胞壁的莫利纳A.作用。前植物SCI。2014; 5:358
资金
国家重点研发计划项目(no . 2017YFD0201100)资助资助机构在研究的设计、数据的收集、分析和解释以及手稿的撰写中没有发挥任何作用。
数据和材料的可用性
本研究中产生或分析的所有数据均包含在本文及其补充信息文件中。
作者信息
隶属关系
贡献
XY,DQ,HZ和JY设计guidanced实验。CY和YL分析蛋白质组学的日期。YL采集的样品。CY和XY进行的实验,并与所有作者的贡献起草的手稿。所有作者阅读并认可的终稿。
通讯作者
伦理宣言
伦理批准和同意参与
番茄(番茄L.)种子“zhongza9hao”,获得教育部中华人民共和国中国的农业部的许可,从蔬菜花卉研究所,中国农业科学院的购买。植物检疫证书号为620,900,200,000,857。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
附加文件
附加文件1:
图S1。BcGs1蛋白的纯化和坏死活性。A:纯化BcGs1的SDS-PAGE分析。M蛋白标记。1,纯化BcGs1。B: BcGs1在番茄、烟草、黄瓜和豌豆叶片中的坏死活性。多克斯(673 kb)
权利和权限
开放访问本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
杨超,梁勇,邱达。et al。木质素新陈代谢涉及葡萄孢菌BcGs1-番茄引起的防御反应。BMC植物杂志18,103(2018)。https://doi.org/10.1186/s12870-018-1319-0
已收到:
接受:
发表:
关键字
- 真菌蛋白激发子
- 防御反应
- iTRAQ
- 苯丙
- 木质素
- 葡萄孢菌