- 研究文章GydF4y2Ba
- 开放获取GydF4y2Ba
- 发表:GydF4y2Ba
新形成的六倍体小麦显示出立即的更高耐受性氮缺乏比其亲本系GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba18GydF4y2Ba, 文章编号:GydF4y2Ba113.GydF4y2Ba(GydF4y2Ba2018年GydF4y2Ba)GydF4y2Ba
抽象的GydF4y2Ba
背景GydF4y2Ba
众所周知,六倍普通小麦(GydF4y2BaTriticum aestivum.GydF4y2Ba与四倍体小麦祖先相比,其对许多胁迫环境的适应性更强。然而,普通小麦获得这些增强适应性的生理基础和进化过程仍有待研究。在这里,我们的目的是调查是否以及通过什么方式,对低氮的耐受性表现在普通小麦可能立即出现在六倍体化。GydF4y2Ba
结果GydF4y2Ba
我们将与氮(n)代谢相关的特征与合成的allohexpaploid小麦(Neo-6×,Bbaadd)与其平坦的常见小麦一起模仿,与其四倍体(Bbaa,4GydF4y2Ba×GydF4y2Ba)和二倍体(DD,2GydF4y2Ba×GydF4y2Ba) 父母。我们发现,低氮条件下,新6GydF4y2Ba×GydF4y2Ba光合作用基本维持在正常水平,地上部氮积累量较高,氮素同化作用较强GydF4y2Ba×GydF4y2Ba和2GydF4y2Ba×GydF4y2Ba的父母。我们发现,neo-6增强对缺氮的耐受性有多种机制GydF4y2Ba×GydF4y2Ba.在形态学水平,新6GydF4y2Ba×GydF4y2Ba具有生物量比其父母,随着越来越多根喂少芽与N,从而能够在更高的枝条N累积,这可能是一个自适应增长策略的更高根/苗比率。在电平,HGydF4y2Ba+GydF4y2Ba外流新6GydF4y2Ba×GydF4y2Ba高于它的4GydF4y2Ba×GydF4y2Ba父母。一个强壮的H.GydF4y2Ba+GydF4y2Ba外排可能使neo-6具有较高的氮吸收能力GydF4y2Ba×GydF4y2Ba.在基因表达水平,新6GydF4y2Ba×GydF4y2Ba显示出涉及的临界基因的表达水平明显高于其4GydF4y2Ba×GydF4y2Ba和2GydF4y2Ba×GydF4y2Ba的父母。GydF4y2Ba
结论GydF4y2Ba
这项研究文档小麦异源六倍体可以与它的两个4比达到紧接更高的耐受性的N-不足GydF4y2Ba×GydF4y2Ba和2GydF4y2Ba×GydF4y2Ba父母,并通过多种机制完成。GydF4y2Ba
背景GydF4y2Ba
多倍体,或全基因组复制(WGD),是高等植物进化的普遍驱动力[GydF4y2Ba1GydF4y2Ba那GydF4y2Ba2GydF4y2Ba那GydF4y2Ba3.GydF4y2Ba那GydF4y2Ba4.GydF4y2Ba].多倍体也为重要作物的驯化也促进了小麦,油菜,马铃薯,甘蔗和棉等重要作物。通常,多倍体,特别是各种多倍数(杂交的WGD),可以瞬间诱导遗传和表观遗传学改变总和和职业特异性水平的改变的基因表达[GydF4y2Ba5.GydF4y2Ba].一些研究已经证明,多倍体可能导致直接的生理和形态的创新,如增加光合能力,改变花的颜色,以及增强的对生物和非生物胁迫[GydF4y2Ba6.GydF4y2Ba那GydF4y2Ba7.GydF4y2Ba那GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba10.GydF4y2Ba,表明快速的遗传和表观遗传变化以及生理特性的改变可能是多倍体适应性进化的结果。GydF4y2Ba
六倍体普通小麦(GydF4y2BaTriticum aestivum.GydF4y2BaL.GydF4y2Ba.GydF4y2Ba(基因组BBAADD)是一种非常年轻的六倍体物种(约8500年),但迅速成为世界上最重要的粮食作物之一,现在仍然如此[GydF4y2Ba11.GydF4y2Ba那GydF4y2Ba12.GydF4y2Ba].多倍麦统治在西亚和欧洲的现代文明统治。六倍体小麦的形成和成功还提供合适的系统,以探索多倍体特异性特性是否在多倍体基因组进化过程中演化或在多倍化后立即赋予多倍化,因为它们的祖种,四倍体小麦(GydF4y2Bat . turgidumGydF4y2Ba,基因组BBAA)和D-基因组山羊(GydF4y2Ba山羊草属tauschiiGydF4y2Ba)仍然现存。GydF4y2Ba
栽培四倍体小麦与野生小麦的生理系统GydF4y2BaAE。麦GydF4y2Ba它们在不同的选择压力下独立进化,可以想象,这将它们的生理特征塑造成不同的状态。因此,它们在C和N代谢方面可能具有截然不同的特征。因此,六倍体普通小麦通过四倍六倍化合并和加倍BA和D基因组后,氮代谢的反应和行为以及氮利用效率是否或如何立即发生变化是一个有趣的问题。为此,模拟天然普通小麦的人工合成六倍体小麦是首选材料。GydF4y2Ba
植物根系吸收硝酸盐(NOGydF4y2Ba3.GydF4y2Ba-GydF4y2Ba)通过使用较大的转运蛋白家族来分为两类土壤:NPF(硝酸盐转运蛋白1 /肽转运蛋白,NRT1)和高亲和力NRT2基因家族[GydF4y2Ba13GydF4y2Ba].在GydF4y2Ba拟南芥意大利GydF4y2Ba,鉴定出53个NPF基因和7个NRT2基因[GydF4y2Ba14GydF4y2Ba那GydF4y2Ba15GydF4y2Ba].六倍体小麦可以具有大得多的NPF和NRT 2个科,因为每个构件可以包括三个或更多homeologs。被吸收的NO据了解GydF4y2Ba3.GydF4y2Ba-GydF4y2Ba硝酸还原酶(NR)先还原为亚硝酸盐,再还原为NHGydF4y2Ba4.GydF4y2Ba+GydF4y2Ba通过亚硝酸盐还原酶(NIR)。NH.GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba然后通过谷氨酰胺合成酶(GS)和谷氨酸合酶(Gogat)或替代的谷氨酸脱氢酶(GDH)途径掺入氨基酸中。在更高的植物中,光合作用,光素和N同化形式复杂的交互式网络:Gogat / GS循环消除了毒性NHGydF4y2Ba4.GydF4y2Ba+GydF4y2Ba从光呼吸保护光合酶和光合作用用品GOGAT / GS周期与还原能力,在NADPH,ATP或Fdred [的形式衍生GydF4y2Ba13GydF4y2Ba那GydF4y2Ba14GydF4y2Ba那GydF4y2Ba15GydF4y2Ba那GydF4y2Ba16GydF4y2Ba].因此,Gogat / GS循环,GDH,光素,硝酸盐转运蛋白和光合作用是用于氮代谢调节的核心组分。GydF4y2Ba
为了调查是否与通过什么手段在六倍体小麦的氮代谢合并和由allohexaploidization加倍BA和d的基因组后,立即改变,我们比较了有关合成小麦异源六倍体的氮代谢生理性状(NEO-6GydF4y2Ba×GydF4y2Ba;基因组BBAADD)与其确切亲本基因型,GydF4y2BaAE。麦GydF4y2Ba(基因组DD)(2GydF4y2Ba×GydF4y2Ba) 和GydF4y2Bat . turgidumGydF4y2Ba(基因组BBAA) (4GydF4y2Ba×GydF4y2Ba),并分析正常和低氮条件下的基因表达。一种天然的六倍体小麦品种(nat-6GydF4y2Ba×GydF4y2Ba)也被纳入比较。我们表明,在合成的六倍体小麦中,六倍体化可以瞬间改变氮代谢性状。GydF4y2Ba
结果GydF4y2Ba
生长和光合作用GydF4y2Ba
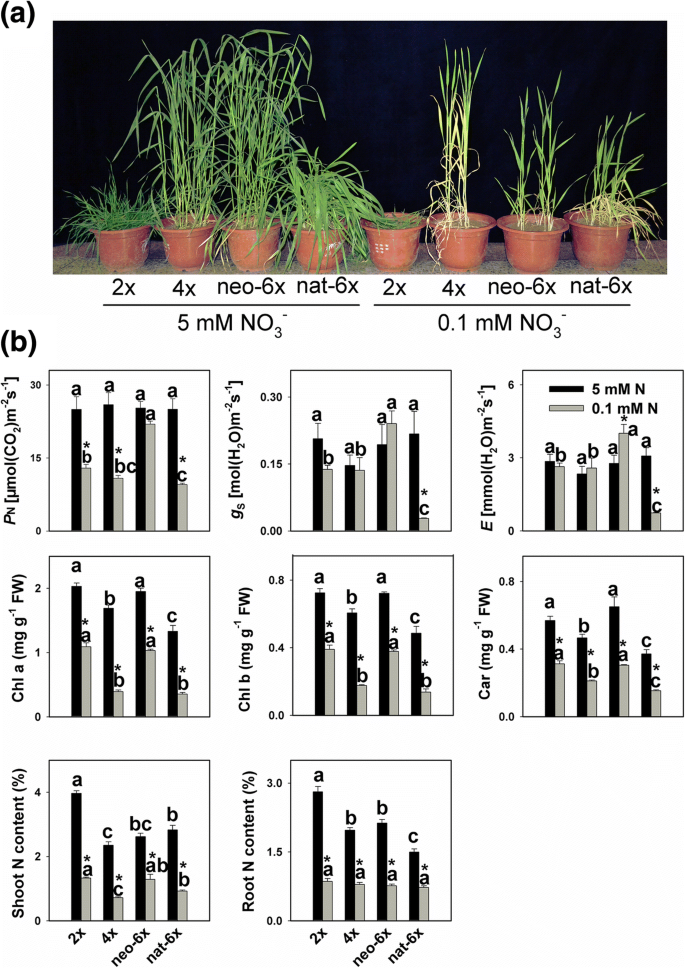
在土壤中的总氮的98%以上是在有机质的形式,然而这主要是直接不可用的植物。将有机N被转化为通过土壤中的微生物可用的无机形式(铵,亚硝酸盐,然后硝酸盐)[GydF4y2Ba16GydF4y2Ba].在典型的有氧农业土壤,硝酸盐是主要的无机氮的形式。可用的无机氮的农业土壤中的通常浓度范围是从1至10mM [GydF4y2Ba16GydF4y2Ba].在这项研究中,我们设置NO的5毫GydF4y2Ba3.GydF4y2Ba-GydF4y2Ba0.1 mM为低氮条件。正常施氮条件下,4个品系均生长良好,低施氮条件下,新6GydF4y2Ba×GydF4y2Ba没有更强的根,更好的留下比4GydF4y2Ba×GydF4y2Ba(无花果。GydF4y2Ba1GydF4y2Ba和附加文件GydF4y2Ba1GydF4y2Ba:图S1,附加文件GydF4y2Ba2GydF4y2Ba:图S2)。我们测量了三个光合参数,GydF4y2BaP.GydF4y2BaNGydF4y2BagGydF4y2BaS.GydF4y2Ba,GydF4y2BaE.GydF4y2Ba结果表明,在正常氮条件下,4个小麦品系在3个参数上表现相似。GydF4y2Ba1GydF4y2Ba);而在低氮条件下,neo-6的3个参数均较高GydF4y2Ba×GydF4y2Ba比其亲本基因型和,令人惊讶的,甚至高于NAT-6GydF4y2Ba×GydF4y2Ba.叶绿素A和叶绿素B具有与低N条件相似的反应,并且在N条件下,Neo-6×具有更高的叶绿素和类胡萝卜素含量小于4GydF4y2Ba×GydF4y2Ba和NAT-6GydF4y2Ba×GydF4y2Ba但类似于2GydF4y2Ba×GydF4y2Ba.相比之下,低N条件强烈降低了叶绿素的积累,但新六个递减GydF4y2Ba×GydF4y2Ba(叶绿素A 47%和叶绿素B 48%)比4更温和GydF4y2Ba×GydF4y2Ba(叶绿素a 77%和叶绿素b的71%)和NAT-6GydF4y2Ba×GydF4y2Ba(叶绿素A 73%和叶绿素B 72%)虽然类似于2GydF4y2Ba×GydF4y2Ba(叶绿素a 46%和叶绿素b 46%)。我们还测量主光合作用电子传输参数:PSII效率(ΦGydF4y2BaPSIIGydF4y2Ba),通过开放PSII中心激发捕获效率(FGydF4y2BaV.GydF4y2Ba'/FGydF4y2BamGydF4y2Ba’)和光系统II的最大量子产量(FGydF4y2BaV.GydF4y2Ba/FGydF4y2Ba米)GydF4y2Ba(附加文件GydF4y2Ba3.GydF4y2Ba:图S3)。结果表明,低N略微降低φGydF4y2BaPSIIGydF4y2Ba在所有四个小麦品系,但在NAT-6的递减GydF4y2Ba×GydF4y2Ba和新6GydF4y2Ba×GydF4y2Ba是否小于2GydF4y2Ba×GydF4y2Ba和图4GydF4y2Ba×GydF4y2Ba.Low N只对F产生了适度的影响GydF4y2BaV.GydF4y2Ba'/FGydF4y2BamGydF4y2Ba“和FGydF4y2BaV.GydF4y2Ba/FGydF4y2BamGydF4y2Ba.这些数据表明,在低氮条件下,中央光系统没有受到损伤。在正常氮条件下,2GydF4y2Ba×GydF4y2Ba比4GydF4y2Ba×GydF4y2Ba,虽然n内容在neo-6中GydF4y2Ba×GydF4y2Ba仅比4略高GydF4y2Ba×GydF4y2Ba(无花果。GydF4y2Ba1 bGydF4y2Ba那GydF4y2BaP.GydF4y2Ba> 0.05)。在地上部,低施氮显著降低了4个小麦品系的氮素积累量,但新6小麦的氮素积累量仍显著降低GydF4y2Ba×GydF4y2Ba(51%)小于2GydF4y2Ba×GydF4y2Ba(66%),4GydF4y2Ba×GydF4y2Ba(70%),甚至NAT-6GydF4y2Ba×GydF4y2Ba(67%)(图。GydF4y2Ba1 bGydF4y2Ba).在N低,拍摄N含量在新6×是的那个的4 1.79倍GydF4y2Ba×GydF4y2Ba,但根本N内容没有区别。携带在一起,Neo-6GydF4y2Ba×GydF4y2Ba减少较小GydF4y2BaP.GydF4y2BaNGydF4y2Ba与其他3个小麦品系相比,新6GydF4y2Ba×GydF4y2Ba具有比2累积更强的能力GydF4y2Ba×GydF4y2Ba和图4GydF4y2Ba×GydF4y2Ba在低氮条件下。为了检验这一发现的通用性,我们还比较了另外4个四倍体小麦品系和2个合成六倍体小麦品系对低氮的响应。结果表明,所有四倍体的叶绿素和类胡萝卜素还原量均高于新6倍体GydF4y2Ba×GydF4y2Ba行(额外的文件GydF4y2Ba4.GydF4y2Ba:图S4)。GydF4y2Ba
低N条件对新形成六倍体生长,光合作用和氮含量的影响(Neo-6GydF4y2Ba×GydF4y2Ba),其二倍体(2GydF4y2Ba×GydF4y2Ba)和四倍体(4GydF4y2Ba×GydF4y2Ba)父母和天然allohexaploid(NAT-6GydF4y2Ba×GydF4y2Ba).17日龄幼苗在0.1 mM低氮条件下处理31 d。值是四种生物学重复的方法。GydF4y2Ba一种GydF4y2Ba的下0.1和5mM N条件4个小麦系的生长状态。GydF4y2BaB.GydF4y2Ba光合作用和氮含量:GydF4y2BaGGydF4y2BaS.GydF4y2Ba−气孔导度;GydF4y2BaP.GydF4y2BaNGydF4y2Ba − net photosynthetic rate; Chl – chlorophyll; Car–carotenoid;E.GydF4y2Ba−蒸腾速率。星号表示显着差异(GydF4y2BaT.GydF4y2Ba测试,GydF4y2BaP.GydF4y2Ba< 0.05)。在相同的N条件下,对所有四行中任意两行的平均值进行比较GydF4y2BaT.GydF4y2Ba测试 (GydF4y2BaP.GydF4y2Ba < 0.05), and means followed by different letters at the same N condition are significant
氮同化GydF4y2Ba
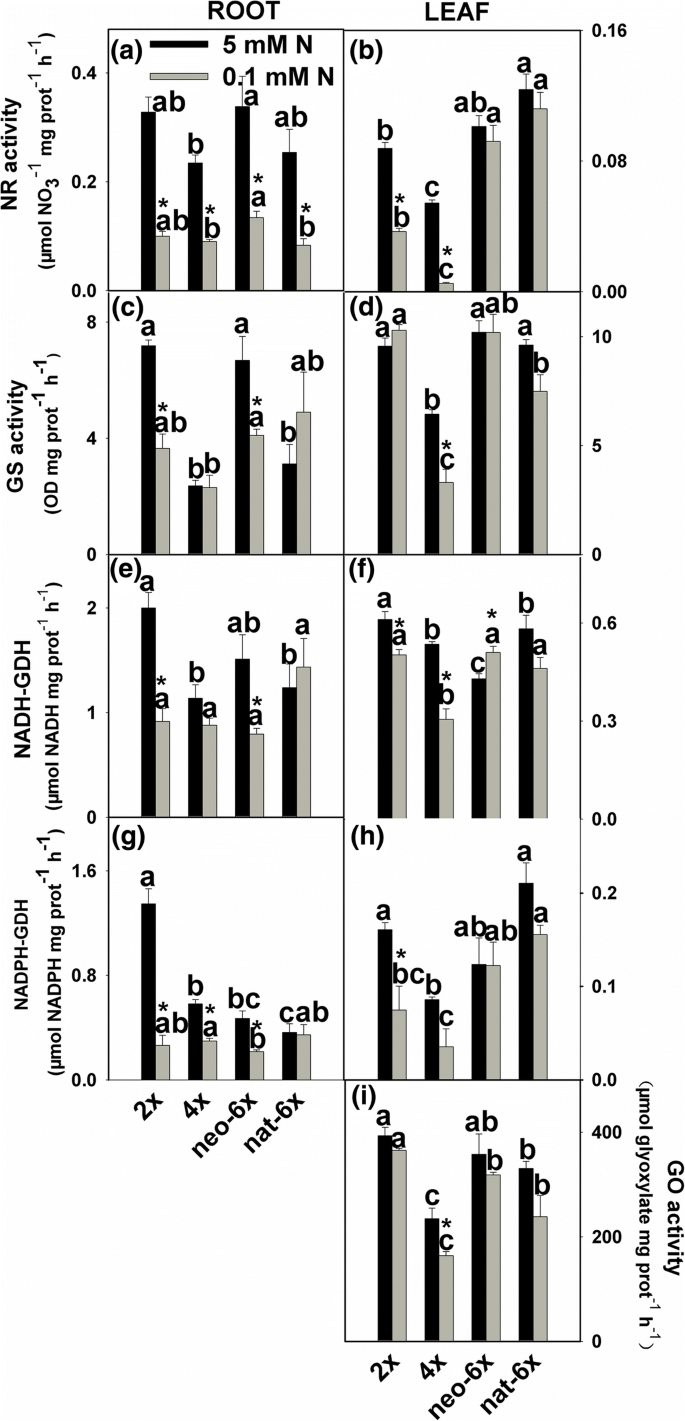
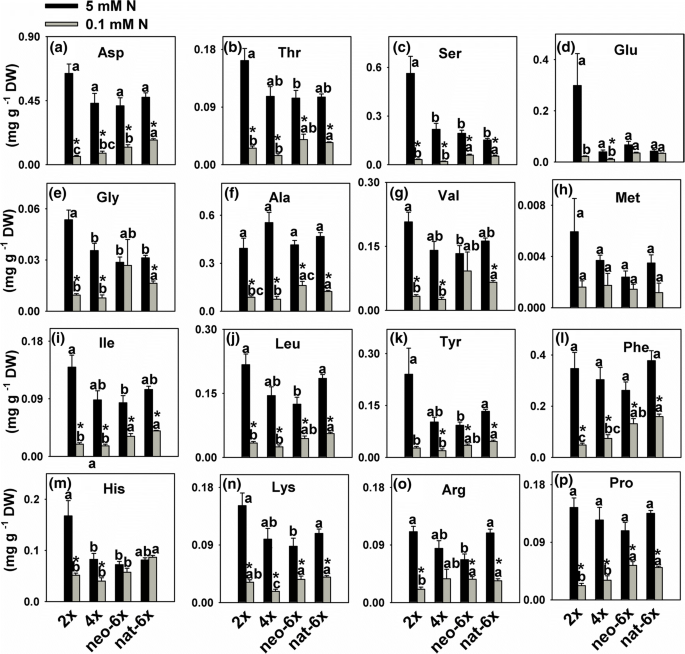
我们测量涉及氮同化最关键酶和乙醇酸氧化酶(GO)的活性,限速酶为光呼吸活动。我们首先比较正常N条件下的四个小麦品系之间的差异。结果表明,在正常N(5毫摩尔)的条件,2GydF4y2Ba×GydF4y2Ba,新6GydF4y2Ba×GydF4y2Ba和NAT-6GydF4y2Ba×GydF4y2Ba所有这些都呈现比4更高的值GydF4y2Ba×GydF4y2Ba在NR GS,NADPH-GDH和叶子的活动中;2GydF4y2Ba×GydF4y2Ba和新6GydF4y2Ba×GydF4y2BaNADH-GDH、NR和GS活性高于4GydF4y2Ba×GydF4y2Ba和NAT-6GydF4y2Ba×GydF4y2Ba根(无花果。GydF4y2Ba2GydF4y2Ba).在叶片中,低N条件大大降低了2中的NR活性GydF4y2Ba×GydF4y2Ba和图4GydF4y2Ba×GydF4y2Ba但不是在新6GydF4y2Ba×GydF4y2Ba和NAT-6GydF4y2Ba×GydF4y2Ba在7天的时间点(图GydF4y2Ba2GydF4y2Ba).低氮不仅减少了GS活性在4GydF4y2Ba×GydF4y2Ba叶子,但不是在两个时间点的其他3个品种(图GydF4y2Ba2GydF4y2Ba和附加文件GydF4y2Ba5.GydF4y2Ba:图S5)。在根中,当植物在低N条件下生长7天,NADH-GDH活性在2降低GydF4y2Ba×GydF4y2Ba和新6×但不是在4GydF4y2Ba×GydF4y2Ba和NAT-6GydF4y2Ba×GydF4y2Ba, NADPH-GDH活性降低GydF4y2Ba×GydF4y2Ba, 4GydF4y2Ba×GydF4y2Ba和新6GydF4y2Ba×GydF4y2Ba但不是在NAT-6GydF4y2Ba×GydF4y2Ba.在叶,NADH-GDH活动2分别降低GydF4y2Ba×GydF4y2Ba, 4GydF4y2Ba×GydF4y2Ba和新6GydF4y2Ba×GydF4y2Ba而NADPH-GDH活性仅在2中降低GydF4y2Ba×GydF4y2Ba(无花果。GydF4y2Ba2GydF4y2Ba).在低氮条件下,所有四个小麦品系的乙醇酸氧化酶(GO)的活动呈下降趋势,但只有4GydF4y2Ba×GydF4y2Ba达到了统计学意义,且减量大于neo-6GydF4y2Ba×GydF4y2Ba(无花果。GydF4y2Ba2GydF4y2Ba).我们没有检测到所有四个小麦线的根源的活动。在正常的n条件下,在叶片中,Neo-6中所有测量的氨基酸的内容物GydF4y2Ba×GydF4y2Ba与4相似GydF4y2Ba×GydF4y2Ba;而在低氮条件下,大部分氨基酸含量均较低GydF4y2Ba×GydF4y2Ba比neo-6GydF4y2Ba×GydF4y2Ba(无花果。GydF4y2Ba3.GydF4y2Ba).在低氮条件下,新6×的氨基酸减量均小于2GydF4y2Ba×GydF4y2Ba和图4GydF4y2Ba×GydF4y2Ba(附加文件GydF4y2Ba6.GydF4y2Ba:图S6)。在根,16种氨基酸10表明,两种新6GydF4y2Ba×GydF4y2Ba和2GydF4y2Ba×GydF4y2Ba比4更大减少GydF4y2Ba×GydF4y2Ba(附加文件GydF4y2Ba7.GydF4y2Ba:图S7,附加文件GydF4y2Ba8.GydF4y2Ba:图S8)。总之,Neo-6GydF4y2Ba×GydF4y2Ba能维持高于2GydF4y2Ba×GydF4y2Ba和图4GydF4y2Ba×GydF4y2Ba在叶子中的低n条件下,但不是根。在根系中,Low n在Neo-6上的影响GydF4y2Ba×GydF4y2Ba氮同化类似于4GydF4y2Ba×GydF4y2Ba甚至neo-6GydF4y2Ba×GydF4y2Ba累积较少的氨基酸。显然,在正常的n条件下,新形成的六倍型麦片的二倍体母体表现出比四倍体母体更高的N累积,NR和GS活性,NR和GS活性,以及叶绿素含量。这表明它们可能具有不同的n个新陈代谢特征。在低n强调叶子,neo-6GydF4y2Ba×GydF4y2Ba能维持相对正常的氮素同化状态,产生比2GydF4y2Ba×GydF4y2Ba和图4GydF4y2Ba×GydF4y2Ba;而在根中,neo-6×具有与2相似的N同化GydF4y2Ba×GydF4y2Ba和图4GydF4y2Ba×GydF4y2Ba.GydF4y2Ba
低氮条件对新六倍体(neo-6 .)氮素同化酶活性的影响GydF4y2Ba×GydF4y2Ba),其二倍体(2GydF4y2Ba×GydF4y2Ba)和四倍体(4GydF4y2Ba×GydF4y2Ba)父母和天然allohexaploid(NAT-6GydF4y2Ba×GydF4y2Ba).测定了各小麦品系相同叶位新鲜成熟叶片中酶的含量。从每个小麦品系的5株单株中提取的10片成熟叶片作为一个生物复制被汇集在一起。这些值是四个生物复制的平均值。星号表示显着差异(GydF4y2BaT.GydF4y2Ba测试,GydF4y2BaP.GydF4y2Ba< 0.05)。在相同的N条件下,对所有四行中任意两行的平均值进行比较GydF4y2BaT.GydF4y2Ba测试 (GydF4y2BaP.GydF4y2Ba< 0.05),且相同N条件下不同字母后的平均值显著。将幼苗进行低N条件(0.1mm)7天。NR,硝酸还原酶;GS,谷氨酰胺合成酶;GDH,谷氨酸脱氢酶;并去乙醇酸氧化酶GydF4y2Ba
在(新形成的六倍体的芽新6的低N条件对氨基酸的内容GydF4y2Ba×GydF4y2Ba),其二倍体(2GydF4y2Ba×GydF4y2Ba)和四倍体(4GydF4y2Ba×GydF4y2Ba)父母和天然allohexaploid(NAT-6GydF4y2Ba×GydF4y2Ba).这些值是四个生物复制的平均值。星号表示显着差异(GydF4y2BaT.GydF4y2Ba测试,GydF4y2BaP.GydF4y2Ba< 0.05)。在相同的N条件下,对所有四行中任意两行的平均值进行比较GydF4y2BaT.GydF4y2Ba测试 (GydF4y2BaP.GydF4y2Ba< 0.05),且相同N条件下不同字母后的平均值显著。对幼苗进行低N条件(0.1mm)31天GydF4y2Ba
硝酸盐吸收和NPF和NRT基因的表达GydF4y2Ba
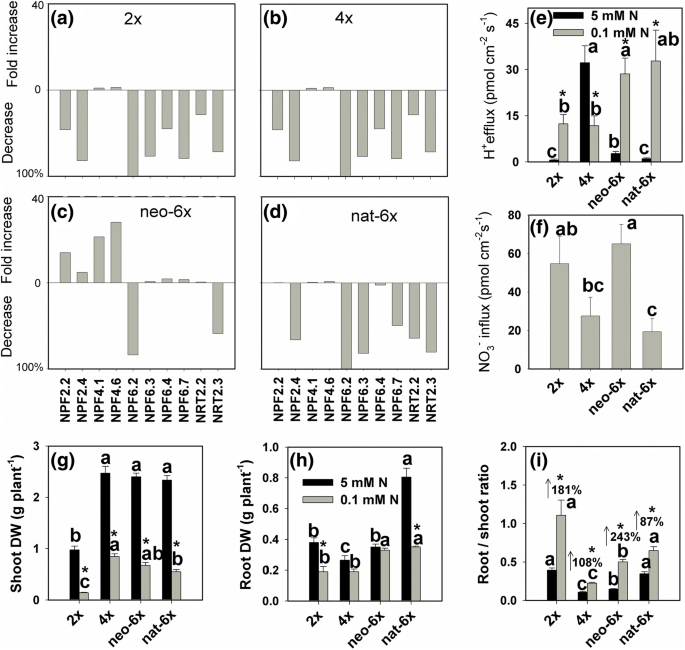
我们观察到,低N压力显着增强了H.GydF4y2Ba+GydF4y2Ba根的流出2GydF4y2Ba×GydF4y2Ba,NAT-6GydF4y2Ba×GydF4y2Ba和新6GydF4y2Ba×GydF4y2Ba,但下降^ hGydF4y2Ba+GydF4y2Ba4根的外流GydF4y2Ba×GydF4y2Ba(无花果。GydF4y2Ba4.GydF4y2Ba).在低氮条件下,HGydF4y2Ba+GydF4y2BaNeo-6的渗透率较高GydF4y2Ba×GydF4y2Ba和nat6 × 2GydF4y2Ba×GydF4y2Ba和图4GydF4y2Ba×GydF4y2Ba.我们还调查了NOGydF4y2Ba3.GydF4y2Ba-GydF4y2Ba通量在均为N的条件下根。不幸的是,5毫米N条件下,我们没有发现任何NOGydF4y2Ba3.GydF4y2Ba-GydF4y2Ba通量信号由于NO的高背景GydF4y2Ba3.GydF4y2Ba-GydF4y2Ba.因此,我们只测量NOGydF4y2Ba3.GydF4y2Ba-GydF4y2Ba低N条件下的磁通(图GydF4y2Ba4F.GydF4y2Ba).结果表明NOGydF4y2Ba3.GydF4y2Ba-GydF4y2BaNeo-6中的涌入GydF4y2Ba×GydF4y2Ba远高于4GydF4y2Ba×GydF4y2Ba和NAT-6GydF4y2Ba×GydF4y2Ba在低n条件下(图。GydF4y2Ba4F.GydF4y2Ba).在低N条件下,射击Neo-6的干重(DW)GydF4y2Ba×GydF4y2Ba出现比4稍稍降低GydF4y2Ba×GydF4y2Ba,但差异不显著,而neo-6的根DW要高得多GydF4y2Ba×GydF4y2Ba而在4个国家中GydF4y2Ba×GydF4y2Ba和2GydF4y2Ba×GydF4y2Ba(无花果。GydF4y2Ba4g-H.GydF4y2Ba).DW的根/苗比率在所有四行低N条件均升高,但增强的程度是在新6更高GydF4y2Ba×GydF4y2Ba而不是其他三个小麦线的那些(图。GydF4y2Ba4I.GydF4y2Ba).在新6×DW的根/苗比率较高得多的在4GydF4y2Ba×GydF4y2Ba在低n条件下(图。GydF4y2Ba4I.GydF4y2Ba)GydF4y2Ba.GydF4y2Ba接下来我们测量了8个NPF基因和2个NRT2基因在根中的表达。结果表明,低氮条件下表达下调GydF4y2BaNPF6.3GydF4y2Ba和GydF4y2BaNPF 6.7.GydF4y2Ba在2GydF4y2Ba×GydF4y2Ba, 4GydF4y2Ba×GydF4y2Ba和NAT-6GydF4y2Ba×GydF4y2Ba但稍微上调新六个基因的表达GydF4y2Ba×GydF4y2Ba(无花果。GydF4y2Ba4模拟GydF4y2Ba和附加文件GydF4y2Ba9.GydF4y2Ba:图S9)。值得注意的是,低N条件增强了GydF4y2BaNPF4.6GydF4y2Ba在新-6表达GydF4y2Ba×GydF4y2Ba通过28倍,而其他三个小麦线中该基因表达的诱导仅在0.59-1.9倍的范围内。同样,低N条件升高了表达GydF4y2BaNPF4.1GydF4y2Ba在neo-6GydF4y2Ba×GydF4y2Ba21.3倍,但是在其他三个小麦品系仅在范围0.24-2.35倍(图GydF4y2Ba4.GydF4y2Ba和附加文件GydF4y2Ba9.GydF4y2Ba:图S9)。GydF4y2Ba
的低N条件影响的硝酸盐转运根基因的表达(GydF4y2Ba广告GydF4y2Ba), HGydF4y2Ba+GydF4y2Ba外排(GydF4y2BaE.GydF4y2Ba), 不GydF4y2Ba3.GydF4y2Ba-GydF4y2Ba涌入(GydF4y2BaFGydF4y2Ba),干重(DW)(GydF4y2Ba克小时GydF4y2Ba)及根/枝比率(GydF4y2Ba一世GydF4y2Ba)在新形成的六倍倍醇(Neo-6GydF4y2Ba×GydF4y2Ba),其二倍体(2GydF4y2Ba×GydF4y2Ba)和四倍体(4GydF4y2Ba×GydF4y2Ba)父母和天然allohexaploid(NAT-6GydF4y2Ba×GydF4y2Ba).(GydF4y2Ba广告GydF4y2Ba)的基因表达的倍数增加根据(治疗对照)/对照,和基因表达减少的百分比来计算根据(控制处理)* 100%/控制计算。(GydF4y2BaE-I.GydF4y2Ba)星号表示差异显著(GydF4y2BaT.GydF4y2Ba测试,GydF4y2BaP.GydF4y2Ba< 0.05)。在相同的N条件下,对所有四行中任意两行的平均值进行比较GydF4y2BaT.GydF4y2Ba测试 (GydF4y2BaP.GydF4y2Ba< 0.05),且相同N条件下不同字母后的平均值显著。值是3-7生物重复的方法。当幼苗经受低n条件(0.1mm)7天时,基因表达,没有GydF4y2Ba3.GydF4y2Ba-GydF4y2Ba涌入和HGydF4y2Ba+GydF4y2Ba测量了efflux。测量根和芽的干重,并在应力的31天计算根DW /芽DW比(根/芽比)。在5毫米的情况下,我们没有发现任何没有GydF4y2Ba3.GydF4y2Ba-GydF4y2Ba通量信号由于NO的高背景信号GydF4y2Ba3.GydF4y2Ba-GydF4y2Ba因此,NOGydF4y2Ba3.GydF4y2Ba-GydF4y2Ba仅0.1mM的N处理的流入数据显示在图GydF4y2BaFGydF4y2Ba
讨论GydF4y2Ba
氮是作物的主要营养物质之一,不仅参与种子生产,而且参与对应激条件的反应。在全球范围内,为了养活不断增长的人口,将近10GydF4y2Ba11.GydF4y2Ba公斤氮每年被施加到农业生态系统[GydF4y2Ba16GydF4y2Ba那GydF4y2Ba17GydF4y2Ba].然而,作物能够仅利用30-40%的施用的n [GydF4y2Ba16GydF4y2Ba那GydF4y2Ba17GydF4y2Ba].丧失不仅提高了农业生产成本,而且加剧了土壤和水污染[GydF4y2Ba18GydF4y2Ba].因此,具有高的氮吸收效率作物品种,可以在低N条件生长相当良好是非常重要的用于降低N个输入到农业生态系统[GydF4y2Ba18GydF4y2Ba那GydF4y2Ba19GydF4y2Ba].我们的这项研究的结果表明,在多倍体小麦与氮代谢性状与它们的基因组的组合物,只要一个合成的六倍体小麦(类似于普通小麦基因组中的组合物)而言相关联。在正常N条件,拍摄N和氨基酸含量,NR和GS活性以及叶绿素含量在新6所有更高GydF4y2Ba×GydF4y2Ba比4GydF4y2Ba×GydF4y2Ba.这表明由2的不同土壤N条件GydF4y2Ba×GydF4y2Ba和图4GydF4y2Ba×GydF4y2Ba可能已经塑造了他们的代谢效率。通过Allohexaploidization合并和加倍AB和D基因组(导致物种GydF4y2BaTriticum aestivum.GydF4y2BaL.),氮代谢已经协同可能是由BBAA和DD subgenomes之间的正上位相互作用增强。有趣的是,我们观察到,低N条件下,新6GydF4y2Ba×GydF4y2Ba能维持相对正常的光合作用、较高的地上部氮积累量和较好的氮同化状态GydF4y2Ba×GydF4y2Ba和图4GydF4y2Ba×GydF4y2Ba父母(图。GydF4y2Ba5.GydF4y2Ba).这表明以下,在肝己倍化之后,六倍体小麦可以立即达到比其2更强的N缺乏耐受性GydF4y2Ba×GydF4y2Ba和图4GydF4y2Ba×GydF4y2Ba的父母。然而,我们需要注意的是,我们只比较了一个nat-6×和有限的neo-6株系GydF4y2Ba×GydF4y2Ba.不过,我们认为这种看法是有趣的,如果一般证实,这可能表明,由于现代农业的做法N个持续超过剂量应用时,立即被新成立的普通小麦收购了,否则要强得多氮素利用率已被侵蚀。我们认为,这个问题值得进一步研究,因为它可能不得不采用合成小麦策略在小麦遗传改良[显著影响GydF4y2Ba20.GydF4y2Ba].GydF4y2Ba
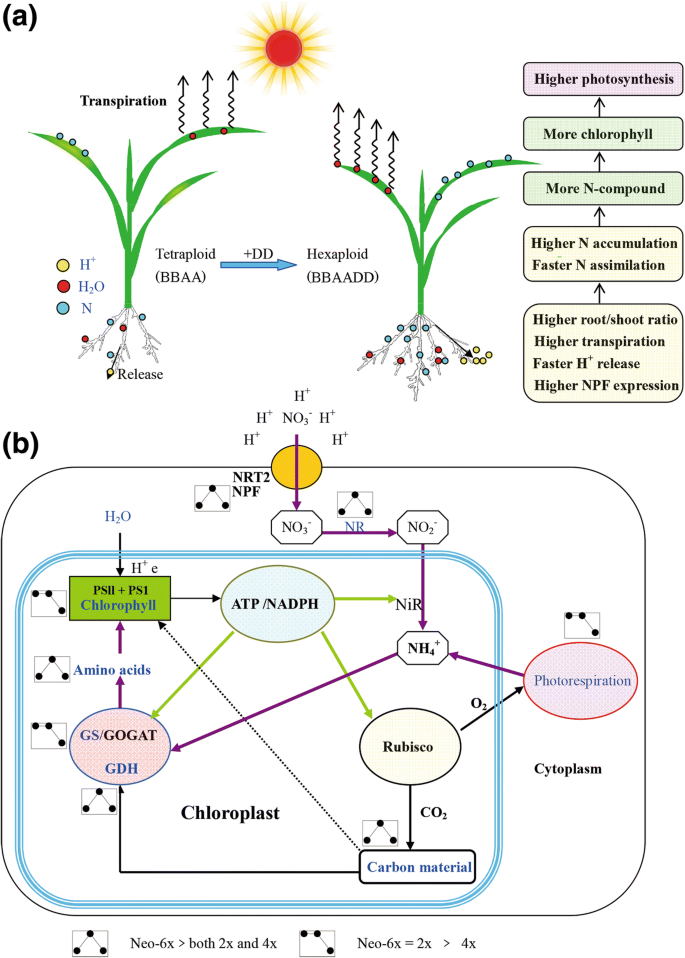
新形成的六倍体的氮缺乏耐受机制(Neo-6GydF4y2Ba×GydF4y2Ba).GydF4y2Ba一种GydF4y2BaH的比较特征GydF4y2Ba+GydF4y2BaHGydF4y2Ba2GydF4y2Ba啊,没有GydF4y2Ba3.GydF4y2Ba-GydF4y2Ba新形成的六倍体(基因组BBAADD)和低N条件下其四倍体(基因组BBAA)父摄取。GydF4y2BaB.GydF4y2Ba新形成的六倍体之间的差异(NEO-6GydF4y2Ba×GydF4y2Ba)及其二倍体(2GydF4y2Ba×GydF4y2Ba)和四倍体(4GydF4y2Ba×GydF4y2Ba)的光合作用和低氮条件下的氮代谢GydF4y2Ba
之前的研究还表明,多倍体可以瞬间增强植物的应力耐受性,并且耐高的耐受性被认为与根特征创新有关。例如,在GydF4y2Ba拟南芥GydF4y2Ba四倍体,有人记载,四倍体的较高的K积累和盐耐受性由根倍体独立地控制拍摄的倍性的,[GydF4y2Ba8.GydF4y2Ba].在新形成的六倍体小麦,根的Na的能力越强GydF4y2Ba+GydF4y2Ba控制有助于其耐盐性[GydF4y2Ba10.GydF4y2Ba].然而,关于六倍体小麦的适应性性状的出苗时间很少。我们的研究表明,新形成的六倍体小麦的N缺乏耐受性的主要生理特性可以立即形成全聚倍数。首先,在形态学水平,Neo-6GydF4y2Ba×GydF4y2Ba在低N条件下具有较高的生物量的根/芽比。它可能是Neo-6的适应性生长策略GydF4y2Ba×GydF4y2Ba随着越来越多的根少喂枝条用N,从而能够在枝条高得多的氮累积。较高的蒸腾速率的新6GydF4y2Ba×GydF4y2Ba蒸腾作用是植物吸收离子和水分的主要动力。第二,在电生理水平上,我们测量了HGydF4y2Ba+GydF4y2Ba因为H通量GydF4y2Ba+GydF4y2Ba梯度或HGydF4y2Ba+GydF4y2Ba原动力是驱动NO的能量GydF4y2Ba3.GydF4y2Ba-GydF4y2Ba由根吸收。通常,低N压力显着增强H.GydF4y2Ba+GydF4y2Ba根源的浮出来提升没有的摄取GydF4y2Ba3.GydF4y2Ba-GydF4y2Ba[GydF4y2Ba21GydF4y2Ba].结果还表明,在低氮胁迫条件下,2GydF4y2Ba×GydF4y2Ba父母,Neo-6×和NAT-6×均具有越来越大的H趋势GydF4y2Ba+GydF4y2Ba流出物;然而,4GydF4y2Ba×GydF4y2Ba亲本呈下降趋势。在低氮条件下,HGydF4y2Ba+GydF4y2Ba外流新6GydF4y2Ba×GydF4y2Ba比他们的父母高。这些数据表明,HGydF4y2Ba+GydF4y2BaNeo-6的effluxGydF4y2Ba×GydF4y2Ba可能促成它的强吸氮量容量。事实上,NOGydF4y2Ba3.GydF4y2Ba-GydF4y2BaNeo-6的涌入GydF4y2Ba×GydF4y2Ba远高于4GydF4y2Ba×GydF4y2Ba在低n条件下。最后,在基因表达水平上,我们在根系中测定了NPF或NRT2基因家族的表达,因为它们是显性的GydF4y2Ba3.GydF4y2Ba-GydF4y2Ba转运蛋白(GydF4y2Ba13GydF4y2Ba],在宽范围的外部的NOGydF4y2Ba3.GydF4y2Ba-GydF4y2Ba浓度[GydF4y2Ba22GydF4y2Ba那GydF4y2Ba23GydF4y2Ba].结果表明,新6GydF4y2Ba×GydF4y2Ba在几个NPF基因中具有比父母的显着更高的表达水平。特别是,低N状况上调GydF4y2BaNPF4.1GydF4y2Ba和GydF4y2BaNPF4.6GydF4y2Ba在新-6表达GydF4y2Ba×GydF4y2Ba分别为21.3-28倍,同时仅略微增强其表达水平2GydF4y2Ba×GydF4y2Ba和图4GydF4y2Ba×GydF4y2Ba的父母。此外,低压低压下调GydF4y2BaNPF2.2GydF4y2Ba和GydF4y2BaNPF2.4GydF4y2Ba在2GydF4y2Ba×GydF4y2Ba和图4GydF4y2Ba×GydF4y2Ba但在neo-6中上调了他们的表达GydF4y2Ba×GydF4y2Ba,表现出由低n抑制表达2而来的即时表达重编程GydF4y2Ba×GydF4y2Ba或4.GydF4y2Ba×GydF4y2Ba父新-6诱导的表达GydF4y2Ba×GydF4y2Ba.在限制性的情况下,较高的表达水平GydF4y2Ba3.GydF4y2Ba-GydF4y2Ba转运体基因可能使新形成的六倍体小麦吸收氮更快。GydF4y2Ba
结论GydF4y2Ba
氮代谢速度生长,发育和适应性反应植物的关键(图GydF4y2Ba5.GydF4y2Ba).植物氮代谢的改变可能会影响多种代谢过程,例如光合作用,光呼吸作用和次级代谢。硝酸盐吸收,NR和GOGAT / GS周期是氮代谢,其驱动N同化和下游代谢过程的三个核心组件(图GydF4y2Ba5.GydF4y2Ba).我们建议,新形成的六倍体显示高得多的氮吸收和-assimilation效率和更大的根生物量具有的N-限制条件下其四倍体母体,这可通过引入基因组DD来实现,固定杂种优势或其他机制进行比较。在这项工作中,我们的文件高吸氮量和异源六倍体合成小麦(图-assimilation效率底层主要生物化学和基因表达调控机制。GydF4y2Ba5.GydF4y2Ba).从进化的角度看,我们的工作可以改善调节普通小麦的适应性更强的机制的理解。我们发现,人工合成小麦的更强的N-缺乏耐受性的原因是它的根的新颖特征。连同以前的研究中,它表明,根功能的创新可能是多倍体的适应性进化,这可能与增强抗逆作物多倍体的养殖影响的重要组成部分。GydF4y2Ba
方法GydF4y2Ba
植物材料GydF4y2Ba
在本研究中,我们利用一个新形成的六倍体小麦品系(allol -960,基因组BBAADD)及其两个亲本和一个天然六倍体小麦(cv。为主要实验生物。allo960是通过杂交aGydF4y2Ba圆锥小麦GydF4y2Ba系(黑鸟,基因组BBAA)与GydF4y2Ba山羊草属tauschiiGydF4y2Baline (30A,基因组DD) [GydF4y2Ba10.GydF4y2Ba].异基因960和其父母的种子是从乔治·费达克(农业与农业食品部,加拿大)提供。在此研究中,使用并标记为异基因960的第六自花授粉几代新6GydF4y2Ba×GydF4y2Ba,其四倍体亲本为4GydF4y2Ba×GydF4y2Ba,其二倍体亲本为2GydF4y2Ba×GydF4y2Ba和天然六倍体小麦(CV.中国春天)作为NAT-6GydF4y2Ba×GydF4y2Ba.在这项工作中,探索新形成的六倍体氮缺乏耐受性的改变的生理机制,我们利用的Allo-960和其确切2GydF4y2Ba×GydF4y2Ba(30A)和4-GydF4y2Ba×GydF4y2Ba(黑鸟)亲本测定基因表达和生理指标。为了检验结果的通用性,我们还使用了另一种方法GydF4y2BaAE。Tauschii.GydF4y2Ba线,两条新形成的六倍体线和4线四倍体,但我们只测量了它们的叶绿素含量来指示的N缺乏耐受性的改变。所有使用的小麦品系中的其他文件中列出了GydF4y2Ba10.GydF4y2Ba:表S1。GydF4y2Ba
应力处理GydF4y2Ba
根据农业土壤可用无机氮的(1至10mm)的典型浓度[GydF4y2Ba24GydF4y2Ba那GydF4y2Ba25GydF4y2Ba那GydF4y2Ba26GydF4y2Ba],我们设置5毫米的NOGydF4y2Ba3.GydF4y2Ba-GydF4y2Ba为对照N条件,0.1 mM为低N胁迫。所有小麦品种的种子都播种在装有彻底洗净的沙子的花盆里。每个花盆包含5株幼苗作为生物复制。所有幼苗均置于温度周期为20-23/13-17°C,昼夜光周期为16/8 h的温室中。用改良的半强度霍格兰营养液(对照,5 mM NOGydF4y2Ba3.GydF4y2Ba-GydF4y2Ba, pH 6.5)胁迫处理前17 d。在此之后(即四叶期前后),在低氮胁迫下,补施缺氮半强的荷格兰溶液(0.1 mM NO .) 7 d或31 dGydF4y2Ba3.GydF4y2Ba-GydF4y2Ba, pH值6.5)。CaClGydF4y2Ba2GydF4y2Ba用于补偿CaGydF4y2Ba2+GydF4y2Ba在低N处理溶液中。GydF4y2Ba
生理指标测定GydF4y2Ba
低于n应激31天后,净光合速率(GydF4y2BaP.GydF4y2BaNGydF4y2Ba),气孔电导(GydF4y2BaGGydF4y2BaS.GydF4y2Ba)和蒸腾速率(GydF4y2BaE.GydF4y2Ba)、PSII效率(ΦPSII)、通过开放PSII中心激发捕获效率(Fv ' /Fm ')和光系统II的最大量子产量(Fv/Fm)根据仪器的协议使用便携式开放流动气体交换系统LI-6400 (LI-COR,美国)进行了测定。光合有效辐射(PAR)为1200 μmol mGydF4y2Ba−2GydF4y2BaS.GydF4y2Ba−1GydF4y2Ba.为了尽量减少植株间的差异,将5株幼苗作为生物重复,所有生化测量至少有4个重复。叶绿素含量的测定方法参照Ni et al. 2008 [GydF4y2Ba27GydF4y2Ba].用氨基酸自动分析仪对干样中的游离氨基酸进行分离和测定[GydF4y2Ba28GydF4y2Ba].总氮含量通过元素分析仪(VARIO EL立方,Elementar公司,德国)测量。GydF4y2Ba
酶活性分析GydF4y2Ba
使用常规方法测定新鲜成熟叶片在相同的叶片位置的酶的酶。汇合了来自五种个体植物的十个成熟叶子作为生物学复制,有四个生物学重复。硝酸还原酶(NR:EC 1.6.1.1),谷氨酰胺合成酶(GS:EC 6.3.1.2)和谷氨酸脱氢酶(NADH-GDH:EC 1.4.1.2和NADPH-GDH:EC 1.4.1.4)的活性进行测量改变了Debouba等人的方法。2006年和泗水等人。2008 [GydF4y2Ba29GydF4y2Ba那GydF4y2Ba30.GydF4y2Ba].用Wu等人的方法测定乙醇酸氧化酶(GO:EC 1.1.3.15)。2013 [GydF4y2Ba31GydF4y2Ba].用新鲜植物组织测定各酶的活性。用1 mL缓冲液(100 mM KH)提取NRGydF4y2Ba2GydF4y2Ba宝GydF4y2Ba4.GydF4y2Ba-NaOH缓冲液pH 7.4,7.5mM的半胱氨酸,和1mM EDTA,1.5%酪蛋白)在4℃下。0.1毫升的上清液在含有0.3毫升的100mM KH反应混合物温育GydF4y2Ba2GydF4y2Ba宝GydF4y2Ba4.GydF4y2Ba-NAOH缓冲液(pH7.4),0.1ml 3mm NADH,0.1ml 100 mm KNOGydF4y2Ba3.GydF4y2Ba30°C, 30分钟。加入0.25 mL磺胺、0.25 mL 0.02% N-(1-萘基)乙二胺二盐酸盐和0.1 mL冰醋酸终止反应。最后在540 nm处测定吸光度。NR活性以μmol NO表达GydF4y2Ba3.GydF4y2Ba-GydF4y2Ba毫克的蛋白质GydF4y2Ba−1GydF4y2BaHGydF4y2Ba−1GydF4y2Ba.GS用1 mL缓冲液提取,缓冲液包含25 mM Tris-HCl (pH 7.6)、1 mM MgCl2、1 mM EDTA、14 mM β -巯基乙醇和1% PVP,在4°C下提取。在含有0.3 mL 250 mM咪唑-盐酸缓冲液(pH 7.0)、0.2 mL 300 mM l -谷氨酸钠、0.2 mL 30 mM ATP-Na的反应混合物中加入0.1 mL上清GydF4y2Ba2GydF4y2Ba, 0.1 mL 500 mM MgSOGydF4y2Ba4.GydF4y2Ba在25℃下10分钟。通过加入0.1mL 1M羟胺盐酸盐,0.4ml溶液(3.3%FECL)停止反应(3.3%GydF4y2Ba3.GydF4y2Ba, 8% TCA和17%HCl),旋转10min。最后,在540 nm处测定反应混合物的吸光度。GS活性以OD值为540 nm mg蛋白表达GydF4y2Ba−1GydF4y2BaHGydF4y2Ba−1GydF4y2Ba.谷氨酸脱氢酶(NADH-和nadph特异性GDH)在4°C下用1 mL提取缓冲液(100 mM pH 8.2 Tris-HCl缓冲液,14 mM β -巯基乙醇,1% PVP)。将0.5 mL上清加入含有0.6 mL 0.2 M Tris-HCl缓冲液(pH 8.0)、0.15 mL 0.1 M α-酮戊二酸钠、0.15 mL 1 M NH的反应混合物中GydF4y2Ba4.GydF4y2BaCl和0.1毫升3mM的NADH(NADPH)。将反应物,接着在340nm处的吸光度的减少的测量。活动表示为微摩尔NADH mg蛋白质GydF4y2Ba−1GydF4y2BaHGydF4y2Ba−1GydF4y2Ba或μmol NADPH mg蛋白GydF4y2Ba−1GydF4y2BaHGydF4y2Ba−1GydF4y2Ba.GO用1mL提取的提取缓冲液含有100mM KHGydF4y2Ba2GydF4y2Ba宝GydF4y2Ba4.GydF4y2Ba-4℃的-NAOH缓冲液(pH8.0)。将0.05ml上清液在含0.5ml 100mm Kh的反应混合物中温育GydF4y2Ba2GydF4y2Ba宝GydF4y2Ba4.GydF4y2Ba-NaOH缓冲液(pH 8.0), 0.1 mL 1 mM FMN, 0.1 mL 50 mM乙醇酸5min。加入0.1 mL 2 M HCl、0.1 mL 1.82 M NaOH、0.33%苯肼盐酸盐和1 mL浓HCl终止反应。在550 nm处测定吸光度。氧化石墨烯活性在μmol乙醛酸mg蛋白中表达GydF4y2Ba−1GydF4y2BaHGydF4y2Ba−1GydF4y2Ba.GydF4y2Ba
测量H.GydF4y2Ba+GydF4y2Ba和不GydF4y2Ba3.GydF4y2Ba-GydF4y2Ba通量GydF4y2Ba
种子播种后在8.5 cm培养皿中发芽3天。培养皿置于生长室内,白天温度为25°C,夜间温度为18°C,光照16 h,光照量为300 μmol mGydF4y2Ba−2GydF4y2Ba·年代GydF4y2Ba−1GydF4y2Ba。然后将年轻的幼苗转移到含有0.1或5mm的半强度Hoagland营养液的培养皿中GydF4y2Ba3.GydF4y2Ba-GydF4y2Ba(pH 6.5)保存7天。低氮胁迫7 d后,净NOGydF4y2Ba3.GydF4y2Ba-GydF4y2Ba和HGydF4y2Ba+GydF4y2Ba通过Xuyue Science和Technology(北京,中国)使用非侵入性扫描离子选择性电极技术(Siet,Siet System Bio-003A,Falmouth,Ma,USA)测量根成熟区表面的助熔剂).从每个基因型随机选择六株植物,将根部转移到含有10ml测量溶液的培养皿中,0.1或5mm NOGydF4y2Ba3.GydF4y2Ba-GydF4y2Ba,并平衡2小时。然后将根部转移到含有0.1或5mm NO的新鲜测量溶液的新培养皿中GydF4y2Ba3.GydF4y2Ba-GydF4y2Ba,净HGydF4y2Ba+GydF4y2Ba和不GydF4y2Ba3.GydF4y2Ba-GydF4y2Ba监测通量8分钟。h的测量溶液GydF4y2Ba+GydF4y2Ba助焊剂由0.1 mm KCl和0.1mm CaCl组成GydF4y2Ba2GydF4y2BapH为6.0时,测定溶液中NOGydF4y2Ba3.GydF4y2Ba-GydF4y2Ba焊剂组成为0.1mM的CaClGydF4y2Ba2GydF4y2Ba在pH 6.0中和0.3毫米MES。GydF4y2Ba
实时存在GydF4y2Ba
在低氮条件下生长7 d后,采收叶片和根系,用TRIzol试剂(Invitrogen)提取总RNA。新6×的5株单株作为5个生物重复,其余3个株系将3株单株合并为3-4个生物重复。RNA经dnase (Invitrogen)处理后,用SuperScriptTM RNase H-Reverse Transcriptase (Invitrogen)进行逆转录,然后用基因特异性引物进行qRT-PCR分析(附文件)GydF4y2Ba11.GydF4y2Ba:表S2)。GydF4y2Ba施GydF4y2Ba那GydF4y2Ba扶轮领导学院(RLI)GydF4y2Ba和GydF4y2BaGAPDH.GydF4y2Ba在测定中用作标准化的对照基因[GydF4y2Ba32GydF4y2Ba那GydF4y2Ba33GydF4y2Ba那GydF4y2Ba34GydF4y2Ba].NPF基因和NRT2基因的表达与来自先前研究的引物序列测定[GydF4y2Ba34GydF4y2Ba那GydF4y2Ba35GydF4y2Ba],并使用计算出的GydF4y2Ba△GydF4y2Ba△GydF4y2BaCT方法[GydF4y2Ba36GydF4y2Ba].GydF4y2Ba
统计分析GydF4y2Ba
使用统计程序SPSS 13.0(SPSS,芝加哥,USA)进行统计分析。所有的数据都是从3到7个生物重复。统计显着性的确定GydF4y2Bat -GydF4y2Ba测试。GydF4y2Ba
缩写GydF4y2Ba
- 车:GydF4y2Ba
-
类胡萝卜素GydF4y2Ba
- chl:GydF4y2Ba
-
叶绿素GydF4y2Ba
- E.GydF4y2Ba:GydF4y2Ba
-
蒸腾速率GydF4y2Ba
- GDH:GydF4y2Ba
-
谷氨酸脱氢酶GydF4y2Ba
- 走:GydF4y2Ba
-
乙醇酸氧化酶GydF4y2Ba
- GS:GydF4y2Ba
-
谷氨酰胺合成酶GydF4y2Ba
- GGydF4y2BaS.GydF4y2Ba:GydF4y2Ba
-
气孔导度GydF4y2Ba
- NR:GydF4y2Ba
-
硝酸还原酶GydF4y2Ba
- NRT:GydF4y2Ba
-
硝酸盐转运体GydF4y2Ba
- P.GydF4y2BaNGydF4y2Ba:GydF4y2Ba
-
净光合速率GydF4y2Ba
参考文献GydF4y2Ba
- 1。GydF4y2Ba
温德尔JF。基因组进化的多倍体。植物mol biol。2000; 42:225-49。GydF4y2Ba
- 2.GydF4y2Ba
陈ZJ。遗传和表观遗传机制的基因表达和在植物多倍体的表型变异。Annu Rev植物Biol。2007; 58:377。GydF4y2Ba
- 3.GydF4y2Ba
焦友,WICKETT NJ,Ayyampalayam S,Chanderbali As,Landerher L,Ralph Pe,Lynn P,Tomsho LP,Hu Y,Liang H等人。种子植物和贪眼的祖先多倍体。自然。2011; 473:97-100。GydF4y2Ba
- 4.GydF4y2Ba
凯洛格ea。实际上有多倍体和多样化之间的连接吗?CURR OPIN植物生物学。2016; 30:25-32。GydF4y2Ba
- 5.GydF4y2Ba
Kashkush K,费尔德曼男,利维AA。基因丢失,沉默和激活的新合成小麦异源四倍体。遗传学。2002; 160:1651-9。GydF4y2Ba
- 6。GydF4y2Ba
皮尔斯IS,KrügelT,鲍德温IT。在neopolypoloidy-瞬时形态的功能性后果创新抗食草动物防御系统。植物杂志2006; 47:196-210。GydF4y2Ba
- 7。GydF4y2Ba
陈志强,王志强,王志强,等。异源多倍体对光胁迫的越界生理和转录组反应GydF4y2Ba甘氨酸dolichocarpaGydF4y2Ba(豆科)。遗传。2013;110:160 - 70。GydF4y2Ba
- 8。GydF4y2Ba
超DY,Dilkes B,罗H,道格拉斯A,Yakubova E,Lahner B,盐DE。多倍体表现出更高的钾摄取和耐盐性在GydF4y2Ba拟南芥GydF4y2Ba.科学。2013; 341:658-9。GydF4y2Ba
- 9。GydF4y2Ba
伦辛SA。基因复制植物形态进化的驱动程序。CURR OPIN植物生物学。2014; 17:43-8。GydF4y2Ba
- 10。GydF4y2Ba
杨超,赵林,张海涛,杨振华,王海涛,文胜,张超,张超,刘斌。六倍体小麦对盐胁迫的生理响应。美国国立科学院。2014; 111:11882-7。GydF4y2Ba
- 11.GydF4y2Ba
栽培小麦多倍体的进化:驯化、自然杂交和异源多倍体物种形成在其多样化中的作用。植物生理学杂志。2011;52:750-64。GydF4y2Ba
- 12.GydF4y2Ba
彭建华,孙东,Nevo E.小麦驯化进化、遗传和基因组学研究。摩尔繁殖。2011;28:281 - 301。GydF4y2Ba
- 13.GydF4y2Ba
乐然S,Varala K,博耶C,Chiurazzi男,克劳福德N,丹尼尔-Vedele女,大卫L,迪克斯坦R,Fernandez的E,弗勒B,等人。硝酸盐转运1 /肽转运家族成员在植物统一命名。趋势植物SCI。2014; 19:5-9。GydF4y2Ba
- 14.GydF4y2Ba
王志强,王志强,王志强,等。硝酸盐转运与信号转导。J Exp Bot. 2007; 58:2297-306。GydF4y2Ba
- 15.GydF4y2Ba
纂YF,邱CC,蔡CB,何CH,许PK。硝酸盐转运蛋白和肽转运蛋白。费用。2007; 581:2290-300。GydF4y2Ba
- 16。GydF4y2Ba
DechorgnatĴ,阮CT,Armengaud P,Jossier男,Diatloff E,Filleur S,丹尼尔-Vedele F.从土对种子:硝酸盐在植物中的长途旅行。J Exp Bot。2011; 62:1349至1359年。GydF4y2Ba
- 17。GydF4y2Ba
高凯,陈芳,袁磊,张峰,米国。低氮胁迫下玉米根系形态变化和氮素分配的综合分析。植物学报。2015;38:740-50。GydF4y2Ba
- 18。GydF4y2Ba
Saengwilai P, Nord EA, Chimungu JG, Brown KM, Lynch JP。玉米根皮层通气组织促进低氮土壤氮素的吸收。植物杂志。2014;166:726-35。GydF4y2Ba
- 19。GydF4y2Ba
Cormier F,Foulkes J,Hirel B,Gouache D,Moënne-loccoz y,Gouis JL。增加氮利用效率的育种:小麦审查(GydF4y2BaT. Aestivum.GydF4y2BaL.)。植物品种。2016; 135:255-78。GydF4y2Ba
- 20.GydF4y2Ba
刘东,张磊,郝明,宁胜,袁智,戴胜,黄磊,吴斌,闫昭,兰旭,郑勇。中国春之乡小麦育种研究。作物j . 2018; 6:82 - 90。GydF4y2Ba
- 21。GydF4y2Ba
罗建军,李华,刘涛,彭成,罗志华。两种对照杨树氮素代谢对氮素有效性的影响。J Exp Bot. 2013; 64:4207-24。GydF4y2Ba
- 22。GydF4y2Ba
克劳福德NM,玻璃ADM。分子在植物硝酸盐吸收的生理方面。趋势植物SCI。1998; 3:389-95。GydF4y2Ba
- 23。GydF4y2Ba
米勒AJ,史密斯SJ。谷物根细胞中的硝酸盐和隔室。J Exp Bot。1998年; 47:843-54。GydF4y2Ba
- 24.GydF4y2Ba
Xu G,风扇X,Miller AJ。植物氮素同化和利用效率。annu转速植物生物。2012; 63:153-82。GydF4y2Ba
- 25.GydF4y2Ba
玻璃ADM。对氮的吸收生理约束:作物植物的氮利用效率。暴击启植物科学。2003; 22:453-70。GydF4y2Ba
- 26.GydF4y2Ba
Crawford nm,forde bg。无机氮营养的分子与发育生物学。拟南芥书。2002; 1:E0011。GydF4y2Ba
- 27.GydF4y2Ba
倪Z,金ED,哈M.改变的昼夜节律调节混合动力车和异源多倍体的增长活力。自然。2008; 457:327-31。GydF4y2Ba
- 28。GydF4y2Ba
赵志刚,王志刚,王志刚,等。氮的吸收与代谢GydF4y2Ba杨树×canescensGydF4y2Ba受盐度的影响。新植物。2006; 173:279-93。GydF4y2Ba
- 29。GydF4y2Ba
Debouba男,Gouia H,铃木A,Ghorbel MH。对番茄涉及氮同化途径的酶的NaCl应力效应“GydF4y2BaLycopersicon esculentumGydF4y2Ba“幼苗。J植物理性。2006; 163:1247-58。GydF4y2Ba
- 30.GydF4y2Ba
两种高产桑树基因型氮素代谢关键酶的调控GydF4y2Ba桑属阿尔巴GydF4y2Ba对盐胁迫有不同的敏感性。环境Exp Bot. 2008; 64:171-9。GydF4y2Ba
- 31.GydF4y2Ba
吴T,顾S,周H.天然和异国情调的潮汐木质幼苗光合和生理反应模拟潮汐浸渍。estuar沿海架子S. 2013; 135:280-4。GydF4y2Ba
- 32.GydF4y2Ba
拉威尔C,Martre P,Romeuf I,Dardevet男,埃尔 - 马勒基R,博尔德Ĵ,DUCHATEAU N,布鲁内尔d,Balfourier楼Charmet G.核苷酸多态性在小麦转录激活温泉影响其表达模式,并且对多效性作用谷物蛋白的组合物,面团的粘弹性,和籽粒硬度。植物理性。2009; 151:2133-44。GydF4y2Ba
- 33。GydF4y2Ba
希门尼斯MJ,活塞楼阿蒂恩萨SG。在比较转录的合适的参考基因用于qPCR数据的归一化识别在分析GydF4y2BaTriticeaeGydF4y2Ba.足底。2011;233:163 - 73。GydF4y2Ba
- 34。GydF4y2Ba
郭T,轩汉,杨Y,王L,魏L,王Y,康G.在氮饥饿期间编码小麦根转运者NRT1和NRT2家族的基因转录分析。J工厂增长调节。2014; 33:837-48。GydF4y2Ba
- 35。GydF4y2Ba
Buchner P,Hawkesford MJ。小麦硝酸盐转运蛋白1 /肽转运蛋白家族(NPF)成员的复杂系统发育和基因表达模式。J Exp Bot。2014; 19:5697-710。GydF4y2Ba
- 36.GydF4y2Ba
Livak KJ,Schmittgen TD。使用实时定量PCR和2的相对基因表达数据分析(-Delta Delta C(T))方法。方法。2001; 25:402-8。GydF4y2Ba
确认GydF4y2Ba
我们感谢George Fedak博士(农业和农业和粮食加拿大),为合成的Allohexaploid小麦(Allo-960)及其亲本系的初始种子提供初始种子。GydF4y2Ba
资金GydF4y2Ba
这项工作是由中国国家自然科学基金(编号31670218和31300192)和吉林省政府的科技发展规划的青年科学基金(编号20160520062JH)的支持。GydF4y2Ba
作者信息GydF4y2Ba
从属关系GydF4y2Ba
贡献GydF4y2Ba
实验设计及手稿撰写:CY、ZY、BL。数据分析:CY、FS;生理实验:CY、ZY、LZ。基因表达实验:ZY。所有作者阅读并批准了最终的手稿。GydF4y2Ba
相应的作者GydF4y2Ba
道德声明GydF4y2Ba
伦理批准和同意参与GydF4y2Ba
不适用。GydF4y2Ba
利益争夺GydF4y2Ba
提交人声明他们没有竞争利益。GydF4y2Ba
出版商的注意GydF4y2Ba
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。GydF4y2Ba
附加文件GydF4y2Ba
附加文件1:GydF4y2Ba
图S1。GydF4y2Ba低N条件对新成立六倍体六倍体生长状态的影响(NEO-6GydF4y2Ba×GydF4y2Ba),其二倍体(2GydF4y2Ba×GydF4y2Ba)和四倍体(4GydF4y2Ba×GydF4y2Ba)父母和天然allohexaploid(NAT-6GydF4y2Ba×GydF4y2Ba).幼苗在低氮(0.1 mM)条件下培养28 d。(JPG 749 KB)GydF4y2Ba
额外的文件2:GydF4y2Ba
图S2。GydF4y2Ba低氮条件对新形成六倍体(neo-6 .GydF4y2Ba×GydF4y2Ba),其二倍体(2GydF4y2Ba×GydF4y2Ba)和四倍体(4GydF4y2Ba×GydF4y2Ba)父母和天然allohexaploid(NAT-6GydF4y2Ba×GydF4y2Ba).幼苗在低氮(0.1 mM)条件下培养28 d。低氮条件下,4个小麦品系间叶片下部第二叶片表现出明显差异。(TIF 7026 kb)GydF4y2Ba
额外的文件3:GydF4y2Ba
图S3。GydF4y2Ba低氮条件对新形成六倍体(neo-6 .GydF4y2Ba×GydF4y2Ba),其二倍体(2GydF4y2Ba×GydF4y2Ba)和四倍体(4GydF4y2Ba×GydF4y2Ba)父母和天然allohexaploid(NAT-6GydF4y2Ba×GydF4y2Ba).在低氮(0.1 mM)条件下培养31 d。FGydF4y2BaV.GydF4y2Ba'/FGydF4y2BamGydF4y2Ba’,开放式PSII中心激励捕获效率;FGydF4y2BaV.GydF4y2Ba/FGydF4y2Ba米,GydF4y2Ba光系统II的最大量子产率GydF4y2Ba.GydF4y2Ba星号表示显着差异(GydF4y2BaT.GydF4y2Ba测试,GydF4y2BaP.GydF4y2Ba< 0.05)。(TIF 859 kb)GydF4y2Ba
额外的文件4:GydF4y2Ba
图S4。GydF4y2Ba低N条件对合成六倍体麦叶绿素和类胡萝卜素含量(BBAADD基因组),二倍体(DD基因组)和四倍体麦(BBAA基因组)的影响。二倍体小麦:TQ18;新形成(合成)六倍体麦:AT5,Allo-960和Eli 13;四倍体麦:37a,altar81,黑鸟,机器人和ttr04。在低氮(0.1 mM)条件下培养31 d。值是三种生物重复的方法。星号表示显着差异(GydF4y2BaT.GydF4y2Ba测试,GydF4y2BaP.GydF4y2Ba< 0.05)。(TIF 1779 KB)GydF4y2Ba
额外的文件5:GydF4y2Ba
图S5。GydF4y2Ba低氮条件对新六倍体(neo-6 .)氮素同化酶活性的影响GydF4y2Ba×GydF4y2Ba),其二倍体(2GydF4y2Ba×GydF4y2Ba)和四倍体(4GydF4y2Ba×GydF4y2Ba)父母和天然allohexaploid(NAT-6GydF4y2Ba×GydF4y2Ba).这些值是四个生物复制的平均值。星号表示显着差异(GydF4y2BaT.GydF4y2Ba测试,GydF4y2BaP.GydF4y2Ba< 0.05)。在相同的N条件下,对所有四行中任意两行的平均值进行比较GydF4y2BaT.GydF4y2Ba测试 (GydF4y2BaP.GydF4y2Ba < 0.05), and means followed by different letters at the same N condition are significant. The seedlings were subjected to low N condition (0.1 mM) for 31 days. NR, nitrate reductase; GS, glutamine synthetase; GDH, glutamate dehydrogenase; and GO, Glycolate oxidase. (TIF 1582 kb)
附加文件6:GydF4y2Ba
图S6。GydF4y2Ba低氮条件下枝条氨基酸变化百分率与对照比较。百分比按(对照-治疗)*100%/对照计算。新形成的六倍体(新6GydF4y2Ba×GydF4y2Ba),其二倍体(2GydF4y2Ba×GydF4y2Ba)和四倍体(4GydF4y2Ba×GydF4y2Ba)父母和天然allohexaploid(NAT-6GydF4y2Ba×GydF4y2Ba低氮(0.1 mM)处理31 d。(TIF 4881 kb)GydF4y2Ba
附加文件7:GydF4y2Ba
图S7。GydF4y2Ba在新形成的六倍体小麦的根的低N条件对氨基酸的含量(NEO-6GydF4y2Ba×GydF4y2Ba),其二倍体(2GydF4y2Ba×GydF4y2Ba)和四倍体(4GydF4y2Ba×GydF4y2Ba)父母和天然allohexaploid(NAT-6GydF4y2Ba×GydF4y2Ba).这些值是四个生物复制的平均值。星号表示显着差异(GydF4y2BaT.GydF4y2Ba测试,GydF4y2BaP.GydF4y2Ba< 0.05)。在相同的N条件下,对所有四行中任意两行的平均值进行比较GydF4y2BaT.GydF4y2Ba测试 (GydF4y2BaP.GydF4y2Ba< 0.05),且相同N条件下不同字母后的平均值显著。在低氮(0.1 mM)条件下培养31 d。(TIF 1585 kb)GydF4y2Ba
附加文件8:GydF4y2Ba
图S8。GydF4y2Ba与对照条件相比,低n条件下根部氨基酸的百分比百分比。根据(对照处理)计算百分比(对照处理)* 100%/对照。新形成的六倍体(新6GydF4y2Ba×GydF4y2Ba),其二倍体(2GydF4y2Ba×GydF4y2Ba)和四倍体(4GydF4y2Ba×GydF4y2Ba)父母和天然allohexaploid(NAT-6GydF4y2Ba×GydF4y2Ba低氮(0.1 mM)处理31 d。(TIF 4448 KB)GydF4y2Ba
附加文件9:GydF4y2Ba
图S9。GydF4y2Ba低氮条件对新形成的六倍体(neo-6 .GydF4y2Ba×GydF4y2Ba),其二倍体(2GydF4y2Ba×GydF4y2Ba)和四倍体(4GydF4y2Ba×GydF4y2Ba)父母和天然allohexaploid(NAT-6GydF4y2Ba×GydF4y2Ba).值是3-5生物复制的手段。星号表示显着差异(GydF4y2BaT.GydF4y2Ba测试,GydF4y2BaP.GydF4y2Ba< 0.05)。在相同的N条件下,对所有四行中任意两行的平均值进行比较GydF4y2BaT.GydF4y2Ba测试 (GydF4y2BaP.GydF4y2Ba< 0.05),且相同N条件下不同字母后的平均值显著。将幼苗进行低N条件(0.1mm)7天。(TIF 1508 KB)GydF4y2Ba
额外的文件10:GydF4y2Ba
表S1。GydF4y2Ba在这项工作中使用的小麦系(XLSX 11 kb)GydF4y2Ba
其他文件11:GydF4y2Ba
表S2GydF4y2Ba.q-RT-PCR分析引物。(XLSX 11 kb)GydF4y2Ba
权利和权限GydF4y2Ba
开放获取GydF4y2Ba本文根据创意公约署署署的条款分发了4.0国际许可证(GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)适用于本条提供的数据,除非另有说明。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
杨超,杨志强,赵磊。GydF4y2Ba等等。GydF4y2Ba新形成的六倍体小麦对缺氮的耐受性立刻高于其亲本。GydF4y2BaBMC植物杂志GydF4y2Ba18,GydF4y2Ba113(2018)。https://doi.org/10.1186/s12870-018-1334.1.GydF4y2Ba
收到了GydF4y2Ba:GydF4y2Ba
公认GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
DOIGydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-018-1334.1.GydF4y2Ba
关键词GydF4y2Ba
- 小麦GydF4y2Ba
- 氮上升GydF4y2Ba
- 硝酸盐转运体GydF4y2Ba
- AllopolyploidyGydF4y2Ba
- 基因表达GydF4y2Ba
- 适应GydF4y2Ba