抽象的
背景
虽然高粱基因组草案是可用的,但由于缺乏广泛的突变资源,对基因功能的了解是有限的。病毒诱导基因沉默是研究基因功能的一种替代突变资源。本研究报告了一种改进和有效的方法布罗姆花叶病毒(BMV)在高粱中基于Vigs。
方法
用磨削2g感染制备的SAP接种高粱植物尼古利亚娜·宾夕法尼亚州叶子在1毫升10毫米磷酸钾缓冲液(pH 6.8)和100毫克碳化硅磨料。汁液被涂在两到三片高粱叶子上。接种的植物被一个圆顶覆盖以保持高湿度,并在18°C的黑暗中保存两天。接种后转入18°C生长室,光照/暗循环12 h。
结果
本研究表明,通过在18℃下孵育植物,高粱的BMV感染率可以显着增加。观察到高粱基因型/品种的BMV感染率大幅度变化,BTX623是最敏感的。泛素(UBIQ.)沉默是高粱VIGS较好的视觉标记镁切酶亚单位H.(CHLH.) 和植物去脱离酶(PDS).发现在BMV中使用基因的反义链显着提高高粱中Vigs的效率和程度。原位杂交实验表明,高粱的不均匀沉默是由于病毒传播不均匀造成的。本研究进一步证明了在高粱花序中基因也可以被沉默。
结论
一般来说,高粱植株很难被BMV感染,因此难以进行VIGS研究。然而,利用BMV作为载体,利用BMV敏感高粱品种、18°C孵育植物和目的基因片段的反义链,仍然可以在高粱中实现高效的VIGS。
背景
植物科学家目前面临的一个挑战是在不断变化的环境中利用有限的资源(如水和肥沃的土地)提高植物生产力。高粱(高粱双色(L.)Moench。]可以在夏季温度高于20°C以上的干气条件下生长[1那2].高粱是草科C4一年生作物,具有光合效率高的特点。谷物型、甜型和饲用型高粱都符合当前的农业生产体系。高粱是仅次于水稻、小麦、玉米和大麦的第五大谷类作物[2],年产量从植物面积为4500万公顷的年产约6550万吨[3.].高粱为食物种植,为牲畜和燃料饲料。这是30个国家的500万人的食物来源[2].近80%的高粱种植地区在发展中国家[2].然而,根据联合国粮农组织的数据,2014年美国是高粱的最大生产国,其次是墨西哥、尼日利亚、苏丹和印度[3.].高粱生产受近150种害虫,真菌,病毒和寄生杂草的影响[2].此外,高粱暴露于各种非生物胁迫,因为它主要是在边缘地上种植[2].对高粱基因功能的研究将有助于提高高粱植株的生产力,提高其对生物和非生物胁迫的抵抗力。
高粱的全基因组序列(BTx623)可用于识别控制理想性状和促进分子育种的基因序列(www.phytozome.net/sorghum) [4.那5.].然而,验证基因的预测作用至关重要。高粱只有少数突变体收集可用:一个大规模的乙基甲烷磺酸诱变文库,有近5000个株系[6.]和5,466γ射线诱导的突变体M2线[7.].这些线的大多数都是无表征的,因此在高粱中的基因功能的理解远未完成。
病毒诱导的基因沉默(Vigs)是一种快速且稳健的方法,用于评估基因或多个基因的瞬态转录后基因沉默的功能[8.].VIGS机制依赖于参与病毒RNA降解的植物抗病毒防御[9.那10].对于VIGS,一个植物基因片段被插入到病毒基因组中。Dicer-like protein (DCL)可产生针对病毒基因组和插入植物基因序列的小干扰(si) rna。siRNA与RNA诱导沉默复合体(RISC)整合,以病毒RNA和特定植物mRNA为靶点进行降解[11].
VIGS成功的两个关键因素是:1)病毒侵染植物的能力;2)植物在对生长发育影响有限的情况下保护自己免受病毒侵害的能力。几种VIGS载体系统可用于沉默双子叶植物和单子叶植物的基因[8.那12那13那14].针对单子叶植物,已开发了不同的VIGS载体系统布罗姆花叶病毒(BMV; [15]),大麦条纹马赛克病毒(BSMV;16那17]),竹花叶病毒[18],Cymbidium Mosaic病毒[19],黄瓜马赛克病毒[20.],狐尾镶嵌病毒[21.那22.], 和稻屯鳞病毒[23.].
我们测试了两个Vigs Vector Systems,BMV和BSMV,以高粱沉默基因。丁等人。[15]开发了基于BMV的Vigs载体向单子古氏菌中的沉默基因。几项研究将基于BMV基于Bmv的Vigs在大麦中的沉默基因[15],玉米[15], 白饭 [15],季(高弗雷斯)[24.,高粱[25.那26.].然而,报告的基于BMV的BMV用于沉默基因的方法在高粱中使用Vigs的沉默是麻烦的,并且不是非常低的沉默频率效率。BSMV用于大麦的沉默基因[16那27.)、小麦(27.那28.]和在尼古利亚娜·宾夕法尼亚州[29.,但没有报道对高粱的基因沉默。本文报道了一种利用VIGS高效沉默高粱基因的改进方法。通过对多个参数的比较,确定了高粱高效VIGS的最佳环境条件、标记基因、VIGS载体和高粱品种。
结果
一种改良的、简单有效的将病毒导入高粱的方法
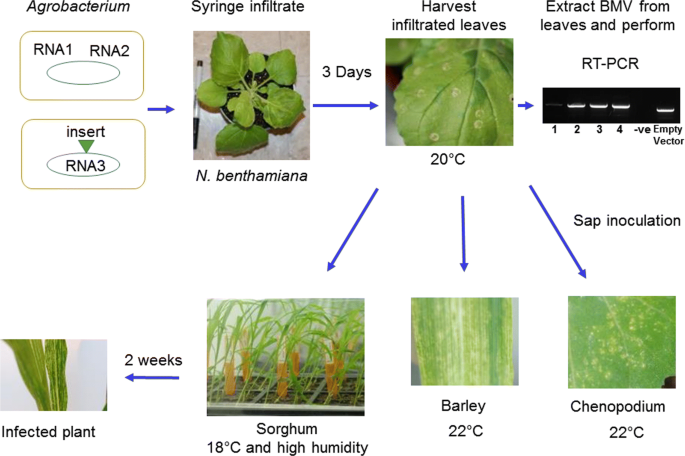
基于bmv的VIGS载体[15已成功地习惯于沉默基因,以在玉米(如玉米)中的功能性表征[15那30.那31.],大麦[15,和大米[15].以前的方法[25.那26.在我们的实验室中用于高粱的VIGS不是很有效,而且需要体外RNA的合成,既麻烦又昂贵。在这里,一个更简单和便宜的方法使用农杆菌- 基于BMV-VIGS的载体[32.那33.]用于沉默高粱中的基因。BMV基因组由三个正链RNA(RNA 1 [3.2kb],RNA 2 [2.9kb]和RNA 3 [2.1kb])制成。对于Vigs,RNA 1和RNA 2被克隆到一个农杆菌二进制载体和RNA 3转化为另一个[32.].如前所述,一个植物基因片段被插入RNA 3中[15].我们采用了之前在玉米中使用的基于BMV的VIGS方法[33.].简单地说,这两个农杆菌将含有RNA 1,RNA 2和RNA 3的菌株生长至1.5 o.d600并以相等的量混合,以渗入三周的叶子n benthamiana植物的病毒增殖(图。1).感染了n benthamiana感染后4天收获叶子,并将SAP提取或储存在-80℃。感染的水肿n benthamiana是用来接种的chenopodium.、大麦和高粱等植物。
低温高粱对BMV的耐受性降低
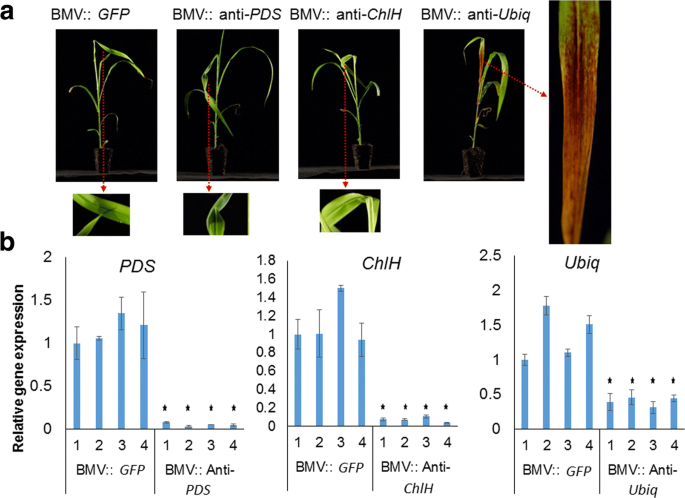
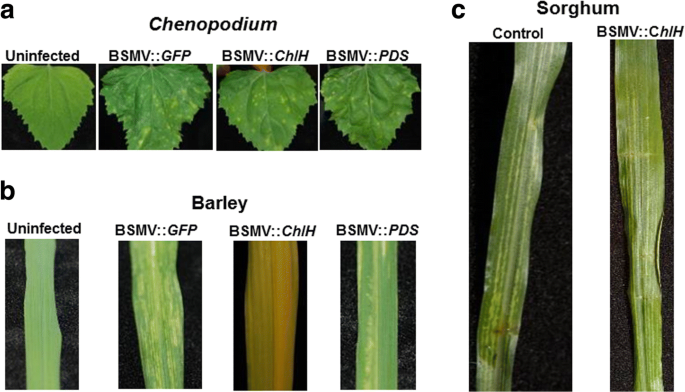
成功Vigs的一个重要因素是病毒在植物内感染和蔓延的能力。与大麦和玉米相反,在我们的温室条件下,在22℃下BMV感染后,我们无法在高粱中看到高频率的可见病毒症状(图。2A).BMV-GFP.接种玉米和大麦的系统叶片在22°C时出现了广泛的白色条纹(图2)。2A).GFP.序列与植物DNA不具有同源性,因此不会引起植物的基因沉默。白色或黄色条纹是由于BMV感染的常见症状。然而,在22℃下,只有10%的高粱(BTx623系)在系统叶片上产生有限的白色条纹。此外,用BMV VIGS构建的片段接种BMVGFP.或SBCHLH., 要么SbPDS高粱基因在22℃下不能产生任何病毒症状或基因沉默。在这项研究中,GFP.基因片段作为阴性对照,未发现同源的植物序列GFP..这些构建体在感染时产生病毒症状chenopodium.和22°C的大麦表明构建体是传染性的(图。2B.).有趣的是,所有BMV接种的BTX623高粱植物(100%)在BMV接种之前在18℃下保持在18℃并在BMV接种后三周(图。2B.).高粱植物中感染症状的程度变化。这些结果表明,在低温(18°C)下孵育的高粱植物在BMV攻击后呈现更好的症状,而不是22℃。尽管在18°C时病毒症状,高粱植物并没有显示任何视觉CHLH.或PDS沉默的症状。
泛素在高粱中是一个更好的标记
这植物去脱离酶(PDS) 和镁切酶亚单位H.(CHLH.)沉默在许多植物物种中被普遍用作vigs介导的基因沉默的可见标记[29.那34.].高粱的反义股CHLH.或PDS本研究利用bmv介导的VIGS基因片段检测高粱(图。3.).将这些结构体接种到高粱上,在18°C下,我们清楚地观察到病毒症状(白色条纹),表明在高粱上成功感染。令人惊讶的是,我们没有注意到树叶变白了PDS在BMV :: Anti-中沉默PDS因造成植物或叶子的变黄CHLH.在BMV :: Anti-中沉默CHLH.接种植物(图。3A).然而,实时定量RT-PCR(QRT-PCR)数据明显地显示了转录物水平的减少CHLH.或PDSBMV :: ANT-CHLH.或BMV::反PDS分别接种植物(图。3B.).微弱的沉默症状可能被掩盖,因为白色条纹观察到由于BMV::GFP.病毒感染与PDS或CHLH.沉默的症状。因此,我们得出结论PDS或CHLH.基因沉默并不是衡量高粱基因沉默效率的良好视觉标记。
泛素SUSENDING是高粱中VIGS更好的标记。高粱植物用BMV Vigs构建体接种沉默CHLH.那PD,或UBIQ.基因。一种只有BMV::反UBIQ.接种过的植株有一个与对照不同的可见表型(BMV::GFP.).将每个病毒载体接种在10个高粱幼苗上。在所有幼苗中观察到类似的结果。这里示出了代表性图像。B.使用QRT-PCR从接种高粱接种叶片的第二叶中提取RNA,用于基因表达分析。表达PDS那CHLH.,UBIQ.在BMV ::抗议中显着较低PDS,BMV :: ANT-CHLH., BMV::反UBIQ.分别与对照植物相比(BMV ::GFP.).误差棒表示三次重复的标准偏差。样本由学生进行分析T.测试。星号表示与P≤0.01的对照相比的统计学上有显着差异
为了识别高粱植物中vigs更好的视觉标记,我们开发了一个带有片段的BMV-Vigs构建体泛素(UBIQ.)基因。我们选择沉默UBIQ.因为它是植物发育的关键蛋白,因此沉默该基因有望产生视觉表型。部分减少UBIQ.在大麦中瞬态基因沉默的转录物已被证明引起细胞死亡[35.].除了GFP.(对照)经qRT-PCR检测,所有基因结构均能沉默目的基因。3B.).然而,只观察到由于沉默引起的可见表型UBIQ.沉默的植物显示褐变(图。3A).因此,我们得出结论,在所有不同的沉默标志中,UBIQ.是高粱中对VIGS最好的视觉标记。
反义链的UBIQ.比Vists Strand更高效
在BMV Vigs载体中插入基因的反义链使得与在大麦中使用有义股线相比,更大程度地沉默[36.那37.].在其他研究中,基因的意义或反义链导致大麦和小麦中基于bsmv的VIGS水平相似[17那38.].这促使我们比较了Vigs的效率与反义股。我们使用高粱的感觉或反义产生了Vigs构建UBIQ.基因。同样的高粱206bp片段UBIQ.选择基因以发展感觉和反感构建体。选择的序列对其他序列具有较少的同源性UBIQ.高粱的基因家族成员。
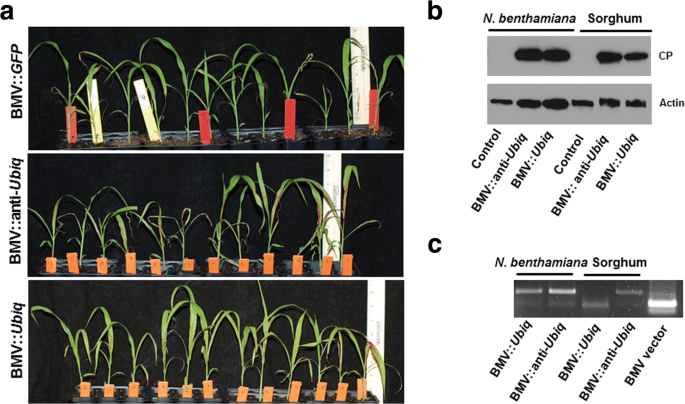
高粱植株感染BMV::UBIQ.(感觉链)或BMV :: Anti-UBIQ.(反义条)由于泛素沉默(图。4A).然而,BMV ::抗叶片的棕色着色更广泛UBIQ.与BMV相比接种::UBIQ.接种高粱(图。4A).在100%的BMV ::抗 - 抗褐色观察到褐变UBIQ.感染植物,而BMV ::仅73%::UBIQ.受感染的植物。我们进一步量化了感染人群的BMV水平n benthamiana用于接种高粱植物(图。4B.).在Western印迹中使用对BMV的外套蛋白质的抗体进行量化以量化病毒。当标准化为肌动蛋白蛋白质时,BMV的水平相对较多,在BMV ::UBIQ.与bmv :: antive相比感染UBIQ.已感染n benthamiana植物(图。4B.和附加文件1:图S1)。类似的数量n benthamiana叶片SAP用于接种高粱。但是,BMV ::禁止BMV金额UBIQ.与BMV ::相比,接种高粱植物略微(归一化后〜25%)更多UBIQ.接种植物(图。4B.和附加文件1:图S1)。
当基因片段的反义链被用于沉默时,BMV VIGS的效率更高。以两周生长期的高粱为材料,接种含BMV的山楂树液n benthamiana.一种BMV ::UBIQ.和BMV :: ANT-UBIQ.受感染的植物具有不同程度的UBIQ.沉默。在BMV::anti-中沉默的程度更严重UBIQ.受感染的植物。这个实验重复了三次,得到了相似的结果。B.采用抗BMV外壳蛋白抗体的western blot方法分析BMV水平。BMV水平在感染BMV的高粱植物中更多:抗 -UBIQ.与bmv ::UBIQ..CRT-PCR检测BMV RNA3基因片段的存在。用BMV::抗感染的高粱中存在插入的BMVUBIQ.但在高粱中没有检测到BMV ::UBIQ..在RT-PCR和western blot中,三片叶子n benthamiana每个样本收集20株高粱植株来提取病毒
此外,存在的存在UBIQ.基因片段(插入)中的BMV Vigs矢量分离n benthamiana和高粱接种植物进行了测试。使用特异于BMV RNA 3的引物进行RT-PCR,侧翼插入部位。在n benthamiana,与插入件的病毒更像没有BMV ::UBIQ.和BMV :: ANT-UBIQ.受感染的植物。在高粱中,BMV :: Allet的病毒更多地在BMV ::抗 -UBIQ.与BMV ::相比,接种植物UBIQ.接种植物。有趣的是,没有插入物的病毒在接种BMV的高粱植株中更多::UBIQ..这些结果表明,在高粱,反义束UBIQ.片段比BMV Vigs载体中的感觉链更稳定。然而,将需要更多与其他基因片段的实验得出结论,反义链将更有效地在高粱中vigs。
BTx623是一种适合bmv基VIGS的高粱品种
如上所述,VIGS的一个重要要求是病毒在给定植物中感染和繁殖的能力。高粱被BMV感染的频率,特别是在22O.C及以上,非常低。我们推测,在不同的基因型/品种高粱中可能存在重新分析对BMV感染的变化。因此,筛选了67个高粱基因型/品种以鉴定BMV的高易感基因型/品种。两周的老高粱植物被BMV接种擦伤::GFP..摩擦接种前3天,将植株置于生长室,18℃,光照/暗循环12/12 h。接种后,植株在18°C保存4周。接种后4周,对系统叶片(摩擦接种叶片上方的2片叶片)进行白条纹检查(BMV感染症状)。已记录显示感染症状的接种植物的百分比(附加文件)2:表S1)。选择6个对BMV有不同程度敏感性的基因型/品种接种BMV进行复检:GFP.和BMV :: ANT-UBIQ.(表1).通过筛选,BTx623被确定为对BMV和BMV结构最敏感的品种(见表)1).
高粱的不均匀沉默与BMV在染病叶片中的不均匀分布有关
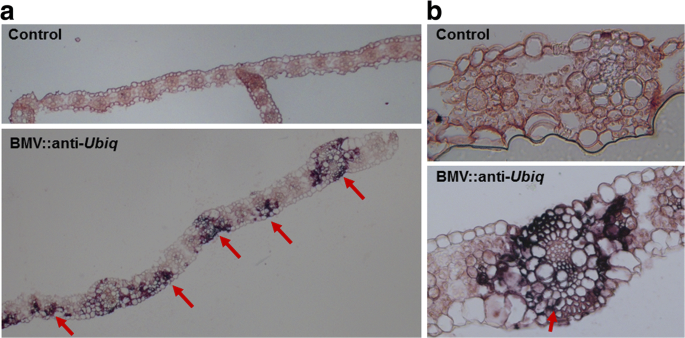
基因的一致沉默在叶中被观察到n benthamiana通过烟草使病毒基于Vigs [34.];在大豆的叶子中,n benthamiana和豌豆(Pisum一) 经过苹果潜在球面病毒(ALSV) - 基于Vigs [39.];Barley的基于BSMV的Vigs叶子[29.].但是,均匀的沉默UBIQ.通过基于BMV的Vigs载体的高粱是罕见的。为了确定这种现象的生物学原因,使用设计用于杂交编码病毒的涂层蛋白的RNA的RNA的探针观察到感染叶片细胞中BMV的存在。这原位杂交结果表明,病毒RNA在整个叶片中不均匀分布,血管组织周围的浓度更多(图。5A).然而,病毒RNA并不存在于受感染的血管组织的所有细胞中(图。5B.).这些结果表明,在BMV感染时,高粱叶中的不均匀沉默是由于叶子中病毒的差异不均匀。
Vigs可以在高粱小花中实现
在种子和胚胎中的基因函数的测定对于研究一些特征至关重要。Vigs已被用于研究大豆和小麦花序中的基因功能[27.那40那41.].由于BMV-VIGS是瞬时的,所以用BMV-VIGS构建的叶片无法实现高粱基因在花序中的沉默。因此,我们开发了一种对高粱花序组织中的基因进行沉默的技术。高粱品种Topper 76对BMV敏感,且体型较小,便于接种和温室栽培。用高粱的汁液摩擦接种高粱花序n benthamiana感染BMV ::抗议UBIQ.构造。将接种植物在黑暗和潮湿的环境中保持在18℃,然后转移到具有22℃的温室的温室前两天。将植物保持在18°C腔室中,开花阶段的70%湿度导致叶片损坏。由于褐变UBIQ.在高粱小花,RACHILLA和Rachis中清楚地观察到基因沉默(图。6.).起初,沉默只在一小块区域内观察到,但随着时间的推移,表现沉默表型的花序面积增加。这些初步结果表明,bmv介导的VIGS可以用来沉默高粱生殖组织中的基因。
在高粱BTx623中未观察到bsmv介导的VIGS
除了BMV,大麦条纹马赛克病毒(BSMV)也作为高粱的潜在VIGS载体进行了试验。BSMV被广泛用于大麦和小麦的基因沉默[29.].农杆菌的(29.] 和体外基于病毒RNA合成的[38.BSMV-VIGS系统可用。我们使用农杆菌基于BSMV-VIGS系统的静音CHLH.那PDS,GFP.(对照)高粱(BTx623)。BSMV基因组(α-RNA、β-RNA和γ-RNA)被克隆成三个不同的基因组农杆菌向量。如前所述将植物基因的片段插入γ-RNA中[29.].这三个农杆菌将含有α-RNA,β-RNA和γ-RNA的菌株生长至1.5 o.d600,混合等量,渗透到三周大的老鼠体内n benthamiana用于病毒乘法的叶子。感染了n benthamiana在四天后收获叶子,用来提取SAP进行感染chenopodium.、大麦和高粱等植物。产生的BSMV-VIGS结构体均能感染chenopodium.和大麦成功(图。7A,7B.).大麦的叶子感染了bsmv ::CHLH.变黄,在沉默时常见的表型CHLH.基因(图。7B.;[29.])。然而,我们无法观察到BTX623的植物高粱植物的任何病毒症状,接种BSMV。在BSMV接种后保持在18°C的未接种和接种的高粱植物在40℃下看起来相似(图。7C.).因此,我们得出结论,基于BSMV基于高粱的BTX623品种不高效。
讨论
高粱BTx623基因组有34211个蛋白编码位点,在Phytozome 11 (https://phytozome.jgi.doe.gov).需要一种鲁棒方法来研究基因功能以改善农艺性状。与拟南芥和水稻不同,高粱不可用稳定的T-DNA插入突变体。高粱的遗传操作产生敲低/敲除或过度表达线的繁重需要几个月和组织培养设施[42.].Vigs是高粱中基因功能研究的替代方法。在本研究中,我们在高粱中报告了一种改进的Vigs方法。
VIGS成功的第一步是用病毒感染植物。在温室环境生长条件下(22°C), BMV对高粱的侵染频率较低(图2)。2A和2B.).许多研究报告称,在比环境温度更低的温度下,病毒对植物和动物的传染性会增加[43.那44.].提出了较低温度下的病毒感染性增加,因此是由于宿主的抗病毒防御[43.那44.那45.].此外,已经显示出较低的温度来增强几种双子叶植物物种中的Vigs表型,而已经显示出较高的温度来增加病毒基因组沉默[39.那44.那46.那47.那48.].此外,与较高的光强度(≥450μE/ m2 / s)和温度(30°C)相比,较低的光强度(<300μE/ m2 / s)和温度(25℃)具有更有效的系统沉默。49.].我们的研究表明,在18°C条件下,高粱植株侵染BMV的频率较高。同样,在小麦中,基于BSMV的VIGS在18-22℃的较低温度下表现出更好的沉默表型O.C [50.].然而,一些单子叶植物的报道表明,较高的温度会增加病毒感染。在大麦中,bsmv介导的VIGS在20-24时效果更好O.与16或28岁相比O.C [38.].此外,Ding等人[51.[在较低温度(24/20°C,日/夜)的大麦中,观察到在较低温度(24/20°C,日/夜)中,受感染和累积的BMV病毒以及接近血管细胞和有限的血管组织侵袭。这些结果表明,温度对植物病毒组合的影响变化,因此对于研究载体植物组合的每种vigs的温度条件非常重要。
由于光漂白和变黄的叶子PDS和CHLH.分别沉默,用作二榫膜和单子叶植物中Vigs的指标[34.].出奇,PDS或CHLH.bmv介导的VIGS对高粱的基因沉默并没有产生明显的表型。然而,由于病毒感染,叶片上可以看到白色/黄色条纹(图。3A).PDS或CHLH.因此,沉默在高粱中不是一个合适的VIGS标记。我们提出了几个原因PDS和CHLH.在高粱中不适合作为VIGS标记。1)白色表型由于PDS由于BMV感染引起的沉默类似于病毒感染,2)PDS / ChlH高粱的沉默表型也与缺氮症状相似,3)高粱可能对PDS和ChlH蛋白水平的降低具有耐受性,因此不表现出任何明显的症状。
管家基因UBIQ.通过靶向蛋白质进行降解,对细胞功能至关重要。因此,UBIQ.预计基因沉默会导致细胞死亡的显着细胞功能障碍,这将明显可见。部分还原UBIQ.大麦瞬态基因沉默的表达水平导致细胞死亡[35.].我们的研究表明,与这些结果一致表明UBIQ.bmv介导的VIGS沉默高粱表现出明显的褐变(细胞死亡)表型(图)。3A).
反义链的基因沉默效率比义链的基因沉默效率高UBIQ.在我们的研究中观察到。BMV是一种阳性(+)链RNA病毒科Bromoviridae.在受感染的宿主细胞中,+链RNA病毒产生的+链基因组RNA比负链RNA多10到100倍[52.].一直以来,BMV产生更多的+链而不是-链[53.那54.].高+股病毒导致来自+股的+链中的+链的较大程度的病毒siRNA,如植物或动物感染+ RNA病毒的动物[52.那55.那56.那57.那58.].基因的反义链的较高沉默效率可能是由于产生更多siRNA的产生。此外,在高粱中,我们检测到比重组BMV中的易感链更保留反义链。此外,当基因片段处于反义链中时,高粱叶中存在更多的病毒,而不是有义股线。当使用反义链时,这些因素的累积效果可能导致更高的效率。
Vigs用于研究植物花序中基因的功能。例如,大豆(大豆种皮颜色是通过沉默一个基因来改变的黄瓜马赛克病毒基于Vigs [40].同样,A.PDS通过接种第一叶片或子叶的基于Alsv基Vigs,基因在未成熟的豆荚和种子涂层中沉默于大豆和种子涂层[41.].基于BSMV的VIGS被用于通过接种小麦花序沉默小麦花中的一个基因,因为接种幼苗不足以沉默花中的一个基因[27.].当用基于BMV的Vigs接种高粱幼苗的叶子时,仅观察到在接种后的三种新的叶子中观察到沉默。但是,在用BMV ::抗病感染花序UBIQ.它导致Floret,Rachilla和高粱的痛苦的褐变(图。6.).这是使用Vigs的高粱花序中基因沉默的第一报告。
结论
有几种VIGS载体可以使单子叶植物中的基因沉默。至少有两项研究报告使用基于bmv的VIGS沉默高粱基因[25.那26.].使用该方法,少量植物(低频)达到50%的沉默效率[25.那26.].在这里,我们测试了几个参数以开发更高效的基于BMV的高粱的Vigs。病毒乘以n benthamiana正如用这种载体进行的玉米VIGS研究[33.]与马丁等人不同,[26.]和Biruma等人,[25.,在这里合成BMV病毒mRNA体外直接感染高粱植株结果表明,3个因素显著提高了高粱的VIGS效率和频率。1)利用基因的反义链发展VIGS结构而不是义结构。2)接种病毒前后,将高粱植株置于较低温度(18℃)。3)利用高粱品种(如。那BTx623) that allows more BMV multiplication. Further, we identified an appropriate marker gene (UBIQ.),在沉默时表现出明显的症状。除了改进了高粱的VIGS方法外,我们还发现利用基于bmv的VIGS可以沉默高粱生殖组织中的基因。一种高效的基于bmv的VIGS将对高粱基因功能分析的相关研究起到重要的推动作用。
方法
植物生长、接种和病害评价
高粱,大麦,土荆芥,和n benthamiana植物在22℃和夜间温度下在温室中生长。所有植物都在Metromix 360中生长。叶子三周n benthamiana植物被解除了武装农杆菌肿瘤术菌株GV2260含有不必要的注射器在T-DNA内的重组BMV载体。接种(如下所述)大麦,chenopodium.,n benthamiana将植物保持在温室中,具有16小时光周期和22℃。高粱植物在18℃,12h光周期,70%湿度和150-200μmolm的生长室中保持在生长室中-2S.-1在接种前3天和接种后3周的光照强度。通过在摩擦接种后4周,在感染的叶片上方的第二片叶子中与白色条纹计数植物来评估BMV感染症状。
发展BMV Vigs构造
利用3周龄高粱植株的RNA生成cDNA, PCR扩增基因片段,构建VIGS。引物的5´端被设计为具有NCO我或AVR.II限制性消化和克隆到BMV-Vigs载体的限制酶网站[15那33.].用于实验的引物序列列于附加文件中3.:表S2。插入件的尺寸为200至400个碱基对。克隆到插入到向量中,BMV3 F引物(附加文件3.:表S2)用于测序。用插入物的质粒转化为A. Tumefaciens.应变GV2260。
植物接种BMV
两个农杆菌将含有BMV基因组RNA1和RNA2的菌株和含有BMV基因组RNA3的菌株在LB培养基中培养过夜。分离后重悬至1.5 OD600在10 mm MES(pH5.8)和100nm乙酰血清酮中。相同的两种农杆菌将菌株混合并在室温下在振荡器中保持3小时。这农杆菌鸡尾酒是注射器(不必要)渗透到完全开放的叶子中n benthamiana在22°C的温室中生长。n benthamiana渗透后4天收获叶子,用来制备如下所述的SAP,或者在液氮中冷冻并储存在-80°C以供将来使用。
接种方法在图2中示意性地表示。1.高粱植株在22°C温室中生长12天(四叶期)。将幼苗转入18°C、12 h/12 h光暗循环3 d的生长室。将染病菌磨成2g,制成磨接液n benthamiana叶子在1毫升10毫米磷酸钾缓冲液(pH 6.8)和100毫克碳化硅磨料。汁液被涂在两到三片高粱叶子上。接种的植物被一个圆顶覆盖以保持高湿度,并在18°C的黑暗中保存两天。接种后转入18°C生长室,光照/暗循环12 h。类似于高粱,chenopodium.除了高粱中文所述,还接种大麦植物,除了高粱,除了将植物保持在22℃之外。BSMV接种也以与BMV类似的方式进行。
定量rt - pcr
使用Qiagen Rnaeasy套件提取总植物RNA(www.qiagen.com.).用RNase--A的DNase I处理RNA。上标III用于合成cDNA和寡核苷酸(DT)底漆的第一股线。使用10倍稀释的cDNA,SYBR绿色实时PCR主混合物进行定量RT-PCR(www.thermofisher.com.)和ABI PRISM 7500 (Applied Biosystems, NY, USA)。将基因的转录水平归一化SbActin.学生T.-test测定沉默植株与对照植株的表达水平差异有统计学意义。
病毒提取和RT-PCR
为了提取病毒,叶子n benthamiana接种后4 d采收,接种后3周采收高粱叶片。用聚乙二醇沉淀法提取BMV [15].苯酚/氯仿用于从纯化的病毒中提取RNA [15].利用上标III和随机引物合成cDNA第一链。使用BMV3正向和反向引物的PCR(附加文件3.:侧面的表S2)进行在病毒的RNA3中侧移的插入DNA。
BMV量化
从感染的叶子中提取总蛋白质n benthamiana和高粱使用含有1mM MgCl 2,220mM Tris / HCl pH 7.4,50mM KCl,250mM蔗糖和10mMβ-巯基乙醇的萃取缓冲液。在12.5%凝胶中使用SDS-PAGE分离等量(2μg)的提取蛋白,然后使用对BMV外壳蛋白的抗体进行蛋白质印迹[51.].
原位杂交
BMV RNA3-Insitu-L/R引物对(附加文件3.表S2)用于PCR探针制备,扩增BMV RNA3的362-bp。PCR探针用Digoxigenin-11-UTP (Sigma-Aldrich Co. LLC, Mo, USA)标记。长期的协议(http://www.its.caltech.edu/~plantlab/protocols/insitu.pdf.)用于组织制备。机器人GenePaint系统(Tecan)用于预杂交、杂交、洗涤[59.].该部分使用尼康Eclipse TE 300(尼康公司。美国纽约)。
缩写
- 中收取:
-
病毒诱导的基因沉默
- BMV:
-
布罗姆花叶病毒
- BSMV:
-
大麦条纹马赛克病毒
- UBIQ:
-
泛素
- chlh:
-
镁切酶亚单位H.
- PD:
-
植物去脱离酶
- siRNA:
-
小干扰RNA
参考
- 1.
Morris GP, Ramu P, Deshpande SP, Hash CT, Shah T, Upadhyaya HD,等。高粱农业气候性状的群体基因组和全基因组关联研究。中国科学院院刊。2018;110:453-8。
- 2。
Srinivasarao P,Belum VSR,Nagaraj N,Hari du。高粱生产用于多元化的用途。在:高粱的遗传学,基因组学和育种。CRC压力机。2014; 2014:1-27。
- 3。
FAOSTAT。作物的生产。联合国粮食及农业组织统计司。可以从:http://faostat3.fao.org/download/q/qc/e.(访问18.05.2015)2015。
- 4。
全基因组测序揭示了非洲土著谷类作物高粱的遗传潜力。Nat Commun。2013;4:2320。
- 5。
帕特森啊,鲍德·杰,布鲁格曼r,dubchak i,grimwood j,gundlach h。高粱双色基因组和草的多样化。自然。2009; 457:551-6。
- 6。
辛智,王茂林,乔普拉,王鹏。糖精的基因突变系统及资源。在:帕特森,编辑。糖精科的基因组学。纽约:施普林格Verlag;2013.p . 169 - 85。
- 7。
陈志强,陈志强,陈志强,等。水稻分子育种研究进展高粱双色一种新型能源作物。见:Kwang WJ,编辑。细胞与分子生物学国际评论。学术出版社;2016.221 - 57页。
- 8。
Senthil-Kumar M, Mysore KS。植物功能基因组学中VAGS的新尺寸。趋势植物SCI。2011; 16:656-65。
- 9。
MA X,Nicole M-C,Metiignier L-V,Hong N,Wang G,Moffett P. RNA沉默和RNA处理组分在病毒恢复和病毒诱导的植物中沉默中的不同作用。J Exp Bot。2014; 66:919-32。
- 10.
Baulcombe直流。基于病毒诱导基因沉默的快速前进遗传。CurrOp植物BIOL。1999年; 2:109-13。
- 11.
Baulcombe直流。植物中的RNA沉默。大自然。2004;432:356 - 63。
- 12.
Lee Ws,Rudd JJ,Kanyuka K.病毒诱导基因沉默(Vigs)用于涉及的小麦基因的功能分析Zymoseptoria tritici敏感性和耐药性。真菌麝猫杂志.2015; 79:84-8。
- 13。
李志刚,李志刚,李志刚。植物单子叶植物瞬时表达系统的研究进展。在:Azhakanandam K, Silverstone A, Daniell H, Davey MR,编辑。作物基因表达与实现技术的最新进展。施普林格;2015.p . 391 - 422。
- 14。
Cheuk A,Houde M.使用统一基因表达的快速有效方法大麦条纹马赛克病毒.植物方法。2017; 13:24。
- 15.
丁奇,施耐德WL,Chaluvadi SR,Mian Ma,Nelson Rs。野人马赛克病毒菌株的表征及其作为单圈宿主中基因沉默的载体的用途。Mol植物微生物相互作用。2006; 19:1229-39。
- 16。
Holzberg S,Brosio P,Gross C,Pogue GP。大麦条纹马赛克病毒诱导基因沉默在单码子厂。工厂J. 2002; 30:315-27。
- 17。
Scofield SR,Huang L,Brandt As,Gill BS。用于六倍体小麦病毒诱导的基因沉默系统的开发及其在LR21介导的叶片锈蚀路径的功能分析中的应用。植物理性。2005; 138; 2165-2173。
- 18。
Liou M-R,Huang Y-W,Hu C-C,Lin N-S,Hsu Y-H.单子叶植物的双基因沉默矢量系统。植物Biotechnol J. 2014; 12:330-43。
- 19。
Lu H-C,陈H-H,Tsai W-C,陈W-H,SU H-J。chang dc-n,yeh h-h。兰花生殖阶段的基因功能验证的策略。植物理性。2007; 143:558-69。
- 20.
王R,杨X,王N,刘X,尼尔森Rs,Li W等人。一种有效的病毒诱导的玉米功能基因组学研究的基因沉默载体。工厂J. 2016; 86:102-15。
- 21.
刘,谢凯,贾q,赵j,陈t,李h,魏x,diqo x,hong y,liu y。狐尾草花叶病毒- 诱导单子植物中的基因沉默。植物理性。2016; 171(18):1-1807。
- 22.
梅颖,张超,科诺德BM, Hill JH, Whitham SAA。狐尾镶嵌病毒病毒诱导基因沉默的载体在玉米中。植物理性.2016; 171:760-72。
- 23.
Purkayastha A,Mathur S,Verma V,Sharma S,Dasgupta I.使用源自DNA病毒的载体在水稻中沉默的病毒诱导的基因。Planta。2010; 232:1531-40。
- 24.
草中病毒诱导的基因沉默资源。植物杂志。2009;149:152-7。
- 25.
在高粱中发现了2个具有NB-LRR编码基因的位点collettrichum sublineolum.您的App Genet。2012; 124:1005-15。
- 26.
一种高度保守的NB-LRR编码基因簇SetOphaeria Turcica在高粱。BMC植物BIOL。2011; 11:151。
- 27。
Ma M,Yan Y,Huang L,Chen M,Zhen H.病毒诱导小麦尖峰和谷物的基因沉默及其在HMW-GS编码基因的功能分析中的应用。BMC植物BIOL。2012; 12:141。
- 28。
Tufan HA, Stefanato FL, McGrann GR, MacCormack R, Boyd LA。这大麦条纹马赛克病毒用于病毒诱导的基因在谷物中诱导的系统差异地影响小麦的真菌病原体的易感性。J植物理性。2011; 168:990-4。
- 29。
袁超,李超,严林,AO Jackson,刘志,韩晨,等。高吞吐量大麦条纹马赛克病毒病毒诱导基因沉默在单焦和双叶的病毒的载体。Plos一个。2011; 6:E26468。
- 30.
系统病毒诱导的基因沉默使玉米基因在生物营养互作过程中的功能特性得以研究Ustilago Maydis..新植醇。2011;189:471 - 83。
- 31.
Cao Y,Shi Yan,Li Y,Cheng Y,周涛,风扇Z.玉米ROP1可能参与植物对病毒感染的防御反应。莫尔植物途径。2012; 13:732-43。
- 32.
丁Xs,Mannas SW,Bishop Ba,Rao X,LeCoultre M,Kwon S,Nelson Rs。一种改进布罗姆花叶病毒沉默矢量:更大的插入稳定性和更广泛的重视。植物理性。2017年;https://doi.org/10.1104/pp.17.00905.
- 33.
玉米伸长蛋白C与玉米基因组连接蛋白VPg的相互作用甘蔗花叶病毒易受病毒感染。新植醇。2014;203:1291 - 304。
- 34.
Senthil-Kumar M, Mysore KS。烟草使病毒基于病毒诱导的基因沉默尼古利亚娜·宾夕法尼亚州.Nat协议。2014;9:1549 - 62。
- 35.
多聚泛素化在大麦抗寄主基础上的作用。植物细胞。2006;18:3321-31。
- 36.
Pacak A,Strozycki Pm,Barciszewska-Pacak M,Alejska M,Lacomme C,Jarmolowski A等。基于溴马赛克病毒的重组载体根据插入序列的取向触发有限的基因沉默响应。拱病毒。2010; 155:169-79。
- 37。
陈志强,陈志强,陈志强,等。利用病毒诱导的基因沉默技术开发新型病毒载体分析草类基因功能的原理。方法2013;975:15-32。
- 38。
马德森,马志强,马志强大麦条纹马赛克病毒- 诱导大麦的基因沉默。Mol植物微生物相互作用。2007; 20:1323-31。
- 39。
igarashi a,yamagata k,sugai t,takahashi y,sugawara e,tamura a等。苹果潜在球面病毒在包括烟草,番茄的广泛植物中,可靠且有效的病毒诱导基因诱导的载体诱导的载体拟南芥,葫芦和豆类。病毒学。2009; 386:407-16。
- 40。
张志强,张志强,张志强,等。病毒诱导基因沉默介导大豆类黄酮合成相关基因功能分析生物技术学报2007;5:778-90。
- 41。
Yamagishi N,Yoshikawa N.病毒诱导的大豆种子中的基因和大豆植物的出苗阶段苹果潜在球面病毒向量。植物学报。2009;71:15-24。
- 42。
Wu E, Lenderts B, Glassman K, Berezowska-Kaniewska M, Christensen H, Asmus T, et al.。优化农杆菌-介导的高粱转化方案及转基因高粱植株的分子数据。中国生物医学工程学报。2014;29(4):429 - 434。
- 43.
阿德尔曼Zn,安德森·湄·莫尔,Murraddu Mg,Samuel GH,Morazzani em,Myles km。冷却器温度破坏了RNA干扰,增加了疾病向量蚊虫对病毒感染的敏感性。Plos opprop top ten。2013; 7:E2239。
- 44.
Szittya G, Silhavy D, Molnár A, Havelda Z, Lovas Á, Lakatos L, et al.;低温通过控制siRNA的生成来抑制RNA沉默介导的防御。EMBO j . 2003; 22:633-40。
- 45.
阿德尔曼ZN,安德森MAE,莫拉扎尼EM,迈尔斯KM。一种用于监测黄热病蚊虫RNAi途径的转基因传感器菌株AEDES AEGYPTI..昆虫生物化学Mol Biol。2008; 38:705-13。
- 46.
Chellappan p,vanitharani r,Ogbe F,Fauquet cm。温度对Gemini病毒诱导RNA沉默在植物中的影响。植物理性。2005; 138:1828-41。
- 47.
傅DQ,朱伯兹,朱HL,张HX,谢毅,江WB等。通过低温和低湿度提高番茄中病毒诱导的基因。mol细胞。2006; 21:153-60。
- 48.
双生病毒介导的基因沉默棉叶皱纹病毒棉花的低温会增强。植物杂志。2008;148:41-50。
- 49.
帕蒂尔·BL, Fauquet CM。光强和温度对瞬时农业渗透沉默信号系统传播的影响。植物学报。2015;16:484-94。
- 50.
关键词:影响因素大麦条纹马赛克病毒-介导的小麦基因沉默。植物病理学杂志。2010;54:476 - 481。
- 51.
丁xs,flasinski s,尼尔森卢比。大麦的感染布罗姆花叶病毒主要局限于静脉内的细胞,并通过温度依赖机制与静脉相关。摩尔Plant-Microbe互动.1999年; 12:615-23。
- 52.
西南郊约20叮。RNA-based抗病毒免疫。Nat Immunol牧师.2010; 10:632-44。
- 53.
Janda M,Ahlquist P.RNA依赖性复制,转录和雀斑病毒病毒RNA复制品的持久性S..酿酒酵母.细胞。1993;72:961 - 70。
- 54.
Noueiry Ao,Ahlquist P. Brome Mosaic病毒RNA复制:揭示宿主在RNA病毒复制中的作用。Annu Rev phytopathol。2003; 41:77-98。
- 55.
HO T,Pallett D,Rusholme R,Dalmay T. Wang H.一种简化的方法,用于克隆短干扰RNA芸苔属植物juncea感染萝卜镶嵌potyvirus和Turnip Crinkle Carmovirus..J Virol方法。2006; 136:217-23。
- 56.
Molnár A, Csorba T, Lakatos L, Várallyay É, Lacomme C, Burgyán J.植物病毒衍生的小干扰rna主要来源于高度结构的单链病毒rna。J性研究.2005; 79:7812-8。
- 57.
qi x,bao fs,xie z.小的RNA深度测序显示出角色拟南芥RNA依赖性RNA聚合酶在病毒siRNA生物发生中。Plos一个。2009; 4:E4971。
- 58.
通过小rna的深度测序发现新的病毒。In: Jin, H, Gassmann W. editors。RNA丰度分析:方法和方案。Totowa, NJ: Humana出版社;2012.p . 177 - 191。
- 59.
杰克逊D.在植物中原位杂交。在:Bowles DJ,Mcpherson,M.编辑。分子植物病理:一种实用的方法。牛津:牛津大学新闻;1991. p。163-174。
致谢
我们感谢X. S. Ding和Rick Nelson博士和Rick Nelson(诺布尔研究所)提供BMV Vigs载体,对BMV Cate蛋白的抗体,以及有用的建议,以及后者对稿件提供了批判性评论。我们感谢Andy Jackson博士从伯克利大学提供我们BSMV基于Vigs的Vigs向量和Guifen Li&Yuhong Tang(Noble Research Institute)原位杂交。我们感谢Sally Mackenzie博士(内布拉斯加州大学)在整个项目中进行鼓励和讨论。我们承认桑希哦(贵族研究所)的技术援助的贡献。这项工作由Bill和Melinda Gates基金会通过内布拉斯加州林肯大学资助。
支持信息
本文提供了以下支持信息:
资金
这项工作由条例草案和Melinda Gates基金会通过内布拉斯加州林肯大学资助。
数据和材料的可用性
与本稿件有关的所有数据都在主要稿件或可从期刊网站访问的补充文件中提供。
同意出版
不适用。
作者信息
从属关系
贡献
KM和DS设计研究;DS和H-KL进行了研究;ID提供试剂;DS和KM撰写了论文。所有作者阅读并批准了最终的手稿。
相应的作者
伦理宣言
伦理批准和同意参与
不适用
相互竞争的利益
提交人声明他们没有竞争利益。
权利和权限
开放获取本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Singh,D.K.,Lee,HK。,Dweikat,I.等等。一种高效的高粱病毒诱导基因沉默的改进方法。BMC植物BIOL.18,123(2018)。https://doi.org/10.1186/s12870-018-1344-z
收到了:
公认:
发表:
关键词
- 病毒诱导基因沉默(VIGS)
- 高粱植物
- 植物去脱离酶
- 重视效率
- 雀麦花叶病毒