- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
TM8gydF4y2Ba抑制发育时机gydF4y2Ba烟草benthamianagydF4y2Ba并且在被子植物中具有多样化的功能gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba18gydF4y2Ba文章编号:gydF4y2Ba129gydF4y2Ba(gydF4y2Ba2018gydF4y2Ba)gydF4y2Ba
抽象的gydF4y2Ba
背景gydF4y2Ba
MADS-box基因是植物生殖发育的关键调控因子,该基因家族的大多数系谱成员都得到了广泛的研究。但其功能古时多样gydF4y2BaTM8gydF4y2Ba谱系迄今为止仍然难以捉摸。可用数据表明,通过开花植物中的许多基因损失事件在番茄和快速发展中提出了可能的功能。gydF4y2Ba
结果gydF4y2Ba
我们展示了广泛的守恒gydF4y2BaTM8gydF4y2Ba被子植物中,发现相对于其他MADS-box基因谱系,没有重复的基因已经被各大全基因组复制事件后保留。通过击倒的gydF4y2BaNbTM8gydF4y2Ba通过病毒诱导的基因沉默gydF4y2Ba烟草benthamianagydF4y2Ba,我们证明gydF4y2BaNbTM8gydF4y2Ba镇压gydF4y2BamiR172gydF4y2Ba与另一个疯箱基因一起,gydF4y2Ba营养期短gydF4y2Ba(gydF4y2BaNbSVPgydF4y2Ba).在密切相关的物种gydF4y2Ba矮牵牛织布达gydF4y2Ba,gydF4y2BaPHTM8gydF4y2Ba在我们调查的条件下没有表达,与此一致,一个敲除突变体没有显示一个表型。最后,我们培育了转基因番茄植株gydF4y2BaTM8gydF4y2Ba沉默或异位表达,但这些植物没有显示清楚的表型。因此,无法确定其明确的功能gydF4y2Ba茄属植物lycopersiumgydF4y2Ba.gydF4y2Ba
结论gydF4y2Ba
虽然存在gydF4y2BaTM8gydF4y2Ba在被子植物中提出一般的功能仍然是困难的。根据目前所有可用的数据,加上我们自己的研究结果,gydF4y2BaTM8gydF4y2Ba功能似乎已迅速多样化的整个被子植物和作为阻遏gydF4y2BamiR172gydF4y2Ba在gydF4y2Ba烟草benthamianagydF4y2Ba, 和...一起gydF4y2BaNbSVPgydF4y2Ba.gydF4y2Ba
背景gydF4y2Ba
MIKCgydF4y2BaCgydF4y2Ba型MADS-box基因参与多种发育过程[植物转录因子gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2 gydF4y2Ba,gydF4y2Ba3 gydF4y2Ba].在裸子植物中,由于重复事件,可以区分出12个分枝,而在被子植物中,由于重复事件,出现了17个分枝[gydF4y2Ba4gydF4y2Ba].米克gydF4y2BaCgydF4y2Ba型MADS-box基因在开花过渡、花分生组织和花器官特征、果实和种子发育等方面发挥着重要作用。它们在植物生殖过程中的关键作用,通常是作物改良的利益,导致了至少一个物种的大多数成员的功能特征。几个MIKC的功能gydF4y2BaCgydF4y2Ba类型的血统,然而,仍然是难以捉摸的gydF4y2Ba番茄马德斯8gydF4y2Ba- CLADE.gydF4y2Ba(TM8)gydF4y2Ba是其中之一[gydF4y2Ba5gydF4y2Ba].gydF4y2Ba
因为它在经典的模式物种,如gydF4y2Ba拟南芥gydF4y2Ba,玉米和米饭,gydF4y2BaTM8gydF4y2Ba原本并不功能特点是任意种类。最近的一项研究phylogenomic被子植物评估MICK型MADS的进化保守box基因,描述了五个独立的损失gydF4y2BaTM8gydF4y2Ba-分支贯穿整个被子植物,使它成为最经常丢失的MADS-box谱系,仅次于gydF4y2Ba开花轨迹CgydF4y2Ba(gydF4y2Ba方法gydF4y2Ba) [gydF4y2Ba6gydF4y2Ba].另一方面,由于可用的基因组和序列数量的增加,很明显gydF4y2BaTM8gydF4y2Ba同源物似乎存在于整个精子上。gydF4y2Ba
番茄马德斯8gydF4y2Ba(gydF4y2BaTM8gydF4y2Ba)是被分离出来的第一个被识别的演化支成员gydF4y2Ba茄属植物lycopersicum。gydF4y2Ba它被归为“早期”开花基因,在花的分生组织中表达,在内部的三个花轮中表达较少[gydF4y2Ba7gydF4y2Ba].它的第一个表征也在番茄中。过度表达全长gydF4y2BaTM8gydF4y2Ba-反义RNA导致了12个转基因株系中3个的雌花器官缺陷、雌雄不育和单性结实[gydF4y2Ba8gydF4y2Ba].最近,努力彻底表征gydF4y2BaTM8gydF4y2Ba, Daminato等人生产了过表达全长的转基因番茄gydF4y2BaTM8gydF4y2Ba和植物表达gydF4y2BaTM8gydF4y2Ba与SRDX转录抑制结构域融合[gydF4y2Ba9gydF4y2Ba].他们观察到22个独立中的三分之一的雄蕊畸形gydF4y2BaTM8gydF4y2Ba过表达株系,并与此一致,的B-基因的表达在这些花被改变。15.gydF4y2Ba35 s: TM8: SRDXgydF4y2Ba线条显示了更明显的表型,如齿形较深的绿叶和长圆形卵巢和水果,是无籽的。花卉和果梗出现较长,脱落区异常。gydF4y2Ba无接缝的gydF4y2Ba,一个gydF4y2BaSVPgydF4y2BaHomolog,在这些植物中显著下调。作者的结论是gydF4y2BaTM8gydF4y2Ba对番茄花的发育有一定的影响gydF4y2BaMACROCALYXgydF4y2Ba.gydF4y2Ba
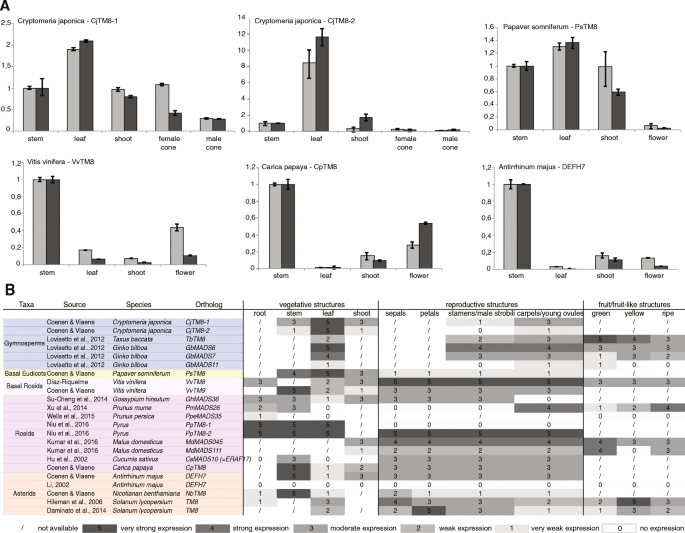
除了这项研究,几乎没有任何关于gydF4y2BaTM8gydF4y2Ba到目前为止。很少有研究,主要是对某一特定物种的MADS-box基因进行全基因组分析,报告了MADS-box的存在gydF4y2BaTM8gydF4y2Ba在多样性的基因组和功能,有时提出了基于基因表达数据。在gydF4y2BaCucumis巨大成功gydF4y2Ba,gydF4y2BaERAF17gydF4y2Ba,黄瓜gydF4y2BaTM8gydF4y2BaOrtholog,参与了乙烯诱导后雌花的发育[gydF4y2Ba10gydF4y2Ba].在gydF4y2Ba金鱼草majus,gydF4y2Ba的gydF4y2BaTM8gydF4y2Ba直接同源gydF4y2BaDEFH7,gydF4y2Ba仅在幼苞片中表达(未发表的观察,[gydF4y2Ba11gydF4y2Ba])。Hileman等人检测gydF4y2BaTM8gydF4y2Ba在几乎所有的番茄组织中,尽管在根、幼苗、心皮和绿色果实中含量较少[gydF4y2Ba12gydF4y2Ba].在gydF4y2Ba葡萄gydF4y2Ba,gydF4y2BaVvTM8gydF4y2Ba在开花过渡的潜在芽中,在花发育的后期阶段和卷须中检测到[gydF4y2Ba13gydF4y2Ba].然而,在最近对卷须和花序发育的转录分析中,gydF4y2BaVvTM8gydF4y2Ba没有提到[gydF4y2Ba14gydF4y2Ba].在裸子植物中的肉质果实结构的分子研究中,gydF4y2BaTM8gydF4y2Ba意外确定[gydF4y2Ba15gydF4y2Ba],在营养结构和生殖结构中也显示了广泛的表达模式。gydF4y2BaTbTM8gydF4y2Ba在胚珠发育过程中表达最高的是gydF4y2Ba水松baccatagydF4y2Ba.在gydF4y2Ba银杏毕洛巴巴gydF4y2Ba,三个gydF4y2BaTM8gydF4y2Ba类基因在叶片中表达,但也存在于雄球果和雌球果以及在种子和肉质肌皮的发育过程中。根据这些观察,gydF4y2BaTM8gydF4y2Ba在裸子植物的肉质果实状发育中起着重要作用。在另一个全基因组范围内鉴定MADS-box基因gydF4y2Ba李属却已gydF4y2Ba,gydF4y2BaPmMADS26gydF4y2Ba被鉴定为鞋底gydF4y2BaTM8gydF4y2Ba同源基因只在雌蕊和果实中表达,在成熟过程中其表达量逐渐增加[gydF4y2Ba16gydF4y2Ba].在密切相关的gydF4y2Ba碧桃gydF4y2Ba另一方面gydF4y2BaTM8gydF4y2Baortholog,被确定为gydF4y2BaPpeMADS35gydF4y2Ba,在根、叶、子叶、胚胎和果实中表达量非常低[gydF4y2Ba17gydF4y2Ba].在梨的研究中,gydF4y2BaPpTM8-1gydF4y2Ba在芽、枝、叶和根中均有高表达,而在花中无表达gydF4y2BaPpTM8-2gydF4y2Ba在所有组织[中高表达gydF4y2Ba18gydF4y2Ba].类似的模式在gydF4y2Ba马吕斯家gydF4y2Ba,其中一个gydF4y2BaTM8gydF4y2Ba同族体,gydF4y2BaMdMADS045gydF4y2Ba在果实中表达,在花发育中表达较强;gydF4y2BaMdMADS111gydF4y2Ba,除发育中的果实外,在大多数组织中表达较低[gydF4y2Ba19gydF4y2Ba].gydF4y2Ba
虽然没有明确的将军或保留的角色gydF4y2BaTM8gydF4y2Ba从这些不同的表达数据可以得出结论,大多数研究共享一个广泛的gydF4y2BaTM8gydF4y2Ba表达模式,在营养组织和生殖组织中,最常在花分生组织和果实发育中表达。因此,gydF4y2BaTM8gydF4y2Ba最常见的是在花和果实的发育中发挥作用[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba15gydF4y2Ba].然而,没有明确的击倒或敲除突变体,似乎有必要提供更多的了解其真正的作用。在本研究中,我们评估的功能gydF4y2BaTM8gydF4y2Ba在茄科中的作用gydF4y2Ba矮牵牛织布达gydF4y2Ba(gydF4y2Ba佩妮gydF4y2Ba)gydF4y2BaPHTM8gydF4y2Ba敲除突变,以及转基因改变gydF4y2BaTM8gydF4y2Ba表达gydF4y2Ba烟草benthamianagydF4y2Ba(gydF4y2Ba烟草gydF4y2Ba),gydF4y2Ba茄属植物lycopersicumgydF4y2Ba(西红柿)。本研究所得的不同结果,结合以往研究的杂项数据,支持快速功能演化的观点gydF4y2BaTM8gydF4y2Ba基因。gydF4y2Ba
结果gydF4y2Ba
TM8gydF4y2Ba在重大基因组复制事件后没有被保留gydF4y2Ba
最近的研究表明gydF4y2BaTM8gydF4y2Ba在裸子植物中受到高度保守,这思工甚至扩展在裸子植物中,成为果实种子植物中最大的疯狂箱子之一[gydF4y2Ba4gydF4y2Ba].另一方面,在Angiosperms中,它被指定为最常见的疯子盒亚克士gydF4y2Ba方法gydF4y2Ba[gydF4y2Ba6gydF4y2Ba].为了进一步了解它的进化历史,我们重建了它在被子植物中的系统发育,从而不仅关注它丢失的地方,而且试图描述它的广泛保存。为了做到这一点,我们使用了所有可用的基因组序列到目前为止,在植物zome 12和Sol基因组网络(附加文件gydF4y2Ba1gydF4y2Ba),补充有来自NCBI和Onekp平台的EST和转录组数据库的序列[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba].为鉴定属于缺乏完全可用基因组的目的物种的同源系作了特别的努力。gydF4y2Ba
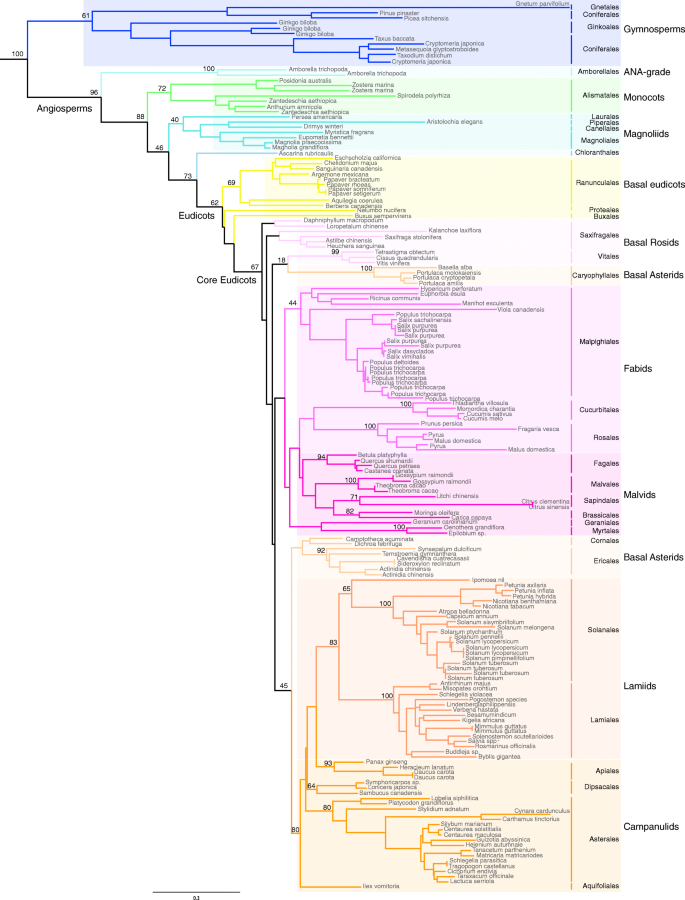
得到的系统发育清楚地表明了gydF4y2BaTM8gydF4y2Ba在整个被子植物中,基因系统发生在被子植物系统发生之后(图1)。gydF4y2Ba1gydF4y2Ba额外的文件gydF4y2Ba2 gydF4y2Ba).这意味着在gydF4y2BaTM8gydF4y2Ba-谱系,这与大多数其他MADS-box基因不同,这些基因和其他转录因子一样,在全基因组复制后通常是保守的[gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba].另一方面,案件的数量gydF4y2BaTM8gydF4y2Ba丢失或无法识别的是令人惊叹的众多,在高昂的植物进化中遍布。不gydF4y2BaTM8gydF4y2Ba在睡莲目、除泽泻目外的所有单子叶目、Trochodendrales、Gunnerales、Dilleniales、Santanales、Fabales、Gentianales或Boraginales以及其他小目和许多重要科(如芸苔科)中均有同源性。在绿藻目、Proteales、Buxales、Geraniales和Cornales中只鉴定出一个或几个同源系。虽然在没有完全测序的基因组可用的情况下,我们无法就其在一个物种中的损失得出最终结论,但到目前为止,许多物种都有广泛的取样和大量的转录组数据。缺乏gydF4y2BaTM8gydF4y2Ba来自这些数据库确实表明它在这些分类赛中缺席。gydF4y2Ba
最大似然系统发生gydF4y2BaTM8gydF4y2Ba-具有bootstrap支持的被子植物科。当>50时,主要节点显示BS支持值。gydF4y2BaSOC1gydF4y2Ba基因被用作外群(这里没有显示)。在被子植物目中,没有gydF4y2BaTM8gydF4y2Ba同源物可以从方法中列出的数据库中鉴定出来。完整的系统发育,包括所有登录号作为附加文件提供gydF4y2Ba2 gydF4y2Ba
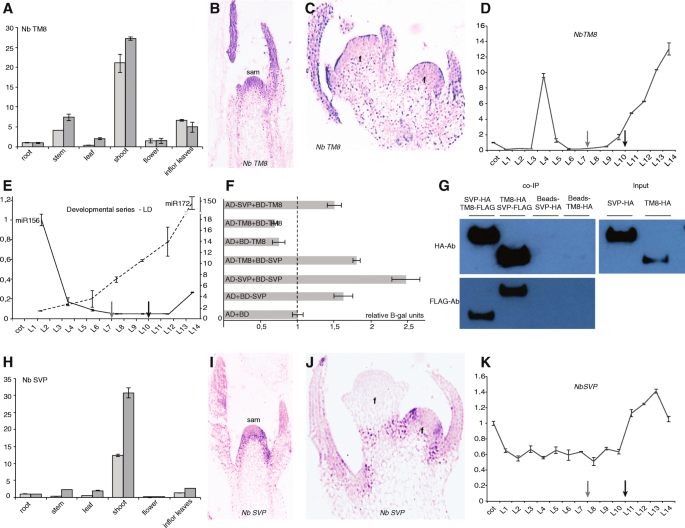
NbTM8gydF4y2Ba和gydF4y2BaNbSVPgydF4y2Ba抑制gydF4y2BamiR172gydF4y2Ba在gydF4y2Ba烟草benthamianagydF4y2Ba
我们决定使用gydF4y2Ba烟草benthamianagydF4y2Ba的初始表征gydF4y2BaTM8gydF4y2Ba,因为它已被证明是病毒诱导基因沉默(VIGS)的一个优秀的模式物种,一种快速和简单的方法获得功能表型的损失[gydF4y2Ba24gydF4y2Ba].首先计算时间和地点gydF4y2BaTM8gydF4y2Ba函数gydF4y2Ba烟草gydF4y2Ba,我们使用qPCR和原位杂交(图。gydF4y2Ba2 gydF4y2Ba).qPCR的结果表明,gydF4y2BaNbTM8gydF4y2Ba在茎中表达强烈,在幼苗、叶片和花器官中表达较少。gydF4y2Ba2gydF4y2Ba).原位杂交揭示gydF4y2BaNbTM8gydF4y2Ba在开发芽和花中的表达(图。gydF4y2Ba2 b, cgydF4y2Ba;额外的文件gydF4y2Ba3 gydF4y2Ba).在发育系列的植物中,每一个都有一个叶片,在营养发育早期,在第四个叶片开始的时候,表现出一个强烈的高峰。在此高峰后,其表达量下降,仅在第9或第10叶左右再次增加,并继续增加,直到第一朵花出现(第14叶)(图。gydF4y2Ba二维gydF4y2Ba).我们假设第一个峰值可能在少年成年转型周围,因此我们也量化了gydF4y2BamiR156gydF4y2Ba和gydF4y2BamiR172gydF4y2Ba通过茎环qPCR检测水平(图。gydF4y2Ba2 egydF4y2Ba).与这一假设一致,我们发现第一个峰在gydF4y2BaNbTM8gydF4y2Ba表情几乎完全吻合的那一刻gydF4y2BamiR156gydF4y2Ba下降低于增加gydF4y2BamiR172gydF4y2Ba的水平。在gydF4y2Ba拟南芥gydF4y2Ba,这种幼年-成虫过渡的特征是在叶片背面产生毛状体[gydF4y2Ba25gydF4y2Ba],所以我们研究了少年成人过渡gydF4y2Ba烟草gydF4y2Ba识别此阶段变化的相似标记。我们观察到,在第三和第四叶附近出现了大的毛状体和尖的叶尖,证实了相变确实发生在这一点上(附加文件gydF4y2Ba4gydF4y2Baa - c)。第二个峰值gydF4y2BaNbTM8gydF4y2Ba表达与增加表达的同源物一致gydF4y2Ba抑制器CONSTANS 1gydF4y2Ba在gydF4y2Ba烟草gydF4y2Ba(gydF4y2BaNBSoc1.gydF4y2Ba),如图用灰色箭头表示(图。gydF4y2Ba2D,E.gydF4y2Ba和附加文件gydF4y2Ba4gydF4y2BaD)。gydF4y2BaSOC1gydF4y2Ba是花卉诱导的标志吗gydF4y2Ba拟南芥gydF4y2Ba并且在花的转变过程中强烈表达[gydF4y2Ba26gydF4y2Ba].这些观察结果表明gydF4y2BaNbTM8gydF4y2Ba在两个相变期间的行为gydF4y2Ba烟草gydF4y2Ba,可能通过调节gydF4y2BamiR156gydF4y2Ba和gydF4y2BamiR172gydF4y2Ba.gydF4y2Ba
基因表达的gydF4y2BaNbTM8gydF4y2Ba和gydF4y2BaNbSVPgydF4y2Ba在gydF4y2Ba烟草benthamianagydF4y2Ba.gydF4y2Ba一个gydF4y2Ba相对表达gydF4y2BaNbTM8gydF4y2Ba在两种生物重复的植物和生殖结构中。gydF4y2BabgydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba原位杂交gydF4y2BaNbTM8gydF4y2Ba生长中的嫩枝和花。gydF4y2BadgydF4y2Ba从子叶(cot)到14片叶(L14)的发育系列gydF4y2BaNbTM8gydF4y2Ba.灰色箭头标志着花卉过渡,黑箭头标志着花卉诱导。gydF4y2BaegydF4y2Ba相对表达gydF4y2BamiR156gydF4y2Ba(左)和gydF4y2BamiR172gydF4y2Ba(右)时gydF4y2Ba烟草gydF4y2Ba发展。gydF4y2BafgydF4y2Ba酵母的2台混合动力gydF4y2BaNbTM8gydF4y2Ba和gydF4y2BaNbSVPgydF4y2Ba.gydF4y2BaggydF4y2BaCo-IP结果gydF4y2BaNbTM8gydF4y2Ba和gydF4y2BaNbSVPgydF4y2Ba.用标志偶联琼脂糖珠子拉下蛋白质并通过蛋白质印迹通过HA(UP)和标志(下)抗体来观察。gydF4y2BahgydF4y2Ba相对表达gydF4y2BaNbSVPgydF4y2Ba在营养生长和生殖结构。gydF4y2Ba我gydF4y2Ba- - - - - -gydF4y2BajgydF4y2Ba原位杂交gydF4y2BaNbSVPgydF4y2Ba生长中的嫩枝和花。gydF4y2BakgydF4y2Ba发展一系列的gydF4y2BaNbSVPgydF4y2Ba.山姆:茎尖分生组织;f:花分生组织;LD:漫长的一天。误差条是标准差gydF4y2Ba
由于MADS-box基因通常在异聚体复合体中发挥作用,我们考虑是否有蛋白相互作用伙伴参与这一调控。一个好的候选人会是gydF4y2Ba营养期短gydF4y2Ba(gydF4y2BaSVPgydF4y2Ba),另一个MADS-box基因参与了花的转化,通过下调gydF4y2BamiR172gydF4y2Ba在gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba27gydF4y2Ba].我们首先测试的能力gydF4y2BaNbSVPgydF4y2Ba和gydF4y2BaNbTM8gydF4y2Ba交互使用酵母双杂交。虽然我们发现在一个方向(AD-SVP + BD-TM8)的正相互作用,结果在另一方向(AD-TM8 + BD-SVP)仍无定论由于NbSVP(图1的自动激活。gydF4y2Ba2 fgydF4y2Ba).因此,我们随后进行了共免疫沉淀gydF4y2Ba拟南芥gydF4y2Ba叶片叶片原生质体并证实这些蛋白质可以在体外相互作用(图。gydF4y2Ba2 ggydF4y2Ba).gydF4y2Ba
因此,我们决定也进行表征gydF4y2BaNbSVPgydF4y2Ba.qPCR显示,gydF4y2BaNbSVPgydF4y2Ba在幼苗和叶片中表达更强烈,而在茎中表达程度较低gydF4y2BaNbTM8gydF4y2Ba(无花果。gydF4y2Ba2 hgydF4y2Ba).似乎两者都是gydF4y2BaNbTM8gydF4y2Ba和gydF4y2BaNbSVPgydF4y2Ba在植物性部位获得最强表达水平gydF4y2Ba烟草benthamianagydF4y2Ba的相对表达式gydF4y2BaNbSVPgydF4y2Ba在花中也比在花中低gydF4y2BaNbTM8gydF4y2Ba与植物部件中的表达相比。原位杂交gydF4y2BaNbSVPgydF4y2Ba进一步表明,gydF4y2BaNbSVPgydF4y2Ba在开发芽中表达,类似于gydF4y2BaNbTM8gydF4y2Ba但相反,其表达在花卉分娩中不存在(图。gydF4y2Ba2 i, jgydF4y2Ba;额外的文件gydF4y2Ba3 gydF4y2Ba).这类似于gydF4y2Ba拟南芥gydF4y2Ba在哪里gydF4y2BaSVPgydF4y2Ba在营养生长过程中表达是恒定的,但在花序中表达减少,并在花发育过程中进一步消失[gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba].qPCR在发育系列中揭示了与之相反的gydF4y2BaNbTM8gydF4y2Ba,的表达gydF4y2BaNbSVPgydF4y2Ba在营养发育早期并没有出现主要高峰。类似于gydF4y2BaNbTM8gydF4y2Ba,gydF4y2BaNbSVPgydF4y2BamRNA的表达量在开花过程开始时增加gydF4y2Ba烟草APETALA1gydF4y2Ba(gydF4y2BaNbAP1gydF4y2Ba表示(图。gydF4y2Ba2 kgydF4y2Ba额外的文件gydF4y2Ba4gydF4y2BaD)。gydF4y2Ba
这些数据对共同表达和相互作用gydF4y2BaNbSVPgydF4y2Ba和gydF4y2BaNbTM8gydF4y2Ba,建议gydF4y2BaNbTM8gydF4y2Ba在一起gydF4y2BaNbSVPgydF4y2Ba在枝条到开花的过渡中可能有重叠的作用。的表达gydF4y2BaNbTM8gydF4y2Ba在营养发展早期进一步表明gydF4y2BaNbTM8gydF4y2Ba可能在少年到成人过渡中发挥作用。gydF4y2Ba
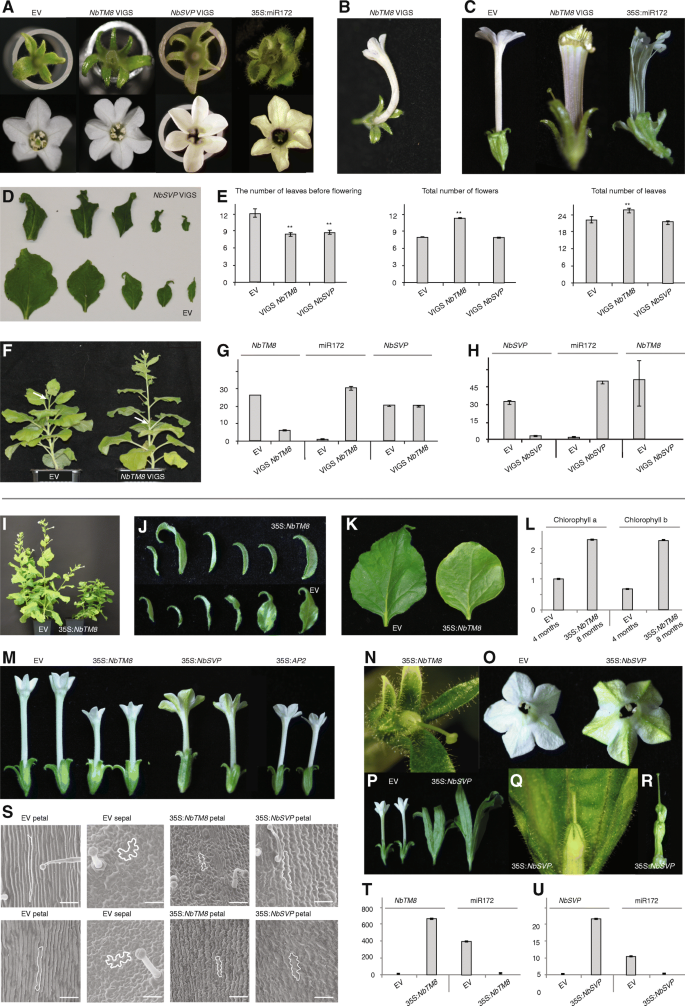
我们评估了……的效果gydF4y2BaNbTM8gydF4y2Ba和gydF4y2BaNbSVPgydF4y2Ba利用病毒诱导的基因沉默进行击倒。空向量(EV)变换gydF4y2Ba农杆菌属gydF4y2Ba被注射到控制植物中。由此产生的gydF4y2BaNbTM8gydF4y2Ba-VIGS植物和gydF4y2BaNbSVPgydF4y2Ba-VIGS植物在几个方面非常相似。gydF4y2BaNbTM8gydF4y2Ba-VIGS植株的花和花序叶均表现出一系列特征缺陷。最常观察到的异常(在15%的VIGS花和3%的EV,gydF4y2BapgydF4y2Ba= 0.018)与EV植物相比,Vigs植物的外三螺纹中的花器官数量增加,也是经常显示的特征gydF4y2BaNbSVPgydF4y2Ba-VIGS植物(19%的花相比EV的3%,gydF4y2BapgydF4y2Ba= 0.004)(图gydF4y2Ba3gydF4y2Ba).此外,在某些情况下,gydF4y2BaNbTM8gydF4y2Ba-VIGS花瓣管扭曲或有时甚至打开(图。gydF4y2Ba3 b, cgydF4y2Ba).叶在花序是较小的,扭曲和深绿色(图。gydF4y2Ba3 dgydF4y2Ba).总的来说,gydF4y2BaNbTM8gydF4y2Ba-VIGS植物可以描述为加速发展的基础上增加了花和叶的生产速度。这两个gydF4y2BaNbTM8gydF4y2Ba-VIGS和gydF4y2BaNbSVPgydF4y2Ba- 在作为代理之前使用叶片的叶子数量时,植物正在早期开花(图。gydF4y2Ba3 e-fgydF4y2Ba).与对照植物相比,它们的开花时间提前了大约三片叶子,表明两者都有gydF4y2BaNbSVPgydF4y2Ba和gydF4y2BaNbTM8gydF4y2Ba作为花过渡的阻遏物gydF4y2Ba烟草gydF4y2Ba(无花果。gydF4y2Ba3 egydF4y2Ba).为gydF4y2BaNbSVPgydF4y2Ba这并不奇怪,因为gydF4y2BaSVP-gydF4y2Ba类似的基因已经被证明是花过渡的阻遏物gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba28gydF4y2Ba].为gydF4y2BaTM8gydF4y2Ba然而,早期开花表型尚未归因于该亚科的成员。qPCR证实明显减少gydF4y2BaNbTM8gydF4y2Ba和gydF4y2BaNbSVPgydF4y2Ba在花序叶和花中均有表达gydF4y2BaNbTM8gydF4y2Ba-VIGS和gydF4y2BaNbSVPgydF4y2Ba-VIGS电厂分别与电动汽车控制(图。gydF4y2Ba3 ggydF4y2Ba).有趣的是,观察到的表型与gydF4y2Ba烟草gydF4y2Ba构成表达的植物gydF4y2Ba拟南芥mir172gydF4y2Ba(无花果。gydF4y2Ba3得了gydF4y2Ba) [gydF4y2Ba30.gydF4y2Ba].为了验证是否表达的增加gydF4y2BamiR172gydF4y2Ba也许可以解释一些表型,gydF4y2BamiR172gydF4y2Ba中定量表达gydF4y2BaNbTM8gydF4y2Ba-VIGS和gydF4y2BaNbSVPgydF4y2Ba-vigs行。结果表明gydF4y2BamiR172gydF4y2Ba与电动汽车控制装置相比,在VIGS株系中明显上调(图5)。gydF4y2Ba3 g hgydF4y2Ba).因为gydF4y2BaNbTM8gydF4y2Ba和gydF4y2BaNbSVPgydF4y2Ba能够相互作用并表现出相似的表型,它们也可能相互调节。的确,gydF4y2BaNbSVPgydF4y2Ba沉默的结果在伴随的下调gydF4y2BaNbTM8gydF4y2Ba(无花果。gydF4y2Ba3 hgydF4y2Ba),同时保持沉默gydF4y2BaNbTM8gydF4y2Ba不影响gydF4y2BaNbSVPgydF4y2Ba级别(无花果。gydF4y2Ba3 ggydF4y2Ba).gydF4y2Ba
沉默和过度表达的影响gydF4y2BaNbTM8gydF4y2Ba和gydF4y2BaNbSVPgydF4y2Ba.gydF4y2Ba一个gydF4y2Ba额外的花器官gydF4y2BaNbTM8 -gydF4y2Ba和gydF4y2BaNbSVPgydF4y2Ba-VIGS植物,类似于35S:gydF4y2BamiR172gydF4y2Ba表型。gydF4y2BabgydF4y2Ba在一些扭曲的花瓣管gydF4y2BaNbTM8gydF4y2Ba-VIGS植物。gydF4y2BacgydF4y2Ba分裂花瓣管gydF4y2BaNbTM8gydF4y2Ba-VIGS 35 s:gydF4y2BamiR172gydF4y2Ba植物。gydF4y2BadgydF4y2BaNbTM8gydF4y2Ba-VIGS植物有花序小,greenisher和扭曲的叶子。gydF4y2BaegydF4y2Ba开花早,发育加快gydF4y2BaNbTM8gydF4y2Ba-VIGS和gydF4y2BaNbSVPgydF4y2Ba-VIGS植物。星号表示在0.01显著性水平上存在显著性差异。gydF4y2BafgydF4y2BaNbSVPgydF4y2Ba-VIGS植株较对照开花早。(箭头表示第一朵花)。gydF4y2BaggydF4y2Ba相对表达gydF4y2BaNbTM8gydF4y2Ba,gydF4y2BamiR172gydF4y2Ba和gydF4y2BaNbSVPgydF4y2Ba在花序组织中gydF4y2BaNbTM8gydF4y2Ba-VIGS和控制植物。gydF4y2BahgydF4y2Ba相对表达gydF4y2BaNbSVPgydF4y2Ba,gydF4y2BamiR172gydF4y2Ba和gydF4y2BaNbTM8gydF4y2Ba在gydF4y2BaNbSVPgydF4y2Ba-VIGS和控制植物。gydF4y2Ba我gydF4y2Ba最强的35 s:gydF4y2BaNbTM8gydF4y2Ba线生长较慢,只发育幼叶。gydF4y2BajgydF4y2BaEV的萼片和苞片与35S的萼片和萼片苞片比较:gydF4y2BaNbTM8。gydF4y2BakgydF4y2Ba与35S相比,成年叶片的特写:gydF4y2BaNbTM8gydF4y2Ba叶子。gydF4y2BalgydF4y2Ba4月龄EV植株与8月龄35S植株叶绿素水平比较:gydF4y2BaNbTM8gydF4y2Ba植物。gydF4y2Ba米gydF4y2Ba35岁以下的花瓣管:gydF4y2BaNbTM8gydF4y2Ba,35秒:gydF4y2BaNbSVPgydF4y2Ba, 35 s:gydF4y2BaNbAP2gydF4y2Ba花。N)强缩瓣管35S:gydF4y2BaNbTM8gydF4y2Ba花。gydF4y2BaogydF4y2Ba35S的花瓣状萼片:gydF4y2BaNbSVPgydF4y2Ba线条。gydF4y2BapgydF4y2Ba35S的叶状萼片:gydF4y2BaNbSVPgydF4y2Ba线与EV比较。gydF4y2Ba问gydF4y2Ba35S的强烈缩瓣筒和扩大萼片:gydF4y2BaNbSVPgydF4y2Ba花。gydF4y2BargydF4y2Ba35S叶状心皮:gydF4y2BaNbSVPgydF4y2Ba花。gydF4y2Ba年代gydF4y2BaEV萼片和花瓣的扫描电镜对比35S:gydF4y2BaNbTM8gydF4y2Ba和35秒:gydF4y2BaNbSVPgydF4y2Ba花瓣。比例尺代表50 μm。gydF4y2BatgydF4y2Ba的相对表达水平gydF4y2BaNbTM8gydF4y2Ba和gydF4y2BamiR172gydF4y2Ba对照和35S的花序组织:gydF4y2BaNbTM8gydF4y2Ba线条。gydF4y2BaugydF4y2BaqPCR的gydF4y2BaNbSVPgydF4y2Ba和gydF4y2BamiR172gydF4y2Ba对照和35S的花序组织:gydF4y2BaNbSVPgydF4y2Ba.EV:空矢量控制线。错误栏是三种技术复制的平均值的标准错误gydF4y2Ba
由于沉默似乎加速了发育转变,我们解决了本构表达是否会通过产生转基因延迟这些过渡gydF4y2BaNbTM8gydF4y2Ba和gydF4y2BaNbSVPgydF4y2Ba超表达植株。虽然解释脱靶结合导致的过表达表型需要谨慎,但我们观察到许多一致的改变。在所有35S中:gydF4y2BaNbTM8gydF4y2Ba株系中,最强的一株表现出所有叶片向幼叶的戏剧性转变,花序苞片仍保持萼片状(图1)。gydF4y2Ba3i,J.gydF4y2Ba).两个株系显示出显著的寿命增加-超过三倍-衰老被推迟由叶绿素水平的比较(图。gydF4y2Ba3 k, lgydF4y2Ba).此外,这些最强壮的品系不产生任何种子。在所有的转基因株系中,花瓣管的大小严重减少,并变得更绿色(图。gydF4y2Ba3M,N.gydF4y2Ba),在构成表达的植物中先前观察到的表型gydF4y2Ba拟南芥APETALA2gydF4y2Ba(gydF4y2BaAP2gydF4y2Ba)gydF4y2Ba烟草gydF4y2Ba[gydF4y2Ba30.gydF4y2Ba].转基因植物overexpressinggydF4y2BaNbSVPgydF4y2Ba也显示相似的表型如35S:gydF4y2BaNbTM8gydF4y2Ba植物。他们也导致减少和绿色的花瓣管(无花果。gydF4y2Ba3 m, o-qgydF4y2Ba).扫描电子显微镜显示,这是一个结果部分花瓣到萼片转变(图。gydF4y2Ba3 sgydF4y2Ba).在其他35 s:gydF4y2BaNbSVPgydF4y2Ba当萼片增大时,花瓣筒更强烈地减少(图。gydF4y2Ba3P,Q.gydF4y2Ba).萼片和心皮呈叶状,如前所述的异位表达gydF4y2BaSVPgydF4y2Ba其他茄科植物的类基因(图。gydF4y2Ba3 p-rgydF4y2Ba) [gydF4y2Ba31gydF4y2Ba].在35 s:gydF4y2BaNbTM8gydF4y2Ba和35秒:gydF4y2BaNbSVPgydF4y2Ba线条,gydF4y2BamiR172gydF4y2Ba显著下调(图。gydF4y2Ba3 t, ugydF4y2Ba).gydF4y2Ba
一起,gydF4y2BaNbTM8gydF4y2Ba和gydF4y2BaNbSVPgydF4y2Ba转录物在拍摄顶端商品中具有重叠的表达模式,在叶子,苞片和花卉营商中。当Sepal Primordia出现时,它们的表情模式是未耦合的gydF4y2BaNbSVPgydF4y2Ba表达式就消失了。根据上述数据,有可能gydF4y2BaNbTM8gydF4y2Ba和gydF4y2BaNbSVPgydF4y2Ba作为负稳定者gydF4y2BamiR172gydF4y2Ba在gydF4y2Ba烟草gydF4y2Ba并可通过压制控制发育过渡的时间gydF4y2BamiR172gydF4y2Ba的水平。gydF4y2Ba
TM8gydF4y2Ba似乎已经失去了它的功能gydF4y2Ba矮牵牛织布达gydF4y2Ba
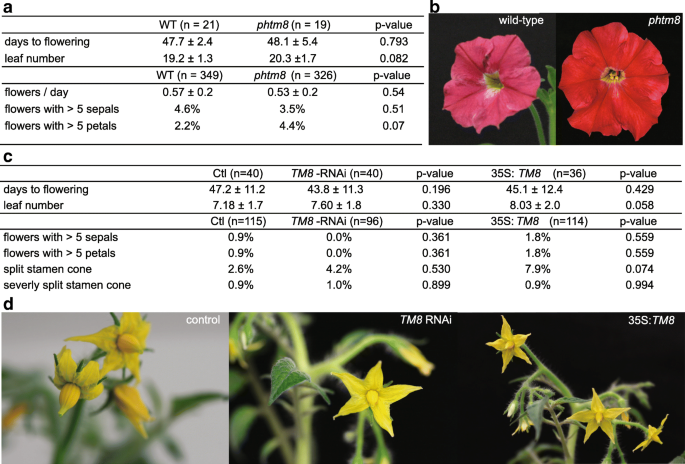
下一步是评估该开花抑制复合物在其他物种中的保护作用。密切相关的gydF4y2Ba佩妮gydF4y2Ba是一个很好的模式,考虑的可用性gydF4y2BaPHTM8gydF4y2Ba敲除突变体,其中包含由a引起的占地面积gydF4y2BadTph1gydF4y2Ba在起始密码子中插入转座子,导致帧移位(附加文件gydF4y2Ba5gydF4y2Ba).我们对19株足迹突变植物(gydF4y2BaPHTM8gydF4y2Ba)和21种野生型植物的发育和形态特征均无显著差异,但开花时间、叶和花形态均无显著差异(图1)。gydF4y2Ba4gydF4y2Ba).gydF4y2Ba
PHTM8gydF4y2Ba突变体,gydF4y2BaTM8gydF4y2Ba改变转基因西红柿不从控制植物不同。gydF4y2Ba一个gydF4y2Ba开花时间、开花前叶片数或花器官数的均值和标准差gydF4y2BaPHTM8gydF4y2Ba敲除突变体和野生型。gydF4y2BabgydF4y2Ba野生型之间没有明显区别gydF4y2Ba佩妮gydF4y2Ba和gydF4y2BaPHTM8gydF4y2Ba.gydF4y2BacgydF4y2Ba开花时间的平均值和标准偏差,开花前的叶子数,在转基因西红柿和控制的雄蕊锥中的花器官或异常。gydF4y2BadgydF4y2Ba控制,gydF4y2BaTM8gydF4y2Ba沉默和过度表达的番茄。gydF4y2BapgydF4y2Ba-值由非成对双尾学生t检验确定gydF4y2Ba
评价效果gydF4y2BaPHTM8gydF4y2Ba过度表达,我们试图生成35S:gydF4y2BaPHTM8gydF4y2Ba但我们无法克隆gydF4y2BaPHTM8gydF4y2Ba从gydF4y2Ba佩妮gydF4y2BaCDNA尽管克隆努力很大(见gydF4y2Ba方法gydF4y2Ba).在随后的搜索中gydF4y2BaPHTM8gydF4y2Ba表达数据我们发现gydF4y2BaPHTM8gydF4y2Ba也没有被拾起的各种疯狂箱基因筛选gydF4y2Ba佩妮gydF4y2BaImmink等人的cDNA文库[gydF4y2Ba32gydF4y2Ba].gydF4y2Ba
所有可用的爆破gydF4y2Ba佩妮gydF4y2Ba转录组和EST数据库到目前为止也没有提供任何结果,这表明gydF4y2BaPHTM8gydF4y2Ba不是或只是非常弱的表达gydF4y2Ba佩妮gydF4y2Ba至少在正常生长条件下是这样的。但在蛋白质序列上,与其他序列没有明显的偏差gydF4y2BaTM8gydF4y2Ba可以观察到伪化的同源或标记(附加文件gydF4y2Ba6gydF4y2Ba).因此,这种蛋白质可能仍然具有功能,但可能只能在尚未测试的条件下表达。gydF4y2Ba
综上所述,gydF4y2BaPHTM8gydF4y2Ba似乎不会充当花卉压缩机gydF4y2Ba佩妮gydF4y2Ba相比gydF4y2BaNbTM8gydF4y2Ba在gydF4y2Ba烟草gydF4y2Ba而它的功能似乎在这些属于同一科的物种之间发生了分歧。gydF4y2Ba
它在番茄中的作用也不清楚gydF4y2Ba
自gydF4y2Ba佩妮gydF4y2Ba似乎没有表达gydF4y2BaPHTM8gydF4y2Ba番茄是Solanceae科的另一种成员,也是最早被发现的一种gydF4y2BaTM8gydF4y2Ba经鉴定[gydF4y2Ba7gydF4y2Ba].获得2个过表达系和22个RNAi系gydF4y2Ba农杆菌属gydF4y2Ba介导的转化。从非选择性培养基上生长的未感染的外植体获得控制线。一旦转移到土壤,所有T0系都是基因分型和专注地观察到营养和生殖器官的可能异常,但没有观察到明显的一致偏差。尽管所有三个组的许多果实都是占疗法的,但可以从转基因和控制线中获得足够的种子来评估gydF4y2BaTM8gydF4y2Ba功能在T1代中,这是不可能利用VIGS在gydF4y2Ba烟草gydF4y2Ba.这两个35 s:gydF4y2BaTM8gydF4y2Ba和14个选择gydF4y2BaTM8gydF4y2Ba-RNAi转基因t1系基因分型,随后测试改变gydF4y2BaTM8gydF4y2Ba表达式RT-PCR(附加文件gydF4y2Ba7gydF4y2Ba).gydF4y2Ba
根据结果gydF4y2Ba烟草gydF4y2Ba我们期待改变的表达gydF4y2BaTM8gydF4y2Ba可能导致开花时间或花开始前叶片数量的变化,但这不是我们观察到的(图。gydF4y2Ba4摄氏度gydF4y2Ba).只有14一个测试gydF4y2BaTM8gydF4y2Ba-RNAi线平均为晚花与对照组相比,和一个35S:gydF4y2BaTM8gydF4y2Ba线是早开花,与我们观察到的相反gydF4y2Ba烟草gydF4y2Ba,但更重要的是,与其他任何一行都不一致。除开花时间外,我们还对T1植株的前3个花进行了表型分析,发现雄蕊球果变形、花器官多余等形态异常。同样,虽然这些花中的绝大多数看起来都很正常,但也有一些是对照组,gydF4y2BaTM8gydF4y2Ba-RNAi鲜花和35S:gydF4y2BaTM8gydF4y2Ba花有裂雄蕊圆锥(无花果。gydF4y2Ba4 c, dgydF4y2Ba).只有三种花,每组一种花,表现出严重的症状,如[gydF4y2Ba9gydF4y2Ba(图。gydF4y2Ba4摄氏度gydF4y2Ba额外的文件gydF4y2Ba8gydF4y2Ba).额外的花器官,见于gydF4y2Ba烟草gydF4y2Ba也观察到,但在非常低的数字和控制中再次gydF4y2BaTM8gydF4y2Barnai 35 s:gydF4y2BaTM8gydF4y2Ba行(无花果。gydF4y2Ba4摄氏度gydF4y2Ba额外的文件gydF4y2Ba8gydF4y2Ba).gydF4y2Ba
总之,我们得出结论,转基因番茄植株过表达gydF4y2BaTM8gydF4y2Ba或沉默gydF4y2BaTM8gydF4y2Ba和对照没有区别,对番茄没有明显的作用。我们的数据表明gydF4y2BaTM8gydF4y2Ba不充当开花压缩机gydF4y2Ba茄属植物lycopersium,gydF4y2Ba正如它在gydF4y2Ba烟草gydF4y2Ba.gydF4y2Ba
在整个进化过程中,表达谱是多样的gydF4y2Ba
虽然我们不能概括阻遏物的功能gydF4y2BaTM8gydF4y2Ba对于所有的茄科植物,我们想知道在进化过程中是否能找到一种普遍的表达模式。我们比较了现有的文献资料和新产生的表达gydF4y2BaTM8gydF4y2Ba在gydF4y2Ba日本柳杉粳稻gydF4y2Ba,gydF4y2Ba果实gydF4y2Ba,gydF4y2Ba葡萄gydF4y2Ba,gydF4y2Ba番木瓜gydF4y2Ba和gydF4y2Ba金鱼草majusgydF4y2Ba(无花果。gydF4y2Ba5gydF4y2Ba).基于这些数据,我们可能会谨慎地说,整个叶片中的进化表达减少,而在所有其他组织中的表达变化过多或没有足够的数据可以得出任何结论。通常,这些数据支持这个想法gydF4y2BaTM8gydF4y2Ba函数不是广泛守恒的。gydF4y2Ba
讨论gydF4y2Ba
虽然大多数MADS-box基因分支在至少一种模式生物中都有很好的特征,但只有有限的和经常不一致的发现已经发表gydF4y2BaTM8gydF4y2Ba- CLADE。努力贡献新的知识gydF4y2BaTM8gydF4y2Ba,重建了茄科植物的系统发育历史,并对茄科3种植物的基因进行了表征。gydF4y2Ba
的gydF4y2BaTM8gydF4y2Ba-谱系是一个更古老的MADS-box谱系,因为它已经出现在精子植物的最后一个共同祖先[gydF4y2Ba4gydF4y2Ba].我们发现,与大多数其他MADS-box转录因子不同的是,它的副本在ε和γ等主要复制事件发生后并没有被保留,整个基因组的复制和三倍复制分别发生在被子植物和核心eudicots的起源之前[gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba].茄科植物也经历了一次全基因组三倍复制,gydF4y2BaTM8gydF4y2Ba再次主要呈现为单一拷贝基因。Angiospers缺乏重复可能是为什么的主要原因gydF4y2BaTM8gydF4y2Ba失去了几个独立的时间[gydF4y2Ba6gydF4y2Ba].然而,如此多的被子植物物种可以在没有它的情况下繁荣发展的事实表明,它的功能变得不再那么必要,它变得特定于某些环境,或者它的功能在被子植物中迅速进化。gydF4y2Ba
我们在gydF4y2Ba烟草benthamianagydF4y2Ba的gydF4y2BaTM8gydF4y2BaorthologuegydF4y2BaNbTM8gydF4y2Ba起抑制作用gydF4y2BamiR172gydF4y2Ba.gydF4y2BaNbTM8gydF4y2Ba表达水平受到gydF4y2BaNbSVPgydF4y2Ba它们的蛋白质产物相互作用。这两种转录因子在茎中有重叠的表达模式。类似的,gydF4y2BaNbTM8gydF4y2Ba我们确定了gydF4y2BaNbSVPgydF4y2Ba抑制作为…的抑制因子gydF4y2BamiR172gydF4y2Ba.当我们能够提出一个功能gydF4y2Ba烟草benthamianagydF4y2Ba这一功能在其他近缘茄科植物中似乎没有很强的保守性。缺乏明确的表型gydF4y2BaPetunia TM8gydF4y2Ba-mutant和both thegydF4y2BaTM8gydF4y2Ba结果表明,转基因番茄的RNAi基因表达水平高于转基因番茄gydF4y2BaTM8gydF4y2Ba在这些物种中没有重要的功能。因此,我们必须得出结论gydF4y2BaTM8gydF4y2Ba虽然它们的蛋白质序列看起来很保守,但它们的功能在这些密切相关的物种之间已经严重分化,甚至消失了。gydF4y2Ba
似乎两者gydF4y2BaSVPgydF4y2Ba和gydF4y2BaTM8gydF4y2Ba是茄科物种中快速进化的调节模块的一部分,可能对物种间的表型多样性有广泛的贡献。事实上,也gydF4y2BaSVPgydF4y2Ba在茄科中功能分化。在密切相关的gydF4y2BaNicotiana Tabacum ntsvp.gydF4y2Ba被发现调节花梗伸长[gydF4y2Ba35gydF4y2Ba].在番茄gydF4y2BaSVPgydF4y2Ba同源物是gydF4y2Ba无接缝的gydF4y2Ba它离区发展和花序结构【功效gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba].在gydF4y2Ba酸浆属物种MFP2gydF4y2Ba授粉后调节充气萼[gydF4y2Ba31gydF4y2Ba].茄科植物的外部gydF4y2Ba金鱼草majusgydF4y2Ba同系物的gydF4y2BaSVPgydF4y2Ba是gydF4y2BaINCOMPOSITAgydF4y2Ba,它阻止了预先叶素的发育并控制了花的分生组织的特性[gydF4y2Ba38gydF4y2Ba].gydF4y2Ba
对于番茄来说,我们的结果与Daminato等人进行的类似研究中发现的结果完全对应。[gydF4y2Ba9gydF4y2Ba].作者在22分之中描述了Androecia中的形态畸形gydF4y2BaTM8gydF4y2Ba过表达线是与野生型番茄相比唯一的宏观差异[gydF4y2Ba9gydF4y2Ba].我们在OE、RNAi和对照植物中观察到相同的表型和其他花轮模式的干扰。这里必须注意的是,我们所有t0线的大多数花看起来完全正常,只有少数植物的少数花显示这种异常,通常在第一朵花开放。在Daminato等人的研究中,并没有明确指出转基因株系中有多少花表现出这种表型。Daminato等人以正常的野生型番茄为对照,我们使用的是从体外生长的未接种的愈伤组织中获得的番茄,我们假设两项研究中观察到的畸形可能是由于体细胞无性系变异[gydF4y2Ba39gydF4y2Ba].此外,只有两个野生型番茄被描述为一个控制,并且由于表型的低发病率,至少在我们的情况下,这不是不可能,作者因此错过分裂雄蕊锥的在野生型系的存在在他们的研究。另外,我们只生成了两个表达系的事实,可能反过来解释为什么我们没有观察到一致的张开雄蕊表型。gydF4y2Ba
另一个解释可能是Daminato等人。使用较长的剪接变体(NM_001247176.2)的构建体,这似乎在我们的对齐中看到的整个Salanaceae(附加文件gydF4y2Ba6gydF4y2Ba).我们使用了较短的变体,因为这是我们从我们的cDNA拾取的克隆。短变体显示从BP 142到BP 155(位于K域的最后一部分)中的删除,并定期在茄科中发生。到目前为止,均未报告两种剪接变体之间可能的差异。吲哚不太可能影响高阶复杂的形成,如K3结构域所提出的,因此蛋白质失去了其功能[gydF4y2Ba40gydF4y2Ba].为了评估较短和较长剪接变体的效果,两者应在相同的实验设置中进行评估。gydF4y2Ba
最后,我们发现了一些与另一个MADS-box基因有趣的相似之处,gydF4y2Ba开花轨迹CgydF4y2Ba(gydF4y2Ba方法gydF4y2Ba).gydF4y2Ba方法gydF4y2Ba在春化反应中起关键作用gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba41gydF4y2Ba].它压抑开花通路集成商gydF4y2Ba开花基因座T(ft)gydF4y2Ba和gydF4y2Ba抑制conans1 (soc1)过表达。gydF4y2Ba这是表观遗传学冷下调,使工厂只花冷的一个长时间之后[gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba].第一个相似之处gydF4y2BaTM8gydF4y2Ba这两个基因在基因组中的位置是相同的吗gydF4y2BaSEPALATA3gydF4y2Ba(gydF4y2BaSEP3.gydF4y2Ba) [gydF4y2Ba44gydF4y2Ba,gydF4y2Ba45gydF4y2Ba].的gydF4y2Ba方法gydF4y2Ba然而,基因的起源要晚于gydF4y2BaTM8gydF4y2Ba,有人认为gydF4y2Ba方法gydF4y2Ba类基因可以从gydF4y2BaTM8gydF4y2Ba被子植物祖先同源物[gydF4y2Ba44gydF4y2Ba,gydF4y2Ba45gydF4y2Ba].其次,这也是值得注意的是,这两个基因是失去了最常见的整个被子植物[中MADS盒分支gydF4y2Ba6gydF4y2Ba].有趣的是,在大多数情况下,一个丢失了,另一个仍然存在,这意味着大多数基因组至少包含其中一个。第三,这两者似乎也有功能上的联系:它们都被认为是发育转变和开花的抑制因子,并通过调节microRNA通路发挥作用,至少在细胞内是这样gydF4y2Ba烟草gydF4y2Ba关于gydF4y2BaTM8gydF4y2Ba[gydF4y2Ba46gydF4y2Ba].此外,在这些抑制活动中,双方都将SVP作为他们的互动伙伴[gydF4y2Ba47gydF4y2Ba].就像gydF4y2Ba方法gydF4y2Ba,功能为gydF4y2BaSVPgydF4y2Ba相变的延迟与温度有关[gydF4y2Ba48gydF4y2Ba,gydF4y2Ba49gydF4y2Ba].考虑到这两个gydF4y2Ba方法gydF4y2Ba和gydF4y2BaSVPgydF4y2Ba温度依赖性基因,似乎是评估温度效果的有趣选择gydF4y2BaTM8gydF4y2Ba未来研究中的功能。gydF4y2Ba
结论gydF4y2Ba
我们的目的是解决关于MADS-box基因功能的一个悬而未决的问题。我们能够在三个相关的茄科物种中生成功能数据,但仍然很难概括被子植物甚至茄科的功能。而gydF4y2BaTM8gydF4y2Ba似乎表现为阻遏物的功能gydF4y2BamiR172gydF4y2Ba在gydF4y2Ba烟草benthamianagydF4y2Ba,它的功能似乎同一个家庭的成员之间的分歧很快。它之前被提出gydF4y2BaTM8gydF4y2Ba是一种快速发展的基因[gydF4y2Ba4gydF4y2Ba我们的数据也符合这一观点。gydF4y2Ba
方法gydF4y2Ba
本研究中使用的所有引物列于附加文件中gydF4y2Ba9gydF4y2Ba.所有结构在使用前通过测序验证。gydF4y2Ba
系统发育分析gydF4y2Ba
之前确认gydF4y2BaTM8gydF4y2Ba来自不同物种的材料用于blast (blastn)到目前为止由Phytozome 12.0提供的所有Viridiplantae基因组[gydF4y2Ba20.gydF4y2Ba和Sol基因组网络[gydF4y2Ba50gydF4y2Ba)(附加文件gydF4y2Ba1gydF4y2Ba).所有编码序列均使用MAFT进行对齐,并使用geneous中实现的PhyML构建初始系统发育树,采用GTR替代模型和默认参数[gydF4y2Ba51gydF4y2Ba,gydF4y2Ba52gydF4y2Ba].在强支持范围内的所有序列gydF4y2BaTM8gydF4y2Ba选择-clade (SH-like branch support = 1)进行进一步分析。gydF4y2BaSOC1gydF4y2Ba基因被用作树根的外群。的gydF4y2BaTM8gydF4y2Ba在完全序列的基因组中检测到的序列额为NCBI NT,EST和TSA DataBank和TSKP平台在NCBI NT,EST和TSA DataBank和Onekp平台中获得的命中率为所有Angiosperm订单中的代表[gydF4y2Ba21gydF4y2Ba].由177个序列的最终数据矩阵再次通过MAFT对准,手动优化,并使用与PHYML SPR树形拓扑结构搜寻和GTR替代模型构建的最可能的树,并通过与100个重复[引导分析评价gydF4y2Ba53gydF4y2Ba].完整的系统发育包括所有登录号在附加文件中提供gydF4y2Ba2 gydF4y2Ba.gydF4y2Ba
植物材料和生长条件gydF4y2Ba
我们收到了转基因gydF4y2Ba烟草benthamianagydF4y2Ba过表达拟南芥miR-172a-1的细胞系来自陈雪梅(UC Riverside, Mlotshwa等人)[gydF4y2Ba30.gydF4y2Ba])。为gydF4y2Ba茄属植物lycopersicumgydF4y2Ba在本研究中使用了微汤姆品种。为gydF4y2Ba矮牵牛织布达gydF4y2Ba野生型W138和一个W138系,足迹为7bpgydF4y2BadTph1gydF4y2Ba插入gydF4y2BaPHTM8gydF4y2Ba使用起始密码子。所有的植物都在恒温(25°C)和长日照条件(16小时光照,8小时黑暗)下生长。gydF4y2Ban benthamianagydF4y2Ba和gydF4y2Ba佩妮gydF4y2Ba种子首先在慢性颗粒中播种并在维护的成长柜中种植。后来,它们种植在盆中并移动到生长室。gydF4y2Ba
RNA分离及cDNA制备gydF4y2Ba
RNA分离和逆转录gydF4y2Ba
将所有取样植物材料在液氮中冷冻并储存在-80℃。使用TrizoL®之后的制造商的指示(Invitrogen,Carlsbad,USA)和用涡轮增压DNA(Ambion,Austin,USA)治疗的DNase来分离总RNA。使用Goscript逆转录系统(Promega,Madison,USA),RNA被逆转录至cDNA。使用分光光度计测定RNA质量,通过扩增来测试成功的逆转录gydF4y2Ba施gydF4y2Ba通过PCR基因。gydF4y2Ba
用于MicroRNA定量的茎环QRT-PCR的RNA分离gydF4y2Ba
再次使用TRIzol®分离RNA,但对于RNA沉淀,我们使用了两倍体积的异丙醇,在−80°C下沉淀30分钟。用AMV逆转录试剂盒(Promega, Wisconsin, U.S.A.)制备cDNA。后(gydF4y2Ba54gydF4y2Ba],我们设计了一个定制的茎环引物来特异性逆转录microRNA172和microRNA156。使用AMV逆转录酶(Promega, Madison, US)在总RNA池中使用oligo-dT引物逆转录多a -尾mRNA 's。gydF4y2Ba
描述的gydF4y2BaNbTM8gydF4y2Ba和gydF4y2BaNbSVPgydF4y2Ba在gydF4y2Ba烟草benthamianagydF4y2Ba
克隆gydF4y2BaNbTM8gydF4y2Ba和gydF4y2BaNbSVPgydF4y2Ba,gydF4y2BaSOC1gydF4y2Ba- - -gydF4y2BaAP1gydF4y2Ba同源染色体gydF4y2Ba
的全长序列gydF4y2BaNbTM8gydF4y2Ba从花蕾的cDNA序列中克隆得到gydF4y2BaNtTM8gydF4y2Ba(EB449747)。的部分序列gydF4y2BaSVPgydF4y2Ba在gydF4y2Ban benthamianagydF4y2Ba存在于Genbank(EH369950)的EST-Database中。我们使用3'RACE克隆3'-序列gydF4y2BaNbSVPgydF4y2Ba.一个正向引物与一个寡核苷酸结合来扩增3 '区。为gydF4y2BaAPETALA1gydF4y2Ba(gydF4y2BaAP1gydF4y2Ba)的同源序列gydF4y2Ba烟草gydF4y2Ba(gydF4y2BaNAP1-2gydF4y2BaAF009127)和gydF4y2Ba烟草的抗旱性gydF4y2Ba(gydF4y2Bansmads2.gydF4y2BaAF068726)建成。选择正向和反向引物扩增231 bp的区域gydF4y2BaNbAP1gydF4y2Ba.(gydF4y2BaSOC1gydF4y2Ba基于gydF4y2BaConstans1的SufressorgydF4y2Ba-homologs来自gydF4y2Ba烟草gydF4y2Ba(gydF4y2Batobmads1gydF4y2Ba(X76188)和茄属番茄(Solanum lycopersicon) (BG599624)gydF4y2BaNBSoc1.gydF4y2Ba通过类似的策略被放大了。新的序列被添加到基因库。gydF4y2Ba
qRT-PCR和发育系列gydF4y2Ba
检测选定基因和microRNA的表达(gydF4y2BaNbTM8gydF4y2Ba,gydF4y2BaNbSVPgydF4y2Ba,gydF4y2BaNBSoc1.gydF4y2Ba,gydF4y2BaNbAP1gydF4y2Ba,gydF4y2BamiR156gydF4y2Ba和gydF4y2BamiR172gydF4y2Ba),采用qRT-PCR。Real-time PCR在steone Plus仪器上(Applied Biosystems, Forster City, US)使用Fast SYBR Green Master Mix (Applied Biosystems, Forster City, US)进行。使用Applied Biosystems Primer Express软件设计引物。利用与茎环引物互补的引物和microRNA正向互补引物对成熟microRNA水平进行定量。利用植物开始开花前的花序组织来量化EV、VIGS或过表达系中的基因或microRNA。这里提供的所有数据都是来自两个生物复制的三个技术复制,并对它们进行了归一化处理gydF4y2Ba施gydF4y2Ba表达。发育系列从幼苗开始,两个完全扩展的子叶。每次出现新的叶子时都会抽出后续阶段。为了测量单独的植物器官中的表达,在第一朵花的开花中取样成熟植物的整个器官。在发育系列和单独的植物器官中,收集汇集的植物材料以获得足够的组织以进行RNA分离。使用Delta CT-Method分析数据。gydF4y2Ba
原位杂交gydF4y2Ba
使用T7 RNA聚合酶(New England Biolabs, Ipswich, AU)在包含T7启动子的PCR扩增模板中使用地高辛标记的UTP (Roche, Basel, CH)在体外转录Sense和反义探针。组织用4%多聚甲醛固定,石蜡包埋,8 μm切片。切片安装在Probe-On-Plus幻灯片上(Fisher Scientific,匹兹堡,美国)。杂交前,杂交和检测基本上遵循Carr & Irish [gydF4y2Ba55gydF4y2Ba].gydF4y2Ba
病毒引起的基因沉默gydF4y2BaNbTM8gydF4y2Ba和gydF4y2BaNbSVPgydF4y2Ba
Gene-specific地区gydF4y2BaNbTM8gydF4y2Ba和gydF4y2BaNbSVPgydF4y2Ba被引入TRV2载体[gydF4y2Ba56gydF4y2Ba].这些结构被转换为gydF4y2Ba农杆菌属gydF4y2Ba菌株GV3101并用来渗透gydF4y2Ban benthamianagydF4y2Ba.为了量化开花时间,gydF4y2Ban benthamianagydF4y2Ba种子是在长日照条件下播种的。相当数量的植株(20-50)在可能的幼龄阶段(3 - 4叶场)被渗透。入渗后,将植物送回生长室,用箔纸覆盖2天以保持湿润。开花时间是指第一朵花出现前叶片的数量。作为对照,用空载体TRV2渗透植株,并在相同条件下生长。叶和花的材料来自gydF4y2BaNbTM8gydF4y2Ba-VIGS,gydF4y2BaNbSVPgydF4y2Ba在液氮中收集显示表型的-VIGS植株和空病媒控制植株,以检查有效下调。gydF4y2Ba
过度表达gydF4y2BaNbTM8gydF4y2Ba和gydF4y2BaNbSVPgydF4y2Ba
全长序列gydF4y2BaNbTM8gydF4y2Ba和gydF4y2BaNbSVPgydF4y2Ba从gydF4y2Ba烟草benthamianagydF4y2Ba克隆到35S过表达载体(pcB301,菲利普罗兰)。过表达载体转化到gydF4y2Ba农杆菌属gydF4y2Ba应变GV3101。稳定的转变gydF4y2Ba烟草benthamianagydF4y2Ba遵循番茄优化的转化方案,但使用叶盘作为外植体[gydF4y2Ba57gydF4y2Ba].与T0空载体线相比,在T0代进行表型表征为强35S:gydF4y2BaNbTM8gydF4y2Ba品系全为雌性不育。gydF4y2Ba
酵母2台混合动力gydF4y2Ba
全长gydF4y2BaNbTM8gydF4y2Ba和gydF4y2BaNbSVPgydF4y2Ba序列与PGAD424-载体中的GAL4活化结构域与PGBT9矢量(CLONTECH,山景,CA)中的GAL4 DNA结合结构域融合。如[gydF4y2Ba58gydF4y2Ba].每种转化的两种菌落用于β-半乳糖苷酶液体测定,并通过使用邻硝基苯基-β-半乳糖胺(ONPG)作为基材进行相互作用[gydF4y2Ba59gydF4y2Ba].米勒单位的量化β牛乳糖活动是使用以下公式计算:米勒单位=(1000×A420) / (t V××OD600) A420 =吸光度在420 nm, OD600 =光密度在600 nm, t和V = 0 =数量的分钟。5毫升。gydF4y2Ba
Co-IPgydF4y2Ba
全长gydF4y2BaNbTM8gydF4y2Ba和gydF4y2BaNbSVPgydF4y2Ba克隆到HBT95表达载体[gydF4y2Ba60gydF4y2Ba]与双血凝素(HA)或FLAG标记,然后max - prepared。后来他们被改造了gydF4y2Ba拟南芥gydF4y2Ba使用PEG-CA的原生质体gydF4y2Ba2 gydF4y2Ba转化和共同免疫沉淀如[gydF4y2Ba61gydF4y2Ba].通过使用HA-HRP和Flag-HRP抗体通过蛋白质印迹通过琼脂糖珠捕获蛋白质,通过蛋白质印迹通过蛋白质印迹来观察共同免疫沉淀的蛋白质。gydF4y2Ba
扫描电子显微镜gydF4y2Ba
将植物材料固定在FAA(70%乙醇:乙酸:40%甲醛,90:5:5)中,并在70%乙醇中洗涤两次,并在70%乙醇和二甲氧基亚亚甲烷(DMM)的1:1混合物中脱水。5分钟和纯DMM 20分钟。临界点干燥后(CPD 030; BAL-TEC AG,BALZERS,LIECHTENSTEIN),使用乳头-C将干燥的材料安装在铝片上并用金(SPI模块溅射涂布机; SPI SUPPLIES,WEST CHESTERS,PA,美国))在用JEOL JSM-6360 SEM(JEOL Ltd.,Tokyo,Japan)观察之前。gydF4y2Ba
PHTM8gydF4y2Ba描述在gydF4y2Ba矮牵牛织布达gydF4y2Ba
识别的gydF4y2BaPHTM8gydF4y2BadTph1插入等位基因和衍生的足迹等位基因gydF4y2Ba
的gydF4y2Baphtm8 dTph1gydF4y2Ba通过爆炸搜索识别插入等位基因gydF4y2BadTph1gydF4y2Ba转座子侧翼序列数据库[gydF4y2Ba62gydF4y2Ba),近年来已经有了相当大的扩大。存在gydF4y2BadTph1gydF4y2Ba利用基因特异性引物对插入位点两侧的PCR方法,确定了该插入系在植株的后代中插入。在不同的后代中,我们确定了一些植物的纯合子突变假定的足迹等位基因。足迹等位基因的测序显示7bp的足迹插入导致移码突变gydF4y2BaPHTM8gydF4y2Ba编码序列。通过自行实现,获得来自纯合的WT和纯合的占地面积突变体的后代,用于进一步的表型分析。gydF4y2Ba
表现型的gydF4y2BaPetunia phtm8.gydF4y2Ba足迹突变gydF4y2Ba
21 W138gydF4y2Ba佩妮gydF4y2Ba野生型(WT)gydF4y2BaPHTM8gydF4y2Ba足迹突变体被编号并随机地放在生长室中。随后对植物的一般异常和营养特征进行表型分析。“开花的天数”是从播种的那一天开始计算的,直到第一朵花盛开的那一天。“叶数”包括在第一次花序之前的所有真叶(无子叶)。开花后,统计每株植物前20朵花的萼片数、花瓣数及其他异常情况,直至实验结束。采用非配对双尾t检验,以确定在对照组和足迹线之间测量的特征的平均值是否有显著差异。gydF4y2Ba
克隆gydF4y2BaPHTM8gydF4y2Ba
二gydF4y2BaPHTM8gydF4y2Ba根据预测的CDS设计引物对gydF4y2BaPHTM8gydF4y2Ba(M. VandenBussche)。除了gydF4y2BaPHTM8gydF4y2Ba正向引物与polyT反向引物结合。以6、8、12、14、16、18和20个叶场的全株材料为材料,在47℃~ 60℃退火30 ~ 45个周期,对其cDNA进行PCR检测。所有得到的合适长度(约579 bp)的扩增子被克隆到pGEM®-T Easy (Promega)中,随后测序,但没有匹配gydF4y2BaTM8gydF4y2Ba.在我们尝试克隆失败之后gydF4y2BaPHTM8gydF4y2Ba,随后的数据集gydF4y2BaPHTM8gydF4y2Ba表达式:gydF4y2Ba佩妮gydF4y2Ba转录组(gydF4y2Ba63gydF4y2Ba]、SOL基因组网络(SGN)的Unigenes和ESTs [gydF4y2Ba50gydF4y2Ba]和矮牵牛花NCBI转录组猎枪组装(TSA)。gydF4y2Ba
描述的gydF4y2BaTM8gydF4y2Ba在gydF4y2Ba茄属植物lycopersicumgydF4y2Ba
克隆gydF4y2BaTM8gydF4y2Ba
完整的番茄gydF4y2BaTM8gydF4y2Ba使用基于所述序列(X60760.1)引物,从成熟叶cDNA克隆[gydF4y2Ba7gydF4y2Ba].经测序确认后,通过BP克隆反应将其克隆到pDONR21中,然后通过Gateway克隆公司的LR克隆反应将其克隆到pK2GW7载体中[gydF4y2Ba64gydF4y2Ba].构建一个长度为332bp的番茄片段gydF4y2BaTM8gydF4y2Ba,从I-bp的域266和在3'UTR结束开始,被选中。短短gydF4y2BaTM8gydF4y2Ba在番茄基因组中敲除-片段,验证其特异性。除了gydF4y2BaTM8gydF4y2Ba,证明所选序列具有较高的特异性,适合RNAi。将332 bp序列克隆到pK7GWIWG2(I)载体中。所有目的载体均经测序确认。这些结构被转化为LBA4404gydF4y2Ba农杆菌属gydF4y2Ba菌株和选择在规格/链球菌/rif板。gydF4y2Ba
番茄转变gydF4y2Ba
番茄转化协议如下所示[gydF4y2Ba65gydF4y2Ba].将番茄子叶切成两半,作为外植体用于农业侵染。转化的外植体在补充卡那霉素(kan)的2z培养基上进一步生长,只允许成功转化的外植体存活。对照系由未转化的愈伤组织产生,在不含抗生素的2z培养基上生长。转化植株在MSSV +IBA + kan培养基上产生地上部和根后,在土壤中进行种植。对所有T0和T1植株进行基因分型,使用35S启动子上的正向引物和k域上的反向引物(引物列表)来确认这些结构物的存在。半定量PCR结果证实OE基因的表达高于ctl,而在沉默基因中没有(或低得多)表达。取一朵开放花的花序进行RT-PCR。gydF4y2Ba
番茄转化体的表型gydF4y2Ba
所有T0植株的营养或生殖结构均有异常。在可能的地方收获种子,然后再播种。T1植株进行详尽的表型分析。对照组40例,RNAi 40例,OE 36例,随机置于生长室内。植物的表型方式与gydF4y2Ba佩妮gydF4y2Ba.观察每株植物前3个花的花瓣数、萼片数、雄蕊分裂数、球果数等异常情况。统计学意义由非配对双尾t检验确定。gydF4y2Ba
缩写gydF4y2Ba
- AP1:gydF4y2Ba
-
APETALA1gydF4y2Ba
- AP2:gydF4y2Ba
-
APETALA2gydF4y2Ba
- 方法:gydF4y2Ba
-
开花轨迹CgydF4y2Ba
- 英国《金融时报》:gydF4y2Ba
-
开花轨迹TgydF4y2Ba
- OE:gydF4y2Ba
-
超表达gydF4y2Ba
- SOC1:gydF4y2Ba
-
铜抑制器1gydF4y2Ba
- SVP:gydF4y2Ba
-
营养期短gydF4y2Ba
- TM8:gydF4y2Ba
-
番茄马德斯8gydF4y2Ba
- 中收取:gydF4y2Ba
-
病毒诱导的基因沉默gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
Theissen G, Becker A, Di Rosa A, Kanno A, Kim JT, Münster T,等。MADS-box基因在植物中的应用历史较短。In:植物分子进化;2000.115 - 49页。gydF4y2Ba
- 2.gydF4y2Ba
研究了MADS-box基因的主要分支及其在开花植物发育和进化中的作用。分子系统进化。2003;29:46 - 89。gydF4y2Ba
- 3.gydF4y2Ba
关键词:植物,MADS-domain,发育多样性,进化多样性发展。2012;139:3081 - 98。gydF4y2Ba
- 4.gydF4y2Ba
格拉姆措L,Weilandt L,泰森G. MADS针叶树进入基因组:朝向确定种子植物祖先集的MADS-box基因。Ann Bot。2014; 114:1407至29年。gydF4y2Ba
- 5.gydF4y2Ba
Heijmans K,莫雷尔P,Vandenbussche M. Mads-Box基因和花卉发展:黑暗的一面。J Exp Bot。2012; 63:5397-404。gydF4y2Ba
- 6.gydF4y2Ba
系统基因组学揭示了开花植物中一系列重要和不可缺少的MADS-box基因。J Exp Zool B Mol Dev Evol. 2015; 324:353-62。gydF4y2Ba
- 7.gydF4y2Ba
Pnuuli L,Abu-Abeid M,Zamir D,Nacken W,Schwarz-Sommer Z,Lifschitz E.番茄中的Mads Box基因家族:患者在花卉发育期间的时间表达,与Antirrhinum和Arabidicopsis的归属基因的核心基因。工厂J. 1991; 1:255-66。gydF4y2Ba
- 8.gydF4y2Ba
Lifschitz E,Brodai L,Hareven d,赫尔维茨C,Prihadash A,Pnueli L,等人。花发育番茄的分子定位。在:尤德Ĵ,编辑。番茄的分子生物学。宾夕法尼亚州:Technomic的出版公司;1993年第175-84。gydF4y2Ba
- 9.gydF4y2Ba
关键词:番茄花,MADS-box, TM8,基因表达中国生物医学工程学报,2014;gydF4y2Ba
- 10.gydF4y2Ba
佐藤,萨科·萨托,萨凯,苏克海S.一种疯狂箱基因(ERAF17)的分离及其表达与黄瓜植物中乙烯乙烯形成雌花诱导的相关性(gydF4y2BaCucumis巨大成功gydF4y2BaL),足底。2001;213:943-52。gydF4y2Ba
- 11.gydF4y2Ba
明迈李。antirrhinummum jajus的新疯子箱基因的分子与遗传特征。博士论文。Universitätzuköln。2002年。gydF4y2Ba
- 12.gydF4y2Ba
Hileman LC, Sundstrom JF, Litt A, Chen M, Shumba T, Irish VF。番茄MADS-Box基因家族的分子和系统发育分析。生物学报,2006;23:2245-58。gydF4y2Ba
- 13.gydF4y2Ba
Díaz-Riquelme J, Lijavetzky D, Martínez-Zapater JM, Carmona MJ。葡萄中mikcc型MADS盒子基因的全基因组分析。植物杂志。2009;149:354 - 69。gydF4y2Ba
- 14.gydF4y2Ba
Díaz-Riquelme J, Martínez-Zapater JM, Carmona MJ。葡萄藤卷须和花序发育的转录分析(gydF4y2Ba葡萄gydF4y2Bal .)。《公共科学图书馆•综合》。2014;9:e92339。gydF4y2Ba
- 15.gydF4y2Ba
Lovisetto A,Guzzo F,Tadiello A,Toffali K,Favretto A,Casadoro G. Mad-Box基因的分子分析追溯到裸子植物的肉质果实发明。mol Biol Evol。2011; 29:409-19。gydF4y2Ba
- 16.gydF4y2Ba
徐忠,张强,孙玲,杜丹,程涛,潘浩,等。MADS-box基因家族的全基因组鉴定、特征分析和表达分析gydF4y2Ba李属却已gydF4y2Ba.Mol Gen Genomics。2014; 289:903-20。gydF4y2Ba
- 17.gydF4y2Ba
Wells CE, Vendramin E, Jimenez Tarodo S, Verde I, Bielenberg DG。桃MADS-box基因的全基因组分析[gydF4y2Ba碧桃gydF4y2Ba(l)类等)。植物生物学杂志。2015;15:41。gydF4y2Ba
- 18.gydF4y2Ba
acta photonica sinica, 2011, 40(5): 689 - 693 .牛青,李军,蔡东,钱明,贾辉,白松,等。休眠相关的MADS-box基因和microrna共同调控梨休眠转变(gydF4y2BaPyrus PyrifoliagydF4y2Ba白梨组)花蕾。实验机器人。2016;67:239-57。gydF4y2Ba
- 19.gydF4y2Ba
Kumar G, Arya P, Gupta K, Randhawa V, Acharya V, Singh AK。苹果MADS-box基因家族DAM和FLC-like基因的比较系统发育分析和转录谱分析。Sci众议员2016;6:20695。gydF4y2Ba
- 20.gydF4y2Ba
Goodstein DM,Shu S,Howson R,Neupane R,Hayes Rd,Fazo J等人。植物血统:绿色植物基因组学的比较平台。核酸RES。2012; 40:D1178-86。gydF4y2Ba
- 21。gydF4y2Ba
马雅琴,张建平,张建平,等。1000个工厂(1KP)项目的数据访问。Gigascience。2014;3:17。gydF4y2Ba
- 22。gydF4y2Ba
Maere S,De Bodt S,Raes J,Casneuf T,Van Montagu M,Kuiper M等。建模基因和基因组重复在真核生物中。PROC NATL ACAD SCI。2005; 102:5454-9。gydF4y2Ba
- 23。gydF4y2Ba
MADS-box多基因家族的分类和系统发育揭示了MADS-box基因亚家族在真核生物形态进化中的作用。生物化学学报,1996;43:48 - 516。gydF4y2Ba
- 24。gydF4y2Ba
Geuten K,Viaene T,Vekemans D,Kourmpetli S,Dria S.使用病毒诱导的基因沉默分析发育控制基因。方法Mol Biol。2013; 975:61-9。gydF4y2Ba
- 25。gydF4y2Ba
关键词:毛状体;相变gydF4y2Ba拟南芥gydF4y2Ba.发展。1997; 124:645-54。gydF4y2Ba
- 26。gydF4y2Ba
Samach A、Onouchi H、Gold SE、Ditta GS、Schwarz-Sommer Z、Yanofsky MF等。拟南芥CONSTANS靶基因在生殖发育中的不同作用科学。2000;288:1613-6。gydF4y2Ba
- 27。gydF4y2Ba
zhao HJ, Kim JJ, Lee JH, Kim W, Jung J-H, Park C-M,等。在拟南芥中,短营养期(SHORT VEGETATIVE PHASE, SVP)蛋白通过直接结合pri-miR172a启动子负调控miR172转录。2月。2012;586:2332-7。gydF4y2Ba
- 28。gydF4y2Ba
关键词:拟南芥,花过渡,负调控因子,SVP,分子克隆植物j . 2000; 21:351-60。gydF4y2Ba
- 29。gydF4y2Ba
在拟南芥花发育的早期阶段,AGL24和无瓣a1的冗多控制AGAMOUS。植物细胞。2006;18:1373 - 82。gydF4y2Ba
- 30.gydF4y2Ba
关键词:拟南芥,APETALA2,花模式缺陷,microRNA172中国生物医学工程学报,2006;gydF4y2Ba
- 31.gydF4y2Ba
他C, Saedler H.发现MPF2的异位表达是酸浆灯笼(Physalis)进化的关键。自然科学学报2005;102:579 - 84。gydF4y2Ba
- 32.gydF4y2Ba
Immink RGH,费拉里奥S,Busscher-朗格Ĵ,Kooiker男,Busscher男,Angenent介绍GC。分析矮牵牛MADS-box转录因子家族。Mol Gen Genomics。2003; 268:598-606。gydF4y2Ba
- 33.gydF4y2Ba
Jiao Y, Wickett NJ, Ayyampalayam S, Chanderbali AS, Landherr L, Ralph PE等。种子植物和被子植物的祖先多倍体。大自然。2011;473:97 - 100。gydF4y2Ba
- 34.gydF4y2Ba
关键词:数据挖掘,数据挖掘,数据挖掘,数据挖掘核心真核真核植物茎系的γ古六倍体:MADS-Box基因和物种多样化的意义中国生物医学工程学报,2012;gydF4y2Ba
- 35.gydF4y2Ba
王d,陈X,张Z,刘d,宋G,香港X等。甲MADS-box基因NtSVP通过直接抑制烟草KNAT1状KNOX基因NtBPL(规定花梗伸长gydF4y2Ba烟草gydF4y2Bal .)。实验机器人。2015;66:6233-44。gydF4y2Ba
- 36.gydF4y2Ba
Szymkowiak EJ,爱尔兰EE。JOINTLESS抑制了番茄花序分生组织的联合特性。足底。2006;223:646-58。gydF4y2Ba
- 37.gydF4y2Ba
刘丹,王丹,秦志,张丹,尹磊,吴磊,等。SEPALLATA MADS-box蛋白SLMBP21与JOINTLESS和MACROCALYX形成蛋白复合物,作为番茄花脱落区发育的转录激活因子。植物j . 2014; 77:284 - 96。gydF4y2Ba
- 38.gydF4y2Ba
Masiero S,Li M-A,我,Hartmann U,Saedler H,Huijser P等人。缺乏:一种疯狂箱基因控制antIrrhinum中的预防型发育和花卉营销特性。发展。2004; 131:5981-90。gydF4y2Ba
- 39.gydF4y2Ba
Khaliluev先生,Chaban IA, Kononenko NV, Baranova EN, Dolgov SV, Kharchenko PN等。转基因番茄植株花分生组织的异常发育并不依赖于防御相关pr蛋白和抗菌肽编码基因的表达。《中国生物医学工程学报》2014;gydF4y2Ba
- 40.gydF4y2Ba
关键词:mic -type MADS-domain protein,陆生植物,结构模块,相互作用基因。2005;347:183 - 98。gydF4y2Ba
- 41.gydF4y2Ba
Michaels SD, Amasino RM。开花位点C编码一种新的抑制开花的MADS结构域蛋白。植物细胞。1999;11:949。gydF4y2Ba
- 42.gydF4y2Ba
春化需要FLC通过组蛋白甲基化的表观遗传沉默。大自然。2004;427:164-7。gydF4y2Ba
- 43.gydF4y2Ba
Michaels SD, Himelblau E, Kim SY, Schomburg FM, Amasino RM。冬年拟南芥开花信号的整合。植物杂志。2005;137:149-56。gydF4y2Ba
- 44.gydF4y2Ba
召T,霍尔默R,Bruijn的小号DE,Angenent介绍GC,范登伯格HA,Schranz的ME。的MADS-box转录因子基因Phylogenomic共线性网络的分析表明沿袭特定换位,古串联重复和深度阵地保护。植物细胞。2017; 29:1278至1292年。gydF4y2Ba
- 45。gydF4y2Ba
Ruelens P,De Maagd Ra,Proost S,Theißeng,Geuten K,Kaufmann K.开花轨迹C在单码,串联的Anviosperm特异性疯箱基因。NAT Communce。2013; 4:2280。gydF4y2Ba
- 46。gydF4y2Ba
邓伟,应H,海利韦尔CA, Taylor JM, Peacock WJ, Dennis ES。开花位点C (FLC)调控拟南芥整个生命周期的发育途径。美国国家科学院学报2011;108:6680-5。gydF4y2Ba
- 47。gydF4y2Ba
李丹,刘超,沈磊,吴勇,陈浩,Robertson M,等。在拟南芥中,一个抑制因子复合物控制着开花信号的整合。Dev细胞。2008;15:110-20。gydF4y2Ba
- 48。gydF4y2Ba
Lee JH, Ryu H-S, Chung KS, Pose D, Kim S, Schmid M,等。MADS-Box转录因子抑制因子对温度反应性开花的调控科学。2013;342:628-32。gydF4y2Ba
- 49。gydF4y2Ba
Posé D, Verhage L, Ott F, Yant L, Mathieu J, Angenent GC, et al.;拮抗FLM变异株对开花的温度依赖调控。大自然。2013;503:414-7。gydF4y2Ba
- 50.gydF4y2Ba
Bombarely A, mena N, Tecle IY, Buels RM, Strickler S, fisher - york T,等。Sol Genomics Network (solgenomics.net):用Perl种植番茄。核酸杂志2011;39:D1149-55。gydF4y2Ba
- 51.gydF4y2Ba
参考文献:gindon S, Dufayard J-F, Lefort V, Anisimova M, Hordijk W, Gascuel O. New Algorithms and Methods to Estimate Maximum-Likelihood Phylogenies:评估PhyML 3.0的性能。系统医学杂志。2010;59:307-21。gydF4y2Ba
- 52.gydF4y2Ba
Kearse M,Moir R,Wilson A,Stones-Havas S,Cheung M,Sturrock S等人。佐芙基本:用于组织的集成和可扩展的桌面软件平台和序列数据分析。生物信息学。2012; 28:1647-9。gydF4y2Ba
- 53.gydF4y2Ba
系统发育的置信度限制:一种使用bootstrap的方法。进化。1985;39:783 - 91。gydF4y2Ba
- 54.gydF4y2Ba
陈c, Ridzon DA, Broomer AJ, Zhou Z, Lee DH, Nguyen JT,等。利用茎环RT-PCR实时定量microrna。核酸杂志2005;33:e179。gydF4y2Ba
- 55.gydF4y2Ba
卡尔·SM,爱尔兰VF。花的同源性基因表达决定了甘蓝的发育停滞期。葡萄孢属anditalica。足底。1997;201:179 - 88。gydF4y2Ba
- 56.gydF4y2Ba
Dinesh-Kumar SP,Anandalakshmi R,Marathe R,Schiff M,刘Y.病毒诱导的基因沉默。方法Mol Biol。2003; 236:287-94。gydF4y2Ba
- 57.gydF4y2Ba
Geuten K,Irish V.Solanaceae花卉归气B基因的隐性变异为新功能演变提供了分子基础。植物细胞。2010; 22:2562-78。gydF4y2Ba
- 58.gydF4y2Ba
Gietz Rd,Woods Ra。LIAC / SS载体DNA / PEG方法的酵母转化。方法Mol Biol。2006; 313:107-20。gydF4y2Ba
- 59.gydF4y2Ba
米勒jh。分子遗传学的实验。纽约:冷泉港实验室公关;1972年。gydF4y2Ba
- 60.gydF4y2Ba
Ca2+依赖蛋白激酶与植物逆境信号转导科学。1996;274:1900-2。gydF4y2Ba
- 61.gydF4y2Ba
Ramon M, Ruelens P, Li Y, Sheen J, Geuten K, Rolland F. The hybrid four-CBS-domain KINβγ subunit function as canonical γ subunit of plant energy sensor SnRK1. acta photonica sinica, 2011, 40 (3): 481 - 486 . [10]植物j . 2013; 75:11-25。gydF4y2Ba
- 62.gydF4y2Ba
vanderbussche M, Janssen A, Zethof J, van Orsouw N, Peters J, van Eijk MJT等。建立一个3D索引的牵牛花插入数据库用于反向遗传学。植物j . 2008; 54:1105-14。gydF4y2Ba
- 63.gydF4y2Ba
Villarino GH,致法A,Giovannoni JJ,Scanlon MJ,Mattson NS。转录组分析gydF4y2Ba矮牵牛织布达gydF4y2Ba利用高通量RNA测序来应对盐胁迫。《公共科学图书馆•综合》。2014;9:e94651。gydF4y2Ba
- 64.gydF4y2Ba
Karimi M, Inzé D, Depicker A. GATEWAY™农杆菌介导植物转化载体。植物科学学报,2002;gydF4y2Ba
- 65.gydF4y2Ba
农杆菌在番茄中的转化。见:植物组织培养手册;1991.311 - 9页。gydF4y2Ba
致谢gydF4y2Ba
我们要感谢Hanne Mariën和Matthew Ramon进行Co-IP实验,以及Filip Rolland为我们提供pcB301载体。我们感谢Ellen De Sutter在准备转基因番茄方面提供的技术援助。此外,我们感谢Patrice Morel对基因分型的帮助gydF4y2Ba佩妮gydF4y2Ba.最后,我们要感谢陈雪梅(UC Riverside)对转基因miR172过表达系的贡献。gydF4y2Ba
资金gydF4y2Ba
HC是由鲁汶大学资助的。电视是由IWT Vlaanderen (no。35040)和鲁汶大学PDM奖学金。MV得到了CNRS的ATIP-AVENIR奖的支持。KG由KULeuven赠款C24/17/037和OT/12/053和FWO赠款G065713 N资助。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
本研究期间生成或分析的所有数据都包含在本发布的文章及其补充信息文件中。gydF4y2Ba
作者信息gydF4y2Ba
隶属关系gydF4y2Ba
贡献gydF4y2Ba
电视产生并分析了这一切gydF4y2Ba烟草gydF4y2Ba数据,所有的表达式数据gydF4y2Ba日本柳杉粳稻gydF4y2Ba,gydF4y2Ba果实gydF4y2Ba,gydF4y2Ba葡萄gydF4y2Ba,gydF4y2Ba番木瓜gydF4y2Ba和gydF4y2Ba金鱼草majusgydF4y2Ba并撰写了部分手稿草稿。HC进行了系统发育分析,生成并分析了所有gydF4y2Ba佩妮gydF4y2Ba和番茄资料并写了手稿。MV确定了gydF4y2BaPHTM8gydF4y2Ba突变并预测gydF4y2BaPHTM8gydF4y2BaCD。KG设计和CoördIngination的实验,分析了数据并写了稿件。所有作者都阅读并批准了稿件的最终版本。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版gydF4y2Ba
不适用。gydF4y2Ba
利益争夺gydF4y2Ba
作者们宣称他们没有相互竞争的利益。gydF4y2Ba
出版商的注意gydF4y2Ba
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。gydF4y2Ba
附加文件gydF4y2Ba
额外的文件1:gydF4y2Ba
爆炸基因组的列表。(XLSX 42 kb)gydF4y2Ba
额外的文件2:gydF4y2Ba
TM8gydF4y2Ba对齐和完整的系统发育与登录号。(NEWICK 19 kb)gydF4y2Ba
额外的文件3:gydF4y2Ba
原位杂交检测探针阴性控制。山姆:茎尖分生组织;f:花分生组织;df;发展中花。(PDF 3584 kb)gydF4y2Ba
额外的文件4:gydF4y2Ba
在发展阶段的表征gydF4y2Ba烟草benthamiana。gydF4y2Baa)少年成人相变gydF4y2Ba烟草gydF4y2Ba如叶盘上的大颗粒(由黑点表示)和尖叶尖端的外观所示,发生在叶3-4周围。b)成人阶段的大型毛皮组的细节gydF4y2Ba烟草gydF4y2Ba.C)毛状体密度在两种情况下增加得更快gydF4y2Ba烟草gydF4y2Ba转基因线overexpressinggydF4y2BamiR172gydF4y2Ba(16种和地级)。D)相对表达gydF4y2BaNbAP1gydF4y2Ba(左)和gydF4y2BaNBSoc1.gydF4y2Ba(右)时gydF4y2Ba烟草gydF4y2Ba发育(子叶直到第14叶)。相应的灰色和黑色箭头分别表示花的过渡和花发育的开始。(PDF 11213 kb)gydF4y2Ba
额外的文件5:gydF4y2Ba
足迹突变序列说明。野生型gydF4y2BaPHTM8gydF4y2Ba开始密码子前后的序列比较gydF4y2BaPHTM8gydF4y2Ba新起始密码子周围的序列由gydF4y2BadTph1gydF4y2Ba转座子插入。的gydF4y2BadTph1gydF4y2Ba转座因子留下了一个7bp的足迹(下划线),创造了一个新的起始密码子(红色),这导致了立即的移码gydF4y2BaPHTM8gydF4y2Ba.足迹突变体的新翻译蛋白很快产生一个终止密码子,导致一个短的非感官蛋白。(PNG 21 kb)gydF4y2Ba
额外的文件6:gydF4y2Ba
TM8gydF4y2Ba茄科植物的蛋白质比对显示了不同的剪接变体。gydF4y2BaPHTM8gydF4y2Ba与它的同源体很好地对齐,不显示任何伪化的迹象。(PDF 1315 kb)gydF4y2Ba
额外的文件7:gydF4y2Ba
RT-PCRgydF4y2BaTM8gydF4y2Ba和gydF4y2Ba施gydF4y2Ba在T1表型线中番茄。控制,gydF4y2BaTM8gydF4y2Ba超表达(OE)和gydF4y2BaTM8gydF4y2Ba-RNAi株系(31个周期都是从至少有一朵开放花的花序中获得的10 ng/μL cDNA)。(PDF 46 kb)gydF4y2Ba
额外的文件8:gydF4y2Ba
在愈伤组织培养的番茄植株中观察到异常。A)正常的野生型花,包括五个花瓣,五个萼片,一个由五个雄蕊形成的圆锥和内部的子房。B)控制花间断和sepaloïd雄蕊球果。C) RNAi花有额外的花器官和花冠花药。D)具有sepaloïd花瓣的OE花;E)雄蕊锥裂;F)雄蕊和雌蕊融合;I) OE花,具有sepaloïd雄蕊。在图E和F中,为了更好地看清雄蕊和雌蕊,花瓣和萼片被去掉了。(PDF 202 kb)gydF4y2Ba
额外的文件9:gydF4y2Ba
引物列表。(43 XLSX kb)gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文在知识共享归属4.0国际许可条款下发布(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条提供的数据,除非另有说明。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
科恩,H, Viaene, T. Vandenbussche, M。gydF4y2Baet al。gydF4y2BaTM8gydF4y2Ba抑制发育时机gydF4y2Ba烟草benthamianagydF4y2Ba并且在被子植物中具有多样化的功能。gydF4y2BaBMC植物杂志gydF4y2Ba18日,gydF4y2Ba129(2018)。https://doi.org/10.1186/s12870-018-1349-7gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-018-1349-7gydF4y2Ba
关键字gydF4y2Ba
- TM8gydF4y2Ba
- SVPgydF4y2Ba
- 中收取gydF4y2Ba
- 烟草benthamianagydF4y2Ba
- 抑制因子的miR172gydF4y2Ba
- RNAigydF4y2Ba
- 超表达gydF4y2Ba
- 茄属植物lycopersiumgydF4y2Ba
- 矮牵牛织布达gydF4y2Ba