摘要
背景
植物组织中实际植物素水平的定量测量是互动性相关基因表达的分子方法的互补。定量植物素的目前的分析方法推动了在象形图(PG)水平下可以常规量化毒素的检测限,减少了在几年前将这些研究所需的组织数量从未想象过的量。同时,激光微碎裂显微镜(LMD)等技术的开发使得允许从离散组织收获的特异性细胞而不包括相邻细胞。该方法近年来普及,特别是在转录组分析中实现更高程度的空间分辨率。与其他定量测量一样,包括激素量化,使用传统LMD采样仍然具有挑战性,因为样品制备明显损害了分析物的保存。因此,我们已经开发并验证了一种相结合低温,冷冻干燥和用激光微碎裂显微镜捕获的样品制备方案,以提供适用于超细管空间分辨的助长量化的高质量和保存完好的植物材料。
结果
我们开发了一种新方法,为吲哚-3-乙酸(IAA)定量提供离散植物组织,同时保持植物组织在最佳状态下以防止植物素降解。该方法结合了低温,冷冻干燥和LMD的使用。该方案还可用于其他需要具有高组织特异性的小分子分析的其他应用,其中生物化合物的劣化可能是一个问题。使用LMD可以在约4小时内收集相当于15mg的非常特异性组织。
结论
我们已经证明,通过概念证明,冷冻干燥的植物组织冷冻切片适合于LMD收获和植物激素生长素的GC-MS/MS定量。我们希望能够以高精度的空间和时间分辨率来解析生长素水平,这将使复杂过程的实验成为可能,这将增加我们对生长素(以及其他植物激素)在植物发育中的许多作用的认识。
背景
有了分析极低激素水平的能力,人们就希望能够取样非常特定的植物组织,以揭示调节发育的精确激素变化。植物激素通常活跃于特定的组织或组织内的细胞层,区分不同类型细胞的能力对理解这些反应具有革命性意义。生长素可以作为一个更微妙的植物激素的例子,并参与了大量不同的植物生长和发育反应,包括侧根和不定根形成,细胞扩张,顶端优势,向地性和脱落,等等。移动生长素信号的作用最早是在19世纪下半叶由Ciesielski [1],但直到20世纪上半叶才发现这种信号化合物的化学特性,并识别出吲哚-3-乙酸[2].
生长素的生理反应高度依赖于局部浓度。因此,生物合成,降解,并且在维持生长素发挥中心作用的交通似乎是生长素前体,无激素,并结合物之间的微妙平衡体内平衡。
正如我们之前讨论过的[3.[使用各种报告系统,已能可视化养蛋白活动的空间 - 时间分辨率。这些方法基于使用合成启动子(如DR5)的构建体[4.或融合蛋白DII-VENU(如融合蛋白DII-VENU)的共同受体[5.].他们已经开发,并与标准化改造方案的参考植物种类特别有用。虽然这些技术都具有重要的实用程序,用于生长素活性的了解网站不定量测定生长素水平和,廖等人。[6.在他们的报告中强调,“值得注意的是,这两份报告都没有显示出对生长素浓度或处理时间的线性反应,因此这些不能用来推断实际的生长素水平。”然而,这些方法补充了这里描述的测量特定组织的绝对定量程序。
自从第一个生物测定在20世纪20年代和1930年代开发以来,检测和定量植物组织中的植物组织中的植物组织中的植物组织中的主要动力是植物生物学中的主要动力3.].生长素在植物组织中含量很低,一般在5-50 ng/g鲜重范围内[7.].我们发现一致的花蕾与这些一般范围一致,IAA浓度在1.2至55 ng / g fw的范围内(Hvoslef-eide,等,准备稿件)。早期研究需要千克数量的植物材料,以及单一测量的努力,以及数月的努力[3.].为了克服这些限制,提高了生长素纯化方法和越来越灵敏的仪器的利用率得到了发展。由于其对植物生长素的定量,同位素稀释[初始应用3.[通过质谱法在植物素定量中发挥了重要作用。它允许应用现代样品操纵和不断改进的仪器的利用,以便该程序达到令人印象深刻的限制,特别是关于分析所需的植物材料量[8.].这些高度敏感的物理分析方法有潜力提供深入了解生长素在植物生理中的作用,因为它们打开了用高空间分辨率测量生长素分布的可能性[9.].
激光微生物显微镜(LMD)允许从复杂组织中收获的特异性细胞,甚至在单细胞的水平上,为下游分析提供包括定量实时聚合酶链反应(PCR),微阵列,DNA基因分型,RNA的起始点转录物分析,cDNA文库的生成等。此技术自1996年以来已经获得[10.],但在植物研究中的首次应用直到2002年[11.].LMD主要与RNA分离和基因表达研究组合使用[12.那13.,可以在石蜡包埋的组织上完成。LMD应用于小分子代谢产物分析,特别是植物激素,由于这些分子的固有低浓度,它们在包埋基质材料和水中的溶解度,以及化合物降解的可能性,特别是在环境温度下,提出了额外的挑战。这些特性使得传统的LMD方法不适用于生长素样品的制备,因为在脱水和固定过程中使用溶剂和固定剂会溶解和/或导致激素原位降解。为了保持组织中原始的植物激素含量,采用了冷冻干燥后的冷冻切片,因为冷冻干燥不会改变激素含量[14.].低温抑制更典型通常被应用于动物组织而不是植物组织,因为植物中的真空和细胞壁的存在通常使得难以保持细胞结构的完整性[15.那16.].然而,低温抑制厚度的增加改善了这种组织的结果。在这里,我们报告了一种有效的样品制备方法,其结合了三个步骤:(1)植物组织的低温乳粥,(2)冷冻干燥干燥,(3)使用LMD收集细胞。本协议描述了用于随后的养肝萃取和使用GC-MS / MS和同位素稀释量的植物材料的集合[8.].由于缺乏结合LMD和毒素量化的协议,并且由于植物开发中的植物蛋白的重要作用是其作为位置信号的作用[9.,这项工作有可能导致激素分析提供的信息质量的显著改善。
方法
植物材料
具有至少两个叶片大约5cm从一品红收获长插条(大戟属植物pulcherrima,Willd。“千禧年Klotzsch交货)。母株和插穗在长日照条件下生长(光照16 h,白天22°C,夜间20°C),插穗在70%相对湿度(RH)下保存4周。插枝生根后,移栽到12厘米高的花盆中,在同样的条件下再保存两到三周。为了诱导开花,将植株转移到光照10 h、20℃、RH 74%的短日照条件下。一品红的花序是由一朵主花(一级花)、三朵二级花环绕、六朵三级花依次环绕[17.].本研究使用了六阶的相同发展的三阶花蕾。
花蕾断头诱导脱落
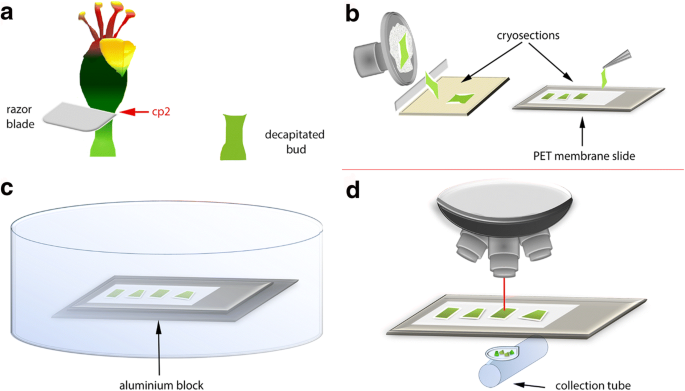
当三阶花蕾完全开发时,根据我们以前的出版物(CP2;图32,它们在切割点2上用剃刀刀片斩首1A).通过这样做,花卉器官被删除,但剩下的花朵保持完整[18.那19.].这诱导脱落区的形成,在大约4天(D4)之后可见,并且诱导后大约七天散发出芽(D7)。
用控制样本验证方法
为了验证生物取样方法,我们在斩首后立即从芽(D0)后收集脱落区内的感兴趣区域,然后从脱落后左右从脱落区(图。2).脱落带通常具有非常不规则的三维锥体形状,因此如果没有相邻细胞层的包含,人工收集是困难的;这一特性使它成为LMD精度的理想候选者(图。3.).将本次采样结果与在离断区同一时期采集的花芽简单断面进行了比较。实验样本和对照样本的区别在于,使用激光显微解剖显微镜精确采集的冷冻干燥组织与包含不需要细胞类型的冷冻横截面的对比。因此,我们预期结果会落在相同数量级内,但不一定会产生与组织IAA浓度完全相同的值。
材料
组织TEK®OCT™化合物和Cryomolds®(Sakura Fineedk,荷兰)
框架载玻片PET(聚对苯二甲酸乙二醇酯)-膜1.4 μm,参考n°11,505,190(徕卡微系统,德国)
镊子2A (A. Dumont & Fils,瑞士)
Custom-made aluminium blocks 3.0 cm × 8.5 cm × 0.4 cm
RNASE自由微纤维管0.6 mL
框架支持Leica N°11,532,325(德国Leica Microsystems)
Accu-Edge®4689低轮廓切片机刀片(Feather日本)
设备
低温恒温切片机HM560 (Microm,德国)
顶部集装箱冷冻干燥机(Heto Holten A/S, Allerød,丹麦)
激光显微解剖显微镜徕卡6000(徕卡Microsystems,德国),软件V6.7.2.4295
激光徕卡CTR 6500(徕卡Microsystems,德国)
Pre-sampling程序
选择来自一品红花芽的两种不同阶段的脱落区进展的脱落区组织用于本研究,并使用LMD收获对应于脱落区的特定细胞层。脱落区的形态非常特征,使得在显微镜下易于识别。本研究使用了三种生物重复。每次重复的每次复制的平均每次和2.8天花蕾。每次复制一次:(1)由低温,冷冻干燥和LMD组成的样品制备程序(图。1(2)使用刘等人开发的协议组成的最终分析程序,包括养蛋白提取,衍生化和定量。[8.]
本协议包括五个部分:
- 1.
用低温恒温器对花蕾进行纵向冷冻切片
- 2。
从上一步中生成的冷冻干燥冷冻液
- 3.
冻干冷冻切片的LMD,以获取脱落区特定组织
- 4.
方法验证
- 5。
通过GC-MS / MS从显微切割的组织和定量生长素提取
组织收集和低温
D0芽被斩首并立即收集,并在斩首后六天收获D6芽。对于两个时间点,收获整个斩首芽并在收集后立即将液氮置于 - 80℃直至冷冻渗透。使用Cryostat MicroOlome HM560(Microm,Germany)进行冷冻滤膜,带有Accu-Edge®4689低调的显微刀片(羽毛日本)。将叶片和样品(样品保持器)的温度分别在低温恒温器至-16℃和-15°C中进行改性;根据其宏观结构,最佳温度可从组织到组织。为了找到每个样本类型的最佳组合,试验植物材料需要试验。
期望的冷冻切片厚度也可以根据研究的目标和组织的性质而不同。在这项研究中,厚度通常约为250 μm,尽管从70 μm到350 μm的切片中获得了可接受的结果。花蕾使用最佳切割温度(OCT™Tissue-Tek®Compound和Cryomolds®,Sakura Finetek,荷兰)嵌入培养基放置在样品固定器上,以保持其固定在所需位置(图。4.).在低温恒温箱中开始快速冷冻过程之前,在花蕾周围添加了一些额外的OCT。多余的OCT可以在需要时用刀片从组织边缘去除。为了防止植物生长素在冷冻切片过程中降解,我们使用带扁平尖的直镊子(tweezers 2A A. Dumont & Fils, Switzerland)来操作花蕾,同时将花蕾置于干冰中保存。冷冻切片用冷镊子转移到PET膜载玻片上后,将徕卡亚克力支架(n°11,532,325,德国徕卡微型系统公司)直接置于切片下方几秒钟,以帮助冷冻切片附着在载玻片表面。如果放置正确,组织和OCT都将均匀地扩散到膜上。为了避免冰冻切片暴露在更高的温度下,放置得很快。每个切片上放置3到4个冷冻切片(图。5.).虽然OCT可用于帮助冷冻粘合粘附到滑动膜上,但必须小心使用,以避免通过液化污染组织。冷冻液可以粘附于没有OCT的膜,但是在冷冻干燥过程中可以折叠组织边缘,从而导致来自PET膜载玻片的样品损失。在每次冷冻切断后,在10℃或干冰后,在-19℃下保持PET膜载玻片。
冷冻干燥
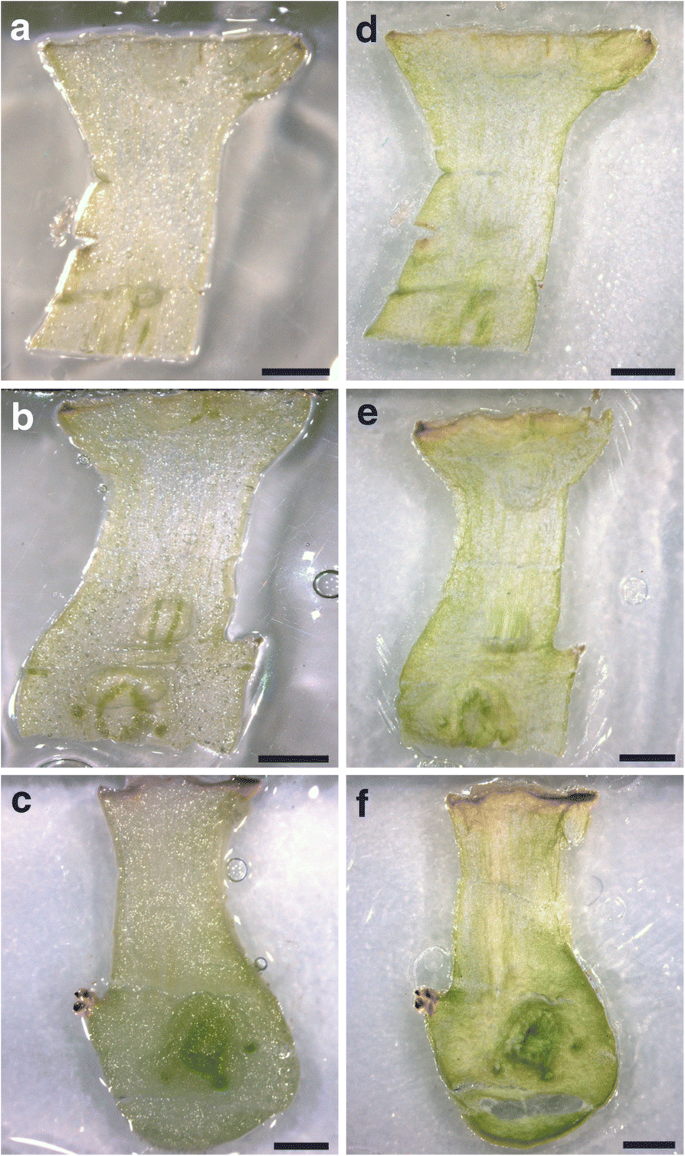
将冷冻乳糖的PET膜载玻片置于4mm厚的预先冷冻定制的铝块之上,以便将它们保持在冷冻状态(图。6.).冷冻切片在真空中冷冻干燥,直至组织完全干燥。冻干玻片保存在−80°C,直至显微解剖。为了测试冷冻干燥后的组织完整性和区分所需结构的可行性,评估了不同厚度的组织切片(70、100、200、250和300 μm)。
微探针
显微解剖使用徕卡6000激光显微解剖显微镜(徕卡,Mycrosystems,德国)。激光(德国CryLaS FTSS 355-50)至少提前20分钟打开,以便在开始剥离前预热。激光显微解剖软件(德国徕卡microsystems, V6.7.2.4295)设置激光参数:功率60,孔径45,速度20,标本平衡0。这些参数针对我们在本研究中使用的材料进行了优化,可以进行调整,以获得每个新组织的最佳条件。激光的切割位置是用一个新的PET膜载片或一块没有任何组织的膜来标定的。将清洁的微离心管放置在显微镜下的收集装置中,将装有冰冻切片的载玻片放置在载玻片支架中开始剥离。选择感兴趣的区域并解剖,重力收集显微解剖的组织。
每次只对一个载玻片进行显微解剖,其余的载玻片在黑暗中冷藏(这对防止IAA降解很重要)。所有冰冻切片的厚度均为250 μm,切片体积通过面积乘以厚度计算得出。由于显微解剖体的脆性和较小的尺寸使其难以处理以平衡称重,使用从较大的样品中确定的体积与重量的换算,可以在统一的植物样品中更准确地计算出新鲜重量信息。
验证样本
为了验证该方法,提供对照材料的花蕾被冷冻在液氮中,并用低温恒温器在脱落区周围进行横切。每个时间点用三个芽。由于样本在采集后立即被冷冻,每个横截面的重量通过ImageJ 1.49n程序测量面积来计算(Rasband, w.s., ImageJ, u.s. National Institutes of Health, Bethesda, Maryland, USA,https://imagej.nih.gov/ij/, 1997-2016),并根据截面厚度(500 μm)将结果乘以0.5 mm。通过考虑三个测量值的平均值并计算标准误差,评价了控制样品和LMD样品的重复性。生长素定量方法与实验材料相同[8.].
助流量化
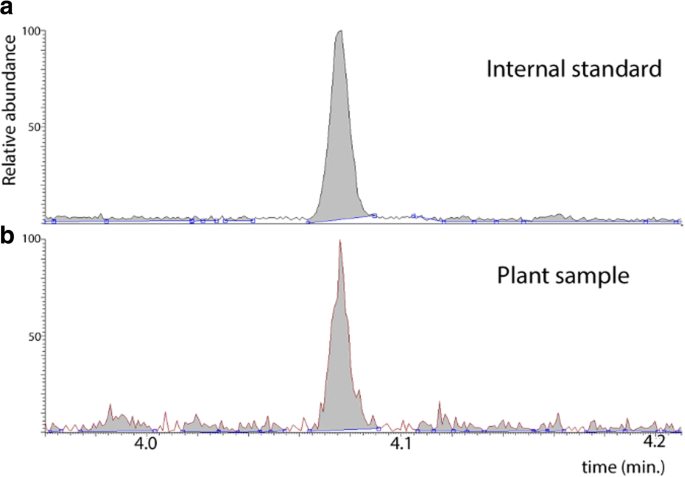
用于养蛋白提取的方案[8.]在1.5mL微量离子管中最佳地进行;因此,转移用LMD收集的组织在0.6mL微量离心管中进行。由于低粘合的尺寸和在它们下面的滑动膜的潜在存在,静电力要求必须采取额外的护理。本研究中使用的方案可用于量化植物素,以及毒素生物合成前体,如色氨酸,吲哚,吲哚-3-丙酮酸(IPYA)和吲哚-3-丁酸(IBA)。该方案使用同位素稀释使用[13.C6.] IAA作为内标[20.]并且只需要2至20毫克的植物材料。在本研究中的每次重复中加入了大约340pg的内标。代谢物提取物用重氮甲烷衍生化[21.[根据Liu等人,通过在GC-MS / MS上选择反应监测(SRM)模式来分析。[8.].在衍生化后的最后再悬浮步骤中,用10 μL乙酸乙酯代替15 μL,对原方案作了小修改。在本研究中,样品在制备后立即通过GC-MS/MS进行分析,尽管在必要时,样品可以存储在−80°C。
结果
我们已经描述了使用少量离散植物组织的样品收集和养肝分析的可靠方案。该方案结合了低温植物组织,冷冻干燥这些冷冻液,以及激光微粉,用于收获特定细胞或细胞层。然后通过GC-MS / MS在收集的植物材料中量化IAA水平,[13.C6.] IAA作为内标。
Cryosectioning和冷冻干燥
- 1.
在冷冻干燥后,厚度为70μm至200μm厚度的所有冷冻液的完整性(图。7.).
- 2。
经冷冻干燥处理后,250 μm厚度的冷冻切片保存完好,是最适合所研究芽组织的冷冻切片厚度
- 3.
对于某些研究,可能需要较厚的冷冻乳(300至350μm)。还发现这些厚度以保持冷冻组织的结构(数据未显示)。
激光微生物
- 4.
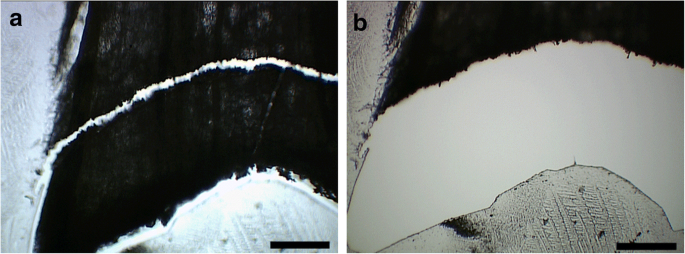
激光能够将所测试的所有厚度分解(数据未显示)。然而,在300和350μm的乳冻乳白的厚度使得获得脱落区的正确可视化,因为细胞层的数量掩蔽了三维形状。因此,为了我们的目的,决定使用250μm(图。8.).
- 5。
使用LMD收获的区域,用于D0样品的平均值(三个重复)为61.8±3.32毫米2那Corresponding to 15.4 ± 0.83 mg of fresh tissue, while the average area for D6 (three replicates) was 54.9 ± 2.17 mm2,相当于13.7±0.53 mg鲜重1).
助流量化
讨论
随着程序和设备的改进,植物微小组织的生长素定量方法正在不断发展。这里使用的程序是由我们开发的,并于2012年首次报道[8.].它仍然是一个需要相对少量的组织进行单一分析,主要是因为选择反应监测(SRM)的GC/MS-MS模式提供的特异性和精度是通过使用同位素稀释提供的[13.C -标记的内部标准[20.].在生长素分析改进下一个重要步骤是特异性地靶向感兴趣的组织的能力。然而,即使在微方法,IAA降解的样本采集过程中的问题,组织的数额的这些非常小的样本,并且还确定如何收集足够的特定组织的,以获得在MS良好的反应仍然显著的问题。LMD成为一个可行的方式来选择和收获特定区域或已知的厚度和表面面积的细胞,但这些部分的前处理,固定和染色工艺最常用的引发的降解和/或激素的溶解和其他小分子存在于组织中。这个问题在很大程度上是由冷冻切片的组织,从而避免任何进一步的固定和染色克服。冷冻干燥的用含有整个冷冻切片载玻片下方的冷冻铝块的帮助下一个重要的附加步骤促成了这种协议的成功。(1)最小化的组织的准备时间,以减少植物生长素的(2)获得足够的材料以获得通过质谱法可靠的量化的潜在的降解和:决定哪些条件是用于处理植物材料最佳当两个因素是非常重要的。Three parameters were evaluated: (1) the thickness of the cryosections, (2) the distinguishability of the abscission zone under the microscope, i.e. the ability to distinguish the macro structures we were targeting, and (3) the feasibility of using a laser to dissect these cryosections. The use of cryosectioning for plant tissues is not a common choice because the presence of vacuoles and cell walls makes it more difficult than for mammalian tissue samples [22.].另外,使用它们时,它是非常罕见找到具有的厚度大于30μm的冷冻切片的例子,由于显微镜可视化(光穿透)的限制。这对于需要大约10薄片到20微米一些显微镜应用尤其如此。然而,只要该结构仍然容易在显微镜下识别,增加证明,因为它使我们可以收集更大量的组织的在较短的时间是在该情况下有利的厚度。当下游分析涉及低水平的代谢物或其它勉强可追踪化合物,这可以是在一个很大的优势,例如,长期治疗前的协议或其它方法。
结论
这是第一个使用LMD收获的微解剖植物材料进行生长素定量的报告。与其他植物激素相比,生长素的浓度相对较低,难以定量恢复,其极性定向转运的位置定位使得其时空信息成为分析的关键问题。因此,一种可靠的、能够提供组织特异性的样品制备方法的重要性是非常重要的。该协议提供了新的方法,将增加我们关于生长素在植物组织中的空间特异性分布的知识。由于本研究中使用的样品制备方法允许我们排除使用溶剂,生长素降解的可能性被降到最低。因此,这个方案提供了一个明确的优势,探索生长素浓度在一个更精确的分辨率和更直接的方式。该方案适用于其他应用,如转录组学、蛋白质组学、代谢组学等,在这些应用中,组织采集需要高分辨率,化合物的最小降解对可靠的结果至关重要。
缩写
- AZ:
-
离层区
- 弗兰克-威廉姆斯:
-
鲜重
- gc - MS / MS:
-
气相色谱-串联质谱联用
- IAA:
-
吲哚-3-醋酸
- LMD:
-
激光微生物
- 十四:
-
最佳切削温度
参考文献
- 1.
Ciesielski T. Untersuchungen über die Abwartskrümmung der Wurtzel。贝。z。杂志。d。Planzen(康涅狄格州)。1872; 1(1):行。
- 2。
Abels,Theologis A. Auxin的奥德赛。冷泉harb持猪肉。2010; 2(10):A004572。
- 3.
Tivendale n,Cohen J.养肝的分析史。J工厂增长调节。2015; 34(4):1-15。
- 4.
等。Aux/IAA蛋白抑制含有天然和高活性合成生长素反应元件的报告基因的表达。植物细胞。1997;9(11):1963 - 71。
- 5。
等。一种新的高时空分辨率绘制生长素响应和分布的传感器。大自然。2012;482(7383):103 - 6。
- 6。
Liao C-Y等。记者,用于敏感和定量测量养肝响应。NAT方法。2015; 12(3):207-10。
- 7。
等。植物生长素定量分析方法综述。Acta botanica sinica . 2016; 902:8-21。
- 8。
刘旭,等。方案:从微小组织样本中对生长素和生长素前体进行高通量和定量分析。工厂方法。2012;8(1):31。- 17页
- 9。
等。生长素在植物模式形成中的位置信号。中国科学(d辑:地球科学)1996;93(17):9282-6。
- 10.
Emmert-Buck Mr,等。激光捕获微散。科学。1996年; 274(5289):998-1001。
- 11.
asano t等人。通过激光捕获微量分离的植物细胞构建专用cDNA文库:旨在综合分析水稻韧皮中的基因。工厂J. 2002; 32(3):401-8。
- 12.
Olofsson L, Lundgren A, Brodelius PE。利用激光显微解剖、压力弹弓和RNA扩增技术分离和分离黄花蒿(Artemisia annua L.)顶端和亚顶端毛状体细胞中萜类代谢基因的表达
- 13。
ohtsu k等人。通过使用激光微粉和高通量技术的组合,在植物中进行细胞类型特异性基因表达。植物细胞生理。2007; 48(1):3-7。
- 14。
George Kkl,鸡蛋v,莫尔顿杰。使用冷冻真空干燥材料在养羊酸和其他植物器官的化学分析中:用干燥的乙醚萃取。BOT GAZ。1941; 102(3):590-601。
- 15.
纳尔逊T,等人。激光显微切割植物组织的:你看到的就是你得到的。Annu Rev植物Biol。2006; 57(1):181-201。
- 16。
BALESTINI R,BONFANTE P.激光微生物(LM):用于植物材料的应用。植物生物系统。2008; 142(2):331-6。
- 17。
引用本文:王志强,王志强,等。豌豆和大戟的初级和次级脱落-它们如何比较和区别?植物科学学报2016;6:1204。
- 18。
Lee Y等人。响应于大戟脉冲(一品红)诱导Peencel脱落事件的顺序细胞壁变换。工厂J. 2008; 54:993-1003。
- 19。
Hvoslef-eide,A.K.等,初级和次要脱落豌豆和大戟它们有什么区别?在:Tranberger TJ, Tucker M, Roberts JA, Meir, S,编辑。植物器官脱落:从模型到作物。出版社:Frontiers ISBN: 978-2-88945-328-3;2016.p . 245 - 261。
- 20.
Cohen JD,Baldi BG,Slovin JP。13.C6.[苯环]吲哚-3-乙酸:植物中吲哚-3-乙酸质谱定量分析的新内标植物杂志。1986;80(1):战绩。
- 21.
王志伟,等。一种高通量的生长素定量分析方法。Nat协议。2010;5(10):1609 - 18。
- 22.
Kerk nm,等。激光捕获来自植物组织的细胞的微小细胞。植物理性。2003; 132(1):27-35。
致谢
作者是从影像中心生命科学为她宝贵的技术帮助挪威大学(NMBU),并在使用激光显微切割显微镜和其他仪器的训练非常感谢希尔德Raanaas科尔斯塔。
资金
挪威生命大学(NMBU)博士奖学金2013-2016。挪威百年椅(NOCC)方案旅游奖学金,明尼苏达大学。该研究的这种分析方面由国家科学基金会(IOS-1238812)提供资助,戈登和玛格丽特贝利养老金为环境园艺和明尼苏达农业实验站的补充支持。
数据和材料的可用性
数据在挪威生命科学大学提供数据存档,可以通过联系相应作者Akhe获得。
作者信息
从属关系
贡献
LGMS进行实验和撰写论文,YKL提供监督和改进数字和手稿,MT提供帮助IAA量化,JDC和AKHE设计研究,提供监督和贡献手稿。所有作者阅读并批准了最终的手稿。
相应的作者
伦理宣言
伦理批准和同意参与
我们宣布,我们已遵守所有本地立法,以及机构,国家或国际指导方针。我们没有以任何不符合关于濒危野生动物群和植物群的贸易公约的现场研究和植物。
同意出版物
不适用
利益争夺
提交人声明他们没有竞争利益。
权利和权限
开放访问本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Muñoz-Sanhueza, l.g., Lee, Y., Tillmann, M.。et al。使用激光微散射植物组织部分的植物化分析。BMC植物BIOL.18,133(2018)。https://doi.org/10.1186/s12870-018-1352-z
收到了:
公认:
发表:
关键字
- 助流量化
- 同位素稀释分析
- 激光微生物显微镜
- GC-MS / MS量化
- 植物样品制备
- 分钟的样品
- 冷冻干燥
- 冷冻干燥
- Cryosectioning