- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
发育种子的时间转录组分析揭示了与油积累有关的一致基因调控(gydF4y2BaMillettia pinnatagydF4y2Ba)gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba18gydF4y2Ba,文章号:gydF4y2Ba140gydF4y2Ba(gydF4y2Ba2018gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
Pongamia (gydF4y2BaMillettia pinnatagydF4y2Basyn。gydF4y2BaPongamia pinnatagydF4y2Ba),一种油籽豆科植物,正在成为可持续生物柴油生产的潜在原料。从种子发育过程中调控油分积累的分子机制出发,全面地研究枫香种子油分积累的分子机制,培育具有商业应用价值的优良性状。迄今为止,只有有限的基因组或转录本序列可用于该物种,而发育种子的时间转录组分析仍然缺乏。gydF4y2Ba
结果gydF4y2Ba
在本研究中,我们对发育中的邦蜜亚种子的形态和生理特征、油分含量和组成以及整体基因表达谱进行了时间序列分析。首先,从胚形、种子重量、种子含水量和种子颜色等方面综合证据,划分出3个主要发育阶段;然后,通过RNA-Seq分析定量这三个阶段的基因表达水平,每个阶段有三个生物重复。近94%的unigenes在所有三个阶段都表达,而只有不到2%的unigenes只在其中一个阶段表达。在不同阶段之间共鉴定出8881个差异表达基因(DEGs)。此外,qRT-PCR分析了10个参与脂代谢的deg,证明了我们的RNA-Seq数据在时间基因表达谱中的良好可靠性。我们观察到从胚胎发生阶段到种子灌浆早期,种子含油量急剧增加,随后在干燥阶段稳定而适度地增加,并达到最大值。我们认为,在胚胎发生阶段,脂肪酸(FA)和三酰甘油(TAG)生物合成相关基因的高度活跃表达,可能会在这一阶段引发大量油脂积累和膜脂合成,从而促进细胞快速增殖,而脱水阶段TAG合成相关基因的协同激活,可能会进一步促进贮藏脂合成,以实现种子油脂的最大含量。gydF4y2Ba
结论gydF4y2Ba
本研究不仅在种子发育过程中建立了基因表达谱与油脂积累之间的桥梁,而且为今后通过基因工程研究获得更高的油脂产量或更好的油脂特性以应用于生物燃料奠定了基础。gydF4y2Ba
背景gydF4y2Ba
在过去的几十年里,全球人口的增长和化石燃料的枯竭刺激了对替代能源和可再生能源的需求不断增长。生物柴油通常从植物油中提取,是最有前途的传统柴油替代品之一,具有温室气体排放低、生物降解快、润滑性强、闪点高、储存和运输更安全等优点[gydF4y2Ba1gydF4y2Ba].生物柴油生产和商业化面临的一个主要挑战是原料供应有限,而且价格昂贵。gydF4y2Ba2gydF4y2Ba].虽然一些油料植物理论上可以作为生物柴油的原料来源,但由于它们对粮食供应或土地使用产生不利影响,其中大多数不适合工业化生产。例如,增加大豆作为生物柴油原料的使用可能会减少它们为人类和动物提供的蛋白质和油[gydF4y2Ba3.gydF4y2Ba],而扩大油棕种植以应用生物燃料,则可能导致雨林破碎化和生物多样性丧失[gydF4y2Ba4gydF4y2Ba].因此,迫切需要寻找更多不与粮食作物或森林树木竞争的产油植物,以扩大生物柴油原料的储备。gydF4y2Ba
Pongamia (gydF4y2BaMillettia pinnatagydF4y2Basyn。gydF4y2BaPongamia pinnatagydF4y2Ba)就是其中一种多油树,近年来受到越来越多的关注[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba].它属于豆科(豆科),广泛分布于印度和东南亚至波利尼西亚和北澳大利亚[gydF4y2Ba5gydF4y2Ba].邦蜜树的非食用籽油产量很高,很容易提取并转化为生物柴油[gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba].该物种的年产油量可达到约6000升/公顷,远高于其他几种原料物种的产量[gydF4y2Ba9gydF4y2Ba].此外,邦加米亚种子油富含油酸[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba],从而使生物柴油产品具有更理想的燃料性能。最重要的是,邦加米亚树可以承受广泛的非生物胁迫,并改善土壤养分状况[gydF4y2Ba12gydF4y2Ba],这意味着它们可以种植在边缘或退化的土地上,而不会影响粮食生产和森林保护。事实上,本种已被引入非洲、印度、马来西亚、澳大利亚和美国的亚热带和干旱地区进行商业种植[gydF4y2Ba13gydF4y2Ba].此外,豆科植物可进行生物固氮,从而减少氮肥的用量[gydF4y2Ba14gydF4y2Ba],这也使得该物种在生物柴油应用中更具成本效益和环保。gydF4y2Ba
通过标记辅助选择或遗传操作来开发适用性状的邦蜜亚品种将从更好地了解该物种的遗传背景中受益匪浅。作为一种近亲繁殖的二倍体(2n = 22)豆科植物,Pongamia的单倍体基因组大小接近1200mb [gydF4y2Ba15gydF4y2Ba].虽然其参考基因组尚未获得,但已有数十个基因或基因组区域在Pongamia被分离和测序,用于系统发育和群体遗传分析[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba].相比之下,只有少数Pongamia基因被鉴定为功能研究。最近的一项研究确定了四种生物钟基因(gydF4y2BaELF4gydF4y2Ba,gydF4y2BaLCL1gydF4y2Ba,gydF4y2BaPRR7gydF4y2Ba,gydF4y2BaTOC1gydF4y2Ba),并发现它们的表达在长时间的白天条件下受到日常调节[gydF4y2Ba20.gydF4y2Ba].另外两项研究已相继分离出两个Pongamia去饱和酶基因的全长cDNA克隆(gydF4y2BaPpSADgydF4y2Ba而且gydF4y2BaPpFAD2gydF4y2Ba),它们在种子发育的不同阶段表现出不同的表达模式[gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba].gydF4y2Ba
像其他豆科植物一样,蓬草主要在种子中合成和储存它的油。在种子发育过程中,油脂以及淀粉和蛋白质等主要储存化合物的形成受到各种生理事件的促进,而这些生理事件又由基因表达程序的镶嵌所控制[gydF4y2Ba23gydF4y2Ba].因此,全面测定转录本丰度对于阐明种子发育过程中油脂积累的分子基础具有重要意义。到目前为止,已经报道了几种豆科植物种子发育的全球转录谱,如大豆[gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba], Medicago [gydF4y2Ba27gydF4y2Ba],莲花[gydF4y2Ba28gydF4y2Ba]、鹰嘴豆[gydF4y2Ba29gydF4y2Ba],使用微阵列或RNA测序(RNA- seq)平台。然而,这些工作并没有特别强调参与脂质代谢的基因。对于Pongamia,我们使用RNA-Seq对根和叶组织进行了首次转录组分析,并发现了大量候选盐反应基因[gydF4y2Ba30.gydF4y2Ba].最近,Wegrzyn等人[gydF4y2Ba13gydF4y2Ba]用72株幼苗的rna构建了叶片转录组,而Sreeharsha等[gydF4y2Ba31gydF4y2Ba]用从叶子、花、荚果和种子组织中汇集的rna生成了一个全面的转录组。与这两项工作并行的是,我们建立了用于基因发现和分子标记开发的种子转录组[gydF4y2Ba32gydF4y2Ba].然而,对该物种的转录谱进行系统的检查,以进一步探索某些调控机制仍然缺乏。gydF4y2Ba
在本研究中,我们首次从形态和生理变化的角度描述了枫香种子的发育过程。同时,我们监测了在这一过程中油分含量和脂肪酸组成的变化。然后,我们对豆科植物种子三个主要发育阶段的代表性RNA样本进行了高通量测序,并生成了一个数据集,提供了种子发育期间基因表达的全景视图。此外,我们对不同发育阶段的差异表达基因(DEGs)进行了分类,重点研究了与FA和三酰甘油(TAG)代谢相关的基因的表达模式。我们的研究结果将有助于阐明某些脂代谢相关基因的转录重编程与发育期蓬蜜亚种子油脂积累动态模式之间的可能相关性。gydF4y2Ba
结果gydF4y2Ba
板栗种子发育过程中的形态和生理变化gydF4y2Ba
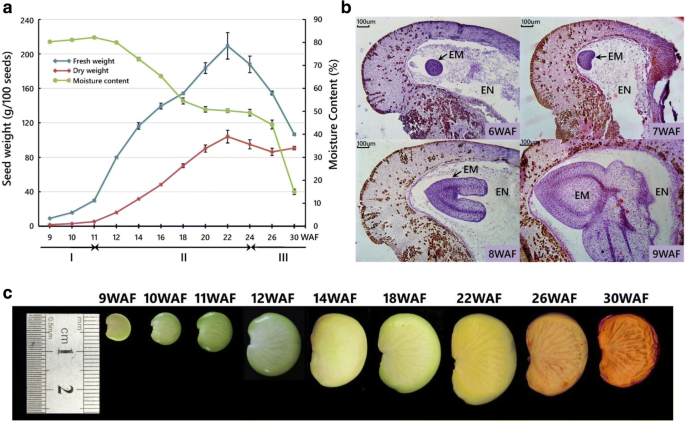
为了为发育中的邦加米亚种子的全球转录分析提供一个框架,我们最初定义了种子发育的三个主要阶段,这些阶段具有不同的形态变化和生理事件。利用位于中国深圳的三棵10年树龄的树木作为生物重复进行种子采样。在每个采样时间点,每棵树采集100颗种子,尽量减少种子性状的随机性影响。结果表明,在开花后的前11周(WAF),种子重量适度增加,种子含水量保持在鲜重的80%以上(图2)。gydF4y2Ba1gydF4y2Ba).这11周包括被称为胚胎发生或组织分化阶段的第一个发育阶段,在细胞水平上也以原胚(数据未显示)、球状(6个WAF)、心脏(7个WAF)、鱼雷(8个WAF)和子叶(9个WAF)阶段为特征(图。gydF4y2Ba1 bgydF4y2Ba).在此阶段,种子长度小于10毫米(图2)。gydF4y2Ba1 cgydF4y2Ba).在11 ~ 12 WAF期间,种子重量迅速增加,从以细胞分裂为主的胚胎发生阶段过渡到以细胞扩张为主的种子填充阶段。在第二阶段,种子的鲜重和干重分别增加了7倍和20倍,种子长度增加了近2.5倍,在22 WAF时达到最大值。最后,种子在24 WAF左右进入脱水阶段,水分含量从50%左右急剧下降到15%以下。在此阶段,种子干重略有下降,种子长度略有收缩。在整个发育过程中,种子颜色从胚发生期和灌浆期早期的亮绿色,到灌浆期后期的淡黄色,再到脱水期的浅棕色和深棕色(图2)。gydF4y2Ba1 cgydF4y2Ba).gydF4y2Ba
发育期板栗种子的油脂含量和脂肪酸组成gydF4y2Ba
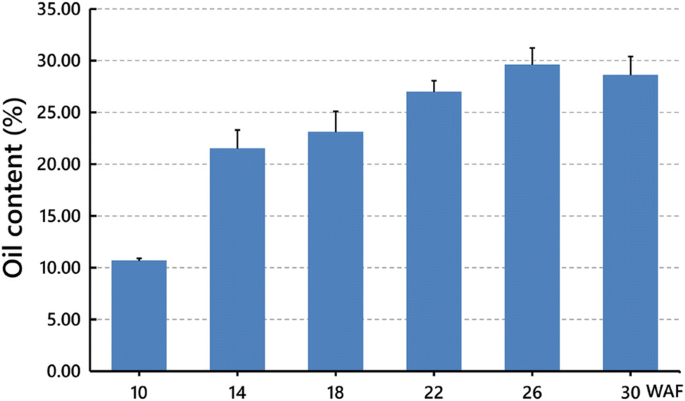
为了探索蓬蜜亚种子发育过程中油脂积累的动态模式,我们以4周为间隔,测量了其油脂含量从10 WAF到30 WAF,涵盖了所有三个主要发育阶段。在每个时间点,还从每棵树上提取100颗种子来提取种子油。我们的研究结果表明,在10waf时,油分含量首先从干重的10.67%增加到14waf时的21.49%,然后在26waf时逐渐增加到29.59%,然后在30waf时略微下降到28.60%(图2)。gydF4y2Ba2gydF4y2Ba).这些结果表明,油的活跃积累始于胚胎发生阶段,并持续到整个种子灌浆期和脱水早期,并在脱水后期逐渐消失。gydF4y2Ba
此外,我们还分析了上述6个时间点提取的种子油的FA组成。所有种子油样品中均检出棕榈酸(C16:0)、硬脂酸(C18:0)、油酸(C18:1)、亚油酸(C18:2)、亚麻酸(C18:3)、二十碳酸(C20:0)、白背酸(C22:0) 7种FAs(表2)gydF4y2Ba1gydF4y2Ba),而某些类型的FAs如肉豆蔻酸(C14:0)和木质素酸(C24:0)仅在某一样品中检出微量,芥酸(C22:1)在本研究的任何样品中均未检出。棕榈酸和硬脂酸是两种最丰富的饱和脂肪酸,其相对比例分别从10 WAF时的14.10和7.86%逐渐下降到30 WAF时的11.63和6.33%。同时,二十碳酸和山后酸的相对比例虽然处于较低水平,但也略有下降。在不饱和脂肪酸中,亚油酸的相对比例从10 WAF时的49.40%下降到30 WAF时的37.94%,而油酸的相对比例从27.30稳步上升到43.26%,在22 WAF时,即种子灌浆后期,成为枫香籽油中最丰富的脂肪酸类型。此外,另一种不饱和脂肪酸亚麻酸的含量从0.32下降到0.20%。综上所述,在蓬草种子发育过程中,饱和脂肪酸的比例减少,与之相对应的是不饱和脂肪酸的比例在相同程度上增加。gydF4y2Ba
板栗种子三个发育阶段基因表达水平的研究gydF4y2Ba
为了评估蓬草种子发育过程中基因表达水平的变化,我们在Illumina测序的基础上进行了RNA-Seq分析。利用三个发育阶段收获的种子RNA样本构建了9个测序文库(以下分别记为MpSI、MpSII和MpSIII),每个文库有3个生物学重复。总共产生了超过1.08亿个短读(49nt长度)。这些库的原始序列数据保存在NCBI序列读取存档(SRA)数据库中,登录号为SRP132431。在去除适配器和低质量序列后,每个文库的干净reads被映射到我们之前研究建立的Pongamia种子转录组中的53,586个unigenes [gydF4y2Ba32gydF4y2Ba].每个库的映射读数在1030万~ 1130万之间,映射率在91.06 ~ 94.82%之间(表11 - 11)gydF4y2Ba2gydF4y2Ba).其中,每个图书馆的唯一映射阅读数在620万至770万之间。序列饱和分析证实,每个库中的上述reads足以接近饱和(附加文件gydF4y2Ba1gydF4y2Ba:图S1)。gydF4y2Ba
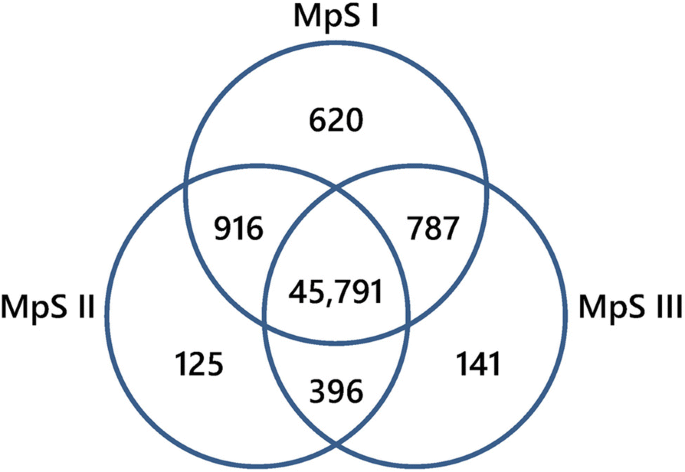
随后,将映射reads归一化为RPKM (reads per kilobase per million mapped reads)值,量化所有unigenes的表达水平。在至少一个发育阶段的样本中总共表达了48776个unigenes,其中MpSI、MpSII和MpSIII样本中分别表达了48114个(98.64%)、47228个(96.83%)和47115个(96.59%)unigenes。其中,在三个阶段的样品中均表达了45791个unigenes(93.88%)。gydF4y2Ba3.gydF4y2Ba).这三个阶段的高表达基因(RPKM≥1000)大多编码植物防御相关蛋白、成熟相关蛋白和贮藏蛋白(附加文件)gydF4y2Ba2gydF4y2Ba:表S1)。值得注意的是,编码油酸样蛋白的4个单基因(4077、10,311、22,761、22,766)在所有三个阶段都有高表达,其中一个编码种子亚油酸9s -脂氧合酶的单基因(22769)在MpSII和MpSIII阶段都有高表达,一个编码酰基载体蛋白(ACP)的单基因(22773)在MpSI阶段有高表达。另一方面,仅在MpSI、MpSII和MpSIII期表达的unigenes分别为620个(1.27%)、125个(0.26%)和141个(0.29%)。gydF4y2Ba3.gydF4y2Ba).大多数这些相特异性基因编码蛋白质参与转录和翻译过程的调节(附加文件gydF4y2Ba3.gydF4y2Ba:表S2)。有趣的是,我们发现其中一些相特异性基因与脂代谢相关,如ACP基因(28085)、FA去饱和酶基因(50523)、FA羟化酶基因(50014)、3-氧酰基-ACP合成酶基因(42167)、MpSI期表达的极长链烯酰辅酶a还原酶基因(51546)、MpSII期表达的酰基辅酶a硫酯酶基因(43564)以及MpSIII期表达的两个脂肪酶基因(36,735,44,985)。gydF4y2Ba
为了评估我们的RNA-Seq数据在每个阶段的三个生物重复之间的可重复性,我们基于所有9个样本的RPKM值进行了Pearson相关分析。相关树状图显示,MpSI、MpSII和MpSIII期样本的基因表达水平具有较高的相关性,平均系数分别为0.9664、0.9925和0.9764(补充文件)gydF4y2Ba1gydF4y2Ba:图S2)。主成分分析显示,九个样本可以明确地划分为三个组,对应于三个发育阶段(附加文件gydF4y2Ba1gydF4y2Ba:图S3),这也证明了本研究得到的基因表达数据具有良好的重现性。gydF4y2Ba
种子发育阶段差异表达基因的鉴定和功能分类gydF4y2Ba
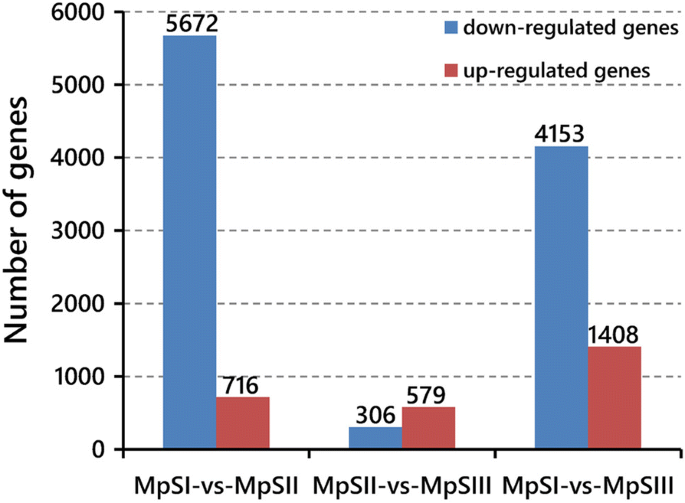
筛选出RPKM≥0.1,|log的deggydF4y2Ba2gydF4y2Ba各期间两两比较的fold change|≥1,假发现率(FDR)≤0.001。在至少一次比较中共鉴定出8881个deg(附加文件gydF4y2Ba4gydF4y2Ba:表S3)。其中,MpSI期与MpSII期之间共鉴定出6388个DEGs,其中上调716个,下调5672个;MpSII期与MpSIII期之间共鉴定出885个DEGs,上调579个,下调306个(图。gydF4y2Ba4gydF4y2Ba).前者鉴定出的deg数量多于后者,说明从胚胎发生期到种子饱满期的基因表达变化比从种子饱满期到脱水期的基因表达变化更显著。此外,在MpSI和MpSIII相之间还鉴定出5561个deg,其中1408个上调,4153个下调(图2)。gydF4y2Ba4gydF4y2Ba).作为对照,编码肌动蛋白的unigene(4651)在任何比较中表达均无显著差异。gydF4y2Ba
我们进一步使用GO和KEGG赋值对连续两次比较中识别的deg的功能进行分类。首先,2522个deg在三个主要的GO类别中分配了1975个GO术语(附加文件gydF4y2Ba5gydF4y2Ba:表S4)。相比之下,53586个内参基因中有14027个被赋以GO术语,并作为富集分析的背景。在生物过程的范畴内,两组比较中的DEGs均与“脂肪酸代谢过程”、“甘油脂代谢过程”、“甘油磷脂代谢过程”、“糖脂代谢过程”、“糖鞘脂代谢过程”等几种脂类代谢过程相关。其中,只有“脂肪酸代谢过程”显著(gydF4y2BaPgydF4y2Ba≤0.05)在MpSI-vs-MpSII比较中被deg富集(附加文件gydF4y2Ba6gydF4y2Ba:表S5)。在分子功能方面,尽管在两种比较中都有许多与脂质代谢相关的活性,如“脂肪酶活性”、“脂肪酸合成酶活性”、“o -酰基转移酶活性”、“辅酶连接酶活性”、“脂质结合”和“脂质转运体活性”,但在mpsii与mpsiii比较中,只有“辅酶连接酶活性”是由DEGs丰富的七个术语之一(附加文件)gydF4y2Ba6gydF4y2Ba:表S5)。在细胞成分类别中,与“光系统”、“类囊体”和“细胞器子室”相关的GO术语在两种比较中都被DEGs显著丰富(附加文件)gydF4y2Ba6gydF4y2Ba:表S5)。其次,在MpSI-vs-MpSII和MpSII-vs-MpSIII比较中,1506和201个deg分别被映射到125和89个KEGG通路(附加文件)gydF4y2Ba7gydF4y2Ba:表S6)。两组比较均出现了脂代谢相关通路,如“脂肪酸代谢”、“甘油脂代谢”、“甘油磷脂代谢”、“鞘脂代谢”和“醚脂代谢”。同样,53,586个内参基因中有8498个被分配了KEGG通路注释,并作为富集分析的背景。结果,有14和6个显著通路(gydF4y2BaPgydF4y2Ba≤0.05)分别在前者和后者比较中富集DEGs(附加文件gydF4y2Ba7gydF4y2Ba:表S6)。值得注意的是,在MpSI-vs-MpSII比较中,“脂肪酸生物合成”途径仅被DEGs丰富。gydF4y2Ba
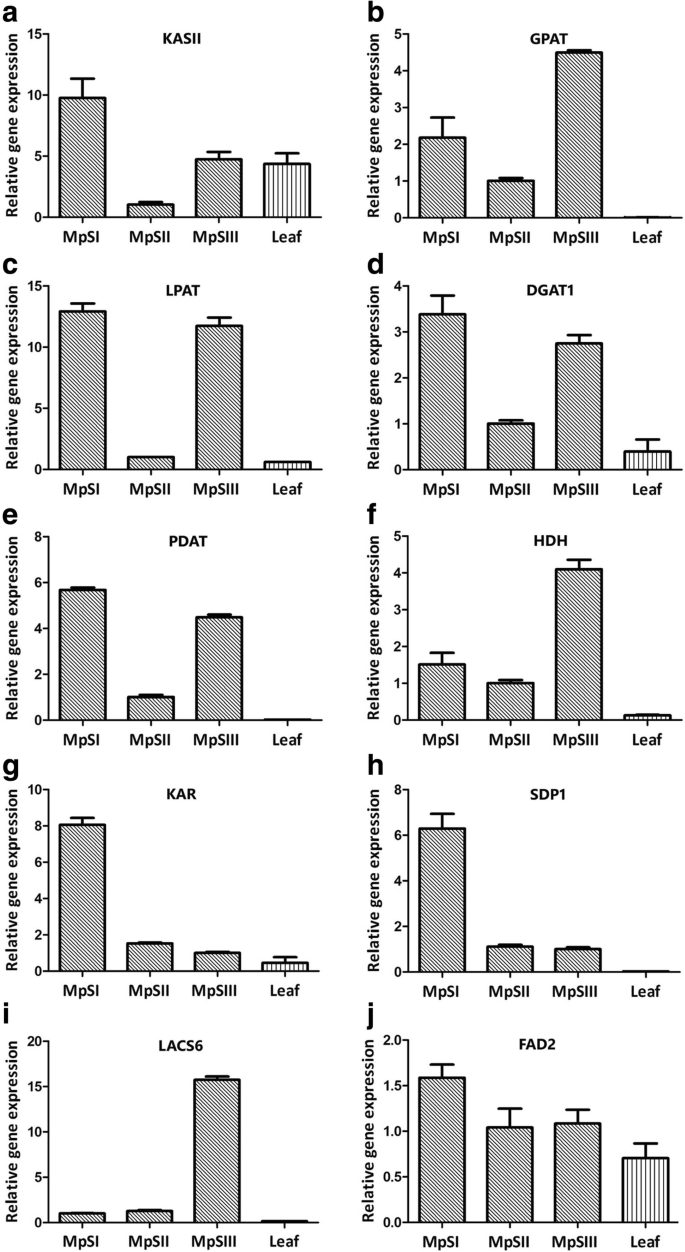
为了验证从RNA-Seq数据中获得的DEGs的表达模式,我们对10个脂代谢相关单基因进行了定量RT-PCR (qRT-PCR),编码3-酮酰基- acp合成酶II (KASII)、3-酮酰基- acp还原酶(KAR)、长链酰基-辅酶a合成酶(LACS)、甘油-3-磷酸酰基转移酶(GPAT)、溶血磷脂酰酰基转移酶(LPAT)、二酰基甘油酰基转移酶(DGAT)、磷脂:二酰基甘油酰基转移酶(PDAT),微粒体-6脂肪酸去饱和酶(FAD2), TAG脂肪酶(SDP1),和3-羟基酰基辅酶a脱氢酶(HDH)(附加文件gydF4y2Ba1gydF4y2Ba:表S7)。从三个发育阶段的种子和嫩叶中取样的rna被用作模板。需要注意的是,RNA-Seq和qRT-PCR的rna是在同一时间点分别制备的。这10个基因的qRT-PCR结果与RNA-Seq数据基本一致(图。gydF4y2Ba5gydF4y2Ba).六个unigenesgydF4y2BaKASIIgydF4y2Ba(3703),gydF4y2BaGPATgydF4y2Ba(25602),gydF4y2BaLPATgydF4y2Ba(52868),gydF4y2BaDGAT1gydF4y2Ba(21767),gydF4y2BaPDATgydF4y2Ba(36776)和gydF4y2BaHDHgydF4y2Ba(25781)呈v型表达。的表达式gydF4y2Ba冰斗gydF4y2Ba(23072)和gydF4y2BaSDP1gydF4y2Ba(45233)基因在MpSII期显著下降,之后两个阶段均为抑制表达。相比之下,agydF4y2BaLACS6gydF4y2Baunigene(20808)在两个前期均保持较低表达,随后在MpSIII期显著上调。对于一个gydF4y2BaFAD2gydF4y2Baunigene(48822),虽然表达量有所下降,但下降幅度并不像RNA-Seq数据预测的那样显著。10个候选基因中分别有7个和3个在MpSI期和MpSIII期表达最大。这10个基因在种子中的表达量均高于叶片。此外,线性回归分析也显示RNA-Seq和qRT-PCR分析显示的表达谱之间存在高度显著的相关性(附加文件gydF4y2Ba1gydF4y2Ba:图S4)。总的来说,上述结果表明,我们的RNA-Seq数据是可靠的,在种子发育过程中基因的时间表达分析。gydF4y2Ba
用qRT-PCR方法分析了10个与油脂积累相关基因的相对表达量。gydF4y2Ba一个gydF4y2BaKASII。gydF4y2BabgydF4y2BaGPAT。gydF4y2BacgydF4y2BaLPAT。gydF4y2BadgydF4y2BaDGAT1。gydF4y2BaegydF4y2BaPDAT。gydF4y2BafgydF4y2BaHDH。gydF4y2BaggydF4y2Ba凹地。gydF4y2BahgydF4y2BaSDP1。gydF4y2Ba我gydF4y2BaLACS6。gydF4y2BajgydF4y2BaFAD2。内对照采用Pongamia肌动蛋白基因。柱状图表示三个技术重复的标准差gydF4y2Ba
参与油脂积累的ungenes转录谱的描述gydF4y2Ba
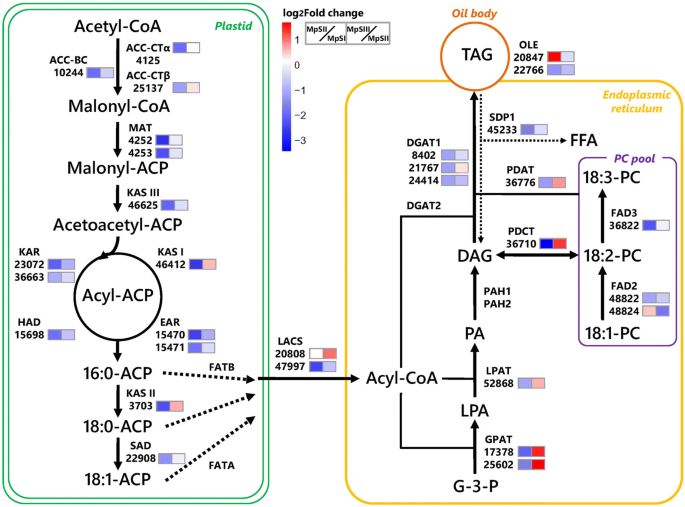
为了深入了解蓬草种子发育过程中油积累的分子因素,我们重点研究了与FA和TAG代谢相关的unigenes(附加文件)gydF4y2Ba8gydF4y2Ba:表S8)。在质体中从头合成FA开始于乙酰辅酶a羧化酶(ACC)将乙酰辅酶a转化为丙二酰辅酶a, ACC是一种具有生物素羧化酶(BC)和羧转移酶(CT)活性的多亚基酶。我们的RNA-Seq数据支持14个编码ACC或其亚基的unigenes的表达。其中,与ACC-BC、ACC-CTα和ACC-CTβ亚基同源的3个unigenes在相间被鉴定为DEGs。具体来说,gydF4y2BaACC-CTαgydF4y2Ba(4125)和gydF4y2BaACC-CTβgydF4y2Ba(25137)同源体从MpSI期到MpSII期显著下调,在MpSIII期略有上调gydF4y2BaACC-BCgydF4y2Ba(10244)同源物从MpSI期一直下调到MpSIII期(图。gydF4y2Ba6gydF4y2Ba).随后,malonyl-CoA通过malonyl-ACP转移酶(MAT)转化为malonyl-ACP。我们的结果表明有两个gydF4y2Ba垫gydF4y2Ba转录本(4252,4253)仅在MpSI-vs-MpSII比较中有差异表达。接下来,丙二醇- acp进入四步延伸循环,依次由一系列酶催化,包括KASIII, KAR, 3-羟基酰基- acp脱水酶(HAD),烯酰- acp还原酶(EAR)和KASI。在这项研究中,每一个单基因gydF4y2BaKASIIIgydF4y2Ba(46625),gydF4y2Ba有gydF4y2Ba(15698)和gydF4y2BaKASIgydF4y2Ba(46412),以及各两个unigenesgydF4y2Ba冰斗gydF4y2Ba(23,072, 36,663)和gydF4y2Ba耳朵gydF4y2Ba(15,470, 15,471)在各期间表达差异显著。除了gydF4y2BaKASIgydF4y2Ba(46412),所有这些与FA合成相关的DEGs从MpSI期到MpSIII期的表达量都呈下降趋势(图46412)。gydF4y2Ba6gydF4y2Ba).经过7个周期的延伸,得到的C16:0-ACP可以通过KASII进一步拉长到C18:0-ACP,然后通过18:0-ACP去饱和酶(SAD)去饱和到C18:1-ACP。一个单基因gydF4y2BaKASIIgydF4y2Ba(3703)呈v型表达,而(3703)为单基因gydF4y2Ba悲伤的gydF4y2Ba(22908)从MpSI期显著下调至MpSIII期(图。gydF4y2Ba6gydF4y2Ba).与其他与FA和TAG代谢相关的基因相比,这两个unigenes对gydF4y2Ba悲伤的gydF4y2Ba(22,800,22,908)在Pongamia种子中表达量较高(附加文件)gydF4y2Ba8gydF4y2Ba:表S8)。新生的C16:0-ACP或C18:0-ACP主要通过脂肪酸酰基- acp硫酯酶B (FATB)释放为游离饱和FAs,而C18:1-ACP通过脂肪酸酰基- acp硫酯酶A (FATA)水解为不饱和FAs。在本研究中,我们检测到编码FATA(48,046, 48,047)和FATB(49,454, 49,455)的4个unigenes的表达,但均未出现明显的表达水平变化。一般来说,gydF4y2BaFATBgydF4y2Ba基因表达水平高于对照组gydF4y2Ba法达gydF4y2Ba基因。gydF4y2Ba
蓬草种子发育过程中FA和TAG生物合成相关基因转录丰度的变化。在每种酶下,只有表达差异显著的unigenes才会显示其ID号。MpSI-vs-MpSII对比和MpSII-vs-MpSIII对比中RPKM值的折叠变化分别在前一个框和后一个框中以不同的颜色尺度表示(红色为上调,蓝色为下调)。这个数字是根据Dussert等人发表的模型修改的。[gydF4y2Ba58gydF4y2Ba]gydF4y2Ba
在质体中合成的游离FAs被lacs酰化,在质体包膜处形成脂酰辅酶as池,然后输出到细胞质中。在这项工作中,我们观察了LACS酶家族中6个成员的14个unigenes的表达,包括LACS1, LACS2, LACS4, LACS6, LACS8和LACS9(附加文件)gydF4y2Ba8gydF4y2Ba:表S8)。大多数在三个发育阶段均表现稳定表达。只有两个unigenes,一个是过氧化物酶体LACS6(20808),一个是叶绿体LACS9(47997),被鉴定为转录变化趋势相反的DEGs(图。gydF4y2Ba6gydF4y2Ba).酰基辅酶as库可以从细胞质转运到内质网(ER),然后用于TAG或多不饱和FA的合成。gydF4y2Ba
TAG在ER中的从头组装是由GPAT酶启动的,它将酰基酯化为gydF4y2BasngydF4y2Ba-1的甘油-3-磷酸(G-3-P)。这里有七个同源词gydF4y2BaGPATgydF4y2Ba多基因家族在邦加米亚种子中被发现表达(附加文件)gydF4y2Ba8gydF4y2Ba:表S8)。其中,两人gydF4y2BaGPAT1gydF4y2Ba和三个gydF4y2BaGPAT3gydF4y2Ba转录本表达丰度较低,无明显变化,而其他两种转录本表达丰度较低gydF4y2BaGPATgydF4y2Ba转录本(17,378,25,602)从MpSI期到MpSII期显著下调,然后在MpSIII期显著上调(图。gydF4y2Ba6gydF4y2Ba).然后,上述步骤生成的溶血磷脂酸(LPA)在LPAT酶的催化下进行第二次酯化反应生成磷脂酸(PA)。有八个gydF4y2BaLPATgydF4y2Ba在邦加米亚种子中表达的同源物。然而,只有一个gydF4y2BaLPAT2gydF4y2Ba转录本52868在种子发育过程中表达差异显著。在第三次酯化反应前,PA的磷酸基被磷脂酸磷酸水解酶(PAP)去除,形成二酰基甘油(DAG)。虽然四个unigenes是两个gydF4y2Ba人民行动党gydF4y2Ba基因(gydF4y2BaPAH1gydF4y2Ba而且gydF4y2BaPAH2gydF4y2BaDAG可以通过DGAT酶的活性从酰基辅酶as中接受酰基,也可以通过PDAT酶的活性从磷脂酰胆碱(PC)中接受酰基。有三个gydF4y2BaDGAT1gydF4y2Ba转录本(8402,21767,24414)表达差异显著,另有7个gydF4y2BaDGAT2gydF4y2Ba成绩单和一份gydF4y2BaDGAT3gydF4y2Ba转录本显示表达水平无明显变化。与DGAT2相比,DGAT1的unigenes表达更丰富。对于PDAT酶,6个unigenes中有一个(36776)被鉴定为DEGs,其表达在MpSII期急剧降低,然后在MpSIII期升高(图。gydF4y2Ba6gydF4y2Ba).PC除了为DAG提供酰基形成TAG外,还可以通过磷脂酰胆碱:二酰基甘油胆碱转移酶(diacylglycerol cholinephosphotransferase, PDCT)的活性与DAG交换磷酸胆碱。只检测到一个转录本(36710)gydF4y2BaPDCTgydF4y2Ba基因,其表达在种子发育过程中也发生了显著变化(图;gydF4y2Ba6gydF4y2Ba).最后,新合成的标签被一层磷脂和两亲性蛋白质包围,在种子中形成油体。如前所述,大多数油酸转录本在所有三个发育阶段都以稳定和高丰度表达(附加文件)gydF4y2Ba8gydF4y2Ba:表S8)。其中只有两个gydF4y2Ba奥立gydF4y2Baunigenes(20,847, 22,766)被鉴定为转录变化趋势相反的DEGs(图2)。gydF4y2Ba6gydF4y2Ba).板栗种子中未鉴定出钙红素或甾醇酸的转录本。gydF4y2Ba
多不饱和脂肪酸的生物合成主要基于C18:1在质体和ER中通过不同的途径进一步去饱和。在ER中,C18:1酰基可能被酰基辅酶a:溶血磷脂酰胆碱酰基转移酶(LPCAT)合并到PC中,然后被微粒体FAD2和-3 FA去饱和酶(FAD3)依次去饱和,形成C18:2和C18:3。另外,C18:1也可以通过叶绿体-6 FA去饱和酶(FAD6)和-3 FA去饱和酶(FAD7)转化为C18:2和C18:3。我们的研究没有发现Pongamia种子中LPCAT的转录本。不过,两人各有两份成绩单gydF4y2BaFAD2gydF4y2Ba观察到异构体(附加文件gydF4y2Ba8gydF4y2Ba:表S8)。其中,一人gydF4y2BaFAD2-1gydF4y2Ba转录本(48824)呈钟型,MpSII期表达高峰gydF4y2BaFAD2-2gydF4y2Ba转录本(48822)从MpSI期下调至MpSIII期(图。gydF4y2Ba6gydF4y2Ba).此外,还有一个gydF4y2BaFAD3gydF4y2Ba转录本(36822)经历了从MpSI阶段到MpSII阶段的显著下调,此后在后面的两个阶段保持恒定的表达。相比之下,一份成绩单gydF4y2BaFAD6gydF4y2Ba吉恩和四份成绩单gydF4y2BaFAD7gydF4y2Ba基因被发现表达,但没有一个被鉴定为DEGs(附加文件gydF4y2Ba8gydF4y2Ba:表S8)。gydF4y2Ba
种子油脂的积累不仅取决于TAG的产生,还受到TAG降解的影响。TAG脂肪酶与参与FA β氧化的酶,包括酰基辅酶a脱氢酶(ACD)、烯酰辅酶a水合酶(ECH)、HDH和3-酮酰辅酶a巯基酶(KAT),是导致种子油脂分解的原因。在这项研究中,我们发现了七个gydF4y2BaSDP1gydF4y2Ba这些转录本均表现出从MpSI期到MpSIII期表达减少的趋势。gydF4y2Ba6gydF4y2Ba).同样,几乎所有的成绩单gydF4y2Ba澳洲牧牛犬gydF4y2Ba,gydF4y2Ba决定自gydF4y2Ba,gydF4y2Ba凯特gydF4y2Ba显示抑制表达水平(附加文件gydF4y2Ba8gydF4y2Ba:表S8)。只有一个过氧化物酶体gydF4y2BaHDHgydF4y2Ba转录本(25781)从MpSII期到MpSIII期表现出显著的上调。该转录本编码过氧化物酶体β -氧化的脱氢酶,这被认为是拟南芥幼苗建立所必需的[gydF4y2Ba33gydF4y2Ba].综上所述,上述标签分解基因的抑制可能有助于邦蜜亚种子油脂的积累。gydF4y2Ba
最后,我们研究了某些在油脂积累中发挥潜在作用的转录因子的转录谱。WRI1是一种主要的植物油合成调节剂,属于APETALA2/乙烯反应因子(AP2/ERF)家族。我们只找到了一个gydF4y2BaWRI1gydF4y2Ba转录本(47905)在Pongamia种子转录组中具有下调表达模式(附加文件gydF4y2Ba8gydF4y2Ba:表S8)。FUSCA3 (FUS3)和abscisacid INSENSITIVE4 (ABI4)是另外两个与脂质代谢相关的转录因子,我们的RNA-Seq数据支持了它们的表达。一个gydF4y2BaFUS3gydF4y2Ba转录本(4198)表现出与基因表达相似的下调模式gydF4y2BaWRI1gydF4y2Ba文本,而gydF4y2BaABI4gydF4y2Batranscript(10739)在所有三个阶段都高度表达,没有显著变化(附加文件gydF4y2Ba8gydF4y2Ba:表S8)。除了这三个unigenes,我们没有鉴定出与脂代谢相关的其他转录因子的转录本,如叶子叶蛋白1 (LEC1)、LEC2、ABI3和MYB89。在今后的研究中,需要进一步扩大该物种的转录因子库。gydF4y2Ba
讨论gydF4y2Ba
从邦加木中生产的生物柴油的潜在产量和性能在很大程度上受到其种子油含量和FA组成的影响,这不仅在不同地点的树木之间存在很大差异,而且在种子发育的不同阶段也存在很大差异。本研究采用发育阶段特异性的脂质谱分析和基因表达分析方法,研究了中国枫香树种子脂质代谢的调控。与印度的邦加米亚树相比,邦加米亚树在4月至6月开花,种子在次年2月至5月成熟[gydF4y2Ba12gydF4y2Ba],根据我们的实地调查,来自中国的树木种子成熟的时间较短,开花时间为4 - 5月,种子成熟时间为10 - 12月。印度树种子发育较慢的主要原因可能是,在进入连续胚增大之前,它们通常经历几个月胚尺寸最小的生长,伴随着荚果扩展到最大尺寸[gydF4y2Ba11gydF4y2Ba],而中国产的豆荚在胚膨大前的伸展时间不到1个月。gydF4y2Ba
关于种子发育过程中油分含量和FA剖面变化的研究已经在一些印度邦加米亚品种中进行。Pavithra等人。[gydF4y2Ba11gydF4y2Ba]在30 ~ 42 WAF期间,种子含油量从32.06增加到36.53%,呈现出从绿荚期到褐荚期的时间跨度。他们还观察到,种子的鲜重从30 WAF增加到39 WAF,然后在42 WAF时下降,而水分含量在30 WAF至42 WAF期间从50%以上下降到15%以下。因此,他们用于脂质分析的时间跨度可能大致对应于种子填充和干燥阶段。基于30 - 42 WAF相同的采样时间尺度,Sreeharsha等[gydF4y2Ba31gydF4y2Ba]记录了更明显的含油量从13%上升到36%。上述两项研究均表明,在25 WAF之前,印度蓬棉种子发育速度较慢,含油量可忽略不计[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba31gydF4y2Ba].沙玛等人。[gydF4y2Ba34gydF4y2Ba]在7 ~ 37 WAF的较宽时间跨度内对种子进行了采样,检测出的含油量范围在15.96 ~ 36.93%之间。在本研究中,我们注意到从胚胎发生阶段的10个WAF到种子饱满早期的14个WAF有一个急剧的增加(10.67-21.49%),随后在种子饱满和干燥阶段有一个稳定的增加(21.49-29.59%),最大出现在26个WAF(图67 - 21.49%)。gydF4y2Ba2gydF4y2Ba).本研究检测到的Pongamia种子最大含油量接近157份印度材料含油量的平均值(31.70%)[gydF4y2Ba35gydF4y2Ba].有趣的是,与观察到的油籽植物的油脂生物合成通常发生在种子发育的中后期不同[gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba],我们的研究和夏尔马等人的研究[gydF4y2Ba34gydF4y2Ba]提供了两个在邦加米亚种子发育早期积累大量油脂的例子。gydF4y2Ba
在FA组成方面,我们的研究支持了以往研究中所显示的棕榈酸、硬脂酸、油酸和亚油酸在邦加米亚籽油中的优势[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba].这四种FAs是细胞膜或某些细胞成分的基本成分[gydF4y2Ba39gydF4y2Ba],它们在种子发育过程中都是必需的。因此,在所有采样时间点,它们在种子油中的相对比例远高于其他类型的FAs也就不足为奇了。此外,所有样品中均检出亚麻酸、二十碳酸和后依酸,均不到种子油的1%。以前,Bala等人在邦加米亚种子油中记录了大量的芥酸。[gydF4y2Ba10gydF4y2Ba],但在我们的研究和其他几项研究中没有发现[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba].除油酸自胚胎发生期开始稳步增加,在种子灌浆后期含量最高外,在蓬亚籽中可检测到的所有类型FAs均随着种子成熟呈逐渐减少的趋势(表2)gydF4y2Ba1gydF4y2Ba).大多数类型FAs的相对比例的这种变化趋势与先前报道的基本一致[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba34gydF4y2Ba].另一方面,各种研究中每种FA的变异范围差异很大,这可能是由于采样树木之间的遗传差异以及采样地点的环境影响造成的。gydF4y2Ba
为了揭示种子发育过程中油含量或FA组成的变化与基因表达差异调控之间的可能关系,我们进行了时间转录组分析。通过Illumina测序,我们生成了超过1.08亿个短读,这些短读被有效地映射到我们之前研究建立的Pongamia参考种子转录组[gydF4y2Ba32gydF4y2Ba].Pearson相关分析和主成分分析的结果均支持生物重复间较高的一致性。此外,qRT-PCR分析也验证了我们的RNA-Seq数据在时间基因表达谱中的可靠性。此前,RNA-Seq技术已成功应用于多种油籽植物,如油菜籽[gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba]、蓖麻[gydF4y2Ba42gydF4y2Ba],麻疯树[gydF4y2Ba36gydF4y2Ba],和亚麻[gydF4y2Ba38gydF4y2Ba],以描述一组控制种子发育过程中油脂积累的基因及其调节网络。这些研究结果揭示了脂质代谢调控的保守性和物种特异性的时间表达模式。在我们的研究中,RNA-Seq结果表明,在ponongamia种子的三个发育阶段中,unigenes的表达比例很高(93.88%),而只有不到2%的unigenes只在其中一个发育阶段表达。这一观察结果与这样的观点相吻合,即参与各种种子功能的大多数基因在所有发育阶段都是共享的[gydF4y2Ba43gydF4y2Ba],而每个阶段可能都有一个非常小的特定于该阶段的基因[gydF4y2Ba44gydF4y2Ba].此外,随着种子发育的进行,蓬豆种子各阶段表达的基因数量略有减少,在大豆和鹰嘴豆种子发育过程中也可见到这一现象[gydF4y2Ba25gydF4y2Ba,gydF4y2Ba29gydF4y2Ba].gydF4y2Ba
使用严格的标准,我们在至少一个阶段之间的成对比较中确定了8881个deg。总的来说,从胚胎发生期到种子饱满期,下调基因(5672个)明显多于上调基因(716个)。在大豆中,相对于结实期,在灌浆期,下调的基因也超过了上调的基因[gydF4y2Ba45gydF4y2Ba],而在成熟种子中发现的下调基因主要与细胞生长、细胞维持和光合作用有关[gydF4y2Ba46gydF4y2Ba].同样,在鹰嘴豆接近成熟阶段的种子中,与发育早期相比,大多数代谢酶编码基因都下调了[gydF4y2Ba29gydF4y2Ba].大多数基因在胚发生期优先表达是合理的,因为胚发生期是种子中蛋白质和脂肪生成代谢活性较高的阶段,有利于细胞增殖。换句话说,这反映了在这一阶段合成结构材料以支持细胞快速分裂的基因高表达的必要条件。此外,在紫花苜蓿中也观察到种子灌浆过程中代谢酶水平的下降,这表明随着胚胎吸收营养物质,代谢从高度活跃状态转变为静止状态[gydF4y2Ba47gydF4y2Ba].后来,在从种子灌浆阶段到干燥阶段的过渡过程中,发现的DEGs少得多。虽然以往的转录组学研究相对于早期阶段较少关注脱水阶段,但现有的拟南芥和大豆的证据仍然表明,种子脱水在基因表达方面是一个活跃的阶段,而不是静止的阶段,并且从储备积累后期到脱水的转变与一个主要的转录切换有关[gydF4y2Ba26gydF4y2Ba,gydF4y2Ba48gydF4y2Ba].因此,在这一转变过程中发现的上调基因(579个)比下调基因(306个)多得多,这也不足为奇。gydF4y2Ba
在从乙酰辅酶as合成FA的过程中,ACC、MAT、KASIII、KAR、HAD、EAR和KASI等所有核心酶的单基因从胚胎发生阶段到种子填充阶段均表现出显著的下调(图2)。gydF4y2Ba6gydF4y2Ba).多数单基因在灌浆期至脱水期表达量呈下降趋势,但在这一发育转变过程中表达量变化不显著。在拟南芥、油菜籽和蓖麻等不同物种的种子发育过程中,也观察到FA合成相关基因的这种协调和下降的表达模式[gydF4y2Ba48gydF4y2Ba,gydF4y2Ba49gydF4y2Ba].至于FA延伸和去饱和,KASII和SAD的单基因也在胚胎发生期表达最活跃。根据先前在大多数油籽物种中的发现,表达水平gydF4y2Ba悲伤的gydF4y2Ba基因的表达量远高于其他FA合成相关基因,这可能是由于SAD的催化效率较低[gydF4y2Ba50gydF4y2Ba].3个unigene = 2gydF4y2BaFAD2gydF4y2Ba亚型,gydF4y2BaFAD3gydF4y2Ba被鉴定为具有不同时间表达模式的deg。之前的一项研究报告了两种不同的表达模式gydF4y2BaFAD2gydF4y2Ba这表明每种语言都有两份以上的副本gydF4y2BaPpFAD2-1gydF4y2Ba而且gydF4y2BaPpFAD2-2gydF4y2Ba[gydF4y2Ba22gydF4y2Ba].从序列相似性和表达模式来看,似乎是一种gydF4y2BaFAD2-1gydF4y2Ba而且gydF4y2BaFAD2-2gydF4y2Ba本研究中的转录本可能代表不同于上述研究的每种亚型的新副本。尽管随着种子的发育,饱和FAs的比例减少而不饱和FAs的比例增加,但我们发现FATA和FATB的单基因表达水平没有显著变化,它们分别优先水解不饱和和饱和FAs [gydF4y2Ba51gydF4y2Ba].因此,我们推测酰基- acp硫酯酶的其他转录本或转录后调控可能共同解释了在发育蓬加亚种子中两类FAs的份额的相反变化。gydF4y2Ba
硫酯酶释放的游离FAs首先被LACS酯化成CoA,然后组装成TAGs。我们的结果证实了6种LACS亚型的表达。一个编码过氧化物酶体LACS6的单基因(20808)从胚胎发生阶段到脱水阶段显著上调,这表明它在制备更多酰基coas以组装TAG方面发挥了关键作用。对于催化TAG生物合成中逐步酰化的三种酰基转移酶,我们不仅验证了GPAT和LPAT家族的几个成员的表达,而且还验证了两种不相关的DGAT酶的表达。在Pongamia中,DGAT1的unigenes的表达量远高于DGAT2,这与油菜和大豆的情况相同[gydF4y2Ba49gydF4y2Ba,gydF4y2Ba52gydF4y2Ba].此外,我们还检测到编码另一种酰基转移酶PDAT的几个ungenes的表达。有趣的是,在这些酰基转移酶中鉴定的用于TAG合成的大多数DEGs呈v型表达模式(图2)。gydF4y2Ba6gydF4y2Ba),这意味着它们在胚胎发生期和干燥期都有积极表达,但在种子灌浆期没有表达。TAG合成相关基因在发育种子中的v型表达模式尚未在拟南芥或油籽植物中报道过,在这些植物中,持续下调或钟形表达一直是主导模式[gydF4y2Ba48gydF4y2Ba,gydF4y2Ba49gydF4y2Ba].在Pongamia,最近的一项研究表明,在印度的一个接种的成熟绿豆荚阶段,大多数参与TAG合成的基因都有不同程度的上调[gydF4y2Ba31gydF4y2Ba],大致对应从种子灌浆期到早期脱水期的时间跨度。在某种意义上,我们关于脱水阶段大多数TAG合成相关基因的再激活的结果与该工作的结果一致。此外,我们的基因表达谱的结果是基于更广泛的时间跨度,涵盖了胚胎发生阶段,并显示了TAG合成相关基因在这一阶段的协同激活,这在该工作中没有被调查。gydF4y2Ba
考虑到RNA-Seq实验胚胎发生阶段的采样时间点为10 WAF,这一阶段FA和TAG合成相关基因的高度活跃表达可能是导致含油量从10 WAF急剧增加到14 WAF的最主要原因(图。gydF4y2Ba2gydF4y2Ba).此外,由于新形成的FAs也可用于磷脂的合成,因此上述两组基因的激活也可能促进膜脂的快速合成,以支持细胞早期的增殖。另一方面,干燥期协同基因再激活主要出现在TAG合成相关基因中,而FA合成相关基因中没有。似乎最有可能的是,在这个后期阶段,Pongamia种子优先考虑储存脂质生物合成。在发育后期,麻疯树种子也表现出对合成贮藏脂而非膜脂的偏好[gydF4y2Ba53gydF4y2Ba].同时,本研究中观察到的大部分TAG降解相关基因表达量的降低也有助于蓬胶籽成熟过程中油脂的积累。gydF4y2Ba
结论gydF4y2Ba
本研究从形态生理特征、油分含量、FA组成、基因表达谱等方面对蓬蜜亚种子发育过程进行了时间分析,为研究蓬蜜亚种子油分积累的分子基础提供综合信息。通过合理间隔监测胚形、种子重量、种子含水量和种子颜色,我们确定了Pongamia种子的三个主要发育阶段,即胚胎发生阶段从1 WAF到11 WAF,种子填充阶段从11 WAF到24 WAF,以及24 WAF之后的脱水阶段。应该注意的是,在不同来源的邦加米亚树中,每个发育阶段的时间跨度可能不同。利用Illumina测序技术,从3个具有代表性的时间点选取9个样本进行比较转录组分析。通过两相比较,我们确定了8881个deg,并强调了这些deg与石油聚集的关系。含油量的测定表明,从胚发生期到种子灌浆期,含油量急剧增加,随后在脱水早期稳定增加,达到最大值。这种早期种子油含量的增加与胚胎发生阶段大部分FA和TAG合成相关基因的活跃表达有关,这也可能是在胚胎发生阶段合成丰富的膜脂以满足细胞快速增殖的需要。之后,这两组基因协同下调,直至干燥阶段,TAG合成相关基因被重新激活,进行贮藏脂质的合成,以达到种子油脂的最大含量。除了揭示基因表达的发育阶段特异性调控与油脂积累之间的潜在相关性之外,本研究中产生的大量数据将为精确定位脂代谢中的关键基因提供有价值的信息,例如那些具有v型表达模式编码GPAT(17,378, 25,602)、LPAT(52868)或DGAT(21767)的unigenes,并促进Pongamia或相关物种的遗传操作,以改善生物燃料生产。gydF4y2Ba
方法gydF4y2Ba
植物材料gydF4y2Ba
位于中国深圳园博园的三棵10年树龄的邦加米亚树被用作种子采样的生物复制。每棵树不同分支上的花序在它们的第一个开花日期被标记。为了进行显微分析,每隔三天从5个WAF到9个WAF中收获豆荚。为了定量分析种子重量、含油量和脂肪酸组成,从9个WAF到30个WAF定期收获豆荚。为了进行RNA-seq和qRT-PCR分析,豆荚在10 WAF、20 WAF和30 WAF下收获,代表了坡蜜亚种子的三个发育阶段,这是由它们的形态和生理变化定义的。在每个时间点,种子都被人工从豆荚中分离出来,用于后续实验。还从同一棵树上采集了幼叶进行qRT-RCR检测。新采集的种子和叶子用蒸馏水清洗,立即在液氮中冷冻,然后在−80°C保存,然后提取RNA。gydF4y2Ba
微观分析gydF4y2Ba
Pongamia种子被固定在FAA的解决方案(甲醛100毫升、80毫升75%的乙醇,10毫升乙酸)的24小时在室温下,用高纯净水三次(每次10分钟),然后浸泡在高纯净水2 h。接下来,种子在迈耶的苏木精染色样品的解决方案1 h,在蒸馏水冲洗2分钟,然后脱水在一系列的乙醇溶液浓度增加(例如,70,85,95,和100%)在每个溶液中10分钟。将脱水后的样品用二甲苯透明化,石蜡包埋,切片厚度为6 μm。最后,切片在Olympus BX51显微镜(Olympus, Japan)下观察,DP72数码相机(Olympus, Japan)拍摄。gydF4y2Ba
种子重量、含油量和FA组成的定量分析gydF4y2Ba
为了尽量减少种子性状的随机性影响,以下定量分析均基于3棵树在每个时间点各采集100颗种子。去除豆荚后立即测量种子的鲜重,然后在60°C的烤箱中干燥,直到继续干燥重量没有下降,以确定干重。用鲜重减去干重来计算种子含水量。在含油量分析中,将各时间点采集的干种子分别用研钵和研杵研磨成粉末,然后在索氏仪中以正己烷为溶剂抽油。含油量以百分比计算(gydF4y2BawgydF4y2Ba/w)干燥种子。提取的油样用甲氧基钠孵育20分钟,然后加入异辛烷和氯化钠,再孵育20分钟。上相通过硫酸钠除去水分,转移到气相色谱瓶中。随后,使用气相色谱-质谱法(Agilent 7890A-5975C, Agilent Technologies, USA)分析每个油样的FA剖面。毛细管柱选用HP-5MS (30.0 m × 250 μm × 0.25 μm)。氦气被用作载气。烘箱温度设置为180°C至240°C, 5°C mingydF4y2Ba−1gydF4y2Ba,烘箱平衡时间为1 min。进样器温度设置为230℃,检测器温度保持在280℃。试验进行了3个生物重复。FAs采用NIST05质谱库进行鉴定。每种FA的丰度以总FA的百分比表示。gydF4y2Ba
RNA提取及文库构建gydF4y2Ba
采用改良的CTAB法从蓬蜜亚种子中分离总RNA [gydF4y2Ba32gydF4y2Ba].对于三个具有代表性的时间点,三棵树的种子分别进行RNA提取。根据制造商的方案,用RNeasy Plant Mini Kit (Qiagen, Germany)进一步纯化得到的9个RNA样本。然后,用Agilent 2100生物分析仪(Agilent Technologies, USA)测定每个RNA样本的浓度和质量。所有样品的OD260/OD280比值均为2.0 ~ 2.1,RIN (RNA完整性数)值均大于7.0。每个样品共提取10 μg纯化总RNA用于文库构建。首先,利用Sera-mag Magnetic Oligo (dT) Beads (Thermo Fisher Scientific, USA)从总RNA中富集poly-(A) mRNA。接下来,用片段缓冲液将mRNA消化成短片段(Ambion, USA)。然后,将这些裂解的RNA片段作为模板,使用随机六聚体引物合成第一链cDNA,然后使用SuperScript double -strand cDNA synthesis Kit (Invitrogen, USA)合成第二链cDNA。双链cDNA片段用QiaQuick PCR Extraction Kit (Qiagen, Germany)进行纯化,并用测序适配器连接。 Finally, the short fragments were enriched by PCR amplification to create the sequencing libraries.
Illumina测序和读取参照种子转录组映射gydF4y2Ba
9个RNA-Seq文库在Illumina HiSeq 2000上测序。在过滤包含适配器序列和低质量序列的reads后,从每个测序文库中得到的干净reads被映射到我们之前研究中生成的参考种子转录组[gydF4y2Ba32gydF4y2Ba].读取映射由SOAPaligner/soap2软件执行[gydF4y2Ba54gydF4y2Ba],允许错配不超过两个垒。为了量化基因表达丰度,将每个参考单基因的唯一匹配reads数归一化为RPKM,可以消除基因长度和测序差异对基因表达计算的影响[gydF4y2Ba55gydF4y2Ba].根据各参考单基因的RPKM值,计算三个样本在各代表性时间点的Pearson相关系数。使用edgeR包对所有9个样品进行主成分分析[gydF4y2Ba56gydF4y2Ba].gydF4y2Ba
存在分析gydF4y2Ba
qRT-PCR检测了4份总RNA样本,其中3份来自与RNA- seq实验相同时间点采集的种子,1份来自幼叶。使用SuperScript First-strand cDNA Synthesis Kit (Invitrogen, USA)从6 μg总RNA中提取第一链cDNA。引物设计为10脂代谢相关的unigenes列在附加文件gydF4y2Ba1gydF4y2Ba:表S9。按照制造商的说明,在ABI PRISM 7300序列检测系统(美国应用生物系统公司)上进行反应。每个反应液为20 μl,其中SYBR Premix Ex Taq (Takara, Japan) 10 μl,每个引物0.5 μl (10 μM), cDNA模板1 μl, RNase-free水8 μl。每个基因的反应都进行了三次,热循环条件如下:95°C持续30秒,然后95°C持续5秒,60°C持续30秒,循环40次。通过熔融曲线分析证实引物特异性。用2gydF4y2Ba——ΔΔCtgydF4y2Ba方法的归一化gydF4y2Ba肌动蛋白gydF4y2Ba基因(4651)。gydF4y2Ba
deg的鉴定和功能分类gydF4y2Ba
利用edgeR包比较种子发育阶段的单基因表达[gydF4y2Ba56gydF4y2Ba].的gydF4y2BatgydF4y2Ba以FDR为阈值,用检验来判断表达差异是否有统计学意义gydF4y2BaPgydF4y2Ba-value用于多次测试。在本研究中,用RPKM≥0.1,|log对deg进行筛选gydF4y2Ba2gydF4y2Ba在各阶段的两两比较中,折变|≥1,FDR≤0.001。为了进一步表征deg的功能,他们使用Blast2GO [gydF4y2Ba57gydF4y2Ba],并通过blast对KEGG数据库进行代谢途径标注。以整个种子转录组为背景,通过超几何测试对DEGs进行GO和KEGG通路富集分析。gydF4y2Ba
缩写gydF4y2Ba
- ABI4:gydF4y2Ba
-
对脱落酸不敏感gydF4y2Ba
- ACC:gydF4y2Ba
-
乙酰辅酶a羧化酶gydF4y2Ba
- ACD:gydF4y2Ba
-
酰coa脱氢酶gydF4y2Ba
- 机场核心计划:gydF4y2Ba
-
酰基载体蛋白gydF4y2Ba
- DAG:gydF4y2Ba
-
甘油二酯gydF4y2Ba
- 度:gydF4y2Ba
-
差异表达基因gydF4y2Ba
- DGAT:gydF4y2Ba
-
二酰基甘油酰基转移酶gydF4y2Ba
- 耳朵:gydF4y2Ba
-
Enoyl-ACP还原酶gydF4y2Ba
- 决定:gydF4y2Ba
-
Enoyl-CoA水合酶gydF4y2Ba
- 呃:gydF4y2Ba
-
内质网gydF4y2Ba
- 费尔南多-阿隆索:gydF4y2Ba
-
脂肪酸gydF4y2Ba
- FAD2:gydF4y2Ba
-
- 6fa去饱和酶gydF4y2Ba
- FAD3:gydF4y2Ba
-
Omega-3 FA去饱和酶gydF4y2Ba
- 法达:gydF4y2Ba
-
脂肪酰基acp硫酯酶AgydF4y2Ba
- FATB:gydF4y2Ba
-
脂肪酰基acp硫酯酶BgydF4y2Ba
- 罗斯福:gydF4y2Ba
-
错误发现率gydF4y2Ba
- FUS3:gydF4y2Ba
-
FUSCA3gydF4y2Ba
- G-3-P:gydF4y2Ba
-
3 -磷酸甘油gydF4y2Ba
- 走:gydF4y2Ba
-
基因本体论gydF4y2Ba
- GPAT:gydF4y2Ba
-
Glycerol-3-phosphate酰基转移酶gydF4y2Ba
- 有:gydF4y2Ba
-
3-hydroxyacyl-ACP脱水酶gydF4y2Ba
- HDH:gydF4y2Ba
-
3-hydroxyacyl-CoA脱氢酶gydF4y2Ba
- 冰斗:gydF4y2Ba
-
3-ketoacyl-ACP还原酶gydF4y2Ba
- 内:gydF4y2Ba
-
3-ketoacyl-ACP合酶gydF4y2Ba
- 凯特:gydF4y2Ba
-
3-ketoacyl-CoA硫解酶gydF4y2Ba
- KEGG:gydF4y2Ba
-
京都基因和基因组百科全书gydF4y2Ba
- lac:gydF4y2Ba
-
长链酰基辅酶a合成酶gydF4y2Ba
- LEC1:gydF4y2Ba
-
绿叶COTYLEDON1gydF4y2Ba
- 摘要:gydF4y2Ba
-
Lysophosphatidic酸gydF4y2Ba
- LPAT:gydF4y2Ba
-
Lysophosphatidyl酰基转移酶gydF4y2Ba
- 垫:gydF4y2Ba
-
Malonyl-ACP转移酶gydF4y2Ba
- 奥立:gydF4y2Ba
-
OleosingydF4y2Ba
- PA:gydF4y2Ba
-
磷脂酸gydF4y2Ba
- 人民行动党:gydF4y2Ba
-
磷脂酸磷酸水解酶gydF4y2Ba
- PC:gydF4y2Ba
-
磷脂酰胆碱gydF4y2Ba
- PDAT:gydF4y2Ba
-
磷脂:二酰基甘油酰转移酶gydF4y2Ba
- PDCT:gydF4y2Ba
-
磷脂酰胆碱:二酰基甘油胆碱转移酶gydF4y2Ba
- RPKM:gydF4y2Ba
-
每千碱基每百万映射读取数gydF4y2Ba
- 悲伤:gydF4y2Ba
-
Stearoyl-ACP desaturasegydF4y2Ba
- 标签:gydF4y2Ba
-
三酰甘油gydF4y2Ba
- WAF:gydF4y2Ba
-
开花后数周gydF4y2Ba
- WRI1:gydF4y2Ba
-
WRINKLED1gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
Hill J, Nelson E, Tilman D, Polasky S, Tiffany D.生物柴油和乙醇生物燃料的环境、经济和能源成本与效益。中国科学院学报(自然科学版),2006;26(3):344 - 344。gydF4y2Ba
- 2.gydF4y2Ba
Haas MJ, McAloon AJ, Yee WC, Foglia TA。估算生物柴油生产成本的过程模型。生物技术学报。2006;39(4):344 - 344。gydF4y2Ba
- 3.gydF4y2Ba
Pimentel D, Marklein A, Toth MA, Karpoff MN, Paul GS, McCormack R, Kyriazis J, Krueger T.食品与生物燃料:环境和经济成本。生态学报。2009;37(1):1 - 12。gydF4y2Ba
- 4.gydF4y2Ba
爱德华兹DP,霍奇森JA,哈默KC,米切尔SL,艾哈迈德AH,康奈尔SJ,威尔考夫DS。对野生动物友好的油棕种植园未能有效保护生物多样性。生态学报,2010;3(4):236-42。gydF4y2Ba
- 5.gydF4y2Ba
Scott PT, Pregelj L, Chen N, Hadler JS, Djordjevic MA, Gresshoff PM。gydF4y2BaPongamia pinnatagydF4y2Ba:未来生物燃料工业尚未开发的资源。生物能源,2008;1(1):2-11。gydF4y2Ba
- 6.gydF4y2Ba
Dwivedi G,夏尔马议员。印度邦伽米亚生物柴油前景展望。更新苏斯特能源Rev. 2014; 32:114-22。gydF4y2Ba
- 7.gydF4y2Ba
刘志强,李志强,张志强,等。原油制备生物柴油的研究进展gydF4y2BaPongamia pinnatagydF4y2Ba.生物技术学报,2005;26(3):344 - 344。gydF4y2Ba
- 8.gydF4y2Ba
奈克M,梅赫尔LC,奈克SN,达斯LM。以高游离脂肪酸Karanja为原料生产生物柴油gydF4y2BaPongamia pinnatagydF4y2Ba)油。生物质生物能源。2008;32(4):354-7。gydF4y2Ba
- 9.gydF4y2Ba
Biswas B, Scott PT, Gresshoff PM。豆科植物作为可持续生物燃料生产的原料:机遇与挑战。中国植物科学,2011;29(4):344 - 344。gydF4y2Ba
- 10.gydF4y2Ba
Bala M, Nag TN, Kumar S, Vyas M, Kumar A, Bhogal NS。大致组成及脂肪酸概况gydF4y2BaPongamia pinnatagydF4y2Ba这是一种潜在的生物柴油作物。石油化工学报,2011;32(4):559-62。gydF4y2Ba
- 11.gydF4y2Ba
Pavithra HR, Gowda B, Kumar KR, Prasanna KT, Shivanna MB.开发中的油、脂肪酸剖面和卡兰金含量gydF4y2BaPongamia pinnatagydF4y2Ba(l)皮埃尔种子。石油化工学报,2012;29(3):344 - 344。gydF4y2Ba
- 12.gydF4y2Ba
桑万,饶DV,夏尔马。羽绒草(Pongamia pinata)研究进展皮埃尔:一种多功能豆科植物。地理科学,2010;8(11):130-9。gydF4y2Ba
- 13.gydF4y2Ba
Wegrzyn JL, Whalen J, Kinlaw CS, Harry DE, Puryear J, Loopstra CA, Gonzalez-Ibeas D, Vasquez-Gross HA, Famula RA, Neale DB。豆科树羽叶组织的转录组谱。树Genet基因组,2016;12(3):44。gydF4y2Ba
- 14.gydF4y2Ba
Jensen ES, Peoples MB, Boddey RM, Gresshoff PM, hauggard - nielsen H, Alves BJR, Morrison MJ。豆类,以减缓气候变化,并为生物燃料和生物精炼厂提供原料。复习一下。农业可持续发展,2012;32(2):329-64。gydF4y2Ba
- 15.gydF4y2Ba
赵德华,李志强,李志强,等gydF4y2BaPongamia pinnatagydF4y2BaL.和离体再生植株的基因组大小稳定性。原生质。2014;251(3):703 - 9。gydF4y2Ba
- 16.gydF4y2Ba
胡建明,李志强,李志强,李志强。光敏色素核苷酸序列数据揭示的豆科米氏族单系亚群。中国科学(d辑),1998;30(3):344 - 344。gydF4y2Ba
- 17.gydF4y2Ba
胡JM,拉文M,沃伊切霍夫斯基MF,桑德森MJ。米族米科(豆科)核核体ITS/5.8S序列系统发育分析:米科核心植物Poecilanthe-Cyclolobium和Callerya类群系统工程学报,2002;27(4):722-33。gydF4y2Ba
- 18.gydF4y2Ba
石诗诗,黄玉玲,曾坤,谭FX,何洪辉,黄建忠,傅YX。红树林的分子系统发育分析:胎生和盐分泌的独立进化起源。分子系统进化学报,2005;34(1):159-66。gydF4y2Ba
- 19.gydF4y2Ba
李国强,李国强,李国强。遗传多样性、种子性状及耐盐性gydF4y2BaMillettia pinnatagydF4y2Ba(l)Panigrahi,一棵生物柴油树。中国农业科学,2013;26(2):379 - 379。gydF4y2Ba
- 20.gydF4y2Ba
刘丽娟,刘丽娟,刘丽娟。生物燃料植物生物生物钟基因的分离与鉴定(gydF4y2BaMillettia pinnatagydF4y2Ba).生物能源学报,2015;8(2):760-74。gydF4y2Ba
- 21.gydF4y2Ba
刘志强,王志强,王志强。硬脂酰酰基载体蛋白去饱和酶基因的研究进展,gydF4y2BaPongamia pinnatagydF4y2Ba中国生物医学工程学报,2014;29(2):344 - 344。gydF4y2Ba
- 22.gydF4y2Ba
Moolam RA, Singh A, Shelke RG, Scott PT, Gresshoff PM, Rangan L.生物柴油植物微粒体油酸去饱和酶(FAD2)基因的鉴定gydF4y2BaPongamia pinnatagydF4y2Ba中文信息学报。2016;30(4):1351-60。gydF4y2Ba
- 23.gydF4y2Ba
李志强,李志强,李志强,等。豆科植物种子发育的分子生理学研究。植物学报,2005;gydF4y2Ba
- 24.gydF4y2Ba
Severin AJ, Woody JL, Bolon YT, Joseph B, Diers BW, Farmer AD, Muehlbauer GJ, Nelson RT, Grant D, Specht JE,等。的RNA-Seq图谱gydF4y2Ba大豆gydF4y2Ba:大豆转录组指南。中国生物医学工程学报。2010;gydF4y2Ba
- 25.gydF4y2Ba
Asakura T, Tamura T, Terauchi K, Narikawa T, Yagasaki K, Ishimaru Y, Abe K.发育大豆种子的全局基因表达谱。植物化学学报,2012;gydF4y2Ba
- 26.gydF4y2Ba
Jones SI, Vodkin LO。利用RNA-Seq分析大豆种子从受精到成熟的发育过程。公共科学学报,2013;8(3):e59270。gydF4y2Ba
- 27.gydF4y2Ba
本尼迪托VA,托雷斯-赫雷斯I,穆雷JD,安德里安卡亚A,艾伦S,卡卡尔K,瓦德雷M,维迪尔J,祖伯H,奥特T,等。模式豆科植物的基因表达图谱gydF4y2BaMedicago truncatulagydF4y2Ba.植物学报,2008;36(3):344 - 344。gydF4y2Ba
- 28.gydF4y2Ba
Verdier J, Torres-Jerez I, Wang MY, Andriankaja A, Allen SN, He J, Tang Y, Murray JD, Udvardi MKgydF4y2BaLotus对虾gydF4y2Ba基因表达图谱(LjGEA)及其在豆科植物种子成熟研究中的应用。植物学报,2013;26(2):353 - 353。gydF4y2Ba
- 29.gydF4y2Ba
普拉丹,班迪瓦,沙N,康德C,高尔R,巴提亚S.发育鹰嘴豆全球转录组分析(gydF4y2Ba中投arietinumgydF4y2Bal .)种子。植物科学进展(英文版);gydF4y2Ba
- 30.gydF4y2Ba
黄建忠,陆旭,闫红,陈淑云,张伟科,黄富峰,郑永智。盐反应基因的转录组特征和测序鉴定gydF4y2BaMillettia pinnatagydF4y2Ba是一种半红树植物。DNA, 2012;19(2): 195-207。gydF4y2Ba
- 31.gydF4y2Ba
Sreeharsha RV, Mudalkar S, Singha KT, Reddy AR.在一种有前途的生物燃料树种中,揭示从花起始到脂质生物合成的分子机制,gydF4y2BaPongamia pinnatagydF4y2Ba使用转录组分析。科学报告2016;6:34315。gydF4y2Ba
- 32.gydF4y2Ba
黄建忠,郭晓辉,郝晓辉,张伟科,陈淑云,黄rf, Gresshoff PM,郑永智。gydF4y2Ba新创gydF4y2Ba树豆科植物种子转录组的测序和特征分析gydF4y2BaMillettia pinnatagydF4y2Ba用于基因发现和SSR标记开发。Mol育种。2016;36(6):15。gydF4y2Ba
- 33.gydF4y2Ba
Rylott EL, Eastmond PJ, Gilday AD, Slocombe SP, Larson TR, Baker A, Graham IA。的gydF4y2Ba拟南芥gydF4y2Ba过氧化物酶体β -氧化多功能蛋白基因(MFP2)对幼苗的建立至关重要。植物学报,2006;45(6):930-41。gydF4y2Ba
- 34.gydF4y2Ba
沙玛SS, Islam MA, Negi MS, Tripathi SB.种子发育过程中油脂含量和脂肪酸谱的变化gydF4y2BaPongamia pinnatagydF4y2Ba(l)皮埃尔。中国植物学报。2015;20(3):281-4。gydF4y2Ba
- 35.gydF4y2Ba
沙玛SS,伊斯兰MA,马利克AA,库马尔K, Negi MS, Tripathi SB.种子性状,脂肪酸谱和遗传多样性评价gydF4y2BaPongamia pinnatagydF4y2Ba(l)皮埃尔种质。植物学报。2016;22(2):193-205。gydF4y2Ba
- 36.gydF4y2Ba
蒋宏伟,吴佩忠,张松,宋超,陈亚平,李巍,贾彦宏,方晓辉,陈峰,吴国军。发育中物理坚果基因表达谱的全球分析(gydF4y2Ba麻风树gydF4y2Bal .)种子。公共科学学报,2012;7(5):e36522。gydF4y2Ba
- 37.gydF4y2Ba
尹德明,王勇,张小刚,李红梅,陆旭,张建军,张伟科,陈世永。gydF4y2Ba新创gydF4y2Ba花生的组装(gydF4y2Ba落花生hypogaeagydF4y2BaL.)种子转录组揭示了油积累途径的候选单基因。公共科学学报,2013;8(9):e73767。gydF4y2Ba
- 38.gydF4y2Ba
Abdullah HM, Akbari P, Paulose B, Schnell D, Qi WP, Park Y, Pareek A, Dhankher OP.转录组分析gydF4y2Ba亚麻荠漂白亚麻纤维卷gydF4y2Ba目的:鉴定与三酰甘油在种子发育过程中生物合成和积累有关的基因。生物技术生物燃料,2016;9:19。gydF4y2Ba
- 39.gydF4y2Ba
沃尔克T,肯尼AT。种子贮藏脂质的生物合成变化。植物物理学报,2001;52:335-61。gydF4y2Ba
- 40.gydF4y2Ba
邓伟,闫峰,张晓玲,唐玉文,袁玉军。油菜发育胚胎的转录谱分析及其重要作用的鉴定gydF4y2BaBnDof5.6gydF4y2Ba在胚胎发育和脂肪酸合成中。中国生物医学工程学报。2015;36(8):1624-40。gydF4y2Ba
- 41.gydF4y2Ba
徐红梅,孔晓东,陈峰,黄建新,楼晓霞,赵建勇gydF4y2Ba芸苔属植物显著gydF4y2Ba使用RNA-Seq和脂类相关候选基因的鉴定。BMC基因组学。2015;16:858。gydF4y2Ba
- 42.gydF4y2Ba
Brown AP, Kroon JTM, Swarbreck D, Febrer M, Larson TR, Graham IA, Caccamo M, Slabas AR.蓖麻组织特异性全转录组测序,旨在了解三酰甘油脂类生物合成途径。公共科学学报,2012;7(2):e30100。gydF4y2Ba
- 43.gydF4y2Ba
Le BH, Cheng C, Bui AQ, Wagmaister JA, Henry KF, Pelletier J, Kwong L, Belmonte M, Kirkbride R, Horvath S,等。拟南芥种子发育过程中基因活性的全局分析及种子特异性转录因子的鉴定。中国科学(d辑:自然科学),2010,26(3):344 - 344。gydF4y2Ba
- 44.gydF4y2Ba
种子发育程序:双子叶和单子叶的系统生物学比较。植物生物学,2013;64:189-217。gydF4y2Ba
- 45.gydF4y2Ba
杜娟,王士德,何晨明,周波,阮丽丽,寿海霞。利用RNA测序分析鉴定控制大豆种子结实率和大小的调控网络和枢纽基因。中国生物医学工程学报,2017;29(3):344 - 344。gydF4y2Ba
- 46.gydF4y2Ba
琼斯,杜冈萨雷斯,洛沃金。大豆种子发育过程中转录模式的通量。BMC基因组学。2010;11:136。gydF4y2Ba
- 47.gydF4y2Ba
Gallardo K, Firnhaber C, Zuber H, Hericher D, Belghazi M, Henry C, Kuster H, Thompson R.发育过程中蛋白质组和转录组结合分析gydF4y2BaMedicago truncatulagydF4y2Ba种子。蛋白质组学。2007;6(12):2165-79。gydF4y2Ba
- 48.gydF4y2Ba
杨晓明,李志刚,杨晓明。种子脱水对种子萌发和成熟的影响。植物科学进展,2010;15(4):211-8。gydF4y2Ba
- 49.gydF4y2Ba
Troncoso-Ponce MA, Kilaru A, Cao X, Durrett TP, Fan JL, Jensen JK, Thrower NA, Pauly M, Wilkerson C, Ohlrogge JB。四种发育中的油籽的比较深层转录谱分析。植物学报,2011;36(6):344 - 344。gydF4y2Ba
- 50.gydF4y2Ba
尚克林J, Cahoon EB。脂肪酸的去饱和和相关修饰。植物物理学报,1998;49:411 - 419。gydF4y2Ba
- 51.gydF4y2Ba
Salas JJ, Ohlrogge JB。植物FatA和FatB酰基acp硫酯酶底物特异性的研究。中国生物工程学报。2002;39(1):1 - 4。gydF4y2Ba
- 52.gydF4y2Ba
李荣泽,余KS, Hildebrand DF。gydF4y2BaDGAT1gydF4y2Ba,gydF4y2BaDGAT2gydF4y2Ba而且gydF4y2BaPDATgydF4y2Ba环氧和羟基脂肪酸积累植物种子和其他组织中的表达。脂质。2010;45(2):145 - 57。gydF4y2Ba
- 53.gydF4y2Ba
Chaitanya BSK, Kumar S, Kaki SS, Balakrishna M, Karuna MSL, Prasad RBN, Sastry PS, Reddy AR.阶段特异性脂肪酸通量在种子发育过程中甘油脂代谢的调节作用gydF4y2Ba麻风树gydF4y2Ba中国农学通报,2015;29(5):529 - 529。gydF4y2Ba
- 54.gydF4y2Ba
李仁强,于超,李玉玲,林文涛,姚明生,王娟。一种改进的短读对齐超快工具。生物信息学,2009,25(15):1966 - 7。gydF4y2Ba
- 55.gydF4y2Ba
Mortazavi A, Williams BA, McCue K, Schaeffer L, Wold B.用RNA-Seq绘制和量化哺乳动物转录组。光子学报。2008;5(7):621-8。gydF4y2Ba
- 56.gydF4y2Ba
Robinson MD, McCarthy DJ, Smyth GK。edgeR:用于数字基因表达数据差异表达分析的生物导体包。生物信息学,2010,26(1):139 - 40。gydF4y2Ba
- 57.gydF4y2Ba
Conesa A, Gotz S, Garcia-Gomez JM, Terol J, Talon M, Robles M. Blast2GO:功能基因组学研究中注释、可视化和分析的通用工具。生物信息学。2005;21(18):3674 - 6。gydF4y2Ba
- 58.gydF4y2Ba
Dussert S, Guerin C, Andersson M, Joet T, Tranbarger TJ, Pizot M, Sarah G, Omore A, Durand-Gasselin T, Morcillo F. 3种油棕榈果实和种子组织油脂含量和脂肪酸组成不同的转录组比较分析。中国生物医学工程学报,2013;29(3):344 - 344。gydF4y2Ba
确认gydF4y2Ba
我们感谢王江鑫博士和雷安平博士在脂质分析实验中的帮助。我们也非常感谢审稿人和编辑们为改进手稿提出的意见和建议。gydF4y2Ba
资金gydF4y2Ba
国家自然科学基金(No. 31300275、31370289)、广东省创新科研团队基金(No. 2014ZT05S078)、深圳市科技研究发展基金(No. 2014ZT05S078)资助。JCYJ20140724165855348)。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
用于Pongamia内参基因表达谱分析的Illumina读取数据已提交给NCBI序列读取档案(SRA),登录号为SRP132431。支持我们发现的所有其他数据都可以在附加文件中找到gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba.gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
JH、CPJ和YZ构思了这项研究。XH和YJ采集了不同时间点的邦蜜亚种子,进行了显微分析,并测量了种子重量。YJ和QS测定了种子发育过程中含油量和脂肪酸组成。XG制备了用于Illumina测序的rna。KSK和YKA进行qRT-PCR实验。JH和XH分析了所有表型和分子数据。JH, DEH, CPJ和YZ起草并修改了手稿。所有作者均已阅读并批准最终稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们之间没有利益冲突。gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
附加文件gydF4y2Ba
附加文件1:gydF4y2Ba
图S1。gydF4y2Ba9个测序库的序列饱和度分析。gydF4y2Ba图S2。gydF4y2Ba所有9个样本RPKM值的Pearson相关分析。gydF4y2Ba图S3。gydF4y2Ba9个样品RPKM值的主成分分析。gydF4y2Ba图S4。gydF4y2BaRNA-Seq与qRT-PCR数据的基因表达率之间的线性回归分析。gydF4y2Ba表S7。gydF4y2BaqRT-PCR分析10个脂代谢相关unigenes的引物。(docx600kb)gydF4y2Ba
附加文件2:gydF4y2Ba
表S1。gydF4y2Ba蓬草种子三个发育阶段高表达基因(RPKM≥1000)列表。(xls36kb)gydF4y2Ba
附加文件3:gydF4y2Ba
表S2。gydF4y2Ba蓬葛籽各发育阶段特异性表达的基因列表。(XLS 131kb)gydF4y2Ba
附加文件4:gydF4y2Ba
表S3。gydF4y2Ba板栗种子发育阶段之间的DEGs表。(xl2356 kb)gydF4y2Ba
附加文件5:gydF4y2Ba
表S4。gydF4y2Ba蓬草种子发育阶段DEGs的GO注释。(XLS 2996 kb)gydF4y2Ba
附加文件6:gydF4y2Ba
表S5。gydF4y2Ba发育阶段间富含DEGs的GO术语。(xls29 kb)gydF4y2Ba
附加文件7:gydF4y2Ba
表S6。gydF4y2BaKEGG途径用DEGs表示。(XLS 54 kb)gydF4y2Ba
附加文件8:gydF4y2Ba
表S8。gydF4y2Ba与FA和TAG代谢相关的Pongamia基因列表。(xls47kb)gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文根据创作共用属性4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)除另有说明外,适用于本条所提供的资料。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
黄,J,郝,X,金,Y。gydF4y2Baet al。gydF4y2Ba发育种子的时间转录组分析揭示了与油积累有关的一致基因调控(gydF4y2BaMillettia pinnatagydF4y2Ba).gydF4y2BaBMC植物生物学gydF4y2Ba18,gydF4y2Ba140(2018)。https://doi.org/10.1186/s12870-018-1356-8gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-018-1356-8gydF4y2Ba
关键字gydF4y2Ba
- Millettia pinnatagydF4y2Ba
- 油藏gydF4y2Ba
- 时间转录组分析gydF4y2Ba
- 种子发展gydF4y2Ba
- 共同监管gydF4y2Ba
- 生物燃料gydF4y2Ba