摘要
背景
Cypetus esculentus.其独特之处在于它能在块茎中积累大量的油、淀粉和糖作为主要的贮藏贮藏物,且块茎产量高,因此被认为是研究块茎和根等地下库组织中碳分配到不同贮藏贮藏物的新模型。蔗糖(Suc)在不同储层生物合成碳通量的调控中起着核心作用;然而,Suc在地下富油贮藏组织中代谢的分子机制尚不清楚。在本研究中,一个全面的转录组分析c . esculentus通过与其他植物油脂或碳水化合物丰富的贮藏组织比较,研究了Suc代谢相关基因的表达模式。
结果
结果表明,油松块茎中基因转录本具有一些种特异性特征c . esculentus这表明:(i) Suc代谢相关基因的表达受发育调控,并表现出与其他植物贮藏组织不同的模式;(ii) Suc的分解和生物合成过程可能是Suc代谢的主要途径;(iii)在块茎发育过程中,Suc的降解可能主要通过Suc合成酶(SUS)而非转化酶(INV)的作用。SUS1、SUS3和SUS4的同源异构体是催化Suc分解的主要SUS亚型,而液泡INV (VIN)是控制糖组成的主要决定因子;(iv)胞质己糖磷酸化可能更多地依赖于果糖作为底物,尿苷二磷酸葡萄糖焦磷酸化酶(UGP)在这一途径中起重要作用;(v)在Suc生物合成途径中发挥关键作用的是苏基磷酸合酶(SPS) B-和c家族成员,而不是SPS A家族成员。
结论
我们已经成功地鉴定了Suc的代谢途径c . esculentus块茎,强调指出,可能在这个独特的地下储存组织促进糖分积累一些保守的和独特的表达。在这项研究中发现可能表明了特殊的分子机制和新陈代谢的Suc转录调控的具体和差异表达的基因发生在油块茎c . esculentus.
背景
Cypetus esculentus.是莎草科莎草科的多年生草本植物,广泛分布于几乎所有的热带、亚热带和温带地区[1].c . esculentus是目前发现的一种特殊的非传统地下作物,其产量相对较高(在4.5 ~ 12 t·ha- 1)[2],它的贮藏块茎积聚了高水平的这三种贮藏物质:高达40%的淀粉、35%的油和20%的可溶性糖[3.,4,5,6],提供约400-450千卡/100克的高能量[6].块茎的c . esculentus是食用和新鲜食用,干燥,烤的形式,或碾磨成味无麸质的粉或地做出美味的牛奶般饮料[6,7].块茎可用于生产食用油,可与橄榄油或榛子油相媲美[8,9],脱脂残渣可进一步用于饲料或制糖、酿酒[10.].此外,c . esculentus对人类健康大有益处[11.,12.]并且可以用作生物燃料生产的潜在良好的原料,因为油和淀粉的高含量13.,14.,15.].
主要贮藏储量在块茎发育过程中的积累规律c . esculentus前人通过生化分析对其进行了表征,表明油脂、淀粉和糖类在块茎发育过程中是有序、逐渐积累的[4].因此,c . esculentus作为一种新的模式植物来研究碳在非光合作用的地下贮藏组织中的分配。然而,碳通量分配背后的分子机制c . esculentus块茎仍不清楚。
作为一种重要的碳代谢过程,Suc代谢不仅对植物生长和发展至关重要,通过提供碳源和能量[16.,17.],但也是糖积累的决定因素和Suc体内平衡的关键,赋予其对生物和非生物胁迫的耐受性[18.,19.,20.,21.].特别地,SuC代谢在涉及不同储量储备的生物合成的碳通量中发挥着核心作用,包括淀粉,油,糖和沉没组织中的沉淀组织,如种子,水果,块茎,茎,灯泡,商品和花卉[16.].
尽管它的重要性,但对Suc在地下富油贮藏营养组织中的代谢过程或途径的全面描述仍然缺乏。尽管模型植物中的Suc代谢已被充分证实,其过程在植物中被认为是高度保守的,但富含油脂的块茎植物中的分子和生化细节仍不清楚。此外,除富含油脂的种子和果实或富含碳水化合物的果实、根和块茎外,油质块茎中Suc代谢的分子调控机制仍知之甚少。本研究综合分析了黄瓜块茎发育中Suc代谢相关基因的整体表达情况c . esculentus通过与其他植物富含油脂或碳水化合物的贮藏器官的比较,揭示了几种种特异性基因表达谱。我们的研究代表了一个全面的分析基因参与的Suc代谢c . esculentus,不仅揭示了往下代谢石油块茎组织,但也提供一个基础为进一步研究这些基因的功能和随后的往下代谢的操纵,目的是增加石油的积累,淀粉或糖,以及质量和产量的遗传改良c . esculentus块茎。
结果
块茎发育过程中蔗糖的积累c . esculentus
与其他常见植物相比,其富含油或淀粉或其水槽器官的糖,糖的一部分在成熟块茎中的新重量(FW)c . esculentus在贮藏储量中相对较高,高于油料植物,甚至高于葡萄、甜菜、甘薯、马铃薯等一些富含碳水化合物的水果、块根作物(Table1).在块茎c . esculentus糖的主要成分是其的Suc可以累积到干重的20%,而次要的包括葡萄糖(GLC)和果糖(FRU)[4,6,22.].
为了研究块茎发育过程对糖积累的影响,本研究测定了块茎发育过程中糖的含量。总糖水平计算为Suc、Glc和Fru的总和。图中显示了种子块茎播种后120天左右的果实发育过程中糖积累量的变化。1说明不同发育阶段的个体糖和总糖含量不同。在各发育阶段,Suc浓度最高,Glc次之,Fru浓度最低。以每个新鲜块茎为基础,块茎中糖的积累在整个发育过程中都是持续的,含糖量在9 ~ 124 mg之间⋅块根- 1.在早期到中间阶段(40-85 DAS)期间存在相对缓慢的糖积累,其中累积率仅为0.41毫克⋅块根- 1⋅d- 1,多比后期的降低(85-120 DAS)与2.88毫克⋅块根- 1⋅d- 1,表明块茎发育过程中调节糖积累的代谢过程存在差异。在120 DAS时,糖增加到124 mg·块茎- 1其中,Suc明显高于Glc和Fru(图2)。1A).此时,蔗糖约占FW的9.5%,Suc、Glc和Fru分别为5.7、2.2和1.6%(图2)。1B.).在理论上,通过INV和SUS的催化作用,Suc的营业额可以产生比Glc更多的Fru。然而,我们的结果表明,Fru在块茎发育过程中始终保持在低于Glc的水平。由此推测,与Glc相比,Fru底物对己糖代谢的要求可能更高。
的Suc积累的模式c . esculentus在块茎发育过程中发生的类似于拟南芥种子库器官的发育[23.,24.],油菜籽[25.),烟草(26.,大豆27.和西红柿的果实[28.],甜瓜[29.],苹果[30.),菠萝31.],桃子[32.],菠萝蜜[33.],和马铃薯的块茎肿胀[34.,但不同植物在积累Suc时的实际Suc含量存在差异。块茎发育过程中Suc水平的时间变化表明,块茎中Suc的积累与块茎发育密切相关c . esculentus由发育过程,这很可能与代谢的Suc基因的表达模式相关联的受到高度调节。
已有研究表明,Suc的积累主要取决于Suc降解(INV和SUS活性)和合成(SPS活性)之间的平衡[29.].研究发现,Suc的积累与INV和SUS的活性呈负相关[35.,36.,37.].尽管对于SPS活性与Suc积累的显著相关性仍存在争议[35.,36.], SPS似乎在Suc降解和再合成的同步循环中发挥了关键作用,因此为代谢提供Suc的利用[38.,39.].有人建议[4],在开发块茎的时候c . esculentus从细胞分裂转化为开始积累油脂的贮藏室,主要酶活性由INV向sus介导的Suc代谢转换,导致块茎中由高己糖向Suc转化为高己糖向高己糖转化。在本研究中,我们确实观察到在块茎发育过程中,蔗糖对己糖的比率较高c . esculentus(无花果。1),那里的石油开始积累约50das [40].
总的来说,我们的结果表明,糖积累的变化与块茎的发育有关。
蔗糖代谢相关基因c . esculentus块茎表现出不同于其他植物富含油脂或碳水化合物的贮藏组织的转录模式
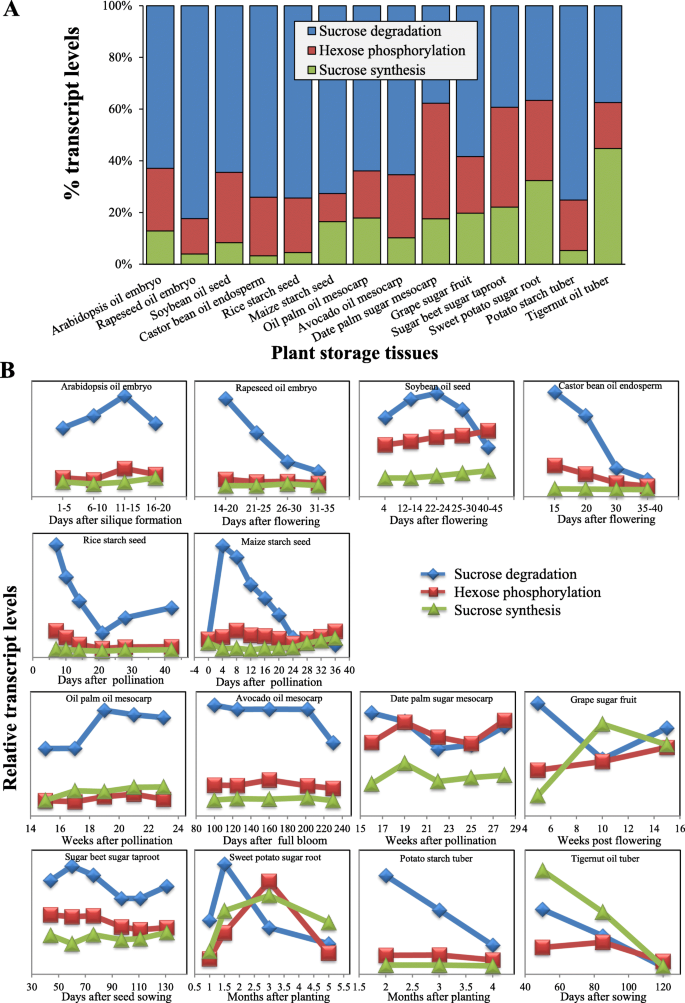
我们之前的转录组分析c . esculentus块茎from three representative samples at 50, 85 and 120 DAS of developmental stages (i.e. the early stage of 40–50 DAS, the middle stage of 50–85 DAS and the late stage of 85–120 DAS, corresponding to the stage of low oil level and oil accumulation rate, medium oil level but high oil accumulation rate, and high oil level with low oil accumulation rate, respectively) have indicated that 41.05% of total 99,558 transcripts were successfully annotated [40].其中,488个注释的转录本涉及碳水化合物代谢,其中355个unigenes在发育中被发现表达c . esculentus块茎(附加文件1:表S1d)。鉴定了超过120种成绩单和60个未成年人,用于Suc代谢(附加文件1:表S3)。大多数的Suc代谢相关的转录物和个Unigenes的参与了磷酸化的己糖,随后以该顺序(图的Suc降解和合成的Suc。2 b额外的文件1:表S1d)。大多数已知的Suc代谢酶和/或蛋白质在块茎中已被成功检测到c . esculentus,表明其参与油薯中Suc代谢的能力与其他植物类似。
为的Suc代谢基因的表达模式。一个富油块茎中Suc代谢途径示意图Cypetus esculentus..酶或蛋白质的名称用蓝色表示。对于每个酶或蛋白质,箭头的宽度表示基因表达水平(FPKM,每千碱基外显子模型的平均片段每百万图读)。黑色和紫色箭头分别表示中常见和不同的基因表达模式Cypetus esculentus.本研究中研究的其他植物的块茎。运输者被标记为黑色箭头穿过红色椭圆形。不同亚型和/或亚基的FPKM值是平均转录水平。黑色括号中的红色数字表示每种酶或蛋白质中FPKM大于1的unigenes的数量。缩写:CIN,胞质转化酶;CWIN:细胞壁转化酶;F6P fructose-6-phosphate;颗,果糖激酶;Fru果糖;G1P glucose-1-phosphate; G6P, glucose-6-phosphate; Glc, glucose; Hexose-P, hexose-phosphate; HT, hexose transporter; HXK, hexokinase; PD, plasmodesmata; PGI, phosphoglucoisomerase; PGM, phosphoglucomutase; S6P, succose-6-phosphate; SPP, sucrose-phosphatase.; SPS, sucrose-phosphate synthase; Suc, sucrose; SUS, sucrose synthase; SUT, sucrose transporter; T6P, trehalose-6-phosphate; TPS, trehalose-6-phosphate synthase; TST, tonoplast sucrose transporter; SWEET, Sugars Will Eventually be Exported Transporter (hexose and sucrose transporter); UDP-Glc, uridine diphosphate glucose; UGP, UDP-Glc pyrophosphorylase; VIN, vacuolar invertase.b表达水平的Suc代谢的基因。左,成绩单内容的三种途径之间的分配。右,每蛋白FPKM在各通路。不考虑接近旁系同源物或等位基因转录本,多个蛋白同种型或者多蛋白复合物的亚基的分离被认为是一个单一的蛋白质和它们的转录物求和(附加文件1:表S3)
基于我们的转录组数据和植物Suc代谢模型的基因表达,研究了植物Suc代谢的核心途径c . esculentus图中显示了块茎。2.Suc的代谢主要包括3个代谢途径,即Suc的分解、己糖(包括Glc和Fru)的磷酸化以及已糖磷酸化后Suc的生物合成反应。在非光合作用库组织中,Suc的分解有两种途径:水解和各种酶的裂解。脱离韧皮部的Suc可以无质进入细胞壁基质,也可以通过胞间连丝(PD)完整地被吸收[41,42],则Suc可被细胞壁转化酶(CWINs)水解为其组成单糖,如Glc和Fru,或被SUS降解为UDP-Glc和Fru,或被胞内转化酶,如细胞质转化酶(CINs)和VINs,产生Glc和Fru [17.].己糖磷酸化主要涉及多个途径,其中产生的Glc、Fru和UDP-Glc分别通过己糖激酶(HXK)、果糖特异性果糖激酶(FK)和UGP磷酸化为葡萄糖-6-磷酸(G6P)、果糖-6-磷酸(F6P)和葡萄糖-1-磷酸(G1P)。磷酸葡萄糖异构酶(PGI)或磷酸葡萄糖合成酶(PGM)催化G6P可逆转化为F6P或G1P。Suc再合成主要是两步不可逆反应,F6P与UDP-Glc结合,通过SPS作用转化为suc6 -phosphate (S6P),随后S6P在S6P磷酸酶(SPP)的催化下转化为Suc和磷酸盐[43].
在c . esculentus往下合成相关基因的表达在这些代谢途径是最丰富的,平均价值记录水平,由FPKM(每千碱基片段每百万映射读取)外显子模型的每个蛋白质,几乎相当于往下的总水平退化和己糖磷酸化(无花果。2 b).这一结果提示,转录调控Suc的合成可能是影响Suc代谢的主要因素c . esculentus块茎。
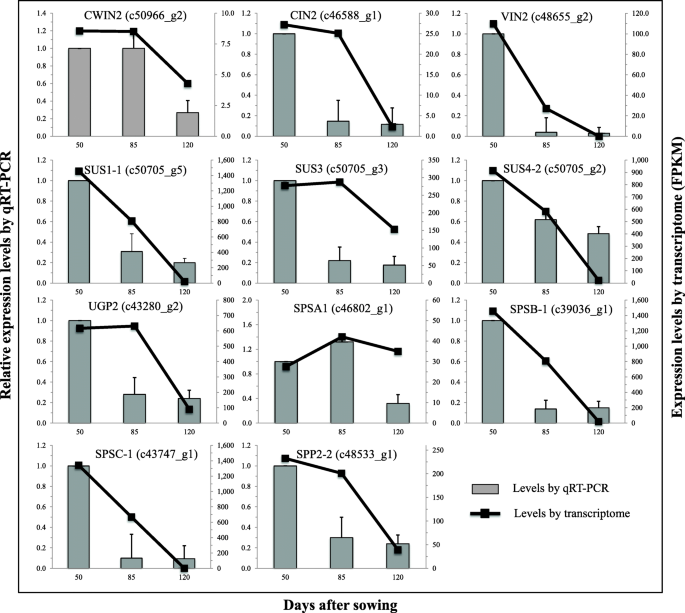
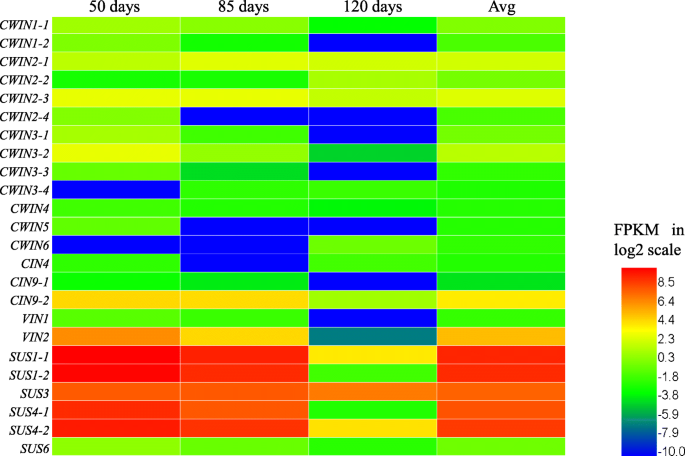
此外,在三种代谢过程中表达的基因在块茎发育中全部下调,在各种发育阶段具有不同的转录水平(图。3 b),提示与体内Suc代谢相关的基因c . esculentus块茎是发育调节的。通过实时定量PCR (qRT-PCR)分析与块茎发育中Suc代谢相关的候选基因的结果进一步证实了这一点。4).
使用QRT-PCR测量涉及SuC代谢的选择unigenes的相对基因表达谱。18秒被用作QRT-PCR的内部对照。值代表平均值±标准差(N = 4).这些基因的引物序列列在附加文件中1:表S4
我们发现,下的Suc代谢c . esculentus块茎与其他植物贮藏组织如富含油或碳水化合物的种子、果实、根和块茎具有不同的转录模式。3.).与此相反c . esculentus其他植物中表达最多的基因参与了Suc的降解,而不是Suc的合成。此外,合成Suc的转录本要低得多,比Suc降解和己糖磷酸化的总水平低2- 30倍(图)。3).此外,两组间Suc代谢的时间表达模式也不相同c . esculentus块茎和发展的过程中,其他植物贮藏组织(图3 b).在c . esculentus在块茎发育过程中,三种代谢途径的转录本均下调,特别是在块茎发育过程中,Suc降解和合成均表现出协同的时间表达。而在其他植物贮藏组织中,Suc合成基因的表达呈持续或小幅上升的趋势,且在发育的各个阶段均表现出与Suc降解不同的模式。
总之,我们的数据表明,与Suc代谢途径相关的基因c . esculentus块茎具有不同于其他植物富含油脂或碳水化合物的贮藏组织的转录模式,表明其存在不同的基因表达调控c . esculentus块茎。
蔗糖合酶在蔗糖降解过程中高度表达c . esculentus块茎
在进入不同亚细胞室的不同通路之前,Suc必须要么被INV不可逆地水解为Glc和Fru,要么被SUS催化可逆地(最好是与UDP一起裂解为UDP-Glc和Fru) [44](图。2).
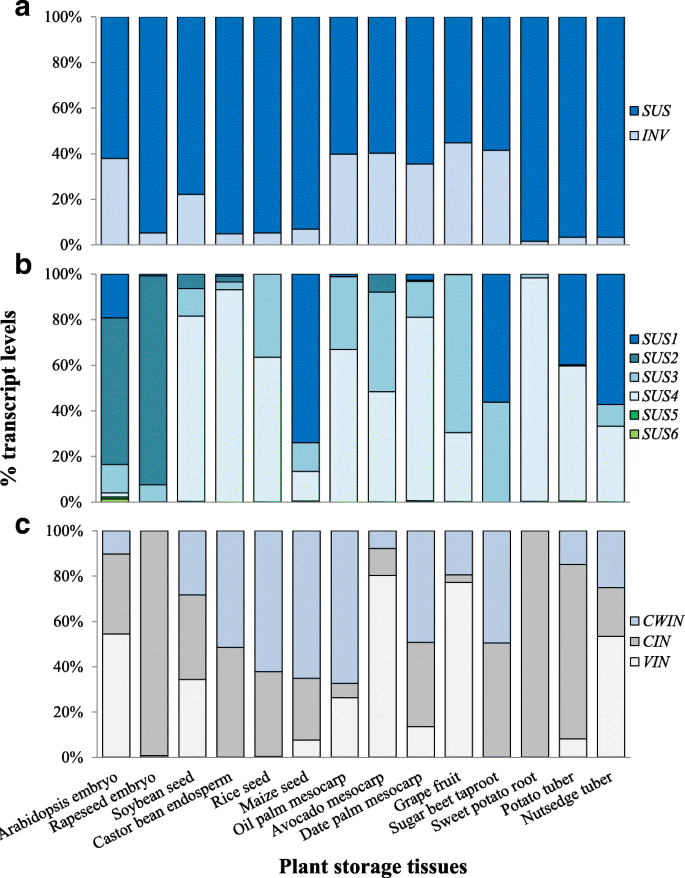
在c . esculentus塔伯,抄本SUS基因在胞质溶胶中高表达,具有超过2500 FPKM /蛋白质的平均(附加文件的转录物值1:表S3)。丰富的表达水平SUS,比高于10倍挪威,也发生在所有的块茎发育(图5).更高的表达SUS过度挪威与其他植物贮藏器官相似(图。6),表示守恒函数SUS不同植物贮藏组织间的Suc代谢此外,我们的数据显示,转录本的变化趋势SUS块茎发育中的基因与成功内容的变化负相关,进一步支持重要作用SUS在往下退化。这些数据表明,SUS可能是初始Suc代谢的首选酶,细胞内Suc的降解可能主要依赖于具有高水平转录本的SUS的活性c . esculentus.我们的研究结果可以加强和支持油菜籽、小麦、利马豆和马铃薯块茎的酶学分析,表明在贮藏器官发育过程中,SUS的酶活性比INV占优势,是产生己糖的主要酶[45,46,47,48].研究表明,SUS作为参与Suc代谢的关键酶,在生理上发挥着重要作用,主要负责将光合吸收的碳导入库器官,其蔗糖溶解是碳从Suc进入库的主要途径[49].
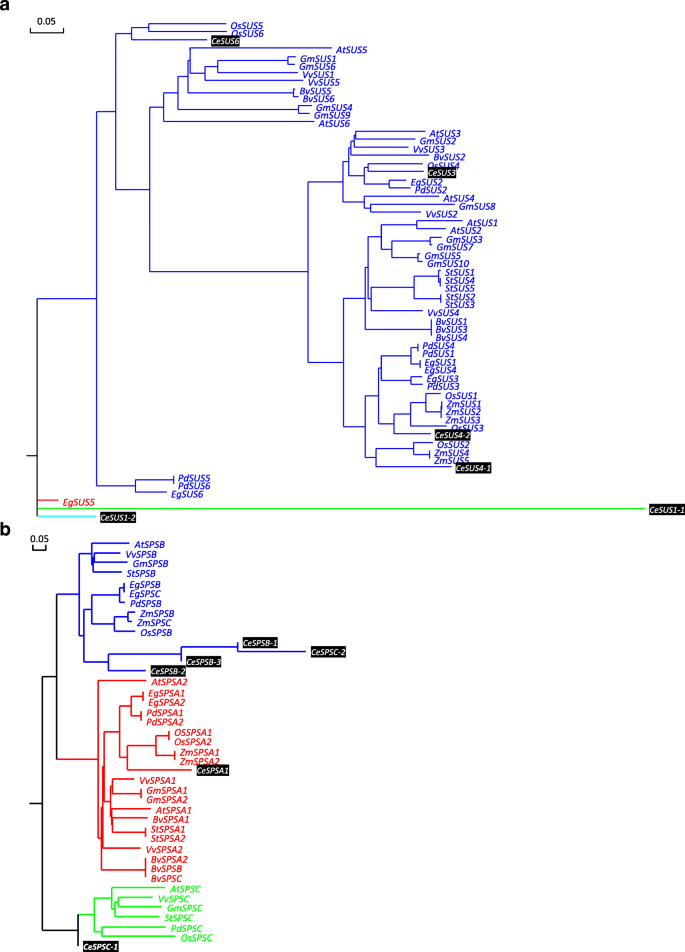
结果表明:SUS是由一个多基因小家族编码的,在大多数植物物种中包含至少两种同型,同型的数量在不同的植物物种中是不同的。例如,拟南芥和水稻有六种不同的基因SUS基因(50,51],而有三个SUS玉米和豌豆的基因[52,53].在c . esculentus块茎,四个同种型SUS经鉴定,包括一份SUS3(AT4G02280)和SUS6(AT1G73370),两份SUS1(AT5G20830)和SUS4(AT3G43190)(附加文件1:表S3)。在这些异构体中,转录最多的是SUS1Ortholog,后面是SUS4和SUS3,而SUS6只是隐隐约约地表达出来(图。5).在块茎发展期间,这三SUS1,SUS3和SUS4垂直喉部均下调并显示出协调表达模式(图。5),暗示它们的重要贡献SUS与Suc合酶的亚型。相对较高的转录水平SUS1in.c . esculentus块茎在其他植物贮藏组织中并不常见。例如,大量表达SUS1仅鉴定在拟南芥和玉米,甘蔗胶带和土豆块茎的种子中(图。6 b).系统发育分析的结果也表明SUS1in.c . esculentus块茎是特异性的(图。7一个).
对外科的存在和相对高度的转录物SUS3和SUS4在植物的种子、果实、根和块茎中也存在相同的SUS酶,表明这两种酶亚型在植物的Suc降解过程中具有进化上的保守作用。与大多数种子和水果组织相比,SUS2ortholog被发现或勉强可检测到c . esculentus块茎,类似于根的甜菜、甘薯和马铃薯块茎,建议直接同源SUS2不是先决条件往下合酶在根和茎的组织,也许SUS2直接同源的种子和水果组织可能在往下分解发挥更多的作用。的缺席和/或非常弱的表达SUS5和SUS6说明不同植物不同库器官中对Suc合酶的贡献较小。
总的来说,这些结果强烈地表明SUS基因在c . esculentus块茎显示特定的时间和空间表达式模式。可以在块茎中具有不同的同种型同种型。以前的证据表明拟南芥成员SUS基因表现出部分地重叠,而且不同的表达特征。AtSUS2被高度和特别是在发育中的种子中表达仅;相比之下,AtSUS1,AtSUS5和AtSUS6一般表达在根、茎、花、角果和种子中。AtSUS3主要表达在根,花和种子[49].
转化酶基因的表达模式是物种特异性的c . esculentus块茎
INV通常根据亚细胞定位分为三个亚家族,即细胞壁INV (CWIN)、液泡INV (VIN)和胞浆INV (CIN),胞浆INV也可能在质体、线粒体和细胞核中表达[17.,43,54].
三种类型的INV基因也被检测到c . esculentus块茎,但与之相比,他们的转录表达相对低SUS,即使在块茎发育早期也不超过120 FPKM,在块茎成熟时则下降到小于15 FPKM(图2)。5).在这些挪威同源性分析,超过50%的转录本是由vin.异构体,而CWIN和CIN分别为25和22%(图。6摄氏度).非常低的表达式CWIN在油管中可能反映碘醇的己糖的可用性主要是通过CIN或SUS或催化反应。通过己糖转运蛋白的表达模式进一步支持这一点(高温超导),高温超导表达少于15 FPKM的转录物,平均比SuC运输扣为7倍(sut)(额外的文件1:表S3)。往下运输c . esculentus块茎被认为与马铃薯相似[4].当结节形成时,Suc通过胞间连丝从韧皮部共卸载[55].
该副本的表情和他们的三个亚细胞的贡献发票与其他植物贮藏器官的对应物有很大的不同,这些对应物在不同的物种和组织中存在差异2:图S1)。本研究中所检测的所有植物贮藏组织都不具有与其他植物相同的同工酶或转录模式,这一事实证实了这一点。例如,在地下贮藏组织中,甘薯和马铃薯的表达量最高CIN直接同源而不是vin.相比之下,nutsedge的文字记录vin.是最富有的。的CIN2异构体在马铃薯中转录最多,但在甘薯和坚果草中缺失。七个亚型CWIN直接同源(CWIN1-6)均检出c . esculentus,而只有CWIN1和CWIN3在马铃薯中用低转录物表达垂直表现出[56),没有CWINs在甘薯中发现[57].
基因的多样性和表达模式的高度分化挪威多样植物中亚科可能反映的水解的Suc通过INVS催化底层机制的演化。据证实,挪威在进化过程中分离植物物种之前发生基因复制和发散[58].这种分歧支持各种各样的假设挪威基因有特殊的功能[54].它们的表达以组织、细胞器和发育特异性表达模式为特征[59,60].具有多种INVs同工酶的生理优势可能是在不同条件下控制Suc的代谢、转运或储存方面具有更大的灵活性[59].
差异调节的表达挪威在油球的发育过程中也观察到类似的现象c . esculentus.如图所示。5,这三个挪威Subfamilies显示了独特的表达模式,尽管它们在块茎开发中都被下调。vin.orthologs具有比最丰富的成绩单,比3倍高于3倍CWIN或者CIN在块茎发展的早期阶段,但他们几乎不在块茎成熟时表达。在块茎中阶段发展,这些发票几乎同样转录。所有这些事实反映了三个挪威同种型在发育中调节并以重叠但不同的表达模式表示。它可能表明,在发展中通过成功划分c . esculentus块茎可以是SUS将调节SUC利用率,而INV控制SUC储存和糖组成的同工酶,如先前的研究所指出的[20.,58,61,62].植物液泡是糖的主要贮藏部位,在糖的暂时或长期贮藏中起着中心作用[63].在番茄、葡萄浆果和马铃薯块茎中发现VIN活性与己糖积累呈正相关[64,65,66].
胞质己糖磷酸化c . esculentus块茎表现出独特的保守的表达模式
己糖磷酸化涉及经由通过各种酶催化三种不同的途径F6P的合成向合成的Suc(图2).一种是通过FK作用将Fru直接转化为F6P。另一种是HXK催化Glc生成G6P,然后通过GPI的可逆催化作用将G6P转化为F6P。第三种是通过UDP-Glc生成G1P,然后转化为G6P,分别由UGP和PGM催化[17.,43].
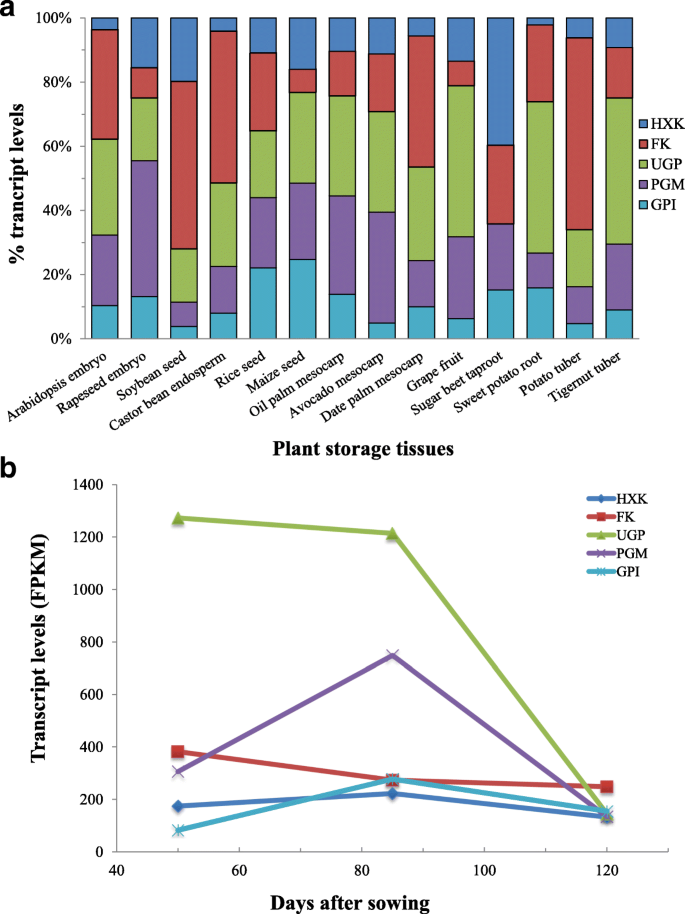
c . esculentus块茎含有所有必需的己糖磷酸化的五个酶,作为其他的植物贮藏组织(图8),除了糖用甜菜主根其中ugp.在基因表达水平未检测到[67].然而,在不同的组织和不同的物种中,这5个基因家族成员的同源性转录水平的分布是不同的。在c . esculentus块茎,表达水平ugp.是最高的,其次是PGM.然后颗,而虽然HXK和谷歌价格指数是最少的。这种表达模式与其他植物有很大的不同,说明不同植物的己糖磷酸化过程可能受不同的酶主导。
在大多数植物物种中,六糖磷酸途径中的每种酶中的每一个被编码多于一个基因。如附加文件所示3.:图S2,对于相同的基因家族的同种型转录物在不同的植物组织很大的差别进行了贡献,示出不同的植物物种中的基因同种型的表达模式的不同点。大多数植物含有两种亚型ugp.或者PGM.,而在c . esculentus块茎只有一种亚型UGP2或者PGM2直接同源被确认。相比之下,大多数植物组织只有一个副本UGP2,四个副本UGP2在c . esculentus块茎(附加文件1:表S3),可与大豆种子媲美[68)、大米(69],和玉米[70]有三个或四个UGP2亚型。
通过对不同植物组织中各基因家族的同源转录本的比较,揭示了它们的不同之处,同时也揭示了一些保守的特征。在大多数植物组织中,转录水平的丰度越高颗比之HXK结果表明,己糖磷酸化可能主要依赖于Fru底物。此外,越丰富的成绩单ugp.和PGM.直接同源比HXK,以及更高的表达水平SUS而不是挪威提示UGP介导的G6P合成具有很高的活性,UGP可能是G6P生成的主要决定因素,并在己糖磷酸途径中发挥重要作用。
据观察,油块茎发育过程中,这五个基因酶显示不同的表达模式(图8 b),表明它们的表达是受发育调节的。此外,这些酶的表达模式与Suc含量的变化不一致,说明这些酶可能不是影响Suc积累的主要因素c . esculentus块茎。
石油管道中Suc生物合成途径的基因表达c . esculentus可能是非典型的
以UDP-Glc和F6P联合为起始的Suc生物合成途径中生成的Suc一般涉及两种酶:SPS和SPP(图2)。2).SPS催化UDP-Glc和F6P生成S6P,而SPP催化S6P不可逆水解生成Suc。SPP催化反应基本上是不可逆的,将可逆SPS反应的平衡向净合成Suc的方向改变[17.].
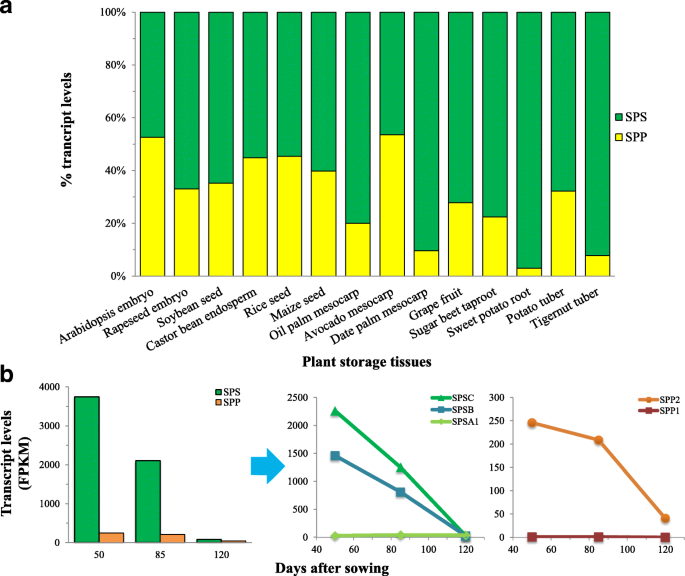
在莎草块茎,的的Suc生物合成基因的直向同源物是由平均1070 FPKM /蛋白质(图的表示。2 b).Suc生物合成蛋白90%以上的转录本被鉴定为SPS直接同源(无花果。9).类似较高的表达水平SPS,相对于仕达屋优先计划,也在其它油或富含碳水化合物的植物组织中观察到除了拟南芥种子并且其中SPS进行比SPP略少表达鳄梨果肉。然而,的高度表达模式SPSin.c . esculentus块茎提出了鲜明的对比的那些其他大多数植物组织的,其中SPS直系同源物用倍5更高相比较少表达仕达屋优先计划的转录水平SPSin.c . esculentus块茎比块茎多十倍仕达屋优先计划,类似于椰枣中果皮或马铃薯块茎的情况。
更高的表达SPS而不是仕达屋优先计划orthologinc . esculentus块茎也发生在块茎发育过程中(图。9 b).这两个SPS和仕达屋优先计划直系同源基因在下调的方式表达。在早期阶段,成绩单SPS要丰富得多,至少是仕达屋优先计划.即使在块茎成熟时,尽管表达水平SPS和仕达屋优先计划分别超过六倍,表达水平下降SPS仍然是…的两倍仕达屋优先计划.
总的来说,上述结果可能反映了占主导地位的作用SPS正弦波在Suc合成中的作用c . esculentus,支持SPS是Suc合成途径中的关键调控酶,并对控制进入Suc的碳通量做出重要贡献[71,72],而SPP似乎对用于Suc生物合成的碳通量几乎没有控制[73].
有证据表明,高等植物中含有几种SPS由小的同种型编码SPS基因家族。在拟南芥中,SPS基因家族由四个成员同种型组成,表示为SPSA1(AT5G20280),SPSA2(AT5G11110),SPSB(AT1G04920)和SPSC(AT4G10120) [74,75,76].在胡桃苔块茎中SPSA2同源基因没有被识别(附加文件4:图S3)。同源性的转录本SPSC是最丰富的,其次是SPSB.SPSA1最不表达,只有2%的总成绩单SPS亚型。的相对较低的表达SPSA亚型在c . esculentus块茎可能反映其对负责SuC合成的SPS酶的贡献较小。这些结果与其他植物储存组织中的观察结果形成鲜明对比,其中SPSA表达最丰富的时候是SPSB和SPSC转录不良或无法检测(附加文件4:图S3)。的差异SUS基因之间的亚科c . esculentus和系统发育分析也提出了其他植物(图。7 b).据报道,拟南芥SPSA1和SPSA2在所有器官中表达[75,77,78),而SPSB主要表达于生殖器官,而SPSC基因在叶片中优先表达,说明SPSA- 和C-家庭成员是主要因素SPS在叶子中表达的亚型,这似乎与拟南芥的种子是一样的(附加文件4:图S3)。注意到SPSA1在所有植物贮藏组织中均有表达,但表达程度不同。以往的系统发育分析显示,SPS的调节磷酸化位点在不同物种的SPSA家族成员中都很保守[77],这表明SPSA亚型,在特别SPSA1,是进化保守,可能在植物中发挥看家的作用。
这三个人的时间表达模式SPS基因在c . esculentus块茎还透露,SPSB- 和C-家庭成员是主要因素SPS表达同种型(图。9 b),它们都被转录,并且在块茎发育过程中具有酶活性。然而,基因表达SPSA1小幅上调的,而成绩单为SPSB和SPSC异构体表现出下调的规律,与Suc含量的动态变化一致。这可能反映出SPSA1似乎在功能上不同,至少部分不同于SPSB- 和C家庭成员c . esculentus而对合成Suc无关键作用。
SPP在Suc合成中的作用以及SPP是否具有速率限制尚不清楚。之前的研究表明,SPP似乎对控制Suc生物合成的作用较小[73].在拟南芥中,四个副本仕达屋优先计划的基因,SPP1(At1g51420),SPP2(At2g35840),SPP3A(At3g54270)和SPP3B(At3g52340)(附加文件4:图S3),具有类似的外显子-内含子结构[74,79].在c . esculentus块茎,仕达屋优先计划家庭组成了四个基因,一个副本SPP1和三份SPP2直接同源,没有SPP3成员(额外的文件1:表S3)。他们表现出不同的表达水平SPP2Isoform比SPP1.SPP1在块茎发育过程中表达非常弱(图。9 b).的主要表达模式SPP2其他植物储存组织也发生了同种型(附加文件4:图S3),暗示进化节约和不同植物中的家务角色SPP2直接同源。这些结果加强并扩展到最近的一项研究,揭示了拟南芥SPP2在植物的地上部分表达最多,活性最高,而SPP1Isoform为非活性酶基因,主要在根中表达[80].
讨论
在对比共同块茎和根茎作物如马铃薯,胡萝卜,其排他地积聚碳水化合物作为主要的存储组件S,c . esculentus是目前已知的唯一一种生产含有大量油脂和淀粉的块茎的植物。此外,c . esculentus还积累了大量的块茎中的糖。因此,c . esculentus被认为是一种新的模式植物,适合研究碳分配向地下库组织(如块茎和根)中各种储量的生物合成[4].在本研究中,我们首次对与Suc代谢相关的基因表达进行了全面的转录组分析,Suc代谢是各种碳代谢的中心反应,从Suc降解到Suc的再合成c . esculentus并与植物种子、果实、根、块茎等富含油脂或碳水化合物的贮藏组织进行比较,以揭示块茎植物中Suc代谢的潜在机制。
研究结果表明,在常规的Suc代谢途径中,包括Suc分解、己糖磷酸化和Suc再生物合成的连续反应也存在基因亚型c . esculentus这表明植物库组织在植物进化过程中仍然是控制Suc代谢的一组共同的基因亚型。作为其他植物富含油脂或碳水化合物的库组织,Suc代谢相关基因的表达c . esculentus块茎似乎是在发育管制的监管。己糖磷酸化对Suc降解的较高程度的转录物c . esculentus块茎也与油或碳水化合物富含储存组织的储存组织类似。同样,在两者中c . esculentus块茎和其他植物贮藏组织的转录水平要高得多SUS而不是挪威亚型和SPS对仕达屋优先计划基因。此外,磷酸己糖通路相关基因的多种时间表达模式也出现在不同的植物贮藏组织中,表明这些不同的酶在植物发育过程中具有相对重要的作用。
然而,有几种不同的基因表达模式可能是组织或物种特异性c . esculentus块茎。相较于其他植物贮藏器官,c . esculentus曾在其块茎两者的Suc降解和合成是块茎发育过程中显示在的Suc水平的变化协议协调的时间表达模式高丰度的基因表达。因此,油块茎c . esculentus本研究可用于探讨同时降解和合成Suc循环调节Suc池净通量的机制,以及在块茎发育过程中维持较高的Suc净降解率是否为先决条件。在此分别中,只给出了为SUS1、SUS3和SUS4在SUS同种型在块茎中以类似的图案表达,这种含油组织适合于确定这三个同时表达的重要性SUS并探讨了它们在催化Suc分解中的重叠作用的可能性。与其他植物储存器官形成鲜明对比的是SPSB和SPSC在模式植物中尚不清楚其在Suc生物合成中的作用,但在植物中大量转录并具有协调的表达模式c . esculentus块茎。因此,富含石油的块茎c . esculentus可以作为一个理想的系统来描述这两者的具体功能和规范吗SPSSuc生物合成中的异构体。液泡表达差或缺乏发票在常见的地下作物,如甜菜和甘薯的根,以及马铃薯块茎,它仍然难以捉摸如何个别vin.异构体调节液泡糖稳态,细胞质己糖水平和细胞扩张的地下储存组织;然而,身份的认定VIN2中转录本相对丰富的同源物的VIN为研究豆科植物的功能和调控提供了有益的手段VIN2vin介导的植物发育机制。
结论
总之,我们对石油块茎的综合转录组分析c . esculentus与其他富含碳水化合物或油脂的贮藏组织进行比较,发现Suc的代谢基因既有相似的表达模式,也有不同的种特异性表达模式,说明在贮藏组织中,Suc代谢基因的表达模式存在差异c . esculentus, (i)在块茎发育过程中也发生Suc代谢c . esculentus相关基因的转录表达受发育高度调控;(ii)大多数Suc代谢基因也具有多种亚型,在不同条件下可能实现不同的控制Suc代谢的功能;(3)与其他植物贮藏组织不同,Suc降解和再合成基因均以协同下调的方式高表达;(4)的直系关系SUS1,INV2,UGP2,SPSB,和SPSC具有相对丰富的转录水平c . esculentus块茎可能是未来代谢工程方法的潜在基因靶标。我们的研究在一起,探讨了在显影油块组织中对Suc代谢的转录控制。这些知识对操纵Suc代谢的潜在目标有影响c . esculentus通过代谢工程或分子育种来促进这种未充分利用的作物的大规模栽培和利用,提高其生物量和质量c . esculentus块茎。
方法
植物材料
Cypetus esculentus.L.变种。巨大成功在22±0.5℃、相对湿度40 ~ 60%、光照16 h (130 μmol⋅米2⋅年代- 1)/ 8小时黑暗周期。新鲜收获块茎,在不同发育阶段,并立即储存于液氮中直至进一步使用。
糖的决心
至少10个块茎在液体氮中汇集和研磨2制成细粉,然后用80% (v/ v)乙醇5分钟。在此之后,将匀浆以6000×g离心10分钟,用于糖分析的液体上清液。用Morris [蒽酮的比色方法测定块茎可溶性糖(的Suc,GLC和FRU)的量化81]与米勒[的3,5二硝基水杨酸方法组合82].
总RNA提取
使用改良的十六烷基三甲基溴化铵(CTAB)为基础的方法从正在发育的块茎中分离出总RNA,具体方法见[40].将纯RNA样品溶解在不含RNA的水中,储存在液氮中。
RNA深序
使用NanoDrop 2000分光光度计和Agilent 2100生物分析仪对总rna的质量和产量进行了验证。采用Illumina Hiseq4000测序平台(上海大生物医药科技有限公司,中国)进行RNA测序。RNA-seq数据可在国家生物技术信息中心(NCBI)短读归档项目- PRJNA320781, PRJNA320787和PRJNA312713上获得。通过对NCBI蛋白数据库进行BLAST同源性搜索,注释了De novo装配序列(> 200 bp)。ftp://ftp.ncbi.nlm.nih.gov/blast/db/), Swiss-Prot (http://www.ebi.ac.uk/uniprot/)、齿轮(http://www.ncbi.nlm.nih.gov/COG/),STRING(http://string-db.org/),去(http://www.geneontology.org/)和kegg(http://www.genome.jp/kegg/).使用每百万次映射读数(FPKM)的外显子模型的每千碱基碎片量化基因表达水平[83].
实时定量PCR (qRT-PCR)分析
采用SYBR Green Realtime PCR Master Mix (Toyobo Co. Ltd)进行qRT-PCR分析,使用Eppendorf Mastercycler ep realplex (Eppendorf Company, Germany)的系统,作为我们之前工作的方法[40].相对mRNA用ΔΔC定量T方法[84].18S rRNA作为内参。用于qRT-PCR分析的引物对列于附加文件1:表S4。
缩写
- CIN:
-
胞质转化酶
- CWIN:
-
细胞壁转化
- F6P:
-
果糖-6-磷酸
- 颗:
-
果糖激酶
- Fru:
-
果糖
- G1P:
-
glucose-1-phosphate
- G6P:
-
glucose-6-phosphate
- 相关:
-
葡萄糖
- 己糖-P:
-
hexose-phosphate
- HT:
-
己糖转运蛋白
- HXK:
-
己糖激酶
- 帕金森病:
-
胞间连丝
- PGI:
-
phosphoglucoisomerase
- 的PGM:
-
磷素酶
- S6P:
-
succose-6-phosphate
- SPP:
-
Suc-phosphatase
- SPS:
-
Suc-phosphate合酶
- 成功:
-
成功
- SUS:
-
SUC合酶
- SUT:
-
往下运输
- 甜:
-
糖最终将成为出口转运体(己糖和Suc转运体)
- T6P:
-
海藻糖-6-磷酸
- TPS:
-
trehalose-6-phosphate合酶
- 结核菌素:
-
液泡膜的Suc转运
- UDP-Glc:
-
尿苷二磷酸葡萄糖
- UGP:
-
UDP-Glc焦磷酸化酶
- vin:
-
在液泡转化酶
参考资料
- 1。
De Castro O, Gargiulo R, De Guacchio E, Caputo P, De Luca P.关于起源的分子研究Cypetus esculentus.(莎草科,禾本目):同一枚硬币的两面(杂草与作物)。Ann Bot。2015; 115(5):733-45。
- 2。
Makareviciene V,Gumbyte M,Yuni A,Kalenska Ks,Kalenski V,Rachmetov D,Sendzikiene E.在生物柴油生产中使用Chufa Sege的机会。ind crop prod。2013; 50:633-7。
- 3。
阿拉法特,Gaafar A, Basuny A, Nassef L. Chufa块茎(Cypetus esculentus.L.):作为食物的新来源。世界申请科学J. 2009; 7:151-6。
- 4.
土耳其龙,马蒂达斯,古斯塔夫斯森凯,霍夫兰德·克,奥尔森·我,BülowL,Stymne S,Carlsson As。块茎油和淀粉堆积的特征Cypetus esculentus.var。巨大成功莎草科:一个研究非种子组织中油脂储量的新模型系统。美国生物医学工程学报2010;97:1884-93。
- 5.
桑切斯-萨帕塔E,费尔南德斯-洛佩兹J,佩雷斯-阿尔瓦雷斯JA。老虎螺母(Cypetus esculentus.)商业化:健康方面,组成,性质和食品应用。Crom Conce Sci Food安全。2012; 11:366-77。
- 6.
Codina-Torrella I, Guamis B, Trujillo AJ。虎皮坚果的特性及比较(Cypetus esculentus.不同地理来源:理化特性和蛋白质分馏。作物学报2015;65:406-14。
- 7.
Belewu MA, Belewu KY。虎子、大豆和椰奶来源的理化比较评价。中国农业科学(英文版);
- 8.
Dubois V,Breton S,Linder M,Fanni J,Paruringier M. 80植物油的脂肪酸谱有关于它们的营养潜力。EUR J Lipid SCI Technol。2007; 109:710-32。
- 9.
Ezeh O, Gordon MH, Niranjan K.虎果仁油(Cypetus esculentus.):综述了其组成和理化性质。中国油脂科学。2014;116:783-94。
- 10。
段俊,马军。虎果栽培。北京:科普出版社;1983.
- 11.
Bamishaiye EI, Bamishaiye OM。虎子:作为一种植物,其衍生物及其益处。粮食农业营养发展杂志2011;11:5157-70。
- 12.
Defelice MS.黄色的坚果Cypetus esculentus.l -神的小吃。杂草抛光工艺。2002;16:901-7。
- 13。
张海英,马汉娜,阿里,李南Cypetus esculentus.l)块茎油作为燃料。作物学报1996;5:177-81。
- 14.
Barminas JT, Maina HM, Tahir S, Kubmarawa D, Tsware K.虎果生物燃料特性的初步研究Cypetus esculentus.)油。Bioresour抛光工艺。2001;79:87 - 89。
- 15.
Ofofule Au,Ibeto CN,Okoro UC,Onukwuli OD。生物柴油从Tigernut(Cypetus esculentus.)油及其与石油-柴油混合的特性。物理Rev Res Inter. 2013; 3:145-53。
- 16.
卢恩我。蔗糖代谢。船。2008;https://doi.org/10.1002/9780470015902.a0021259.
- 17.
阮y-l。蔗糖新陈代谢:碳酸多样化和糖信号的网关。Annu Rev植物Biol。2014; 65:33-67。
- 18.
hebers K, Meuwly P, Frommer WB, Metraux JP, Sonnewald U.由转化酶异位表达介导的系统性获得性抗性:可能在分泌途径中感知己糖。植物细胞。1996;8:793 - 803。
- 19.
Bonfig KB, Gablera A, Simon UK, Luschin-Ebengreuth N, Hatzc M, Berger S, Muhammad N, Zeier J, Sinha AK, Roitsch T.翻译后通过下调转化酶抑制剂的表达来降低源叶中的转化酶活性是植物防御反应的一部分。摩尔。2010;3:1037-48。
- 20.
阮艳玲,金勇,杨永杰,李国杰,Boyer JS。蔗糖输入、代谢和转化酶介导的信号:在发育、产量潜力和对干旱和热的反应中的作用。摩尔。2010;3:942-55。
- 21.
范海克,范海克,范德恩,范德恩拟南芥蒂利亚纳.实验植物学。2011; 62:3849-62。
- 22.
Linssen JPH, Cozijnsen JL, Pilnik W. Chufa (Cypetus esculentus.):一种新的膳食纤维来源。中国农业科学。1989;49:291-6。
- 23.
陈志强,陈志强,陈志强,等。植物种子发育的综合研究进展拟南芥蒂利亚纳生态型WS。植物生理生化。2002;40:151-60。
- 24.
Focks N, Benning C。wrinkled1:一种新颖的,低种子油突变体的拟南芥,碳水化合物代谢的种子特异性调节缺乏。植物理性。1998年; 118:91-101。
- 25.
希尔LM,莫利·史密斯ER,发展油菜种子的胚乳糖罗斯索恩S.代谢。植物理性。2003; 131:228-36。
- 26.
汤姆林森KL,麦克休S,拉韦H,固安捷JL,詹姆斯LE,波默罗伊KM,穆林JW,米勒SS,丹尼斯DT,三木BL。证据表明,己糖对蔗糖比不控制所述开关以在油籽存储产品积累:烟草种子发育和过表达质外体转化酶的作用的分析。实验植物学。2004; 55:2291-303。
- 27.
陈鹏,侯安。大豆种子发育过程中化学成分的变化。食品化学。2011;124:1369 - 75。
- 28.
番茄酸性转化酶基因表达调控糖组成的研究(Lycopersicon)水果。植物杂志。1993;103:863 - 70。
- 29.
甜瓜发育过程中蔗糖磷酸合酶和酸性转化酶对蔗糖浓度的影响Cucumis梅洛l .)水果。植物杂志。1989;91:1527-34。
- 30.
李敏,冯峰,程磊。苹果果实发育过程中糖代谢和积累相关基因的表达模式。《公共科学图书馆•综合》。2012;7:e33055。
- 31。
张XM,王W,杜LQ,谢杰,姚友,孙通用汽车。在开发和成熟过程中,蔗糖磷酸磷酸盐合酶,蔗糖合酶和中性转化酶的表达模式,活性和碳水化合物代谢调节。int j mol sci。2012; 13:9460-77。
- 32。
Desnoues E,Gibon Y,Baldazzi V,Signoret V,GénardM,Quilot-Turion B.果实开发过程中的果糖代谢在桃子后代,具有不同的果糖 - 葡萄糖比。BMC植物BIOL。2014; 14:336。
- 33。
Hu L,Wug,Hao C,Yu H,Tan L.转录组和选定的代谢物分析揭示了菠萝蜜中的糖代谢点(面包果heterophylluslam)。植物科学。2016;248:45-56。
- 34。
Ross Ha,Davies Hv,Burch Lr,Viola R,McRae D.碳水化合物含量和蔗糖降解薯土豆核糖含量的发育变化(茄属植物tuberosum).植物生理学。1994; 90:748-56。
- 35。
Miron D, Schaffer AA。蔗糖磷酸合酶、蔗糖合酶和酸性转化酶在番茄果实发育中的活性Lycopersicon escufenfum磨坊。和蔗糖积累Lycopersicon HirsutumHumb。和Bonpl。植物理性。1991; 95:624-7。
- 36。
不同番茄品种果实发育过程中糖含量及蔗糖合酶、蔗糖磷酸合酶和酸性转化酶活性的研究。Sci Hortic。1996;65:125-36。
- 37。
西瓜果实蔗糖积累的遗传变异及生化分析。植物生理学杂志。2010;17:589 - 96。
- 38。
李志强,王志强,王志强,等。蔗糖磷酸合酶在番茄果实蔗糖积累途径中的作用[j]。植物杂志。1992;99:434-8。
- 39.
蔗糖磷酸合酶表达的降低强烈抑制了水分胁迫诱导的马铃薯块茎中蔗糖的合成。植物j . 1999; 19:119-29。
- 40.
杨志,纪华,刘东。地下富油贮藏营养组织油脂生物合成的比较Cypetus esculentus.有油籽和果实的块茎。植物生理学杂志。2016;57:2519-40。
- 41.
Riesmeier JW,Willmitzer L,Frommer WB。蔗糖转运蛋白在韧皮植物加载和同化分配中的基本作用的证据。Embo J. 1994; 13:1-7。
- 42.
帕特里克JW。费雪的高压流形模型能解释韧皮部运输和资源分配吗?植物学报2013;4:184。
- 43.
卢恩我。蔗糖代谢。船。2016;https://doi.org/10.1002/9780470015902.a0021259.pub2.
- 44.
陈志强,陈志强,陈志强,等。蔗糖代谢在植物发育和糖敏感中的作用。《植物学报》2004;7:235-46。
- 45.
徐德培,宋世杰,黑CC.青豆种子的蔗糖代谢。植物杂志。1989;89(4):1106 - 16。
- 46.
小麦胚乳发育过程中蔗糖代谢的研究(Triticum aestivum.).杂志。1995;93(1):123 - 31所示。
- 47.
Appeldoorn NJG,De Bruijn Sm,Koot-Gronsveld Eam,Visser RGF,Vreugenhil D,Van der Plas LHW。蔗糖转化对马铃薯早期结核期蔗糖转化为己糖的酶的发育变化。Planta。1997年; 202:220-6。
- 48.
莫利史密斯ER,派克MJ,芬德利K,Kockenberger W,山LM,史密斯AM,罗斯索恩S.糖与发育中胚胎的传输是不经由油菜种子批量胚乳。植物理性。2008; 147:2121-30。
- 49.
Bieniawska Z,保罗巴勒特DH,蒜。AP,强忍阵痛V,克鲁格NJ,马丁C,Zrenner R,史密斯AM。分析蔗糖合成酶基因家族在拟南芥中。植物杂志2007; 49:810-28。
- 50。
陈志强,陈志强,陈志强,等。拟南芥蔗糖合酶多基因家族的结构和表达谱。acta physica sinica(物理学报),2004;32(6):593 - 598。
- 51。
水稻全蔗糖合酶基因家族的表达分析。植物科学。2008;174:534-43。
- 52。
王天良,王志强,王志强,等。大豆蔗糖合酶基因的克隆与表达分析。植物杂志。2001;127:655 - 64。
- 53。
这三种玉米蔗糖合酶亚型在分布、定位和磷酸化方面存在差异。植物生理学报2006;47:959-71。
- 54。
Sturm活性。植物发育和蔗糖分配中的初级结构、功能和作用。植物杂志。1999;121(1):1 - 8。
- 55。
Viola R, Roberts AG, Haupt S, Gazzani S, Hancock RD, Marmiroli N, Machray GC, Oparka KJ。马铃薯块茎的形成涉及从质外体向共质体韧皮部卸载的转换。植物细胞。2001;13(2):385 - 98。
- 56。
主席Hofvander P, Ischebeck T,杜尔松H, Kushwaha SK, Feussner我Carlsson,安德森m .马铃薯块茎的表达拟南芥WRINKLED1增加三酰甘油和膜脂质而影响碳水化合物代谢中心。植物生物技术学报2016;14:1883-98。
- 57。
陶X,谷YH,王海燕,郑W,李X,CW赵,张英姿。基于集成从头转录的组件甘薯数字基因表达分析[番薯甘薯(L.)林。Plos一个。2012; 7:e36234。
- 58。
弗里德曼E,扎米尔D.一个同线转化酶基因家族在番茄,马铃薯,和拟南芥的功能分化。植物理性。2003; 131(2):603-9。
- 59。
植物转化酶:生理学、生物化学与分子生物学。Adv Bot Res. 1998; 28:71-117。
- 60.
Sturm A,Tang GQ。植物的蔗糖切割酶对于发育,生长和碳分区至关重要。趋势植物SCI。1999; 4(10):401-7。
- 61.
胡萝卜中蔗糖切割酶的分子特征和功能分析(胡萝卜胡萝卜l .)。中国生物医学工程学报1996;47:1187-92。
- 62.
对胡萝卜(Daucus carota L.)中蔗糖合酶的反义抑制对生长的影响并不显著。植物学报。1999;41(4):465-79。
- 63.
沃米特A,Trentmann O,Feifer I,洛尔C,TjadenĴ,迈尔S,施密特U,Martinoia E,纽豪斯HE。分子鉴定和来自拟南芥属的新型单糖转运的生理表征参与液泡糖转运。植物细胞。2006; 18(12):3476-90。
- 64.
反义酸性转化酶(TIV1)基因改变了转基因番茄果实中可溶性糖的组成和大小。植物杂志。1996;112(3):1321 - 30。
- 65.
葡萄果实中糖的积累。两种推测的液泡型转化酶cdna的克隆及其在葡萄藤组织中的表达。植物杂志1996;111(1): 275 - 283。
- 66.
烟草转化酶抑制剂同源物的异位表达可防止冷诱导的马铃薯块茎甜化。生物科技Nat》。1999;17(7):708 - 11所示。
- 67.
关键词:甜菜,生长发育,转录谱,代谢途径J Exp Bot. 2007; 58:699-715。
- 68.
Jones SI, Vodkin LO。利用RNA-Seq分析大豆种子从受精到成熟的发育过程。《公共科学图书馆•综合》。2013;8:e59270。
- 69.
佐藤Y,武久H,Kamatsuki K,南H,并木N,伊川H,Ohyanagi H,杉本K,安东尼BA,永村Y. RiceXPro 3.0版:扩大水稻转录组信息学资源。核酸RES。2013; 41(数据库号):D1206-13。
- 70.
陈建军,曾波,张敏,谢胜,王刚,Hauck A,赖建军。玉米胚和胚乳发育的转录组动态景观。植物杂志。2014;166:252 - 64。
- 71.
Huber SC, Huber JL。蔗糖-磷酸合酶在高等植物中的作用及调控。植物生理学报1996;47:431-44。
- 72.
冬季H,贝尔SC。在高等植物蔗糖代谢的调节:本地化和关键酶的活性的调节。CRC暴击启植物科学。2000; 19:31-67。
- 73。
陈淑娟,陈晓东,陈晓东,等。转基因烟草中蔗糖-6-磷酸磷酸酶水平的降低对烟草光合作用的影响。足底。2005;221:479 - 92。
- 74。
蔗糖合成中的新复杂结构。植物生态学报。2003;6:208-14。
- 75。
Castleden CK, Aoki N, Gillespie VJ, MacRae EA, Quick WP, Buchner P, Foyer CH, Furbank RT, Lunn JE。小麦和其他牧草中蔗糖-磷酸合酶基因家族的进化和功能。植物杂志。2004;135:1753 - 64。
- 76。
Lutfiyya LL,徐N,D'ORDINE RL,莫雷尔JA,米勒PW,达夫SM。蔗糖磷酸酯合成酶的系统发育和表达分析同工酶植物。J植物理性。2007; 164(7):923-33。
- 77。
Langenkamper G, Fung RWM, Newcomb RD, Atkinson RG, Gardner RC, MacRae EA.植物中的蔗糖磷酸合酶基因分别属于三个不同的家族。中国科学(d辑:地球科学)2002;
- 78。
在拟南芥中,蔗糖-磷酸合酶的两个主要叶片亚型的缺失限制了蔗糖的合成和夜间淀粉的降解,但不改变光合作用中碳的分配。[J] .机器人。2014;65(18):5217-29 .]
- 79。
卢恩我。植物蔗糖-磷酸酶基因家族。基因。2003;303:187 - 96。
- 80.
Albi T, Ruiz MT, de Los Reyes P, Valverde F, Romero JM。蔗糖磷酸磷酸酶(SPP)亚型的特征拟南芥蒂利亚纳以及S6PPc结构域在二聚反应中的作用。《公共科学图书馆•综合》。2016;11 (11):e0166308。
- 81.
莫里斯DL。碳水化合物的Dreywood蒽酮试剂定量测定。科学。1948;107:254-5。
- 82.
二硝基水杨酸试剂在测定还原糖中的应用。肛门化学1959;31:426-8。
- 83.
Trapnell C, Williams BA, Pertea G, Mortazavi A, Kwan G, van Baren MJ, Salzberg SL, Wold BJ, Pachter L.通过RNA-Seq转录本组装和定量揭示了细胞分化过程中未注释的转录本和亚型转换。生物科技Nat》。2010;28(5):511 - 5。
- 84.
Schmittgen TD,Livak KJ。通过比较C(T)的方法分析实时PCR数据。纳特Protoc。2008; 3:1101-8。
- 85.
刘俊,邓S,汪H,叶军,吴HW,孙HX,蔡NH。CURLY LEAF调节基因组协调种子大小和脂质的生物合成。植物理性。2016; 171:424-36。
- 86.
Troncoso-Ponce MA, Kilaru A, Cao X, Durrett TP, Fan J, Jensen JK, throwing NA, Pauly M, Wilkerson C, Ohlrogge JB。四种正在发育的油料种子的比较深层转录分析。植物j . 2011; 68:1014-27。
- 87.
Bourgis F,Kilaru A,Cao X,Ngando-Ebongue GF,Drira N,Ohlrogge JB,Arondel V.碳分配中含有巨大含量的油棕和枣椰子Mesocarp的比较转录组和代谢物分析。PROC NATL ACAD SCI U S A. 2011; 108:12527-32。
- 88.
Kilaru A, Cao X, Dabbs PB, Sung HJ, Rahman MM, Thrower N, Zynda G, Podicheti R, Ibarra-Laclette E, Herrera-Estrella L, Mockaitis K, Ohlrogge JB。基础被子植物中油脂的生物合成:转录组分析鳄梨美洲中果皮。BMC Plant Biol. 2015;15:203。
- 89.
贾科梅利(Giacomelli E, Xumerle L, Fasoli M, Malerba G, Bellin D, Pezzotti M, Delledonne M.)葡萄使用RNA-Seq。植物杂志。2010;152(4):1787 - 95。
- 90。
Norton G,Harris JF。强奸籽的组成变化(芸苔属植物显著l .)。Planta。1975; 123:163-74。
- 91。
奥尼亚VN,Offiah FU,结EI,伊洛GE,Onwubiko NC。近端和一些尼日利亚蓖麻油的矿物组合物(萝藦)登记入册。Acad J Biotech. 2015; 3:093-6。
- 92。
美国农业部国家标准参考营养数据库。美国农业部农业研究服务处,2017。http://ndb.nal.usda.gov/ndb/nutrients/.2017年3月18日访问。
- 93.
Olayiwola IO, Abubakar HN, abdebayo GB, Oladipo FO。甘薯(Ipomea甘薯LAM)通过尼日利亚克瓦拉州的化学和抗营养分析来土着消费食品。Pak J Nutr。2009; 8:1894-7。
- 94.
有机和常规栽培体系下“早期”马铃薯品种的营养和感官特征。食品化学。2011;133:1249-54。
- 95.
王志强,王志强,王志强。马铃薯块茎的营养评价Cypetus esculentus.L. J SCI食品农业。1970; 21:211-4。
确认
非常感谢我所邓兴博士的qRT-PCR技术支持。
资金
北京市自然科学基金资助项目(No. 5151001);国家自然科学基金资助项目(No. 31371692)。
数据和材料的可用性
RNA-seq的数据可在NCBI短读取存档项目 - PRJNA320781,PRJNA320787和PRJNA312713。在这项研究中产生的或分析所有的数据都包括在此发表的文章和其他文件英寸
作者信息
从属关系
贡献
ZY设计研究。ZY, DL, HJ进行了实验。ZY对数据进行了分析,并准备了手稿。所有作者阅读并批准了最终的手稿。
通讯作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
竞争利益
两位作者宣称他们没有相互竞争的利益。
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
附加文件
附加文件1:
表S1。的总结c . esculentus与碳水化合物代谢相关的转录组数据集、组装和注释以及转录本和单基因的数量。表S2。注释的c . esculentus转录组。表S3。注释和表达水平与蔗糖代谢相关的选择的基因。表S4。引物对用于qRT-PCR。表S5。与蔗糖代谢相关的精选基因的组装序列。(XLSX 6684 kb)
附加文件2:
图S1。不同植物贮藏组织中各转化酶亚型的相对基因表达量。(PDF 86 kb)
附加文件3:
图S2。不同植物贮藏组织中己糖磷酸化各亚型的相对基因表达水平。(PDF 63 kb)
附加文件4:
图S3。不同植物贮藏组织中蔗糖合成途径各亚型的相对基因表达量。(PDF 61 kb)
权利和权限
开放访问本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
杨志强,刘东,纪华,等Cypetus esculentus.:比较转录组分析。BMC植物杂志18,151(2018)。https://doi.org/10.1186/s12870-018-1363-9
收到:
接受:
发表:
关键字
- Cypetus esculentus.
- 石油储量丰富的块茎
- 蔗糖代谢
- 酶途径
- 基因表达模式