摘要
背景
硝酸(不3.−)是高等植物氮素(N)的主要来源,在氮素信号转导中起重要作用。提高作物氮素利用效率已成为促进全球可持续农业发展的有效策略。与氮素吸收相关的调控途径和相应的生化过程在很大程度上影响着植物对氮的耐受性。因此,探索氮素利用效率的分子机制和基因资源将为耐氮饥饿作物的分子育种奠定基础。
结果
在本研究中,我们描述了TaNBP1,小麦的鸟嘌呤核苷酸结合蛋白亚基β基因(t . aestivum),在介导植物n饥饿反应中。TANBP1蛋白质HARBORS保守的W40结构域和TANBP1-GFP(绿色荧光蛋白)信号集中在细胞质膜和细胞溶胶的位置。TaNBP1转录物在根中诱导并在N饥饿应激上留下,并且通过N恢复处理回收该上调表达。TaNBP1与野生型相比,过表达可以改善表型、扩大根系结构(RSA)和增加生物量,这与它在增强氮积累和改善活性氧(ROS)稳态中的作用有关。硝酸盐转运体(NRT)基因NtNRT2.2和抗氧化酶基因NtSOD1,NtSOD2,NtCAT1是转录调控的吗TaNBP1有利于提高植物的氮素吸收和AE活性。
结论
共,TaNBP1对N饥饿应激的转录反应。通过改变NRT基因的转录,通过改善N吸收和细胞ROS稳态增强植物N饥饿适应的植物N饥饿适应NtNRT2.2和抗氧化酶基因NtSOD1,NtSOD2,NtCAT1,分别。我们的研究有助于了解植物氮素饥饿反应的机理,以及在节氮栽培条件下利用基因工程改良作物品种的效益。
背景
氮(N)是植物生长和发育的必要态蛋黄酱。长期以来,增加的N肥料的增加对于改善作物生产力,贡献了很大程度上。然而,除了增加的投资外,农作物生产中的N个输入的过量给予了严重的环境问题[1].因此,在节氮栽培条件下提高作物的氮利用效率(NUE)可以缓解氮对环境的污染,是可持续农业发展的有效策略。
植物具有响应于外部N可用性[演变多方面策略2,3.].在N缺乏症时,植物通过引发涉及涉及一套N-饥饿响应基因的转录途径的响应途径来响应N-饥饿信号传导,其协同作用有助于植物N饥饿适应。其中,已经证实了不同的转录因子(TFS)和硝酸盐转运蛋白(NRTS)参与N饥饿反应。例如,TF编码基因,包括拟南芥硝酸盐调节1基因(ANR1)结节初始化蛋白质7基因(NLP7.),以及玉米DNA指结合蛋白基因(zmdof1.),通过介导外部硝酸盐反应和内部氮同化,在调节氮饥饿耐受中起重要的中介作用[4,5,6].拟南芥NRT基因(即,chl1.和NRT2.1)在感知硝态氮信号、吸收外部硝态氮、跨组织转运内部氮等方面发挥重要作用[7,8].现在有充分记录了植物能够感测外部硝酸盐可用性。因此,硝酸盐作为植物中的信号分子,涉及调节与N摄入,代谢和相关基因表达相关的许多生物学过程[9].然而,尽管大量的研究集中于对N饥饿反应和适应途径的理解,但植物如何感知和转导N信号的详细机制仍然很大程度上不清楚。
GTP结合蛋白(G-蛋白)是由三个亚基,Gα,Gβ和Gγ组成的异映射体。在植物种类以及其他真核生物中,这种功能类中的蛋白质在转换内部提示和环境压力师的转换信号中的基本作用进行了重要作用[9,10].组成g蛋白的亚单位在不同的生物过程中执行不同的功能。例如,拟南芥二聚体Gβγ1和Gβγ2涉及植物对多种真菌病原体感染的防御[11];它在防止植物感染和伤害中起重要的中介作用P. inringae.,一种细菌病原体,通过调节程序性细胞死亡(PCD)和活性氧(ROS)稳态[10].同样,G蛋白的亚基Gα赋予植物增强防御性P. inringae.通过调整气孔运动的感染和损伤[12].几个Gα样亚基已被证实参与建立超大G蛋白,即具有Gβ和Gγ亚基的XLGs,赋予植物增加GTP水解能力,从而促进底物降解和调节植物开花特性[13,14].
亚基Gβ涉及G蛋白的构造,并向Gα和Gγ,另外两种G蛋白亚基施加类似的生物学功能。它也参与了植物病原体防御性[15].此外,该亚基也是多种生理过程中的必需介体,包括根籍重力反应[16,组织分化[17]和沟道介导的离子运输[18].这些发现表明,Gβ亚基在调控植物生长发育和非生物胁迫反应中发挥着不同的作用。
小麦(t . aestivumL.)是世界各地培养的重要谷物作物之一。到目前为止,已经进行了大量的研究,重点是对植物N饥饿反应的生理和生化机制的理解[19].然而,与N饥饿信号传导感知和转换相关的分子网络仍然很大程度上是未知的t . aestivum物种。以前,基于微阵列分析,我们鉴定了鸟嘌呤核苷酸结合蛋白(NBP)编码TaNBP1基因(Genbank登录号AK332651),一种β亚基(Gβ)基因的小麦G蛋白,在N饥饿条件下表达上调。在这项研究中,我们在功能上表现了TaNBP1小麦Gβ亚基基因在调控N饥饿胁迫中的作用。我们的结果表明TaNBP1通过调节N采集和细胞ROS稳态,N-饥饿是诱导植物缺乏耐受性的必要调节剂。
方法
特征分析TaNBP1
利用MEGA7软件测定了TaNBP1及其同源蛋白在植物中的序列相似性(https://www.mega.com.).包括TANBP1及其工厂对应物的NBP蛋白共享的保守结构域被规定如前所述[20.].系统发育关系TaNBP1,利用dnstar软件(https://www.dnastar.com).
TaNBP1的三维结构预测及亚细胞定位分析
一个被称为瑞士模型算法的在线工具(https://swissmodel.expasy.org/interactive)模拟蛋白质的三维结构,预测TaNBP1的三维结构。为了确定从内质网(ER)中分选的TaNBP1的亚细胞定位,我们生成了一个含有a的表达盒TaNBP1-GFP.(绿色荧光蛋白编码基因)融合基因如前所述[21],其中,所述的编码序列(CDS)的TaNBP1使用特异性引物对通过RT-PCR扩增(附加文件1:表S1)和集成在框架与GFP.在组成型Camv35s启动子的控制下。根据Guo等人所述检测来自转化烟草表皮细胞中的融合的GFP信号。(2013)[21].
表达分析TaNBP1
Shiyou 20,在我们的微阵列中,北方的精英高产小麦品种用于鉴定在N饥饿胁迫下差异表达的基因,选择研究表达模式TaNBP1在两个N用品。为了这个目的,将种子下黑暗25℃发芽。发芽后,将幼苗分别在生长室中水培。由微型为此,所述幼苗的根通过漂浮在营养液,将其两次一周,再次塑料泡沫的孔浸入标准Murashige和Skoog(MS)溶液(16毫摩尔N)空气循环泵。对于幼苗生长条件如下:16小时/ 8小时(亮/暗),22℃,230微摩尔米的光强度的光周期温度−2年代−1在光相期间,空气湿度为65至75%。在第三叶膨胀阶段,通过转移到含有含量的N(0.02mM n)的改性MS溶液中进行小麦幼苗,这是通过减少NH而建立的4没有3.了解3.同时补充KCl以维持溶液中钾含量不变。此外,通过将27 h缺氮幼苗再次转移到标准MS溶液中,启动后续的N恢复处理。在0 h (N饥饿前)、1、3、9和27 h (N饥饿后和N恢复后)采集根和叶组织。成绩单的TaNBP1基于qRT-PCR检测。简单地说,用TRIzol试剂(Invitrogen,美国)提取组织中的总RNA。治疗后与RNase-free DNase(豆类,大连,中国),以避免基因组DNA污染,总RNA(2μg)受到合成第一链cDNA使用RT-AMV转录酶(豆类、大连、中国)在20μL反应体积使用益生元(dT) 18日在42°C为30分钟,根据制造商的指示。qRT-PCR检测共25 μL,含12.5 μL SYBR Premix ExTaqTM (TaKaRa,中国大连)、0.5 μL正反引物、1 μL cDNA和10.5 μL无核酸酶水。TaNBP1检查组织中的转录物基于2计算——ΔΔCT使用小麦的方法Tatubulin作为内部控制。用于QRT-PCR分析的基因特异性引物在附加文件中示出1S1:表。
转基因的一代N. Benthamian.线和TaNBP1过度表达
转基因N. Benthamian.线和TaNBP1通过过表达来表征基因介导N饥饿耐受的功能。有了这个目标,一盒含有TaNBP1CDS使用常规方法构建。简而言之,这是TaNBP1CDS通过RT-PCR用的特异性引物(附加文件放大1:表S1),然后插入NCO我/BstEII二元载体pCAMBIA3301在CaMV35S启动子下游位置的酶切位点。将表达盒转化为A. Tumefaciens.污点EHA105和进一步产生的N. Benthamian.线和TaNBP1如先前所述进行过表达[22].
不同氮处理下转基因株系表型和生物量测定
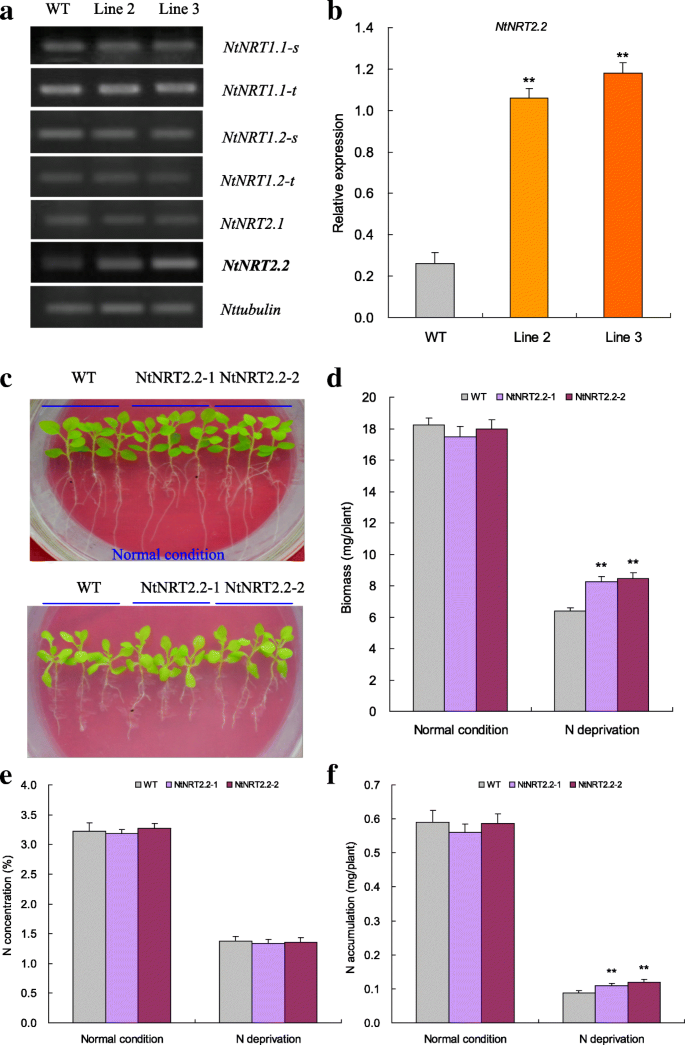
两条更高的线TaNBP1表达式级别(第2行和第3行,附加文件1(图S1A)来研究介导植物氮饥饿反应的基因功能。为此,将品系2和品系3在T3代的种子在黑暗中萌发。在萌发10天后,将转基因和野生型(WT)的均匀幼苗在标准MS溶液中进行水培培养,使其正常生长(16 mM N)或在含有还原N (0.06 mM N)的改良MS溶液中进行N饥饿处理;该改良缺氮溶液的配制方法与小麦缺氮苗相似。在与小麦生长条件相同的条件下,在不同氮条件下培养转基因和WT幼苗。在培养过程中,营养液用小型泵进行空气循环,每周更新两次。6周后,用数码相机记录转基因和野生型植株的表型,将植株样品置于80°C烘箱中烘干48 h后获得生物量。
氮浓度和NRT基因表达模式中的测定法的N-剥夺转基因系
研究了N饥饿处理后转基因品系(品系2和品系3)和野生型中N浓度和硝态氮转运体(NRT)基因表达模式。其中,N浓度的评估如前所述(Guo et al. 2011) [23].在转基因品系和野生型植物氮累计量通过N浓度和植物生物量相乘来计算。为了表征NRT基因推定涉及氮吸收的调解和内部N易位穿过组织,一组NRT的编码烟草的基因,包括NtNRT1.1-S,NtNRT1.1-T,NtNRT1.2-s,ntnrt1.1 - 2. t,ntnrt2; 1,NtNRT2.2,进行使用表达式求值的N-被剥夺TaNBP1以过表达系和WT为样本,基于半定量RT-PCR或qRT-PCR [21].烟草组成型基因称为Nttubulin使用特异性引物对NRT基因转录本进行标准化(附加文件1:表S1)。
水稻生长及氮相关性状的测定ntnrt2; 2过度表达线
NtNRT2.2在n -缺失TaNBP1与野生型相比,高表达株系(第2和3号株系)与野生型有一定的关系TaNBP1-介导的N饥饿反应。为了评价该NRT基因在植物氮素吸收中的调控作用,进行了转基因研究N. Benthamian.线和NtNRT2.2使用类似程序产生过度表达以建立类似的程序TaNBP1超表达。扩增的引物NtNRT2.2cd显示在附加文件中1S1:表。定义NtNRT2.2NtNRT2.2-1和NtNRT2.2-2是该NRT基因高表达的两个细胞系(附加文件)1:图S1B),在N饥饿处理下进行培养。为此目的,T3代的NTNRT2.2-1和NTNRT2.2-2的种子在黑暗中发芽。发芽后十天,转基因和野生型(WT)的均匀幼苗在标准MS溶液中培养,用于正常生长(16mm N),或通过在含有减少的N(0.06mm N.0.06mm N.0.06mm N.),建立与N-剥夺的WT和线条相同TaNBP1过度表达作为上述。同样,使用迷你泵空气循环,营养溶液在培养过程中每周内再生两次。在六周后评估表型,生物质和N浓度,然后进行上述描述。
抗氧化相关基因ROS参数和表达模式的评估TaNBP1过度表达线
鉴于细胞内活性氧(ROS)稳态与植物N饥饿反应密切相关,我们测定了超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)等抗氧化酶(AEs)的活性,以及丙二醛(MDA)、过氧化氢(H2O2)和超氧阴离子TaNBP1过度表达线(第2行和3)和野生型。如Huang等人报告的那样确定上述参数。2010 [24].来定义可能涉及调控的基因TaNBP1的SOD、CAT和POD活性,研究了烟草的一系列AE基因,包括5个SOD编码蛋白(NtSOD1,NtSOD2,NtSOD3,NtMnSOD1,NtMnSOD2),六编码CAT蛋白(即,NTCAT.,NtCAT1,NtCAT3,NtCAT1; 1,NtCAT1; 2,NtCAT1; 3)和11编码豆荚蛋白(即,ntpod1; 1来ntpod1; 7,ntpod2; 1,ntpod2; 2,NtPOD4,NtPOD9),使用N-剥夺的表达评估TaNBP1基于RT-PCR或qRT-PCR的过表达系。用于这些AE基因的登录号和引物对显示在附加文件中1S1:表。
AE差异基因调控AE活性的功能分析
对AE编码基因的表达分析显示,其中3个,包括NtSOD1,NtSOD2,NtCAT1,被证明在N-剥夺的情况下表达差异TaNBP1超表达。为了研究它们在氮饥饿条件下调节植物声发射活性的作用,我们构建了过表达这些声发射基因的转基因系。为此,采用PCR方法扩增AE基因的CDS,并将CDS分别插入pCAMBIA3301双载体NCO我/BstEII控制下CAMV35S启动子的限制性位点。构建含有这些AE基因并遗传转化为烟草的表达盒进行了相似的产生tanrt2; 2过度表达线如上所述。用于扩增AE基因的引物对在附加文件中显示1S1:表。
选择每个AE基因的两个代表性线以在正常和N饥饿处理中定义基因介导的AE活性。为此目的,WT和转基因系的种子在T3产生,具有AE基因的过表达,包括NTSOD1-1和NTSOD1-2NtSOD1,ntsod2-1和ntsod2-3为NtSOD2,以及NTCAT1-2和NTCAT1-3NtCAT1它们在黑暗中发芽。发芽10天后,将转基因和野生型幼苗均匀垂直培养在含有1/2 MS盐(8 mM N)的琼脂培养基上或添加还原N的1/2 MS盐(0.06 mM N)的琼脂培养基上。此外,采用相同的生长条件培养转基因和WT幼苗。处理3周后,转基因和野生型幼苗的AE活性测定与野生型幼苗相似TaNBP1超表达。
统计分析
通过4个重复的结果,得到了充分或缺氮条件下野生型和转基因株系的生物量、N浓度、N量、SOD、CAT、POD活性、MDA含量的平均值和qRT-PCR数据。采用统计分析系统软件(SAS Corporation)分析各组平均值的标准误差和平均值之间的显著差异。
结果
的描述TaNBP1
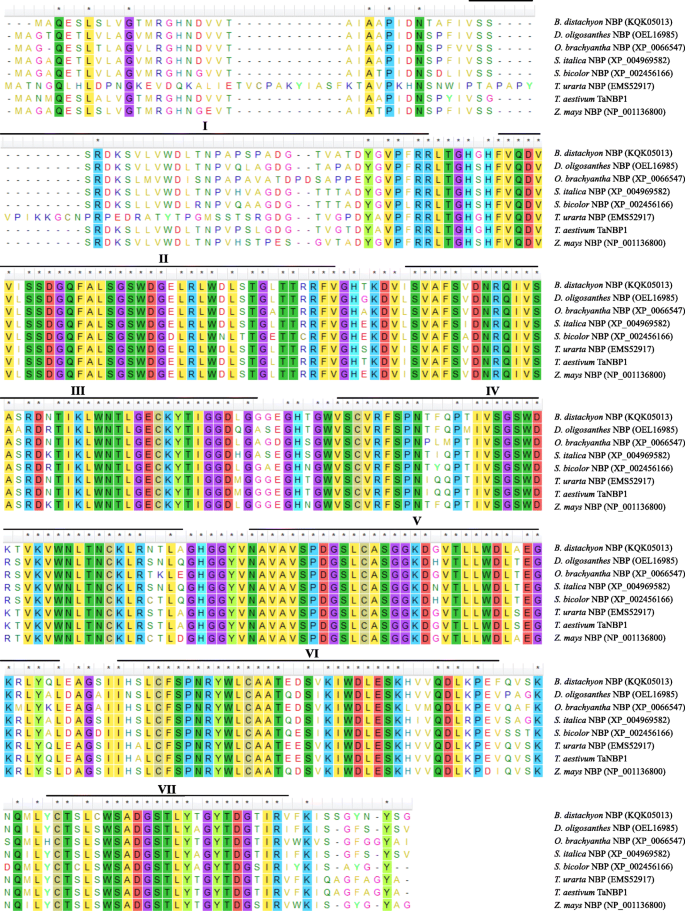
TaNBP1cDNA长1273 bp,编码335 aa多肽(附加文件1:图S1);TANBP1的预测分子量和等电点(PI)分别为36.28kd和6.32。在氨基酸水平,TANBP1与其同行股份股票高度相似之处b . distachyon,d . oligosanthes,O. Brachyantha.,美国italica,美国二色的,T. Uraartu.,z梅斯;它们都含有保守的WD40结构域,涉及7个叶片单元的构成(图2)。1).在核酸水平,TaNBP1在不同的植物物种中显示出高度的同源基因,与来自H.Vulgare.(AK359815),b . distachyon(XM_003567896),o .漂白亚麻纤维卷(CT833917),和美国italica(XM_004961250)(附加文件1:图S2)。这些结果表明TaNBP1与植物相似的进化途径。
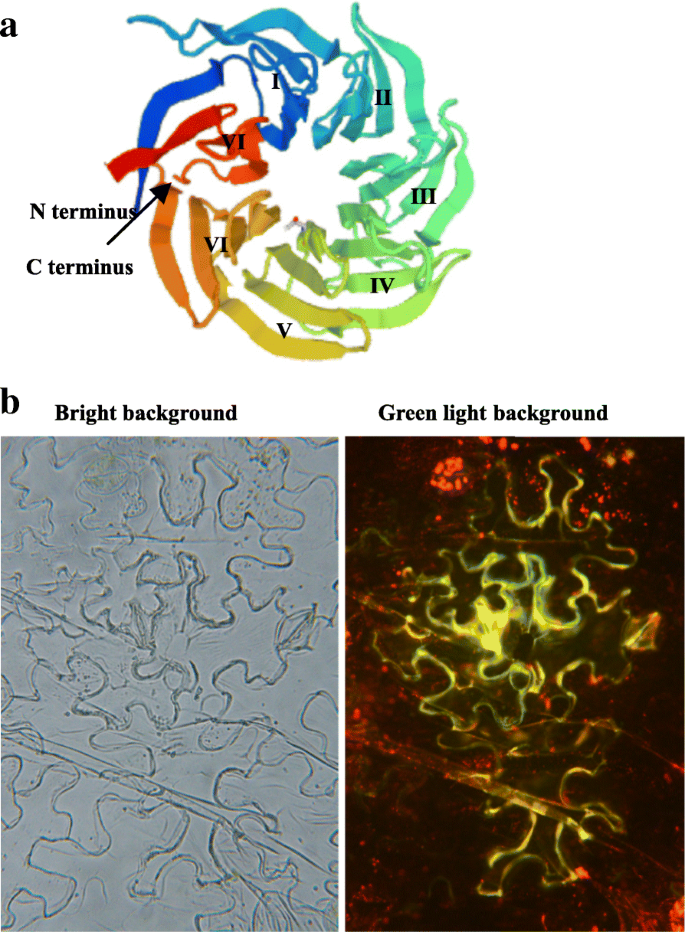
基于三维结构(3-D)预测分析,据揭示了TanBP1 HARBORS通过保守的WD40重复启动的典型β-螺旋桨特征域(重复I至VII)(图。2).基于转化的烟草表皮细胞中检测到的融合TANBP1-GFP的分布,提出TANBP1位于细胞质膜和胞质溶溶胶的位置,因为源自融合的GFP信号浓缩在这些细胞位置上(图。2 b).
表达TaNBP1响应外部n级
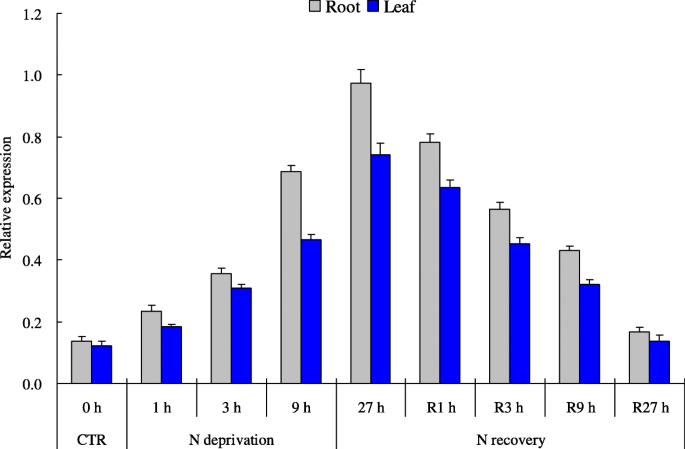
的表达模式TaNBP1在各种外部n水平下检测到根部和叶子的组织中。在正常情况下(16 mm n),TaNBP1在根和叶片中显示出转录物在较低。n饥饿应激(0.02 mm n),TaNBP1两种组织中的表达在27小时治疗方案上逐渐上调,处理后27小时达到峰值(图。3.).此外,上调的转录本TaNBP1在N正常恢复处理后,N被剥夺的组织逐渐恢复,表明随着N恢复的进程,其诱导的表达在两个组织中逐渐降低(图)。3.).这些结果表明,TaNBP1是对外部N级别的时间响应。
TaNBP1赋予植物改善了N-饥饿应激的生长和n采集
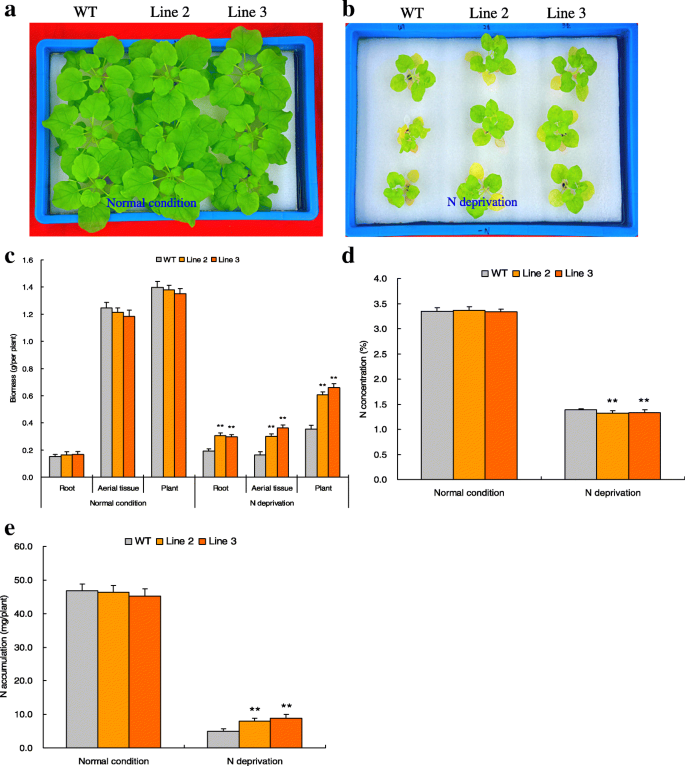
进行转基因分析以表征TaNBP1调节氮饥饿反应。第2行和第3行,两个T3行具有更多的目标转录本(附加文件1:选择和经受N正常和N饥饿应激处理的图S3a。在N正常情况下,线2和3表现出与野生型(WT)的类似表型和生物质(图。4和c).与野生型相比,在缺氮处理下,品系2和品系3的表型均有所扩大,根系结构(RSA)有所改善,生物量也有所增加(图2)。4 b和c)(分别为54.69和增加根59.90%和83.44和在第2行和第3行空中组织122.09%)。这些结果表明,TaNBP1是调节植物耐氮饥饿的关键。
在N饥饿处理后评估转基因系(第2和3线)和WT的N浓度。在N正常条件下在转基因和WT植物中观察到N浓度和N累积量的明显变化(图。4 d).相比之下,在N饥饿处理下,第2和3线表现出相对于野生型的增加的累积N量(图。4 e虽然在缺氮条件下,各品系的氮含量与野生型相当(图3),但2、3号品系的氮含量分别增加了63.54和79.02%)。4 d).这些结果表明TaNBP1参与增强的N积累,有助于植物N饥饿耐受性。
NtNRT2.2显示上调的表达TaNBP1在氮饥饿胁迫下,植株对氮的吸收增强
烟草NRT编码基因的表达,包括NtNRT1.1-S,NtNRT1.1-T,NtNRT1.2-s,NtNRT1.2-t,NtNRT2.1,NtNRT2.2在缺氮转基因株系(品系2和3)和WT植株中。其中,NtNRT2.2与野生型植物相比,第2和第3行转录本显著上调(图。5A,B.),与其他未改变的NRT基因表达模式(例如,NtNRT1.1-S,NtNRT1.1-T,NtNRT1.2-s,NtNRT1.2-t,NtNRT2.1)。这些结果表明NtNRT2.2受到控制权TaNBP1而NRT基因的上调可能是转基因植株氮素积累增加的原因之一。
功能的功能NtNRT2.2在改善N饥饿下的N累积时,基于转基因分析评估了N饥饿应激。ntnrt2.2-1和ntnrt2.2-2,两个NtNRT2.2具有更多目标转录本的过表达行(附加文件1(图S3B),并进行N正常和N饥饿处理。在N正常条件下,NtNRT2.2-1与NtNRT2.2-2表现出相当的表型(图2)。5度)、生物质(无花果。5 d)、N浓度(图。5 e)和n累积(图。5 f)野生型。然而,在N饥饿处理下,转基因系显示出改善的表型(图。5度),增加生物量(图。5 d,从29.15增加到32.60%);5 f相对于wt增加,从25.00增加到36.32%。转基因系中的N含量增加是由改进的生物质引起的,因为在转基因和WT幼苗中观察到相似的N浓度(图。5 e).这些结果表明NtNRT2.2在植物遭受氮饥饿胁迫时,对植物获取氮具有重要的调节作用。
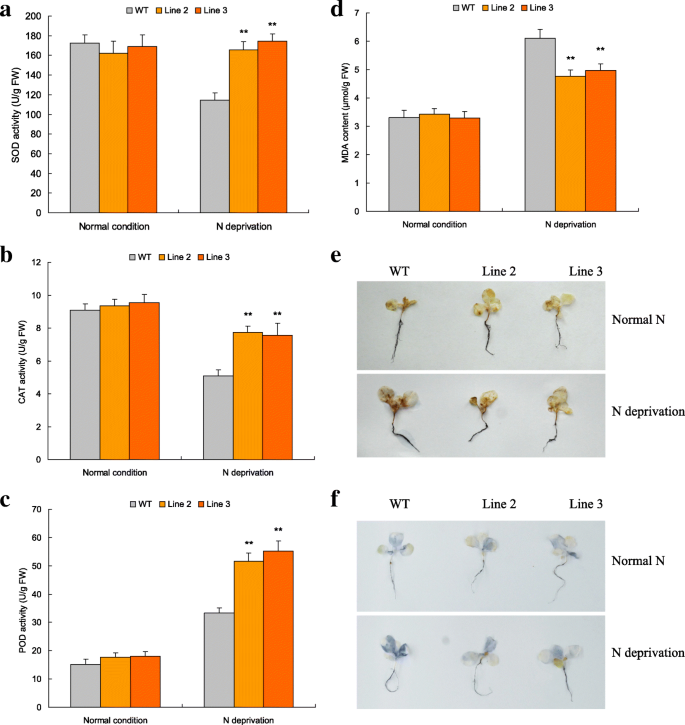
TaNBP1过表达改善了N饥饿条件下细胞ROS的稳态
一组ROS相关参数,包括SOD,CAT,POD,MDA内容的活动以及H的量2O2和超氧化物阴离子TaNBP1在N正常和N饥饿处理后测定过表达系和野生型。在正常N条件下,转基因品系2和3的SOD、CAT、POD活性和MDA、H2O2和超氧阴离子含量(图。6来f).在N饥饿处理,第2行和3显示了提高的超氧化物歧化酶(图的活动。6,从44.48增加到52.32%),CAT(图。6 b从48.13增加到52.06%)和豆荚增加(图。6摄氏度(从55.00增加到65.53%),MDA含量降低(图。6 d减少18.69%至27.88%),减少了H.2O2与WT相比,超氧化物阴离子量(图。6 e和f).因此,TaNBP1赋予增加的AE活动和改善细胞ROS稳态对于由N个饥饿应力处理的植物,这有助于TaNBP1-介导的N饥饿耐受。
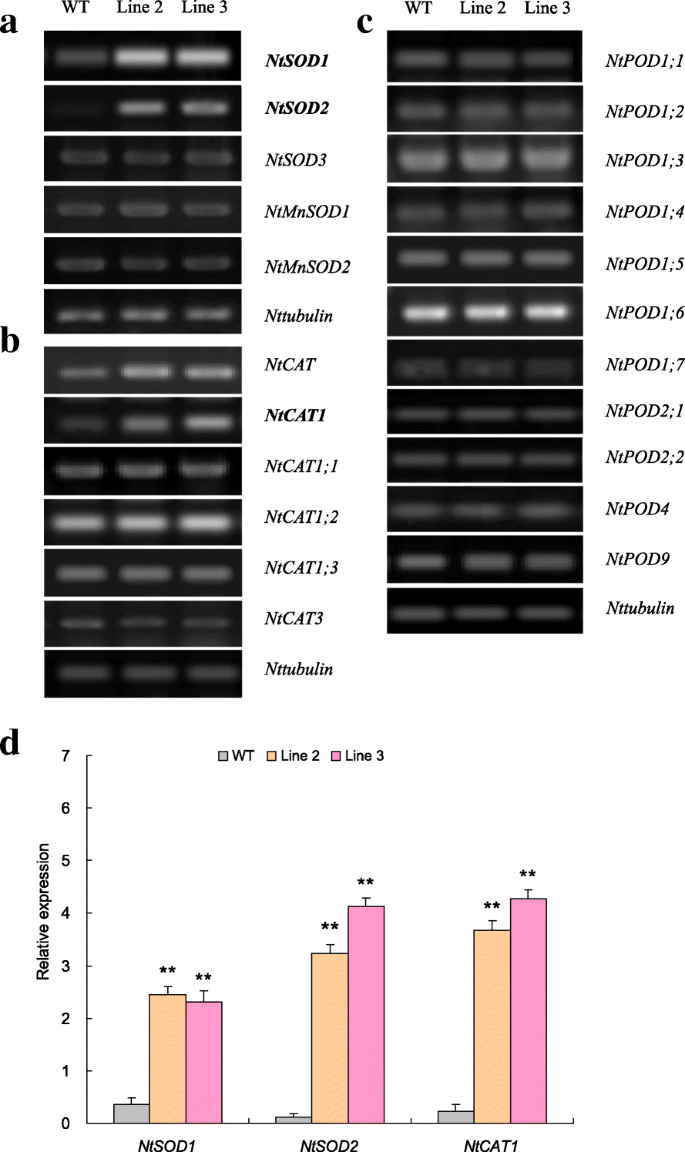
n缺失组AE基因表达模式TaNBP1过度表达线
一套烟草AE编码基因,包括SOD五(即,NtSOD1,NtSOD2,NtSOD3,NtMnSOD1,NtMnSOD2),六只猫(即,NTCAT.,NtCAT1,NtCAT1; 1,NtCAT1; 2,NtCAT1; 3,NtCAT3)和11个豆荚(即,ntpod1; 1,ntpod1; 2,ntpod1; 3,ntpod1; 4,ntpod1; 5,ntpod1; 6,ntpod1; 7,ntpod2; 1,ntpod2; 2,NtPOD4,NtPOD9)在N-剥夺的表达评估中进行了表达评估TaNBP1超表达。其中,两个SOD基因(即,NtSOD1和NtSOD2)和一个CAT基因(即,NtCAT1)在第2和第3行中的表达显着上调,与所检查的其他AE基因对比,其在转基因和WT植物中显示出未改变的转录物丰度(图。7一个来d).因此,这些差异AE基因的表达可能是控制的TaNBP1而它们的转录上调可能影响了n缺失组修饰后的AE活性和细胞ROS稳态TaNBP1超表达。
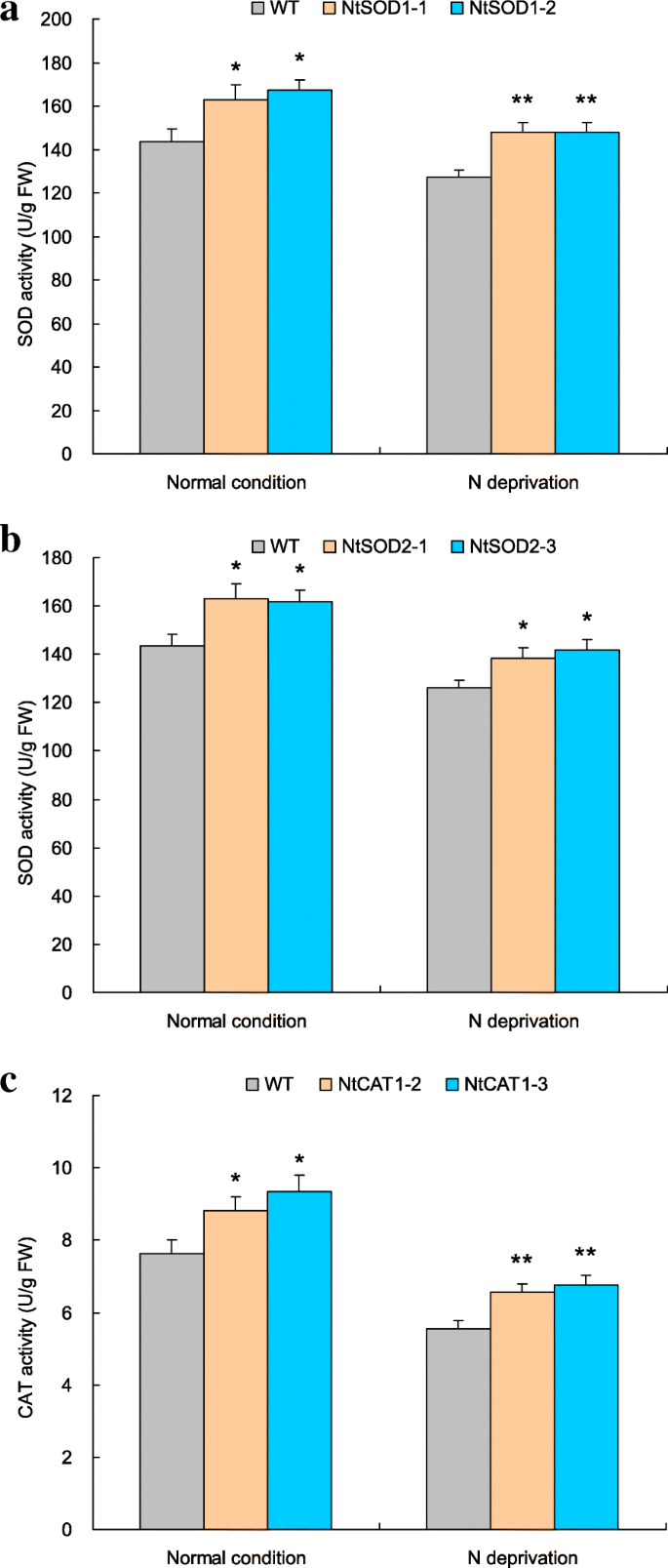
差分SOD和POD基因介导大量细胞AE活动
功能NtSOD1,NtSOD2,NCAT1在介导细胞AE活动基于转基因的分析进行了表征。基于靶转录物丰度的检测,两行具有很强的靶基因表达,包括SOD1-1和SOD1-2为NtSOD1, SOD2-1和SOD2-3NtSOD2和cat1-2和cat1-3为NtCAT1(附加文件1:图S4A至S4E),并进行N饥饿处理。在N正常和N饥饿处理下,转基因株系的相应AE活性均明显高于野生型(图2)。8 a - c),即SOD1-1和SOD1-2以及SOD2-1和SOD2-3显示出增强的SOD活性(图。8和b),而CAT1 - 2和CAT 1-3则表现出CAT活性升高(图1)。8 c这些结果表明,不同的AE编码基因参与了SOD和CAT活性的调节,并有助于改善n缺失组的细胞ROS稳态TaNBP超表达。
讨论
参与g蛋白组装的Gα、Gβ和Gγ亚基在所有真核生物中都是保守的。构成这些亚基的科的成员在植物物种中通常是有限的。例如,只有Gα亚基编码基因(GPA1) [25],A亚基Gβ编码基因(AGB1)和一组编码亚基gβ样的一组基因[26]、3个Gγs亚基基因(AGG1,AGG2和AGG3)分别编码Gγ1,Gγ2和Gγ3[27],已在拟南芥中被发现。对G蛋白亚基表征已经验证与植物生长,发育和应激反应有关[多样的生物学过程的调节他们的关键作用9,10].
G-蛋白的亚基Gβ参与调节植物中各种生理过程,包括介导植物病原体P. inringae.防御性(28]调节植物开花启动[14]调节种子萌发,ABA介导的气孔开口和向内K.+声道输出的激活(29,并调节植物的表型和角质层发育[30.,31].在该研究中,小麦Gβ亚基TANBP1的表征表明它具有保守的WD40重复,这涉及NBP1家族蛋白的3-D结构建立。我们分析从TANBP1-GFP融合检测亚细胞水平的GFP分布显示,将信号集中在细胞质膜和细胞溶胶上,表明TANBP1从内质网分选后对这些位置进行靶向这些位置,在那里它建立了与亚基的异象G-蛋白gα和gγ。
在N饥饿应激上引发了不同的N信号,这引发了大集的调控和功能基因的转录改变[32].一组涉及植物N饥饿应激反应的基因,包括编码NRT蛋白的基因[32]、氨转运载体[33],DOF1转录因子[5,谷氨酰胺合成酶[34]和生长素受体(AFB3)[35,在不同的外源氮水平上表现出修饰的转录模式。在本研究中,我们发现TaNBP1在修正的氮输入条件下表现出变化,表明TaNBP1氮素饥饿处理27 h后,根和叶的转录产物逐渐增加。当缺氮植株再次接受氮正常恢复处理时,该基因的上调表达逐渐下调。这些表达模式表明TaNBP1是参与植物氮饥饿响应。此前,独联体被称为NRE的调节元件被证明是对N响应基因套件的转录调节至关重要的,包括拟南芥中亚硝酸盐还原酶(NIR)和NRT蛋白的转录调节,例如NRT2.1和NRT2.2[32].进一步表征独联体- N饥饿响应的推翻元素TaNBP1可以帮助理解在低氮胁迫其转录机制。
上亚基Gβ功能表征揭示了其各种生物学作用,包括下胚轴在细胞分裂的调节[30.,种子发芽[31苗木建立和根伸长率[31,36],气孔开口和向内k+-保卫细胞中的通道反应[18].在本研究中,对N剥夺反应的观察促使我们对N剥夺反应的作用进行表征TaNBP1调节植物N饥饿耐受性。在n饥饿处理下,线条TaNBP1与野生型相比,过表达表现出改善表型、增加氮积累量和更高的植株生物量(图2)。4A-E.).在转基因系中低压胁迫下N吸收和植物干物质产生的显着改善表明TaNBP1在调节植物对氮饥饿胁迫的适应中是必不可少的。在缺氮条件下进行高氮肥利用的作物基因工程中也有一定的应用价值。
低亲和转运系统(Low-affinity transport system, LATS)和高亲和转运系统(high-affinity transport system, HATS)是植物物种和其他真核生物主要的氮吸收系统,在不同的氮输入条件下,介导植物氮获取和内部氮跨组织转运中起着至关重要的作用[37].其中,HATS是constisted由NRT2家族基因,其中,N饥饿应力下在植物氮吸收功能编码的高亲和力硝酸盐转运蛋白的[38].以前,基于突变体分析,表征了一组NRT2系列成员在低压应激下介导N采集的功能。例如,突变体与敲除NRT2.1,NRT2.2,NRT2.4,NRT2.7,拟南芥NRT2家族基因显示根硝酸盐吸收能力急剧下降[39,40,41].在本研究中,我们分析了一套NRT编码基因的表达模式,以应对它们参与的天气TaNBP1- 根据N饥饿胁迫下的N吸收改善。我们的结果与所检查的其他NRT基因相比表明,在剥夺了N-剥夺的情况下显示出不妨碍转录TaNBP1过表达系和野生型,一个NRT家族成员称为NtNRT2.2与野生型相比,在转基因株系中表达上调。转基因分析NtNRT2.2结果表明,过表达该基因的品系植株表型改善,氮素累积量增加(图2)。5 c, d, f).这些调查结果表明NtNRT2.2有助于植物在低氮胁迫下吸收氮。因此,TaNBP1介导的N饥饿耐受与上调表达有关NtNRT2.2,在其转录TaNBP1氮素饥饿胁迫对植株氮素积累、表型行为和生物量生产的影响。
根系统结构(RSA)大致以水采集和从生长培养基的无机养分的吸收的影响。除了介导的氮吸收的NRT蛋白中,RSA由调制低氮胁迫也对植物氮吸收,已报道其建立要与不同的NRT基因受累相关急剧影响。例如,拟南芥NRT2.1除对NO的调节作用外,还涉及初生根和次生根的起始和延伸的生理过程3.−摄取[32].在本研究中,我们对带过表达的线条RSA表征的分析TaNBP1或NtNRT2.2透露,与野生型相比,它们根据N饥饿处理显示的所有RSA系统(图。4摄氏度和5度).这一发现表明TaNBP1介导RSA的建立,这可能是通过其转录调控来完成的NtNRT2.2.以前,显示改变N水平时调制的RSA行为与植物素,一种植物激素的类型相关联。玉米提供了相应的证据(z梅斯),其根生长在高硝酸盐条件下抑制,并且抑制强度与根尖中的生长素浓度的降低相关。减轻从射击到根部的植物素信号传递的转导然后涉及调制RSA行为[42].此外,一些研究已经表明g蛋白、NRT蛋白和细胞生长素运输特性之间的内在联系。例如,拟南芥Gβ(也被命名为AGB1)介导生长素在中心柱体内的向顶运输,影响生长素在表皮和/或皮层中的作用,并进一步调节RSA的建立[43];N饥饿条件下拟南芥NRT1.1负调控细胞生长素运输,正调控生长素介导的RSA建立[38].这些发现在一起表明了G-蛋白,NRT蛋白和植物蛋白的协同作用机制在调节RSA行为方面。关于RSA行为的进一步表征TaNBP1和NtNRT2.2可以帮助了解植物的根表型形成。
细胞ROS在各种压力下过量产生,导致蛋白质、脂质和核酸的损伤,最终导致细胞损伤或细胞死亡[44].另一方面,植物已经进化出一套相应的保护策略(即酶促和非酶促抗氧化系统)来保护自己免受氧化损伤[45].抗氧化酶(AE)如SOD,CAT和POD是在由环境应激发起ROS的解毒关键介质。最近,已经验证了的不同AE基因的转录被下的G蛋白亚基的控制进行调节。例如,在水稻的CAT基因的转录物(o .漂白亚麻纤维卷)由RGG1,G-蛋白的γ亚基调节;过度表达rgg1.使植物增强CAT活性及提高耐盐性[46].这一发现表明了g蛋白亚基与植物细胞ROS稳态之间的假定联系。本研究基于对缺氮患者ros相关参数的评估TaNBP1过表达线,我们揭示了TaNBP1在缺氮条件下调节细胞ROS稳态。我们的结果表明TaNBP1过表达系SOD、CAT和POD活性升高,MDA含量降低,H2O2和超氧阴离子累积量(图。6来f)与野生型相比。进一步的转基因分析一组不同的AE基因,包括NtSOD1,NtSOD2,NtCAT1, 3个AE基因表达明显上调,与TaNBP1证实了它们在AE活性调节中的作用。这些结果表明,tanbp1介导的N饥饿耐受性也与细胞ROS解毒的基因功能有关。AE基因差异的转录机制TaNBP1需要进行调节来进一步表征。
结论
我们的调查表明TaNBP1是对外源氮水平的转录反应。过度表达TaNBP1在缺氮条件下,植株的表型、氮素累积量和生物量均得到改善TaNBP1是植物适应氮饥饿胁迫的重要调控因子之一。TaNBP1介导的植物N-饥饿耐受性与基因功能密切相关,通过NRT基因的转录调节改善N采集,RSA建立和细胞ROS稳态NtNRT2.2和独特的AE基因,如NtSOD1,NtSOD2,NtCAT1.这些差异基因的过表达显著调控植物氮素吸收、根系构型的建立和AE活性。TaNBP1可作为在作物有价值的靶基因与保存的N-培养条件下高NUE基因工程之一。
缩写
- AE:
-
抗氧化酶
- 猫:
-
催化剂
- 多发性硬化症:
-
Murashige和斯库
- NRT:
-
尼特拉特运输车
- 子:
-
开放阅读框
- 圆荚体:
-
过氧化物酶
- ROS:
-
反应性氧气
- WT:
-
野生型
参考
- 1.
鞠晓涛,邢光新,陈小平,张少林,张丽娟,刘学军,崔志林,尹波,Christie P,朱志林,等。通过改进中国集约化农业系统的氮管理降低环境风险。美国国家科学研究院2009;106:3041-6。
- 2.
斯蒂特男,穆勒C,马特P,Gibon Y,卡里略P,Morcuende R,Scheible WR,克拉普A.向氮代谢的集成视图步骤。实验植物学。2002; 53:959-70。
- 3.
Vidal E, Gutiérrez RA。氮素营养和代谢产物反应的系统观点拟南芥.植物学报。2008;11:521-9。
- 4.
张浩,Forde BG。一种控制营养诱导的根构型变化的拟南芥MADS盒基因。科学。1998;279:407-9。
- 5.
在低氮条件下,利用Dof1转录因子促进植物的氮素同化和生长。美国国立大学学报2004;101:7833-8。
- 6.
Castaings L, Camargo A, Pocholle D, Gaudon V, Texier Y, Boutet-Mercey S, Taconnat L, Renou JP, Daniel-Vedele F, Fernandez E,等。结节开始样蛋白7调节硝酸盐的感知和代谢拟南芥.植物杂志2009年; 57:426-35。
- 7.
何CH,SH林,胡HC,纂YF。CHL1功能作为在植物中硝酸盐传感器。细胞。2009; 138:1184至1194年。
- 8.
何昌,蔡永福。硝酸盐,铵和钾的传感和信号。植物学报。2010;13:604-10。
- 9.
Krapp A, David LC, Chardin C, Girin T, Marmagne A, Leprince AS, Chaillou S, Ferrario-Méry S, Meyer C, Daniel-Vedele F.拟南芥硝酸盐的转运和信号转导。[J] .机器人。2014;65(3):789-98 .]
- 10.
Delgado-Cerezo M,Sánchez-Rodríguezc,escudero v,miedese,fernándezpv,jordál,hernández-blanco c,sánchez-vallet a,bednarek p,schulze-leffert p等。Arabidopsis杂酰基蛋白调节细胞壁防御和对坏养殖真菌的抵抗力。莫尔植物。2012; 5:98-114。
- 11.
Trusov Y,Seamelam N,Lookes Je,Kunkel M,Nowak E,Schenk PM,Botella Jr。异络G蛋白介导的病症的抗病性抗性抗病性包括独立于水杨酸 - ,茉莉酸/乙烯 - 和脱离酸介导的防御信号传导的机制。工厂J. 2009; 58:69-81。
- 12.
曾伟,何世英。鞭毛蛋白受体鞭毛蛋白- sensing2在调节气孔反应中的重要作用两光伏番茄拟南芥中的DC3000。植物理性。2010; 153:1188-98。
- 13.
丁L,Pandey S,Assmann SM。拟南芥超大g蛋白(XLG)调节根形态发生。工厂J. 2008; 53:248-63。
- 14.
许杰,成S, Assmann SM。Ca2+- 依赖性GTP酶,超大G蛋白2(XLG2),促进了与vernalization1(RTV1)相关的DNA结合蛋白的激活,导致拟南芥中花卉积分剂基因和早期开花的激活。J Biol Chem。2012; 287:8242-53。
- 15.
朱H,Li GJ,Ding L,Cui X,Berg H,Assmann SM,夏Y.拟南芥额外大的G蛋白2(XLG2)与异校型G蛋白的Gβ亚基相互作用和抗病性抗病性。莫尔植物。2009; 2:513-25。
- 16.
Pandey S, Monshausen GB, Ding L, Assmann SM。特大型和常规G蛋白对根波响应的调控拟南芥.工厂J. 2008; 55:311-22。
- 17.
Ullah H, Chen JG, Temple B, Boyes DC, Alonso JM, Davis KR, Ecker JR, Jones AM。β亚基拟南芥G蛋白负调节生长素诱导的细胞分裂并影响多种发育过程。植物细胞。2003; 15:393-409。
- 18.
风扇LM,张W,陈杰,泰勒·吉普,琼斯am,assmann sm。保护细胞K的脱落酸调节+Gβ-和rgs缺陷的阴离子通道拟南芥线条。国家科学院院刊美A. 2008; 105:8476-81。
- 19.
Zhou B, Serret MD, Elazab A, bert Pie J, Araus JL, Aranjuelo I, Sanz-Sáez Á。小麦穗碳同化和氮素再转化对籽粒产量有显著影响。acta botanica yunnanica(云南植物研究),2016;
- 20.
Urano D, Chen J, Botella JR, Jones AM。植物界的异质三聚体G蛋白信号转导。开放杂志。2013;3:120 - 86。
- 21.
郭c,赵x,刘x,张l,gu j,li x,lu w,xiao k.小麦磷酸盐转运蛋白的功能tapht2; 1在充足和有限磷供应条件下的磷转运和植物生长调控。足底。2013;237:1163 - 78。
- 22.
Sun Z,Ding C,Li X,Xiao K.Tazfp15的分子表征及表达分析,小麦C2H2型锌指转录因子基因(Triticum Aestivum.L.)。ĴINTEGR AGRIC。2012; 11:31-42。
- 23.
郭C,李继,张W,张L,Cui X,Xiao K.染色体替代对小麦氮,磷和钾利用效率的影响。前大农业中国。2011; 5:253-61。
- 24.
黄奇,刘杰,陈XJ。过度表达PtrABF基因,bZIP转录因子分离枳壳trifoliata,通过清除活性氧和调节胁迫应答基因的表达来增强烟草的脱水和耐旱性。BMC Plant Biol. 2010;10:230。
- 25.
Ma H,Yanofsky MF,Meyerowitz em。GPA1的分子克隆与表征来自拟南芥的G蛋白α亚基基因。Proc Natl Acad Sci U S A. 1990; 87:3821-5。
- 26。
胡玉华,马红霞,马红霞。玉米(ZGB1)和拟南芥(AGB1)中鸟嘌呤核苷酸结合蛋白-亚基同源基因的克隆及序列分析。中国科学院院刊1994;91:9554-8。
- 27。
Thung L,Trusov Y,Chakravorty D,Botella Jr。ggamma1 + ggamma2 + ggamma3 = gbeta:从拟南芥中寻找异映上的G蛋白γ亚基结束。J植物理性。2012; 169:542-5。
- 28。
Lee S, Rojas CM, Ishiga Y, Pandey S, Mysore KS。拟南芥异质三聚体g蛋白在寄主和非寄主抗性中发挥着重要作用两病原体。《公共科学图书馆•综合》。2013;8:e82445。
- 29。
Mishra G,张W,Deng F,Zhao J,Wang X.分叉途径引导脱离酸作用对拟南芥的气孔闭合和开口。科学。2006; 312:264-6。
- 30.
Ullah H,Chen Jg,Young JC,Im Kh,Sussman Mr,Jones Am。异质型G蛋白的细胞增殖调节拟南芥.科学。2001; 292:2066-9。
- 31.
Ullah H,陈杰,王某,琼斯am。异质纤维型G蛋白在调节中的作用拟南芥种子萌发。植物理性。2002; 129:897-907。
- 32.
Remans T, Nacry P, Pervent M, Girin T, Tillard P, Lepetit M,等。在植物根系对氮素限制的综合形态和生理响应中,硝酸盐转运体NRT2.1起着核心作用拟南芥.植物杂志。2006;140:909-21。
- 33.
工程师CB, Kranz RG。叶和根的倒数表达ATAMT1.1.并响应氮饥饿的根系结构变化。植物理性。2007; 143:236-50。
- 34.
Fuentes Si,Allen DJ,Ortiz-Lopez A,Hernandez G.胞质谷氨酰胺合成酶的过表达增加了低氮浓度的光合作用和生长。实验植物学。2001; 52:1071-81。
- 35.
Vidal EA, Araus V, Lu C, Parry G, Green PJ, Coruzzi GM, Gutiérrez RA。硝酸盐响应的miR393/AFB3调节模块控制根系统结构拟南芥.美国国家科学研究院2010;107:4477-82。
- 36.
潘迪,陈建国,琼斯AM,阿斯曼SM。g蛋白复合物突变体对脱落酸对萌发和萌发后发育的调控非常敏感。植物杂志。2006;141:243-56。
- 37.
LUDEWIG U,NeuhäuserB,铵运输和积累在植物中的Dynowski M.分子机制。费用。2007; 581:2301-8。
- 38.
Krouk G,Tillard P,Gojon A.高亲和力的监管3−NRT1.1的摄取系统 - 介导的NO3.-拟南芥的需求信号。植物杂志。2006;142:1075 - 86。
- 39.
小DY,饶H, Oliva S, Daniel-Vedele F, Krapp A,等。推测的高亲和性硝酸盐转运体NRT2.1在营养线索的作用下抑制侧根起始。美国国家科学研究院2005;102:13693-8。
- 40。
肖邦F,奥塞尔M,多贝MF,查登F,张恩等。的拟南芥ATNRT2.7硝酸盐转运蛋白控制种子中的硝酸盐含量。植物细胞。2007; 19:1590-602。
- 41。
Kiba T,Feria-Bourrellier A-B,Lafouge F,Lezhneva L,Boutet-Mercey S等人。的拟南芥硝酸盐转运蛋白NRT2.4在氮饥饿植物的根部和芽中起着双重作用。植物细胞。2012; 24:245-58。
- 42。
田强,陈芳,刘军,张芳,米国。高硝态氮对玉米根系生长的抑制与根系IAA水平的降低相关。植物生理学报。2008;65:942 - 51。
- 43。
细胞分裂素与乙烯、生长素和葡萄糖信号调控相互作用拟南芥幼苗根系方向生长。植物理性。2011; 156:1851-66。
- 44.
鳃SS,Tuteja N.作物植物中非生物胁迫耐受性耐受性氧气和抗氧化机械。植物理性生物化学。2010; 48:909-30。
- 45.
你Ĵ,期间作物非生物胁迫应答陈Z. ROS调控。前植物SCI。2015; 6:1092。
- 46.
Swain DM,SAHO RK,Srivastava VK,Trivathy BC,Tuteja R,Tuteja N.通过提升ROS的解毒,Zutegeric G蛋白γ亚基RGG1在水稻中提供盐度应力耐受性。Planta。2016;https://doi.org/10.1007/s00425-016-2614-3.
致谢
这项工作得到了国家自然科学基金(第31371618号)的支持,以及河北的主要研发项目(第3020101号)。
资金
基金资助:国家自然科学基金资助项目(no. 201430430429);基金资助:国家自然科学基金资助项目(31571664);17962901 d)。
可用性数据和材料
本研究中产生或分析的所有数据均包含在本文及其补充数据文件中。
作者的贡献
KX设计了研究并撰写了论文。ZL, YZ, XW, MY, CG进行研究,分析数据,并进行统计分析。所有作者阅读并批准了最终的手稿。
作者信息
从属关系
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
两位作者宣称他们没有相互竞争的利益。
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
附加文件
额外的文件1:
表S1。PCR引物。图S1。的全长cDNATaNBP1以及相应的转译氨基酸。的起始密码子ATG和终止密码子TAGTaNBP1被红色背景标记。由TANBP1中的七倍β-螺旋桨组成的七个保守的WD40重复域(I至VII)被蓝色背景突出显示。图S2。文学源关系TaNBP1其来自各种植物物种的同源基因。图S3。靶向过表达的靶基因转录物TaNBP1和NtNRT2.2一个,TaNBP1转基因株系的转录本;b,NtNRT2.2转基因素中的转录物。WT,野生型。第1行至第7行,独立转基因系TaNBP1过度表达。NTNRT2.2-1至NTNRT2.2-6,独立线路NtNRT2.2过度表达。在一个,TaNBP1e转基因株系的表达水平由结构标准化Tatubulin记录。在b,NtNRT2.2转基因株系中的表达水平由结构归一化Nttubulin记录。内标内参基因的表达水平设为1。图S4。针对过表达差异AE基因的靶基因转录物一个,NtSOD1转基因株系的转录本;b,NtSOD2转基因株系的转录本;c,NtCAT1转基因株系的转录本;WT,野生型。AE基因在转基因株系中的表达水平由结构标准化Nttubulin表达水平设置为1的转录本。(医生162 kb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
刘志强,赵永强,王旭东。et al。TaNBP1,小麦的鸟嘌呤核苷酸结合亚基基因,是通过调节N采集和ROS稳态来调节N饥饿适应的调节。BMC植物杂志18,167(2018)。https://doi.org/10.1186/s12870-018-1374-6
收到了:
接受:
发表:
关键字
- 小麦(Triticum Aestivum.L.)
- 鸟嘌呤核苷酸结合蛋白亚基β
- G-蛋白质
- 基因表达
- n饥饿的压力
- 功能描述