抽象的
背景
植物花药发育是一个由基因精确控制的系统而复杂的过程。这一过程的调控基因及其调控机制尚不明确。与许多作物花药发育相关的mrna或mirna的研究相比,结合这两种组学的关联分析在棉花花药发育方面尚未见报道。
结果
本研究采用转录组关联分析和小RNA测序技术,对棉花花药发育的4个阶段,即孢子生殖细胞增殖期(SCP)、减数分裂期(MP)和花药发育的分子机制进行了研究。小孢子释放期(MRP)和花粉成熟期(PM)。分析表明,随着发育的进展,差异表达的基因越来越多地被招募。功能基因的表达在不同发育阶段有显著差异。与细胞周期、黄体酮介导的卵母细胞成熟和减数分裂相关的基因主要表达于花药发育早期(SCP和MP),以及与能量代谢、类黄酮生物合成、轴突引导和磷脂酶D信号通路主要富集于花药发育后期(MRP和PM)。表达模式分析显示,MP中差异表达基因数量最多,且差异表达基因的表达谱显著增加,提示MP在整个花药发育周期中具有重要意义。此外,miRNA靶基因的预测和分析表明miRNA在花药发育中起重要作用。miRNAs ghr-miR393、Dt_chr12_6065和At_chr9_3080分别通过靶基因参与细胞周期、碳水化合物代谢和生长素合成,实现花药发育的调控。
结论
通过对mRNA和miRNA的关联分析,我们的作品更好地了解棉花花药不同发育阶段的优先表达的基因和调节,以及MiRNA在这一过程的精确监管中的参与,其中对于澄清植物制剂的机制,以应对内部和外部环境的影响将是有价值的。
背景
棉(gossypium hirsutuml.)是由于其纤维作为全球纺织业的主要自然来源,是由于其纤维最具经济的重要作物之一。花的发展直接决定了棉花产量的形成。到目前为止,对雄性配子体的研究专注于模型植物,例如拟南芥,[1,2,3.]但是棉花上有较少的研究报告。尽管种植趋势的基本机制可以交叉,但每个物种都有自己的特殊性[4].花的发生到花粉粒成熟是一个系统而复杂的过程,涉及到大量基因的调控[5,6,7].据报道,涉及制剂发展的基因集中在调节淀粉和蔗糖代谢,碳水化合物代谢,抗氧化生产,黄酮类生物合成,细胞周期,减数分裂和植物激素途径[4,8,9].在花粉发育的早期阶段,大量的糖被引导到花药,以支持其发展[10].在花粉发育和成熟的晚期,淀粉是需要的能量储存,这有助于次级细胞壁增厚和花粉颗粒的肿胀,最终促进了花药的解除[5,11].因此,在该阶段的糖和淀粉合成,运输和代谢中的紊乱可能严重损害花粉发育,导致雄性不育[12].与野生型相比,雄性无菌突变体显示淀粉和蔗糖生产中的偏降[8,13].进一步调查显示基因,包括Ghck1,SnRK1己糖激酶和14-3-3蛋白基因参与淀粉生物合成中蔗糖的代谢。这些基因的差异表达会导致男性不育[9,13,14,15].线粒体、叶绿体和过氧化物酶体在能量代谢中起着重要作用,也是活性氧(ROS)产生的场所。已知花粉和绒毡层细胞含有大量线粒体,并在花粉发育过程中表现出高呼吸[16].黄酮类化合物是自由基清除剂,也是花粉外套的组分[17].在花药的发展期间,发现许多与槲皮素的生物合成相关的基因,表达比在其他组织中更高4].植物激素是重要的代谢调节剂,植物雄性不育的发生往往伴随着各生殖器官内源激素含量的变化[18].遗传是花形成的绝对条件[19]参与塔皮特和编程细胞死亡的发展[20.].花药中Ga的合成和积累主要由GA20ox和GA3OX1[21,22].差异表达GA20ox和GA3OX1通常会导致男性不育的发生[13,22].IAA是另一种调节植物生长发育的重要植物激素[23].花药中IAA含量低是导致雄性不育的主要原因,而IAA表达量低是导致雄性不育的主要原因ilr1.和吲哚-3-乙酸-Amido因此导致低水平的IAA [13].同样,高水平的IAA对花药的发展也有害,这可以增加诱导的花药比例[9].microRNA(miRNA)是一类内源性小调节性非编码RNA,其负调节通过降解靶mRNA或抑制基因翻译后转录后靶基因的表达[24].最近的研究表明,miRNAs参与了多种发育过程,包括种子萌发[25],根籍发展[26]和花器官特性[27].研究表明,MiR159通过靶基因参与了雄性配子体的发展DUO1[28[MiR159的过表达导致雄性不育[29].基因ARFS.在花卉发展中发挥重要作用[30.],棉花靶向miRNA160的过度表达可以诱导花药盲目[31].
到目前为止,通过分离的MiRNA和转录om的分离应用,少数关于花药开发的分子机制的研究[32,33]但尚未报告结合两个OMIC的关联分析。在我们的研究中,进行了四个连续发育阶段的棉花制剂中mRNA和miRNA的关联分析,并实现了对该过程的基因表达和调节的更好理解。
结果
花药发育不同阶段间的差异基因
通过对测序结果的统计分析,每个样本平均可以测得6.8 Gb的原始碱基数据,干净碱基的比例在95%以上。对棉花内参基因组的比较分析表明,平均干净reads的映射率为81.5%1:表S1)。样品之间的距离通过聚类方法计算,结果表明,两个生物重复在不同阶段优先聚集在一起的样本(附加文件2:图S1)。
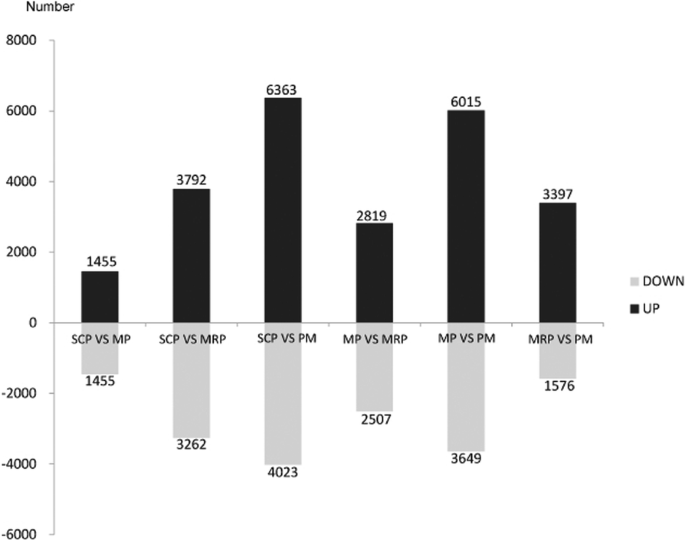
为鉴定花药发育过程中的差异表达基因,对4个连续发育阶段的差异表达基因(DEGs)进行了筛选,SCP与MP、MRP和PM相比,分别鉴定出2910、7054和10386个差异表达基因;MP与MRP和PM比较,分别筛选出5326个和9664个DEGs, MRP与PM比较得到4973个DEGs(图5)。1).结果表明,随着花药发育的进展,DEGs的数量逐渐增加,说明在不同的发育阶段有更多的特异性基因被招募,以保证花药的正常发育和成熟。
DEGS的功能分析
为了进一步了解Degs的功能,我们对基因和基因组(Kegg)富集分析进行了京都百科全书。分别用SCP作为对照和与MP,MRP和PM相比筛选的DEGS主要富集细胞周期,孕酮介导的卵母细胞成熟和减数分裂途径(图。2和附加文件3.:表S2)。这些途径是花药早期发展的必要条件。与MP与MRP和PM相比从MP获得的绝大多数DEG涉及能量代谢途径,例如淀粉和蔗糖代谢,戊糖和葡糖醛酸酯互联和糖酵解/葡糖生成途径(图。2 b和附加文件3.:表S2);MRP与PM之间的DEGs除黄酮类化合物生物合成、轴突引导和磷脂酶D信号通路外,主要富集于能量代谢途径(图1)。2C和附加文件3.:表S2)。
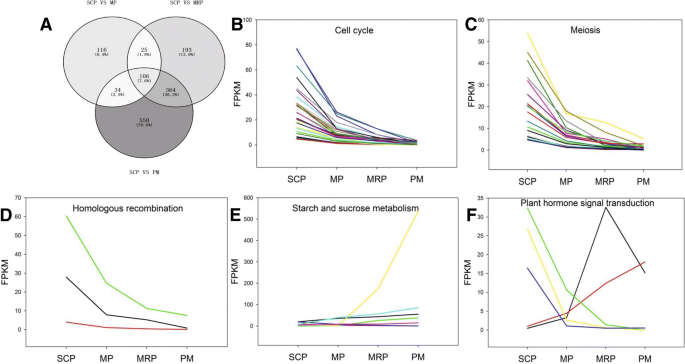
大约29条与花粉和花药发育有关的代谢和信号通路[4,34[如细胞周期,减数分裂,谷胱甘肽代谢和同源重组以进一步富集分析。在SCP与其他三个阶段之间的单独比较中的次数中,在上述29个途径中分别富集281,688和1054℃。三组DEG共用总共106个基因(图。3A和附加文件4:表S3),这些基因被聚集到11个途径中,例如细胞周期,减数分裂,淀粉和蔗糖新陈代谢等。富集最大数量的DEG的途径是细胞周期,其次分别具有30和18次的分裂。这表明细胞周期和减数分裂在整个花药开发过程中的重要性[1].在106℃中,富含细胞周期,同源重组,减数分裂,黄酮类生物合成和过氧式组织等途径中富集的基因的表达谱表现出下降趋势随着花药的发展(图。3B.,c和d;额外的文件4:表S3;额外的文件5:图S2)。虽然参与碳水化合物消化和吸收和淀粉和蔗糖代谢的基因显示出上下表达趋势(图。3E;额外的文件4:表S3;额外的文件5:图S2),用作花粉成熟度的标志物,为花粉发芽提供了能量储备[9,11].参与碳代谢和植物激素信号转导的基因没有一致的表达趋势(图。3F.和附加文件4:表S3)。
在花药开发期间,DEG的表达模式
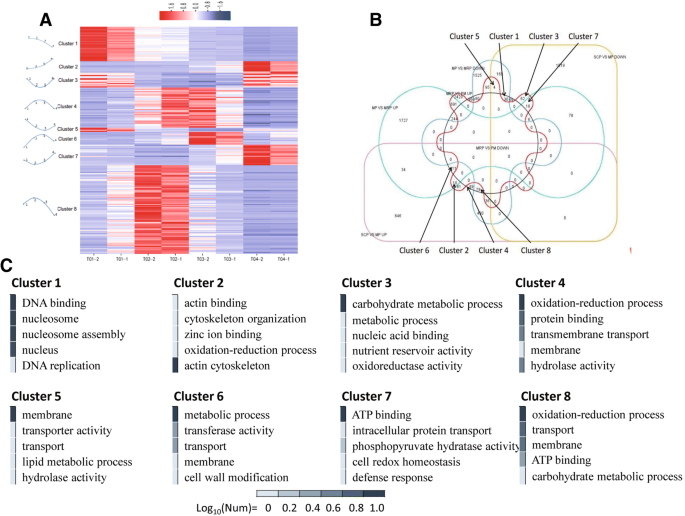
用SCP获得三组DEG作为对照,分别与MP,MRP和PM进行比较,分析八种主要表达模式(图。4A和b;额外的文件6:表S4).Cluster 8包括最大数量的基因(78个基因),然后是簇4(35)和簇1(30)。包含在簇8中的DEG的表达谱达到MP中的最高(图。4A和附加文件6:表S4),表明Meiosis通常进行并需要大量高表达的基因[35].基因本体学(GO)富集发现,富含氧化还原过程,运输,膜,碳水化合物代谢过程和ATP结合项(图。4C.).
在聚类4中,MP和MRP的基因表达量最高(图4)。4A和附加文件6:表S4),这与MP需要大量特定基因参与的事实一致。致富集结果与群体8和富含水解酶活性和蛋白质结合项的部分相同(图。4C.).聚类1中富集的DEGs在SCP中表达量最高,但随着花药发育,表达量逐渐降低(图1)。4A和附加文件6:表S4),GO注释表明,花粉母细胞的增殖是必需的与DNA结合,核心组装和DNA复制有关的这些基因(图。4C.).剩下的五种簇富含少数差异表达的基因,并且没有显着的富集。
麦克纳斯在花药期间的不同表达
通过在四个阶段深度测序花药样品,为每个样品获得平均21.1M清洁读数。获得的清洁读数与参考基因组对齐,发现平均对准率为93.86%(附加文件7:表S5)。在Mirbasa中,清洁读数是在mirbasa中的同源对准,同时,对未能进行同源性比较的读取进行了新的miRNA预测。发现从所有样品中检测到97个miRNA,其中分别包括56名已知的miRNA和41个新的miRNA。
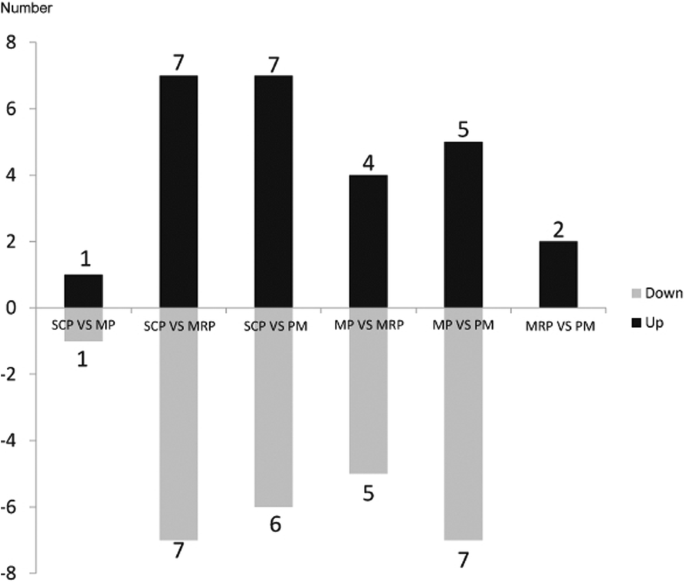
当SCP与MP,MRP和PM相比,分别获得2,14和13个差异表达的miRNA(图。5).这一趋势与DEG的数量类似,可能是因为涉及更多不同的基因参与了花药的调节,因此需要更多的miRNA来调节mRNA表达[32].当MP用作对照时并与MRP和PM相比,筛选出9和12个差异表达的miRNA(图。5)分别从MRP和PM之间的比较获得了两种差异表达MIRNA(图。5).
差异表达miRNA的靶基因预测
对不同表达mirna的靶基因在花药发育相关通路转录组测序和富集的同一阶段的DEGs中进行预测。在SCP和MRP的比较中,共有9个靶基因对7个mirna进行了预测。在SCP和PM的比较中,13个差异表达mirna中有8个预测了13个靶基因(附加文件8:表S6;额外的文件9:表S7)。然而,与SCP和MP相比,没有预测目标基因。
预测靶基因的Kegg浓缩分析发现,靶基因主要富集在细胞周期等途径,谷胱甘肽代谢和植物激素信号转导(附加文件10:图S3;额外的文件11:图S4),表明相应miRNA在花粉发育中的重要性[30.,36].GO聚类分析发现,靶基因主要聚在分子功能(MF)和生物过程(BP)上,少数聚在细胞成分(CC)上。
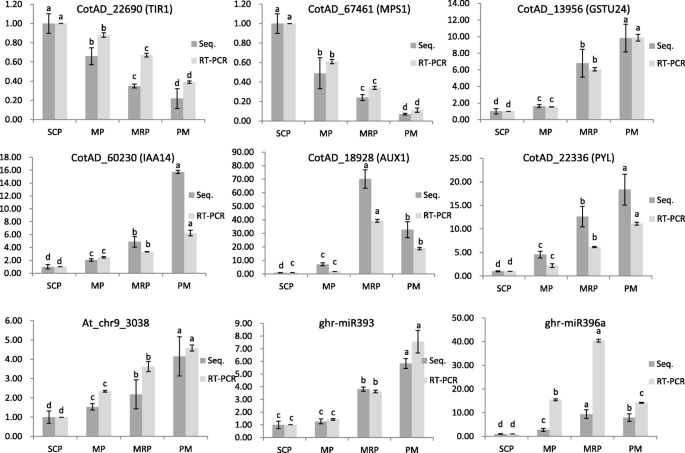
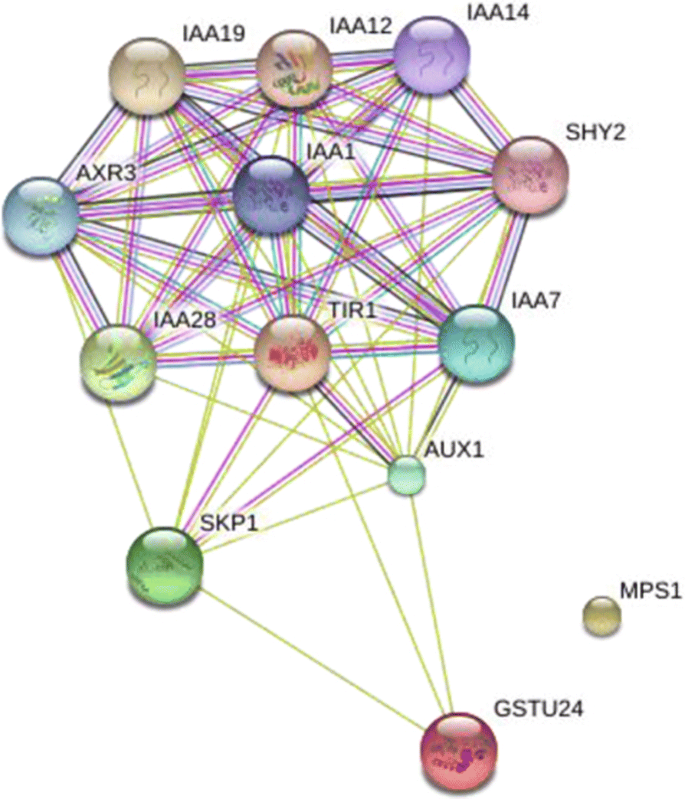
在预测的靶基因中,有3个共享靶基因,命名为CotAD_22690 (Tir1.),Cotad_67461(MPS1)和cotad_13956(GSTU24.),相应的miRNA分别为AT_CHR9_3038,GHR-MIR393和GHR-MIR396A。表达分析表明,所有三个miRNA和GSTU24.在整个过程中占据了调节,而且Tir1.和MPS1总是下调(图。6).用String网站预测这三种靶基因的相互作用(图。7).由于TIR1是生长素受体,介导Aux/IAA蛋白的蛋白酶体降解,已证实与多种IAA蛋白相互作用,但其与GSTU24的相互作用仍处于推测状态[37].MPS1与其他两种蛋白没有相互作用。
未发现其他基因在我们的转录组测序中表达,但是IAA14上调。IAA14在低毒素浓度下用作早期疾病响应的阻遏物[38]而TIR1促进IAA14的降解[31,39],这可以解释表达Tir1.表达的同时下降IAA14在花药开发期间增加。
讨论
制剂开发中的代谢和信号途径
四个阶段的比较分析表明,远程之间存在更多的次数(图。1),表明更多特定的基因开始参与调节,以及花药的过程[40,41.].
用SCP作为对照获得的DEGs的Kegg浓缩分析(图。2)结果表明,花药对以下分数的材料储备并确保了从SCP转变为MP。在MP的比较中作为控制(图。2 b)结果表明,花粉母细胞已达到或接近过分裂,并开始保留后续花粉成熟的材料和能量[8].在MRP和PM之间的比较中(图。2C),结果暗示,在花粉发育的后期,除了持续的能量物质保留之外,Micropores还为后续授粉和储备材料的施肥提供了基础[5,8,42.,43.].PM期黄酮类化合物不仅是花粉被皮的成分,而且是清除自由基的物质,因此,上调黄酮类化合物的生物合成有助于防止或减少花粉在授粉过程中遭受逆境环境,特别是非生物胁迫[44.].磷酸化信号有助于鉴定花粉颗粒和柱头[42.].轴突引导使花粉管向正确的方向生长,引导花粉管到达珍珠孔的位置,从而顺利完成受精过程[8,43.].
种植型开发期间的不同基因表达模式
DEGS表达分析表明,富集在细胞周期,同源重组和减数分裂等途径中的基因被下调(图。3b,c,d).在SCP中,这些基因是最高的表达,并且在PM中达到最低,表达趋势随着花药开发的过程逐渐减少,这表明三个途径在花药开发的早期阶段发挥了决定性作用和调节的重要性随着花药的发展逐渐减弱[1,45.].然而,富含淀粉和蔗糖代谢和碳水化合物消化和吸收途径的基因的表达随着花药的过程而增加(图。3E和附加文件5:图S2F),表明在较晚的花药阶段,能量代谢过程主要在MicroPerocyte中进行[5,46.].
在植物激素信号转导和碳代谢途径中富集的二烷基糖苷缺乏一致的表达谱。3F.和附加文件5:图S2E)。蟾蜍素合成基因的表达AUX1(CotAD_18928)从SCP到MP缓慢升高,在MRP中快速升高,在PM中快速下降(图1)。6).表达分析表明AUX1在MRP中发挥了至关重要的作用[9].然而,脱落酸合成基因塔(CotAD_22336)在整个花药发育过程中表达稳定上调。6).这些不同的表达式模式表明了塔可能发挥重要但不同的角色AUX1在整个花药期间发展[47.,48.].
Meiosis作为花粉开发过程中最重要的阶段
表达模式分析发现,群集8富集最多的末端,然后依次串联4和簇1(图。4A和附加文件6:表S4)。群集8和群集4位于减数分裂阶段,其中DEGS达到最高,表明涉及大量的特定基因,并存在基因调节的复杂性。因此,可以认为MP是整个花药发展期内最重要的阶段[35].在cluster 1中,SCP中DEGs最高,说明花粉母细胞的增殖也需要大量不同的基因参与。SCP作为MP的早期阶段,推测许多特异基因开始在花粉母细胞中表达,为接下来的减数分裂保留物质和能量,以保证减数分裂的顺利进行,促进花粉发育过程[1].该猜想可以从SCP作为对照确认,并分别与MP,MRP和PM相比,DEG在与卵母细胞的成熟和减数分裂相关的途径中。
富集分析显示,簇8中的含量主要富含氧化还原过程,运输,膜,碳水化合物代谢过程和ATP结合项(图。4C.).据推测,花粉母细胞需要获得大量物质以满足减数分裂过程。这样的过程是一种密集的ATP消耗和反应性氧(ROS) - 发霉种过程,导致花粉母细胞动员活性氧清除机制,以防止受氧化受损。在簇4中,在水解酶活性和蛋白质结合项中富集的一部分(图。4C.),调节主轴和细胞骨架重组的降解。在群体1中进行富集揭示了DNA结合,核心组装和DNA复制的富集,这与SCP通过丝分裂中的花粉母细胞的增殖一致(图。4C.).
参与调节种植的MiRNA
MiRNA对靶基因的调控主要是通过与靶基因的蛋白质编码区互补配对,切断靶基因或抑制靶基因的翻译来实现的[49.].
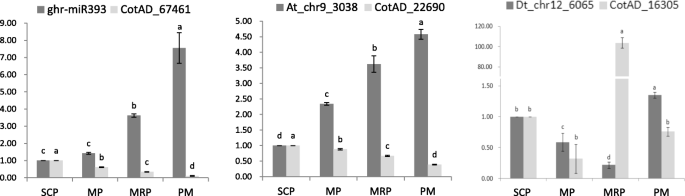
MPS1(COTAD_67461)调节在花药期间的细胞周期功能,受到基因表达的GHR-MIR393调节。这MPS1显示持续上调的表达,GHR-MIR393显示出相反的趋势(图。8).miRBase中的序列对准分析发现,ATH-MIR393和GHR-MIR393的序列之间存在一个基本差异。在拟南芥蒂利亚纳,mtir1.可以促进Ath-MiR393的表达,导致开花延迟[50.].miRNA Dt_chr12_6065与目的基因之间也存在相同的变化趋势PME40(Cotad_16305),该基因与淀粉和蔗糖代谢有关(图。8).生长素是花药发育所必需的。在不同发育阶段,花药对生长素浓度有严格的要求,生长素浓度过高或过低都可能导致花药发育异常。研究表明,生长素浓度过低会导致雄性不育[51.],而过量浓度的养肝浓度会导致花药,影响授粉和施肥过程[31].
助长信号传导主要依赖于TiR1 / AFB2 AUXIN受体(TAAR)疏松素的四个部分冗余的F箱蛋白,以引发Aux / IAA转录阻遏物的降解[52.].Tir1.是At_chr9_3038的目的基因(At_chr9_3038的序列与atha - mir393相同),At_chr9_3038的表达随花药发育过程逐渐增加,与Tir1.(图。8),表明在花药发育早期,需要较高浓度的生长素,随着花药发育,生长素浓度逐渐降低[51.].
IAA14抑制毒素响应基因的表达[31].在我们的研究中,表达剖析IAA14与At_chr9_3038相似。6),在花药发育后期表现出逐渐增加的抑制作用。推测在花药发育过程中,通过多种协调调控方式来调控生长素的浓度,以达到花药发育不同阶段生长素的适宜浓度[31,53.,54.].
由于mirna的稳定性和保守性,通过实时定量RT-PCR,筛选出3种可用于花药发育阶段判断的mirna。的发展棉花花药,表达量的顺序ghr-miR396a > Dt_chr7_8575 > ghr-miR2948-5p SCP, Dt_chr7_8575 > ghr-miR396a > ghr-miR2948-5p议员,ghr-miR2948-5p > Dt_chr7_8575 > ghr-miR396a在MRP和Dt_chr7_8575 > ghr-miR2948-5p > ghr-miR396a点(额外的文件12:图S5)。这三个mirna的相对表达量为棉花花药分期分裂提供了新的方法,也为不同时期的花药分期分裂提供了分子基础,但其原因和机制有待进一步研究。
结论
本研究结果表明,不同的基因参与了花药不同发育阶段的调控,同时也促进了花药的发育。基因表达谱分析提示减数分裂在整个花药发育过程中起重要作用,这一结论可以解释MP最易受环境影响,导致雄性不育的发生。通过对miRNA靶基因的预测,发现miRNA参与了花药发育的调控。特别是在棉花花药发育过程中植物激素生长素的精确调控中,miRNAs发挥着非常重要的作用。研究结果将加深对棉花花药发育过程中基因表达调控的理解,为阐明植物花药发育对内外环境的响应机制提供参考。
方法
植物材料
山地棉的遗传标准线种植在湖南农业大学的实验领域[55.].根据我们之前的研究[56.[分别在峰开花时期,分别收获疗养细胞增殖(SCP),减数分电相(MP),微孔释放时期(MRP)和花粉成熟(PM)四个阶段芽。花药在四个阶段从芽中收集,然后储存在用于转录组和小RNA测序的冰箱。四个阶段的芽,雄蕊和花药尺寸在附加档案中显示13:图S6A,S6B和S6C,在光学显微镜下确认了蜂窝状态的每个阶段(附加文件13:图S6D)。
RNA提取和测序
每个时期收集二十个芽以分离花药组织。根据制造商的规格,使用Trizol Reagent Kit(Invitrogen,Carlsbad,CA)从分离的分离的花青中提取来自每个样品的大约20μg的总RNA。使用NanoDrop 2100分光光度计(Thermo Sciencific,USA)测定RNA的产率,并使用用溴化乙锭染色的琼脂糖凝胶电泳评估完整性。通过涂覆有寡核苷酸(DT)的磁珠富集MRNA,然后通过超声将随机碎裂。使用MRNA片段,第一和第二链CDNA用六碱基引物合成。修复双链CDNA并连接到测序头。对总RNA进行凝胶电泳;回收具有一定尺寸的片段,并加入3'和5'-末端接头;采用Illumina Hiseq 2500的平台进行了小的RNA测序(转录组和小RNA测序均由OE Biotech公司(上海)进行。序列数据沉积在NCBI序列读取存档(SRA,http://www.ncbi.nlm.nih.gov/traces/sra.),注册号为SRP143909。
数据分析
在每个阶段进行两次生物重复,分别被命名为TC1-1和TC1-2(SCP),TC2-1和TC2-2(MP),TC3-1和TC3-2(MRP),TC4-1和TC4-2(PM)。高地棉花的参考基因组和转录组合链ftp://public.genomics.org.cn/bgi/cotton/gossypium_hirsutum/gossypium_hirsutum_v1.0.gz..对棉花洁净碱基的内参基因组进行了比较分析[57.].计算基因表达,随后标准化为RPKM [58.].差分mRNA和差异微小RNA(miRNA)的均匀筛选条件是p < =0.05, and fold change > 2 or fold change < 0.5. The Bowtie software is adopted to compare the sequence obtained by sequencing with the miRNA mature body sequence in miRBase, which is considered to be a known miRNA [59.].结合棉花和RNA二级结构预测软件的同源miRNA序列,如RNA折叠,采用MIDDeep2软件来预测新的成熟体。筛选的差异表达基因进行了GO和KEGG分析[60.].采用K-means聚类算法分析表达式模式和在线预测网站(http://plantgrn.noble.org/psrnatarget/)用于进行靶基因预测,预测参数:最大熵= 4.0;目标访问性= 50.字符串网站(https://字符串。embl.de/)用于预测蛋白质相互作用。
实时定量RT-PCR
测序的残留RNA用于实时定量RT-PCR。底漆对(附加文件14:用于实时定量RT-PCR的表S8)使用Roche LCPDS2软件设计,并由Generay Biotech(Generay,PRC)合成。
MRNA实时定量RT-PCR方法是根据之前的研究[61.].这microRNA.s quantification was performed with a two-step reaction process: reverse transcription (RT) and PCR. Each RT reaction consisted of 0.5 μg RNA, 2 μl of miScript HiSpec Buffer, 1 μl of Nucleics Mix and 0.5 μl of miScript Reverse Transcriptase Mix (Qiagen, Germany), in a total volume of 10 μl. Reactions were performed in a GeneAmp® PCR System 9700 (Applied Biosystems, USA) for 60 min at 37 °C, followed by heat inactivation of RT for 5 min at 95 °C. The 10 μl RT reaction mix was then diluted × 10 in nuclease-free water and held at − 20 °C. Real-time PCR was performed using LightCycler® 480 II Real-time PCR Instrument (Roche, Swiss) with 10 μl PCR reaction mixture that included 1 μl of cDNA, 5 μl of 2 × QuantiFast® SYBR® Green PCR Master Mix (Qiagen, Germany), 0.2 μl of universal primer (Qiagen, Germany), 0.2 μl of microRNA-specific primer and 3.6 μl of nuclease-free water. Reactions were incubated in a 384-well optical plate (Roche, Swiss) at 95 °C for 5 min, followed by 40 cycles of 95 °C for 10 s, 60 °C for 30 s. Each sample was run in triplicate for analysis. At the end of the PCR cycles, melting curve analysis was performed to validate the specific generation of the expected PCR product.
MRNA和MIRNA的表达水平标准化为施(nm_001327051.1)和5.8s.基因分别。使用2计算表达素数量——ΔΔCtmethd [62.].
缩写
- DEG:
-
差异表达基因
- 走:
-
基因本体论
- Kegg:
-
Kyoto基因和基因组的百科全书
- MP:
-
减数分裂阶段
- MRP:
-
微孔释放期
- 下午:
-
花粉成熟
- ROS:
-
活性氧
- SCP:
-
疗养细胞增殖
参考
- 1.
十年的花粉转录组学研究。植物天线转换开关。2015;28(2):73 - 89。
- 2.
GUO SY,SUN B,LOOI LS,XU YF,GAN ES,Huang JB,ITO T.通过两种模型物种中的表观遗传调节进行花卉发展的协调:米饭和拟南芥.植物生理学杂志。2015;56(5):830-42。
- 3.
山东,康俊,赵马,葵杰克,崔鹤,裴耶,李哈,joung yh,choi d,kang bc。番茄雄性无菌1035对于花药中的花粉发育和减数分子至关重要。J Exp Bot。2014; 65(22):6693-709。
- 4.
马耶,魏HL,歌曲MZ,彭迪,刘j,王l,张jf,风扇sl,yu sx。转录组分析分析表明,黄酮类化合物和抗坏血酸酯 - 谷胱甘肽循环在旱地棉花的种植干燥过程中是重要的。Plos一个。2012; 7(11):E49244。
- 5。
[10]杨春华,宋建平。花药开裂的调控机制。植物生理学通讯,1995,15(3):461 - 468。实验机器人。2011;62(5):1633-49。
- 6。
GómezJF,Talle B,Wilson Za。花药和花粉发育:保守的发展途径。J Intent Plant Biol。2015; 57(11):876-91。
- 7。
MA J,Skibbe DS,Fernandes J,Walbot V.男性生殖发展:玉米花药和花粉的基因表达谱。基因组Biol。2008; 9(12):R181。
- 8。
魏m,歌曲mz,风扇sl,yu sx。数字基因表达分析在遗传性雄性无菌和野生型棉花种植型差异表达基因的转录组分析。BMC基因组学。2013; 14:97。
- 9。
闵璐,李云英,胡强,朱立芬,高文华,吴亚龙,丁玉华,刘思敏,杨晓阳,张小龙。棉花花药发育过程中糖和生长素信号通路对高温胁迫的响应植物杂志。2014;164(3):1293 - 308。
- 10。
Oliver Sn,Van Djt,Alfred Sc,Mamun EA,Zhao X,Saini HS,Fernandes SF,Bianchard Ci,Sutton BG,Geigenberger P,Dennis ES,Dolferus R.冷诱导抑制水稻特异性细胞壁转化酶基因osinv4与蔗糖积聚和花粉无菌相关。植物细胞环境。2005; 28:1534-51。
- 11.
Datta R,Chamusco KC,Chourey PS。花粉成熟期间的淀粉生物合成与玉米中的基因表达的改变模式相关。植物理性。2002; 130(4):1645-56。
- 12.
Mamun EA, Alfred S, Cantrill LC, Overall RL, Sutton BG。低温对水稻雄配子体发育的影响。细胞生物学杂志。2006;30(7):583-91。
- 13.
方无效,赵飞,孙y,谢迪,太阳l,徐zz,zhu w,yang lr,zhao ym,lv sp,唐zj,nie lh,li w,hou jn,duan zz,yu yb,yang xj.转录组分析揭示了棉基因雄性无菌突变体YU98-8A中的复杂分子调控。Plos一个。2015; 10(9):E0133425。
- 14.
张义,休克里,琼斯H,巴塞罗P,Lazzeri Pa,Halford NG。反义SNRK1蛋白激酶序列的表达导致转基因大麦的异常花粉发育和雄性不育。工厂J. 2001; 28(4):431-41。
- 15.
Min L,Zhu L,Tu L,Deng F,Yuan D,Zhang X. Cotton Ghcki通过灭活淀粉合酶延迟Tapetum编程细胞死亡来破坏正常的男性繁殖。工厂J. 2013; 75(5):823-35。
- 16。
Selinski J,Scheibe R.花粉管的增长:能量来自哪里?植物信号表现。2014; 9(12):E977200。
- 17。
Hsieh K,Huang AHC。铜叶片中的绦虫聚蓟体积聚内质网衍生的黄酮类化合物和烷烃,用于递送给花粉表面。植物细胞。2007; 19(2):582-96。
- 18。
Shukla A, Sawhney VK。脱落酸:影响水稻雄性不育的因素之一芸苔Canapus..physiol植物。1994年; 91:522-8。
- 19。
King RW, Moritz T, Evans LT, Martin J, Andersen CH, Blundell C, Kardailsky L, Chandler PM。赤霉素和开花位点T基因对长日照黑麦草开花的调控。植物杂志。2006;141(2):498 - 507。
- 20。
Aya K,Ueguchi-Tanaka M,Kondo M,Hamada K,Yano K,Nishimura M,Matsuoka M.Gibberellin通过GamyB的转录调节调节水稻的花药发育。植物细胞。2009; 21(5):1453-72。
- 21。
Lee DJ,Zeevaart Jad。通过光周期调节菠菜中的嗜酸甘油蛋白20-氧化酶1。Planta。2007; 226(1):35-44。
- 22。
Sakata T,ODA S,Tsunaga Y,Shomura H,Kawagishi-Kobayashi M,Aya K,Saeki K,Endo T,Nagano K,Kojima M,Sakakibara H,Watanabe M,Matsuoka M,Higashitani A.低温降低了吉布林素扰乱水稻的花粉发育。植物理性。2014; 164(4):2011-9。
- 23。
赵艳生物合成及其在植物开发中的作用。Annu Rev植物Biol。2010; 61:49-64。
- 24.
植物中microrna及其调控的研究进展。植物生物学杂志,2006;57:19-53。
- 25.
Reyes JL,Chua NH。ABA诱导MIR159控制了两种MYB因子的转录水平拟南芥种子萌发。工厂J. 2007; 49(4):592-606。
- 26.
关键词:不定根,生根,表型可塑性拟南芥受生长素反应因子转录和microRNA丰度的复杂调控。植物细胞。2009;21(10):3119 - 32。
- 27。
Millar AA, Gubler F. The拟南芥GamyB类似的基因,MyB33和MyB65是MicroRNA调节基因,其冗余促进了花药的发展。植物细胞。2005; 17(3):705-21。
- 28。
后期促进复合物是一种双重整合因子,它既调控microrna介导的细胞周期蛋白B1的转录调控,也调控细胞周期蛋白B1的降解拟南芥雄配子体发育。植物细胞。2011;23(3):1033 - 46。
- 29。
Achard P, Herr A, baucombe DC, Harberd NP。赤霉素调控的microRNA调控花的发育。发展。2004;131(14):3357 - 65。
- 30.
杨晓军,赵永明,谢大勇,孙勇,朱晓林,esmaili N,杨志荣,王勇,吕世平,聂丽华,唐志军,赵发,李伟,Mishra N,孙林,朱伟,方永平。棉花核不育系育98- 8a花药发育相关microrna的鉴定与功能分析中国生物医学工程学报,2016;
- 31。
丁y,ma y,liu j,xu j,胡q,李伊,吴yl,谢s,zhu lf,min l,张xl。CircRNAS参与养肝信号传导调节棉花高温胁迫下的雄性不育(gossypium hirsutum).工厂j . 2017, 91(6): 977 - 94。
- 32。
Seifert F,Bossow S,Kumlehn J,Gnad H,Scholten S.使用高度响应品种“Svilena”的转录组和小RNA测序的小麦微孔胚胎发生分析。BMC植物BIOL。2016; 16:97。
- 33。
关键词:小白菜,花粉败育,mirna,转录组,高通量测序植物科学与技术,2015;
- 34。
刘俊,彭迪,魏HL,宋mz,孟yy,ma jh,风扇sl,yu sx。ITRAQ促进了来自光敏雄性无菌突变体和野生型棉花的花药蛋白质组学分析(gossypium hirsutumL.)。J.蛋白质组学。2015; 126:68-81。
- 35。
Jin L, Neiman AM。芽殖酵母减数分裂的转录后调控。咕咕叫麝猫。2016;62(2):313 - 5。
- 36.
张D,杨L.花药内绦虫和幼儿孢子状细胞的规范。CurrOp植物BIOL。2014; 17:49-55。
- 37.
苏y,罗w,陈x,柳h,胡y,林w,xiao l.植物素萃取和纯化基于重组辅助/ IAA蛋白。在线BIOL程序。2017; 19:1。
- 38.
Kepinski S,Leyser O.植物素诱导的SCFTIR1-AUX / IAA交互涉及SCFTIR1复合物的稳定修改。Proc Natl Acad SCI U S A. 2004; 101(33):12381-6。
- 39。
Q&A:生长素:几乎能影响任何东西的植物分子。BMC医学杂志。2016;14(1):67。
- 40.
Concocal显微镜在花粉发育过程中雄性种系中荧光报告活性的Twell D,Brownfield L.方法Mol Biol。2017; 1669:67-75。
- 41.
开花植物雄性配子体发生与种系规范。《植物性繁殖》2011;24(2):149-60。
- 42。
EM勋爵,罗素·SD。植物授粉和受精的机制。《细胞发展生物学》2002;18:81-105。
- 43。
Gilles Lm,Khaled A,Laffaire JB,Chaignon S,Gendroot G,Laplaige J,BergèsH,Beydon G,Bayle V,Bartet P,Comadran J,Martinant JP,Rogowsky PM,Widiez T.丧失花粉特异性磷脂酶的丧失不喜欢爸爸在玉米中触发血管生殖。Embo J. 2017; 36(6):707-17。
- 44。
关键词:糖基转移酶UGT76E11,非生物胁迫,异位表达拟南芥.植物医学杂志。2017;20(1):9。
- 45。
关键词:水稻,花药发育,细胞学分析,遗传控制基因组学杂志。2011;38(9):379-90。
- 46。
Hirose T,Hashida Y,Aoki N,Okamura M,Yonekura M,Ohto C,Terao T,Ohsugi R.分析水稻蔗糖磷酸合酶基因的基因破碎突变体,表现出花粉萌发中蔗糖合成的重要性.植物SCI。2014; 225:102-6。
- 47。
风暴ND,GEELEN D.环境压力对植物雄性生殖发育的影响:生物过程和分子机制。植物细胞环境。2014; 37(1):1-18。
- 48.
王CS,HSU SW,HSU YF。新的洞察解相关基因调节Lilium Longiflorum.在花粉成熟和转基因过程中发生ASR拟南芥.细胞生物学,2013;301:37-94。
- 49.
Khraiwesh B,朱杰,朱耶。miRNA和siRNA在生物和非生物应激反应中的作用。Biochim Biophys Acta。2011; 1819(2):137-48。
- 50。
陈zh,宝ml,孙yz,杨yj,xu xh,王jh,韩n,bian hw,zhu我。MiR393靶向运输抑制剂反应蛋白1的植物素响应调节涉及正常发展拟南芥.中国生物医学工程学报,2011;
- 51。
程毅,戴Xh,赵yd。Yucca Flavin单氧基酶的植物素生物合成对照组的形成和血管组织拟南芥.基因开发。2006; 20(13):1790-9。
- 52.
Windels D,Bielewicz D,Ebneter M,Jarmolowski A,Szweykowska-Kulinska Z,Vazquez F. MiR393需要生产适当的助长信号输出输出。Plos一个。2014; 9(4):E95972。
- 53.
Baranwal vk,Negi N,Khurana P.桑树响应因子基因在桑树中曲目:鉴定,结构,功能性和进化分析。基因(巴塞尔)。2017; 8(9):202。
- 54。
闫Z,刘X,Ljung K,Li S,Zhao W,Yang F,Wang M,Tao Y. B型反应调节器作为中央集成剂在蟾蜍素生物合成酶Ta1的转录控制中的中央积分器。植物理性。2017; 175(3):1438-54。
- 55。
张新文,叶志伟,王tk,熊海荣,袁小龙,张志国,袁亚利,刘卓棉花全局转录组特性研究(gossypium hirsutum l。)花药和SSR标记的开发。基因。2014;551(2):206 - 13所示。
- 56。
[15]邓建民,熊广生,袁玉玲,贾峰,刘忠。不同耐高温性棉花花期SOD、POD、CAT活性和MDA含量的差异及其对高温胁迫的响应。中国棉花学报,2011,30(1):1 - 5。棉花科学。2010;22(3):242 - 7。
- 57。
Kim D,Langmead B,Salzberg SL。Hisat:一种快速拼接对齐器,内存要求低。NAT方法。2015; 12(4):357-60。
- 58。
Morrissy As,Morin Rd,Delaney A,Zeng T,McDonald H,Jones S,Zhao Y,Hirst M,Marra Ma。用于癌症基因表达分析的下一代标签测序。Genome Res。2009; 19:1825-35。
- 59。
Langmead B, Salzberg SL.快速缺口读对齐与领结2。Nat方法。2012;9(4):357 - 9。
- 60.
Kanehisa M, Araki M, Goto S. KEGG将基因组与生命和环境联系起来。中国生物医学工程学报2008;36:28 - 38。
- 61。
关键词:SET结构域蛋白,聚类,聚类分析,聚类分析Gossypium raimondii.以及它们对高温胁迫的反应。Sci众议员2016;6:32729。
- 62。
Livak KJ,Schmittgen TD。使用实时定量PCR和2分析相对基因表达数据-△△CT方法。方法。2001; 25(4):402-8。
致谢
我们感谢Wenkai Ren博士进行批判性阅读和编辑手稿。
资金
该工作得到了中国国家自然科学基金(第31771847和U1403284)的支持,以及湖南省研究生研究创新项目(CX2017B360)。资助者在研究设计,数据收集和分析中没有作用,决定发布或准备稿件。
数据和材料的可用性
排序数据寄存在NCBI序列读取档案中(SRA,http://www.ncbi.nlm.nih.gov/traces/sra.),注册号为SRP143909。
作者信息
隶属关系
贡献
JC和ZL构思、组织、策划了此次调研。JC和PS起草了手稿。JC, PC和QL分析转录组和microRNA测序数据。ZL和XY修改了原稿。所有作者阅读并批准最终稿件。
通讯作者
道德声明
伦理批准并同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
出版商的注意
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
附加文件
附加文件1:
表S1。转录组测序的数据统计。(XLSX 11 kb)
额外的文件2:
图S1。采样到样本聚类。(PDF 9 KB)
附加文件3:
表S2。差异表达基因KEGG富集TOP10。(XLSX 21 kb)
附加文件4:
表S3。代谢和信号通路基因表达水平。(XLSX 13 KB)
额外的文件5:
图S2。植物发育期间与代谢和信号途径相关的基因的表达谱。(PDF 221 KB)
附加文件6:
表S4。差异表达的基因。(XLSX 31 kb)
附加文件7:
表S5。microRNA测序数据统计。(XLSX 11 kb)
额外的文件8:
表S6。差异表达miRNA的靶基因预测,SCP和MRP之间的靶基因与Kegg富集的靶基因。(XLSX 11 kb)
额外的文件9:
表S7。SCP和PM差异表达mirna的靶基因预测和靶基因KEGG富集。(XLSX 11 kb)
额外的文件10:
图S3。靶基因富集和聚类分析。- 答:Kegg富集MiRNA,在SCP和MRP之间差异表达,靶基因;B:miRNA靶基因的表达谱;C:致靶基因的富集(BP:生物学过程; CC:细胞组分; MF:分子函数)。(PDF 429 KB)
额外的文件11:
图S4。靶基因富集和聚类分析。- 答:Kegg富集MiRNA,在SCP和PM之间差异表达,靶基因;B:miRNA靶基因的表达谱。C:致靶基因的富集(BP:生物学过程; CC:细胞组分; MF:分子函数)。(PDF 501 KB)
附加文件12:
图S5。根据通过实时定量RT-PCR确认的表达关系,使用三个miRNA用于判断花药开发期。表达量的顺序是SCP,DT_CHR7_8575> GHR-MIR2948-5P> MP,MP,MGP中的GHR-MIR3948-5P> DT_CHR7_8575> MGP中的GHR-MIR396A和DT_CHR7_8575 > ghr-miR2948-5p > ghr-miR396a in PM. (PDF 67 kb)
额外的文件13:
图S6。棉花花粉发育的四个阶段。棉芽和花药大小分别发生在孢子形成细胞增殖期(SCP)、减数分裂期(MP)、小孢子释放期(MRP)和花粉成熟期(PM)四个连续阶段。答:芽;B:雄蕊;C:花药;D:光学显微镜下的花粉细胞状态(乙胭脂染色)。(PDF 165 kb)
附加文件14:
表S8。引物在实时QRT-PCR中列出。(XLSX 11 kb)
权利和权限
开放获取本文在知识共享归属4.0国际许可条款下发布(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
陈,J.,Su,P.,陈,P。et al。通过转录组学和小RNA测序的关联分析,深入了解棉花花药发育。BMC植物BIOL.18,154(2018)。https://doi.org/10.1186/s12870-018-1376-4
已收到:
接受:
发表:
关键词
- 棉花
- 转录组
- microRNA.
- 花药开发
- 基因表达调节