摘要
背景
通过移动气孔开口和初级CO,Crassulacean酸代谢(CAM)植物使用20-80%的水20-80%2吸收和固定到夜间。蛋白激酶(PKS)在该生物过程中起枢轴作用。然而,由于其丰富和潜在的功能冗余(由众多基因重复引起),很少有几个PKS精确地分析。
结果
在本研究中,我们系统地鉴定了CAM植物凤梨(菠萝comosus).基于激酶结构域序列,菠萝Kinome被分为20组和116个家族。RLK是包含480名成员的最大组,预计其中一半以上以定位在质膜。基于同时性分析,分段和串联重复措施都对菠萝Kinome的扩展作出了重要贡献。Ka / Ks结果表明,所有的重复事件均处于纯化选择中。整体表达分析表明,菠萝PKs表现出不同的组织特异性和日表达模式。聚类中40个PK基因在叶尖的表达量高于白叶基,其中14个基因在光合叶尖和非光合白叶基组织中表达差异较大。
结论
该研究结果为进一步研究菠萝PKs在CAM植物中的功能奠定了基础。该基因的复制、表达和共表达分析帮助我们快速识别菠萝kinome中可能在菠萝碳固定过程中起作用的关键候选基因,并有助于将CAM途径导入C3作物以提高其抗旱性。
背景
凸轮植物如菠萝,龙舌兰和Kalanchoe可以通过减少日间的透析水分损失,提高水利用效率(WUE)[1].这些植物转移部分或全部二氧化碳(CO2)气孔开放时磷酸烯醇丙酮酸羧化酶(PEPC)催化的暗期固定[2,3.].控制夜间气孔开口和碳固定可以帮助Cam植物具有比C3甚至C4植物更高的WUE,以适应干旱环境。凸轮植物仅使用C3植物消耗的第六次含水量,以及C4植物消耗的四分之一的水[1].为了满足全球人口对粮食的需求,提高作物水分利用效率成为应对干旱的重要策略。因此,了解CAM的光合作用,有助于充分阐明CAM的机理,有助于将CAM策略应用于作物的环境适应和作物生产中。CAM植物分布在植物的400多个属中,所有CAM途径中的酶都能在C3植物中找到,说明CAM是从C3祖先进化而来的[1].然而,C3祖先出现后的具体差异仍不清楚[1].
在CAM中发挥关键作用的蛋白质组之一是蛋白激酶(PKs),它通过磷酸化调节下游靶蛋白的活动[4].PKs通常具有一个保守的催化结构域,由250 - 300个氨基酸残基组成[5].汉克斯和亨特[6首先基于催化域的系统发育分析来函数分类真核pKS。Lehti-shiu和shiu [7通过比较植物激酶结构域序列,将25种植物的激酶超科植物激酶组划分为不同的类群。植物基因体通常大于动物基因体[7].鉴定了超过1000,1500和2000个激酶拟南芥,分别是大米和大豆[8,9,10],而人类基因组中只有大约500个PKs [11].rlk / pelle是土地植物Kinomes中最大的群体[12,例如,超过600拟南芥激酶组(8,13].然而,在人类激酶组中只有四种白介素受体相关激酶(IRAKs)存在,它们与植物RLK/Pelle最密切相关[12].RLK/Pelle集团的大规模扩张被认为对kinome工厂的大规模规模做出了主要贡献[7].植物PK系列的扩张可能是由于最近的重复和分歧事件,包括全基因组,节段性和串联重复[7,10,14].
磷酸化是一种常见的翻译后修饰,用于调节酶活性、蛋白质稳定性和蛋白质相互作用[15].的PK已记录在案,在调节植物生长发育,代谢过程,细胞周期的重要作用,和应对生物和非生物胁迫[7,16].磷酸烯醇丙酮酸羧化酶激酶(PPCK)通过磷酸化调控磷酸烯醇丙酮酸羧化酶(PEPC)活性,在初级CO中起核心作用2固定在凸轮植物中[1,3.].然而,仍然很大程度上缺乏与凸轮途径中碳固定相关的磷酸化过程的研究仍然缺乏[1].
利用已发布的菠萝全基因组序列和广泛的转录组数据(菠萝comosus),一种重要的热带多年生CAM单子叶水果作物[3.,17,它使我们能够完全描述整个菠萝PKs(一种CAM植物kinome)及其组织特异性和时间表达模式。植物PK基因的精确注释是充分了解其在植物发育和环境胁迫响应中的作用的第一步[18,19,20.].
在这项研究中,我们确定了整个菠萝PKS,并基于其激酶结构域序列分为组和家庭。还分析了序列特征和扩展机制。此外,用它们的共表达关系评价菠萝PKS的组织特异性和昼夜表达模式。我们的结果提供了菠萝Kinome的全球视野,以及在这一重要的热带水果作物中进一步系统地表征CAM途径的基础。
结果
菠萝蛋白激酶的基因组鉴定和分类
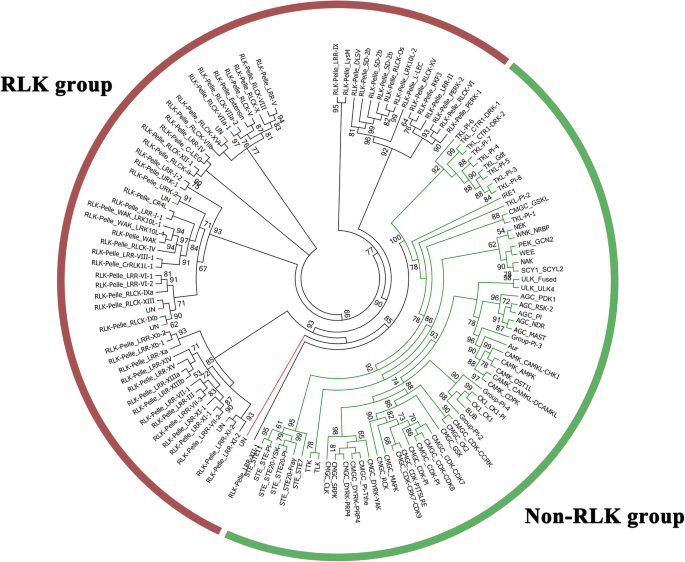
鉴定了总共758个菠萝激酶蛋白(附加文件1:表S1)。对758个PKs进行了HMM搜索,结果显示,758个基因中有7个与HMM搜索结果不同(补充文件)2:图S1)由系统发育分析检查后。这些PK基因与任何其他已知家族的任何组聚集,因此放置在未分类的组中(附加文件1:表S2)。其余751例PKs分为20组116个科(附加文件)1表S3,图1).RLK成员(480)代表总数的一半以上,构成了菠萝激酶组最大的集团,这可以进一步分为55的家庭。其他6个主要组包括AGC(23)、CAMK(57)、CK1(15)、CMGC(67)、STE(28)和TKL(48)。116个激酶家族中,33个家族仅包含1个成员,RLK-Pelle_DLSV家族是最大的家族,共包含41个成员。
菠萝PK家族的分类及系统发育分析。最大似然树由激酶结构域的氨基酸序列使用FastTree构建。树枝被涂上颜色来代表两个不同的组。非rlk组用绿色分支标记;RLK组用红色分支标记。详细的系统发育情况见附加文件2S1:图
菠萝PKs的内含子数目、染色体位置、保守结构域和亚细胞定位
通过对758个PK基因进行家族分类,确定不同家族成员的相关基因结构,了解菠萝PK基因的结构多样性。菠萝PK基因内含子数量(附加文件1表S2)的变化很大,从0到67不等。Aco006620(RLK-PELLE_DLSV)包含最多的内含子。大多数PK基因含有至少一个内含子,在菠萝Kinome中仅发现72个内基因,并且156个PK基因包含超过10个内含子(附加文件1:表S2)。在家庭级别中,RLK-PELLE_LRR-VII-1中的成员,RLK-PELLE_LRR-XB-1,RLK-PELLE_RLCK-X,RLK-PELLE_RLCK-XIII,RLK-PELLE_URK-1和TKL-PL-7包含相同内含子的数量。然而,其他一些家庭的内含子数量高度变化。例如,Camk_Camkl-Chk1家族中的12个基因含有少于三个每种内含子,而剩余的七个家庭成员中的每一个含有12至15个内含子。系统发育树还透露,Camk_Camkl-CHK1家族也可以与内含子号码分为两种群集(附加文件2图S1),富内含子簇(每个基因有8个内含子)和少内含子簇(每个基因< 3个内含子),表明外显子/内含子的分布模式似乎与该家族的进化有关(附加文件1:表S2)。
758个菠萝PK基因中,除43个基因仍在支架中外,其余715个PK基因均被定位到25条菠萝染色体上(附文件)3.:图S2)。染色体的位置分布不均匀。5号染色体包含55个菠萝PK基因,1号染色体53个,24号染色体仅包含4个菠萝PK基因。其他染色体均包含15个以上的PK基因。
基因产品的亚细胞位置信息可用于预测功能。由于菠萝PK基因的亚细胞定位仍然很大程度上是未知的,因此我们预测了具有大提琴和定位器的PKS的亚细胞定位(附加文件1:表S2)。根据大提琴的结果,约38% (287/758)PKs预测定位于质膜,超过一半的RLK成员(277/480)预测定位于质膜(附加文件)3.:图S3)。AGC和STE组中约70%的成员定位于核。67%CAMK组成员预计局部地定位于细胞质,53%CK1组成员分别定位于线粒体。大部分CMGC和TKL组成员局限于细胞核或细胞质。本地化器的亚细胞定位结果总结了43.1%的PKS位于没有过境肽的核中,分别在叶绿体和线粒体中定位51和69(附加文件1:表S2)。在非RLK组中,将60.4%的PKS定位于细胞核。然而,RLK组中的48.1%的基因局部局限于细胞核。
对PFAM数据库进一步检测菠萝PKS中的保守域。完全377 pks只有一个激酶催化结构域。在AGC(82.61%),Camk(68.42%),RLK(57.92%)和TKL(56.25%)组中检测到具有额外保守结构域的剩余PKS,表明各种域组成包含多个域组成(附加文件1:表S4)。每个家族的成员通常共享相似的保守结构域,表明在同一个家族中有共同的进化历史。有趣的是,几乎所有含有Pkinase_Tyr (PF07714)结构域的PKs都发生在RLK和TKL组。
在70个含有多个激酶结构域的菠萝PKs中(附加文件1表S5)、57、9和3个成员分别包含2、3和4个激酶域。Aco014466包含最多的激酶结构域(5个激酶结构域)。菠萝PKs含有一个以上的激酶结构域,集中在几个家族。例如,CMGC_SRPK家族的所有4个成员和80% (12/15)AGC_RSK-2成员都含有两个激酶结构域。
菠萝kinome的节段复制和串联复制事件
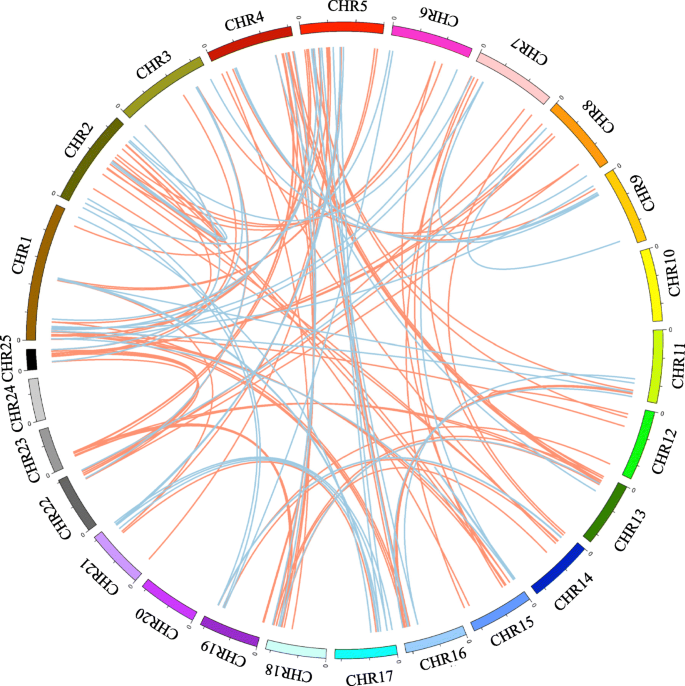
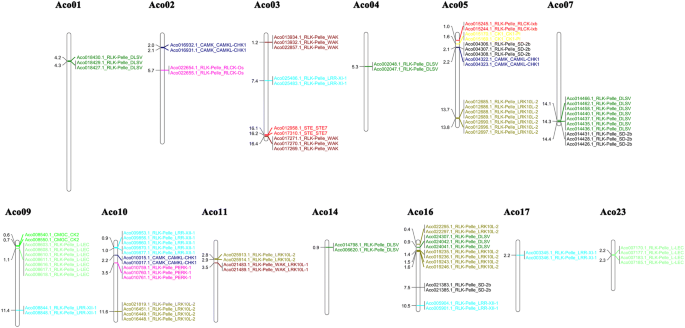
基因复制在扩大大激酶超家族的扩展中起着核心作用,并有助于帮助植物获得新功能,例如适应环境压力[8].菠萝激酶有135个片段重复事件,228个PKs(图。2额外的文件1表S6), RLK组85例。在13条染色体上鉴定了70个串联复制事件,95个PK基因(见图)。3.额外的文件1:表S7)。每条染色体上串联重复的PK基因数量从2个到16个不等,其中第5条染色体上串联重复的PK基因最多。
由于串联复制的基因可能在应激反应中发挥作用,与其他复制类型相比,串联复制发生的频率更高[21].进一步分析了95个串联重复基因的基因本体(GO)功能。三个主要GO类别是生物过程,细胞组分和分子功能。令人惊讶的是,所有串联重复的基因都参与了三个GO类别,生物过程和分子函数中的两个(附加文件3.:图S4A)。进一步分析95个连续重复PK基因的功能GO术语(附加文件)3.:图S4b)。前三个GO术语包括ATP结合(29%),蛋白激酶活性(27%)和蛋白质磷酸化(27%)。我们的研究结果表明,这些串联重复的基因可能在植物发育和信号转导中起作用。
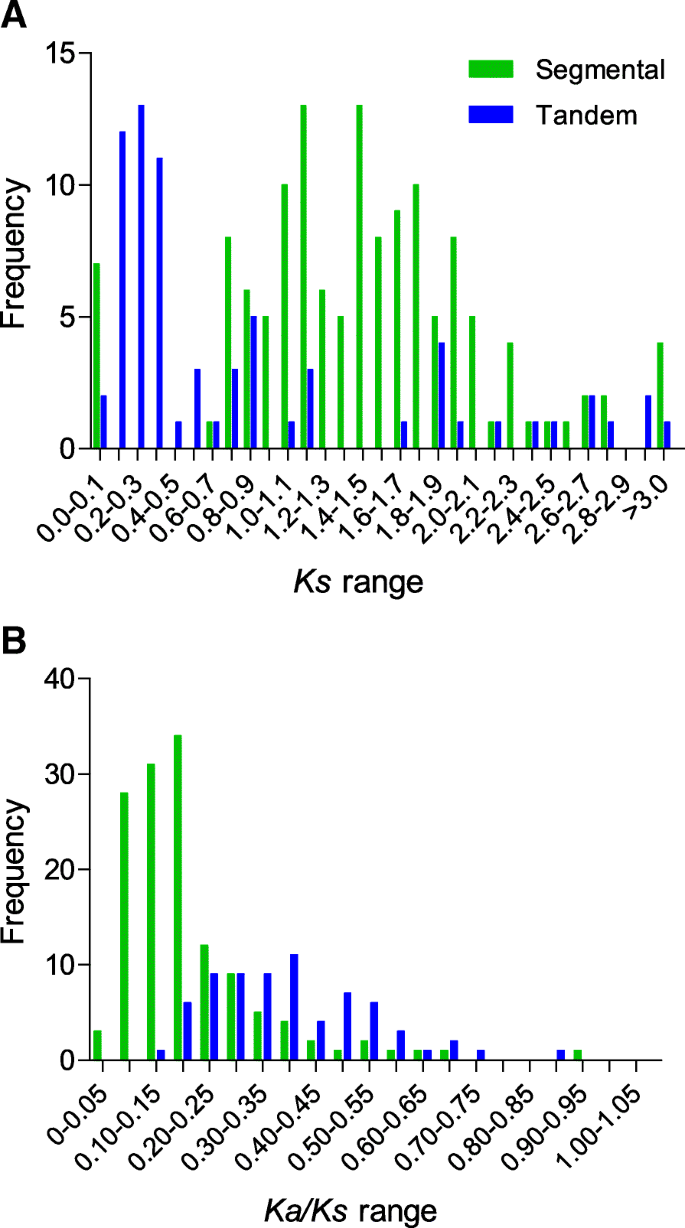
Ks值是用于复制块中的时间指示,和的频率分布Ks值用于估计基因组复制的相对日期(图。4额外的文件1:表S8)。在菠萝节段复制事件中Ks值在1.1 - 1.2和1.4 - 1.5之间达到峰值。然而,在70个串联复制事件中,Ks达到0.2至0.3的值,显示大多数分段重复事件比大多数串联复制事件更古代。的卡/Ks比率是确定复制事件选择的有效措施。卡/Ks= 1,中性选择;卡/Ks< 1表示负选择,也称为净化选择;的价值卡/Ks高于1表示正面选择(达尔文选择)。有趣的是,所有的卡/Ks结果表明,负性(纯化)选择是影响菠萝PK基因扩增的主要因素。4 b).
菠萝PKS的替代剪接
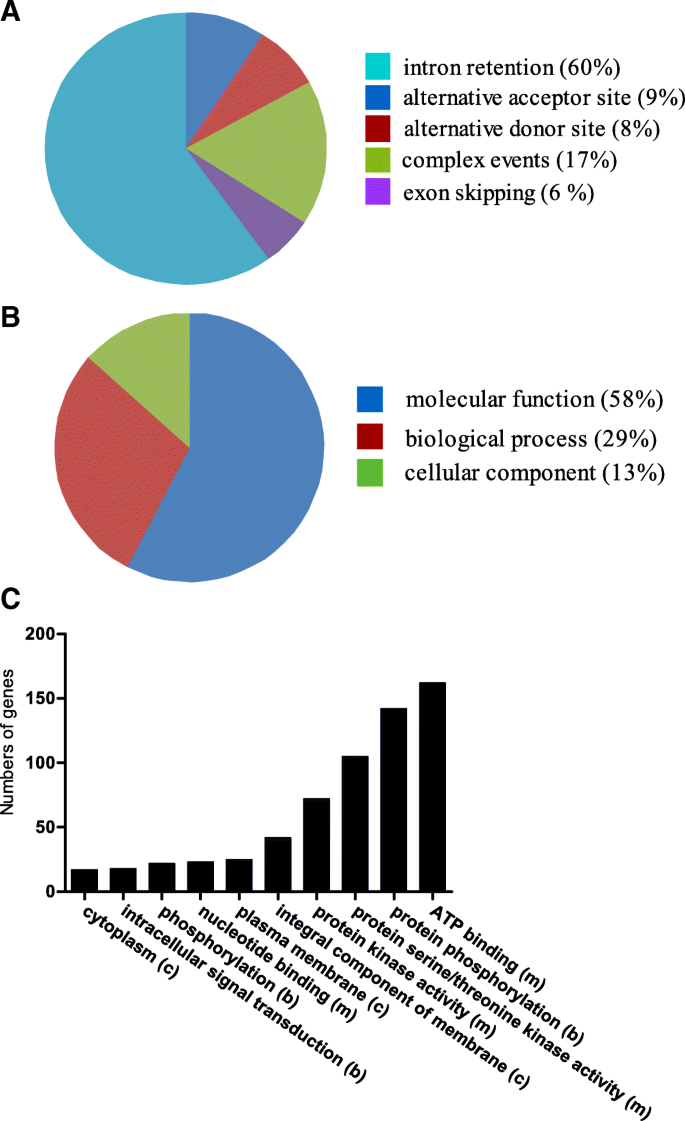
除了基因复制,替代剪接(AS)也在生物功能中发挥各种作用,包括植物应力适应。菠萝Kinome中基因的分析有助于我们了解磷酸化调节机制。在菠萝基因组中鉴定的758个PK基因中,包含的200个基因可转换成绩单(附加文件1:表S9)。在不同AS事件中,内含子保留占59.9%。其他3种AS类型,包括替代受体位点、替代供体位点和外显子跳跃分别占9.2、7.7和5.9%。其余17.3%为复杂事件(见图)。5).
作为基因的功能分析(图。5 b和c)显示,最大比例(58%)的氧化石墨烯项与分子功能有关,如ATP结合、蛋白丝氨酸/苏氨酸激酶活性和核苷酸结合。第二大部分与生物过程有关(29%),包括蛋白磷酸化、磷酸化和细胞内信号转导。与只涉及两类(分子功能和生物过程)的串联复制基因不同,其余经历AS的PK基因(13%)涉及细胞组分类别,如膜、质膜和细胞质的整体组分(图)。5度).
菠萝PK基因在开发过程中的表达分析
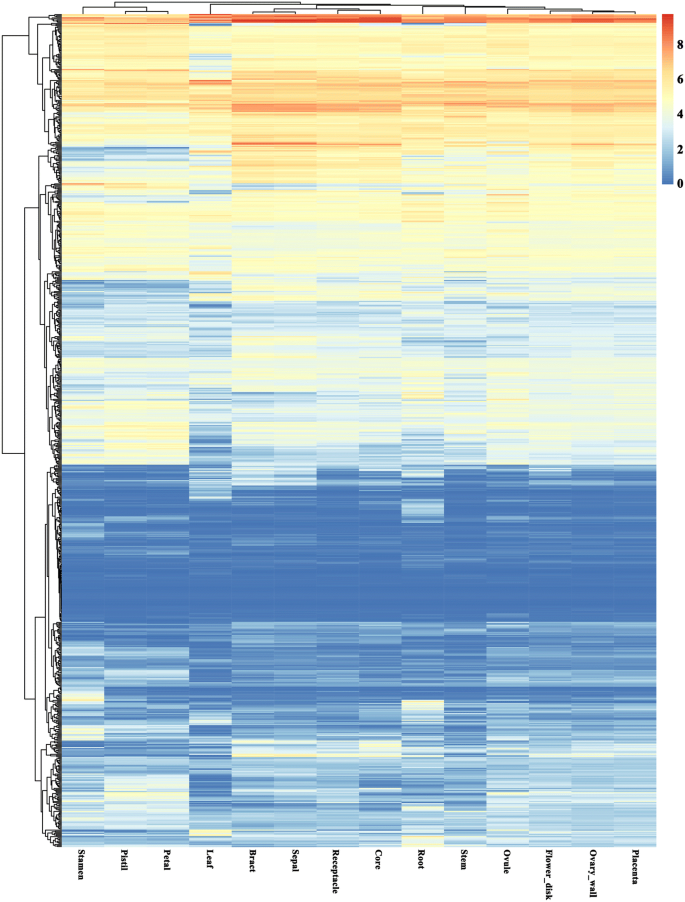
不同基因的组织特异性表达可用于功能验证。为了了解PK基因在不同菠萝组织中的表达模式,我们对公开的转录组数据集进行了分析。758个PK基因在14个不同组织中的表达数据(图。6额外的文件1:表S10)显示了Aco001649(AGC-Pl),ACO001625和Aco012533在CAMK_CAMKL-CHK1,Aco001527在CMGC_MAPK,Aco003435RLK-Pelle_LRR-Xa几乎在所有检测组织中高表达。相反,其他的,例如Aco009019(婴儿),Aco015017(CAMK_AMPK),Aco000324(ck1_ck1),Aco004806(rlk-pelle_cr4l),在检查组织中显示出非常低的表达。在许多不同的家庭中发现大多数组织中表达低的PK基因,特别是在RLK组中。一些其他基因呈现了组织特异性表达模式。例如,ACO008201.在CAMK_CAMKL-CHK1和Aco006575在TKL_CTR1-DRK-2中呈现高表达。ACO000718在AGC_RSK-2,Aco010615在RLK-Pelle_RLCK-IXb,Aco013938CAMK_CDPK,Aco010015CAMK_CAMKL-CHK1在叶片中的表达量相对高于其他组织。为了分析菠萝PKs在不同组织间的表达模式,找出在光合作用中发挥作用的基因,我们过滤了低表达基因,并将其余494个基因分为10个簇k- 基于Pearson的相关距离基于其表达数据进行算法(图。7额外的文件1:表S11)。大部分PK基因(65.38%)被归为5个最大的簇(聚1 ~ 5),其中第7个簇的PK基因在叶片组织中的表达量高于其他组织,可能参与了菠萝的光合作用。
为了比较家庭级别在家庭级别中的菠萝PK基因的不同表达模式,使用激酶家庭表达数据创建具有分层聚类分析的热图(附加文件3.:图S5)。菠萝PK基因家族显示出明显的表达模式。若干家庭,如组-PL-4和RLK-PELLE_XVI高度叶组织表达,但AGC_RSK在根系中显示出高表达。AGC-PL,CMGC_GSK,CMGC_CK2和RLK-PELLE_LRR-XA系列在大多数组织中高度表达。然而,RLK组中的大多数家庭在不同组织中表现出低的表达水平,表明虽然RLK是菠萝Kinome中最大的群体,但涉及菠萝开发的几个RLK成员。进一步构建了PK系列的组织共表表达网络(附加文件3.:图S6)。将包含93个节点和362条边的组织网络划分为2个主网络和4个子网络。RLK-Pelle_RLCK-V包含33条边,是拥有最多边的顶级家族。这一结果表明该家族可能在植物发育中起着重要作用。
昼夜表达模式和菠萝PK基因共表达分析
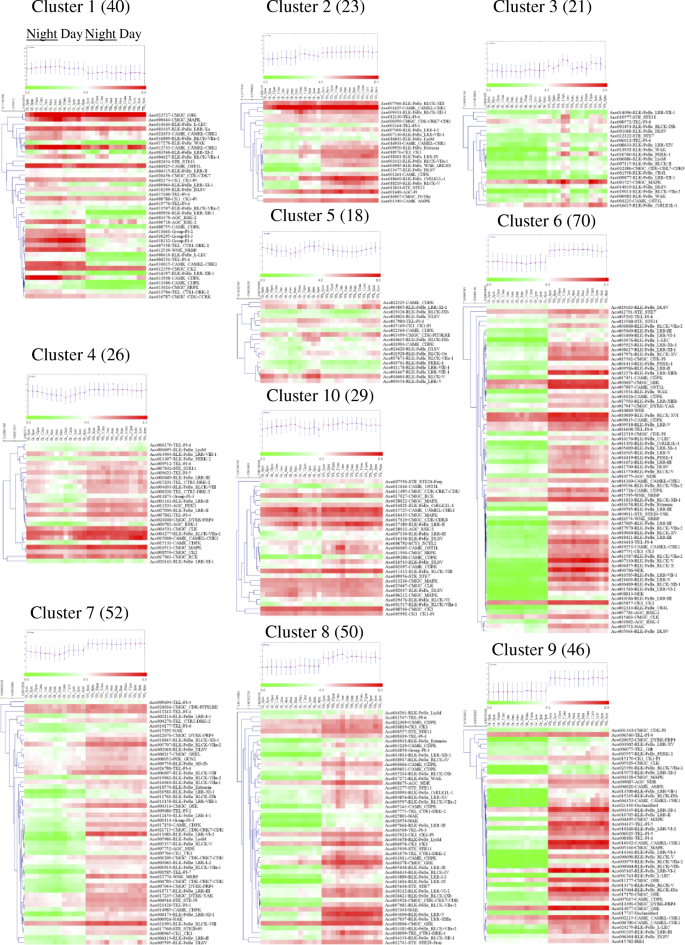
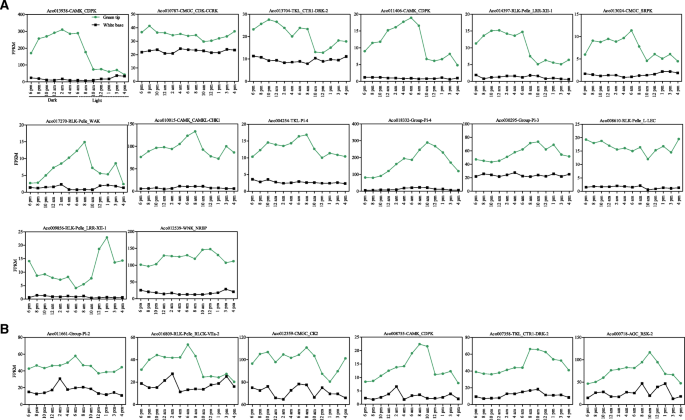
先前的研究表明,CAM植物基因的昼夜节律起着重要作用[3.].为了研究菠萝PK基因的Diel表达模式,我们专门分析了菠萝光合绿色尖端的RNA-SEQ数据(附加文件1表S12)和非光合作用的白色基叶组织(附加文件1表S13),在整个24小时内每隔2小时检测一次,以确定PK基因的时间表达模式。通过比较两种叶中的表达模式组织,与其候选人参与特定碳固定凸轮过程可以区别non-CAM相关成员函数在其他进程,而较低的光合组织表达的昼夜表达式non-photosynthetic组织(3.].过滤低表达PK基因[22,其余的375个基因则使用k-means算法与皮尔逊相关距离,基于他们的日表达模式(图。8额外的文件1:表S14)。簇被显示为具有聚类分析和平均表达模式的热带。在24-H期间进行十种不同的共表达模式簇,并且不同簇中的基因数在18(簇5)至70(簇6)中变化。有趣的是,簇中的基因在绿色尖端(光合作用)中显示出比在白色碱(非光合)组织中更高的表达水平,表明该簇中的基因可能在菠萝光合作用中起作用(图。8).进一步构建了包含33个节点、382条边的聚类1基因间的共表达网络3.:图S7)。每个节点拥有不同数量的调控边,从一个(ACO009964.在rlk-pelle_lrr-xi-1和Aco023527在cmgc_gsk)到二十二(Aco008755在CAMK_CDPK)。20个节点包含超过10条边,表明它们是紧密相关的。然后检索20个PK基因,其FPKM的详细表达模式列于图中。9.有趣的是,所有的20个基因在时间表达时在绿色尖端组织中都至少有一个峰值。然而,14个基因在绿色尖端和白色基底组织之间的表达模式不同(图2)。9),只有6个基因显示出白色基组织,在绿色组织尖端(图相似的表达模式。9 b).在菠萝叶片光合作用部分日表达的14个PK基因参与了光合作用过程。14个基因中,6个基因,Aco013938(camk_cdpk),ACO011406.(camk_cdpk),Aco013704(TKL_CTR1-DRK-2),Aco014397(RLK-Pelle_LRR-XII-1),ACO010787.(cmgc_cdk-ccrk)和Aco013024(cmgc_srpk),达到夜间或清晨(图。9),表明它们可能在特定的CAM光合途径和CO中起作用2夜间固定过程。的Aco013938,也称为aPPCK.菠萝中的基因[3.[菠萝中的夜间期间,通过磷酸化活化Pepc,该基因在叶中高度表达(图。7),因此,可能参与了CAM碳固定途径[3.].有趣的是,另外六个基因包括ACO010787,ACO010015(CAMK_CAMKL-CHK1), Aco018332(组-PL-4),ACO008610(RLK-Pelle_L-LEC), Aco009856(rlk-pelle_lrr-xii-1)和Aco012539(wnk_nrbp)在叶片中也比在其他组织中更高(图。7额外的文件1表S10),表明它们可能参与了菠萝的光合作用过程。另一个令人惊讶的是,Fig的14个基因中有超过一半的基因。9是由节段复制或串联复制产生的。例如,Aco013938、Aco011406、Aco013024、Aco010015和ACO004254.(TKL-PL-4)全部由分段重复产生。但是,四个基因包括Aco017270(RLK-Pelle_WAK),ACO018332,ACO008610和Aco009856源自串联复制(附加文件1:表S7).在菠萝激酶组重复的基因的不同表达,可能是新的官能化或子官能[结果10].
将低表达基因过滤后,分别对串联重复和分段重复产生的PK基因表达模式进行检索(附加文件)1:表S15),分析了基于137的昼夜表达数据的共抑制网络分段和22个串联重复基因(附加文件3.:图S8)。由分段复制基因生成的共表达网络(附加文件)3.:图S8A)包含106个节点和1683条边,大部分节点紧密相关。73个节点包含超过10条边,其中6个节点包含超过60条边,包括Aco000489 (rlk - pelle_rlck - xii - 1,61)、Aco005640 (STE_STE7, 62)、Aco003500 (RLK-Pelle_LRR-Xa, 63)、Aco008813 (NEK, 63)、Aco014181 (rlk - pelle_rlck - via - 2,66)、Aco015343 (NAK, 66)。然而,在基于串联重复基因的共表达网络中,仅有13个节点,21条边3.:图S8B)。
讨论
菠萝kinome拥有庞大的RLK群
许多细胞过程是由特定蛋白质的翻译后修饰控制的,可逆磷酸化是最广泛的翻译后修饰之一,由各种激酶执行,并控制大多数信号通路[16].虽然已经进行了一些发现阐明了PKS的功能,但在Cam植物中已经很好地证明了一个非常有限数量的激酶,可能是因为几种凸轮厂的基因组序列刚刚出版,包括蝴蝶兰属equestris[23),菠萝3.]和kalanchoe [24].因此,对PKs的全基因组识别和表征不仅有助于理解控制生物过程的调控网络,而且有助于理解导致生物多样性的进化驱动力。
在之前的研究中,发现PKs在人类基因组中占1.7%,而在植物基因组中约占4% [11,25].Lehti-shiu和shiu [7]鉴定并分类了25种植物的所有PKs,其激酶数量从326 (Volvox carteri)至2535(桉树祖母).在这项研究中,鉴定了758个菠萝PKs(附加文件1表S1),代表凤梨基因组2.8% (758/27024)[3.].这个比例低于拟南芥(3.4%),葡萄藤(3.7%)和大豆(4.7%)基因组[10,13,26].类似于119,123,121和122个家庭拟南芥将菠萝激酶分别归入116个科(附加文件)1表S3,图1) [7,10,26].三个系列,包括AGC_PKA-PKG,CAMK_CAMKL-LKB和SCY1_SCYL1是不存在的菠萝。其中116个家庭,33只含1名成员。大部分这样的家庭也高度保守的其他植物,它们可能参与更基本的细胞过程。例如,表达拟南芥PEK_GCN2gcn2突变酵母细胞基因可补充氨基酸饥饿反应[17].IRE1在响应哺乳动物的内质网应激中起着关键作用拟南芥IS1拼接BZIP60的mRNA,合成蛋白质的活性形式[27].RLK是菠萝kinome中最大的类群,占菠萝PK基因的63.3%1:表S3)。这种菠萝Kinome中的百分比的百分比与此相似拟南芥(60%) (13]及大豆基因组(65.5%)[10].由于只有2和3个rlk成员在两种藻类物种中存在(Chlamydomonas Reinhardtii.和Volvox carteri), RLK组的显著扩张必然发生在陆生植物出现之后[7].包括RLK-PELLE_LRR和RLK-PELLE_RLCK的子组是RLK中的两个大小子组,分别包含166和117 PKS。
亚细胞定位信息表明,超过半的RLK成员是膜定位的,最可能响应各种细胞外信号(附加文件)1:表S2)。RLK-Pelle_LRR成员已被证实参与信号转导、免疫和应激反应[28].然而,RLK-Pelle_RLCK成员缺乏胞外结构域,大部分预测定位于细胞核、线粒体和细胞质(Additional file)1表S2),可能与植物生长发育有关[29,30.].
菠萝kinome的扩展和复制
与其他真核生物相比,植物通常含有较高的基因复制率[21].基因复制主要促进植物Kinome的大小,特别是RLK组[12].大多数已测序的被子植物基因组在进化过程中至少发生一次全基因组复制(WGD)事件;串联和节段复制也普遍出现[28].重复基因对的存在可以为扩增后的基因提供新的功能。在菠萝kinome中,特别是在RLK组中,片段复制对扩增的贡献最大,占30.1%(228/758)。2).而在大豆和大豆中,71.4%和75.0%的PK基因是通过重复片段产生的拟南芥, 分别 [10,13].
与WGD相比,串联重复发生得更为频繁,对于适应快速变化的环境的进化非常重要[21].九十五串联重复基因进行了鉴定,占12.5%菠萝激酶组,83个是RLK部件(图3.).这个百分比高于拟南芥(9.5%)和大豆(10.6%)Kinome,但低于玉米(17.2%)Kinome [10,13,14].基因本体功能分析揭示了串联复制PK基因的预测功能,所有GO项均与分子功能和生物过程相关(Additional file)3.:图S4)。GO对大豆kinome中串联重复基因的分类与生物/非生物胁迫反应和发育密切相关[10].最近的大部分扩张拟南芥与防御/抗性反应相关的RLK基因是串联复制的基因[25].大米和拟南芥与非生物应激反应相关的氧化石墨烯类基因往往是串联复制的[21,31].
的Ks节段复制和串联复制事件之间的值表明,串联复制事件发生的时间比节段复制事件更晚,这表明串联复制基因可能参与了对各种外部胁迫信号的响应(图。4).应力响应和串联重复之间联系的原因是,串联重复接受了几代基因含量的快速变化[21].
选择性剪接使单个基因产生多个mRNA产物,是调节蛋白质组多样性以适应环境的核心机制[32].剪接位点的选择已经向参与细胞类型,发育阶段和非生物/生物胁迫[33].在Kinome中包含的事件24%(附加档案)包含两百PK基因1:表S9),以及菠萝基因组中的基因约30%[22].内含子保留是菠萝激酶中最普遍的AS类型(图。5),占60%。内含子保留也占菠萝基因组的62%。在其他植物物种中,内含子保留也仍然是归类为事件的主要类型[34,35].
菠萝PK基因的表达模式
具有相似表达模式和功能的基因通常是共同调控的[36].具有组织特异性表达模式的基因在植物发育过程中发挥着重要作用。菠萝PK基因的组织特异性RNA-Seq分析显示不同的表达模式。6和7).PKs,如高表达的CK2, CDPK, MAPK基因家族已被证明在植物生长发育中起作用[37,38,39].拟南芥以及水稻SnRK1在植物整个生命周期的生长发育中具有调节功能[40].过度的GhMPK7在烟草和拟南芥表示GhMPK7可能与植物激素调控的发育有关[19].菠萝体细胞胚胎发生受体样激酶(SERK)的两个基因AcSERK1和AcSERK2)可用于监测胚胎发生能力的获取,它们都可以由不同的激素和非生物应激诱导。我们从NCBI中检索了CDS序列,并通过登录号HM236375(AcSERK1)及HM236376 (AcSERK2),分别41,42].最后,我们确定了Aco001161(RLK-Pelle_LRR-II)AcSERK1,Aco009586(RLK-Pelle_LRR-II)AcSERK2利用BLASTN对菠萝基因组数据库进行分析。
CAM植物在白天关闭气孔以减少水分蒸发损失,而在夜间开气孔时通过PEPC固定二氧化碳[3.].这些特性提高了CAM植物的水分利用效率,使其适应干旱环境。先前的报道表明CAM是从C3祖先进化而来的,这表明CAM工程到C3是提高大多数C3作物水分利用效率的可行策略[1].这一方法的成功关键在于对CAM植物基因组、生化和生理特性的理解[1].Kusakina和Dodd [43]表示在植物光合作用的节律性磷酸化参与并在植物的昼夜系统中起关键作用。在绿叶尖端(光合)和白叶基(非光合)菠萝PK基因时间表达模式有助于区分在菠萝的PK的作用和选择的候选基因在植物中的CAM涉及碳固定(图8).最后,选择20个PK基因并分析其表达模式(图2)。9).在20个基因中,有14个基因在两个叶部表现出不同的表达模式,这些PK基因在绿尖组织中日表达,在白基部组织中低表达,被认为参与了CAM光合途径的碳固定过程(图2)。9).在这14个基因中,Aco013938已被确认为PPCK.基因是凸轮光合途径中的关键基因,并介导Pepc的磷酸化[1,3.].的PPCK1在长寿fedtschenkoi,另一种CAM植物,叶组织中黑暗的中部也有高峰[24].转基因RNAi系kfppck1.降低公司总2黑暗期的固定[44].的同源基因ACO011406.(CAMK_CDPK)拟南芥,AtCPK7,在调节从土壤中吸收水分方面起关键作用[45].直接同源的Aco018332(Group-Pl-4),atstn7.(AT1G68830),在植物对环境变化的反应中起着重要作用[46].出奇,At5g58140,ortholog的ACO000718在AGC_RSK-2(无花果。9 b),也被称为PHOT2,是一种蓝色光感受器拟南芥调节气孔开度的[24].类似地,它的正交Aco016809(RLK-Pelle_RLCK-VIIa-2),AT2G28930是否还要求气孔开在光照中拟南芥[47),这表明ACO000718和Aco016809可能在调节菠萝气孔开放中起作用(附加文件1:表S16)。
结论
共鉴定出758个菠萝PKs,分为20组116科。重复事件促成了菠萝kinome的大规模扩张。的Ka / Ks比率表明,重复事件都在净化选择下。的Ks节段重复事件的数值大于串联重复事件的数值,说明串联重复事件发生的时间较近。此外,菠萝PK基因在不同组织中以及不同叶组织中昼夜之间的表达模式也不同。在CAM植物中,调控CAM活性的可逆磷酸化仍然是未知的。在这项工作中,我们在全球范围内描述了菠萝的kinome。本研究结果为进一步研究菠萝PKs的功能奠定了基础,并可用于C3作物工程抗旱性候选基因的筛选。
方法
菠萝PKs的计算检索与识别
为了鉴定菠萝基因组中的所有蛋白激酶,从phytozome V12.1 (https:////phytozome.jgi.doe.gov./)。隐藏的Markov模型(HMMS)型材的两个挂酶氏族,包括Pkinase(pf00069)和pkinase_tyr(pf07714)从pfam下载(http://pfam.xfam.org/) [48]应用HMMER v3.1b2调查推定的PKs [49].采用默认参数,e值截止值< 1.0E-5,利用SMART (http://smart.embl-heidelberg.de/)[50].在本研究中,如果相关激酶结构域序列至少覆盖了50%的Pfam结构域模型,则推定PK被认为是PK [7].用Lehti-Shiu和Shiu开发的不同科的HMMs定义分组和科的PK分类[7他用四种植物模型种,包括Chlamydomonas Reinhardtii.,Physcomitrella patens.,奥雅萨苜蓿,拟南芥.
序列对准和系统发育分析
利用激酶结构域序列构建系统发育树,验证分类结果。使用perl脚本检索所有鉴定的菠萝PKs的激酶域序列。使用MEGA 6.06的MUSCLE程序对激酶结构域序列进行多序列比对[51].采用最大似然法(ML)构建菠萝激酶蛋白系统发育树(FastTree version 2.1.9)www.microbesonline.org/fasttree/),使用默认参数[52].
染色体位置和内含子数量
菠萝PK基因的染色体位置从菠萝数据库(https:////phytozome.jgi.doe.gov./)。从基因组资源的gff文件中获得了所有菠萝PK基因的内含子数量。
亚细胞定位预测
大提琴预测蛋白亚细胞定位(http://cello.life.nctu.edu.tw) [53]和定位器(http://localizer.csiro.au) [54].
菠萝Kinome中的串联和分段重复事件的识别
多重共线性扫描工具包(MCScanX)包(http://chibba.pgml.uga.edu/mcscan2/)应用于识别手动上遵循的菠萝PKS的共线块[55].使用Circos 0.69软件(http://circos.ca/)。将串联重复定义为在邻近的非基因分开的家庭中的至少两个基因,其五个或更少的基因小于100 kb [56].应用Mapchart软件(http://www.wur.nl/en/show/Mapchart-2.30.htm).
菠萝PK基因GO功能分类分析
Blast2GO工具(https://www.blast2go.com/)用于获得基因本体论(GO)术语的ID为菠萝的PK。在GO长期ID的注释是从基因本体联盟(检索http://www.geneontology.org).
计算卡/Ks价值
首先用ClustalW 2.0对PK基因的节段和串联编码序列进行比对[57].然后,非同义替换(卡)和每个地点的同义词替换(Ks),采用MEGA6.06进行分析。的比例卡来Ks(Ka / Ks)来确定重复事件之间的选择压力。
替代剪接分析
菠萝基因组中PKs的选择性剪接(AS)数据来源于Plant alternative splicing Database (http://proteomics.ysu.edu/altsplice/),并分析AS事件类型[22].
表达分析
菠萝基因数据库(http://118.24.17.128/html/Pineapple_Expression_DB_By_HeLab_AT_SCAU/),分析菠萝PK基因[58].检索鉴定的菠萝PKs在14个不同组织和器官发育过程中的表达数据(NCBI登录号PRJNA382449) [59].从包括绿叶尖端(光合)和白色叶基底(非光合作用)的两个菠萝叶组织检出的24-h周期的昼夜表达数据与加入号prjna305042 [3.].以每千碱基外显子模型每百万片段图谱(FPKM)值计算鉴定的菠萝PK基因在不同组织和时间点的表达量。表示日志的热图2(FPKM + 1) of PKs from the RNA-Seq data were constructed with hierarchical clustering analysis using the R package (www.r-project.org).为了分析家族水平上的组织特异性表达模式,将每个不同家族中所有成员的基因表达数据取平均值。
为了聚类PK基因的组织特异性或日表达模式,我们将所有组织或两个不同菠萝叶组织中FPKM值小于10的基因视为低表达基因,并过滤[22].最后,通过Multiple Experiment Viewer (MEV) version 4.9软件(http://mev.tm4.org/),k- 模拟算法[60,61].
共用网络建设
基于不同组织和时间过程表达数据的Pearson相关系数(PCC)值采用IBM SPSS Statistics v24 (https://www.ibm.com/us-en/marketplace/spssstatistics.).以0.01显著性水平提取PCC绝对值大于0.8的所有菠萝基因或家族对(P-value),并用于监管网络分析。共表达网络使用Cytoscape v3.3.0 (http://www.cytoscape.org).
缩写
- 自动增益控制:
-
PKA-PKG-PKC
- 为:
-
替代拼接
- CAM:
-
景天酸代谢
- CAMK:
-
钙和钙调蛋白调节激酶
- 对照:
-
酪蛋白激酶1
- CMGC:
-
周期蛋白依赖激酶,丝裂原活化蛋白激酶,糖原合酶激酶和周期蛋白依赖样激酶
- FPKM:
-
每千碱基的外显子模型片段每百万片段映射
- 走:
-
基因本体论
- 嗯:
-
隐马尔可夫模型
- 卡:
-
每个站点的非同义替换
- Ks:
-
每个网站的同义替代
- 远程雷达:
-
富亮氨酸重复
- ml:
-
最大似然
- PCC:
-
皮尔森相关系数
- PK:
-
蛋白质激酶
- rlck:
-
受体样细胞质激酶
- RLK:
-
受体激酶
- RNA-Seq:
-
RNA序列
- STE:
-
无菌激酶
- TK:
-
酪氨酸激酶
- 设备:
-
酪氨酸kinase-like激酶
参考
- 1.
杨X,库什曼JC,Borland的AM,爱德华EJ,Wullschleger SD,Tuskan GA,欧文NA,格里菲思H,史密斯江淮,德保利HC。一种在景天酸代谢(CAM)的研究路线图,以增强可持续粮食和生物能源生产的炎热,干燥的世界。新植物。2015; 207(3):491-504。
- 2.
Borland AM, Wullschleger SD, Weston DJ, Hartwell J, Tuskan GA, Yang X, Cushman JC。气候适应性农用林业:对气候变化的生理响应和作为缓解策略的景天蓝酸代谢工程植物学报。2015;38(9):1833-49。
- 3.
明润,瓦斯堡r,wai cm,唐清,schatz mc,鲍德·je,里昂e,wang m-l,陈j,biggers e。菠萝基因组和凸轮光合作用的演变。NAT Genet。2015; 47(12):1435。
- 4.
本- david Y, Letwin K, Tannock L, Bernstein A, Pawson T.哺乳动物蛋白激酶具有潜在的丝氨酸/苏氨酸和酪氨酸磷酸化与细胞周期调节相关。EMBO j . 1991; 10(2): 317 - 25所示。
- 5.
Hanks Sk,Quinn Am,Hunter T.蛋白激酶家族:保守特征和推导的催化结构域的系统。科学。1988; 241(4861):42-52。
- 6.
蛋白激酶6。真核蛋白激酶超家族:激酶(催化)结构域和分类。美国实验生物学学会联合会j . 1995; 9(8): 576 - 96。
- 7.
Lehti-Shiu MD, shis - h。植物蛋白激酶超家族的多样性、分类和功能。中国科学(d辑:地球科学)2012;
- 8.
冠军,克瑞斯男,Mockaitis K,Picaud A,亨利Y.拟南芥Kinome:铸件后。Funct综合基因组。2004; 4(3):163-87。
- 9.
德兰AKN,柳的Y H,曹P,夏尔马R,夏尔马男,Dardick C,罗纳德PC,荣格K-小时。更新水稻激酶数据库RKD 2.0:使得转录和水稻激酶基因的功能分析。米。2016; 9(1):40。
- 10.
刘军,陈宁,程志明,陈宁,贺卫子。大豆kinome的功能分类和基因表达模式。J Exp Bot. 2015;66(7): 1919-34。
- 11.
Manning G,Whyte DB,Martinez R,Hunter T,Sudarsanam S.人类基因组的蛋白质激酶补充剂。科学。2002; 298(5600):1912-34。
- 12.
Lehti-Shiu MD,Zou C,Hanada K,Shiu S-H。植物受体样激酶/骨液基因的进化史和应力调节。植物理性。2009; 150(1):12-26。
- 13.
Zulawski M, Schulze G, Braginets R, Hartmann S, Schulze WX。的拟南芥激酶组:系统发育和进化的见解功能多样化。BMC基因组学。2014; 15(1):548。
- 14.
魏凯,王玉英,谢东。玉米蛋白激酶基因超家族的鉴定及表达谱分析。摩尔繁殖。2014;33(1):155 - 72。
- 15.
可逆性磷酸化对植物酶活性的调控。杂志杆菌。1988;72(2):435 - 9。
- 16.
植物蛋白丝氨酸/苏氨酸激酶的分类和功能。植物学报。1999;50(1):97-131。
- 17.
张家,刘继,明润。凸轮厂菠萝的基因组分析。J Exp Bot。2014; 65(13):3395-404。
- 18.
潘j,张m,kong x,xing x,liu y,周y,liu y,sun l,li d。ZmMPK17,一种新型玉米组D map激酶基因,参与多重应激反应。Planta。2012; 235(4):661-76。
- 19.
史静,安海林,张玲,高智,郭晓强。GhMPK7在棉花广谱抗病和植物发育过程中发挥重要作用。acta botanica sinica(云南植物学报),2010;47(1):1 - 4。
- 20.
徐军,李H-d,陈L-Q,王勇,刘L-L,他L,吴W-小时。蛋白激酶,具有两个钙调磷酸酶B-样蛋白相互作用,调节ķ+Transporter Akt1 In.拟南芥.细胞。2006; 125(7):1347-60。
- 21.
Hanada K, Zou C, Lehti-Shiu MD, Shinozaki K, Shiu S-H。植物串联重复序列谱系特异性扩增在环境刺激适应性反应中的重要性。植物杂志。2008;148(2):993 - 1003。
- 22.
围CM,鲍威尔B,明R,闵XJ。选择性剪接景观分析菠萝(菠萝comosus).热带植物学报。2016;9(3):150-60。
- 23.
蔡俊,刘旭,Vanneste K, prost S,蔡文昌,刘克伟,陈丽娟,何颖,徐强,边春。兰花基因组序列分析蝴蝶兰属equestris.NAT Genet。2015; 47(1):65。
- 24。
杨x,胡r,yin h,jenkins j,shu s,唐h,刘d,liedill da,yim wc,ha J.的高凉菜属基因组为趋同进化和景天蓝酸代谢的构建模块提供了深刻的见解。Nat Commun。2017;8(1):1899。
- 25。
萧绍华,Karlowski WM,潘锐,曾永华,Mayer KF,李文华。受体样激酶家族的比较分析拟南芥和米饭。植物细胞。2004; 16(5):1220至34年。
- 26。
朱轲,王旭,刘杰,唐军,程强,陈建刚,程志明。葡萄藤kinome:发育过程和应激反应的注释、分类和表达模式。长的矮杂志2018;5(1):19。
- 27。
Nagashima Y, Mishiba K-I, Suzuki E,岛田Y,岩田Y,小泉N。拟南芥IRE1催化bZIP60 mRNA的非常规剪接,产生活性转录因子。Sci众议员2011;。
- 28。
王志强,王志强,王志强,等。富亮氨酸重复受体样激酶(LRR-RLK)亚家族在被子植物中的进化动态。植物杂志。2016;170(3):1595 - 610。
- 29。
林伟,马晓霞,何平。小激酶的作用。受体样胞浆激酶在植物免疫和发育中的复杂功能。acta botanica yunnanica(云南植物研究). 2013;55(12):1188-97。
- 30.
Vij S,Giri J,Dansana PK,Kapoor S,Tyagi AK。水稻的受体样细胞质激酶(OSRLCK)基因家族:组织,系统发育关系和发育和应力的表达。莫尔植物。2008; 1(5):732-50。
- 31.
Rizzon C, Ponger L, Gaut BS。并列排列的基因的基因组分布惊人的相似拟南芥和米饭。计算机科学与技术。2006;2(9):e115。
- 32.
毛勇,孙军,曹鹏,张锐,付强,陈松,陈飞,蒋军。水稻开花位点T同源基因选择性剪接功能分析菊花莫瑞菊.如果短杂志2016;3:16058。
- 33.
Fileichkin SA,牧师HD,Givan SA,Shen R,Bryant DW,Fox SE,Wong W-K,Mockler TC。替代拼接的基因组映射拟南芥.基因组研究》2010;20(1):45-58。
- 34.
Marquez Y, Brown JW, Simpson C, Barta A, Kalyna M.转录组调查显示,在中国,可变剪接景观的复杂性增加拟南芥.基因组研究》2012;22(6):1184 - 95。
- 35.
闵晓军,王志刚,王志刚,王志刚。水稻全基因组选择性剪接基因的研究进展。BMC基因组学。2015;16(1):721。
- 36.
Tavazoie S, Hughes JD, Campbell MJ, Cho RJ, Church GM.遗传网络结构的系统确定。Nat麝猫。1999;22(3):281。
- 37.
Mulekar JJ,Huq E.扩大蛋白激酶CK2在调节植物生长和发育中的作用。J Exp Bot。2013; 65(11):2883-93。
- 38.
王志强,王志强,王志强,等。钙依赖蛋白激酶在植物生长发育中的作用。植物营养与肥料学报。植物杂志。2013;163(2):523 - 30。
- 39.
徐军,张树华。丝裂原活化蛋白激酶级联反应在植物生长发育中的作用。植物学报,2015;20(1):56-64。
- 40.
赵Y-H,洪J-W, Kim E-C, Yoo S-D。SnRK1在逆境响应基因表达和植物生长发育中的调控作用。植物杂志。2012;158(4):1955 - 64。
- 41.
MA J,HU Y,HU Z,XU W,XIA J,GUO C,LIN S,CAO L,Chen C,WU C,张J.表征及表达分析AcSERK2菠萝体细胞胚胎发生和逆境抗性相关基因。基因。2012;500(1):115 - 23所示。
- 42.
马军,何艳红,胡志勇,卡纳卡拉斯,徐文婷,夏建新,郭超,林树清,陈昌华,吴超,张建林。菠萝体细胞胚胎发生的组织学分析:AcSERK1胁迫条件下,其表达的验证。Ĵ植物生物化学毕。2016; 25(1):49-55。
- 43.
王志强,王志强。植物昼夜节律系统中的磷酸化。植物学报,2012;17(10):575-83。
- 44.
Boxall SF,DVEVER LV,KneńováJ,古尔胡德PD,Hartwell J.磷酸丙酮酸羧酸酯的磷酸化对于最大和持续的暗黑二氧化碳固定和核心昼夜昼夜昼夜时钟运行是必不可少的高凉菜属fedtschenkoi.植物细胞。2017; 29(10):2519-36。
- 45.
李国栋,李国栋,李国栋,李国栋。钙依赖蛋白激酶CPK7对根系水分传导的影响。植物学报。2015;38(7):1312-20。
- 46.
Bellafiore S,Barneche F,Peltier G,Rochaix J-D。状态过渡和光适应需要叶绿体蛋白质激酶STN7。自然。2005; 433(7028):892。
- 47.
Elhaddad NS,Hunt L,Sloan J,Gray Je。光引起的气孔开口受保护细胞蛋白激酶APK1B的影响。Plos一个。2014; 9(5):E97161。
- 48。
Finn Rd,Coggill P,Eberhardt Ry,Eddy SR,Mistry J,Mitchell Al,Potter SC,Punta M,Qureshi M,Sangrador-Vegas A. PFAM蛋白质家庭数据库:迈向更加可持续的未来。核酸RES。2015; 44(D1):D279-85。
- 49。
Eddy SR. Profile hidden Markov模型。生物信息学。1998;14(9):755 - 63。
- 50.
吴鹏,王伟,李勇,侯晓霞。MAPK级联基因的分化进化模式芸苔属植物拉伯和植物系统发育。Hort Res。2017; 4:17079。
- 51。
Tamura K, Stecher G, Peterson D, Filipski A, Kumar S. MEGA6:分子进化遗传学分析版本6.0。生物医学进展。2013;30(12):2725-9。
- 52。
Price MN, Dehal PS, Arkin AP. FastTree:用轮廓代替距离矩阵计算大型最小进化树。中国生物医学工程学报。2009;26(7):1641-50。
- 53。
余春春,陈永昌,卢春春,黄家杰。蛋白质亚细胞定位预测。蛋白质。2006;64(3):643 - 51。
- 54.
Sperschneider J,Catanzariti Am,Deboer K,Betre B,Gardiner DM,Singh Kb,Dodds Pn,Taylor JM。定位器:植物细胞中植物和效应蛋白的亚细胞定位预测。SCI批准。2017; 7:44598。
- 55.
王颖,李建军,王玉华。mcscan -transposed:基于多重共线性扫描检测转座基因重复。生物信息学。2013;(11):1458 - 60。
- 56.
朱轲,陈峰,刘杰,陈旭,贺卫子,程志明。大豆CIPK基因家族内含子缺失簇的进化及其在干旱胁迫下的表达Sci众议员2016;6:28225。
- 57.
Larkin MA, Blackshields G, Brown N, Chenna R, McGettigan PA, McWilliam H, Valentin F, Wallace IM, Wilm A, Lopez R. Clustal W and Clustal X Version 2.0。生物信息学。2007;23(21):2947 - 8。
- 58.
谢T,陈c,李c,刘j,刘c,李玉河,肝脏肾脏基因家族的基因组调查:发展与压力过程中的进化和表达概况。BMC基因组学。2018; 19:490。
- 59.
刘C,谢T,陈C,栾A,长J,Li C,Ding Y,何Y.菠萝中R2R3-Myb转录因子家庭的基因组组织和表达分析(菠萝comosus).BMC基因组学。2017;18(1):503。
- 60.
Abraham PE, Yin H, Borland AM, Weighill D, Lim SD, De Paoli HC, Engle N, Jones PC, Agh R, Weston DJ。CAM植物龙舌兰的转录、蛋白质和代谢产物的时间动态。Nat植物。2016;2(12):16178。
- 61.
张h,王h,yi h,zhai w,wang g,傅q.转录组谱分析Cucumis梅洛果实发育和成熟。如果短杂志2016;3:16014。
致谢
我们感谢Margaret Staton博士和Miriam Payá-Milans提供的生物信息学援助。
资金
该研究部分由江苏省和田纳西州农业实验站项目的优先级资金提供资金支持#1009395。KZ得到了中国奖学金委员会(CSC,No.201606850052)的支持。
数据和材料的可用性
本文中使用或分析的所有数据集可从合理的请求中获得相应的作者。支持本文结论的RNA-SEQ数据来自Liu等人。(2017)和Ming等人。(2015),使用NCBI登录号:PRJNA382449和PRJNA305042。
作者信息
从属关系
贡献
KZ和ZMC设计了本研究。KZ、HL、XC、QC对数据进行分析。KZ和ZMC撰写了手稿。所有作者都对ms的修改做出了贡献。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
利益争夺
两位作者宣称他们没有相互竞争的利益。
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
附加文件
额外的文件1:
表S1。Kinase域注释为758菠萝蛋白激酶。表S2。菠萝蛋白激酶的家庭分类及其相关信息。表S3。菠萝PK基因在不同家族中的数量。表S4。758个菠萝PKs的域组织。表S5。包含多个激酶结构域的70个菠萝蛋白激酶列表。表S6。菠萝PK基因片段复制产生。表S7。菠萝PK基因由串联复制产生。表S8。分段和串联复制事件和Ka / Ks菠萝蛋白激酶的价值。表S9。菠萝中PK基因的替代剪接类型。表S10。发展阶段14个不同组织中758菠萝激酶基因的平均FPKM表达值。表S11。在发育过程中具有不同表达模式的十个集群中的494个基因。表S12。2458菠萝激酶基因的平均FPKM表达值在绿叶尖端24-H期间。表S13。758个菠萝激酶基因在白叶基24小时内FPKM的平均表达量。表S14。十个不同表达模式的基因簇。表S15。菠萝激酶基因在绿色和白色叶片组织中24小时复制产生的表达值。表S16。20个菠萝PKs的同源性拟南芥.(XLSX 336 kb)
附加文件2:
图S1。菠萝PKs的系统发育分类。采用最大似然法FastTree 2.1.9,以激酶结构域的氨基酸序列构建系统发育树。家庭被用不同的颜色突出。(PDF 286 kb)
额外的文件3:
图S2。菠萝PK基因的染色体位置。图S3。大提琴预测菠萝PK基因在7大群体中的亚细胞定位。图S4。菠萝中95个并行PK基因的GO分析饼图中每个切片的大小表示菠萝kinome中GO项的相对丰度。图S5。菠萝PK家族在14个不同组织中的表达谱。热图是使用R。图S6。14种不同组织中菠萝PK系列的共表达网络。节点指示的家庭和边缘表明家庭之间的重要组成。共表达事件的所有Pearson相关系数在0.01显着性水平下显着(p值)。图S7。24 h内绿色叶尖和白色叶基中PK基因聚类1共表达网络分析节点表示基因,边表示基因间显著共表达。共表达事件的所有Pearson相关系数在0.01显着性水平下显着(p值)。图S8。24 h内,PK基因在叶尖和白叶基部通过片段复制(A)和串联复制(B)生成的共表达网络分析。节点表示基因,边表示基因间显著共表达。Pearson相关系数>的绝对值为0.9,和p< 0.01。不同的线条颜色表示正相关(蓝色)或负相关(红色)。多克斯(3152 kb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
朱坤,刘海涛,陈晓霞。et al。菠萝的kinome:目录和对景天蓝酸代谢植物功能的见解。BMC植物杂志18,199(2018)。https://doi.org/10.1186/s12870-018-1389-z.
收到了:
接受:
发表:
关键字
- 替代拼接
- Coexpression网络
- 景天酸代谢
- 复制事件
- 表达模式
- 系统发育关系
- 菠萝激酶