- 研究文章
- 开放获取
- 发表:
过度表达一种细胞壁损伤诱导的转录因子OsWRKY42,导致胼胝质的沉积和对盐胁迫的耐受性增强,但不增强对细菌感染的耐受性
BMC植物生物学体积18,文章号:177(2018)
摘要
背景
WRKY基因家族成员在调节植物对非生物和生物胁迫的反应中发挥重要作用。用两种不同的细胞壁降解酶(CWDEs), LipaseA和CellulaseA中的任何一种处理,诱导免疫反应,并增强细胞的表达OsWRKY42在大米。然而,OsWRKY42在CWDE诱导的免疫应答中的作用尚不清楚。
结果
水稻转录因子的表达OsWRKY42CWDEs、伤害和盐处理水稻叶片诱导。过度的OsWRKY42导致水稻和拟南芥中胼胝质沉积增强,但这并不能增强对细菌感染的耐受性。经NaCl处理后,拟南芥转基因植株表达OsWRKY42表现出高水平的花青素,并表现出对盐胁迫的增强耐受性。纤维素酶或盐的处理诱导了拟南芥中几个参与JA生物合成和反应的基因的表达。异位表达OsWRKY42结果降低了细胞壁损伤和盐胁迫诱导茉莉酸生物合成和反应基因的表达。OsWRKY42表达拟南芥的系对茉莉酸甲酯介导的生长抑制的耐受性增强。
结论
这里提出的结果表明OsWRKY42作为茉莉酸介导的负调控因子,调节植物对细胞壁损伤或盐度胁迫的反应。
背景
植物细胞壁在发育和适应非生物和生物胁迫中起着至关重要的作用[1].作为其毒力库的一部分,植物病原体产生一系列细胞壁降解酶(CWDEs)来降解细胞壁的不同成分。CWDEs的作用释放细胞壁降解产物,这些产物被归类为损伤相关分子模式(DAMPs) [1,2,3.].DAMPs作为植物免疫反应的激发子[4].植物对DAMPs的感知诱导了一系列信号事件,这些事件激活了免疫反应,包括表达病机相关(PR)基因、活性氧(ROS)的产生、木质素沉积及过敏反应[5].这些反应可增强对病原体后续感染的耐受性[3.,4,5,6这被称为DAMP触发免疫(DTI)。用细胞壁衍生产物如寡半乳糖苷(OGs)、低浓度的hepta-β-葡萄糖苷和寡氧葡聚糖处理也会引起DTI反应[5,7].纤维素二糖是纤维素的降解产物,也可作为一种DAMP,并诱导类似防御的反应[8].参与DTI的分子还没有很好地描述。我们正试图了解涉及CWDE诱导DTI的机制栽培稻(大米)。
黄oryzaepv。oryzae(Xoo语),水稻白叶枯病的致病因子分泌多种植物细胞壁降解酶,作为其毒性库的一部分。用任何一种方法处理水稻组织Xoo语分泌的CWDEs如cellulaseA (ClsA)、纤维素生物苷酶(CbsA)和脂肪酶/酯酶(LipA)诱导植物的免疫反应,如胼胝质沉积,也为植物防御继发的侵袭做准备Xoo语感染(6].水稻叶片转录组分析表明,在LipA或ClsA处理后,许多防御反应相关基因上调,茉莉酸(JA)介导的防御反应也可能在这些条件下上调[9,10].此外,在用LipA治疗后,ja -异亮氨酸的水平被发现升高。差异表达的基因中有相当一部分是转录因子。在ClsA或LipA处理后的总上调基因中,分别约有17%(26 /152个基因)和9%(68/720个基因)是转录因子[9,10].这表明转录因子可能在水稻CWDE诱导的免疫应答中起着至关重要的作用。WRKY转录因子家族在生物和非生物应激反应中起着积极和消极的调节作用[11].我们发现了一个WRKY转录因子,OsWRKY42,其表达在各种CWDEs处理后诱导。基因芯片分析显示OsWRKY42在LipA和里昂证券处理水稻叶片12 h后诱导[9,10].微阵列分析还表明,即使在LipA处理后2小时,该基因的表达也上调(A Ranjan和R V Sonti,未发表数据;GSE53940)。有趣的是,这是唯一一个在LipA治疗后早期(2 h)和晚期(12 h)时间点被诱导表达的转录因子。最近的研究也表明OsWRKY42表达最早在一小时后诱导Magnaporthe oryzae粳稻品种牡丹江8号的侵染.过度的OsWRKY42增强对m . oryzae抑制茉莉酸反应对水稻的侵染[12].
在本研究中,我们试图了解可能的作用OsWRKY42在DTI的阐述中。我们的研究结果表明过度表达OsWRKY42导致胼胝质沉积增强,这是一种防御反应,但在水稻或拟南芥中都没有增强对细菌病原体的耐受性。异源表达OsWRKY42会增强拟南芥的耐盐性。OsWRKY42表达抑制纤维素酶和盐胁迫诱导的茉莉酸生物合成及响应基因的表达。我们的研究结果表明OsWRKY42在DTI中可能抑制了细胞壁损伤后诱导的JA反应。
结果
的表达OsWRKY42在CWDEs治疗时诱发
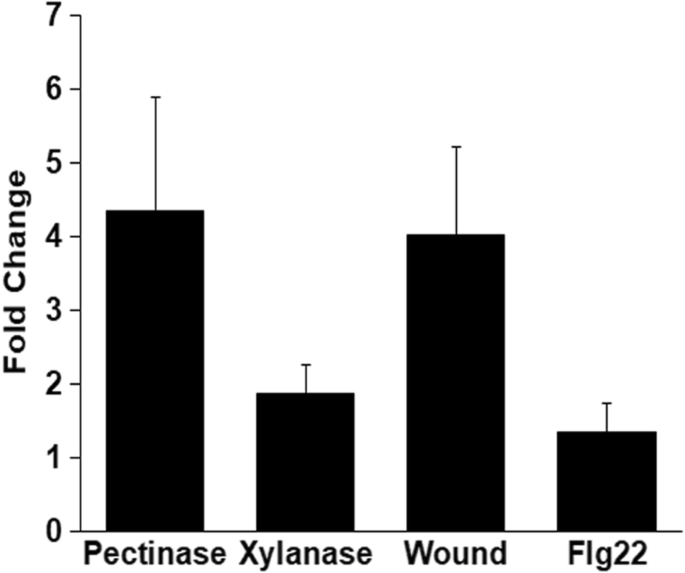
用LipA或里昂证券处理水稻叶片的转录谱分析表明OsWRKY42在处理后12 h上调[9,10].OsWRKY42LipA处理后2 h,水稻叶片中也有诱导表达(A Ranjan和R V Sonti,未发表数据;GSE53940)。有趣的是,OsWRKY42是唯一在LipA处理后2 h和12 h表达均上调的转录因子。水稻叶片也用市售的CWDEs处理,如果胶酶或木聚糖酶,以确定是否表达OsWRKY42在使用其他CWDEs治疗后诱发。的表达式OsWRKY42果胶酶处理后的诱导倍数为4倍,木聚糖酶处理后的诱导倍数为1.5 ~ 2倍(图2)。1).这与之前进行的微阵列分析中使用里昂证券或LipA处理后获得的水平相当[9,10].表达OsWRKY42吉恩在受伤后也升高了四倍。然而,OsWRKY42经Flg22处理后,未诱导表达。1).在三个独立的实验中也得到了类似的结果。
过度的OsWRKY42导致胼胝质沉积增强,但不提供增强的耐受性Xoo语水稻的感染
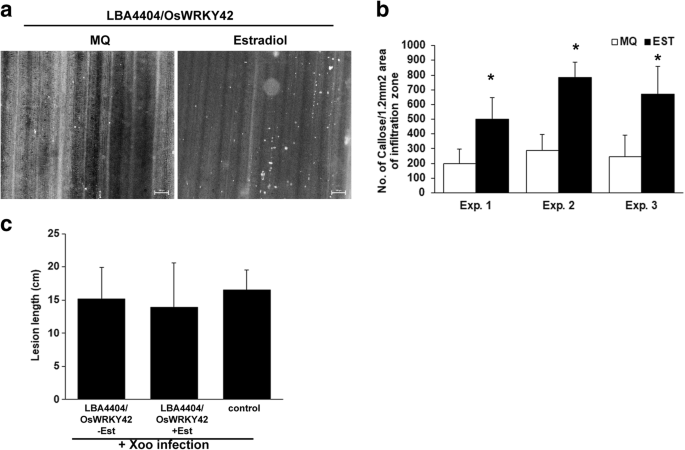
胼胝质的沉积是植物免疫反应的标志。它不仅是一种物理屏障,而且还含有一系列浸渍在其中的抗菌化合物[13].OsWRKY42在17-β雌二醇诱导载体pMDC7中克隆。OsWRKY42通过掺入或不掺入17-β雌二醇的农杆菌LB4404/pMDC7::OsWRKY42在水稻叶片中短暂过表达。17-β雌二醇单独不诱导水稻叶片胼胝质沉积[14].在qPCR分析中,表达OsWRKY42浸润12 h后升高2 - 3倍(数据未显示)。Western blotting证实OsWRKY42-2XFLAG蛋白瞬时过表达1:图S1)。水稻叶片过度表达OsWRKY42与对照组相比,显示出2至3倍的胼胝质沉积(p< 0.05)(图2-b).
瞬态过表达OsWRKY42增强水稻叶片胼胝质沉积,但不增强水稻叶片对细菌感染的耐受性。为测定胼胝质的沉积,用叶片(n= 10)的14日龄TN-1水稻幼苗农杆菌属菌株LBA4404/pMDC7::OsWRKY42与20 μM的17-β雌二醇(Est)或水。一个。16 h后,采集叶片,苯胺蓝染色,在荧光显微镜下观察。图像中的胼胝质沉积物为白色斑点。标尺为50 μm。b.人工计算每个观察区域的胼胝质沉积数量,并绘制出十个叶片的平均值。c.Xoo语感染发生在叶片的中脉(n= 15-20)。中静脉预注射LBA4404/pMDC7::OsWRKY42加或不加雌二醇。12 h后接种Xoo语在农杆菌注射点以下1-2厘米处,用浸在饱和培养物中的针扎Xoo语.病变表现为中静脉发黄,感染后10天测量病变长度。柱状代表平均病变长度。误差条表示标准差。数据分析使用学生的t-test for independent means(*表示与p值< 0.05)。在四个独立的实验中也得到了类似的结果
的过度表达OsWRKY42诱导胼胝质沉积,我们评估了它可能提供增强耐受性的可能性Xoo语水稻(BXO43株)侵染。为此,OsWRKY42在水稻叶片中脉中短暂表达,随后用浸于Xoo语.在感染后第10天,以病变长度的形式测量疾病进展。在有无诱导剂的情况下,病变长度(约15±5 cm)相似,无显著差异(图2)。2摄氏度).只感染过的稻叶Xoo语未接受任何LBA4404治疗的患者,也出现了相似大小的病变(约16厘米长)。因此,过度表达OsWRKY42增强胼胝质沉积,但不提供增强的耐受性Xoo语水稻感染。
异位表达OsWRKY42导致胼胝质沉积增强,但不能增强拟南芥对细菌感染的耐受性
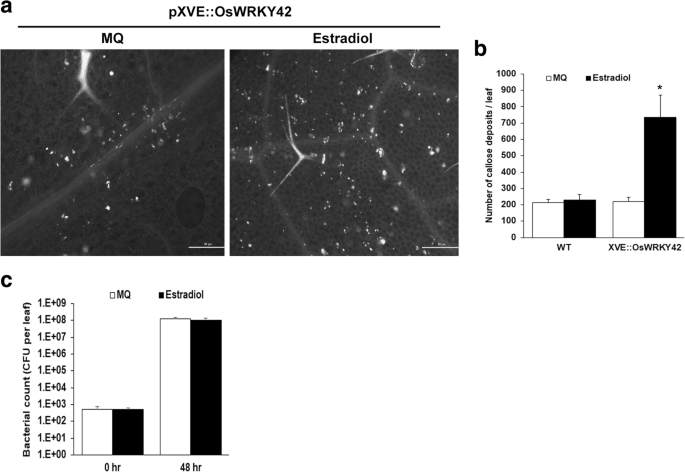
转基因拟南芥系表达OsWRKY42在雌二醇诱导启动子(XVE::OsWRKY42)的控制下生成。的影响OsWRKY42研究了3个独立品系的胼胝质的表达2表达高水平(30 - 75倍)的XVE::OsWRKY42植株OsWRKY42雌二醇治疗后(附加文件2:图S2)。野生型和XVE::OsWRKY42植株经雌二醇或水浸渍后16 h收获莲座期叶片,进一步处理进行胼胝质染色。感应的OsWRKY42表达导致胼胝质沉积数量增加3 - 5倍(图2)。3-b).野生型植物中雌二醇浸润后胼胝质的沉积数量与水浸润叶片中胼胝质的沉积数量相当,这表明雌二醇不会诱导野生型植物中胼胝质的沉积(图2)。3-b).
异位表达OsWRKY42在拟南芥中诱导胼胝质沉积,但不增强对细菌感染的耐受性。3周龄转基因拟南芥叶片2代携带17 β-雌二醇诱导剂OsWRKY42(XVE::OsWRKY42)用诱导剂(20 μM 17-β-雌二醇)或水用1ml无针注射器浸润。一个。为了测定胼胝质沉积,在16 h后采集叶片,用苯胺蓝染色,在荧光显微镜下观察。白点代表胼胝质沉积物。图中比例尺为50 μm。b.人工计数每片叶片的胼胝质沉积数量。该图表示每叶胼胝质沉积的平均数量(n= 5 - 6)。c.为太平洋标准时间感染试验,雌二醇预浸润的叶片被细胞浸润太平洋标准时间培养(OD = 0.01)。在感染后0-2天(dpi)收集样本(每株3片叶子),并处理以估计总细菌计数。在诱导(雌二醇)组和未诱导(水)组的五个独立植物的叶片中,分别计算了集落形成单位(CFU)的数量。数据分析使用学生的t-test for independent means(*表示与p值< 0.05)。误差条表示标准偏差。上述实验在3株独立的XVE::OsWRKY42转基因株系中重复进行
以确定是否OsWRKY42转基因拟南芥表达增强了拟南芥对细菌感染的耐受性OsWRKY42感染了两pv。番茄(Pst)无论是否含有雌二醇。在这些试验中,细菌被渗透到成年植物的莲座期叶片中。感染后2 d,平均细菌数为9 × 10812 × 108每叶的集落形成单位(CFU)有或没有表达OsWRKY42,分别。在存在或不存在的情况下,疾病进展无显著差异OsWRKY42感染后四天后的表达(数据未显示)。因此,异位表达OsWRKY42并没有增强拟南芥对细菌感染的耐受性(图;3 c).
的表达OsWRKY42盐胁迫下水稻的表达上调吗
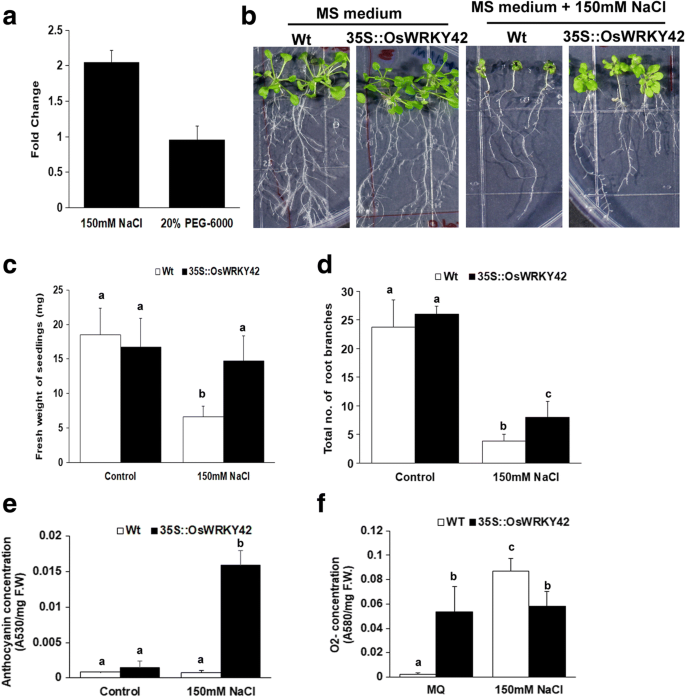
对公开的微阵列数据集的分析显示OsWRKY42水稻在干旱和盐度等非生物胁迫下诱导表达3.:表S1)。我们评估了OsWRKY42150 mM NaCl(盐胁迫)和20% PEG-6000(干旱胁迫)处理水稻幼苗后的表达。的表达式OsWRKY42在NaCl处理12 h后,与水处理对照相比,表达水平上调了两倍,但PEG-6000处理后,表达水平没有显著变化(图2)。4).
异位表达OsWRKY42增强拟南芥转基因株系对盐胁迫的耐受性。一个。将1周大的TN-1水稻幼苗(n = 10)分别浸入150 mM NaCl溶液中,浓度为20% (w/v) PEG-6000和mock(水)。处理后12 h收获叶片,进行qRT-PCR。计算了水处理样品的相对褶皱变化OsGAPDH被用作内部控制。b。为了测定耐盐性,一周大的拟南芥幼苗要么组成性表达OsWRKY42(35S::OsWRKY42)或野生型(Col-0) (n= 20)在MS琼脂培养基上培养,加或不加NaCl (150 mM, Merck)。(c - d)在处理后第15天,量化各组幼苗的总鲜重和根枝数。e.用150 mM NaCl或水处理3周龄的拟南芥(野生型和35S::OsWRKY42),以估算花青素含量。治疗后第十五天,离开(n= 3)在酸性甲醇中提取花青素。花青素用分光光度计估计,花青素含量用吸光度每毫克鲜重(F.W)表示。f.对成年植物离体叶片进行了ROS估算。将野生型或35S::OsWRKY42系的叶片(n = 15)放置在MS溶液(含或不含NaCl (150 mM))浸泡过的无菌滤纸上。处理12 h后,用NBT染色。O2−含量用分光光度法估计,并表示为每毫克鲜重的吸光度变化。用三种不同植物的叶子作为重复。数据分析采用单因素方差分析和Tukey-Karmer诚实显著性差异检验。横条上方的字母表示有显著差异p值< 0.05。在横线上方出现相同的字母表示没有观察到显著差异。在三个独立的35S::OsWRKY42转基因株系上重复实验
异位表达OsWRKY42导致转基因拟南芥植物对盐胁迫的耐受性增强
转基因拟南芥植物组成性表达OsWRKY42生成35S::OsWRKY42基因。三条独立的35S::OsWRKY42 T2表达量最高(150-300倍)的一代OsWRKY42所有实验均采用qPCR分析。在转基因拟南芥根细胞中,荧光显微镜证实OsWRKY42-GFP蛋白的稳定表达4:图S3)。将野生型拟南芥和35S::OsWRKY42拟南芥幼苗在MS琼脂培养基上加150 mM NaCl或不加150 mM NaCl培养15天。盐胁迫导致野生型和35S::OsWRKY42品系生长下降(图2)。4 b-d).然而,野生型幼苗的生长速度比表达型幼苗下降得更多OsWRKY42.在野生型植株中,与35S::OsWRKY42系相比,幼苗叶片较小,根系生长较差。在NaCl存在的情况下,的平均质量OsWRKY42转基因株系(以总鲜重计)明显多于野生株系(p< 0.05)(图4摄氏度).盐对野生型和35S::OsWRKY42系根系生长均有抑制作用。然而,与35S::OsWRKY42转基因株系相比,野生型幼苗的根枝数量显著减少。4 d).在无盐条件下,野生型和35S::OsWRKY42的总鲜重和根分枝具有可比性。4摄氏度-d).在三个实验重复中,三个独立的转基因株系也得到了类似的结果。
异位表达OsWRKY42诱导花青素的产生以应对盐胁迫
3周龄野生型和35S::OsWRKY42用150 mM盐或水处理15天。经盐处理后,35S::OsWRKY42系产生显著(p< 0.05)的花青素含量较高(图;4 e).与35S::OsWRKY42系相比,野生型植株表现出更多的萎蔫(数据未显示)。盐胁迫总是与ROS生成的增加有关[15].因此,我们估计氧自由基(O2−)使用硝基蓝四氮唑(NBT)。将3周龄野生型和35S::OsWRKY42拟南芥叶片分别用NaCl (150 mM)或水处理12 h。4 e).35S::OsWRKY42植株的ROS基础水平显著高于未处理的野生型。有趣的是,35S::OsWRKY42转基因株系经盐处理后ROS水平并没有进一步升高(图2)。4 e).
异位表达OsWRKY42结果抑制了盐和纤维素酶诱导的拟南芥JA生物合成和反应基因的表达
对里昂证券和LipA处理水稻叶片的微阵列分析表明,细胞壁损伤诱导了JA依赖的响应途径[9,10]。最近的一项研究也表明,盐对根生长的抑制作用是由JA介导的[16].因此,我们想知道是否OsWRKY42通过调控JA响应途径中的基因表达增强盐胁迫耐受性。采用qPCR方法研究了盐对1周生拟南芥JA生物合成及相关基因表达水平的影响。通过将野生型和35S::OsWRKY42转基因株系与水处理对照进行比较,估计了折叠变化。拟南芥JA生物合成基因的表达水平烯氧化物环3(AtAOC3),Lipoxygenase-2(AtLOX2)和JA反应基因,如Coronatine insensitive-1(AtCOI-1),茉莉酸ZIM motif 1 (AtJAZ1), AtJAZ10而且乙烯响应因子(AtERF)在野生型和35S::OsWRKY42系盐胁迫下进行了试验。上述JA生物合成及反应基因的表达均显著(p在盐胁迫下,35S::OsWRKY42系较野生型下调(图5)。5).在无胁迫条件下,上述基因的表达水平明显降低OsWRKY42表达行类似于野生类型(附加文件5:图S4)。
异位表达OsWRKY42抑制盐和纤维素酶诱导拟南芥转基因系JA生物合成和反应基因的表达。在35S::OsWRKY42转基因株系和野生型(Col-0)拟南芥经盐和纤维素酶处理后,检测JA生物合成和反应基因的表达。一个。盐处理:1周龄幼苗(野生型或35S::OsWRKY42)分别用MS或150 mM NaCl MS处理12 h。b。纤维素酶处理用2 U/ml纤维素酶(Sigma)浸润3周龄拟南芥(野生型或35S::OsWRKY42)叶片.12 h后收获叶片,进行qPCR分析。该图使用野生型或经水处理的35S::OsWRKY42系的表达值表示相对折叠变化。c。分别用LBA4404或LBA4404/pH7FWG2::OsWRKY42对14日龄水稻幼苗叶片进行注射渗透。处理后12小时,采集叶片进行qRT-PCR。计算对照的相对折叠变化(只渗透了LBA4404的叶片)。AtUBQ5而且OsGAPDH分别作为水稻和拟南芥的内源对照。三次生物重复的平均值被绘制在图表上。误差条表示标准偏差。数据分析使用学生的t-测试独立的方法。横条上方的星号表示与p值< 0.05。拟南芥实验在三个独立的35S::OsWRKY42转基因株系中重复进行
用纤维素酶处理莲座期叶片12 h后,测定了JA生物合成和反应基因的水平。纤维素酶处理诱导几种JA生物合成及反应基因的表达(AtAOC-3,AtCOI-1,AtJAZ1, AtJAZ10而且AtERF)(图。5 b).我们观察到JA生物合成和反应基因的表达显著(p与野生型相比,经纤维素酶处理后35S::OsWRKY42细胞系的表达降低< 0.05)。5 b).同样,JA生物合成的表达(烯氧化物合酶;Oxophytodienoate reducase -2;OsOPR2)和反应基因(OsJAZ13, OsJAZ8, OsMYC的瞬时过表达后,基因表达显著下调OsWRKY42在水稻叶片中(图;5度).这些基因在水稻叶片中里昂证券处理后12 h的时间点被上调[9].
OsWRKY42拟南芥表达系对MeJA诱导的生长抑制表现出耐受
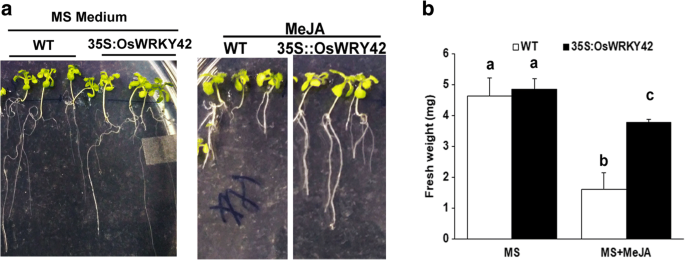
在有100 μM MeJA或无100 μM MeJA的MS琼脂上培养4 d的拟南芥幼苗(35S::OsWRKY42野生型)。MeJA处理1周后测定单株幼苗鲜重。在MeJA存在的情况下,与仅在MS上生长的幼苗相比,野生型幼苗的鲜重减少了约60%(图2)。6).相比之下,35S::OsWRKY42系的苗重仅比对照降低了30%(图2)。6 b).
讨论
OsWRKY42用细胞壁降解酶处理水稻,可诱导表达
我们早前已证明用CWDEs处理水稻叶片组织可诱导免疫反应,增强对随后感染的耐受性Xoo语[6].然而,水稻参与调控这一反应的功能尚不清楚。在之前进行的转录组分析中,OsWRKY42唯一的转录因子是在治疗后的早期和后期上调的吗Xoo语分泌脂肪酶[10].OsWRKY42用其他CWDEs如木聚糖酶和果胶酶处理以及损伤后也诱导表达。这表明,植物细胞壁的损伤诱导了蛋白的表达OsWRKY42在米叶中.然而,用细菌PAMP(如Flg22)处理没有诱导表达OsWRKY42(无花果。1).同时,OsWRKY42在水稻叶片中LPS处理后的转录组分析中没有上调[17].这表明OsWRKY42在使用CWDEs治疗后诱导表达,但在使用Flg22和LPS等PAMPs治疗后不诱导表达。
OsWRKY42表达诱导胼胝质沉积,但不增强对细菌感染的耐受性
最初我们是这样假设的OsWRKY42可能是CWDE诱导免疫反应的正向调节因子。因此,进行胼胝沉积和细菌感染试验。已知胼胝质沉积与免疫反应的诱导有关[13,18].PAMPs (Flg22、f - tu、几丁质、LPS)、DAMPs(寡半乳糖醛酸酯)和CWDEs处理已被证明可引发植物胼胝质沉积[6,17,18,19,20.,21].过度的OsWRKY42在水稻和拟南芥中诱导胼胝质沉积,但对细菌感染没有增强的耐受性,这表明OsWRKY42可能不是免疫反应的积极调节器胼胝质的组成是决定其在病原体入侵过程中所起作用的关键因素。这是可能的组成OsWRKY42诱导的胼胝质沉积可能不足以抵抗病原体感染。OsWRKY42过表达不能诱导胼胝质合成酶基因的表达(AtGSL5,-6,−7,−12),已知与增强对微生物感染的耐受性有关(附加文件6:图S6) [18].可能是胼胝质的沉积增强OsWRKY42过表达可能是由于其他一些胼胝质合酶的表达增强或通过转录后表达的变化AtGSL5,-6,−7,−12。.在大麦中,未被白粉病真菌渗透的胼胝质沉积物(Blumeria茎)所含的阿拉伯木聚糖、纤维素及胼胝质聚合物的含量明显高于已渗透的胼胝质沉积物[22,23].调控杂氧lan生物合成基因表达,改变大麦对白粉病的易感性[23].此外,植物抗毒素在胼胝体部位的沉积与抗真菌感染有关[24].因此,我们检测了植物抗毒素相关基因的表达(AtPAD3, AtCYB81F2, AtPEN2)和异氧基兰生物合成基因[(IRX9-L(β-1,4木糖转移酶)GT61(糖基转移酶家族61)MUR3(木葡聚糖半乳糖转移酶)OsWRKY42表达拟南芥转基因株系.植物抗毒素生物合成基因的表达不受基因表达的影响OsWRKY42但有两个基因参与了异氧基lan的生物合成,即IRX9-L而且MUR3,被发现降低了1.5到2倍OsWRKY42拟南芥转基因植物中的表达(附加文件)6:图S6)。这支持了假设OsWRKY42诱导的胼胝质沉积物可具有不促进增强对病原体感染的耐受性的组合物。另一种可能是胼胝质过表达OsWRKY42可能不是为了防止病原体入侵,但可能是细胞壁损伤后触发的细胞壁强化机制。胼胝质沉积为质膜和细胞壁提供机械强度,以抵御干旱、寒冷、重金属处理和磷缺乏等不同的非生物环境应力[13,25].因此,有可能胼胝质的沉积是由OsWRKY42表达可能是为了维持细胞壁的完整性,而不是为了增强对微生物感染的耐受性。
OsWRKY42表达增强了拟南芥对盐胁迫的耐受性
公开的微阵列数据表明表达OsWRKY42是由非生物胁迫如盐度引起的。我们的结果表明,氯化钠处理增强OsWRKY42水稻幼苗中的表达。异位表达OsWRKY42导致拟南芥对盐胁迫的耐受性增强。韩和同事证明了这一点OsWRKY42过表达水稻转基因株系显示ROS水平升高和早期衰老诱导[26].我们的结果表明OsWRKY42拟南芥表现出较高的ROS基础水平,但这对植株生长没有明显影响。这表明OsWRKY42表达拟南芥的植物能够通过一些尚未确定的机制克服ROS诱导的氧化损伤。此外,与野生型植物不同,盐处理后这些植物的ROS水平没有增加。这可能是因为广泛的花青素生产,观察到在OsWRKY42表示盐胁迫下的线条。在非生物胁迫下,会产生花青素等抗氧化色素以清除ROS [27,28].
已知JA或盐处理可诱导植物产生花青素[27,28,29].盐胁迫诱导JA水平,但没有直接证据表明盐胁迫下花青素的产生是由JA介导的。在野生型拟南芥的实验中,盐处理诱导了JA反应通路,但盐胁迫不诱导花青素的产生。OsWRKY42过表达系具有较高的ROS基础水平。可能是盐处理后ROS水平降低OsWRKY42如果在这些条件下没有被观察到的花青素的增强生产所清除,过表达系将达到更高的水平。因此,在OsWRKY42表达系植株产生花青素以清除过量的ROS。有许多关于花青素生产不依赖JA的机制的报道,其中包括其他激素,如细胞分裂素、乙烯、赤霉素酸和脱落酸[30.].在本研究中,在盐胁迫下观察到的花青素产量的增加可能与JA无关。
OsWRKY42表达下调了JA生物合成和反应基因的水平
最近对水稻和拟南芥的研究表明,盐胁迫介导的植物生长抑制涉及茉莉酸信号通路。水稻JA缺失突变体,cpm2而且hebiba,对盐胁迫的耐受性增强[31].过度的OsCYP94,一种水稻基因,已知能抑制JA反应,增加对盐胁迫的耐受性[32].此外,在拟南芥中,缺乏JA生物合成或反应的突变体(Aos, coi1, jaz3, myc2/3/4, jar1)更能耐受盐胁迫介导的根系生长抑制[16].这些研究表明,盐胁迫诱导了JA反应,是盐胁迫下植物生长受到抑制的原因之一。的表达OsWRKY42在拟南芥中显著下调盐诱导的JA生物合成和响应基因的表达。我们之前的研究表明,水稻叶片中CWDEs (LipA/ClsA)处理12小时后,JA生物合成或反应相关基因的表达上调[9,10].同样,在本研究中,我们发现用纤维素酶处理拟南芥叶片诱导了JA反应基因的表达。的表达OsWRKY42显著降低了纤维素酶诱导的JA生物合成和反应基因的表达.我们还观察到的瞬时表达式OsWRKY42在水稻叶片中抑制JA反应基因的表达。综上所述,上述结果表明OsWRKY42抑制水稻和拟南芥JA反应通路基因的表达。观察到OsWRKY42表达拟南芥植株对MeJA介导的生长抑制表现出增强的耐受性,这与这种可能性是一致的。
SA和JA信号通路在拟南芥中起拮抗作用[33].理想情况下,通过OsWRKY42应该上调SA反应通路,从而增强对太平洋标准时间感染。我们的qPCR分析显示SA反应基因水平(AtPR2,AtSID2)OsWRKY42之后,过表达行与wildtype (Col-0)相同太平洋标准时间感染(附加文件)7:图S5)。这表明,JA反应基因的抑制OsWRKY42不足以带来SA-JA的拮抗作用。因此,我们没有观察到任何增强的耐受性或敏感性太平洋标准时间在拟南芥植物中过度表达OsWRKY42.
OsWRKY42在JA介导的植物胁迫反应中起负调控作用
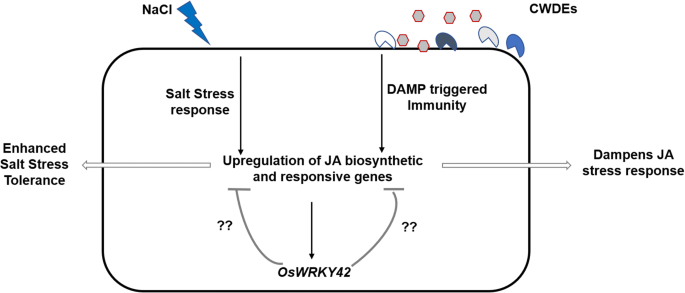
持续诱导的JA反应可能对植物有害。例如,用MeJA处理可以抑制拟南芥的根生长[34].水稻植株过度表达OsMYC2, JA反应基因,表现为矮子表型[35].丙烯氧化物环化酶在青蒿,对植物生长有负面影响[36].由于这些对生长的有害影响,JA诱导的反应需要得到有效的调控。为了严格调控,JA本身诱导其抑制因子如JAZ和拟南芥bHLH III类转录因子蛋白的表达[37,38].此外,MeJA处理水稻幼苗可诱导表达OsWRKY42(附加文件8:图S7)。在这里,我们提出OsWRKY42可以作为JA介导的反应的负调控因子,这些反应是在用CWDE或盐处理后诱导的(图。7.)及CWDE所致OsWRKY42表达旨在抑制JA反应。
的最接近的同类OsWRKY42在拟南芥中,AtWRKY11而且AtWRKY17,分别具有42%和40%的氨基酸序列相同,也被报道为负调控因子太平洋标准时间诱导的基础免疫反应[39].Chen和同事已经定量了JA在OsWRKY42过表达水稻转基因株系的JA基础水平显著低于野生型。目前还不清楚是怎么回事OsWRKY42可能抑制JA反应。这可能是通过直接抑制JA生物合成/反应相关基因的表达,或通过抑制JA生物合成/反应相关基因的阳性激活因子间接实现的。
结论
增强表达OsWRKY42CWDEs或盐处理后可能会抑制JA介导的应激反应。
方法
植物材料和生长条件
以台中原生1号(TN-1)为试验材料,对14 d温室育苗进行胼胝质沉积和qRT-PCR分析。采用40 d温室生长TN-1植株Xoo语感染化验。拟南芥哥伦比亚生态型(Col-0)被用作野生型,也用于转基因植物的生成。在所有实验中,拟南芥种子均用灭菌液(70%乙醇含0.1%吐温-20)表面消毒15分钟,然后用无菌MilliQ纯净水(MQ)冲洗5次。种子在1 / 2 MS (Murashige和Skoog’s)琼脂培养基(pH值5.8)上发芽。将一周大的拟南芥幼苗放入有土壤(蛭石:珍珠岩:组培混合物以1:1:2的比例)的花盆中,并在植物生长室(Percival)中生长,环境温度为22°C,光照周期为12小时/12小时/天。
菌株和生长条件
根癌土壤杆菌菌株LBA4404用于水稻瞬态转化试验和拟南芥转基因植株的生成。携带不同植物表达载体的LB4404菌株衍生物(附加文件9:表S3)在Luria Bertani (LB;HiMedia)汤。Xoo语菌株BXO43(实验室野生型)在PSA(蛋白胨10 g L−1、蔗糖10 g L−1,琼脂12 g L−1)利福平培养基(25 mgL-1)。两pv。番茄(太平洋标准时间DC3000维持在King 's基础琼脂培养基(HiMedia)上,用于植物接种,培养物在含有利福平(25 mgL-1)的LB肉汤中28°C生长过夜。
利用网关克隆系统获得植物表达质粒pMDC7::OsWRKY42和pH 7FWG2::OsWRKY42
的OsWRKY42LOC_Os02g26430基因编码一个长度为762 bp的CDS。如前所述,利用上标III逆转录酶(Invitrogen)从LipA处理过的TN-1水稻叶片(处理后2小时)中分离出的总RNA制备cDNA [10].的OsWRKY42根据制造商说明书(Invitrogen),通过Gateway克隆将2 × FLAG标记的基因克隆到诱导植物表达载体pMDC7中。在pMDC7中,基因表达受17-β雌二醇诱导的XVE启动子控制。用于生成c端GFP标记OsWRKY42将该基因无终止密码子克隆到pH值为7FWG2的植物表达载体中。该基因在CaMV35S启动子下和蛋白c端GFP标记下组成型表达。这些植物表达载体包含OsWRKY42变成了答:tumefeciensLBA4404菌株经电穿孔培养,并在含有适当抗生素的培养基上选择(附加文件)9:表S3)。LBA4404/pMDC7::OsWRKY42克隆通过集落PCR确认,随后使用载体特异性引物对PCR扩增子进行测序(附加文件10:表S2)。
实时定量PCR (qRT-PCR)分析
使用TRIzol试剂(赛默飞世尔科学公司)从拟南芥或水稻叶片中分离总RNA。RNA的质量在琼脂糖凝胶上检查,然后按照制造商的说明进行DNaseI (NEB)处理。使用RNA to cDNA EcoDry预混试剂盒(Clontech, Takara),用1 μg总RNA和寡聚(dT)引物合成cDNA。使用Power SYBR Green/ROX Master Mix(赛默飞世尔科学公司)在7900 HT序列检测系统(美国应用生物系统公司)上对1微升1:10倍稀释的cDNA进行qRT-PCR。OsGAPDH而且AtUBQ5分别作为水稻和拟南芥的内对照。qPCR所用引物(附加文件10:表S2)采用Quantprime设计[40].用2——ΔΔCt方法(41].
水稻的生物和非生物胁迫处理
分别用木聚糖酶(2u /ml, Sigma)、果胶酶(2u /ml, Sigma)、Flg22 (100 μM, Genescript)和水对14日龄TN-1植株叶片进行浸渍。对14日龄TN-1水稻幼苗叶片进行针刺8-10次,并用水喷洒,以测定其对伤害的反应[7].处理后12小时收获叶片,按照前面提到的方法进行qRT-PCR。在非生物胁迫处理中,将一周大的TN-1水稻幼苗分别浸入150 mM NaCl溶液(盐度胁迫)、20% (w/v) PEG-6000(干旱胁迫)和水(模拟)。处理过的幼苗在温室里培养。处理12小时后收获叶片,如前所述进行qRT-PCR处理。为了研究的效果OsWRKY42对JA反应基因表达的影响OsWRKY42被执行。为此,对14天大的TN-1水稻幼苗进行了LBA4404或LBA4404/pH7FWG2::OsWRKY42浸种.处理后12 h收获叶片,进行qRT-PCR分析。
胼胝质沉积
对于水稻中的胼胝质沉积测定,OsWRKY42在14天龄TN-1幼苗叶片中短暂过表达。LB4404 / pMDC7::OsWRKY42在28°C的LB肉汤中过夜。培养物用无菌水冲洗,重悬(OD600= 0.8)的诱导液[10 mM MES (Sigma), pH 5.6, 200 μM乙酰丁香酮(HiMedia)]。用1 ml无针注射器分别用17-β雌二醇(20 μM, Sigma)和无17-β雌二醇(20 μM, Sigma)浸种水稻叶片。浸渍16 h后收获叶片,染色获得胼胝质。将收获的叶片固定在乙醇:乙酸(3:1)溶液中4小时,并定期更换溶液,直到去除所有叶绿素色素。叶片分别在70%乙醇和50%乙醇中再水化2小时,然后在水中再水化2小时。叶片在0.01% (w/v)苯胺蓝溶液中磷酸钾缓冲液(150 mM;pH 9.5) (Millet et al., 2010)。使用荧光显微镜(ECLIPSE Ni-E, Nikon),用蓝色滤光片(激发波长365 nm),在10倍放大倍率下观察和成像胼胝质沉积。在每个实验中,从至少6个叶片的每个视野中,每片叶片观察8个不同的视野,统计胼胝质沉积的数量。进行了三个独立的实验。
胼胝质的沉积也在T2转基因拟南芥株系(XVE::OsWRKY42)过表达OsWRKY42在17-β-雌二醇诱导体系下。用1 ml无针注射器分别用诱导剂(20 μM 17-β-雌二醇)或水(mock)浸渍3周龄植株的莲花期叶片。浸渍16小时后,采收叶片,按上述方法进行处理。
西方墨点法
用含或不含雌二醇的LBA4404/ pMDC7::OsWRKY42饱和农杆菌培养物对14天龄TN-1水稻幼苗叶片进行浸润。16-18小时后,将浸润区域切割,在液氮中研磨,然后在裂解缓冲液(50 mM Tris-HCl [pH 7.5], NaCl [150 mM],甘露醇[250 mM], EDTA [5 mM], 10%甘油,1 mM DTT 1% TritonX100, 1 mM PMSF, 1 mM NaF)中均质,并加入植物蛋白酶抑制剂鸡尾酒(Sigma-Aldrich) [42].总蛋白上清在4℃下15000 g离心15 min后分离,以去除细胞碎片。用10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离等量的分离蛋白上清。采用抗flag (AbCAM)抗体Western blot检测OsWRKY42蛋白。检测HRP偶联抗兔二抗(AbCAM),并用Luminata Forte HRP底物(Millipore)观察蛋白条带。在Vilber loourmat化学发光成像系统下,使用Chemi-capt 5000软件(版本12.8;Vilber Lourmat)。
Xoo语水稻感染
的瞬态过表达OsWRKY42在TN-1水稻叶片中,农菌LBA4404/pMDC7::OsWRKY42在28℃LB肉汤中培养过夜。培养物用无菌水冲洗一次,重悬(OD600= 0.8)的感应溶液(如上所述)。用含雌二醇或不含雌二醇的1 ml注射器,将细菌混悬液注入40日龄水稻叶片中脉。12小时后,叶片中脉感染野生型Xoo语(BXO43菌株)用针刺到生长在PSA(蛋白胨10 g L)上的新鲜菌落−1、蔗糖10 g L−1,琼脂12 g L−1).感染后第10天测量病变长度。
转基因拟南芥植株的生成
拟南芥Col-0生态型(野生型)转化农杆菌属用花浸法检测携带pMDC7::OsWRKY42或pH 7FWG2::OsWRKY42的菌株LBA4404 [43].在含25 μg/ml湿霉素的MS琼脂培养基上选择转基因幼苗。T的转基因性质1通过直接PCR (Terra PCR直接聚合酶试剂盒,Clontech使用叶片组织并对扩增产物进行测序)进一步确认。T2三个独立的转基因株系的后代被用于功能研究。通过诱导pMDC7::OsWRKY42转基因株系(XVE::OsWRKY42)进行胼胝质沉积和细菌感染的检测OsWRKY42.组成型表达的转基因株系OsWRKY42pH值7FWG2::OsWRKY42生成,用于盐胁迫响应研究。
p .两拟南芥植物的侵染
十二个小时。接种前,用无针注射器用雌二醇(20 μM)或水预浸4周龄植株叶片。为太平洋标准时间感染后,细菌在含有利福平(25 mgL-1)的LB肉汤中28°C生长过夜。用无菌水冲洗培养物,在10 mM MgCl中重悬(OD600 = 0.01)2解决方案。用1毫升无针注射器将上述悬浮液浸入预处理过的叶子(雌二醇或水)中。如前所述,通过测量叶片中的细菌生长来监测疾病进展[44].简单地说,在感染后的不同日子(0-2-4 dpi)收获的感染叶片在10 mM MgCl中均质2并连续稀释以测定细菌总数。每个数据点由5个重复组成。
拟南芥幼苗的盐处理
研究了野生型和T型对盐胁迫的响应2组构表达的转基因拟南芥(35S::OsWRKY42)的生成OsWRKY42。转基因幼苗(n= 20)在含湿霉素的MS琼脂上进行筛选。一周大的幼苗(35S::OsWRKY42或野生型)转移到加或不加NaCl (150 mM, Merck)的MS琼脂培养基上。处理后第15天测定幼苗根枝数和总鲜重(mg)。盐对植物生长的影响OsWRKY42比较了转基因株系和野生型(Col-0)。实验在三个独立的转基因株系中重复进行了三次。
采用实时荧光定量PCR (qRT-PCR)技术,分析了盐处理后组成表达35S::OsWRKY42转基因株系和野生型JA生物合成及反应基因的表达。为此,将一周大的幼苗(n = 20)放置在MS溶液浸泡过的无菌滤纸上,有或没有NaCl (150 mM)。处理12小时后进行qRT-PCR分析。
花青素估计
将3周生拟南芥(野生型和35S::OsWRKY42本构系)分别用150 mM NaCl和水处理15天。第15天,称量叶片,在液氮中粉碎。花青素在酸性甲醇(1% HCl在甲醇中)中提取,用Eppendorf生物分光光度计在530 nm和657 nm处测量提取物的吸光度。计算每毫克叶片组织花青素含量[31].
NBT法测定拟南芥叶片活性氧含量
野生型或组成型表达的三周生拟南芥植株的叶盘OsWRKY42(35S::OsWRKY42)放置在MS溶液(含或不含NaCl (150 mM))浸泡过的无菌滤纸上。处理12小时后,将叶片浸泡在2 ml NBT溶液中[0.05% NBT (w/v)和10mmnan3.溶解于pH 7.8的10mm磷酸钾缓冲液中]并在室温下孵育一小时[45].孵育后,将溶液在85°C下煮沸15分钟,并立即冷却以停止反应。用Eppendorf生物分光光度计在580 nm处测定吸光度。O2−计算每毫克组织的含量。
纤维素酶对拟南芥叶片的处理
用无针注射器对3周龄植株(野生型和35S::OsWRKY42本构系)叶片进行纤维素酶(2g Sigma)或水的浸润。处理后12小时收获叶片,如前所述进行qRT-PCR处理。
甲基茉莉酸(MeJA)对拟南芥幼苗的处理
研究了MeJA处理对T的生长反应2转基因(35S::OsWRKY42)或野生型拟南芥的后代。一星期大的幼苗(n= 10),在含有MeJA (100 μM, Sigma-Aldrich)或DMSO(对照)的MS琼脂培养基上培养。处理后第7天,测定单株幼苗的生长(鲜重)。实验在三个独立的转基因株系中重复进行了三次。
统计数据
除非特别提到,所有实验至少进行了3次生物重复。所有拟南芥实验均在三个独立的转基因系中进行。统计分析使用学生的t-在Microsoft Excel软件中测试。采用单因素方差分析(one - one - ANOVA)和Tukey-Karmer诚实显著性差异检验(significant difference test)对盐和MeJA处理后拟南芥幼苗的数据进行分析。
缩写
- 里昂证券(ClsA):
-
CellulaseA
- CWDE:
-
细胞壁降解酶
- 潮湿:
-
损伤相关分子模式
- DTI:
-
DAMP触发免疫
- 美国东部时间:
-
17β雌二醇
- 绿色荧光蛋白:
-
绿色荧光蛋白
- 是:
-
茉莉酸
- 脂肪酶:
-
脂肪酶/酯酶
- 女士:
-
Murashige和Skoog的
- 太平洋标准时间:
-
两pv。番茄DC3000
- ROS:
-
活性氧
- TN-1:
-
台中Native-1
- Xoo语:
-
黄oryzaepv。oryzae
参考文献
- 1.
史密斯LG。植物细胞分裂:在正确的地方筑墙。中国生物化学,2001;2(1):33-9。
- 2.
Vorwerk S, Somerville S, Somerville C.植物细胞壁多糖组成在抗病中的作用。植物科学进展,2004;9(4):203-9。
- 3.
Bergey DR, Ryan CA.伤口和系统诱导钙调蛋白基因在番茄叶片中的表达。植物分子生物学。1999;40(5):815-23。
- 4.
Davis KR, Lyon GD, Darvill AG, Albersheim P.宿主-病原体相互作用:第25页。Erwinia carotovora的内聚半乳糖醛酸裂解酶通过释放植物细胞壁碎片诱导植物抗毒素的积累。植物科学进展。1984;74(1):52-60。
- 5.
沃尔顿JD。解构细胞壁。植物科学进展。1994;40(4):439 - 444。
- 6.
贾哈,拉杰什瓦里,松提RV。两株水稻白单胞菌的功能相互作用。水稻毒力调节中的水稻菌分泌系统。Mol植物-微生物相互作用。2007;20(1):31-40。
- 7.
吴凯,Heil M, Ibarra-Laclette E, Adame-Álvarez RM, Martínez O, Ramirez-Chávez E, Molina-Torres J, Herrera-Estrella L.植物感知伤口的损伤自我识别:基于植物来源的激发子和诱导的十八尖素信号。公共科学学报,2012;7(2):e30537。
- 8.
Souza CA, Li S, Lin AZ, Boutrot F, Grossmann G, Zipfel C, Somerville SC.纤维素衍生低聚物作为损伤相关分子模式并触发防御样反应。中国生物医学工程学报,2017;29(4):344 - 344。
- 9.
Jha G, Patel HK, Dasgupta M, Palaparthi R, Sonti RV。水稻白单胞菌(Xanthomonas oryzae pv.)诱导的水稻叶片超敏反应的转录谱分析。Oryzae纤维素酶。大米。2010;3(1):21。
- 10.
Ranjan A, Vadassery J, Patel HK, Pandey A, Palaparthi R, Mithofer A, Sonti RV。水稻叶片中茉莉酸盐生物合成和茉莉酸盐反应基因的上调对细菌病原体模拟的响应。中国生物医学工程学报。2015;15(3):363-73。
- 11.
Pandey SP, Somssich IE。WRKY转录因子在植物免疫中的作用。植物科学进展。2009;30(4):344 - 344。
- 12.
程红,刘辉,邓勇,肖娟,李霞,王松。水稻抗真菌病需要WRKY45-2 WRKY13 WRKY42转录调控级联。中国生物医学工程学报。2015;37(3):344 - 344。
- 13.
Luna E, Pastor V, Robert J, Flors V, Mauch-Mani B, Ton J.胼胝沉积:多面植物防御反应。Mol植物-微生物相互作用。2011;24(2):183-93。
- 14.
Sinha D, Gupta MK, Patel HK, Ranjan A, Sonti RV。水稻白单胞菌3型分泌系统效应子XopN、XopQ、XopX和XopZ抑制了细胞壁降解酶诱导的水稻先天免疫应答。Oryzae。公共科学学报,2013;8(9):e75867。
- 15.
长谷川总理,Bressan RA, Zhu JK, Bohnert HJ。植物细胞和分子对高盐度的响应。植物物理学报2000;51:463-99。
- 16.
Valenzuela CE, Acevedo-Acevedo O, Miranda GS, Vergara-Barros P, Holuigue L, Figueroa CR, Figueroa PM。盐胁迫响应触发茉莉酸信号通路的激活,从而抑制拟南芥初生根的细胞伸长。中国生物医学工程学报,2016;36(4):339 - 344。
- 17.
Girija AM, Kinathi BK, Madhavi MB, Ramesh P, Vungarala S, Patel HK, Sonti RV。水稻叶片转录谱显示水稻白单胞菌与水稻白单胞菌之间存在功能上的相互作用。水稻脂多糖和胞外多糖在感染期间调节防御反应中的作用。Mol植物-微生物相互作用,2017;30(1):16-27。
- 18.
植物防御相关乳头中胼胝体介导的对致病入侵者的抗性。中国植物科学,2014;5:(168)。
- 19.
Millet YA, Danna CH, Clay NK, Songnuan W, Simon MD, Werck-Reichhart D, Ausubel FM。拟南芥根中微生物相关分子模式激活的先天免疫反应。植物学报。2010;22(3):973-90。
- 20.
张杰,邵峰,李勇,崔浩,陈琳,李辉,邹勇,龙超,兰丽,柴静,等。丁香假单胞菌效应失活MAPKs抑制pamp诱导的植物免疫。细胞宿主微生物。2007;1(3):175-85。
- 21.
Galletti R, Denoux C, Gambetta S, Dewdney J, Ausubel FM, De Lorenzo G, Ferrari S.寡半乳糖在拟南芥中诱导atrbohd介导的氧化爆发是激活有效防御灰霉病(Botrytis cinerea)反应的必要条件。植物科学进展。2008;29(3):344 - 344。
- 22.
赵德华,张志刚,张志刚,张志刚。小麦白僵菌侵染大麦乳突和未侵染乳突中胼胝体、阿拉伯木聚糖和纤维素积累的差异。Sp.hordei。植物学报。2014;204(3):650-60。
- 23.
Chowdhury J, Lück S, Rajaraman J, Douchkov D, Shirley NJ, Schwerdt JG, Schweizer P, Fincher GB, Burton RA, Little A.木聚糖生物合成基因表达改变对白粉病渗透抗性的影响。中国植物科学,2017;8:445。
- 24.
Schmelz EA, Huffaker A, Sims JW, Christensen SA, Lu X, Okada K, Peters RJ。单子叶萜类植物抗毒素的合成、诱导及作用。植物学报(自然科学版);2014;26(4):457 - 457。
- 25.
斯塔斯A,霍斯特WJ。第4.4.4章-胼胝质在非生物胁迫A2 - Bacic,安东尼。入:芬奇GB,斯通BA,编辑。1-3 β葡聚糖和相关多糖的化学、生物化学和生物学。圣地亚哥:学术出版社;2009.p . 499 - 524。
- 26.
汉米,Kim bxcy李J,李兆,全J s。OsWRKY42抑制OsMT1d,诱导水稻活性氧和叶片衰老。分子与细胞。2014;37(7):532-9。
- 27.
柯维尼奇,杨晓明,杨晓明,杨晓明,等。非生物胁迫对拟南芥花青素定位的影响。植物信号行为。2015。
- 28.
盐胁迫与高等植物花青素含量的关系。生物技术与生物技术装备,2014;20(1):47-52。
- 29.
单晓,张勇,彭伟,王忠,谢东。茉莉酸诱导拟南芥花青素积累的分子机制。中国机械工程学报,2009;26(3):389 - 397。
- 30.
Loreti E, Povero G, Novi G, Solfanelli C, Alpi A, Perata P.赤霉素,茉莉酸和脱落酸调节蔗糖诱导的拟南芥花青素生物合成基因的表达。植物学报,2008;26(4):344 - 344。
- 31.
李志刚,李志刚,李志刚。水稻抗盐胁迫能力的增强与水稻抗盐胁迫能力的增强有关。中国生物医学工程学报,2015;26(11):349 - 349。
- 32.
黑谷K,隼K,畑中S,户田Y,小川D,市川H,石丸Y,田下R,铃木T,上田M,等。CYP94家族基因表达水平的升高缓解了茉莉酸盐反应,增强了水稻的耐盐性。植物生理学报。2015;26(4):779-89。
- 33.
Robert-Seilaniantz A, Grant M, Jones JDG。植物疾病和防御中的激素对话:不仅仅是茉莉酸-水杨酸拮抗作用。植物科学进展。2011;49(1):317-43。
- 34.
王晓明,王晓明,王晓明,等。茉莉酸甲酯对拟南芥突变体根系生长和叶片蛋白诱导的抑制作用减弱。中国科学:自然科学,2001;29(3):344 - 344。
- 35.
Uji Y, Taniguchi S, Tamaoki D, Shishido H, Akimitsu K, Gomi K. OsMYC2的过表达导致水稻早期ja - r敏感基因表达上调,提高水稻抗白叶枯病能力。植物物理学报。2016;57(9):1814-27。
- 36.
吴坤,陆旭,张峰,沈强,姜伟,潘强,吕震,闫涛,付霞,王勇,等。alene oxide环化酶在黄花蒿(Artemisia annua)中的过表达促进了青蒿素的生物合成。科学通报,2014;9(3):e91741。
- 37.
于红,宋松,齐涛,范敏,张霞,高红,黄红,吴东,郭红,谢东。bHLH亚群IIId因子负向调控茉莉酸介导的植物防御和发育。公共科学图书馆,2013;9(7):e1003653。
- 38.
Santner A, Estelle M. JAZ蛋白将茉莉酸盐感知与转录变化联系起来。植物细胞学报。2007;19(12):3839-42。
- 39.
Journot-Catalino N, Somssich IE, Roby D, Kroj T.转录因子WRKY11和WRKY17是拟南芥基础抗性的负调控因子。植物细胞学报。2006;18(11):3289-302。
- 40.
Arvidsson S, Kwasniewski M, Riano-Pachon DM, muller - roeber B. QuantPrime -用于定量PCR的高通量引物设计的灵活工具。生物信息学。2008;9(1):465。
- 41.
Livak KJ, Schmittgen TD。使用实时定量PCR和2−ΔΔCT方法分析相关基因表达数据。方法。2001;25(4):402 - 8。
- 42.
Gupta MK, Nathawat R, Sinha D, Haque AS, Sankaranarayanan R, Sonti RV。水稻白单胞菌预测活性位点突变。oryzaeXopQ differentially affect virulence, suppression of host innate immunity, and induction of the HR in a nonhost plant. Mol Plant-Microbe Interact. 2015;28(2):195–206.
- 43.
刘志刚,张志刚,张志刚。农杆菌介导拟南芥转化的一种简化方法。植物学报,1998;16(6):735-43。
- 44.
Starkey M, Rahme LG。铜绿假单胞菌在植物寄主中的发病机制建模。网络学报。2009;4(2):117-24。
- 45.
Sagor GH, Zhang S, Kojima S, Simm S, Berberich T, Kusano T.降低拟南芥细胞质多胺氧化酶活性通过减少活性氧产生和增加防御基因表达来提高盐和耐旱性。前沿植物科学,2016;7:214。
确认
我们感谢蔡南海(洛克菲勒大学)和Ueli Grossniklaus(苏黎世大学)提供pMDC7质粒。我们感谢T. Lavanya对手稿的严格审查。
资金
这项工作得到了印度政府科学和工业研究委员会(CSIR)植物-微生物和土壤相互作用(PMSI)项目的资助。SEP承认大学教育资助委员会(UGC),新德里博士奖学金。这项工作还得到了印度政府科学技术部的J. C. Bose奖学金对RVS的支持。
数据和材料的可用性
在当前研究期间生成和分析的数据集可根据合理要求从通讯作者处获得。
作者信息
从属关系
贡献
SEP、HKP和RVS设计了本研究。SEP和CK进行了研究。SEP、HKP和RVS对数据进行了分析。SEP和RVS撰写了论文。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
附加文件
附加文件1:
图S1。瞬态表达式OsWRKY42经Western blotting证实,水稻叶片中存在明显的基因突变。叶子(n用农杆菌LBA4404/pMDC7::OsWRKY42和20 μM 17-β雌二醇(Est)/ Water对14日龄水稻幼苗进行了10)的注射。16小时后采集叶片,在蛋白提取缓冲液中粉碎,进行Western blotting。OsWRKY42蛋白用抗flag抗体检测(大小约29 kDa)。(TIF 470kb)
附加文件2:
图S2。雌二醇诱导表达OsWRKY42在XVE::OsWRKY42转基因拟南芥中。用1 ml无针注射器分别用诱导剂(20 μM 17-β-雌二醇)或水浸渍3周龄植株叶片。浸泡16小时后,采集叶片进行qPCR分析。该图表示相对折叠变化(2——∆∆Ct)用Est处理后的表达值与水处理后的样品进行比较。AtUBQ5作为qPCR分析的内对照。误差条表示标准偏差。(TIF 3271 kb)
附加文件3:
表S1。OsWRKY42在各种生物和非生物胁迫下诱导表达。(docx17 kb)
附加文件4:
图S3。镜检证实OsWRKY42- gfp蛋白在35S::OsWRKY42中有异位表达。在荧光显微镜下观察OsWRKY42- gfp蛋白在拟南芥35S::OsWRKY42转基因系中的表达。1周龄35S::OsWRKY42幼苗直接放置于培养培养基上,在GFP过滤器和DIC下使用epifluorescence显微镜观察。此处显示的图像是根尖的顶端区域,显示gfp标记的OsWRKY42的表达。标尺为20 μm。(TIF 1956 kb)
附加文件5:
图S4。的本构表达式OsWRKY42对未受胁迫的35S::OsWRKY42拟南芥转基因系JA生物合成和反应基因水平无影响。采集3周龄野生型或35S::OsWRKY42转基因拟南芥叶片,进行qPCR分析。AtUBQ5作为qPCR分析的内对照。该图表示相对折叠变化(2——∆∆Ct)在野生型植物上使用35S::OsWRKY42的表达值。三种生物样本的平均值被绘制在图中。误差条表示标准偏差。在三个独立的35S::OsWRKY42转基因株系上重复实验。(TIF 993 kb)
附加文件6:
图S6。异位表达OsWRKY42改变异氧基兰生物合成相关基因的表达,但不影响不同胼胝质合酶基因的表达。用1 ml无针注射器分别用诱导剂(20 μM 17-β-雌二醇)或水浸渍3周龄植株叶片。浸泡12小时后,采集叶片进行qPCR分析。该图表示相对折叠变化(2——∆∆Ct)用Est处理后的表达值与水处理后的样品进行比较。AtUBQ5作为qPCR分析的内对照。误差条表示标准偏差。上述实验在两个独立的转基因株系中重复进行。(TIF 2938kb)
附加文件7:
图S5。异位表达OsWRKY42不改变SA反应基因的表达太平洋标准时间感染的拟南芥叶子。以35S::OsWRKY42转基因拟南芥和野生型(Col-0)拟南芥叶片为研究对象,用a太平洋标准时间培养(OD = 0.01)。在感染12小时后收集样本(每株3片叶子),并使用SA反应基因特异性引物进行qRT-PCR处理AtPR2而且AtSID2.该图表示相对折叠变化(2——∆∆Ct)使用的表达式值太平洋标准时间被感染的样本多于未感染的样本AtUBQ5作为内源性对照。三次生物重复的平均值被绘制在图表上。误差条表示标准偏差。(TIF 1135kb)
附加文件8:
图S7。MeJA处理诱导OsWRKY42表达。对14 d龄的水稻幼苗叶片分别喷洒水和MeJA(100 μM)。处理4小时后,采集叶片进行qRT-PCR。计算了水处理对照的相对折叠变化。OsGAPDH作为内源性对照。图表示三次生物重复的平均值,误差条表示标准偏差。(TIF 715kb)
附加文件9:
表S3。菌株及质粒清单。(docx17 kb)
附加文件10:
表S2。引物清单。(docx24kb)
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
皮莱,s.e.,库马尔,C.,帕特尔,H.K.et al。过度表达一种细胞壁损伤诱导的转录因子OsWRKY42,导致胼胝质的沉积和对盐胁迫的耐受性增强,但不增强对细菌感染的耐受性。BMC植物生物学18日,177(2018)。https://doi.org/10.1186/s12870-018-1391-5
收到了:
接受:
发表:
关键字
- 细胞壁降解酶
- WRKY转录因子
- OsWRKY42
- 胼胝质沉积
- 盐度的压力
- 茉莉酸