- 研究文章gydF4y2Ba
- 开放访问gydF4y2Ba
- 发表:gydF4y2Ba
茉莉酸促进生长素诱导的暗生长的不定根gydF4y2Ba拟南芥gydF4y2Ba幼苗和茎薄细胞层通过乙烯信号传递和木质素发生的调控gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba18.gydF4y2Ba, 文章编号:gydF4y2Ba182gydF4y2Ba(gydF4y2Ba2018年gydF4y2Ba)gydF4y2Ba
抽象的gydF4y2Ba
背景gydF4y2Ba
植物生存通常需要不定根(ARS),对成功的微扫描至关重要。在gydF4y2Ba拟南芥gydF4y2Ba暗生长幼苗的ar形成发生于下胚轴,并通过吲哚-3-丁酸(IBA)和激动素(Kin)的联合应用而增强。同样的IBA + kin处理可诱导薄细胞层(TCLs)中ar的形成。生长素在许多物种和实验系统中是ar形成和木质素发生的主要诱导剂。在拟南芥的下胚轴和tcl中,木质部发生与ar的形成是竞争的。Jasmonates (JAs)对去黄化拟南芥幼苗ar的形成有负面影响,但对烟草暗生IBA + Kin TCLs ar的形成和木质素发生均有正面影响。在拟南芥中,JAs和生长素在ar形成和木质素发生中的相互作用需要研究。在去黄化的拟南芥幼苗中,生长素响应因子ARF6和ARF8正调控ar的形成,而ARF17负调控ar的形成,但它们在木质素发生中的作用尚不清楚。生长素和乙烯(ET)之间的交互作用也通过EIN3/EIL1信号通路在ar形成和木质素发生中起重要作用。EIN3/EIL1是JA和et信令的直接链路。本研究探讨了JA在拟南芥暗苗和tcl中ar形成和木质素发生中的作用,以及与ET和生长素的关系。 The JA-donor methyl-jasmonate (MeJA), and/or the ET precursor 1-aminocyclopropane-1-carboxylic acid were applied, and the response of mutants in JA-synthesis and -signalling, and ET-signalling investigated. Endogenous levels of auxin, JA and JA-related compounds, andARF6.gydF4y2Ba,gydF4y2BaARF8.gydF4y2Ba和gydF4y2BaARF17gydF4y2Ba表情都是被监控的。gydF4y2Ba
结果gydF4y2Ba
Meja,0.01μm,增强Ar形成,当与IBA + Kin结合时,以及早期JA-Biosynthesis突变体的响应gydF4y2Badde2-2gydF4y2Ba和Ja信号突变体gydF4y2Bacoi1-16gydF4y2Ba证实了这个结果gydF4y2Ba.gydF4y2BaJA水平在tll培养过程中发生早期变化,JA/JA- ile免疫定位于ar尖部和木本细胞。晚期ja生物合成突变体的高ar反应gydF4y2Baopr3gydF4y2Ba提示12-氧植物二烯酸对ar的形成也有积极作用gydF4y2Ba.gydF4y2Ba通过EIN3 / EIL1之间的JA和ET-信号之间的串扰对于Ar形成至关重要,并且涉及致致致致致致癌的竞争调节。通过MEJA浓度抑制ar形成,增强了Xylocaesis,并且与阳性有关gydF4y2BaARF17gydF4y2Ba表达式。gydF4y2Ba
结论gydF4y2Ba
JA浓度依赖于ar的形成和木质素的发生,以及与ET的互作为在抗性物种的快繁中应用开辟了道路。gydF4y2Ba
背景gydF4y2Ba
不定根是由各种气生器官形成的胚后根。在许多物种中,ARs有助于植物锚定和从土壤中吸收水分和矿质养分。ar形成也是重要作物品种营养繁殖的关键步骤[gydF4y2Ba1gydF4y2Ba].在切割中,切除迅速改变蟾蜍蛋白,主要的AR诱导剂的水平,并导致其他植物激素的生产,例如茉莉酸盐(Jas)和乙烯(ET)[gydF4y2Ba2gydF4y2Ba].在拟南芥幼苗中,连续的黑暗得到了低锁骨伸长和ar形成[gydF4y2Ba3.gydF4y2Ba],而ARs是由下胚轴中柱鞘的背斜分裂发起的[gydF4y2Ba4gydF4y2Ba].然而,取决于系统的AR不同成立组织使用的gydF4y2Ba5gydF4y2Ba].杆内皮是在拟南芥中黑暗生长的薄电池层(TCL)的外植体与/敷设与吲哚-3-丁酸(IBA,在10μM)培养的[在0.1μM激动素(KIN)]成立组织而不细胞分裂素[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7GydF4y2Ba].TCL是由花序茎维管系统外的组织形成的,在培养开始时不含任何生长素[gydF4y2Ba7GydF4y2Ba].有趣的是,同样的IBA + Kin处理增强了拟南芥完整的深色下胚轴和tcl的ar形成[gydF4y2Ba8gydF4y2Ba],其特征在于相同的基因表达和生长素累积阶段[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba].IBA是吲哚-3-乙酸(IAA)的天然前体,在完整的下胚轴和tcl中都必须转化为IAA以促进ar的形成[gydF4y2Ba7GydF4y2Ba,gydF4y2Ba10.gydF4y2Ba].gydF4y2Ba
可能发生木质细胞的异位形成(Xylocyesis)gydF4y2Ba在足底gydF4y2Ba以及体外培养的外植体[gydF4y2Ba11.gydF4y2Ba,gydF4y2Ba12.gydF4y2Ba],并且在这两种情况下都被外源生长素单独或与细胞分裂素结合增强[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba13.gydF4y2Ba,gydF4y2Ba14.gydF4y2Ba].在许多物种和插枝中,木本发生是ar形成的一个竞争性程序[14,并在其中引用],包括拟南芥暗生长下胚轴和TCLs [gydF4y2Ba9gydF4y2Ba,gydF4y2Ba11.gydF4y2Ba].gydF4y2Ba
茉莉酸盐影响很多形态形成过程[gydF4y2Ba15.gydF4y2Ba].在外源施用时,茉莉酸甲酯(MeJA)优于茉莉酸甲酯,因为茉莉酸甲酯更易于细胞膜杂交,并能快速去甲基化产生游离茉莉酸甲酯[gydF4y2Ba16.gydF4y2Ba].JA对Ar形成的影响是矛盾的。例如,在矮牵牛切割中降低了JA的水平及其生物活性偶联(+) - 7-gydF4y2BaisogydF4y2Ba-茉莉酰- l-异亮氨酸(JA-Ile)导致还原ar生成[gydF4y2Ba17.gydF4y2Ba].此外,在烟草和拟南芥中,培养的TCLS,通过Meja的亚微粒摩尔浓度(分别为0.01μm),增加了ar-process的内源性Ja水平的形成[gydF4y2Ba7GydF4y2Ba,gydF4y2Ba16.gydF4y2Ba].然而,JA对拟南芥去黄化完整下胚轴ar形成的负作用已被报道[gydF4y2Ba18.gydF4y2Ba].gydF4y2Ba
有关Xylocyesis的JA效应的信息有限。在拟南芥幼苗在轻的/暗状态下生长,JA在原代根本中诱导异位木耳形成,但这种促进由Cytokinin拮抗[gydF4y2Ba19.gydF4y2Ba].在暗生烟草TCLs中,来自MeJA的JA可促进木质素发生,但这发生在IBA + Kin的存在下[gydF4y2Ba16.gydF4y2Ba].gydF4y2Ba
的拟南芥突变体gydF4y2Ba延迟dehiscence2-2gydF4y2Ba(gydF4y2BaDDE2-2)gydF4y2Ba[gydF4y2Ba20.gydF4y2Ba),gydF4y2Baoxophytodienoate——reductase3gydF4y2Ba(gydF4y2Baopr3gydF4y2Ba)[gydF4y2Ba21gydF4y2Ba在ja生物合成方面有缺陷。在gydF4y2Badde2-2gydF4y2Ba转座子的插入破坏了编码烯氧合酶的基因座,导致ja合成的早期停止。在gydF4y2Baopr3gydF4y2Ba, T-DNA的插入会破坏gydF4y2BaOPR3gydF4y2Ba该突变体在OPR3中存在缺陷,OPR3将12-氧植二烯酸(OPDA)转化为JA的第一前体。该突变体表现出少量JA,但大量OPDA [gydF4y2Ba22gydF4y2Ba],这可能导致与java无关的响应[gydF4y2Ba15.gydF4y2Ba].的gydF4y2Ba冠菌素insensitive1-16gydF4y2Ba(gydF4y2Bacoi1-16gydF4y2Ba)突变体是JA不敏感的[gydF4y2Ba23gydF4y2Ba].JASMONATE ZIM-DOMAIN (JAZ)蛋白是COI1的靶标[gydF4y2Ba24gydF4y2Ba,支持COI1-JAZ是ja感知的共受体。gydF4y2Ba
在去硫酸化拟南芥幼苗中,疾病响应因子(ARFS)ARF6和ARF8在转录水平下介导毒素信号传导[gydF4y2Ba25gydF4y2Ba],作为正ar调节因子,而ARF17作为负ar调节因子[gydF4y2Ba26gydF4y2Ba].ARF6和ARF8促进JA生产[gydF4y2Ba27gydF4y2Ba]而且浅点积极调节gydF4y2BaARF6 / ARF8.gydF4y2Ba表达和消极gydF4y2BaARF17gydF4y2Ba表达式[gydF4y2Ba26gydF4y2Ba,而持续的黑暗对gydF4y2BaARFS.gydF4y2Ba是未知的。gydF4y2Ba
生长素- et串扰已被证明在主根和侧根发育中很重要[gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba两种植物激素在合成、运输和信号转导水平上相互依赖。在拟南芥暗生幼苗中,ET的前体1-氨基环丙烷-1-羧酸(ACC)在0.1 μM浓度下抑制ar的形成,而在10 μM浓度下抑制ar的形成。由于ACC提高内源性IAA水平,降低IBA水平,因此有人提出ET通过促进外源性IBA转化为IAA促进ar形成的作用gydF4y2Ba在足底gydF4y2Ba[gydF4y2Ba10.gydF4y2Ba].gydF4y2Ba
乙烯不敏感3 (EIN3)及其同源的EIN3- like 1 (EIL1)是控制大多数ET反应的中心转录因子[gydF4y2Ba30.gydF4y2Ba].ACC和ET通过促进其蛋白质积累来激活EIN3 / EIL1 [gydF4y2Ba31gydF4y2Ba].在暗生长的拟南芥幼苗中gydF4y2Baein3eil1gydF4y2Ba双突变体表明,ET通过EIN3/EIL1信号通路参与了IBA诱导的ar形成和木质素发生,但IBA如何与该网络相互作用尚需进一步研究[gydF4y2Ba10.gydF4y2Ba,gydF4y2Ba11.gydF4y2Ba].EIN3/EIL1也是JA和et信号的直接链接,与至少三个JAZ成员进行物理交互[gydF4y2Ba32gydF4y2Ba].按照,gydF4y2Baein3eil1gydF4y2Ba在诱导病原菌应答基因表达和根毛发育过程中对JA和ET均不敏感[gydF4y2Ba31gydF4y2Ba].gydF4y2Ba
综上所述,本研究旨在探讨JA在暗生长拟南芥幼苗和tcl中ar形成和木质素发生中的作用,以及与ET和生长素的关系。为此,我们研究了完整幼苗和TCLs,以及JA合成和信号转导突变体对MeJA的响应,并进行了激素定量和组织学分析。为了阐明JA和ET之间可能的相互作用,我们将外源ACC加MeJA或不加MeJA的情况应用于JA突变体和ET突变体gydF4y2Baein3eil1gydF4y2Ba.通过ARF网络评价生长素信号可能参与ar形成和木质素发生,表达gydF4y2BaARF6.gydF4y2Ba,gydF4y2BaARF8.gydF4y2Ba,gydF4y2BaARF17gydF4y2Ba还在Meja的存在/缺席时审查。gydF4y2Ba
结果揭示了EIN3/EIL1在JA和ET信号之间的串扰在ar形成控制中的关键功能,包括木质素发生的竞争性调节。的表达gydF4y2BaARF17gydF4y2Ba与Xylocaesis呈正相关,通过抑制Ar形成的MejA浓度(10μm)增强。gydF4y2Ba
方法gydF4y2Ba
幼苗和成体植株的物质和生长条件gydF4y2Ba
拟南芥种子gydF4y2Badde2-2gydF4y2Ba[gydF4y2Ba20.gydF4y2Ba(由瑞士苏黎世大学beatkeller提供)gydF4y2Baopr3gydF4y2Ba[gydF4y2Ba21gydF4y2Ba](由John Browse,华盛顿州立大学,美国提供)和gydF4y2Bacoi1-16gydF4y2Ba[gydF4y2Ba23gydF4y2Ba基于漂白剂(5.6 - ],突变体和相应的野生型(WTS)(西,WS,上校,GL1,分别)在10%的商业次氯酸钠进行消毒(由约翰·G·特纳,东英吉利大学,英国提供)% active chlorine) for 10 min, washed three times in sterile distilled water and sown in square Petri dishes (12 × 12 cm; 15 seeds per dish) on full-strength MS [33gydF4y2Ba]培养基,含1% (gydF4y2BawgydF4y2Ba/gydF4y2BavgydF4y2Ba)蔗糖(Sigma-Aldrich),0.55mM肌醇(Fluka),0.1μM硫胺素-HCl(pH 5.7)(HF对照培养基)和Meja的缺失,在没有或存在的情况下浓度为0.01μm,0.1μm和10μm。或者,在用于薄细胞层(TCLS)培养物(参见下文)的MS“生根培养基”上播种相同线的种子,含有10μMIBA(MERCK)和0.1μmkin(Sigma-Aldrich)(IBA + Kin中等),以与上述相同的浓度添加或不添加Meja。种子gydF4y2Baein3eil1gydF4y2Ba突变体gydF4y2Ba31gydF4y2Ba] (provided by Hongwei Guo, Peking University, China), and of its WT Col-0 were sterilized as above, and sown in dishes containing IBA + Kin medium, adding or not ACC at 0.1 μM. The HF media were sterilized by autoclaving at 120 °C for 20 min. IBA and Kin were added to the media taking the appropriate volume from stock-solutions (10−3gydF4y2BaM和10.gydF4y2Ba−2gydF4y2Ba在高压灭菌之前,分别为m。Meja的无菌储物解决方案10gydF4y2Ba−3gydF4y2BaM和ACC 10gydF4y2Ba−3gydF4y2Ba通过过滤(用0.22μm孔隙过滤器)制备M,并将适当的体积达到已经高压灭菌的培养基中达到最终浓度。在添加MEJA或ACC之前,允许介质的温度降至约45-50°C。gydF4y2Ba
经过3天的分层,在4°C的黑暗下[gydF4y2Ba34gydF4y2Ba]并且暴露于白光6小时以诱导发芽(萌发程序,根据[gydF4y2Ba3.gydF4y2Ba]),将菜肴置于垂直位置,以便不断与琼脂培养基接触幼苗[gydF4y2Ba3.gydF4y2Ba],并在分层(分层DAS的天数)后22天暴露于连续黑暗,在22±2℃下。将幼苗固定在70%乙醇中直至在光学显微镜(LM)下观察。gydF4y2Ba
ARF6:格斯gydF4y2Ba,gydF4y2BaARF8::格斯,gydF4y2Ba和gydF4y2BaARF17:格斯gydF4y2Ba来自种子的转基因幼苗[gydF4y2Ba26gydF4y2Ba](瑞典Umeå大学Catherine Bellini提供)在HF对照培养基上进行22 das,在黑暗中增加了0.01μmMeja的体外。播种和生长条件与上述相同。gydF4y2Ba
用作TCLs来源的植物,属于gydF4y2BaDde2-2, op3, coi1-16, ein3eil1gydF4y2Ba突变体和他们的WTS,以及gydF4y2BaARF6:格斯gydF4y2Ba,gydF4y2BaARF8:格斯gydF4y2Ba,gydF4y2BaARF17:格斯gydF4y2Ba转基因系,在生长室中的土壤中生长,长时间,在22±2°C,70%湿度和白光下(22 w / mgydF4y2Ba2gydF4y2Ba强度),在种子萌发后40天[gydF4y2Ba7GydF4y2Ba].gydF4y2Ba
TCL文化gydF4y2Ba
TCL(约0.5×8毫米)的外植体,由表皮组成,三层皮质实质,内胚层和1-2层纤维[gydF4y2Ba8gydF4y2Ba,从每个基因型随机选取30株的花序茎节间无菌摘取。gydF4y2Badde2-2gydF4y2Ba,gydF4y2Baopr3gydF4y2Ba,gydF4y2Bacoi1-16gydF4y2Ba,gydF4y2Baein3eil1gydF4y2Ba突变体及其WTS)并置于表皮上,在含有0.55mM肌醇(Fluka),0.1μm硫胺素-HCl(Sigma-Aldrich)的全强度MS培养基中含有全强度MS培养基(10dcls),1%蔗糖,0.8%(gydF4y2BawgydF4y2Ba/gydF4y2BavgydF4y2Ba)琼脂,10μmIba加0.1μmkin(生根培养基; [gydF4y2Ba6gydF4y2Ba])。在蒸压前用1 M NaOH将pH调整到5.7。为gydF4y2Badde2-2gydF4y2Ba,gydF4y2Baopr3gydF4y2Ba,gydF4y2Bacoi1-16gydF4y2Ba(和他们的WTs) TCL文化,惩罚了IBA +亲属中为0.01μM, 0.1μM,或10μM,,gydF4y2Baein3eil1gydF4y2Ba(及其WT)TCL培养,其在只有0.01μM加入。一个CC一个t0.1 μM, alone or combined with 0.01 μM MeJA, was added to the IBA + Kin medium in TCL culture ofdde2-2gydF4y2Ba,gydF4y2Bacoi1-16gydF4y2Ba,gydF4y2Baein3eil1gydF4y2Ba突变体和他们的wt。IBA + Kin培养基(不含MeJA和/或ACC)始终作为对照。采用不含IBA和Kin,但含有上述所有浓度MeJA的培养基,初步检测所有基因型的tcl的反应。外植体在22±2℃连续黑暗下培养15天。培养结束时,在立体显微镜下观察每个基因型和处理的60个外植体进行根评分。三套完整的实验,每一套使用不同的植物在相同的条件下培养,得到了非常相似的结果。gydF4y2Ba
50-100毫克的钨和gydF4y2Baopr3gydF4y2Batcl /复制,培养有或没有0.01μM的法案,在天收获0,1、3和5的激素量化,和20毫克的tcl相同的基因型,培养有或没有0.01,0.1到10μM的法案,在天收获15 RT-qPCR分析,如下所述。最后,10个w和gydF4y2Baopr3gydF4y2Ba在第8和15天,用0.01μm或10μmmeja或没有化合物培养的Tcls,用于Ja / Ja-Ile免疫胶形化程序(见下文)。其他样品用于组织学分析(见下文)。gydF4y2Ba
三十tcl /gydF4y2BaARF6 :: GUS,ARF8 :: GUSgydF4y2Ba,gydF4y2BaARF17:格斯gydF4y2Ba在IBA + Kin培养基上在体外随机来自三种实验组转基因植物,补充或不含0.01μm,0.1μm或10μmmeja。gydF4y2Ba
根的评分和测量下胚轴的长度gydF4y2Ba
在22 DAS时,将拟南芥幼苗在70%乙醇中固定,整株安装在玻片上,在LM (ZEISS Axiolab HBO 50)下沿下胚轴计数不定根原基(ARPs)和ARs。通过LEICA IM1000图像管理软件,使用安装在显微镜上的LEICA DFC 320相机以数字形式获取图像。使用配备ZEISS AxioCam相机的LEICA MZ8立体显微镜,使用AxioVision Release 4.7.2软件,通过数字形式获取图像,测量下轴长度。gydF4y2Ba
在培养15天后,通过检查每种基因型,治疗和实验组的植物的60个外植体在立体作用中进行TCLS的根本生产率,并且以数字形式获得图像的图像为下胚轴。来自一个复制的数据显示在文本上。gydF4y2Ba
组织学分析gydF4y2Ba
每组实验10个样品gydF4y2Baopr3gydF4y2Ba以0.01 μM和10 μM MeJA培养的TCLs和0.1 μM ACC培养的Col-0 TCLs分别于第3、5、8天(Ws和10 μM MeJA)收获gydF4y2Baopr3gydF4y2Ba),在第15天(Col-0,WS和gydF4y2Baopr3gydF4y2Ba),分级乙醇系列脱水,嵌入Technovit 7100(贺利氏古莎,德国)。用MICROM HM 350 SV切片机在6 μm处纵切,用0.05%甲苯胺蓝(gydF4y2BawgydF4y2Ba/gydF4y2BavgydF4y2Ba)对于LM观察。使用Leica IM1000 Image Manager软件使用Leica DC500相机在明亮场中获得TCL的组织学图像。gydF4y2Ba
GUS活性的组织化学分析gydF4y2Ba
报告基因的表达模式gydF4y2BauidAgydF4y2Ba在控制下gydF4y2BaARF6.gydF4y2Ba,gydF4y2BaARF8.gydF4y2Ba或者gydF4y2BaARF17gydF4y2Ba在转基因中检查了启动子gydF4y2BaARF6:格斯gydF4y2Ba,gydF4y2BaARF8:格斯gydF4y2Ba和gydF4y2BaARF17:格斯gydF4y2BaTCLs在IBA + Kin培养基上,在0.01 μM或0.1 μM MeJA存在/不存在的条件下,在黑暗条件下培养15 d。组织化学GUS检测根据[gydF4y2Ba8gydF4y2Ba],微不足道的修改。将样品浸入丙酮80%已经冷( - 20℃)中并在-20℃下置于20分钟,然后用蒸馏水洗涤三次,在组织化学过程之前。在黑暗中在37℃温育4小时后,除去GUS缓冲液并用乙醇替换为70%。然后在立体显微镜下观察到20种基因型,治疗和一组实验的样本。此外,将10个TCLS的每根转基因管线脱水并在树脂中掺杂,如上所述,以12μm的间隔纵向分开,具有自动切片机MICROM350 SV,并在LM下观察到。在体外生长的每种转基因系的每种转基因株的20种幼苗中,在0.01μmmeja的情况下,在22das的黑暗下,GUS测定也在体外生长20个幼苗。在LM下观察之前,将幼苗在乙醇中固定在70%。如前所述以数字形式获取转基因TCLS和全坐幼苗的图像。在每次重复的幼苗中,GUS表达模式非常相似,并且在不同重复的幼苗中。gydF4y2Ba
IAA,IBA和茉莉酸的定量gydF4y2Ba
对于IAA和IBA的测定,冷冻植物材料(50 - 100 mg)用10 ml甲醇均质,其中含有50 ng (gydF4y2Ba13.gydF4y2BaCgydF4y2Ba6gydF4y2Ba)剑桥同位素实验室及(gydF4y2Ba13.gydF4y2BaCgydF4y2Ba8gydF4y2Ba,gydF4y2Ba15.gydF4y2BaNgydF4y2Ba1gydF4y2Ba)IBA(由Minnesota大学J. Cohen,USA)提供内部标准。匀浆含有3mL DEAE-Sephadex A25(Amersham Pharmacia Biotech Ab,瑞典)的柱。用3ml甲醇洗涤柱,用3ml 0.1m甲醇洗涤。用制备型HPLC合并3mL 1M,3ml 1.5m和3ml 3m乙酸的馏分3m,3m乙酸(EuroSher 100-C18,5μm,250×4mm,knauer,德国)使用溶剂A(MeOH)和溶剂B(H中0.2%乙酸gydF4y2Ba2gydF4y2BaO)在40% a至100% a的梯度下gydF4y2BatgydF4y2Ba收集8至10分钟,蒸发,甲基化,甲基化与醚珠甲烷甲基化,并按照[中的含量气相色谱 - 质谱(GC-MS)。[gydF4y2Ba35gydF4y2Ba].量化根据[gydF4y2Ba36gydF4y2Ba]使用碎片gydF4y2Bam / z.gydF4y2Ba136 (gydF4y2Ba13.gydF4y2BaCgydF4y2Ba6gydF4y2Ba) IAA-Me,gydF4y2Bam / z.gydF4y2Ba130 (IAA-Me),gydF4y2Bam / z.gydF4y2Ba139(gydF4y2Ba13.gydF4y2BaCgydF4y2Ba8gydF4y2Ba,gydF4y2Ba15.gydF4y2BaNgydF4y2Ba1gydF4y2Ba)IBA-ME和gydF4y2Bam / z.gydF4y2Ba130 1(IBA-ME)。gydF4y2Ba
采用基于标准超高效液相色谱-串联质谱(UPLC-MS/MS)的方法对OPDA、JA和JA- ile的含量进行定量,方法参照[gydF4y2Ba37gydF4y2Ba].简而言之,用[gydF4y2Ba2gydF4y2BaHgydF4y2Ba5gydF4y2Ba] OPDA, [gydF4y2Ba2gydF4y2BaHgydF4y2Ba6gydF4y2Ba是的,和gydF4y2Ba2gydF4y2BaHgydF4y2Ba2gydF4y2Ba] JA-ILE(每次50 ng)作为内部标准。离心后,用9体积的水稀释上清液,对HR-XC(Chromabond,Macherey-Nagel)柱进行固相萃取。用900μL乙腈洗脱。将十μl洗脱液进行UPLC-MS / MS根据[gydF4y2Ba37gydF4y2Ba].使用分析物和内标峰值高度的比率计算OPDA,Ja和Ja-Ile的含量。结果表达为来自三个生物重复的平均数据和相应的标准误差(SES)。gydF4y2Ba
JA/JA- ile在tcl中的免疫定位gydF4y2Ba
在第8和第15天,Ws和gydF4y2Baopr3gydF4y2BaTCLs在IBA + Kin培养基上培养,用0.01 μM MeJA处理或不处理,固定、脱水和浸润。gydF4y2Ba38gydF4y2Ba].简言之,将样品固定在4%(gydF4y2BawgydF4y2Ba/gydF4y2BavgydF4y2Ba)1-乙基-3-(3-二甲基氨基丙基) - 在室温(RT)的PBS中盐酸盐(EDC,Merck),在梯级系列乙醇中脱水后,用聚乙二醇1500渗透(PEG 1500,Merck)在55°C时。将PEG嵌入式样品在室温下硬化,随后用MICROM HM 350 SV Mictotome(MicroM,Walldorf,Germany)纵向切割(5μm厚的部分)。gydF4y2Ba
免疫标记程序和抗体根据[gydF4y2Ba38gydF4y2Ba].切片用抗ja抗体(来自兔子)孵育过夜,用含5% (gydF4y2BawgydF4y2Ba/gydF4y2BavgydF4y2Ba) BSA和1%乙酰化BSA,在4°C。治疗主要的抗体后,部分是二次抗体孵育,山羊anti-rabbit-lgG coniugated与AlexaFluor488(英杰公司)在5% BSA / PBS稀释,在37°C 90分钟。绿色的荧光是指示性的JA和JA-Ile细胞,但不是惩罚或OPDA (gydF4y2Ba38gydF4y2Ba].阳性对照是在没有MeJA的情况下,在4% (w/v) EDC的500 μM JA溶液中固定w外植体。在免疫定位过程中省略一抗作为阴性对照(附加文件)gydF4y2Ba1gydF4y2Ba:图S1a-b)。gydF4y2Ba
用徕卡DMRB荧光显微镜观察切片,并配备特定的滤光片(EF 450-490 nm, DM 510 nm, SF 515 nm)。采用徕卡DC500数码相机采集图像,采用IM1000图像分析软件(徕卡)进行分析。gydF4y2Ba
定量RT-PCR (RT-qPCR)实验gydF4y2Ba
RNA分离和cDNA合成gydF4y2Ba
Tcls都是gydF4y2Baopr3gydF4y2Ba将突变体和相应的WT (Ws)在根诱导激素条件下(10 μM IBA + 0.1 μM Kin)连续黑暗培养15天,分别添加或不添加浓度为0.01、0.1和10 μM的MeJA。每个基因型和处理在第15天收获约20 mg的tcl,在液氮中快速冷冻,研磨成粉末。样品从三个独立的生物学重复中制备。按照说明书使用RNAqueous Kit (Ambion)提取总RNA。用TURBO DNA-free™Kit (Ambion)处理dnase后,进行逆转录:2 μg RNA用10gydF4y2Ba3.gydF4y2BaU/ml M-MuLV逆转录酶(Finnzymes),含2.5 μg随机六聚体和500 ng寡聚物(dT)gydF4y2Ba18.gydF4y2Ba适配器底漆的总体积为50μL,并在40℃下孵育60分钟。通过在70℃下孵育15分钟,终止反应15分钟。在RNASEH(Biolabs)处理之后,通过加入700μlDH稀释反应混合物gydF4y2Ba2gydF4y2BaO.利用内含子侧翼的特异性引物对所有cDNA样本进行PCR检测,以确定基因组DNA没有污染。gydF4y2Ba
定量RT-PCR实验设计gydF4y2Ba
的转录水平gydF4y2BaARF6.gydF4y2Ba/ AT1G30330,gydF4y2BaARF8.gydF4y2Ba/ AT5G37020和gydF4y2BaARF17gydF4y2Ba/ AT1G77850(附加文件中列出的底漆序列gydF4y2Ba2gydF4y2Ba采用RT-qPCR方法,对3个独立的生物重复进行了评估。重复反应混合物(最终体积,20 μl)包含5 μl cDNA, 0.5 μM正反引物和1× DyNAmo™Flash SYBR®Green qPCR mix (Finnzymes)。定量RT-PCR实验采用平衡随机区组设计,如前所述[gydF4y2Ba39gydF4y2Ba].甲的LightCycler?(Roche)的用于采集的CT值对于每个样品,即交叉的阈值,这是所累积的荧光信号所需要的PCR循环的次数跨过背景阈值以上[gydF4y2Ba40gydF4y2Ba].以下标准协议被应用于每个的扩增gydF4y2BaARF.gydF4y2BaCDNA:在95℃下10分钟的初始活化步骤,然后在95℃,在60℃下在95℃下为10 s的40个循环,在72℃下。首先测序每种扩增子以确保扩增序列的特异性,并且为了检查荧光信号在后续运行中从单个预期的扩增子衍生出来,将熔化曲线分析添加到每个PCR程序中。gydF4y2Ba
定量RT-PCR数据分析gydF4y2Ba
描述每个引物对的PCR效率(E)的相对标准曲线根据[gydF4y2Ba41gydF4y2Ba].使用参考基因(R),从选择对其执行定量RT-PCR的正常化[gydF4y2Ba26gydF4y2Ba]并根据[的实验材料验证gydF4y2Ba40gydF4y2Ba].gydF4y2BaTIP41 /gydF4y2Ba在11个检测的基因中,At4g34270的表达最为稳定,因此将实时RT-PCR数据进行归一化。gydF4y2Ba
用公式E计算CT值和E值gydF4y2BaTgydF4y2Ba(CTgydF4y2Ba一个gydF4y2Ba- ctgydF4y2BaBgydF4y2Ba)gydF4y2Ba/ EgydF4y2BaRgydF4y2Ba(CTgydF4y2Ba一个gydF4y2Ba- ctgydF4y2BaBgydF4y2Ba)gydF4y2Ba,其中(t)是靶基因和(R)参考基因,(CT)是交叉阈值,(B)与cDNA有关gydF4y2Baopr3gydF4y2Ba不同浓度MeJA培养或不培养的突变或Ws tcl和(A)从校准器cDNA [gydF4y2Ba40gydF4y2Ba].作为相对于Meja-未处理的WS呈现的数据,该WS是校准剂,并且基因表达比设定为1.所有结果显示为平均数据和相应的SE,从三个生物重复,每个都包括三种技术组成重复。gydF4y2Ba
统计分析gydF4y2Ba
数据以平均值(±SE)表示。在进行统计分析之前,使用GraphPad Instat 3进行正态检验(Kolmogorov-Smirnov)。平均数据采用Student 's进行分析gydF4y2BatgydF4y2Ba测试(gydF4y2BaPgydF4y2Ba< 0.05)比较两种不同基因型的影响,或通过单因素或双向方差分析(ANOVA,gydF4y2BaPgydF4y2Ba< 0.05)以比较不同处理和/或基因型或不同处理和天数的效果。如果方差分析显示显著效应,则采用Tukey后测(GraphPad Prism 6.0)。用χgydF4y2Ba2gydF4y2Ba测试(gydF4y2BaPgydF4y2Ba<0.05)。每个实验的三种生物学复制表现出非常相似的结果。gydF4y2Ba
结果gydF4y2Ba
在IBA + kin培养的WT幼苗和ja突变体中,除coi1-16外,亚微摩尔浓度的MeJA降低了下胚轴的生长并增强了AR的形成gydF4y2Ba
外源Meja的突变体评价突变体(gydF4y2BaDDE2-2)gydF4y2Ba和后期gydF4y2Ba(opr3)gydF4y2BaJA-Biosynthesis的步骤,以及JA信号gydF4y2Ba(COI1-16)gydF4y2Ba在环境、激素和培养条件下生长,这些条件是在TCLs中生成ar所必需的。作为前提,我们评估了相同浓度的MeJA对种子萌发的影响。gydF4y2Ba
分层后的种子分别在10 μM IBA和0.1 μM Kin、0 μM MeJA (0 μM)和0.01 μM、0.1 μM和10 μM MeJA存在的连续黑暗条件下离体生长。与无激素(HF)处理相比,IBA和Kin的存在从未显著降低种子萌发(附加文件gydF4y2Ba3.gydF4y2Ba:图S2a-b)。添加0.01 μM MeJA或0.1 μM MeJA(含或不含IBA和Kin)对各基因型的种子萌发无显著影响gydF4y2Ba3.gydF4y2Ba:图S2a-b)。相比之下,在MeJA浓度最高(10 μM)的情况下,无论是否与IBA和Kin结合,所有基因型的萌发率都很低(0-17%),且萌发时幼苗生长严重受阻,ar形成受到抑制,与基因型无关。gydF4y2Ba
在22 DAS,所有IBA + Kin-种植幼苗gydF4y2Badde2-2gydF4y2Ba,gydF4y2Baopr3gydF4y2Ba,gydF4y2Bacoi1-16gydF4y2Ba对应的WT基因型Col、Ws和Col-gl1沿下胚轴呈ARPs和ARs。因此,我们评估了下胚轴的平均长度和AR密度。gydF4y2Ba
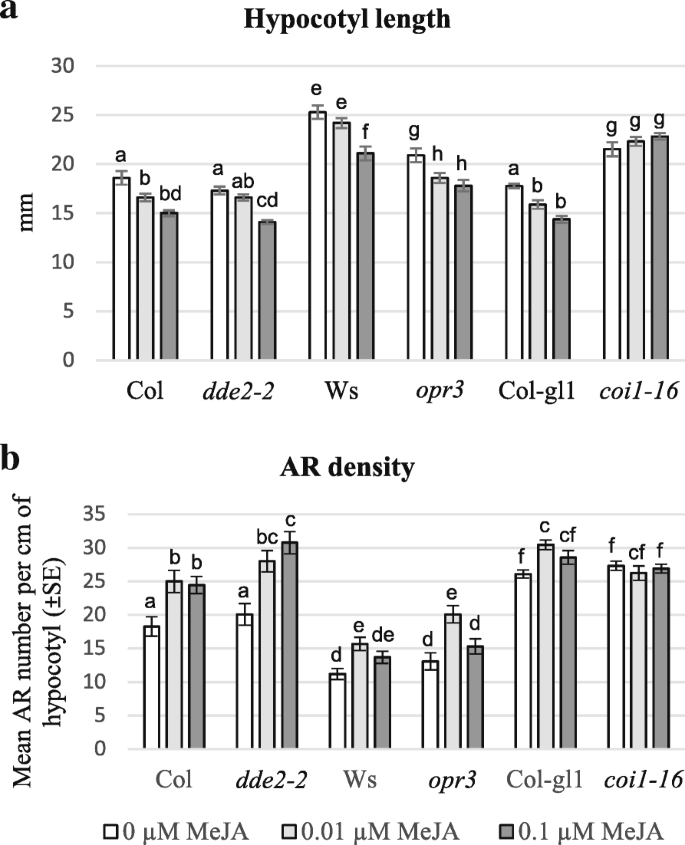
除了gydF4y2Bacoi1-16gydF4y2Ba在其他基因型中,0.1 μM MeJA引起的下胚轴长度显著增加(gydF4y2BaPgydF4y2Ba< 0.0001),但下胚轴长度仍低于20%(图。gydF4y2Ba1gydF4y2Ba).低10倍浓度的MeJA (0.01 μM)显示出类似但不那么明显的效应,在相同基因型内,相对于对照,只有两个WT基因型(Col和Col-gl1)具有统计学意义(gydF4y2BaPgydF4y2Ba< 0.05)gydF4y2Baopr3gydF4y2Ba(gydF4y2BaPgydF4y2Ba< 0.01)(图gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
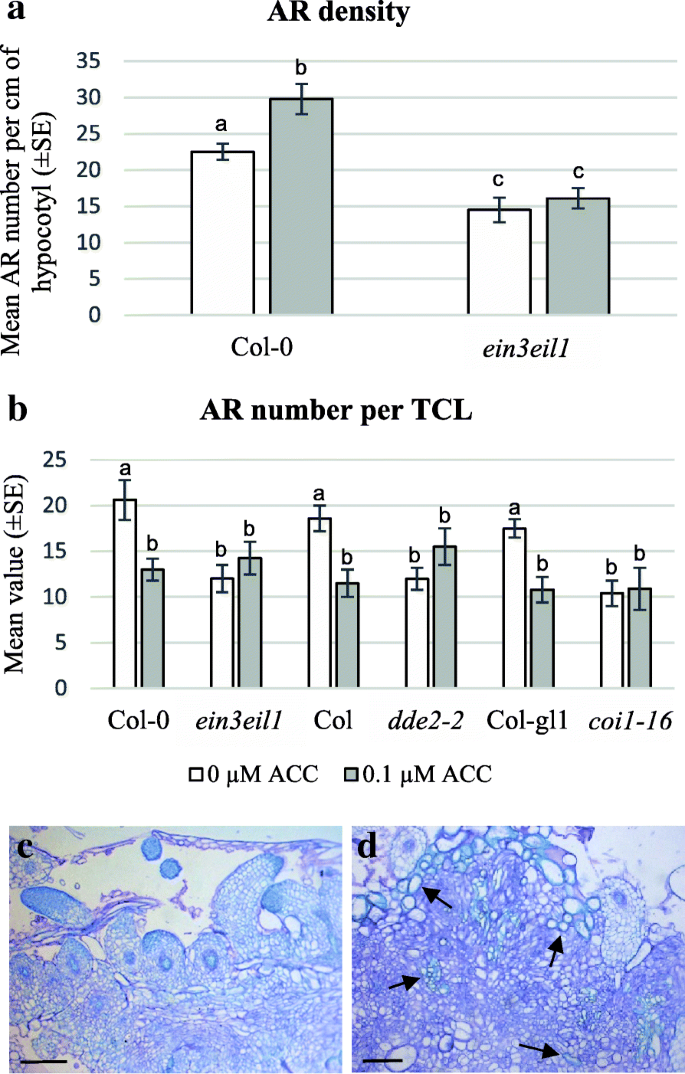
用IBA + Kin和Meja处理的深种JA-突变体幼苗中的胚轴长度和Ar形成。(gydF4y2Ba一个gydF4y2Ba平均下胚轴长度(±SE)在22 DASgydF4y2Badde2-2gydF4y2Ba,gydF4y2Baopr3gydF4y2Ba和gydF4y2Bacoi1-16gydF4y2Ba突变体和它们的WTS(Col,WS和COL-GL1),在没有Meja(0μmmeja)或0.01μm或0.1μmmeja的情况下生长。(gydF4y2BabgydF4y2Ba)平均Ar密度,即平均每厘米幼杆的ARP / Ar编号,(±SE)与(gydF4y2Ba一个gydF4y2Ba).在相同基因型内的处理之间,或在相同处理下的每个突变体与WT之间,至少在gydF4y2BaP < 0.05水平gydF4y2Ba,gydF4y2Ba用不同的字母表示。同一字母无统计学差异。文中还描述了进一步的统计细节。gydF4y2BaNgydF4y2Ba= 30(第一次复制)gydF4y2Ba
与hf培养的幼苗相比,IBA + kin处理的WT幼苗每cm下胚轴产生的平均ARPs/ARs (AR密度)显著增加,Col为8倍,Ws为4倍,Col-gl为11倍(图)。gydF4y2Ba1 bgydF4y2Ba和附加文件gydF4y2Ba3.gydF4y2Ba:图S2c),证实了Col和Ws之前的结果[gydF4y2Ba8gydF4y2Ba].如图所示。gydF4y2Ba1 bgydF4y2Ba, 除了gydF4y2Bacoi1-16,gydF4y2Ba其中MEJA没有引起ar形成的任何变化,两种亚微米摩尔MEJA浓度在增强AR反应方面有效,0.01μmMejA诱导所有其他基因型的显着增加(gydF4y2BaP
0.01 μM MeJA增强WT和ja突变体的TCLs中ar的形成,coi1-16除外gydF4y2Ba
为了深入了解JA对ar形成的影响,我们在相同的条件下研究了从所有基因型植物茎上切下的tcl对ar的响应。MeJA与IBA + Kin在0.01 μM、0.1 μM和10 μM时同时施用,因为后者在相同条件下对烟草TCLs产生一定的愈伤组织增殖[gydF4y2Ba16.gydF4y2Ba].已知拟南芥(COL-0和WS基因型)在HF条件下无法产生ARS [gydF4y2Ba6gydF4y2Ba].然而,为了验证MeJA本身是否能够诱导ar的形成,我们对tcl进行了不加激素的培养,但每一种MeJA浓度都进行了培养。ar和愈伤组织的形成都不是独立于基因型发生的。gydF4y2Ba
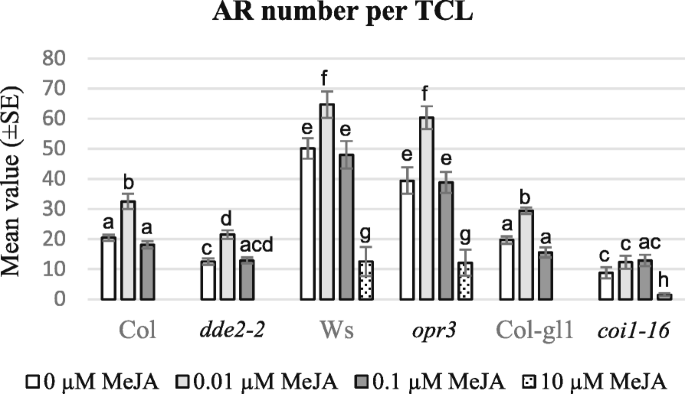
在IBA + Kin下培养15 d后,评估每个外植体具有ARPs/ARs的tcl百分比和宏观ARPs/ARs的平均数量。在没有MeJA的情况下,Ws的外植体生根率约为70%,gydF4y2Ba超载比gydF4y2Ba3坳gydF4y2Badde2-2,gydF4y2Ba和Col-GL1基因型gydF4y2Ba,gydF4y2Ba和40%gydF4y2Bacoi1-16gydF4y2Ba.两种MeJA亚微摩尔浓度的存在没有显著改变这些值。相比之下,10 μM MeJA使w中ar形成的TCLs的比例降低了约6倍,gydF4y2Baopr3gydF4y2Ba,gydF4y2Bacoi1-16gydF4y2Ba,并取消了在Col的ar反应,gydF4y2Badde2-2gydF4y2Ba和col-gl1 tcls。与文化发作相比,没有AR的外植体保持不变,或表现出一定的愈伤组织。在没有MejA的情况下,WT基因型中的AR平均数存在一些差异,并且在WS中的ar形成显着高于Col和Col-Gl1(图。gydF4y2Ba2gydF4y2Ba).所有基因型中,0.01 μM MeJA的存在显著提高了ar数(gydF4y2BaPgydF4y2Ba< 0.05gydF4y2Badde2-2gydF4y2BaCol-gl1,gydF4y2BaPgydF4y2Ba<0.01对于Col,gydF4y2BaPgydF4y2BaWs < 0.001gydF4y2BaPgydF4y2Ba< 0.0001gydF4y2Baopr3gydF4y2Ba), 除了gydF4y2Bacoi1-16gydF4y2Ba(无花果。gydF4y2Ba2gydF4y2Ba和gydF4y2Ba3.gydF4y2Ba).在WT TCLS中,在WS中观察到最高的增加(图。gydF4y2Ba2gydF4y2Ba和gydF4y2Ba3A-B.gydF4y2Ba).而0.1 μM MeJA与0 MeJA之间的ar数无显著差异(图2)。gydF4y2Ba2gydF4y2Ba),少数基因型中ar数量显著减少(Ws,gydF4y2Baopr3gydF4y2Ba,gydF4y2Bacoi1-16gydF4y2Ba)能够在10μmmeja下形成ars(图。gydF4y2Ba2gydF4y2Ba).在所有基因型中,带有ARs的tcl也显示了肉眼可见的愈伤组织形成(图。gydF4y2Ba3.gydF4y2Ba).gydF4y2Ba
IBA + Kin和MeJA培养的ja突变体的TCLs中ar的形成。每切除TCL的平均ARP/AR数(±SE)gydF4y2Badde2-2gydF4y2Ba,gydF4y2Baopr3gydF4y2Ba,gydF4y2Bacoi1-16gydF4y2Ba植物,以及它们的WTS(COL,WS和COL-GL1),在不存在(0μmMeja)中或在0.01μm,0.1μm和10μmmeja的情况下进行15天培养。在相同基因型内的处理之间,或在相同处理下的每个突变体与WT之间,至少在gydF4y2BaPgydF4y2Ba<0.05级,由不同的字母表示。同一字母无统计学差异。进一步的统计细节将在文中描述。gydF4y2BaNgydF4y2Ba= 60(第一次重复)gydF4y2Ba
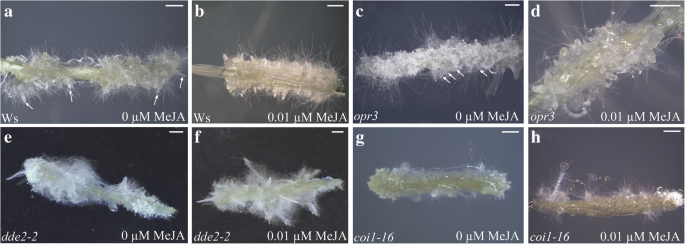
来自JA-突变体的IBA + Kin培养的TCL中的宏观AR响应/不含0.01μmmeja。(gydF4y2Baa -gydF4y2Ba) WT Ws立体显微镜下的图像(gydF4y2Ba一个gydF4y2Ba-gydF4y2BabgydF4y2Ba),gydF4y2Baopr3gydF4y2Ba(gydF4y2BacgydF4y2Ba-gydF4y2BadgydF4y2Ba),gydF4y2Badde2-2gydF4y2Ba(gydF4y2BaegydF4y2Ba-gydF4y2BafgydF4y2Ba),gydF4y2Bacoi1-16gydF4y2Ba(gydF4y2BaggydF4y2Ba-gydF4y2BahgydF4y2Ba)体外培养结束时(第15天)的tcl (gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba,gydF4y2BaggydF4y2Ba)或在0.01μmmeja的存在(gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba,gydF4y2BahgydF4y2Ba).(gydF4y2Ba一个gydF4y2Ba) TCL有伸长的ARs(箭头)和愈伤组织。(gydF4y2BabgydF4y2Ba)TCL具有高于(gydF4y2Ba一个gydF4y2Ba).(gydF4y2BacgydF4y2Ba) TCL与带ARPs(箭头)和伸长的ARs的愈伤组织。(gydF4y2BadgydF4y2Ba)显示众多arp的TCL部分的细节。(gydF4y2BaegydF4y2BaTCL生产的ARs少于(gydF4y2BafgydF4y2Ba).(gydF4y2Bag-hgydF4y2Ba)无(gydF4y2BaggydF4y2Ba)或(gydF4y2BahgydF4y2Ba)Meja。(图片来自第一个复制)。酒吧= 1毫米gydF4y2Ba
独立于治疗之外,gydF4y2Baopr3gydF4y2BaTCLS显示与其WT WS类似的AR响应(图。gydF4y2Ba2gydF4y2Ba),即使与WT不同,大部分根部仍处于ARP阶段(图。gydF4y2Ba3 c - dgydF4y2Ba).不同于gydF4y2Baopr3gydF4y2Ba,gydF4y2Badde2-2gydF4y2BaTCLS显示AR生产(图。gydF4y2Ba3 e-fgydF4y2Ba)显著低于WT,即Ws和Col,即使在0.01 μM MeJA (gydF4y2BaPgydF4y2Ba0和0.01 μM MeJA均< 0.05;gydF4y2Ba2gydF4y2Ba).考虑到OPDA存在于gydF4y2Baopr3gydF4y2Ba突变体而不是gydF4y2Badde2-2gydF4y2Ba突变体,结果表明JA之间的阳性相互作用来自外源Meja和内源OPDA在增强Ar形成时。相比之下,JA和OPDA对AR伸长率的影响需要进一步调查。gydF4y2Ba
不同于Col-GL1 TCLS,gydF4y2Bacoi1-16gydF4y2Ba当用亚微粒摩尔MEJA浓度治疗时,TCLS在AR生产中没有显着变化,并且AR反应低于WT(gydF4y2BaPgydF4y2Ba< 0.05和gydF4y2BaPgydF4y2Ba< 0.0001,分别在0和0.01 μM MeJA下,gydF4y2Ba2gydF4y2Ba和gydF4y2Ba3G-H.gydF4y2Ba).gydF4y2Ba
基于相似的趋势,ar的产量增加了Ws和gydF4y2Baopr3gydF4y2Ba与所有其他基因型相比,Tcls和即使在10μmmeja的情况下也存在Ar响应的存在(图。gydF4y2Ba2gydF4y2Ba),通过组织学分析详细检查这些基因型的TCLS。对于0,0.01和0.1μmmeja,第一细胞分裂在结核病中发生在第3天,独立于基因型(图。gydF4y2Ba4gydF4y2Ba),第5天第1个分生组织细胞簇的形成(图。gydF4y2Ba4 bgydF4y2Ba),以及由所述本体的天10和15之间的ARP / AR-形成(图gydF4y2Ba4 c - dgydF4y2Ba).在同一时间间隔内,经10 μM MeJA处理的tcl的内皮层衍生物要么变得肥大,要么产生木质素元素(图2)。gydF4y2Ba4 e-fgydF4y2Ba)而不是arp。gydF4y2Ba
Ws和gydF4y2Baopr3gydF4y2BaIBA + KingydF4y2Ba-gydF4y2Ba含或不含MeJA培养的tcl。(gydF4y2BafgydF4y2Ba) Ws的纵向径向截面(gydF4y2Baa、cgydF4y2Ba,gydF4y2BaegydF4y2Ba),gydF4y2Baopr3gydF4y2Ba(gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba)在没有Meja的情况下培养的Tcls(gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba)或在0.01μmmeja的存在下(gydF4y2Bac, dgydF4y2Ba)或10μmmeja(gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba).(gydF4y2Ba一个gydF4y2Ba细胞从茎内皮层开始分裂(第3天)gydF4y2BabgydF4y2Ba由内皮细胞衍生(第5天)组织)分生细胞簇。(gydF4y2BacgydF4y2Ba) ar从外植体上伸出(第15天)。(gydF4y2BadgydF4y2Ba)ARPS(在左侧,纵向剖视图)和第15天(右侧)(在右侧,转向视图上)。(gydF4y2BaegydF4y2Ba)与内胚层来源的细胞分化的木素成分(箭头)(第15天)。(gydF4y2BafgydF4y2Ba)肥大细胞和DE Novo形成围绕共源细胞簇(在插图中放大)的木质元素(箭头)(第15天)。用甲苯胺蓝染色的部分。(图片来自第一个复制)。条=50μm(gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,gydF4y2BaegydF4y2Ba和插入gydF4y2BafgydF4y2Ba),100微米(gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba)gydF4y2Ba
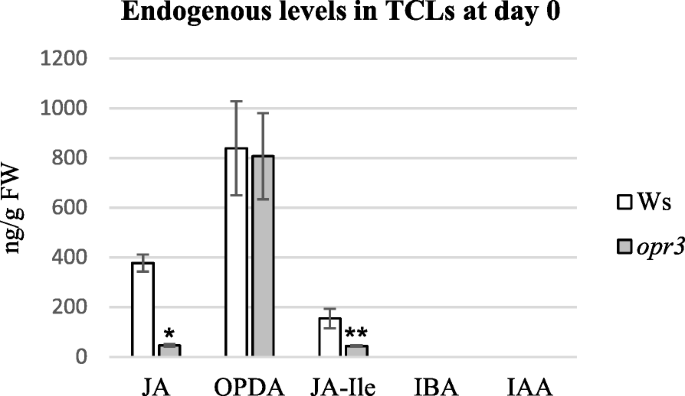
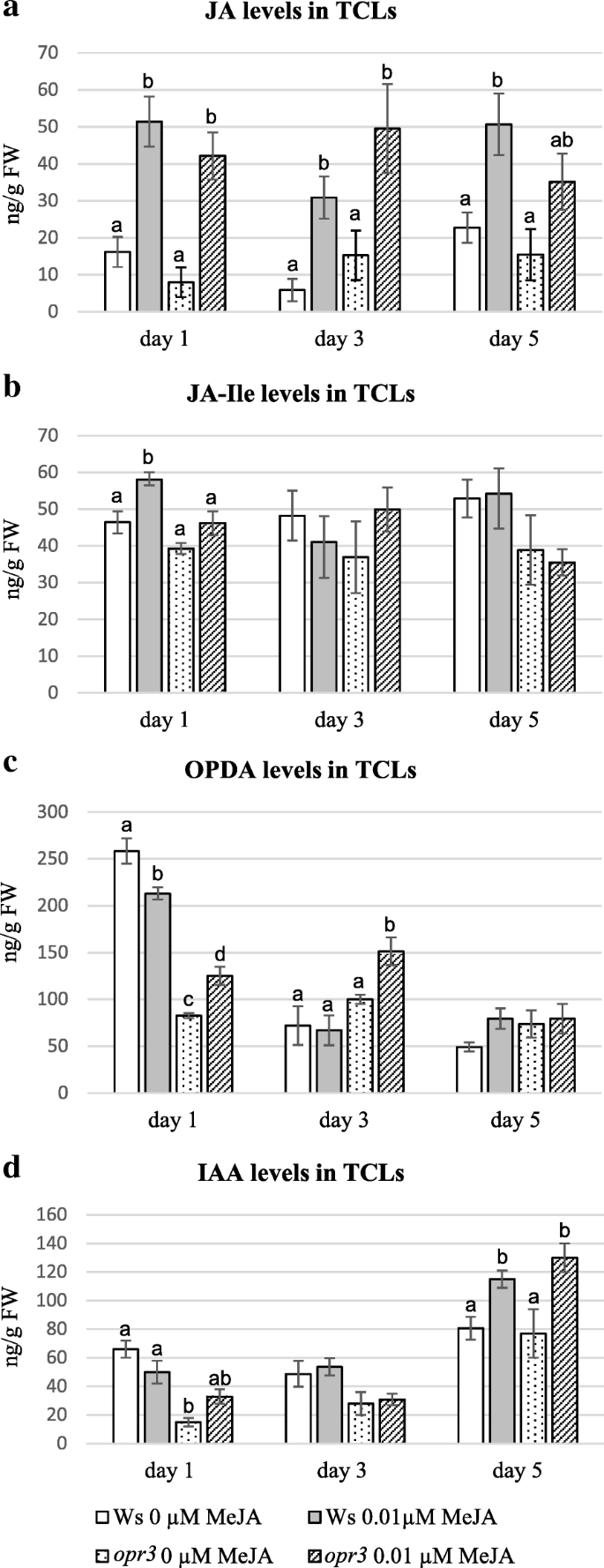
WT和opr3 TCLs中JA、OPDA和IAA水平在培养第1天发生变化gydF4y2Ba
获得的类似结果gydF4y2Baopr3gydF4y2Ba和Ws TCLs在宏观和组织学分析下(图。gydF4y2Ba2gydF4y2Ba和gydF4y2Ba4gydF4y2Ba)促使我们探讨在相同基因型中的内源性和生长素的内源性水平,并且在最佳处理(0.01μmmeja)中进行Ar形成(图。gydF4y2Ba2gydF4y2Ba).w和w中均未检测到IBA和IAAgydF4y2Baopr3gydF4y2Ba根据先前的结果,在茎部切除后不久(即第0天)进行tcl [gydF4y2Ba7GydF4y2Ba].相比之下,可能是由于切除引起的创伤反应,JA, OPDA和JA- ile都存在(图。gydF4y2Ba5gydF4y2Ba).野生型中JA和JA- ile的内源性水平显著高于突变型(在gydF4y2BaPgydF4y2Ba<0.001和gydF4y2BaPgydF4y2Ba< 0.05),而OPDA水平相近,分别是JA的2倍和17倍。gydF4y2Ba5gydF4y2Ba).gydF4y2Ba
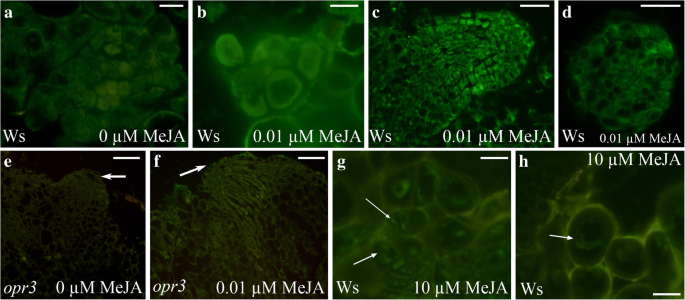
在WT tcl中,JA、JA- ile和OPDA的水平在培养第1天比培养第0天突然下降(图3)。gydF4y2Ba5gydF4y2Ba和gydF4y2Ba6gydF4y2Ba然而,然而,用0.01μmMeja的处理引起了Ja(图。gydF4y2Ba6gydF4y2Ba)和JA-Ile(图。gydF4y2Ba6 bgydF4y2Ba)的含量显著高于未添加MeJA的(gydF4y2BaPgydF4y2Ba<0.0001对于JA,gydF4y2BaPgydF4y2Ba< 0.01的JA-Ile)。相比之下,OPDA水平显著(gydF4y2BaPgydF4y2Ba<0.001)低于没有MEJA的<0.001(图。gydF4y2Ba6摄氏度gydF4y2Ba).在gydF4y2Baopr3gydF4y2BaMeja培养的TCLS,JA类似于WT与WT无关,没有MEJA(图。gydF4y2Ba6gydF4y2Ba), JA-Ile的水平与第0天相似(图。gydF4y2Ba5gydF4y2Ba和gydF4y2Ba6 bgydF4y2Ba),由于化合物存在而没有显着的变化(图。gydF4y2Ba6 bgydF4y2Ba)。OPDA的水平gydF4y2Baopr3gydF4y2Ba与第0天相比,TCLs也显著降低。gydF4y2Ba5gydF4y2Ba和gydF4y2Ba6摄氏度gydF4y2Ba),但在没有Meja的更高水平而不是与化合物(gydF4y2BaPgydF4y2Ba<0.01差异,图。gydF4y2Ba6摄氏度gydF4y2Ba).在第3天,即当在两种基因型中发生第一分裂时(图。gydF4y2Ba4gydF4y2Ba),在WT中有/没有MeJA时JA水平进一步降低,但MeJA存在时仍然显著高于没有MeJA时(gydF4y2BaPgydF4y2Ba<0.05差异,图。gydF4y2Ba6gydF4y2Ba).在WT,在同一天,与Meja的治疗没有导致JA-ILE和OPDA水平的任何显着变化与0 Meja相比(图。gydF4y2Ba6 cgydF4y2Ba),即使与第1天相比,即使OPDA水平降低约4倍(图。gydF4y2Ba6摄氏度gydF4y2Ba).在第3天,JA水平显著(gydF4y2BaPgydF4y2Ba< 0.01)gydF4y2Baopr3gydF4y2BaMeJA处理的tcl与未处理的tcl比较,与第1天观察到的趋势相同(图2)。gydF4y2Ba6gydF4y2Ba).JA-Ile水平未发生变化,与当天WT相同(图3)。gydF4y2Ba6 bgydF4y2Ba),但与WT不同的是,OPDA水平显著(gydF4y2BaPgydF4y2Ba< 0.05)随着MeJA的增加而增加,与无MeJA相比,达到显著升高(gydF4y2BaPgydF4y2Ba<0.001)比在相同处理条件下的WT(图gydF4y2Ba6摄氏度gydF4y2Ba).第5天,即第一个细胞簇形成的时间(图。gydF4y2Ba4 bgydF4y2Ba),在WT TCLs中,JAlevel再次显著升高(gydF4y2BaPgydF4y2Ba<0.01)在MEJA的存在中而不是在缺失,并且类似于第1天的水平,而不会发生显着增加gydF4y2Baopr3gydF4y2Batcl(无花果。gydF4y2Ba6gydF4y2Ba).JA-ILE和OPDA的水平不会受到基因型或治疗的显着影响(图。gydF4y2Ba6 cgydF4y2Ba).在后期文化期间,WT和WT的JA / JA-ILE存在gydF4y2Baopr3gydF4y2Ba用0.01 μM MeJA处理或未处理的外植体进行免疫定位[gydF4y2Ba38gydF4y2Ba].在第8天,在没有Meja的情况下,在共给群细胞簇和夹层的细胞中检测到Ja / Ja-ile(图。gydF4y2Ba7一个gydF4y2Ba),但在0.01 μM MeJA的存在下信号增强(图。gydF4y2Ba7 bgydF4y2Ba).信号继续通过在ARP和AR的提示(15天)(图的所有单元中显示。gydF4y2Ba7 c - dgydF4y2Ba).在ARPs中检测到微弱信号gydF4y2Baopr3gydF4y2Ba突变体TCLs,主要存在0.01 μM的MeJA(图2)。gydF4y2Ba7 e-fgydF4y2Ba箭头)。gydF4y2Ba
在早期文化期间的茉莉酸盐和IAA的内源性水平与/没有MEJAgydF4y2Baopr3gydF4y2BaIBA + KingydF4y2Ba-gydF4y2Ba培养的tcls。(gydF4y2Ba一个gydF4y2Ba-gydF4y2BadgydF4y2Ba)内源性JA的平均值(±SE)(gydF4y2Ba一个gydF4y2Ba),JA-ILE(gydF4y2BabgydF4y2Ba),和OPDA(gydF4y2BacgydF4y2Ba)和IAA(gydF4y2BadgydF4y2Ba),在Ws和gydF4y2Baopr3gydF4y2Ba以0.01 μM MeJA或不加MeJA暗培养1、3和5 d后的TCLs。同一基因型在同一天内,或同一基因型在同一处理下,至少在gydF4y2BaP < 0.05水平gydF4y2Ba,gydF4y2Ba用不同的字母表示。无字母或相同字母表示同一天无统计学差异。进一步的统计细节将在文中描述。N = 3个生物复制gydF4y2Ba
JA/JA- ile在Ws和gydF4y2Baopr3gydF4y2BaIBA +亲缘培养的tcl。(gydF4y2Ba一个gydF4y2Ba-gydF4y2BahgydF4y2Ba) Ws中JA/JA- ile的免疫细胞化学检测(gydF4y2Ba一个gydF4y2Ba-gydF4y2BadgydF4y2Ba,gydF4y2BaggydF4y2Ba-gydF4y2BahgydF4y2Ba)和JA-缺陷突变gydF4y2Baopr3gydF4y2Ba(gydF4y2BaegydF4y2Ba-gydF4y2BafgydF4y2Ba) TCLs的纵向径向切片,在黑暗下培养第8天和第15天(gydF4y2Ba一个gydF4y2Ba,gydF4y2BaegydF4y2Ba)或在0.01μmmeja的存在(gydF4y2BabgydF4y2Ba-gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba)或10μmmeja(gydF4y2BaggydF4y2Ba-gydF4y2BahgydF4y2Ba).(gydF4y2Ba一个gydF4y2Ba)分生组织细胞显示绿色JA/JA- ile免疫荧光信号(第8天)(gydF4y2BabgydF4y2Ba)专业丛的细胞显示出杂荧光信号比(gydF4y2Ba一个gydF4y2Ba(第8天)gydF4y2BacgydF4y2Ba) AR顶端的细节(纵切面),显示顶端细胞与信号(第15天)。(gydF4y2BadgydF4y2Ba)AR尖端(视图在横视中的视图)显示具有信号的细胞(第15天)。(gydF4y2BaegydF4y2Ba)gydF4y2Baopr3gydF4y2Ba无信号的ARP细胞(箭头)在无外源MeJA培养的TCL中培养(第15天)。(gydF4y2BafgydF4y2Ba)微弱的信号gydF4y2Baopr3gydF4y2BaTCL的ARP(箭头)用0.01μmmeja(第15天)培养。(gydF4y2BaggydF4y2Ba)分化木质素团细胞内微弱信号(箭头)(第15天)。(gydF4y2BahgydF4y2Ba)未成熟新生木质细胞(第15天)内微弱信号(箭头)。(图片来自第一个复制)。柱= 20 μm (gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba), 40 μm (gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba), 60 μm (gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba)gydF4y2Ba
在10 μM MeJA培养15天的WT tcl中,JA/JA- ile的免疫定位显示木基团块中存在信号(图)。gydF4y2Ba7GgydF4y2Ba)和在单一的硅藻土中(图。gydF4y2Ba7h.gydF4y2Ba)gydF4y2Ba新创gydF4y2Ba特别是在这个浓度下形成。直到第5天,野生型和野生型的茉莉酸浓度均为0.01 μMgydF4y2Baopr3gydF4y2Ba(无花果。gydF4y2Ba6gydF4y2Ba),建议我们评估前5天外植体中IAA水平。如图所示。gydF4y2Ba6 dgydF4y2Ba在WT和gydF4y2Baopr3gydF4y2Ba在无MeJA培养的tcl中,IAA在第1天在外植体中检测到,但其水平到第3天没有显著变化,而是显著增加(gydF4y2BaPgydF4y2Ba<0.05对于wt和gydF4y2BaPgydF4y2Ba< 0.01gydF4y2Baopr3gydF4y2Ba)在第5天。IAA趋势在0.01μmmeja处理的wt和gydF4y2Baopr3gydF4y2Ba然而,tcl在第5天有较高的增加(gydF4y2BaPgydF4y2Ba<0.001对于wt,和gydF4y2BaPgydF4y2Ba<0.0001 for.gydF4y2Baopr3gydF4y2Ba)与茉莉酸甲酯未处理外植体(图比较。gydF4y2Ba6 dgydF4y2Ba).一个td一个y 1, IBA was detected at higher amounts than IAA, both in WT (1970 ± 160 ng/g FW without MeJA and 1777 ± 390 ng/g FW with MeJA), andopr3gydF4y2Ba外植体(1313±240和1266±320 ng/g FW)gydF4y2Ba,gydF4y2Ba按照外源性IBA供应gydF4y2Ba.gydF4y2Ba到第5天,IBA的趋势与IAA的趋势相似。第5天,添加0.01 μM MeJA的Ws IBA值上升到3284±470 ng/g FW,未添加MeJA的Ws IBA值上升到3052±390 ng/g FW,两者与突变体的相应值无显著差异(未显示)。gydF4y2Ba
在MeJA诱导的ar形成过程中,ARF6和ARF8基因的表达没有发生改变,而ARF17基因在10 μM MeJA诱导下表达增强,并定位于木本细胞gydF4y2Ba
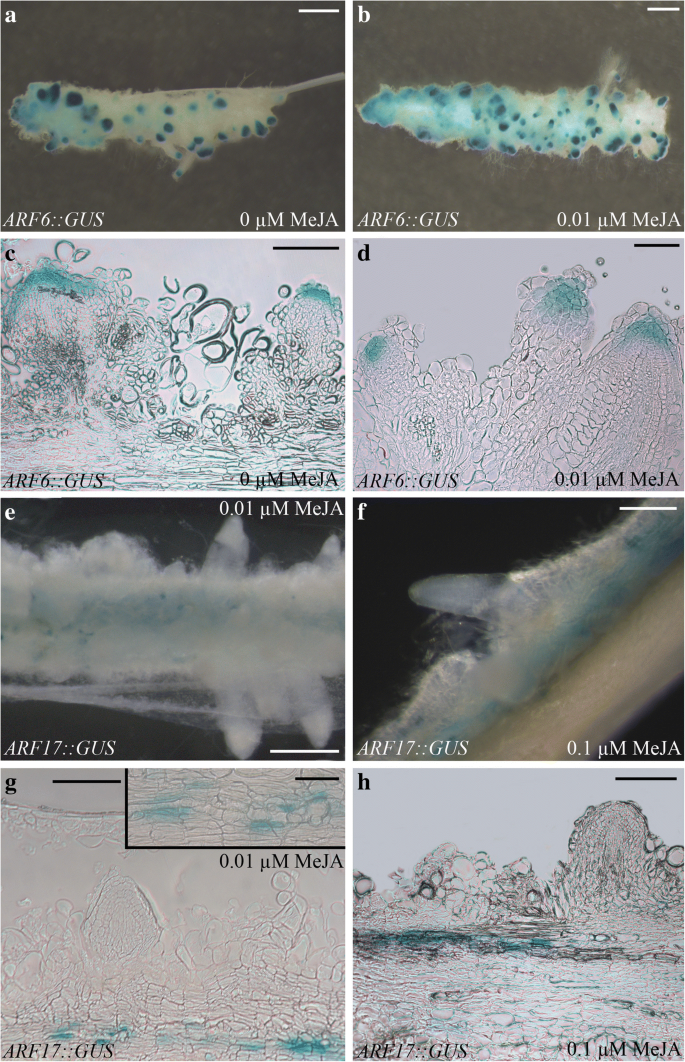
已知在拟南芥中,ARF6和ARF8是轻生长幼苗下胚轴ar形成所必需的,而ARF17是相同条件下ar形成的抑制剂[gydF4y2Ba18.gydF4y2Ba,gydF4y2Ba26gydF4y2Ba].由于这些原因,他们的启动子的活性在黑暗中生长的苗和TCLs通过使用监控gydF4y2BaARF6:格斯gydF4y2Ba,gydF4y2BaARF8:格斯gydF4y2Ba,gydF4y2BaARF17:格斯gydF4y2Ba转基因素。gydF4y2Ba
22 das的转基因深种幼苗的观察显示出表达的存在gydF4y2BaARF6.gydF4y2Ba和gydF4y2BaARF8.gydF4y2Ba,而不是gydF4y2BaARF17gydF4y2Ba,在ARP/AR提示(附加文件gydF4y2Ba4gydF4y2Ba:图S3a-f),带或不带0.01 μM MeJA。相比之下,gydF4y2BaARF17gydF4y2Ba在下胚轴、侧根(LRs)和ARs的维管系统中均有表达,在有和没有MeJA的情况下同样有表达(附加文件gydF4y2Ba4gydF4y2Ba:图S3g-i)。在0.01 μM和0.1 μM MeJA条件下培养15 d,观察到GUS信号存在于细胞的arp尖gydF4y2BaARF6::gydF4y2Ba格斯和gydF4y2BaARF8 ::gydF4y2BaGUS TCLs,具有相似的表达模式,举例说明于gydF4y2BaARF6.gydF4y2Ba图中有/没有0.01 μM MeJA。gydF4y2Ba8个模拟gydF4y2Ba.与他们背景的tcl相同(图。gydF4y2Ba2gydF4y2Ba),转基因株系的外植体在10 μM MeJA下无法生长并形成ARs(数据未显示),因此未对这些外植体进行GUS检测。的表达gydF4y2BaARF17gydF4y2Ba在ARPs/ARs中不存在,但在外植体的愈伤组织中存在,与MeJA浓度无关(图2)。gydF4y2Ba8E-F.gydF4y2Ba).组织学分析证实了宏观观察结果gydF4y2BaARF17gydF4y2Ba表达定位于木原细胞(图。gydF4y2Ba8G-H.gydF4y2Ba).gydF4y2Ba
ARF6:格斯gydF4y2Ba和gydF4y2BaARF17:格斯gydF4y2BaIBA + Kin-Tcls中的表达模式或没有MEJA培养。(gydF4y2Ba一个gydF4y2Ba-gydF4y2BahgydF4y2Ba)定位GUS信号在gydF4y2BaARF6:格斯gydF4y2Ba(gydF4y2Ba一个gydF4y2Ba-gydF4y2BadgydF4y2Ba),gydF4y2BaARF17:格斯gydF4y2Batcl (gydF4y2BaegydF4y2Ba-gydF4y2BahgydF4y2Ba)在黑暗中培养在没有Meja(0μmmeja)的情况下15天(gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba)和0.01 μM MeJA (gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba-gydF4y2BaegydF4y2Ba,gydF4y2BaggydF4y2Ba)或0.1 μM MeJA (gydF4y2BafgydF4y2Ba,gydF4y2BahgydF4y2Ba).(gydF4y2Ba一个gydF4y2Ba)ARP中的GUS信号以及细长AR的顶点。(gydF4y2BabgydF4y2BaTCL也显示了同样的情况gydF4y2BaARF6:格斯gydF4y2Ba表达式如(gydF4y2Ba一个gydF4y2Ba).信号的高存在与ARPs/ARs在(gydF4y2BabgydF4y2Ba)比(gydF4y2Ba一个gydF4y2Ba).(gydF4y2BacgydF4y2Ba-gydF4y2BadgydF4y2Ba) GUS信号在ARPs顶端的定位。(gydF4y2BaE-F.gydF4y2Ba)gydF4y2BaARF17:格斯gydF4y2Ba表达缺失,但沿外植体存在。(gydF4y2BaggydF4y2Ba)gydF4y2BaARF17:格斯gydF4y2Ba在细胞中定位的表达分化为木质元素,如插图中的放大。(gydF4y2BahgydF4y2Ba)gydF4y2BaARF17gydF4y2Ba存在于细胞链中的GUS信号区分为木质元素,但在ARPS中不存在。(gydF4y2Ba一个gydF4y2Ba-gydF4y2BabgydF4y2Ba,gydF4y2BaegydF4y2Ba-gydF4y2BafgydF4y2Ba)立体显微镜图像,(gydF4y2BacgydF4y2Ba-gydF4y2BadgydF4y2Ba,gydF4y2BaggydF4y2Ba-gydF4y2BahgydF4y2Ba) LM下观察的TCLs纵向径向切片。(图片来自第一个复制)。柱= 50 μm(插入gydF4y2BaggydF4y2Ba),100微米(gydF4y2BadgydF4y2Ba), 200 μm (gydF4y2BacgydF4y2Ba,gydF4y2BafgydF4y2Ba-gydF4y2BahgydF4y2Ba)、500 μm (gydF4y2BaegydF4y2Ba)、1毫米(gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba)gydF4y2Ba
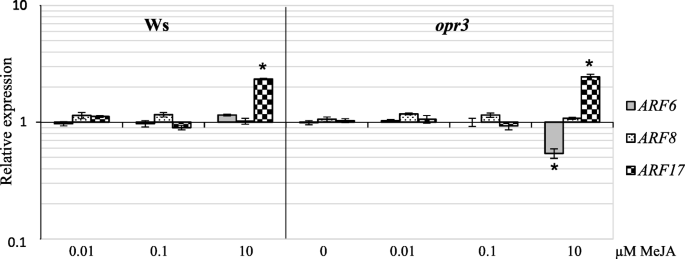
因为众所周知,这三个基因的转录本的稳定性是在特定的mirna的控制下,至少在光下[gydF4y2Ba26gydF4y2Ba,gydF4y2Ba42gydF4y2Ba],它们的表达也通过定量RT-PCR(RT-qPCR的)监控。转录水平在WS TCLs和这些的分析gydF4y2Baopr3gydF4y2Ba所有的茉莉酸甲酯浓度因为高能力,下突变体,以形成这些TCLs的ARS,和AR-响应甚至用10μM茉莉酸甲酯(图的存在。gydF4y2Ba2gydF4y2Ba).rt - qpcr分析表明,在无MeJA(对照tcl)培养的Ws外植体中,各基因的表达量均为1gydF4y2BaARF8.gydF4y2Ba与对照tcl相比,MeJA处理没有显著变化(图2)。gydF4y2Ba9gydF4y2Ba).同样发生了gydF4y2BaARF6.gydF4y2Ba除了表达gydF4y2Baopr3gydF4y2Ba用最高Meja浓度治疗的TCLS,与对照相比,转录物水平几乎降低了一半(gydF4y2BaPgydF4y2Ba< 0.01)。不同,gydF4y2BaARF17gydF4y2Ba表达类似于在0.1和0.01μmMeja的情况下的控制,而重要(gydF4y2BaPgydF4y2Ba<0.01)基因的上调(超过两倍)在10μmMeja处理的外植体中明显明显,独立于基因型(图。gydF4y2Ba9gydF4y2Ba).这种表达的增加与在这些外植体中观察到的ARS的形成时偶联的表达偶联(图。gydF4y2Ba4 e-fgydF4y2Ba).gydF4y2Ba
ARF6.gydF4y2Ba,gydF4y2BaARF8.gydF4y2Ba和gydF4y2BaARF17gydF4y2BaWS和WS的表达分析gydF4y2Baopr3gydF4y2BaRT-qPCR检测tcl。RT-qPCR定量gydF4y2BaARF6.gydF4y2Ba,gydF4y2BaARF8.gydF4y2Ba,gydF4y2BaARF17gydF4y2Ba转录水平在WS和gydF4y2Baopr3gydF4y2BaTCLS在IBA + Kin培养基上培养,没有(0μmmeja)或0.01,0.1和10μmmeja,在黑暗下为15天。每个基因的表达值相对于在不存在MEJA(校准剂)的WT WS TCL中的表达,该值设定为1.每个基因的转录水平被标准化为表达gydF4y2BaTIP41。gydF4y2Ba星号表示基因表达有显著差异(gydF4y2BaPgydF4y2Ba< 0.01),与未加MeJA的相同基因型相比gydF4y2Ba.gydF4y2Ba文中还描述了进一步的统计细节。平均数据和SE是从三个生物复制中获得的,每个都是三种技术复制gydF4y2Ba
乙烯前体ACC增强了IBA + kin培养的幼苗下胚轴中ar的形成,但降低了tcl中的ar形成,而ein3eil1突变体在植物和离体培养中均不敏感gydF4y2Ba
基于众多反应中的ET和JA之间的已知相互作用[gydF4y2Ba32gydF4y2Ba, et前体ACC在0.1 μM浓度下被应用于幼苗和TCLs,因为它已经被证明在单独IBA存在的黑暗下生长的拟南芥幼苗中增强ar的形成[gydF4y2Ba10.gydF4y2Ba].如图所示。gydF4y2Ba10AgydF4y2Ba, ACC与IBA和Kin的存在显著增强了下胚轴ar的形成,但这在下胚轴中没有发生gydF4y2Baein3eil1gydF4y2Ba双突变体,根据其et不敏感[gydF4y2Ba10.gydF4y2Ba].相比之下,ACC的应用导致了显著的(gydF4y2BaPgydF4y2Ba< 0.01),但双突变体同样不敏感(图。gydF4y2Ba10B.gydF4y2Ba).组织学分析显示,虽然ACC处理的WT tcl中ar的形成减少,但与不含ACC的外植体相比,木原性反应增强(图3)。gydF4y2Ba10 c - dgydF4y2Ba).gydF4y2Ba
IBA + Kin成长的ar形成gydF4y2Baein3eil1gydF4y2Ba苗和TCLs,和JA-突变体TCLs,有/无ACC处理。(gydF4y2Ba一个gydF4y2Ba平均AR密度,即每cm下胚轴的AR/ARP数(±SE),在Col-0 (WT)和gydF4y2Baein3eil1gydF4y2Ba在22 DAS下,在0.1 μM ACC存在/不存在的黑暗条件下生长的幼苗。(gydF4y2BabgydF4y2Ba)在从中切除的TCLS中每次外部植物(±SE)的平均ar / arp编号gydF4y2Baein3eil1gydF4y2Ba,gydF4y2Badde2-2gydF4y2Ba,gydF4y2Bacoi1-16gydF4y2Ba在0.1 μM ACC存在或不存在的情况下,培养15 d后,突变体植株及其wt(分别为Col-0、Col和Col-gl1)。(gydF4y2Bac - dgydF4y2Ba)Col-0 Tcls的组织学图像在没有ACC的情况下培养(gydF4y2BacgydF4y2Ba)和0.1μm的ACC(gydF4y2BadgydF4y2Ba),第15天。(gydF4y2Ba一个gydF4y2Ba-gydF4y2BabgydF4y2Ba)在相同基因型内的处理,或在相同处理下的每个突变体与其WT之间的显著差异,至少在gydF4y2BaP
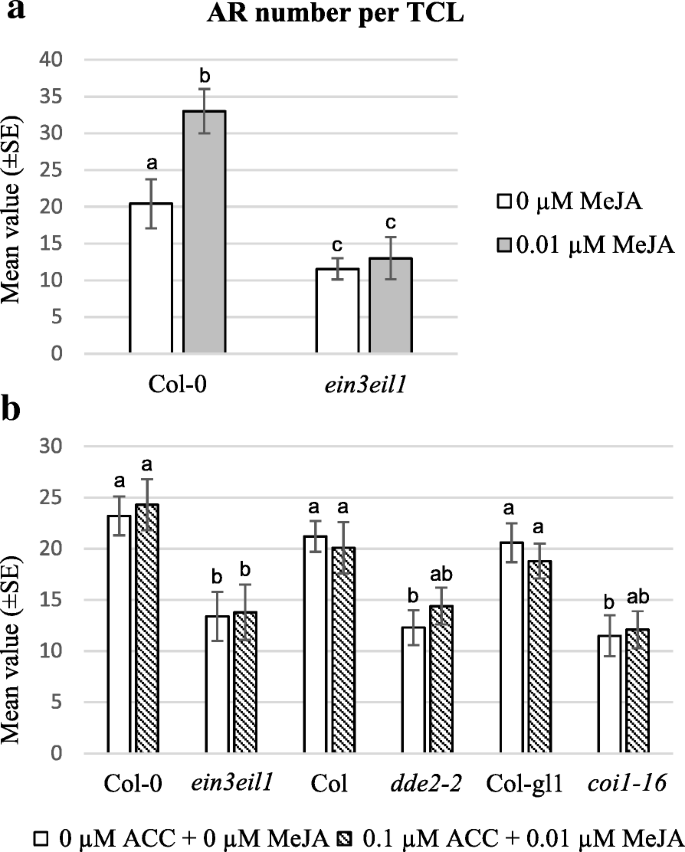
tcl的响应来自于gydF4y2Badde2-2gydF4y2Ba和gydF4y2Bacoi1-16gydF4y2Ba还在ACC(0.1μm)存在下分析突变体,以研究JA(生物合成和感知)与β中的ET-信号之间的相互作用。我们决定排除gydF4y2Baopr3gydF4y2Ba从分析来看,因为该突变体的响应表明OPDA本身对ar形成有影响(图。gydF4y2Ba1 bgydF4y2Ba和gydF4y2Ba2gydF4y2Ba).与wt不同的是,ar反应gydF4y2Badde2-2gydF4y2Ba和gydF4y2Bacoi1-16gydF4y2BaTCLS没有受到ACC的显着影响gydF4y2Baein3eil1gydF4y2Ba(无花果。gydF4y2Ba10B.gydF4y2Ba),提示内源性JA和et信号转导相互作用。为了验证这种可能性,gydF4y2Baein3eil1gydF4y2Ba采用IBA + Kin + 0.01 μM MeJA培养tcl,并与WT (Col-0)进行比较。MeJA的存在增强了Col-0中ar的形成,与其他WT基因型一样(图3)。gydF4y2Ba11个gydF4y2Ba和2,在比较),但ar生产gydF4y2Baein3eil1gydF4y2BaTCLs仍然低于WT,且不受MeJA的显著影响(图。gydF4y2Ba11个gydF4y2Ba).gydF4y2Ba
AR-formation在gydF4y2Baein3eil1gydF4y2BaMeja治疗的Tcls和gydF4y2Baein3eil1gydF4y2Ba和ACC + MeJA处理的ja突变型tcl。gydF4y2Ba(一)gydF4y2Ba从COL-0和Col-0和Col-0切除的TCL中的每种外植体(±SE)的平均值/ ARP编号gydF4y2Baein3eil1gydF4y2Ba在IBA + Kin-培养基的黑暗中在体外培养15天后,在存在/不存在0.01μmMeja的情况下植物。(gydF4y2BabgydF4y2Ba)在从中切除的TCLS中每次外部植物(±SE)的平均ar / arp编号gydF4y2Baein3eil1gydF4y2Ba,gydF4y2Badde2-2gydF4y2Ba,gydF4y2Bacoi1-16gydF4y2Ba在IBA + kin -培养基上,0.1 μM ACC + 0.01 μM MeJA,暗培养15 d后,突变体植株及其WTs分别为Col-0、Col和Col-gl1。在相同基因型内的处理之间,或在相同处理下的每个突变体与WT之间,至少在gydF4y2BaP < 0.05水平gydF4y2Ba,gydF4y2Ba用不同的字母表示。在相同基因型中以及每个突变体和其WT之间的相同字母显示没有统计差异。n = 60(第一次复制)(gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba)gydF4y2Ba
为了更好地理解JA和ET之间的相互作用,在ACC(0.1μm)和Meja(0.01μm)的存在下,在IBA + Kin下培养TCL。有趣的是,两种激素造成的补偿效果,因为在任何基因型中的缺失相比,AR-生产在ACC和MEJA的结合存在下没有显着变化(图。gydF4y2Ba11 bgydF4y2Ba).gydF4y2Ba
讨论gydF4y2Ba
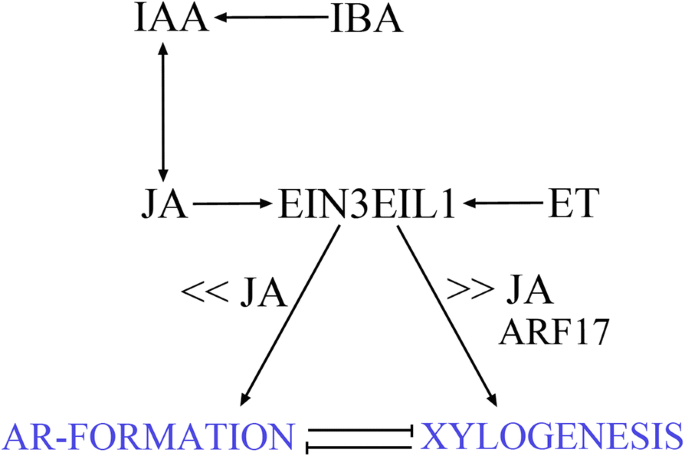
结果表明,JA,在暗度下,JA在暗度下呈正影响Ar形成或Xyloyesis,以相同的方式作用于完整的下胚轴和Tcls,在相同的外源性疾病加细胞素输入下生长。gydF4y2Ba
在两种不同的体系中,JA对ar的形成有积极的影响gydF4y2Ba
众所周知,不同的实验系统对拟南芥的生根能力有不同的影响[gydF4y2Ba5gydF4y2Ba].此外,本研究中分析的两个系统也有很大不同。实际上,次髓基是整个幼苗的一部分,其中当然,内源性激素含量是整个植物的一部分。相比之下,TCLS是从花序茎中切除的组织,即受伤系统,其被整个植物的激素背景分离,并且其中伤害相关的化合物,例如JAS [gydF4y2Ba43gydF4y2Ba]很快就活跃(当前结果)。在连续的黑暗中,在完整的拟南芥中,即使有限(有限),内源性唾液酰基也足以诱导AR反应([gydF4y2Ba8gydF4y2Ba[目前的结果)。这不是暗种TCLS的情况,在HF条件下无法形成ARS [gydF4y2Ba6gydF4y2Ba],培养开始时完全缺乏任何生长素([gydF4y2Ba7GydF4y2Ba],并给出结果)。然而,目前的结果表明,MeJA的去甲基化衍生的JA,在0.01 μM下与IBA + Kin结合,在两个系统和所有WT基因型中都能促进ar的形成。这两种体系的共同结果似乎排除了TCLs的ar反应是由损伤反应形成的JA引起的。为了验证这一假设,我们检测了tcl中JA、JA- ile和OPDA的内源性水平。所有这三种化合物在WT tll中检测到在切除后不久都处于非常高的水平,但它们的水平迅速下降,在第一个ar细胞簇形成(第1-5天)的培养期间一直保持低水平。然而,与0 MeJA相比,0.01 μM MeJA处理促进ar的形成,每天的JA增加幅度很小,但很显著。此外,缺乏一个ar增加十倍的浓度更高的法案(0.1μM)与治疗相比,没有惩罚,和减少/缺乏AR-formation造成的微摩尔的浓度(10μM),明确支持,JA结合IBA +亲属是AR-formation的增强剂,但在特定的低水平(无花果。gydF4y2Ba12.gydF4y2Ba).gydF4y2Ba
JA是IAA在ar形成中的共同调解人,参与早期合成和信号转导gydF4y2Ba
我们最近的结果表明,两者都有gydF4y2Ba在足底gydF4y2Ba而在TCLs中,外源IBA必须转化为IAA形成ARs,而IAA通过邻氨基甲酸合酶活性生物合成是IBA处理拟南芥暗生苗和TCLs中ar促进所必需的[gydF4y2Ba7GydF4y2Ba,gydF4y2Ba10.gydF4y2Ba].结果表明,在0.01 μM MeJA作用下,tcl中内源IAA水平在第一个ar细胞簇形成时(第5天)升高,并与JA的升高平行。根据研究,MeJA处理拟南芥48 h后,游离IAA水平显著升高[gydF4y2Ba44gydF4y2Ba].综上所述,目前和过去的结果表明,JA通过正向影响内源性IAA水平参与ar的形成。TCLs中ar反应的减少gydF4y2Badde2-2gydF4y2Ba和gydF4y2Bacoi1-16gydF4y2Ba突变体表明生物合成的早期步骤和JA的感知都参与了这种与生长素的协同调节。与这些数据相反,JA在拟南芥完整下胚轴去黄化诱导的AR形成中发挥了负作用,并与通过COI1传递JA信号有关[gydF4y2Ba18.gydF4y2Ba].不同的结果可以通过不同的激素和环境条件来解释,即,没有外源激素与IBA + Kin的存在和光与连续黑暗([gydF4y2Ba18.gydF4y2Ba在比较]和本发明的结果),按照JA与其它植物激素的公知的相互作用,和JA的众多光诱导基因的负面影响[gydF4y2Ba15.gydF4y2Ba,gydF4y2Ba45gydF4y2Ba].gydF4y2Ba
有趣的是,晚期生物合成突变体的反应gydF4y2Baopr3gydF4y2Ba不同于早期生物合成突变体的不同gydF4y2Badde2-2gydF4y2Ba,因为gydF4y2Baopr3gydF4y2Ba显示与其WT相当的AR响应gydF4y2Ba在足底gydF4y2Ba在Tcls。突变体gydF4y2Baopr3gydF4y2Ba据报道,已缺乏JA缺陷但opda积累[gydF4y2Ba15.gydF4y2Ba].目前的结果表明,OPDA可以通过与JA信号通路不同的方式积极地影响完整的下胚轴和TCL的ar形成。根据COI1-JAZ下拉测定中的OPDA不是活性配体[gydF4y2Ba24gydF4y2Ba[据报道,已举报了OPDA特异性基因表达和OPDA的无关作用[gydF4y2Ba15.gydF4y2Ba,gydF4y2Ba46gydF4y2Ba].然而,少量的JA/JA- ile在早期检测中gydF4y2Baopr3gydF4y2Ba突变体也可能有助于形成。事实上,已经报道了这种突变体的欧姆姆/ JA-ILE生产的OPR3独立途径[gydF4y2Ba47gydF4y2Ba].尽管尚不清楚这一途径在多大程度上促进了WT中JA的产生,但它可能解释了一些主要归因于OPDA积累的结果。gydF4y2Ba
MeJA促进TCLs木质素发生的浓度比促进ar形成的浓度高很多倍,并且参与ar抑制基因ARF17的表达gydF4y2Ba
木耳的异位/额外地形成gydF4y2Ba在足底gydF4y2Ba是一种木源性反应[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba11.gydF4y2Ba].有趣的是,JA最近被证明可以诱导拟南芥Col-0的根中产生额外的木质部[gydF4y2Ba19.gydF4y2Ba].此外,gydF4y2Bacoi1-1gydF4y2Ba和gydF4y2Bajasmonate resistant1-1gydF4y2Ba突变体,涉及JA信号传导,不要响应JA的额外木质,而gydF4y2Baopr3gydF4y2Ba形式(gydF4y2Ba19.gydF4y2Ba].在相同的体系中,JA效应是剂量依赖的,因为在1 μM JA处理下,WT植株产生额外木质部的比例约为15%,而在10 μM JA处理下,这一比例最高可达60% [gydF4y2Ba19.gydF4y2Ba].我们的研究结果表明,拟南芥TCLS中的Xyloyesis也受到Ja的控制(图。gydF4y2Ba12.gydF4y2Ba).然而,如在AR-形成的情况下,特定JA水平是必要的,用于触发该程序,并且它们似乎比那些必要生根更高。事实上,由本组织学分析,茉莉酸甲酯,在10μM,即作为显示在浓度1000倍,加强AR-形成更高,是能够促进xylogenesis,按照促进额外的木质部gydF4y2Ba在足底gydF4y2Ba以同样的浓度[gydF4y2Ba19.gydF4y2Ba].然而,JA水平刺激Xyloyesis在不同物种中可能不同。事实上,10μmMeja的浓度不是烟草TCLS中的乳糖感应,其中0.1μm能够诱导过程[gydF4y2Ba16.gydF4y2Ba].gydF4y2Ba
有报道称,细胞分裂素降低了JA对拟南芥幼苗木质部发育的影响[gydF4y2Ba19.gydF4y2Ba].这种拮抗作用在拟南芥tcl中似乎没有发生,因为我们的初步结果表明,在10 μM JA下,IBA + Kin和IBA单独培养的外植体均同样增强了木本发生。gydF4y2Ba4 fgydF4y2Ba和附加文件gydF4y2Ba5gydF4y2Ba:对比图S4)。一项详细的定量研究正在进行中,以深入了解木本反应gydF4y2Ba在足底gydF4y2Ba和tcl。gydF4y2Ba
拟南芥中介导生长素诱导基因激活的ARF蛋白[gydF4y2Ba48gydF4y2Ba] ARF6和ARF8在具有部分重叠职能的生殖器官中诱导JA生物合成[gydF4y2Ba27gydF4y2Ba].在光照条件下,这两个基因在拟南芥的下胚轴中都有强烈的表达gydF4y2BaARF17gydF4y2Ba表达式被简化[gydF4y2Ba26gydF4y2Ba].存在的组织学观察和RT-QPCR分析表明,在连续的黑暗下gydF4y2BaARF6.gydF4y2Ba和gydF4y2BaARF8.gydF4y2Ba表达仍然是Meja应用程序的ARP / AR提示中的本地化,gydF4y2BaARF17gydF4y2Ba表达在ARPS / ARS中不存在。然而,有趣的是,gydF4y2BaARF17:格斯gydF4y2Ba信号存在于木本区。按照,即使表达式信号gydF4y2BaARF17gydF4y2Ba在光照下,下胚轴的含量很低,但在维管细胞中仍可检测到[gydF4y2Ba26gydF4y2Ba].我们的结果表明gydF4y2BaARF17gydF4y2Ba在10 μM MeJA的存在下,tcl中木质素发生增加,即浓度增加。这表明ARF17在与ar形成竞争中促进木质素发生(图。gydF4y2Ba12.gydF4y2Ba),根据其此前报道的负ar调节器的作用[gydF4y2Ba26gydF4y2Ba].有趣的是,tclgydF4y2Baopr3gydF4y2Ba突变体表现出与WT相同的表达模式,表达量增加幅度与WT相同gydF4y2BaARF17gydF4y2Ba在10 μM MeJA下表达。再加上木质部的形成gydF4y2Baopr3在足底gydF4y2Ba10 μM JA [gydF4y2Ba19.gydF4y2Ba,在这个JA缺失突变体中存在的OPDA本身不仅可以诱导ar的形成,而且还可以诱导木本发生。当然,进一步的研究是必要的,因为关于opda激活的网络的信息仍然非常有限。gydF4y2Ba
TCLS中AR形成的JA-ET拮抗相互作用涉及EIN3 / EIL1gydF4y2Ba
据报道,JA和ET以相互依赖的方式控制植物防御,但它们在形态发生中也相互拮抗某些功能,如黄化苗顶端钩的形成[gydF4y2Ba32gydF4y2Ba].在拟南芥中,ar反应增强gydF4y2Ba在足底gydF4y2Ba在ET前体ACC联合IBA + Kin存在的情况下,这里观察到的与以往IBA单独联合ACC引起黄化幼苗ar增加的数据一致[gydF4y2Ba10.gydF4y2Ba].此外,通过使用的gydF4y2Baein3eli1gydF4y2Ba突变体,在ET感知中受损,以前[gydF4y2Ba10.gydF4y2Ba],目前的数据表明et作用涉及EIN3/EIL1网络的活性。同样的网络已被证明在木质素发生中起积极作用gydF4y2Ba在足底gydF4y2Ba[gydF4y2Ba11.gydF4y2Ba].gydF4y2Ba
在0.01 μM MeJA处理的tcl中,ACC与IBA + Kin联合,通过促进木质素的形成来降低ar的形成。这表明JA和ET在控制tcl中ar的形成方面存在拮抗作用,因为木质素发生竞争。的低而不变的ar响应gydF4y2Baein3eil1gydF4y2Ba结果表明,在0.01 μM MeJA和0.1 μM ACC联合作用下,野生型TCLs中JA促进ar作用和ET降低作用之间存在补偿关系,表明EIN3和EIL1是两种激素作用的联系者。据报道,JA-ET拮抗作用的分子机制是基于ja激活的转录因子的两个分支相互抑制,其中之一是EIN3/EIL1 [gydF4y2Ba49gydF4y2Ba,gydF4y2Ba50gydF4y2Ba].因此,EIN3/EIL1可能代表JA和ET在控制ar形成和木质素发生方面的关键环节。gydF4y2Ba
结论gydF4y2Ba
总之,结果统一地揭示了JA和ET信号在疾病诱导的Ar - 形成在完整的下胚轴和体外培养的TCls的疾病诱导的ar形成之间的关键函数,涉及致致致致致致致致致致致致致致致致致致致致病作用的TCL(图。gydF4y2Ba12.gydF4y2Ba).与拟南芥相似的方法可能有助于提高ar形成的共同机制的知识gydF4y2Ba在足底gydF4y2Ba在扦插过程中,通过抑制木本发生的竞争性实现,寻找最优条件,使顽固性种更好地生根。gydF4y2Ba
缩写gydF4y2Ba
- ACC:gydF4y2Ba
-
1-aminocyclopropane-1-carboxylic酸gydF4y2Ba
- ar:gydF4y2Ba
-
不定根gydF4y2Ba
- ARP:gydF4y2Ba
-
不定根原基gydF4y2Ba
- DAS:gydF4y2Ba
-
天后分层gydF4y2Ba
- 等:gydF4y2Ba
-
乙烯gydF4y2Ba
- 弗兰克-威廉姆斯:gydF4y2Ba
-
鲜重gydF4y2Ba
- 国际宇航科学院:gydF4y2Ba
-
Indole-3-acetic酸gydF4y2Ba
- IBA:gydF4y2Ba
-
吲哚-3-丁酸gydF4y2Ba
- JA:gydF4y2Ba
-
茉莉酸gydF4y2Ba
- 亲人:gydF4y2Ba
-
激动素gydF4y2Ba
- LM:gydF4y2Ba
-
光学显微镜gydF4y2Ba
- LR:gydF4y2Ba
-
侧根gydF4y2Ba
- Meja:gydF4y2Ba
-
甲基jasmonategydF4y2Ba
- OPDA:gydF4y2Ba
-
12-oxophytodienoic酸gydF4y2Ba
- 公关:gydF4y2Ba
-
主根gydF4y2Ba
- TCL:gydF4y2Ba
-
薄细胞层gydF4y2Ba
- TF:gydF4y2Ba
-
转录因子gydF4y2Ba
- WT:gydF4y2Ba
-
野生型gydF4y2Ba
参考文献gydF4y2Ba
- 1。gydF4y2Ba
李SW,薛L,徐某,冯H,介质介质,基因和信号传导。BOT Rev. 2009; 75:230-47。gydF4y2Ba
- 2.gydF4y2Ba
德鲁奇U,弗兰肯P,Hajirezaei先生。植物激素稳态,信号传导和功能在扦插中的不定根形成。前植物SCI。2016; 7:381。gydF4y2Ba
- 3.gydF4y2Ba
Takahashi F, Sato-Nara K, Kobayashi K, Suzuki M, Suzuki H.蔗糖诱导不定根gydF4y2Ba拟南芥gydF4y2Ba幼苗。植物学报2003;116:83-91。gydF4y2Ba
- 4.gydF4y2Ba
Falasca g,Altamura mm。不定根的组织学分析gydF4y2Ba拟南芥gydF4y2Ba(l)Heynh幼苗。植物生物系统。2003;137:265 - 74。gydF4y2Ba
- 5.gydF4y2Ba
da Rocha Correa L, Troleis J, Mastroberti AA, Mariath JEA, Fett-Neto AG。拟南芥不定根的不同方式。植物医学杂志。2012;14:100-9。gydF4y2Ba
- 6.gydF4y2Ba
黄志刚,黄志刚,黄志刚。水稻不定根的形成gydF4y2Ba拟南芥gydF4y2Ba薄细胞层。植物细胞代表2004; 23:17-25。gydF4y2Ba
- 7.gydF4y2Ba
吲哚-3-丁酸通过转化为吲哚-3-乙酸和刺激邻氨基苯甲酸合成酶活性来促进拟南芥薄细胞层的不定根。BMC Plant Biol. 2017;17:121。gydF4y2Ba
- 8.gydF4y2Ba
植物生长素和细胞分裂素对拟南芥不定根尖静止中心形成的调控。安机器人。2013;112:1395-07。gydF4y2Ba
- 9。gydF4y2Ba
Della Rovere F,Fattorini L,D'Angeli S,Veloccia A,Del Duca S,Cai G,等。Arabidopsis ShR和SCR转录因子和AUX1助流素流入载体控制偶然生根和Xyloyesis之间的开关gydF4y2Ba在足底gydF4y2Ba和在gydF4y2Ba体外gydF4y2Ba培养薄细胞层。安机器人。2015;115:617-28。gydF4y2Ba
- 10。gydF4y2Ba
Veloccia A, Fattorini L, Della Rovere F, Sofo A, D 'Angeli S, Betti C,等。乙烯和生长素的互作对不定根的控制gydF4y2Ba拟南芥gydF4y2Ba.J Exp Bot。2016; 67:6445-58。gydF4y2Ba
- 11.gydF4y2Ba
Fattorini L,Della Rovere F,Andreini E,Ronzan M,Falasca G,Altamura MM。吲哚-3-丁酸诱导幼杆植入物的异位形成gydF4y2Ba拟南芥gydF4y2Ba无需转换成吲哚-3-乙酸和与乙烯的正相互作用。int j mol sci。2017; 18:2474。gydF4y2Ba
- 12.gydF4y2Ba
Pesquet E,Jauneau A,Digonnet C,Boudet Am,Pichon M,Goffner D.gydF4y2BaZinnia线虫gydF4y2Ba:从离体管状细胞到木质部的缺失环节。杂志。2003;119:463-8。gydF4y2Ba
- 13.gydF4y2Ba
Fukuda H.气管内元素分化。植物细胞。1997年; 9:1147-56。gydF4y2Ba
- 14.gydF4y2Ba
Ricci A,Rolli E,Brunoni F,Dramis L,Sacco E,Fattorini L等人。1,3-di(Benzo [gydF4y2BadgydF4y2Ba尿素作为不定根佐剂或木发生促进剂在角豆和松树微插枝上的作用取决于外源吲哚-3-丁酸的存在与否。PCTOC。2016; 126:411-27。gydF4y2Ba
- 15.gydF4y2Ba
植物的生物合成、感知、信号转导和生长发育。《植物学年鉴》2007年综述的更新。安机器人。2013;111:1021-58。gydF4y2Ba
- 16.gydF4y2Ba
Fattorini L, Falasca G, Kevers C, Rocca LM, Zadra C, Altamura MM.茉莉酸甲酯对烟草薄细胞层的不定根有促进作用。足底。2009;231:155 - 68。gydF4y2Ba
- 17.gydF4y2Ba
李志强,张志强,张志强,等。茉莉酸对矮牵牛花扦插生根的影响。BMC Plant Biol. 2015;15:229。gydF4y2Ba
- 18.gydF4y2Ba
陈志强,陈志强,陈志强,等。生长素通过调节茉莉酸稳态来控制拟南芥不定根的起始。植物细胞。2012;24:2515-27。gydF4y2Ba
- 19.gydF4y2Ba
张国强,张淑华,张淑华,张淑华,李淑华,张国强。茉莉酸与细胞分裂素在木质部发育中的拮抗作用。Sci众议员2017;7:10212。gydF4y2Ba
- 20.gydF4y2Ba
Von Malek B,Van der Graaff E,Schneitz K,Keller B.拟南芥雄性无菌突变体DDE2-2在编码茉莉酸生物合成途径之一的联烯氧化物合成酶基因中有缺陷。Planta。2002; 216:187-92。gydF4y2Ba
- 21.gydF4y2Ba
拟南芥雄性不育突变体op3缺乏茉莉酸合成所需的12-氧植物二烯酸还原酶。《美国国家科学院学报》上。2000; 97:10625-30。gydF4y2Ba
- 22.gydF4y2Ba
Chehab EW,Kim S,Savchenko T,Kliebenstein D,Dehesh K,Braam J. Intronort-DNA插入呈现拟南芥OPR3 A条件茉莉酸产生突变体。植物理性。2011; 156:770-8。gydF4y2Ba
- 23.gydF4y2Ba
埃利斯C,特纳JG。甲有条件肥沃COI1等位基因表明植物激素信号在拟南芥通路拟南芥种子和幼苗之间的串扰。Planta。2002; 215:549-56。gydF4y2Ba
- 24.gydF4y2Ba
刘光华,牛勇,刘光华,等。JAZ阻遏蛋白是SCF的靶标gydF4y2BaCOI1gydF4y2Ba复杂的茉莉酸信号。大自然。2007;448:661-5。gydF4y2Ba
- 25。gydF4y2Ba
生长素反应因子。植物学报。2007;10:453-60。gydF4y2Ba
- 26。gydF4y2Ba
Gutierrez的L,布素JD,Pacurar DI,SchwambachĴ,Pacurar男,在拟南芥不定根的森佐贝利尼C.表型可塑性由生长素应答因子转录物和微RNA的丰度复杂调节控制。植物细胞。2009年; 21:3119-32。gydF4y2Ba
- 27。gydF4y2Ba
Nagpal P,埃利斯CM,韦伯H,Ploense SE,巴卡维LS,吉尔福伊尔TJ等。生长素应答因子ARF6和ARF8促进茉莉酸的生产和花成熟。发展。2005; 132:4107-18。gydF4y2Ba
- 28.gydF4y2Ba
李志强,李志强,李志强,等。乙烯通过影响生长素的生物合成和运输依赖的生长素分布来调控根的生长。植物细胞。2007;19:2197 - 212。gydF4y2Ba
- 29.gydF4y2Ba
那迦S,Ivanchenko MG,Muday GK。乙烯调节侧根形成和生长素运输中gydF4y2Ba拟南芥gydF4y2Ba.植物j . 2008; 55:175 - 87。gydF4y2Ba
- 30.gydF4y2Ba
钟胜,赵敏,石涛,石华,安芳,赵强,等。EIN3/EIL1与PIF1协同抑制光氧化,促进拟南芥幼苗绿化。《美国国家科学院学报》上。2009; 106:21431-6。gydF4y2Ba
- 31.gydF4y2Ba
Zhu Z,F,Feng Y,Li P,Xue L,Mu A等。乙烯稳定的转录因子(EIN3 / EIL1)的DEREPLACES介导茉莉酸酯和乙烯信号传导协同作用gydF4y2Ba拟南芥gydF4y2Ba.《美国国家科学院学报》上。2011; 108:12539-44。gydF4y2Ba
- 32.gydF4y2Ba
朱Z.分子基础在拟南芥茉莉酸和乙烯信号作用。J Exp Bot。2014; 65:5743-8。gydF4y2Ba
- 33.gydF4y2Ba
陈志强,陈志强,陈志强,等。一种烟草组织培养快速生长和生物测定的新方法。杂志。1962;15:473 - 97。gydF4y2Ba
- 34。gydF4y2Ba
张志刚,李志刚。拟南芥的研究进展。纽约:冷泉港实验室出版社;2002.gydF4y2Ba
- 35。gydF4y2Ba
Miersch O,Neumerkel J,Dippe M,Stenzel I,Wasternack C.羟基化的茉莉酸盐通常发生茉莉酸的代谢物,并促进茉莉酸甲酸信号传导中的部分关断。新植物。2008; 177:114-27。gydF4y2Ba
- 36。gydF4y2Ba
acta physica sinica, 2017, 36(4): 588 - 588 .刘学军,王学军,王学军。植物生长素和生长素前体的高通量和定量分析。工厂方法。2012;31。gydF4y2Ba
- 37.gydF4y2Ba
Balcke G,Handrick V,Bergau N,Fichtner M,Henning A,Stellmach H,等。植物组织中植物激素高敏感高通量分析的UPLC-MS / MS方法。植物方法。2012; 8:47。gydF4y2Ba
- 38.gydF4y2Ba
利用茉莉酸特异性抗体对番茄和拟南芥叶片茉莉酸特异性表达的研究。新植醇。2011;190:1069 - 80。gydF4y2Ba
- 39.gydF4y2Ba
Rieu I, Powers SJ。实时定量RT-PCR:设计、计算和统计学。植物细胞。2009;21:1031-3。gydF4y2Ba
- 40.gydF4y2Ba
Guénin S, Mauriat M, Pelloux J, Van Wuytswinkel O, Bellini C, Gutierrez L. qRT-PCR数据的标准化:采用系统的必要性,实验条件特异性,参考文献的验证。J Exp Bot. 2009; 60:487-93。gydF4y2Ba
- 41.gydF4y2Ba
Larionov A,Krause A,Miller W.一种基于标准曲线的相对实时PCR数据处理方法。BMC生物信息学。2005; 6:62。gydF4y2Ba
- 42.gydF4y2Ba
刘n,吴S,van Houten J,Wang Y,Ding B,Fei Z等。MicroRNA 167通过MicroRNA 167的疾病响应因子6和8的下调导致番茄中的花卉发育缺陷和女性无菌性。J Exp Bot。2014; 65:2507-20。gydF4y2Ba
- 43.gydF4y2Ba
Wasternack C. Jasmonates:生物合成、信号转导和在植物胁迫反应和生长发育中的作用的最新进展。安机器人。2007;100:681 - 97。gydF4y2Ba
- 44.gydF4y2Ba
Dombrecht B,Xue GP,Sprague SJ,Kirkegaard Ja,Ross JJ,Reid JB等。Myc2差异地调节拟南芥中不同的jasmonate依赖功能。植物细胞。2007; 19:2225-45。gydF4y2Ba
- 45.gydF4y2Ba
翟q,李c-b,zheng w,wu x,zhao j,周g等。植物色团缺乏症导致茉莉酸的过度生产,拟南芥中的茉莉酮酸响应基因的表达升高。植物细胞生理。2007; 48:1061-71。gydF4y2Ba
- 46.gydF4y2Ba
在拟南芥中,12-氧-植物二烯酸触发一组独特的基因表达,并在创伤诱导基因表达中发挥作用。植物杂志。2005;139:1268 - 83。gydF4y2Ba
- 47.gydF4y2Ba
Chini A,Monte I,ZamarreñoA-M,Hamberg M,Lassueur S,Reymond P等人。OPR3无关的途径使用4,5-二脱羟基羟基丙酸乳酸己酸酯合成。NAT CHEM BIOL。2018; 14:171-8。gydF4y2Ba
- 48.gydF4y2Ba
生长素响应因子结构域在生长素响应转录中的作用。植物细胞。2003;15:533-43。gydF4y2Ba
- 49。gydF4y2Ba
张x,zhu z,f,hao d,li p,song j等。jasMonate-activated myc2抑制乙烯短暂敏感性3活性,以拮抗亚乙烯促进的乙烯促进的顶端钩形成。植物细胞。2014; 26:1105-17。gydF4y2Ba
- 50。gydF4y2Ba
宋某,黄鹤,高清,王j,wu d,liu x等。MyC2和乙烯短暂敏感度3之间的相互作用调节拟南芥中茉莉酸酯和乙烯信号之间的拮抗作用。植物细胞。2014; 26:263-79。gydF4y2Ba
致谢gydF4y2Ba
我们感谢提供转基因株系/突变株种子的同事,即beatkeller(瑞士苏黎世大学)gydF4y2Badde2-2gydF4y2Ba突变体,约翰浏览(华盛顿州立大学,美国)gydF4y2Baopr3gydF4y2Ba约翰·特纳(英国东安格利亚大学)gydF4y2Bacoi1-16gydF4y2Ba突变体,郭宏伟(中国北京大学)为gydF4y2Baein3eil1gydF4y2Ba突变体。特别感谢Catherine Bellini (Umeå大学,瑞典)慷慨的礼物gydF4y2BaARF6:格斯gydF4y2Ba,gydF4y2BaARF8:格斯gydF4y2Ba,gydF4y2BaARF17:格斯gydF4y2Ba种子,并举办LF在她的实验室阶段。我们也感谢盖德巴克杜尔,比吉特使用Ortel和哈根Stellmach(所有植物研究所生物化学,哈雷),用于测量植物激素的帮助。gydF4y2Ba
资金gydF4y2Ba
Sapienza Università di Roma,授予MMA编号RP116154C3D60B9D,授予GF编号RG11715C775A7FE9。资金用于实验设计、数据分析和开放获取支付。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
本研究中生成或分析的所有数据均包含在本文中[及其附加文件]gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba和gydF4y2Ba5gydF4y2Ba].在当前研究期间获取和/或分析的数据集可从合理的请求上的相应作者获得。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
LF是主要的研究者。她计划了实验,用幼苗和tcl进行了实验,并进行了免疫定位分析。BH进行JA、JA- ile、OPDA、IAA的定量,并配合免疫定位分析。LG进行了RT-qPCR分析。AV和FDR对标本进行组织学和组织化学检查。DP对结果进行了统计评价。GF合作分析数据并对其进行讨论。MMA解释了数据并撰写了手稿。所有作者阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
两位作者宣称他们没有相互竞争的利益。gydF4y2Ba
出版商的注意事项gydF4y2Ba
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。gydF4y2Ba
附加文件gydF4y2Ba
额外的文件1:gydF4y2Ba
图S1。gydF4y2BaJA / JA-ILE免疫胶凝的阳性和阴性对照。(gydF4y2Ba一个gydF4y2Ba)阳性对照:WS TCL在IBA + Kin培养基上的暗度下培养15天,固定在4%的500μmJA(gydF4y2BawgydF4y2Ba/gydF4y2BavgydF4y2Ba)免疫定位前的EDC。(gydF4y2BabgydF4y2Ba)阴性对照:WS TCL在IBA + kin培养基上的暗度下培养15天,在免疫标记程序期间没有与抗JA初生孵育的切片。(gydF4y2Ba一个gydF4y2Ba-gydF4y2BabgydF4y2Ba) 5 μm厚切片,荧光显微镜下观察。柱= 20 μm。(JPG 185 kb)gydF4y2Ba
附加文件2:gydF4y2Ba
表S1。gydF4y2Ba引物序列。用于定量的引物序列列表gydF4y2BaARF6.gydF4y2Ba,gydF4y2BaARF8.gydF4y2Ba,gydF4y2BaARF17gydF4y2Ba在ws(wt)中的表达gydF4y2Baopr3gydF4y2BaTCLS通过RT-QPCR。(PDF 62 KB)gydF4y2Ba
额外的文件3:gydF4y2Ba
图S2。gydF4y2BaGermination of different genotypes (HF-, IBA + Kin-media) and AR density in WT seedlings (HF-medium). (a - bgydF4y2Ba发芽率gydF4y2Badde2-2gydF4y2Ba,gydF4y2Baopr3gydF4y2Ba和gydF4y2Bacoi1-16gydF4y2Ba突变种子,它们的WTS(COL,WS和COL-GL1),在没有IBA和Kin的介质上(HF培养基,gydF4y2Ba一个gydF4y2Ba)或含有10 μM IBA和0.1 μM Kin (IBA + Kin培养基,gydF4y2BabgydF4y2Ba),或不存在MeJA (0 μM MeJA),或存在0.01 μM或0.1 μM MeJA。(gydF4y2BacgydF4y2Ba) 22 DAS条件下,3个WT基因型幼苗在HF培养基黑暗条件下生长的平均AR密度,即每cm下胚轴的平均ARP/AR数(±SE)。gydF4y2Ba一种,gydF4y2BaPgydF4y2Ba与其他基因型相比差异< 0.05。无字母表示无显著差异。gydF4y2BaNgydF4y2Ba= 30 (gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba).(PDF 87 kb)gydF4y2Ba
附加文件4:gydF4y2Ba
图S3。gydF4y2Ba表达式模式gydF4y2BaARF6:格斯gydF4y2Ba,gydF4y2BaARF8:格斯gydF4y2Ba,gydF4y2BaARF17:格斯gydF4y2Ba在22 DAS条件下,用0.01 μM MeJA或不用0.01 μM MeJA生长的暗生长幼苗。(gydF4y2Baa - bgydF4y2Ba)在AR顶点中检测到的GUS信号gydF4y2BaARF6:格斯gydF4y2Ba来自两个不同的副本。(gydF4y2Bac - dgydF4y2Ba)gydF4y2BaARF8:格斯gydF4y2Ba不同复制苗AR尖的表达。(gydF4y2BaegydF4y2Ba-gydF4y2BafgydF4y2Ba无GUS信号进入gydF4y2BaARF17:格斯gydF4y2Ba不同复制苗的AR尖。(gydF4y2BaggydF4y2Ba)在果皮附近的脉管系统(箭头)表达信号,在下胚轴gydF4y2BaARF17:格斯gydF4y2Ba幼苗。(gydF4y2BahgydF4y2Ba-gydF4y2Ba我gydF4y2Ba)gydF4y2BaARF17:格斯gydF4y2Ba在不同复制的幼苗中,ARs和它们的LRs之间的维管连接(箭头)的表达。光镜下观察整株幼苗。柱= 100 μm (gydF4y2Ba一个gydF4y2Ba-gydF4y2BacgydF4y2Ba),50μm(gydF4y2BadgydF4y2Ba-gydF4y2Ba我gydF4y2Ba).(JPG 1392 kb)gydF4y2Ba
附加文件5:gydF4y2Ba
图S4。gydF4y2BaIBA (10 μM)与MeJA (10 μM)联合培养深色TCLs木本发生。Ws - TCL纵向径向切片的细节,显示与内胚层来源的细胞不同的木基成分(箭头)(第15天)。Bar = 50 μm。(JPG 593 kb)gydF4y2Ba
权利和权限gydF4y2Ba
开放访问gydF4y2Ba本文根据创意公约署署署的条款分发了4.0国际许可证(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条提供的数据,除非另有说明。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
法托里尼,豪斯,B,古铁雷斯,L。gydF4y2Ba等等。gydF4y2Ba茉莉酸促进生长素诱导的暗生长的不定根gydF4y2Ba拟南芥gydF4y2Ba幼苗和茎薄细胞层通过串扰与乙烯信号传导和木瓜发生调节。gydF4y2BaBMC植物杂志gydF4y2Ba18,gydF4y2Ba182(2018)。https://doi.org/10.1186/s12870-018-1392-4gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-018-1392-4gydF4y2Ba
关键词gydF4y2Ba
- 不定加油gydF4y2Ba
- ARF17gydF4y2Ba
- EIN3 / EIL1gydF4y2Ba
- 乙烯gydF4y2Ba
- JasmonategydF4y2Ba
- 薄层细胞gydF4y2Ba
- Xylocyesis.gydF4y2Ba