- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
缺氧胁迫下外源钙对黄瓜果实品质、光合作用、叶绿素荧光和快速叶绿素荧光的影响gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba18gydF4y2Ba文章编号:gydF4y2Ba180gydF4y2Ba(gydF4y2Ba2018gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
植物在淹水和水培栽培过程中常遭受缺氧胁迫。本研究调查了黄瓜(gydF4y2BaCucumis巨大成功gydF4y2BaL.)植物生长参数、叶片光合作用、叶绿素荧光、快速叶绿素a荧光瞬态(OJIP)和果实品质参数对外源钙缓解缺氧胁迫的影响。在出菇期,黄瓜植株暴露在缺氧和缺氧+钙环境中gydF4y2Ba2 +gydF4y2Ba处理(4 mM CagydF4y2Ba2 +gydF4y2Ba)持续9 d。gydF4y2Ba
结果gydF4y2Ba
外源钙处理提高了缺氧胁迫黄瓜的生物量和果实品质,提高了净光合速率、气孔导度和细胞间COgydF4y2Ba2gydF4y2Ba浓度、光系统II光化学的最大量子效率、PSII的实际光化学效率、光化学猝灭系数、非光化学猝灭系数。此外,叶绿素a荧光瞬态测定表明,与缺氧+钙处理叶片相比,缺氧处理叶片的K-和l -带阳性更为明显gydF4y2Ba2 +gydF4y2Ba表明低氧处理诱导氧进化络合物解偶联,抑制了质体醌池外的电子传输(QgydF4y2Ba一个gydF4y2Ba,问gydF4y2BabgydF4y2Ba),包括对光系统i末端电子受体减少的可能限制。外源钙可以减少黄瓜中这些胁迫诱导的损伤。gydF4y2Ba
结论gydF4y2Ba
研究了缺氧胁迫下外源钙对黄瓜果实期光合作用的影响。低氧胁迫可能从PSII的供体侧损伤光合电子传递链,导致PSI的末端受体减少,而外源钙增强了黄瓜叶片的电子传递能力,减少了叶片的低氧损伤。gydF4y2Ba
背景gydF4y2Ba
陆生植物在生长过程中,在应对因内涝、洪水和水培栽培而导致的环境含氧量降低时,其特定组织往往处于低氧浓度中[gydF4y2Ba1gydF4y2Ba].全球约16%的肥沃土地受到土壤内涝的影响,导致作物产量减少高达80% [gydF4y2Ba2gydF4y2Ba].植物能在低氧环境中存活gydF4y2Ba2gydF4y2Ba)通过激活不同的分子、代谢和生理反应来改善环境[gydF4y2Ba3.gydF4y2Ba],例如细胞能量变化减少、细胞质pH值下降、空气组织形成增强、茎伸长、在浸没的叶片周围使用气膜,以及厌氧呼吸和活性氧(ROS)产生的有毒最终产物的积累[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba].根区缺氧显著抑制植物生长、闪蒸和干物质积累[gydF4y2Ba6gydF4y2Ba].此外,低氧胁迫还会通过限制植物ATP的供应而破坏离子运输过程、细胞代谢和养分获取gydF4y2Ba+gydF4y2Ba腺苷三磷酸酶泵(gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba].gydF4y2Ba
钙,尤其是胞质游离钙gydF4y2Ba2 +gydF4y2Ba,被广泛认为是植物体内的关键信号分子,参与多种信号转导途径,介导植物对非生物和生物刺激的适应性反应[gydF4y2Ba9gydF4y2Ba].在水稻、小麦和黄瓜等许多植物中都观察到钙参与了缺氧反应[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba].这种缺氧介导的钙含量升高gydF4y2Ba2 +gydF4y2Ba是激活基因和合成细胞、组织和生物体水平的适应反应所需蛋白质的基础[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba12gydF4y2Ba].水果生长发育的复杂过程受基因和代谢途径的调控[gydF4y2Ba13gydF4y2Ba].光合碳同化是植物重要的代谢过程,受环境条件的强烈影响[gydF4y2Ba14gydF4y2Ba].绿色植物需要PSII从阳光中吸收能量,以支持果实的发育和成熟,但在光合作用中利用这种巨大的光能会带来很大的风险[gydF4y2Ba15gydF4y2Ba],尤其是当植物遭受环境胁迫时,例如盐度[gydF4y2Ba16gydF4y2Ba]和热应激[gydF4y2Ba17gydF4y2Ba].gydF4y2Ba
钙是植物通过维持膜稳定性、渗透稳态和细胞信号传递来抵抗胁迫和正常光合功能所必需的[gydF4y2Ba18gydF4y2Ba].测量叶绿素荧光是测定PSII活性的一种强大且无创的技术。非生物和生物因子对PSII活性有显著影响,因此PSII的测定可以使我们更好地了解植物对环境变化的响应和光合机制[gydF4y2Ba19gydF4y2Ba].最常见的方法是基于荧光计发出的强光化短脉冲(通常为一秒长)时,适应黑暗环境的叶子发出的PAM荧光测定法高频记录[gydF4y2Ba14gydF4y2Ba].荧光动力学可以反映光合作用的一些有价值的信息,如光化学效率和光合电子传递的功能和结构,主要在PSII [gydF4y2Ba20.gydF4y2Ba].荧光值从初始(FgydF4y2Ba0gydF4y2Ba(FgydF4y2Ba米gydF4y2Ba),可分为O相、J相、I相和P相。jip检验作为多相瞬变荧光的数学模型[gydF4y2Ba14gydF4y2Ba],可以测量一些生物物理参数和概率,表征PSII中涉及的组件的功能和结构属性。以前的评论报告说CagydF4y2Ba2 +gydF4y2Ba信号参与植物的红光、蓝光、UV-B信号和生物钟[gydF4y2Ba21gydF4y2Ba].假设外源钙的施用会增加光合作用,果实变大,叶绿素参数增加。gydF4y2Ba
黄瓜是全球产量最大的蔬菜作物之一,是一种重要的经济蔬菜作物,对缺氧胁迫敏感。已有研究表明,外源腐胺和24-表油菜素内酯提高了盐下黄瓜的光合性能[gydF4y2Ba16gydF4y2Ba), Ca(没有gydF4y2Ba3.gydF4y2Ba)gydF4y2Ba2gydF4y2Ba压力(gydF4y2Ba22gydF4y2Ba),分别。快速叶绿素荧光动力学的应用实例也可以在柑橘中找到[gydF4y2Ba23gydF4y2Ba,玉米和番茄[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba24gydF4y2Ba].但目前尚无研究将缺氧胁迫下黄瓜光合特性的测定与叶绿素荧光相结合。因此,本研究的目的是阐明外源钙对低氧胁迫下黄瓜果实光合性能的改善和叶绿素荧光快速记录的影响。gydF4y2Ba
方法gydF4y2Ba
植物材料和生长条件gydF4y2Ba
黄瓜(gydF4y2BaCucumis巨大成功gydF4y2Bal .简历。锦春2号,缺氧敏感[gydF4y2Ba25gydF4y2Ba)播种于含石英砂的塑料托盘(41 × 41 × 5 cm)中,在25°C - 30°C(白天)和15°C - 18°C(夜间)的温室(32°02′N, 118°46′E,中国南京)自然光下培养(最大光合光子通量密度(PPFD)约1200 μmol mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba),相对湿度为70至85%。治疗包括[gydF4y2Ba8gydF4y2Ba: 1)控制:半强度Hoagland溶液(含2 mM钙)gydF4y2Ba2 +gydF4y2Ba溶解氧(DO)水平为8.0±0.2 mg LgydF4y2Ba−1gydF4y2Ba;2)缺氧处理:半强度Hoagland溶液(含2mm Ca)gydF4y2Ba2 +gydF4y2Ba), DO水平为1.0±0.1 mg LgydF4y2Ba−1gydF4y2Ba通过注入NgydF4y2Ba2gydF4y2Ba气体进入营养液;3)缺氧+ CaClgydF4y2Ba2gydF4y2Ba处理:半强度Hoagland溶液+ 4 mM CaClgydF4y2Ba2gydF4y2BaDO水平为1.0±0.1 mg LgydF4y2Ba−1gydF4y2Ba营养液中的氧浓度控制与缺氧处理时相同。用自动DO控制系统(Quantum-25, Quantum分析仪器公司,美国)监测营养液中的氧浓度。每个处理18株,3个重复,在黄瓜植株第二雌花坐果结束时开始试验处理。gydF4y2Ba
处理9 d后,采收对照和处理植株的嫩枝、根和果实,立即在液氮中冷冻,并在−80℃保存以备进一步分析。在植物被破坏性收获之前,测定了光合特性和叶绿素a荧光瞬态,如下图所示。gydF4y2Ba
黄瓜果实生物量和品质的测定gydF4y2Ba
用尺子、游标卡尺和电子秤分别测定株高、茎粗和果实重量。为了确定茎和根的新鲜重量,用蒸馏水清洗植物,擦干水分后称重。根据Bradford [gydF4y2Ba26gydF4y2Ba].水果CagydF4y2Ba2 +gydF4y2Ba按照制造商说明使用钙比色测定试剂盒(Bio Vision, Mountain View, CA, USA)测定含量[gydF4y2Ba8gydF4y2Ba].根据Kang等人的方法,测定黄瓜果实的总可溶性固形物含量(TSS,单位为°Brix)、可滴定酸度(TA,每100克新鲜物质的毫当量酸)和总可溶性糖。[gydF4y2Ba27gydF4y2Ba].gydF4y2Ba
气体交换参数的测量gydF4y2Ba
净光合速率(gydF4y2BaPgydF4y2BangydF4y2Ba)、气孔导度(gydF4y2BaggydF4y2Ba年代gydF4y2Ba),细胞间有限公司gydF4y2Ba2gydF4y2Ba浓度(gydF4y2BaCgydF4y2Ba我gydF4y2Ba)、蒸腾速率(gydF4y2BaTgydF4y2BargydF4y2Ba)用便携式光合作用系统(Li-6400;LI-COR, Inc., Lincoln, NE, USA)治疗9 d后上午10:30。在光合光子通量密度(PPFD)为1000 μmol光子m的条件下保持试管条件gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba相对湿度60-70%,叶温25℃,外源COgydF4y2Ba2gydF4y2Ba浓度380±10 μmol molgydF4y2Ba−1gydF4y2Ba.用水效率(WUE)计算为WUE =gydF4y2BaPgydF4y2BangydF4y2Ba/ TgydF4y2BargydF4y2Ba.gydF4y2Ba
叶绿素荧光分析gydF4y2Ba
利用成像- pam荧光计(Walz, Effeltrich, Germany)对黄瓜叶片进行叶绿素荧光成像。测量前将叶片置于黑暗中30分钟。PSII的最大量子产额(Fv/Fm)、PSII的实际光化学效率(ΦPSII)、光化学猝灭系数(qP)和非光化学猝灭系数(NPQ (=Fm/Fm’-1))根据Lu等的方法进行测量和计算。[gydF4y2Ba28gydF4y2Ba和袁等。[gydF4y2Ba16gydF4y2Ba].PAM软件选择每个叶片相同的区域作为荧光图像。gydF4y2Ba
叶绿素a荧光瞬态的测量gydF4y2Ba
根据Strasserf和Srivastava的方法,使用Handy植物效率分析仪(Handy- pea, Hansatech Instruments Ltd., Norfolk, UK)测量叶绿素a荧光(OJIP)瞬变。gydF4y2Ba29gydF4y2Ba].所有的测量都是在室温(22-25°C)下黑暗适应3小时的植物上进行的。瞬时荧光的诱导温度约为2000 μmol mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba由三个发光二极管阵列(峰值650纳米)提供的红光聚焦在叶片表面,在叶片的暴露区域(直径4毫米)上给予均匀的照明。在前300 μs,数据以10 μs的间隔采样,提供了优秀的时间分辨率gydF4y2BaFgydF4y2Ba0gydF4y2Ba和初始上升动力学。随着荧光信号动力学的减缓,数字化的时间分辨率切换到较慢的采集速率。gydF4y2Ba
根据jip试验公式对OJIP暂态进行分析[gydF4y2Ba23gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba].20 μs时的荧光强度(认为是荧光F0的最小值);当荧光强度足够高时,PSII的所有反应中心(RCs)都关闭;荧光强度分别为300 μs (F300 μs)、2 ms (J-step, FJ)和30 ms (I-step, FI) [gydF4y2Ba30.gydF4y2Ba].以下参数均与时间0(荧光诱导开始)有关:(a)吸收(ABS/RC)、捕获(TR)的比能量通量(每个反应中心,RC)gydF4y2BaogydF4y2Ba/RC),电子传递(ETgydF4y2BaogydF4y2Ba/RC)和天线叶绿素水平的耗散(DIgydF4y2BaogydF4y2Ba/RC)和(b) OJIP瞬态载流子或每个RC的总电子载流子上方的归一化总互补面积(Sm = EC .)gydF4y2Ba0gydF4y2Ba/ / RC =区域(FgydF4y2Ba米gydF4y2Ba- fgydF4y2Ba0gydF4y2Ba)).荧光瞬态的近似初始斜率gydF4y2BafgydF4y2Ba(t): MgydF4y2Ba0gydF4y2Ba= 4米gydF4y2BaogydF4y2Ba= 4•(fgydF4y2Ba300μsgydF4y2Ba- fgydF4y2Ba0gydF4y2Ba) / (FgydF4y2Ba米gydF4y2Ba- fgydF4y2BaogydF4y2Ba).吸收基础上的性能指标gydF4y2Ba(abs)gydF4y2Ba= (rc / abs)•[φp .gydF4y2BaogydF4y2Ba/(1 -φPgydF4y2BaogydF4y2Ba)][ψgydF4y2BaogydF4y2Ba/(1 -ψgydF4y2BaogydF4y2Ba)]。一次光化学的最大量子产率:φPgydF4y2BaogydF4y2Ba= FgydF4y2BavgydF4y2Ba/ FgydF4y2Ba米gydF4y2Ba= (FgydF4y2Ba米gydF4y2Ba- FgydF4y2BaogydF4y2Ba) / FgydF4y2Ba米gydF4y2Ba.gydF4y2Ba
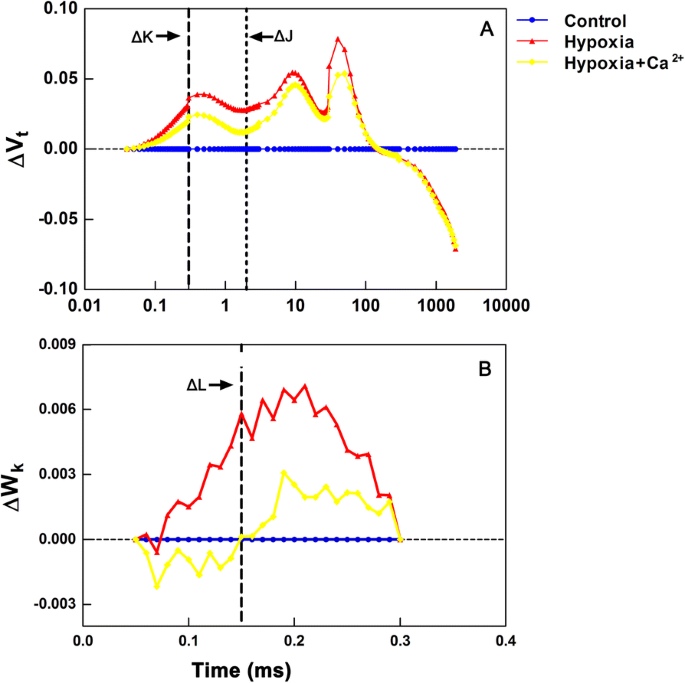
通过计算相对可变荧光V对OJIP瞬态进行了扩展分析gydF4y2BatgydF4y2Ba= (FgydF4y2BatgydF4y2Ba- FgydF4y2BaogydF4y2Ba) / (FgydF4y2Ba米gydF4y2Ba- FgydF4y2BaogydF4y2Ba), WgydF4y2BaKgydF4y2Ba= (FgydF4y2BatgydF4y2Ba- FgydF4y2BaogydF4y2Ba) / (FgydF4y2Ba300μsgydF4y2Ba- FgydF4y2BaogydF4y2Ba)以及处理样品与对照样品之间的差异。ΔL-, ΔK-和ΔJ-bands分别出现在130,300和2ms左右,并与PSII单元的解组、氧进化复合体(OEC)的解耦和Q的积累有关gydF4y2Ba一个gydF4y2Ba−gydF4y2Ba[gydF4y2Ba23gydF4y2Ba].gydF4y2Ba
统计分析gydF4y2Ba
用SAS软件(SAS Institute, Cary, NC, USA)对实验数据进行处理,采用Duncan多距离测试gydF4y2BapgydF4y2Ba< 0.05显著性水平。gydF4y2Ba
结果gydF4y2Ba
果实形态参数与品质gydF4y2Ba
低氧处理显著降低株高、茎粗、茎鲜重和根鲜重(gydF4y2BapgydF4y2Ba= 0.05),尤其是根鲜重(表gydF4y2Ba1gydF4y2Ba).株重、茎粗、茎鲜重和根鲜重为对照的18% ~ 49%。相反,外源钙减轻了缺氧胁迫引起的生长抑制,但外源钙对茎粗没有影响。gydF4y2Ba
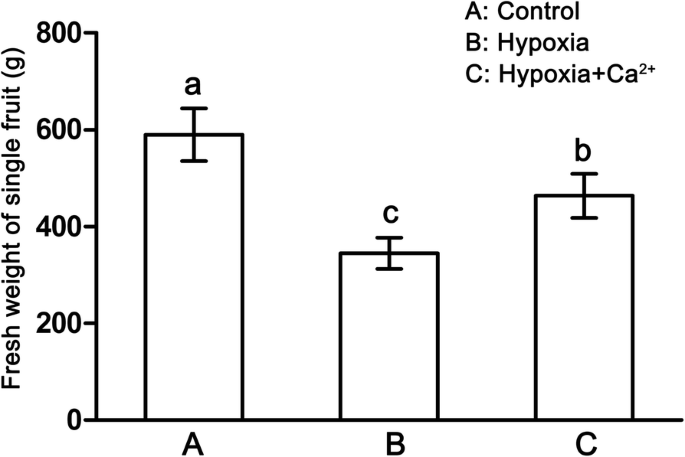
与对照处理相比,低氧处理对果实鲜重有抑制作用(gydF4y2BapgydF4y2Ba= 0.005),缺氧+ CaCl组较高gydF4y2Ba2gydF4y2Ba与低氧处理相比(图。gydF4y2Ba1gydF4y2Ba).虽然鲜重、总蛋白含量、钙含量均较低gydF4y2Ba2 +gydF4y2Ba果实中可溶性固形物含量下降,可溶性糖含量和可溶性固形物含量呈上升趋势gydF4y2Ba2gydF4y2Ba).可滴定酸度(TA)与对照处理相比无显著变化。经外源钙处理后,鲜重CagydF4y2Ba2 +gydF4y2Ba含量、可滴定酸度和可溶性糖浓度与低氧处理相比显著增加gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
气体交换参数gydF4y2Ba
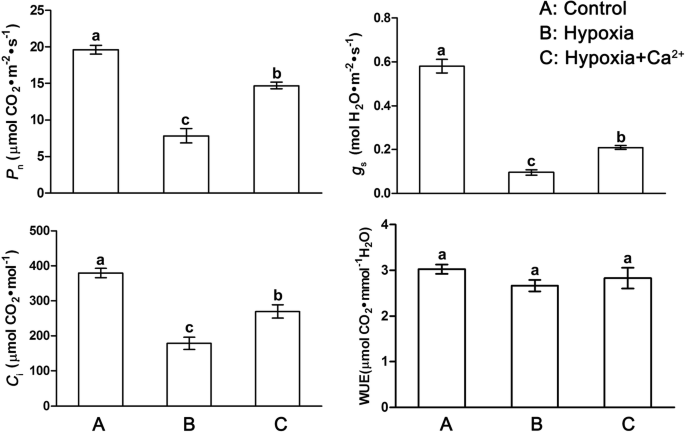
低氧压力减少gydF4y2BaPgydF4y2BangydF4y2Ba,gydF4y2BaggydF4y2Ba年代,gydF4y2Ba而且gydF4y2BaCgydF4y2Bai ~ 18 ~ 47%的对照水平(图。gydF4y2Ba2gydF4y2Ba).而外源性钙可显著减轻缺氧诱导的负性作用;这增加了gydF4y2BaPgydF4y2BangydF4y2Ba,gydF4y2BaggydF4y2Ba年代,gydF4y2Ba而且gydF4y2BaCgydF4y2Ba我gydF4y2Ba与低氧治疗相比,降低了51%到119%,但没有恢复到控制水平。WUE在不同处理间无显著差异。gydF4y2Ba
外源钙的作用gydF4y2Ba2 +gydF4y2Ba常氧条件下黄瓜叶片气体交换参数的研究(gydF4y2Ba一个gydF4y2Ba)、低氧治疗(gydF4y2BabgydF4y2Ba)和缺氧+钙gydF4y2Ba2 +gydF4y2Ba治疗(gydF4y2BacgydF4y2Ba).值为三个独立实验的平均值±标准差。根据邓肯多重距离检验,用不同字母标记的条形之间有显著差异(gydF4y2BapgydF4y2Ba< 0.05)。gydF4y2BaPgydF4y2BangydF4y2Ba,净光合速率;gydF4y2BaggydF4y2Ba年代gydF4y2Ba气孔导度;gydF4y2BaCgydF4y2Ba我gydF4y2Ba细胞间公司gydF4y2Ba2gydF4y2Ba浓度;WUE,水分利用效率gydF4y2Ba
叶绿素荧光gydF4y2Ba
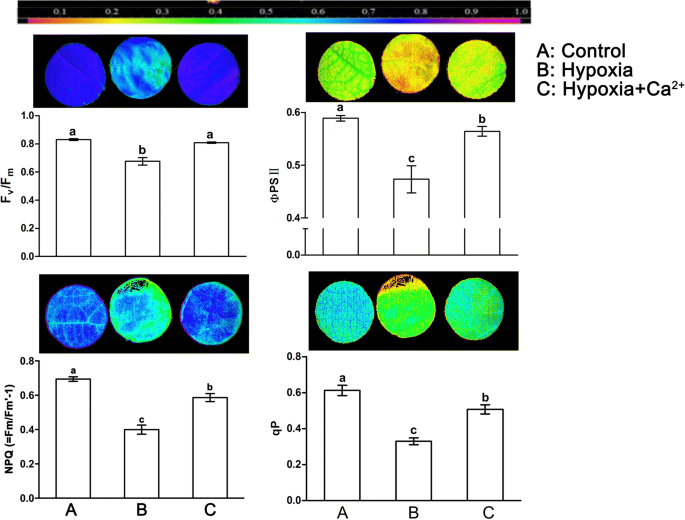
与对照组相比,低氧处理显著降低了Fv/Fm、ΦPSII、qP和NPQ (=Fm/Fm ' -1)。Fv/Fm、ΦPSII、qP和NPQ (=Fm/Fm ' -1)为对照水平的81.5 ~ 57.5%(图2)。gydF4y2Ba3.gydF4y2Ba).相反,与缺氧处理相比,外源性钙的应用提高了这些参数的水平(gydF4y2BapgydF4y2Ba= 0.05)。叶片的伪彩色图像分别反映了四个参数在不同处理下的状态(图1)。gydF4y2Ba3.gydF4y2Ba).叶片表面Fv/Fm、ΦPSII、qP和NPQ (=Fm/Fm ' -1)在缺氧条件下下降不均匀。矿脉附近的Fv/Fm和NPQ (=Fm/Fm ' -1)较对照显著降低。外源钙处理能使叶片颜色恢复到与对照相近的水平。gydF4y2Ba
外源钙的作用gydF4y2Ba2 +gydF4y2Ba常氧条件下黄瓜叶片叶绿素荧光参数及图像的研究(gydF4y2Ba一个gydF4y2Ba)、低氧治疗(gydF4y2BabgydF4y2Ba)和缺氧+钙gydF4y2Ba2 +gydF4y2Ba治疗(gydF4y2BacgydF4y2Ba).值为三个独立实验的平均值±标准差。根据邓肯多重距离检验,用不同字母标记的条形之间有显著差异(gydF4y2BapgydF4y2Ba< 0.05)。Fv/Fm, ΦPSII, qP和NPQ (=Fm/Fm ' -1)在450 μmol光子m光化照明下的图像gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba所示。PSII的最大量子产额Fv/Fm;ΦPSII, PSII实际光化学效率;qP:光化学猝灭系数;NPQ (=Fm/Fm ' -1),非光化学猝灭系数。同一列中的每个图像表示同一叶。顶部的颜色刻度表示从0(黑色)到1(粉色)的值gydF4y2Ba
叶片叶绿素a荧光(OJPI)瞬变及其相关参数gydF4y2Ba
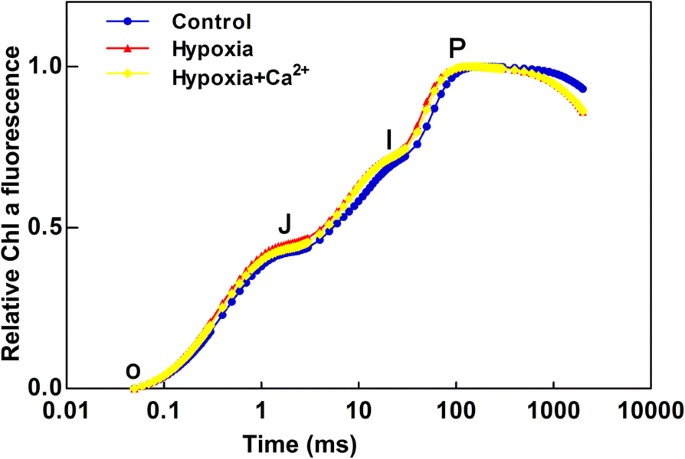
所有处理均表现出典型的OJIP多相增加,包括O、J、I和P相(图1)。gydF4y2Ba4gydF4y2Ba).低氧应激诱导OJIP在j阶和i阶上升,p阶显著下降。gydF4y2Ba
OJIP瞬态过程如图所示。gydF4y2Ba5gydF4y2Ba而且gydF4y2BabgydF4y2Ba显示不同的荧光曲线ΔVgydF4y2BatgydF4y2Ba和WΔgydF4y2BakgydF4y2Ba,分别。有三个明显的趋势:i) ΔK-band (300 μs)的增加,ii) ΔJ-band (2 ms)的增加,iii) ΔI-band (30 ms)的增加。gydF4y2Ba5gydF4y2Ba).与外源钙处理叶片相比,缺氧胁迫叶片中ΔK-band、ΔJ-band和ΔI-band的阳性表达更为明显。与外源钙处理的叶片相比,在缺氧的叶片中有明显的ΔL-band(图1)。gydF4y2Ba5 bgydF4y2Ba).gydF4y2Ba
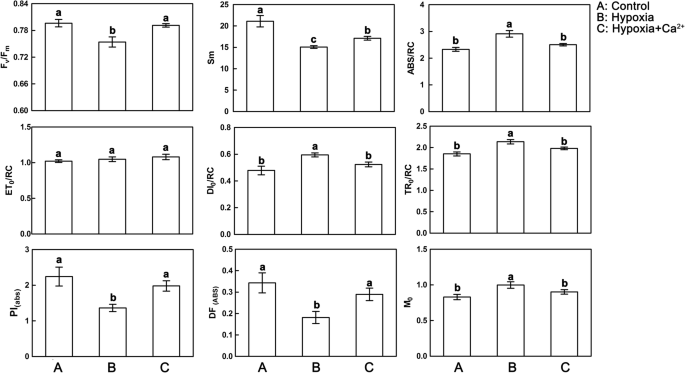
与对照相比,缺氧胁迫叶片的每RC (DI)耗散能量显著增加gydF4y2Ba0gydF4y2Ba/RC),每RC捕获能量通量(TRgydF4y2Ba0gydF4y2Ba/RC),以及每个RC的吸收通量(ABS/RC)(图gydF4y2Ba6gydF4y2Ba).低氧胁迫也降低了每个反应中心的总电子载流子(SgydF4y2Ba米gydF4y2Ba),表明超过Q的电子输运概率gydF4y2Ba一个gydF4y2Ba−gydF4y2Ba减少(无花果。gydF4y2Ba6gydF4y2Ba).这种条件最终导致Q的最大还原速度增加gydF4y2Ba一个gydF4y2Ba−gydF4y2Ba(MgydF4y2Ba0gydF4y2Ba),降低了每RC (DIgydF4y2Ba0gydF4y2Ba/RC)、PSII一次光化学的最大产率(Fv/Fm)、吸收基础性能指标(PIgydF4y2Ba腹肌gydF4y2Ba).在施加外源性钙后,这些性能参数恢复到控制水平(图1)。gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
外源钙的作用gydF4y2Ba2 +gydF4y2Ba常氧条件下黄瓜叶片jip试验参数的影响(gydF4y2Ba一个gydF4y2Ba)、低氧治疗(gydF4y2BabgydF4y2Ba)和缺氧+钙gydF4y2Ba2 +gydF4y2Ba治疗(gydF4y2BacgydF4y2Ba).值为三个独立实验的平均值±标准差。根据邓肯多重距离检验,用不同字母标记的条形之间有显著差异(gydF4y2BapgydF4y2Ba< 0.05)。PSII的最大量子产额Fv/Fm;Sm:每RC的总电子载流子;ABS/RC,用于吸收的比能量通量(每个反应中心,RC);等gydF4y2BaogydF4y2Ba/RC,电子传输的比能量通量(每个反应中心,RC);迪gydF4y2BaogydF4y2Ba/RC,天线叶绿素水平的耗散;TRgydF4y2BaogydF4y2Ba/RC:捕获的比能量通量(每个反应中心,RC)。吸收基础上的性能指标gydF4y2Ba(abs)gydF4y2Ba= (rc / abs)•[φp .gydF4y2BaogydF4y2Ba/(1 -φPgydF4y2BaogydF4y2Ba)][ψgydF4y2BaogydF4y2Ba/(1 -ψgydF4y2BaogydF4y2Ba));荧光瞬态的近似初始斜率gydF4y2BafgydF4y2Ba(t): MgydF4y2Ba0gydF4y2Ba= 4米gydF4y2BaogydF4y2Ba= 4•(fgydF4y2Ba300μsgydF4y2Ba- fgydF4y2Ba0gydF4y2Ba) / (FgydF4y2Ba米gydF4y2Ba- fgydF4y2BaogydF4y2Ba)gydF4y2Ba
讨论gydF4y2Ba
分子氧参与植物的多种生物化学反应。也有大量文献表明,植物可能会降低其生长、产量和光合作用效率,以作为应对各种胁迫的一种规避策略[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba31gydF4y2Ba].因此,研究黄瓜果实期植株对缺氧胁迫的响应,有助于我们了解黄瓜耐缺氧的机制。在本研究中,低氧胁迫显著抑制了黄瓜植株的生长和光合作用gydF4y2Ba1gydF4y2Ba,无花果。gydF4y2Ba2gydF4y2Ba)和降低黄瓜果实鲜重(图。gydF4y2Ba1gydF4y2Ba).外源钙增强了缺氧胁迫黄瓜的生长、光合作用和果实品质。gydF4y2Ba
人们普遍认为,缺氧会抑制韧皮部运输;这可能是由于组织中能量的剥夺导致糖输入或重新加载到韧皮部的减少[gydF4y2Ba32gydF4y2Ba].康等人。[gydF4y2Ba27gydF4y2Ba]的研究发现,在低氧胁迫下,黄瓜叶片的可溶性和淀粉含量显著增加,因为糖从叶片到根系的运输减少。我们之前的研究也发现根区缺氧胁迫降低了植物的生物量和叶片的可溶性蛋白[gydF4y2Ba33gydF4y2Ba].在本研究中,我们在黄瓜果实中也得到了类似的结果。缺氧使可溶性蛋白和钙含量降低gydF4y2Ba2 +gydF4y2Ba但增加了可溶性固形物和总可溶性糖的含量gydF4y2Ba2gydF4y2Ba).额外的Ca后gydF4y2Ba2 +gydF4y2Ba上述指标均接近对照水平,说明外源CagydF4y2Ba2 +gydF4y2Ba可缓解黄瓜植株的缺氧胁迫。gydF4y2Ba
降低公司gydF4y2Ba2gydF4y2Ba同化是胁迫条件下的一种常见反应,它是气孔关闭的结果,对光合作用装置造成进一步的损害。在这项工作中,缺氧引起的减少gydF4y2BaPgydF4y2BangydF4y2Ba,gydF4y2BaggydF4y2Ba年代gydF4y2Ba,gydF4y2BaCgydF4y2Ba我gydF4y2Ba在黄瓜植物中(图。gydF4y2Ba2gydF4y2Ba).同时减少gydF4y2BaggydF4y2Ba年代gydF4y2Ba而且gydF4y2BaCgydF4y2Ba我gydF4y2Ba表明气孔关闭通过限制对CO的获取来限制光合作用gydF4y2Ba2gydF4y2Ba在叶子上。相反,外源性钙引起的gydF4y2BaPgydF4y2BangydF4y2Ba,gydF4y2BaggydF4y2Ba年代gydF4y2Ba,gydF4y2BaCgydF4y2Ba我gydF4y2Ba(无花果。gydF4y2Ba2gydF4y2Ba).在低氧胁迫下,外源钙通过增强叶片碳同化能力和调节气孔运动来提高光合能力。gydF4y2Ba
在叶片研究中,自然会扩展叶绿素荧光数据的解释,以分析其对CO光合速率的影响gydF4y2Ba2gydF4y2Ba同化(gydF4y2Ba18gydF4y2Ba].叶绿素荧光成像作为筛查和诊断工具越来越受欢迎[gydF4y2Ba34gydF4y2Ba],可以加深我们对由气孔的斑块反应和分布代谢调节引起的光合异质性的理解[gydF4y2Ba35gydF4y2Ba].该方法还克服了传统的基于点测的叶绿素荧光分析的缺点。与其他非生物胁迫一样,低氧胁迫对叶片整体造成损伤,进而降低叶片损伤区域的光合能力。为了量化胁迫黄瓜叶片在暗适应和光适应条件下的光合能力,我们分别测量了Fv/Fm和ΦPSII [gydF4y2Ba35gydF4y2Ba].我们的结果表明,在低氧处理下,Fv/Fm和ΦPSII降低了(图1)。gydF4y2Ba3.gydF4y2Ba),表明从初级受体质体醌(QgydF4y2Ba一个gydF4y2Ba)到次级受体质体醌(QgydF4y2BaBgydF4y2Ba)在压力条件下PSII的受体侧被阻塞[gydF4y2Ba36gydF4y2Ba].而外源钙在胁迫条件下显著提高了Fv/Fm和ΦPSII,说明外源钙缓解了胁迫黄瓜植株的光抑制作用,提高了植株的光化学效率[gydF4y2Ba37gydF4y2Ba].此外,外源钙处理还提高了缺氧植物的非光化学猝灭系数(NPQ (=Fm/Fm ' -1))和光化学猝灭系数(qP)。这一结果进一步表明,外源钙可以通过调节散热途径的容量来缓解对黄瓜光化学效率的抑制,从而减少缺氧胁迫对黄瓜植株光合能力的负面影响[gydF4y2Ba38gydF4y2Ba].gydF4y2Ba
为了了解不同环境应力对光合作用的影响,快速叶绿素a荧光的测量和分析是一种有用和有效的方法,可用于评估对PSII光化学的许多外部或内在不利影响[gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba,尽管OJIP测试仍然是一个有争议的解释。典型的多相瞬态在低氧应力下发生了变化。gydF4y2Ba4gydF4y2Ba)和正面的ΔK-bands, ΔJ-bands和ΔI-bands在照明后出现(图。gydF4y2Ba5gydF4y2Ba).既往研究表明,ΔK-bands和ΔJ-bands与OEC的解耦和Q的积累有关gydF4y2Ba一个gydF4y2Ba−gydF4y2Ba(即抑制Q的再氧化gydF4y2Ba一个gydF4y2Ba−gydF4y2Ba),分别gydF4y2Ba24gydF4y2Ba].OEC的效率(FgydF4y2BavgydF4y2Ba/ FgydF4y2Ba0gydF4y2Ba)是光合作用电子传递中最敏感的成分[gydF4y2Ba39gydF4y2Ba].胁迫植物的荧光瞬态中出现阳性ΔK-bands可能表明在缺氧条件下OEC受到破坏,光合单元之间的能量连通性被改变[gydF4y2Ba41gydF4y2Ba].外源钙处理叶片的ΔK-bands阳性不如缺氧胁迫叶片的明显,这可能表明前者对OEC的损伤小于后者。积极的ΔI-bands(图。gydF4y2Ba5gydF4y2Ba)低氧应激可能提示低氧对PSII受体侧的破坏比PSII供体侧的破坏更严重;根据以往的研究,受体侧的失活可能预示着电子传递的破坏[gydF4y2Ba42gydF4y2Ba].基于分组概念和jit检验[gydF4y2Ba40gydF4y2Ba],缺氧诱导阳性ΔI-bands(图。gydF4y2Ba5 bgydF4y2Ba)意味着PSII单元被破坏成更少的分组,那么在PSII单元内部或之间传输的电子和能量就更少了。由于PSII的成组构象比非成组构象更稳定,低氧胁迫导致的成组减少表明胁迫黄瓜叶片中PSII单元的稳定性已经丧失,PSII单元变得更加脆弱。如图所示。gydF4y2Ba5gydF4y2Ba,我们的研究支持在低氧处理下OJIP试验的异质性增加。gydF4y2Ba
在本研究中,在缺氧胁迫植物中观察到活性RC的降低(估计为ABS/RC的增加)(图1)。gydF4y2Ba6gydF4y2Ba).RCs失活率或天线表观尺寸的增大都会导致该参数的减小。非活性RCs的积累与作为热的吸收光耗散效率(DIgydF4y2Ba0gydF4y2Ba/ RC)(图。gydF4y2Ba6gydF4y2Ba),表明非光化学脱激发过程水平较高。为了保护叶片免受光氧化损伤,植物将吸收的多余光能转化为热量。总性能指数(PIgydF4y2Ba(abs)gydF4y2Ba),低氧胁迫叶片Sm和DF均降低gydF4y2Ba(ABS)gydF4y2Ba,增加了TRgydF4y2Ba0gydF4y2Ba/RC和ABS/RC,以及受损的光化学和非光化学氧化还原反应(图5)。gydF4y2Ba6gydF4y2Ba).外源钙降低了TR值gydF4y2Ba0gydF4y2Ba/RC、ABS/RC、DIgydF4y2Ba0gydF4y2Ba/RC控制水平,说明外源钙增强了胁迫叶片的电子传递能力,从而缓解了缺氧介导的黄瓜叶片损伤。gydF4y2Ba
结论gydF4y2Ba
低氧胁迫可能会从PSII的供体侧损害光合电子传递链,直至PSI的末端受体的还原,从而限制还原当量的产生和CO的速率gydF4y2Ba2gydF4y2Ba同化。外源钙增强了黄瓜叶片的电子传递能力,减轻了叶片缺氧损伤。我们还需要进一步的研究,以了解钙剂量是什么机制导致这一切。gydF4y2Ba
缩写gydF4y2Ba
- ABS / RC:gydF4y2Ba
-
每RC吸收通量gydF4y2Ba
- CgydF4y2Ba我gydF4y2Ba:gydF4y2Ba
-
细胞间有限公司gydF4y2Ba2gydF4y2Ba浓度gydF4y2Ba
- 迪gydF4y2BaogydF4y2Ba/ RC:gydF4y2Ba
-
每RC的耗散能量通量gydF4y2BatgydF4y2Ba= 0gydF4y2Ba
- 做的事:gydF4y2Ba
-
溶解氧gydF4y2Ba
- 等gydF4y2BaogydF4y2Ba/ RC:gydF4y2Ba
-
t = 0时每RC的电子输运通量gydF4y2Ba
- FgydF4y2Ba0gydF4y2Ba:gydF4y2Ba
-
当所有PSII RCs都打开时,荧光最小gydF4y2Ba
- FgydF4y2Ba300μsgydF4y2Ba:gydF4y2Ba
-
荧光强度在300 μs时gydF4y2Ba
- FgydF4y2Ba我gydF4y2Ba:gydF4y2Ba
-
i阶跃处的荧光强度(30 ms)gydF4y2Ba
- FgydF4y2BaJgydF4y2Ba:gydF4y2Ba
-
j阶跃处的荧光强度(2 ms)gydF4y2Ba
- FgydF4y2Ba米gydF4y2Ba:gydF4y2Ba
-
最大荧光,当所有PSII RCs关闭gydF4y2Ba
- 阵线/ Fm:gydF4y2Ba
-
PSII的最大量子产额gydF4y2Ba
- ggydF4y2Ba年代gydF4y2Ba:gydF4y2Ba
-
气孔导度gydF4y2Ba
- NPQ (= Fm / Fm”1):gydF4y2Ba
-
Non-photochemical猝灭系数gydF4y2Ba
- 描述:gydF4y2Ba
-
Oxygen-evolving复杂gydF4y2Ba
- PI:gydF4y2Ba
-
性能指标gydF4y2Ba
- πgydF4y2Ba(abs)gydF4y2Ba:gydF4y2Ba
-
吸收基础上的性能指数(PI)gydF4y2Ba
- PgydF4y2BangydF4y2Ba:gydF4y2Ba
-
净光合速率gydF4y2Ba
- PPFD:gydF4y2Ba
-
光子通量密度gydF4y2Ba
- PSI:gydF4y2Ba
-
光系统IgydF4y2Ba
- PSII:gydF4y2Ba
-
光系统IIgydF4y2Ba
- 问gydF4y2Ba一个gydF4y2Ba:gydF4y2Ba
-
主要醌受体gydF4y2Ba
- 问gydF4y2BaBgydF4y2Ba:gydF4y2Ba
-
辅助受体质体醌gydF4y2Ba
- 表示为:gydF4y2Ba
-
光化学猝灭系数gydF4y2Ba
- RC:gydF4y2Ba
-
PSII反应中心gydF4y2Ba
- RH:gydF4y2Ba
-
相对湿度gydF4y2Ba
- ROS:gydF4y2Ba
-
活性氧gydF4y2Ba
- Sm:gydF4y2Ba
-
归一化全补在OJIP之上gydF4y2Ba
- TgydF4y2BargydF4y2Ba:gydF4y2Ba
-
蒸腾速率gydF4y2Ba
- TRgydF4y2BaogydF4y2Ba/ RC:gydF4y2Ba
-
每RC的捕获能量通量gydF4y2BatgydF4y2Ba= 0gydF4y2Ba
- VgydF4y2BatgydF4y2Ba:gydF4y2Ba
-
t时刻的相对可变荧光gydF4y2Ba
- WUE:gydF4y2Ba
-
水分利用效率gydF4y2Ba
- φPgydF4y2BaogydF4y2Ba:gydF4y2Ba
-
t = 0时初级光化学的最大量子产率gydF4y2Ba
- ΦPSII:gydF4y2Ba
-
PSII的实际光化学效率gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
Paul MV, Iyer S, Amerhauser C, Lehmann M, van Dongen JT, Geigenberger P.氧感通过乙烯响应转录因子RAP2.12影响植物在常氧和低氧条件下的代谢和性能。植物杂志。2016;172(1):141 - 53年。gydF4y2Ba
- 2.gydF4y2Ba
植物植物毒性耐受性的生理和细胞方面:膜转运蛋白的作用及其对作物耐涝育种的意义。新植醇。2011;190(2):289 - 98。gydF4y2Ba
- 3.gydF4y2Ba
Shahzad Z, Canut M, tournir - roux C, Martinière A, Boursiac Y, Loudet O, Maurel C.钾依赖性氧敏感通路调节植物根系水力学。细胞。2016;167 (1):87 - 98. - e14灯头。gydF4y2Ba
- 4.gydF4y2Ba
杨春春,徐春峰,李建平,王乃宁,史春春。拟南芥AP2/ERF转录因子AtERF73/HRE1在低氧条件下对乙烯的调控作用。植物杂志。2011;156(1):202 - 12所示。gydF4y2Ba
- 5.gydF4y2Ba
Pedersen O, Rich SM, Colmer TD。幸存的洪水。叶片气膜改善OgydF4y2Ba2gydF4y2Ba和有限公司gydF4y2Ba2gydF4y2Ba交换,根系曝气,完全淹水水稻生长。植物j . 2009; 58(1): 147 - 56。gydF4y2Ba
- 6.gydF4y2Ba
王晓燕,王晓燕,王晓燕,等。植物根系对缺氧和土壤水淹的适应性响应。植物细胞环境学报,2014;37(10):2216-33。gydF4y2Ba
- 7.gydF4y2Ba
王峰,陈志华,刘旭,Colmer TD,周明,Shabala S.组织特异性根离子谱分析揭示了拟南芥CAX和ACA钙转运系统在应对缺氧中的重要作用。科学通报2016;67(12):3747-62。gydF4y2Ba
- 8.gydF4y2Ba
何亮,李斌,陆霞,袁亮,杨莹,袁莹,杜娟,郭松。外源钙对缺氧条件下黄瓜根系线粒体、呼吸代谢酶及离子转运的影响。Sci众议员2015;5:11391。gydF4y2Ba
- 9.gydF4y2Ba
朱旭,邓南德C,斯奈登W,盖劳德JP。CaM和CML在绿色谱系中出现。植物学报,2015;20(8):483-9。gydF4y2Ba
- 10.gydF4y2Ba
何亮,陆霞,田娟,杨艳,李波,李娟,郭松。外源钙对黄瓜根系缺氧响应蛋白影响的蛋白质组学分析。蛋白质组Sci。2012;10(1):42。gydF4y2Ba
- 11.gydF4y2Ba
Yemelyanov VV, Shishova MF, Chirkova TV, Lindberg SM。缺氧诱导的胞质Ca2+浓度升高取决于不同的钙gydF4y2Ba2 +gydF4y2Ba来源于水稻和小麦原生质体。足底。2011;234(2):271。gydF4y2Ba
- 12.gydF4y2Ba
玉米对淹水胁迫的分子和细胞适应。安机器人。2003;91(2):119 - 27所示。gydF4y2Ba
- 13.gydF4y2Ba
王亚丽,张晓峰,王锐,白亚烨,刘春玲,袁亚波,杨玉军,杨少林。辣椒品种差异基因表达分析(gydF4y2Bapyrus bretschneiderigydF4y2Ba)果皮采用两种套袋处理。园艺研究。2017;4:17005。gydF4y2Ba
- 14.gydF4y2Ba
Rochaix JD。光合作用装置的集合植物杂志。2011;155(4):1493 - 500。gydF4y2Ba
- 15.gydF4y2Ba
金辉,刘斌,罗玲,冯东,王萍,刘俊,大强,何莹,齐凯,王俊。拟南芥高光敏感基因1与光合系统II1的低量子产率互作,并在保护光合系统II的光损伤中发挥作用。植物细胞,2014,26(3):1213 - 29。gydF4y2Ba
- 16.gydF4y2Ba
袁颖,舒珊,李松,何亮,李红,杜宁,孙杰,郭珊。外源腐胺对黄瓜叶绿素荧光成像及散热能力的影响(gydF4y2BaCucumis巨大成功gydF4y2BaL.)盐胁迫下。植物生长学报,2014;33(4):798-808。gydF4y2Ba
- 17.gydF4y2Ba
布雷斯蒂克M,兹夫卡克M,卡拉吉HM,卡彭迪埃R,阿拉赫维耶夫SI。光系统II的原位热稳定性:环境诱导的驯化和基因型特异性反应gydF4y2Ba小麦gydF4y2Ba植物生理与生物化学,2012;57:93-105。gydF4y2Ba
- 18.gydF4y2Ba
曲超,刘超,龚鑫,李超,洪敏,王磊,洪峰。缺钾和盐胁迫联合对玉米幼苗光合作用的影响。environmental Exp Bot. 2012; 75:134-41。gydF4y2Ba
- 19.gydF4y2Ba
叶绿素荧光分析:一个好的实践指南和理解一些新的应用。中国生物医学工程学报,2013;32(5):369 - 369。gydF4y2Ba
- 20.gydF4y2Ba
Stirbet Govindjee。Kautsky效应(叶绿素a荧光诱导)与光系统II的关系:OJIP荧光瞬变的基础与应用。中国生物医学工程学报。2011;29(1 - 6):447 - 447。gydF4y2Ba
- 21.gydF4y2Ba
多德安,库德拉J,桑德斯D.钙信号语言。植物生物学,2010;61:593-620。gydF4y2Ba
- 22.gydF4y2Ba
袁亮,舒珊,孙娟,郭珊,手香。24-表油菜素内酯对黄花苜蓿光合特性、抗氧化系统及叶绿体超微结构的影响gydF4y2BaCucumis巨大成功gydF4y2Bal . ca(没有gydF4y2Ba3.gydF4y2Ba)gydF4y2Ba2gydF4y2Ba压力。Photosynth杂志2012;112(3):205 - 14所示。gydF4y2Ba
- 23.gydF4y2Ba
李强,陈立龙,蒋海霞,唐宁,杨亮,林志华,李勇,杨红华。锰过量对CO的影响gydF4y2Ba2gydF4y2Ba柑橘幼苗的同化、核酮糖-1,5-二磷酸羧化酶/加氧酶、叶片的碳水化合物和光合电子运输以及叶片和根系的抗氧化系统。植物生物学杂志,2010;10(1):42。gydF4y2Ba
- 24.gydF4y2Ba
Smit MF, van Heerden PDR, Pienaar JJ, Weissflog L, Strasser RJ, Krüger GHJ。氟化烃类持久性降解产物三氟乙酸酯对菜豆和玉米的影响。植物生理与生物化学。2009;47(7):623-34。gydF4y2Ba
- 25.gydF4y2Ba
马勇,郭松。13个黄瓜品种耐缺氧能力的研究。江苏农业科学2004;5:68-70。gydF4y2Ba
- 26.gydF4y2Ba
利用蛋白质与染料结合的原理,对蛋白质的微克量进行定量的一种快速而灵敏的方法。学生物化学肛门。1976;72(1):248 - 54。gydF4y2Ba
- 27.gydF4y2Ba
康云云,郭荣荣,李娟,段俊杰。根施24-表油菜素内酯对黄瓜碳水化合物状况和发酵酶活性的影响(gydF4y2BaCucumis巨大成功gydF4y2BaL.)缺氧下的幼苗。植物生长学报2009;57(3):259-69。gydF4y2Ba
- 28.gydF4y2Ba
陆超,邱宁,王斌,张杰。盐胁迫处理对盐生植物碱蓬光系统II光化学没有影响,但增加了光系统II对热胁迫的抗性。中国生物医学工程学报2003;54(383):851-60。gydF4y2Ba
- 29.gydF4y2Ba
多相叶绿素是植物和蓝藻中的瞬态荧光。Photochem Photobiol。1995;61(1):32-42。gydF4y2Ba
- 30.gydF4y2Ba
韩松,唐宁,蒋海霞,杨莱特,李勇,陈林生。有限公司gydF4y2Ba2gydF4y2Ba同化、光系统II光化学、碳水化合物代谢和抗氧化系统对硼胁迫的响应。植物科学。2009;176(1):143 - 53年。gydF4y2Ba
- 31.gydF4y2Ba
罗林斯JA, Habte E, Templer SE, Colby T, Schmidt J, von Korff M.大麦叶片蛋白质组在干旱和热胁迫生理和形态响应背景下的变化(gydF4y2Ba大麦芽gydF4y2Bal .)。中国科学(d辑:自然科学版)2013;gydF4y2Ba
- 32.gydF4y2Ba
van Dongen JT, Schurr U, Pfister M,韧皮部代谢GP。机能必须应付体内低氧。植物杂志。2003;131(4):1529 - 43。gydF4y2Ba
- 33.gydF4y2Ba
何亮,郭松,陆霞,王玲,杨颖。钙对低温胁迫下黄瓜幼苗可溶性蛋白表达的影响。南京农业大学学报,2012;35:21-5。gydF4y2Ba
- 34.gydF4y2Ba
王晓东,王晓东,王晓东,等。叶绿素荧光成像技术在园艺研究中的应用。Sci Hortic。2012;138:24-35。gydF4y2Ba
- 35.gydF4y2Ba
陈晓明,陈晓明,陈晓明,陈晓明,等。冰川融化过程中南极底冰藻类对光和盐度响应的叶绿素荧光成像分析。中华兽医学报(英文版)2011;gydF4y2Ba
- 36.gydF4y2Ba
Mehta P, Jajoo A, Mathur S, Bharti S.叶绿素荧光研究揭示高盐胁迫对小麦叶片光系统II的影响。植物生理与生物化学。2010;48(1):16-20。gydF4y2Ba
- 37.gydF4y2Ba
杨晓燕,王晓燕,王晓燕,等。不同盐度和温度下28-高油菜素内酯对豇豆光合作用、荧光和抗氧化系统的影响。环境科学学报,2010;29(2):359 - 361。gydF4y2Ba
- 38.gydF4y2Ba
舒珊,唐莹,袁莹,孙娟,钟明,郭松。24-表油菜素内酯在低温和弱光联合胁迫下番茄幼苗光合特性和氮代谢调控中的作用。植物生理生物化学,2016;107:344-53。gydF4y2Ba
- 39.gydF4y2Ba
Bhattacharyya D, Gnanasekaran P, Kumar RK, Kushwaha NK, Sharma VK, Yusuf MA, Chakraborty S.双病毒卫星破坏叶绿体结构和功能的完整性,导致症状的形成和光合作用的抑制。中国生物医学工程学报(英文版);2015;gydF4y2Ba
- 40.gydF4y2Ba
王晓燕,王晓燕,王晓燕,等。叶绿素a荧光瞬态分析。In:叶绿素a荧光:光合作用的标志。编辑:Papageorgiou GC, Govindjee。荷兰多德雷赫特:施普林格;2004: 321 - 362。gydF4y2Ba
- 41.gydF4y2Ba
斯利瓦斯塔瓦A, Guissé B,格里平H,斯特拉瑟RJ。用快速多相叶绿素a荧光瞬态探针研究高温下豌豆光系统II中天线结构和电子输运的调控。生物化学与生物物理学报(BBA) -生物能量学。1997;1320(1):95-106。gydF4y2Ba
- 42.gydF4y2Ba
阿罗,麦卡弗里,安德森,JM。豌豆在不同生长光照下的光抑制和D1蛋白降解植物杂志。1993;103(3):835 - 43。gydF4y2Ba
致谢gydF4y2Ba
感谢Edanz集团中国Liwen Bianji的Emma Tacken博士(gydF4y2Bahttp://www.liwenbianji.cn/acgydF4y2Ba),以编辑本手稿草稿的英文文本。gydF4y2Ba
资金gydF4y2Ba
国家自然科学基金项目(31401919,31471869)和上海市科委重点项目(14DZ2282100)资助。上海市农业应用技术发展计划项目(No.;G2014070201)和上海市农业系统青年人才计划(沪农青字2016-1-10号),为参与项目的学生和研究人员提供全部或部分的工资和材料。作者声明,该研究是在不存在任何可能被解释为潜在利益冲突的商业或金融关系的情况下进行的。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
在本研究过程中生成和分析的数据集可根据合理要求从通讯作者处获得。gydF4y2Ba
植物材料“锦春2号”种子购自天津仁黄瓜研究所(天津)。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
构思和设计实验:SG。进行实验:LH, LY数据分析:LH。贡献试剂/材料/分析工具:BL, ND。写论文:LH。所有作者都已阅读并认可最终版本的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明他们没有竞争利益。gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格自然对出版的地图和机构附属的管辖权要求保持中立。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文根据创作共用署名4.0国际许可协议发布(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),该协议允许在任何媒体上不受限制地使用、分发和复制,前提是您适当地注明原作者和来源,提供创作共用许可的链接,并说明是否有更改。创作共用公共领域奉献放弃书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)除另有说明外,适用于本条提供的资料。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
He, L, Yu, L, Li, B。gydF4y2Baet al。gydF4y2Ba缺氧胁迫下外源钙对黄瓜果实品质、光合作用、叶绿素荧光和快速叶绿素荧光的影响gydF4y2BaBMC植物杂志gydF4y2Ba18,gydF4y2Ba180(2018)。https://doi.org/10.1186/s12870-018-1393-3gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-018-1393-3gydF4y2Ba
关键字gydF4y2Ba
- 黄瓜gydF4y2Ba
- 外源钙gydF4y2Ba
- 低氧压力gydF4y2Ba
- 光合作用gydF4y2Ba
- 叶绿素荧光gydF4y2Ba
- 快速叶绿素荧光gydF4y2Ba