抽象的
背景
Chrysanthemum是中国十大传统花卉之一,以及世界上四大切花之一,但菊花的生长受到延缓生长和鲜花缺陷的高温受到严重限制。DREB(脱水响应元素结合)转录因子在对非生物和生物应激的反应中起重要作用。然而,DREB A-6群是否参与了耐热性尚未最后报告。
结果
在本研究中,CmDREB6是由菊花(菊花)“Jinba”。CmDREB6包含一个典型的AP2/ERF结构域,被归为DREB a -6亚群,与DREB a -6同源性最高Cichorium intybuslCiDREB6(73%)。CmDREB6在叶片中以最高水平表达。CmDREB6蛋白定位于细胞核。基于酵母杂交试验,CmDREB6在酵母中表现出转录激活活性,及转录激活结构域定位于3“末端的范围从230至289个氨基酸残基。CmDREB6过度表达增强了菊花的耐热性。两种转基因株系的成活率分别高达85%和50%,而野生型(WT)的成活率为3.8%。表达的CmDREB6促进了表达CmHsfA4,CmHSP90,和活性氧清除基因CMSOD.和CmCAT.
结论
在本研究中,DREB A-6亚群基因CmDREB6被菊花'金巴'克隆。过度的CmDREB6通过调控热激反应和ROS同源性增强菊花的耐热性。
背景
植物面临各种非生物胁迫,其中热应激已成为影响作物生长,质量和产量的主要因素之一。高温妨碍植物光合作用,导致细胞膜损伤,细胞衰老和死亡[1].热应激还会影响酶的活性,进而对植物的生长和代谢产生负面影响。
植物和其他生物都一个固有的生存能力暴露在温度高于最优增长(基底耐热性)和获得宽容否则致命的热应力的能力(获得耐热性),在获得公差取决于许多转录因子的激活(2].DREB转录因子属于AP2/EREBP转录因子家族的一个亚家族,其保守的AP2/EREBP(乙烯响应元件结合蛋白)结构域在DREB转录因子与DREB顺式作用元件的结合中起关键作用。DREB组分为6个亚组(A-1 ~ A-6),其中A-1和A-2亚组分别含有dreb1和DREB2s基因。在拟南芥中,这两种类型的基因参与了低温、干旱和高盐胁迫响应[3.].过度的AtDREB1A结果发现,以提高热菊花的耐受性4].然而,DREB A-6群是否参与了耐热性尚未最后报告。
一般地,当温度低于10-15℃的环境温度高时,植物会产生热休克反应(HSR)很快,在几小时内,为了耐受否则致死温度5].的HSR是在由被称为热休克元件(HSE元件)存在于多拷贝的热休克蛋白的上游(HSP)的基因[顺式作用序列的转录水平介导的6].热休克因子(HSF)起着HSP的基因在植物中的表达的调节中起重要作用。当植物受到热刺激,一个HSF可以特异性结合到一个HSE,从而激活体内的HSP基因的表达。热休克蛋白在植物中的快速积累帮助折叠,稳定化和组装的蛋白质,从而提高植物的耐受高温[7].
菊花是中国十大传统花卉之一,也是世界四大切花之一。然而,菊花的生长受到高温的严重限制,高温会阻碍菊花的生长,造成花的缺陷[8].在这项研究中,我们克隆了CmDREB6中,DREB家族A-6亚组的成员,从菊花“金霸”和进一步分析其表达谱和反式激活活性。我们成功地生成CmDREB6过表达菊花线和菊花的热胁迫耐受性阐明了其调节作用,因而在阴影中的非生物胁迫耐受性A-6组DREB的作用一个新的光。
结果
植物的克隆和系统发育分析CmDREB6从菊花
我们克隆了1028 bpCmDREB6从菊花片段。最大的开放阅读框为936 bp,编码311个氨基酸残基的多肽(补充文件)1).推测蛋白的分子量约为34.36 KDa,理论等电点为6.72。系统发生的分析CmDREB6和其他物种的DREB成员证明了这一点CmDREB6被分为DREB A-6分组,并且最密切相关的CiDREB6从Cichorium intybus(无花果。1),显示73%的相似性,以CiDREB6.氨基酸序列分析表明,CmDREB6含有一个典型的AP2/ERF结构域,该结构域包括1 α-螺旋和3 β-薄片,其中14缬氨酸和19亮氨酸保守于DREB A-6亚群(图)。1 b).
DREB肽段氨基酸序列的系统发育分析与比对。一个CMDREB6和39来自其他种类的CVDREB2A(ABR23508.1),CIDREB2(AHJ08574.1),HADREB2(AAS82861.1),GMDREB2A(AFU35563.1),DREB2A(BAA33794.1),OSDREB2A(AAN02487.2),Fadreb2(AAR11157.1),SIDREB2(AD115111.1),SBDREB2A(AEI69362.1),PEDREB2L(ABV03750.1),WDREB2(BAD97369.1),ZMDREB2A(BAE96012.1),PGDREB2A(AAV90624。1),ZMDBF(AAM80486.1),CIDREB6(AHJ08575.1),RAP2-4(NP_177931.1),ABI4(AAM39489.1),ZMABI4(AAM95247.1),RAP2-1(NP_564496.1),RAP2-10(NP_195408.1),GHDBP1(AAO43165.1),CIDREN5(AAC29139.1),GMTINY(ACP40513.1),ZMDBF2(AAM80485.1),CIDREB1A(AHI59150.1),DGDREB1B(ABD90467.1),DGDREB1A(ABD90468.1),CIDREB1B(AAR59151.1),CADREB(AAR88363.1),MTDREB1C(ABB72792.1),HVCBF1(AAL84170.1),ZMDBP4(ACO72995.1),HVCBF2(AAM13419.1),OSDREB1B(AAN02488.1),HVCBF3(ACC63520.1),ZMDREB1A(AAN76804.1),OSDREB1A(AEW6732.1),LPCBF3(AAX57275.1)。bCmDREB6和CiDREB6(AHJ08575.1),ZmDBF(AAM80486.1),RAP2-4(NP_1777931.1)的A-6子组的推导的氨基酸序列的比对。红线代表保守的DNA结合结构域(AP2 / ERF结构域),蓝色线表示M1和M2两种基序,3绿色框,1个橙色框和▲分别表示3β片层,1α螺旋和V14,L19
CMDREB6的亚细胞定位
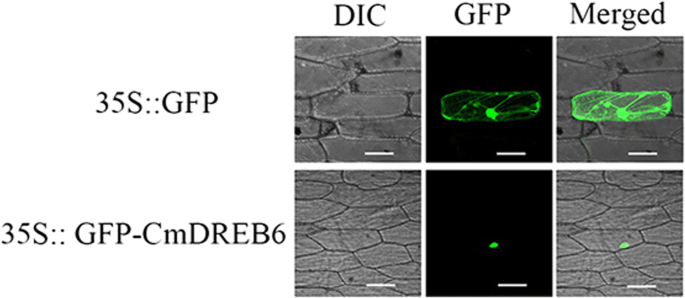
pMDC43 -GFP-CmDREB6构建空载体pMDC43-GFP,通过粒子轰击转化洋葱表皮细胞。对照载体的GFP荧光均匀分布于所观察的洋葱表皮细胞(图。2).相反,pMDC43-GFP-中有GFP荧光CmDREB6融合蛋白仅存在于洋葱表皮细胞的细胞核中。2),表明CmDREB6在体内定位于细胞核。
CmDREB6的反转录激活能力及其转录激活域分析
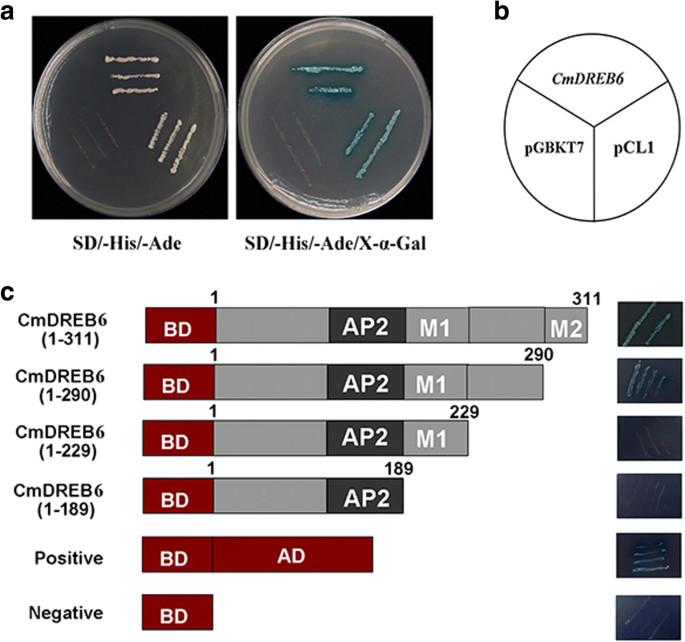
pGBKT7 -CmDREB6将对照质粒引入酵母菌株Y 2 H金中。结果表明,含有重组质粒pGBKT7-的酵母菌株CmDREB6能够在SD / -Trp单缺失培养基上生长,表明重组质粒成功转入酵母菌株Y2H gold;然后将培养的酵母转入双缺陷培养基SD / -His-Ade。重组质粒pGBKT7-CmDREB6正常生长,而含有pGBKT7中质粒的阴性对照菌株没有对SD / -His - 埃德成长,与阳性对照PCL1正常生长(图3).pGBKT7 -CmDREB6在添加了X-α-Gal的双缺陷平板上,菌落变为蓝色(图。3),提示pGBKT7-CmDREB6附身的转录激活能力。
分析转录激活域CmDREB6重组质粒pGBKT7-CmDREB6(1-311氨基酸,全长),PGBKT7的截短片段构建体CmDREB6(1-290),PGBKT7-CmDREB6(1-229),pGBKT7-CmDREB6(1-189),以及质粒pGBKT7空载体进行酵母单杂交测定法。结果发现,含有重组质粒的酵母菌株pGBKT7-CmDREB6(1-229)和PGBKT7-CmDREB6(1-189)不能正常生长,但pGBKT7-CmDREB6(1-311)和pgbkt7-CmDREB6(1 - 290)正常生长。含有pGBKT7空质粒的阴性对照菌株在SD / - hisa - ade平板上没有生长,而阳性对照pCL1生长正常(图1)。3 b).结果表明,转录活化域CmDREB6定位于在C末端的230〜290氨基酸。
组织特异表达谱和表达模式CmDREB6对热应激的反应
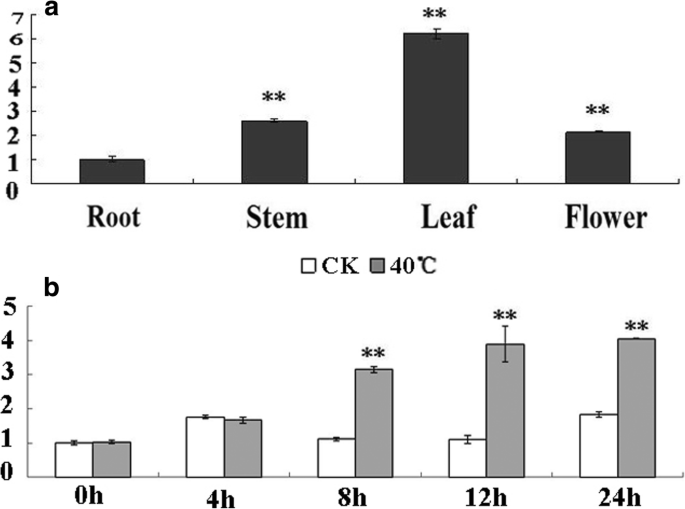
从根,茎,叶和菊花的花提取RNA为的相对表达水平的分析CmDREB6在不同的组织。表达水平CmDREB6最高的是叶,其次是茎,花和根反过来。表达水平CmDREB6在茎中,叶子和花分别比根部分别高1.6,5.2和1.1折(图。4).表达水平CmDREB6热胁迫后8 h、12 h和24 h分别是0 h(热胁迫前)的1.8、2.6和1.2倍。4 b).
的表达模式CmDREB6在40°C处理后。一个相对表达百叶CmDREB6在菊花的根,茎,叶和花。的表达CmDREB6采用qRT-PCR分析。的表达水平CmDREB6在root中设置为1,误差条表示来自三个重复样本的SE。星号表示在表达水平上有显著差异CmDREB6与根相比,茎、叶、花的生长速度更快。*表示在p< 0.05, **表示在p< 0.01。b相对表达百叶CmDREB640°C后处理。的表达CmDREB6采用qRT-PCR分析。的表达水平CmDREB6在WT中设置为1时,误差棒表示来自三个重复样本的SE。用星号表示的表达水平差异显著CmDREB6与WT在0小时,1个小时,3小时和24小时相比,热应力下,分别,*表示显着性在p< 0.05, **表示在p< 0.01
CmDREB6过度表达增强了菊花以热应激的耐受性
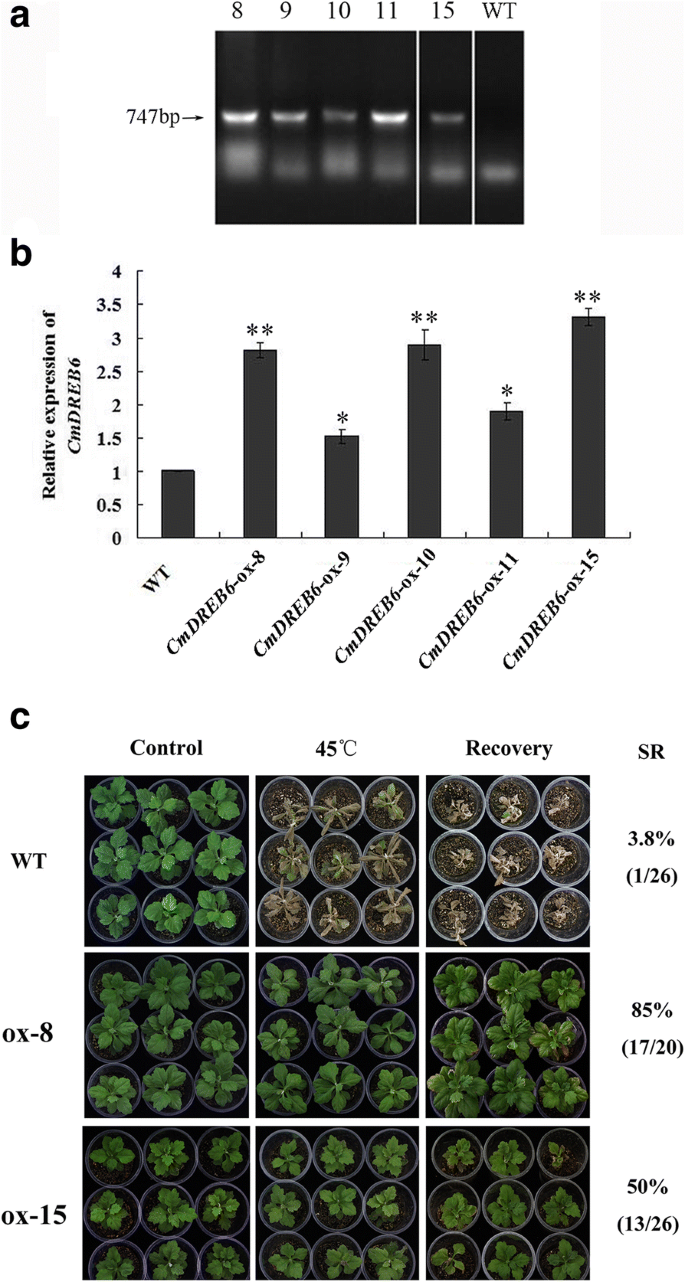
通过PCR扩增耐潮霉素基因,验证了转基因植株的可行性。在5个推测的转基因株系中发现了预期的片段大小约为750 bp的条带,但在WT植株中没有(图2)。5;额外的文件2).表达水平CmDREB6过表达系的植株数量高于野生型‘金巴’;两条表达水平较高的过表达线CmDREB6选择用于进一步的热应激耐受测定的Ox-8和Ox-15(图。5 b).结果表明,WT植物严重枯萎,并且所有WT植物的叶子都变枯,缩小和下垂,特别是在24小时热冲击后重量燃烧的WT的顶部叶子严重燃烧。相比之下,Ox-8和Ox-15线显示较小的衰弱,并且大多数叶片仍然是绿色的(图。5度).经过一周的恢复生长,几乎所有的WT植株都被烤焦,26株中只有1株存活,生长很弱,WT植株的存活率为3.8%,而ox-8和ox-15的存活率分别为85%和50%(图2)。5度),这表明CmDREB6授予菊花耐热性。
CmDREB6过度表达诱导表达CmHsfA4,CmHSP90以及编码基因的抗氧化酶CMSOD.和CmCAT
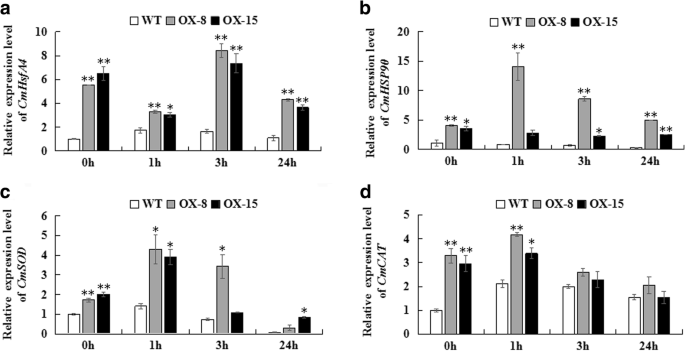
目的:探讨过表达提高菊花耐热性的途径CmDREB6,表达水平CmHsfA4,CmHSP90,CMSOD.和CmCAT对热胁迫下的菊花进行了定量分析。的表达CmHsfA4通过热激处理在WT和牛品系的植物,的表达水平增强CmHsfA4在牛-8,OX-15植物总是比在WT(图更高。6A).的表达CmHSP90对热应激反应增加,表达水平CmHSP90在这两个OX-8和OX-15植物仍然比热胁迫过程中WT(图高。6B.).CmDREB6过表达促进了活性氧清除基因的表达CMSOD.和CmCAT在牛-8和OX-15植物;这两个基因的表达水平比在热胁迫下野生型植物更高(图6 c, d).
讨论
菊花CmDREB6过度的表达赋予了耐热性
A-6 DREB家族的成员已经从几个物种中分离出来,他们在应激反应和发育中的作用已经被描述。CiDREB6主要诱导在强烈的热量和干旱下,但不是低温和高盐[9].拟南芥DREB A-6亚群的八个成员之一,ERF055,在拟南芥的根、茎、叶、花和荚果中均有表达,其中荚果中表达量最高;已得到证实ERF055基因在拟南芥中参与胚胎发育和胚胎后发育[10].AP2/ERF转录因子WIND1 (WOUND INDUCED DEDIFFERENTIATION 1)属于A-6 DREB亚群,在拟南芥中促进细胞去分化,并诱导油菜、番茄和烟草愈伤组织的形成[11].A-6亚组的其他成员在不同的物种中连续孤立。例如,在麻风树图L的表达JcDREB被冷,盐和干旱胁迫诱发,但不是由ABA(脱酸)和过度表达JcDREB拟南芥提高耐盐性和抗冻性[12].GhDBP2在叶子中以高水平表达陆地棉,受干旱、高盐、低温和ABA的强烈诱导[13].在尼科尼亚塔哈瓦姆, overexpressing碱蓬SsDREB, a -6亚群的成员,对盐和干旱的耐受性提高,以及生长速度、叶绿素含量和光合速率、蛋白质水平和可溶性糖含量与野生型相比均有所提高[14].的表达msdreb6.2.从Malus Sieversii.Roem受干旱和盐胁迫的强烈诱导,并在根中大量表达。过度的msdreb6.2.通过增强导致细胞素缺乏发育表型MdCKX4转基因苹果植物中的表达和增强的抗旱耐受性[15].这些数据表明了Dreb.转录因子可用于改善植物对非生物应激的耐受性,不同的DREB转录因子具有不同的成员和物种特异性[16].在本研究中,DREB A-6亚群成员的表达CmDREB6最高的是叶,是由高温引起的,这表明CmDREB6可能在热应激反应中起作用。与热诱导表达式一致,CmDREB6 -过表达的菊花增强耐受性热(图5),建议CmDREB6赋予耐热性。
CmDREB6通过上调表达来增强菊花的耐热性CmHsfA4和CmHSP90
HSFS(热震动因子)在对热应力的反应中起重要作用[17].HSFA3.充当的控制下的热稳定调节器Dreb2a.途径,下游Dreb2a.胁迫调节机制,调控多种热诱导基因的表达[18].更多的证据表明DREB2A激活了HSFA3.并且随后调节的表达HSP基因参与HSR的早期阶段,并且DREB2C式激活的DRE依赖性转录HSFA3.诱导下游基因的表达热休克,从而提高高铁[后期阶段耐热19,20.].最近的研究表明,HSFA2.和HSFA3.功能相同的热调节途径,和HSFA2.在…起主导作用HSFA3.[21].HsfA4是热应激基因表达的有效激活剂[22].然而,调控HSFA4.DREB的报告以前未见报道。在本研究中,归纳CmHsfA4在观察CmDREB6在非胁迫或热胁迫植物中过度表达的植物(图。6),建议Dreb A-6亚家族成员CmDREB6,可能通过激活的表达增强菊花耐热性CmHsfA4.然而,CmDREB6是否与的启动子结合CmHsfA4直接与否仍有待确定。
HSP是重要的分子伴侣,广泛介导应力信号[23].在无应激条件下,HSP和HSF作为分子伴侣共同存在。热休克反应后,植物产生大量有毒蛋白质,热休克蛋白从热休克蛋白中释放出来,然后与毒素蛋白结合[24].许多HSP蛋白是已知的作为用于热不稳定的蛋白的对热诱导变性在植物细胞中的保护[分子伴侣25,26,27].在这项研究中,表达CmHSP90被诱发了CmDREB6过表达植物,可以保护菊花从热损伤。在HsfA子A4的成员已被证明以服务为转录激活因子HSP基因[19,28,29].是否诱导CmHsfA4在CmDREB6过表达植物上调的表达CmHSP70和CmHSP90仍有待阐明的。的MsHSFA4基因Medicago Sativa.在非胁迫条件下不表达,但在热休克诱导下表达,类似于AtHSFA4a表达式[30.].
CmDREB6通过调节ROS的同源性增强菊花的耐热性
热应激可诱导活性氧(ROS)的产生和反应,包括单线态氧(1O2)、超氧自由基(O2-)、过氧化氢(H2O2)和羟基自由基(OH-) [31].ROS引起膜脂和色素的自催化过氧化作用,从而导致膜半透性丧失,改变其功能[1].作为回应,植物会产生抗氧化酶,如超氧化物歧化酶(SOD)、过氧化氢酶(CAT),以减轻对细胞膜的损害,提高耐热性[1].一半被发现参与了HSFA2.对氧化应激反应的表达,其中热休克反应促进表达草皮,而活性氧清除基因猫表达没有明显改变[24].过度的HSFA4A可以防止拟南芥的氧化损伤,并增强耐受性,而且增强耐药性,但也增强了渗透压,百草枯,h2O2和缺氧32].的ThDREB从刚毛柽柳通过增强抗氧化酶活性,可以有效改善盐和干旱胁迫的耐受性,使ROS积累在低水平下,从而促进清除[33].异位表达egdreb1.从Elaeis guineensis增强的番茄过氧化物酶表达(leepod.),抗坏血酸过氧化物酶(leapx.),过氧化氢酶(LeCAT), 超氧化物歧化酶 (LeSOD),热休克蛋白70(LeHSP70)对PEG处理和冷胁迫下番茄幼苗的影响[34].的AtDREB1B转基因植物通常显示丙二醛的较低水平(MDA),但在干旱胁迫下超氧化物歧化酶(SOD),过氧化氢酶(CAT),和过氧化物酶(POD)活性比野生型的较高水平[35].同样的,CmDREB6过表达能促进ROS通路相关基因的表达CMSOD.和CmCAT在菊花里,表明CmDREB6通过调节活性氧稳态增强菊花的耐热性。
此外,在应激相关的转录调节剂的积累可能对生长可能是有害的,并且没有被认为是优选的[36,37].在本研究中,观察到生长迟缓CmDREB6表达水平最高的牛-15系CmDREB6.相较于野生型植物,OX-15线的热胁迫的耐受性和下游的基因的表达的激活是不那么明显的那些牛-8线的,这表明随积累CmDREB6迟钝的生长可能会影响热应激的耐受性。
结论
DREB A-6亚组成员的表达CmDREB6由高温引起的。和CmDREB6-overex抑制的菊花增强了热量的耐受性,这表明这一点CmDREB6赋予耐热性。C的感应mHsfA4在观察CmDREB6过表达,CmHSP90被诱发了CmDREB6过表达植物,可以保护菊花从热损伤。CmDREB6过表达可促进ROS通路相关基因的表达CMSOD.和CmCAT在菊花里,表明CmDREB6通过调节活性氧稳态增强菊花的耐热性。
方法
植物材料和生长条件
从菊花种质资源保中心(南京农业大学,南京,中国)获得的菊花品种“金霸”扦插。钻屑被封装进一个1:2(v/v),在相对湿度80%、光照强度100 μmol·m的温室中保存−2·年代−1和16小时/ 8小时(亮/暗)光周期,与昼夜温度的23°C和18°C,。
分离和序列分析CmDREB6
总RNA,使用RNAiso试剂(宝,日本东京),并按照制造商的协议菊叶中分离。所得RNA的A 1微克等分试样用无RNA酶的DNA酶I被列入为模板进行第一链cDNA的合成处理,使用超级脚本III逆转录酶(Invitrogen,卡尔斯巴德,CA,USA)。的CmDREB6放大开放阅读框(ORF)CmDREB6-f / r inchers(附加文件3.).使用BIOSPIN凝胶提取试剂盒纯化PCR产物(生物焊剂,杭州中国)引入到pMD19-T(Takara公司)进行测序。的CmDREB6序列与使用DNAMANV6软件[及其同系物对齐38],利用MEGA5.0软件基于邻居连接法和1000次bootstrap重复生成系统发育树。其他物种DREB成员的多肽序列从NCBI网站(https://www.ncbi.nlm.nih.gov.).
组织特异性表达模式CmDREB6及其对热应激反应的表达谱
从四周的菊花植物中收获根,茎和叶子,以表征组织特异性表达谱CmDREB6转录。热应力实验(40°C)如前所述[39].分别在高温胁迫后0 h、4 h、8 h、12 h和24 h取第二叶片(从茎尖数)进行RNA分离。第1链cDNA的转录如前所述。使用SYBR®Premix Ex Taq™II (Tli RNaseH Plus) (Takara)和引物对,通过实时定量PCR (qPCR)检测转录本丰度CMDREB6-RT-F / R.(附加文件3.).底漆对CmEF1α-F / R(附加文件3.)扩增内参基因CmEF1α.使用2计算倍数变化-ΔΔct方法 [40].每个实验包括三个生物学重复。
CmDREB6的亚细胞定位和转录激活检测
的CmDREB6使用Phusion®高保真PCR试剂盒(New England Biolabs, Ipswich, MA, USA)扩增ORF,引物对CmDREB6-Nde-F/-BamH-R(附加文件)3.).所得的扩增是通过消化濒死经历我/的BamH然后连接到pENTR™1A (Invitrogen),形成构建物pENTR™1A-CmDREB6.
对于亚细胞测定,CmDREB6通过LR反应进一步插入目的载体pMDC43或pDEST-GBKT7。的pMDC43绿色荧光蛋白-CmDREB6构造和空pMDC43载体导入经由粒子轰击洋葱表皮细胞(PDS-1000; Bio-Rad公司)。在黑暗中举行转化细胞16小时在Murashige和Skoog(MS)培养基,然后共聚焦激光扫描显微镜下观察GFP(绿色荧光蛋白)花期。
用于转录激活测定,CmDREB6通过LR反应插入目的地向量PDEST-GBKT7。具有不同段的PDEST-GBKT7矢量CmDREB6(1-311、1-189、1-229、1-290氨基酸)筛选蛋白的反式激活区。对克隆进行测序,以验证插入是否正确。重组质粒pGBKT7-CmDREB6或pGBKT7空载体(阴性对照)或pCL1(阳性对照)转化为Y2H金酵母株,然后镀于SD / -Trp板上,30℃培养3天。将酵母菌落转移到SD / -His-Ade培养基中,30℃暗培养3天。对酵母菌的生长进行了观察和拍照。
的再生CmDREB6overexpressing菊花植物
为了识别功能CmDREB6, pMDC43的载体绿色荧光蛋白-CmDREB6由35S启动子驱动,通过农杆菌介导的叶盘感染引入到菊花“金霸” [41].通过PCR分析使用推定的转基因植物使用hy(潮)F / R引物,过度表达CmDREB6利用引物进行qPCR检测CMDREB6-RT-F / R..
耐高温试验CmDREB6overexpressing菊花植物
过表达系和WT植物种植在同一批次(土壤:蛭石;1: 1,v/ v)。耐热性试验中,6-8叶期菊花幼苗在45℃下暴露24 h;然后将热胁迫的植物转移到22°C,并让其恢复一周[4].分别记录热处理前后的表型变化,并计算生存率。
基因表达谱CmDREB6overexpressing菊花植物
进一步解剖所涉及的机制CmDREB6分别在高温处理后0 h、1 h、3 h、24 h取热胁迫菊花和野生型植株的第3片叶片(从茎尖数)。总RNA的分离和cDNA的制备如下。热应激相关基因的表达水平CmHsfA4(CmHsfA4 F / R),CmHSP90(CMHSP90 F / R.编码的基因)和抗氧化酶CMSOD.(CmSOD F / R) 和CmCAT(cmcat f / r)被量化。所有使用的引物都在附加文件中列出3..
统计分析
结果一个re expressed as mean ± standard error. Statistical significance was determined by SPSS 19.0 amongst the means of WT and transgenic plants, and a one-way analysis of variance using LSD (least significant diferrence) multiple range test was employed to identify treatment means that differed statistically.
缩写
- 阿巴:
-
脱盐酸
- AP2 / EREBP:
-
乙烯响应元件结合蛋白
- AP2 / ERF:
-
乙烯响应因子
- 猫:
-
过氧化氢酶
- 含有DREB:
-
dehydration-responsive元件结合
- GFP:
-
绿色荧光蛋白
- HSE:
-
热休克元素
- HSF:
-
热休克因子
- HSP:
-
热休克蛋白
- 高铁:
-
热休克反应
- hy:
-
潮
- MDA:
-
丙二醛
- mRNA:
-
信使核糖核酸
- 多发性硬化症:
-
Murashige和斯库
- ORF:
-
开放阅读框架
- PCR:
-
聚合酶链反应
- 圆荚体:
-
过氧化物酶
- ROS:
-
反应氧
- 草皮:
-
超氧化物歧化酶
- 风:
-
伤口诱导脱分化1
- WT:
-
野生型
参考文献
- 1.
徐树华,李军,张晓霞,魏华,崔丽。热驯化预处理对两种冷季草坪草膜脂过氧化、抗氧化代谢产物和叶绿体超微结构的影响。环境实验机器人。2006;56(3):274-85。
- 2.
Larkindale J,Hall JD,Knight Mr,Vierling E.拟南芥突变体的热应激表型在获取热能的情况下涉及多种信号通路。植物理性。2005; 138(2):882-97。
- 3.
柳Q,春日男,佐久Y,阿部H,三浦S,山口筱崎K,等人。两个转录因子,DREB1和DREB2在干旱和低温响应基因表达中,一个EREBP/AP2 DNA结合域分别分离了两个细胞信号转导途径拟南芥.植物玻璃纸。1998;10(8):1391 - 406。
- 4.
洪波,马超,杨勇,王涛,山口筱崎K,高杰AtDREB1A在菊花中增强对热应激的耐受性。植物学报。2009;70(3):231-40。
- 5.
植物的耐热性:概述。环境实验机器人。2007;61(3):199-223。
- 6.
佩勒姆的人力资源。果蝇hsp70热激基因的上游调控启动子元件。细胞。1982;30(2):517 - 28。
- 7。
细胞质中的分子伴侣:从新生链到折叠蛋白。科学。2002;295(5561):1852 - 8。
- 8。
陈胜,崔旭,陈勇,顾超,苗辉,高辉,等。CgDREBa转基因菊花赋予耐旱和耐盐性。Environ Exp Bot。2011; 74(12):255-60。
- 9。
梁M,陈德,林M,郑Q,黄Z,林Z,赵·Z.隔离与特征二DREB1编码脱水应答元件结合在菊苣的蛋白质的基因(Cichorium intybus).植物生长调节。2014; 73(1):45-55。
- 10。
拟南芥AP2 /在茎尖分生组织[d]发展的调控ERF家族基因ERF055腾F.分子解剖。泰安:山东农业大学;2013年(在中国)
- 11.
Iwase A, Mitsuda N, Ikeuchi M, Ohnuma M, Koizuka C, Kawamoto K, et al.;拟南芥风1.在油菜籽,番茄和烟草中诱导愈伤组织形成。植物信号表现。2013; 8(12):199-206。
- 12.
唐敏,刘旭,邓华,沈爽JcDREB该基因可能是木质生物柴油植物麻疯树(Jatropha curcas)中含有AP2/EREBP结构域的转录因子基因,可增强转基因植物的耐盐性和抗冻性拟南芥蒂利亚纳.植物科学。2011;181(6):623 - 31所示。
- 13.
黄湾,金升,刘Jy。新基因的鉴定与表征GhDBP2从棉花编码DRE结合蛋白(陆地棉).acta botanica yunica sinica(云南植物学报)。
- 14.
张晓霞,刘晓霞,吴丽丽,于光华,王旭东,马海涛。盐生植物碱蓬SsDREB转录因子对烟草抗非生物胁迫能力的影响。基因组学杂志。2015;2015(5):1-13。
- 15.
熊亮,肖刚,齐伟,王永强,狄震,姚磊,等。过度的msdreb6.2.结果细胞分裂素缺乏的发育表型和增强耐旱转基因苹果植株。植物杂志2017; 89(3):510-26。
- 16.
周W,贾CG,吴X,胡RX,宇庚,张XH等。ZmDBF3,玉米的一种新的转录因子(玉米L.),参与多种非生物胁迫耐受性。植物学报2016;34(1):1 - 12。
- 17.
李超,陈强,高旭,齐斌,陈宁,徐胜,王旭。阿斯法布2调节应激反应基因的表达,增强机体对热和氧化应激的耐受性拟南芥.中国科学C辑生命科学。2005; 48(6):540。
- 18。
Nishizawa A,Yabuta Y,Yoshida E,Maruta T,Yoshimura K,Shigeoka S. Arabidopsis热冲击转录因子A2作为若干类型的环境压力。工厂J. 2006; 48(4):535-47。
- 19。
Schramm F, Ganguli A, Kiehlmann E, Englich G, Walch D, Koskull-Döring P.热应激转录因子HSFA2.在热应激反应中作为一个基因子集的调节放大器拟南芥.植物学报。2006;60(5):759-72。
- 20.
关键词:拟南芥,DREB2C,转录激活剂,拟南芥HSFA3.时的热应激反应。生物化学Bioph RES有限公司2010; 401(2):238-44。
- 21.
李晓东,王秀玲,蔡玉明,吴建华,莫博特,于尔。拟南芥热胁迫转录因子A2(HSFA2)和A3 (hsfa3)功能相同的热调节途径。植物生理学报。2017;39(3):67。
- 22。
陈志强,陈志强,陈志强,等。高温胁迫转录因子的研究进展HSFA5.作为HsfA4的特异性抑制因子。中国生物化学杂志。2007;282(6):3605-13。
- 23。
Hahn A,Bublak D,Schleiff E,Scharf Kd。HSP90和HSP70之间的串扰和番茄中的热应激转录因子。植物细胞。2011; 23(2):741-55。
- 24。
Nishizawayokoi A, Tainaka H, Yoshida E, Tamoi M, Yabuta Y, Shigeoka S. 26S蛋白酶体功能和Hsp90活性参与调控HSFA2.对氧化应激反应的表达。植物生理学。2010;51(3):486-96。
- 25。
王W,Vinocur B,Shoseyov O,在非生物胁迫响应植物热休克蛋白和分子伴侣的奥特曼A.作用。趋势植物科学S. 2004; 9(5):244-52。
- 26。
在植物细胞质中发现的两类保守热激蛋白的机制差异。中国生物医学工程学报。2010;33(4):591 - 598。
- 27。
水域。植物sHSPs的进化、功能、结构和表达。J Exp Bot. 2013;64(2): 391-403。
- 28。
Pérezsalamó I, Papdi C, Rigó G, Zsigmond L, Vilela B, Lumbreras V, et al.;热休克因子A4A具有耐盐性,并受氧化应激和丝裂原活化蛋白激酶MPK3和MPK6的调控。植物杂志。2014;165(1):319 - 34。
- 29。
薛桂平,Sadat S, Drenth J, Mcintyre CL。小麦热激因子家族对热和其他主要非生物胁迫的响应及其在热激蛋白基因调控中的作用。[J] .机器人。2014;65(2):539-57 .]
- 30.
Friedberg Jn,Bowley SR,McKersie Bd,Gurley WB,Czarnecka-Verner E. Alfalfa类A4热冲击转录因子的分离和表征。植物SCI。2006; 171(3):332-44。
- 31。
刘X,黄B.蠕动纤维草中膜脂过氧化的热应激损伤。农作物科学。2000; 40(2):503-10。
- 32。
拟南芥热休克因子的A4A佩雷斯SalamóI.功能表征,通过一个新的遗传筛选中鉴定。Geochim Cosmochim ACTA。2014; 121(6):41-53。
- 33。
杨刚,于林,张凯,赵颖,郭颖,高春安ThDREB从柽柳中提取的基因提高了转基因烟草和柽柳的耐盐耐旱性。植物生理学报。2017;113:187-97。
- 34。
Azzeme AM, Abdullah SN, Aziz MA, Wahab PE。油棕榈干旱诱导DREB1在低温和PEG处理下诱导转基因番茄DRE/CRT-和非DRE/CRT基因的表达。植物生理学报。2016;112:129-51。
- 35.
魏涛,邓凯,高艳,杨敏,张磊,等。拟南芥Dreb1b.在转基因丹参的耐受性增强对干旱胁迫没有发育迟缓的增长。植物理性生物生物。2016; 104:17-28。
- 36.
Ogawa D,Yamaguchi K,Nishiuchi T.拟南芥的高水平过度表达HSFA2.基因不仅增强了抗热性,而且还增强了耐盐/渗透胁迫和愈伤组织的生长。中国生物医学工程学报。2007;58(12):3373-83。
- 37.
闫志伟,王磊,夏磊,刘永强,等。异位表达的BhHsf1,来自复活植物Boaea Hygrometrica的热休克因子,导致转基因拟南芥和烟草中的热能和延迟生长。植物mol biol。2009; 71(4-5):451-67。
- 38.
MA大号GB,NP乙RC,帕米HM等人。CLUSTAL W和CLUSTAL X 2.0版。生物信息学。2007; 23(21):2947-8。
- 39.
宋安,李鹏,姜军,陈胜,李华,曾军,等。菊花的系统发育和转录分析WRKY转录因子。中华医学杂志。2014;15(8):14442-55。
- 40.
肯尼斯j,丽塔克td。使用实时定量PCR和2分析相对基因表达数据-ΔΔct方法。方法。2001;25:402-8。
- 41.
钟JD,拉德梅克W,Wordragen MFV。恢复对在与根癌农杆菌共培养菊花叶外植体不定芽的形成。植物细胞组织org。1993; 32(3):263-70。
资金
这项工作得到了中国国家自然科学基金(31672192)和中国江苏,中国重点研发方案(BE2017318)。
数据和材料的可用性
目前研究中分析的所有序列reads已保存在NCBI Genbank数据集(https://www.ncbi.nlm.nih.gov/genbank),加入编号为MG199593。本研究期间产生或分析的其他数据包括在这篇发表的文章及其补充数据文件中。
作者信息
从属关系
贡献
XD和WL同样地贡献到实验操作,生物信息学分析以及手稿的写作,并应被视为副第一作者。JJ,WF,ZG,FC和SC设计了实验并导致了稿件的修订。LS,YD,YW,WZ和KY有助于RNA提取和数据处理。所有作者阅读并认可的终稿。
通讯作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
额外的信息
杜新平和李文彦是共同第一作者
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
杜旭东,李伟,盛立。et al。表达的菊花CmDREB6增强菊花对高温胁迫的耐受性。BMC植物杂志18,178(2018)。https://doi.org/10.1186/s12870-018-1400-8
已收到:
接受:
发表:
关键字
- CmDREB6
- 菊花
- 非生物压力
- 耐热性