摘要
背景
不定根的形成是各种植物扦插繁殖成功的重要生理过程。由于针叶树种具有高度的杂合性,扦插繁殖在育种中具有重要的实际应用价值。虽然有多种因素影响不定根的形成,但对其相关的调控机制知之甚少。而不定根一般从扦插的基部形成,这一过程伴随着叶片的生理变化,叶片提供同化物和代谢物。在此,我们对针叶树种的整株扦插不定根形成过程中的转录组动态进行了微阵列分析,日本柳杉粳稻.
结果
在不定根形成的8个时间点上,测定了扦插基部、中间和针叶的基因表达变化规律。针根根部基因的整体表达在针根插入后3 h与针根中部出现差异,在针根插入后3 d变化不大,针根根部基因的整体表达在针根插入后3周和6周发生了特发性变化。在基于层次聚类的主基因簇的基因本体富集分析中,碳水化合物、植物激素等相关基因的表达谱显示了不定根形成的多重生物学变化。
结论
目前的综合转录组分析表明了主要的转录转向,有助于理解影响不定根形成的生物过程和分子因素c .粳稻.
背景
从胚芽、茎和叶等分化细胞发育而来的根被定义为不定根[1].不定根的形成是各种园艺和林业树种扦插成功繁殖的重要生理过程。这种无性繁殖方法保持了供体植物的基因型,因此具有目标无性系的优越特性。由于由此产生的分株间的均匀性为园艺和林业工业提供了经济效益,因此进行了大量研究以确定不定根形成的机制。特别是,园艺植物的生化研究揭示了影响不定根形成的多种因素。植物激素生长素在不定根形成中起关键作用[2,3.,4,5,6],而碳水化合物是这一过程中明确的能量需求[7,8,9,10](在[11,12,13,14])。大量分子生物学研究支持园艺植物的生化发现[15,16,17],反映了基因表达谱在剖析植物生理和发育的潜在生物过程方面的前景[18].因此,之前的综合转录组分析已经阐明了不定根形成的分子机制[19,20.].
不定根在适宜的条件下形成,无性繁殖对针叶树种的繁殖具有很大的可行性,因为针叶树种通常具有高度的异质性[21]并且基因固定的概率很低。因此,全球每年生产超过6500万根针叶树的插枝,其中至少一半产于日本[22].由于其生长迅速,树干笔直,易于木材加工,日本柳杉粳稻是日本最重要的林业物种之一,自1400年左右以来一直通过扦插繁殖[23].虽然c .粳稻易于扦插繁殖,不同基因型的生根能力有很大差异[24],供体树龄[25],以及各种其他因素,并且可以通过生长素的这种处理来增强[26]及底部加热[27].然而,大多数研究不定根的形成c .粳稻采用简单的生根表型二元评价进行。虽然在不定根形成过程中解剖结构发生了变化c .粳稻据报道[28],相关的分子事件,如基因表达的变化,仍然知之甚少。在针叶植物中,已经进行了有限数量的分子生物学研究,揭示了与细胞复制、细胞壁代谢、生长素代谢、应激反应、初级碳水化合物代谢和光合作用有关的基因在供体植物切除后不定根形成过程中表达差异[29,30.].
提供同化物和代谢产物的叶片的生理变化与不定根的形成密切相关。特别是,生长素已被证明能刺激不定根的形成,主要在叶片中合成,并由生长素极性转运体重新分配[31],而光合碳水化合物的产生和蒸腾作用与插枝上根系的伸长有关[32].此外,对c .粳稻提示插枝针叶周围的条件影响不定根的形成效率[33,34,35].不定根一般形成于插枝的基部而不是中间,而这些部分在切除前被视为等效器官。因此,比较扦插根部和中间的生物学变化将有助于对不定根形成机理的理解。
在这项研究中,我们对不定根形成过程中的插枝进行了转录组分析,目的是providing深入了解这一过程的分子机制c .粳稻.三个重要的实验设计元素增强了我们发现的清晰度和相关性:(1)从岩屑的三个部分(基部、中部和针叶)取样;(2)从供体树切除到不定根出现之间的8个时间点采集样本;(3)利用微阵列分析鉴定基因整体表达谱。
方法
植物材料和样品采集
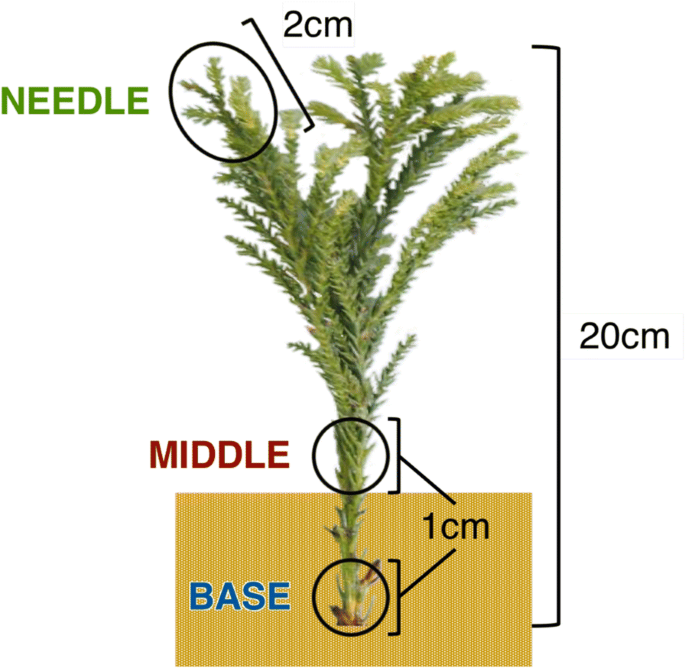
所有样本均取自该地区的个体c .粳稻加树克隆筑波1号。2016年5月25日9:00至10:00之间,在林业和林产品研究所(FTBC,日立,茨城市,日本)森林树木育种中心的一块田地,从18岁的供体树木上采集了约20厘米长的茎插枝。他们被插入到Kanuma土壤,这是一个流行的基质不定根c .粳稻种植在FTBC温室,自动灌溉,没有环境控制。每周观察一次插穗基部的形态,记录生根时间。在提取RNA之前,1厘米长的插枝基部(底部,地下),1厘米长的插枝中部(中间,地上)和2厘米长的嫩枝,包括针叶(针叶;无花果。1)分别于切除后0 -h (hpe)、插入后0 -h (hpi;约2 hpe), 3 hpi,插入后1天(dpi), 3 dpi,插入后1周(wpi), 3 wpi和6 wpi。在每个时间点从3个岩屑中采集样品作为生物重复,共72个样品。样品立即在液氮中冷冻,并在−80°C保存,直到RNA提取。
微阵列设计
微阵列是使用e-array (Agilent Technologies, Santa Clara, CA, USA)设计的,在基本成分方式法的默认参数下。使用Mishima等人描述的Roche GS-FLX系统,从不同发育阶段和季节的不同器官(木材、树梢、枝条、雄花和幼苗(包括根)中收集用于微阵列设计的Isotig序列。[36].高相似度(同源性×覆盖度> 0.95)的探针被排除在外,SurePrint G3基因表达定制8 × 60 K阵列(安捷伦科技)包含三个探针集,对应19304个序列。使用CLC Genomic Workbench 4.1.1版本软件包(CLC bio, Aarhus, Denmark)对TAIR拟南芥蛋白质数据库tair10 - peg -20101214进行查询,用于预测蛋白质产物,阈值e-值为1e−5。
RNA提取和微阵列实验
使用RNeasy Plant Mini试剂盒(Qiagen, Hilden, Germany)从样品中提取总RNA,并使用RNase-Free DNase Set (Qiagen)在柱上进行dna酶消化。在6 wpi生根数厘米的情况下,扦插根部重复3次。RNA浓度使用NanoDrop 2000分光光度计(Thermo Fisher Scientific, Waltham, MA, USA)进行测量,RNA完整性使用Agilent 2100生物分析仪(Agilent Technologies)和Agilent RNA 6000 Nano Kit (Agilent Technologies)进行评估。然后用低输入快速安捷伦标记试剂盒(Agilent Technologies)从每个样品中提取200 ng的总RNA合成氰化物-3 (Cy3)标记的cRNA, 600 ng的Cy3标记的cRNA在60°C下破碎30分钟,并在旋转微阵列杂交烤箱(Agilent Technologies)中用基因表达杂交试剂盒(Agilent Technologies)在8 × 60 K微阵列中杂交17小时,温度为65°C。杂交后,用基因表达洗涤缓冲试剂盒(安捷伦科技)清洗微阵列载玻片,并使用SureScan微阵列扫描仪9.1版(安捷伦科技)扫描。使用11.5版特征提取软件(Agilent Technologies)对所得到的TIFF图像上斑点的信号强度进行量化,并用于计算基因表达水平。微阵列设计的细节和后续数据已提交到NCBI GEO数据库[GSE102874]。
微阵列数据的处理
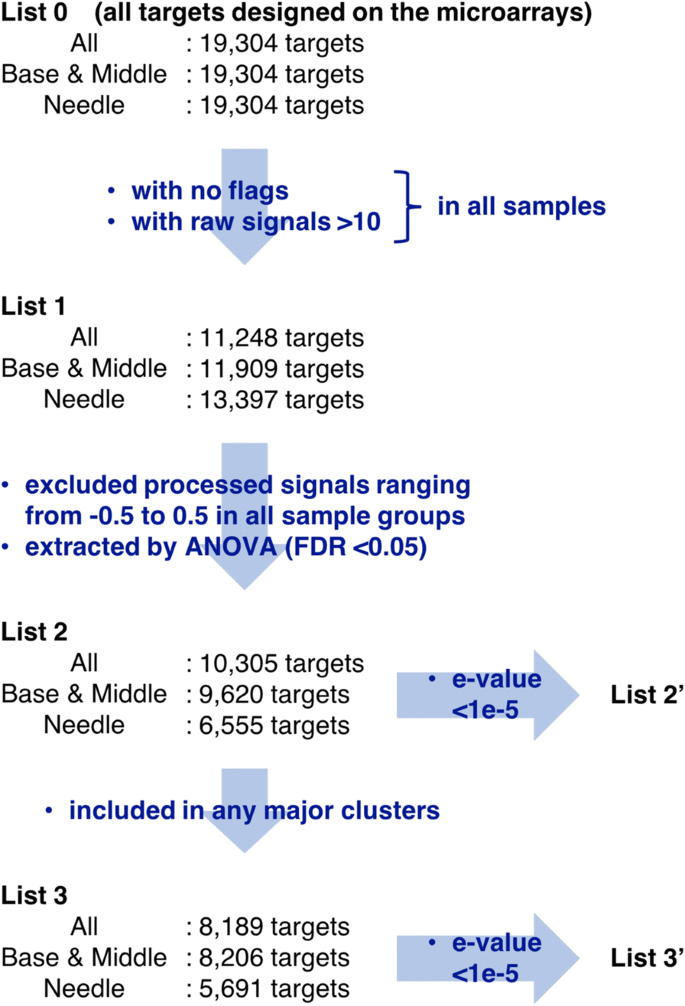
为了研究整个插枝和单个部分的基因表达变化,我们构建并处理了所有部分的三个独立数据集,即基部和中间,以及针,同时考虑了整体基因表达差异对归一化的影响(图2)。2).目前19,304个靶点(列表0)在微阵列上的三个重复中被发现,平均信号强度被认为是每个样本中基因表达水平的定量。列表0的表达式级别使用log进行归一化2-使用Subio平台版本1.21 (Subio Inc., Kagoshima, Japan)将转换和全球正常化到第75百分位。为了提高数据质量,使用特征提取软件识别并排除任何复制点中具有不利标志(gIsFeatNonUnifOLs、gIsBGNonUnifOLs和gIsWellAboveBGs)的目标(列表1),所有样本中仅使用平均原始表达水平大于10的目标进行分析。每个样本组的平均表达水平被认为代表基因表达水平,至少一个样本组的表达水平变化的靶标(表2)通过单向方差分析(Benjamini-Hochberg假发现率< 0.05)提取,靶标的处理表达水平在至少一个组中小于- 0.5或大于0.5。然后使用算术平均和Pearson相关的非加权对组方法进行主成分分析(PCA)和层次聚类,并生成列表2的总体概述。基于分层聚类,从三个数据集中分别识别出13个、12个和8个主要聚类,以及命中值为unique的目标(列表3 ')拟南芥BLASTX搜索后e-value <1e−5的基因被认为具有显著同源性,并从每个聚类中选择用于估计中的基因注释c .粳稻.然后用基因名对这些靶标进行识别,并使用注释、可视化和集成发现数据库将这些靶标分类为GOTERM_BP_DIRECT。https://david.ncifcrf.gov) [37].对于基因本体(GO)术语富集的分析,采用改进的Fisher精确法(Fisher exact)进行EASE评分p值(37],用于定义与注释项相关的基因富集,使用列表1中e-值较低(<1e−5)的靶标(列表1 ')作为群体背景。
定量rt - pcr
微阵列分析使用qRT-PCR进行独立验证(附加文件1:图S1,附加文件2:图S1和附加文件3.:图S3),引物使用Primer Express软件v3.0设计(应用生物系统公司,福斯特城,CA, USA;额外的文件4:表S1)。所有引物对的扩增效率都是使用来自克隆树的基因组DNA进行优化的,该克隆树用于StepOnePlus实时PCR系统(Applied Biosystems)上的SYBR Green实时qRT-PCR微阵列实验。然后根据制造商的说明,使用高容量RNA- cdna试剂盒(应用生物系统公司)反转录总RNA (160 ng)。按照生产厂家的说明书制备PCR混合物,其中包含250 nM的正向和反向引物和5 μL 43倍稀释的cDNA,最终体积为20 μL。所有反应在95°C变性10 min, 95°C变性15 s, 60°C变性1 min变性40个循环。从60°C到95°C进行熔解曲线分析,每0.3°C捕获一次数据,以确保单产物扩增。使用delta-delta-Ct方法进行相对定量和比较泛素作为内部控制的表述[38,39].
结果与讨论
针叶扦插不定根形成过程中基因表达变化的综合评价
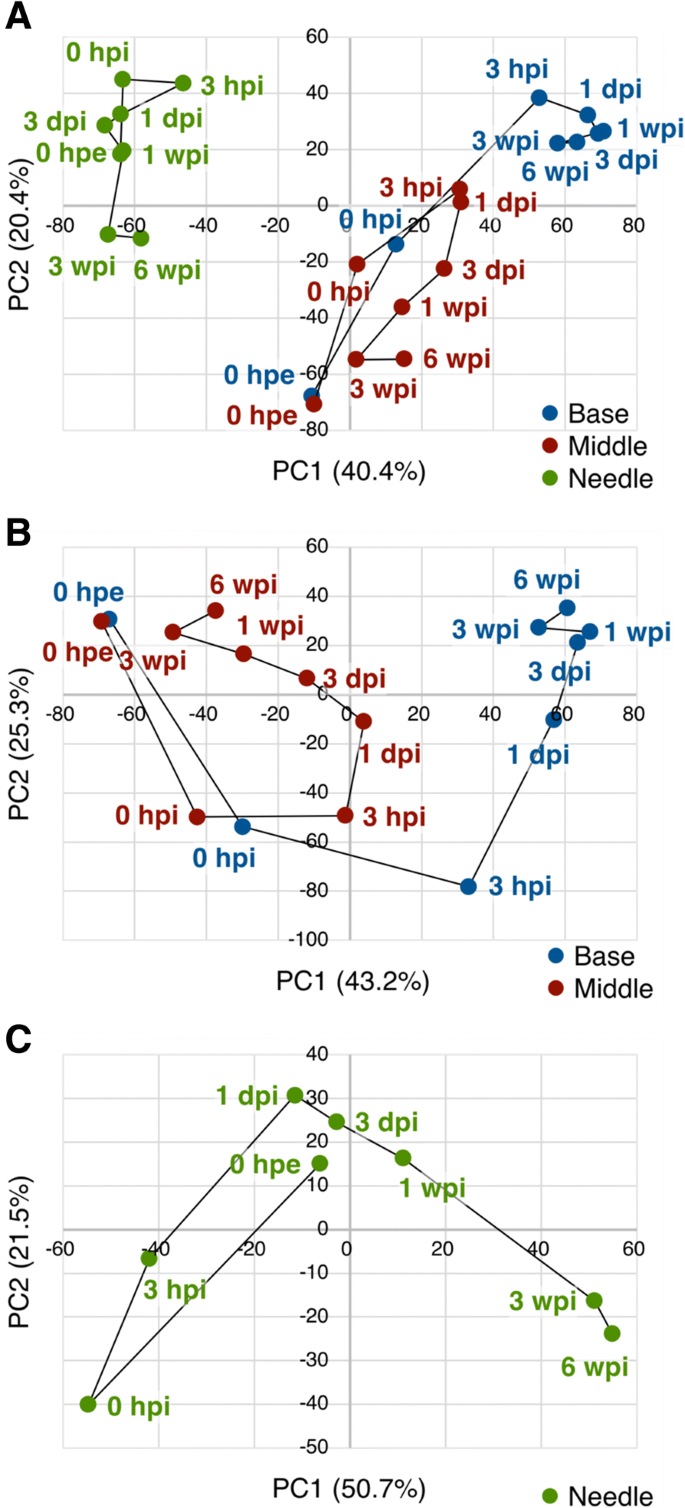
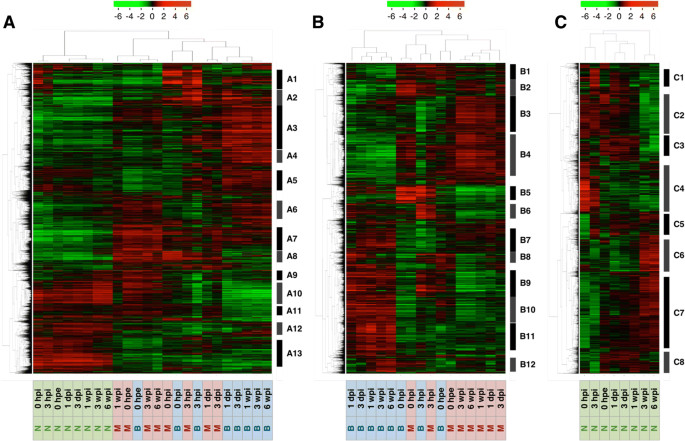
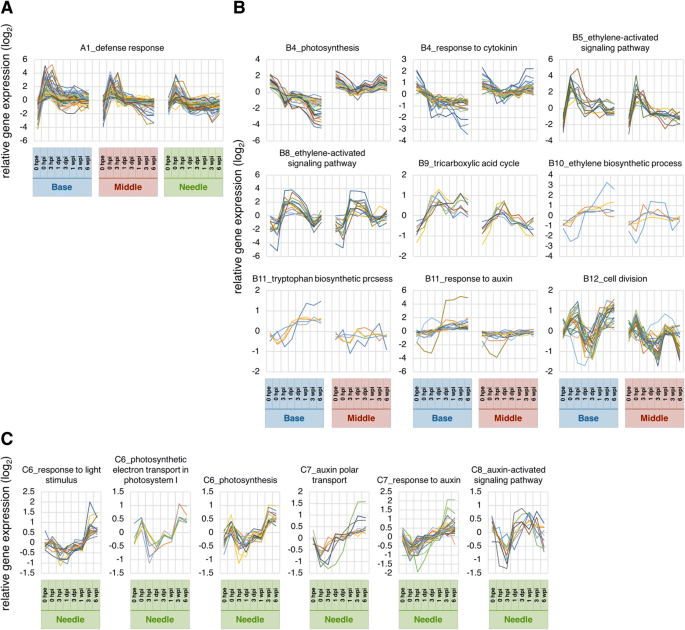
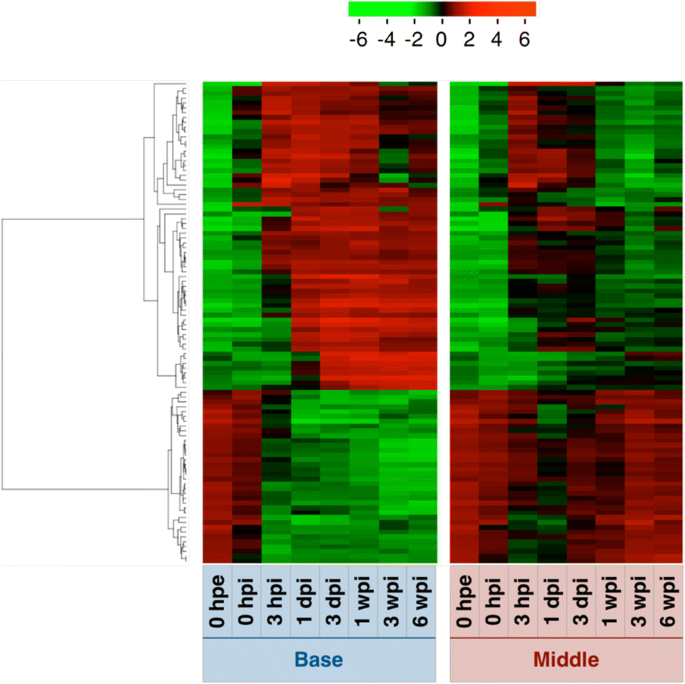
为了根据基因表达水平的变化总结样本间的相似性,我们采用主成分分析和层次聚类方法,对不定根形成过程中部分插枝的基因表达模式进行了表征(图2)。3而且4).总体基因表达水平在针和其他两个部分之间存在差异,在0 hpe时相似,但随着时间的推移,基部和中部之间的差异越来越大。此外,基于层次聚类,确定了13个主要聚类(图2)。4而且5和附加文件5:表S2A)。这些簇中的基因注释在附加文件中列出5各聚类的GO富集分析见附加文件6.
A1簇在0 hpi处有一个常见的峰值,与防御反应相关的基因最丰富(图2)。6和附加文件6:表S3A),表明由于切除引起的伤口信号被传递到整个植物体,并诱导立即的转录反应。A3、A7和A13聚类在针叶和其他两部分之间有不同的基因表达模式。但A7和A13聚类保持了初始差异,A3聚类在基部和中部切除后增加,但在针叶上变化不大。因此,簇A7和簇A13可能反映了原始生物作用的差异,而簇A3对于不定根的形成相对重要。簇A3富集的基因与mRNA加工(GO:0006397)、转录、dna模板化(GO:0006351)、rRNA加工(GO:0006364)、胚囊发育(GO:0009553)、转录调控、dna模板化(GO:0006355)、转录负调控、dna模板化(GO:0045892)、RNA剪接(GO:0008380)和RNA二级结构解缠绕(GO:0010501;额外的文件6:表S3A),表明底部和中部的生物变化更为显著。A7簇在各时间点的基部和中部均高于针叶,富集与信号转导(GO:0007165)、防御反应(GO:0006952)、高尔基体蛋白保留(GO:0045053)、相互减数分裂重组(GO:0007131)、生长素反应(GO:0009733;额外的文件6:表S3A)。A13簇在所有时间点的碱基和中间均比针叶表达量低,在翻译(GO:0006412)、脂肪酸生物合成过程(GO:0006633)、细胞壁组织(GO:0071555)、细胞氧化还原平衡(GO:0045454)、核糖体生物发生(GO:0042254)、ATP合成耦合质子转运(GO:0015986)、甘油醚代谢过程(GO:0006662)、硫酸盐同化(GO:0000103)、转运(GO:0006810)、以及细胞对氧化应激的反应(GO:0034599;额外的文件6:表S3A)。簇A4和簇A10在扦插基部和中间有显著差异。其中,簇A4仅在基部逐渐上调,并富集分生组织营养-生殖阶段转变(GO:0010228)、叶片衰老(GO:0010150)和乙烯生物合成过程(GO:0009693;额外的文件6:表S3A)。簇A10仅在基部逐渐下调,光合作用(GO:0015979)、氧化还原过程(GO:0055114)、叶绿素生物合成过程(GO:0015995)、类囊体膜组织(GO:0010027)、叶绿体组织(GO:0009658)、蛋白质-发色团连锁(GO:0018298;额外的文件6:表S3A)。包含在这些术语中的基因可能只负责从基部形成不定根。
不定根形成过程中扦插基部和中间的基因表达谱
主成分分析和层次聚类结果显示,0 hpe时,基因在基部和中间的整体表达具有显著的相似性(图2)。3 b而且4 b).切除后,碱基和中间基因表达量起初对主成分1的依赖性增强(PC1, 43.2%),对主成分2的依赖性下降(PC2, 25.3%), 3 hpi后恢复;然而,对PC1的依赖在基础层继续增加,而在中间层则减少,因此趋向于更接近原始依赖。这两个部分转录组改变的68.5%由PC1和PC2所代表,其中PC1似乎代表了基段和中间段的差异。PC1系数最大的前100个基因,并在附加文件中标注7,对应的表达模式如图所示。7.这些基因可分为两种主要的表达模式。一种是切除后诱导的基因保留在底部而不是中间,另一种是切除后抑制的基因保留在底部而不是中间(图)。7).前者富集氧化还原过程(GO:0055114)、类黄酮生物合成过程(GO:0009813)、代谢过程(GO:0008152)相关基因,后者富集光合作用相关基因(GO:0015979)和光刺激响应相关基因(GO:0009416;额外的文件8:表S5)。这些结果表明,扦插的基部和中部原本是等价的器官,后来由于切除和插入等物理和生理刺激而分化为不同的器官。此外,基于层次聚类,确定了12个主要聚类(图2)。4 b而且5 b和附加文件5:表S2B)。这些簇中的基因注释在附加文件中列出5相应的氧化石墨烯富集分析结果见附文件6.B4、B11和B12聚类在基底和中间表达模式不同。簇B4富集与光合作用(GO:0015979)和氧化还原过程(GO:0055114)相关的基因,簇B11富集与转录调控、DNA模板化(GO:0006355)相关的基因,簇B12富集与微管运动(GO:0007018)、DNA复制(GO:0006260)、细胞分裂(GO:0051301)、DNA重组(GO:0006310)、有丝分裂染色体凝结(GO:0007076)、细胞周期(GO:0007049)、DNA复制启动(GO:0006270),有丝分裂核分裂(GO:0000278),细胞周期调控(GO:0051726;额外的文件6:表S3B)。考虑到这两个部分形成了形态差异,这些术语相关的基因可能在不定根的形成中发挥更重要的作用。此外,不定根的形成涉及到从分化的细胞中构建和发育新的根原基,因此细胞分裂是这个过程不可缺少的。以前的研究也证实了在不定根形成过程中,根区细胞分裂基因等参与过程的基因表达的改变p .矮牵牛[20.),p . contorta[29],并主要同意目前的数据。
不定根形成过程中扦插根部基因表达的时间变化
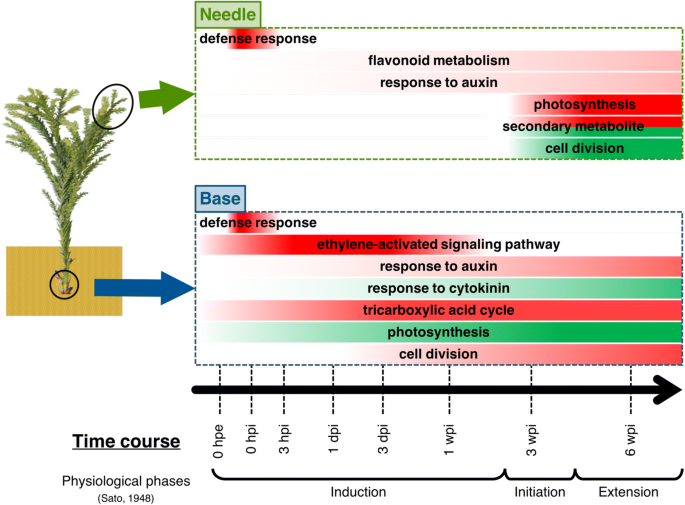
3 hpi时,根部(即生根区)的基因表达谱与中间的基因表达谱不同,但3 dpi后变化相对较小(图2)。3 b),表明不定根形成的转录条件已经建立。不定根的形成在组织学上可分为诱导期、起始期和延伸期[40].Satoo [28]报道了根原基形成的起始,似乎代表了从诱导到起始阶段的过渡,发生在18dpi,不定根在40dpi从皮层中出现c .粳稻.因为在本研究中不定根出现在35dpi,我们的样品的组织学变化可能发生在18dpi左右。因此,我们的结果表明,在不定根形成的稳定基因表达的建立和随之而来的组织学性状之间有很长的时间。这些结果也表明,更重要的基因表达变化发生在诱导阶段,不定根形成的主要转折点发生在不定根出现之前很久c .粳稻.
不定根形成过程中针叶的基因表达模式
目前的层次聚类分析产生了8个主要的聚类(图。4摄氏度而且5度和附加文件5:表S2C),纳入的基因在附加文件中标注5各聚类氧化石墨烯富集分析结果见附加文件6.PCA显示,除了0 hpe,针的转录组变化发生在三个阶段(图2)。3 c).针叶整体基因表达量在0和3 hpi时发生显著变化,在接近0 hpe时又恢复到正常水平。我们假设这些变化代表了对切除和相应恢复的反应,因为C4簇在0 hpi时达到峰值,参与防御反应的基因最多(GO:0006952;额外的文件6:表S3C)。从1 dpi到1 wpi的整体基因表达变化不大,与针叶中0 hpe的基因表达相似(图2)。3 c而且4摄氏度),而在底部则主动变化(图。3 b而且4 b).这些结果表明,即使在严重事件(如从供体树中切除,立即降低了吸水能力)发生后,插枝的针仍保留了与切除前相似的功能。相反,基因在3和6 wpi的特征性表达变化可能代表植物体的生物学变化。因此,聚类C2、C3和C6在3和6 wpi处显示出特征性变化(图2)。4摄氏度而且5度).其中,C2簇在3 wpi后被抑制,其中与翻译(GO:0006412)、细胞分裂(GO:0051301)、细胞质翻译(GO:0002181)、核糖体生物发生(GO:0042254)、细胞周期调控(GO:0051726)、微管运动(GO:0007018)相关的基因在3 wpi后也被抑制,与脂质分解过程(GO:0016042)、蜡质生物合成过程(GO:0010025)、氧化还原过程(GO:0055114)、角质层发育过程(GO:0042335)、DNA复制启动过程(GO:0006270)、脂肪酸生物合成过程(GO:0006633;额外的文件6:表S3C)。C6簇经3 wpi诱导,富集氧化还原过程相关基因(GO:0055114)和光合作用相关基因(GO:0015979;额外的文件6:表S3B)。在3 wpi和6 wpi时,参与细胞分裂、次生代谢产物的生物合成和分解代谢过程以及光合作用的基因表达发生了显著变化,这表明针叶可能与不定根的形成并非完全无关c .粳稻.
能量代谢相关基因
碳水化合物是生物体的主要能量来源,为细胞生长提供能量,从而对不定根的形成产生强烈影响[7,8,10]先前的研究表明,叶片的光合作用与不定根的形成有关[41,42],尽管不定根形成过程中光合速率的变化因植物种类和被切除的季节而异[17,43,44].在c .粳稻,光合速率适度下降,在固定条件下在生长室生根后恢复[45].在我们的分析中,与光合作用(GO:0015979)、光系统I (GO:0009773)中的光合电子传递以及对光刺激的响应(GO:0009416)相关的基因在C6簇中富集(图9)。6摄氏度,附加文件6:表S3C),在针刺3 wpi后诱导。这些数据表明,在整个诱导期,光合活性没有显著变化c .粳稻.这些结果也表明,碳水化合物不是专门为不定根的形成而产生的,因此扦插的原始光合活性和碳水化合物含量是诱导不定根形成的更重要因素,至少在扦插中是如此c .粳稻.然而,这些基因在3 wpi后的特发性诱导可能代表了碳水化合物对不定根萌生和延伸的影响,值得进一步研究不定根形成过程中的能量代谢。
光合作用相关基因(GO:0015979,图;6 b)和一些相关术语在集群C4(附加文件6:表S3C),并在基底处表达随时间显著逐渐降低。虽然这种减少可能是由于切割插入土壤造成的,但在其他物种的扦插中也得到了类似的发现,如p . contorta[29),豇豆属辐射动物[46),石竹类植物caryophyllus[47],表明光合作用活性下降是与不定根形成相关的生理变化之一[9].此外,三羧酸循环相关基因(GO:0006099,图;6 b),在群集B9中富集(附加文件6:表S3B),上调至3 hpi后维持在同一水平。呼吸途径,包括三羧酸循环,在需氧生物的碳代谢和生物能学中起着核心作用,对所有植物细胞的生长、维持和碳平衡至关重要[48].阿卡米等人[9]揭示了不定根形成过程中三羧酸循环和糖酵解的关键酶和代谢产物活性的变化,并提示了呼吸功能与不定根形成的关系p .矮牵牛.结果表明,光合基因在基部表达减少,三羧酸循环基因在中部表达增加,表明基部向下沉器官的功能转变。因此,这些数据证实不定根的形成是一个需要能量的过程。
植物激素代谢相关基因
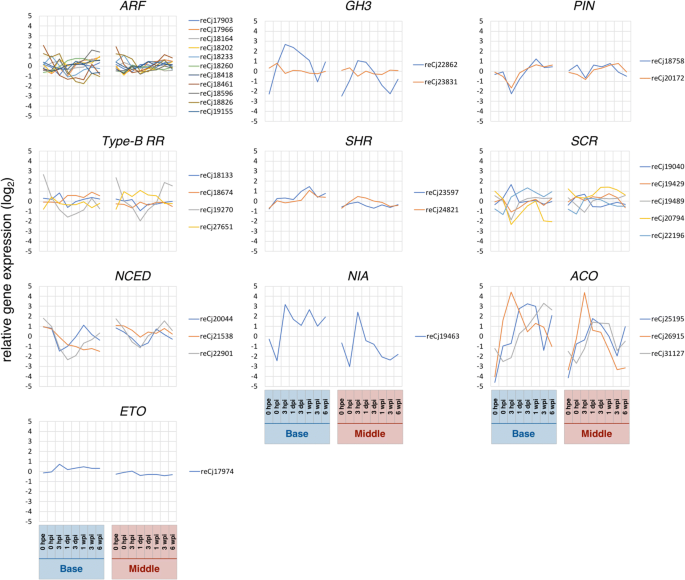
在此,我们提供了植物不定根形成过程中激素代谢的转录组证据c .粳稻.特别是与色氨酸生物合成过程相关的基因(GO:0000162,图。6 b)和对生长素的反应(GO:0009733,图;6 b)在聚类B11中富集,该聚类B11的表达随着时间的推移逐渐增加(附加文件6:表S3B)。生长素极性转运相关基因(GO:0009926,图;6摄氏度)和对生长素的反应(GO:0009733,图;6摄氏度)在聚簇C7中富集,1 dpi后表达量逐渐增加。此外,与生长素激活信号通路相关的基因(GO:0009734,图。6摄氏度)在聚类C8中富集,在3 hpi时表达瞬时下降(附加文件6:表S3C)。集群C7还包括醛氧化酶与生长素生物合成密切相关的基因[49].大量研究表明生长素与不定根形成的发生密切相关[2,3.,4,5,6].此外,加里多等人。31]表明,参与不定根形成的生长素主要是在叶片中通过生长素极性转运途径在转运前合成的d . caryophyllus.在此,有十一个同源词生长素反应因子(东盟地区论坛)被纳入表2’的“base and middle”,这些基因表达谱不同(图2’)。8).这些转录因子调节生长素反应基因的表达,如辅助/ IAA,小生长素向上RNA(阿富汗二月),格雷琴·哈根3(GH3)通过结合生长素诱导基因启动子区域的生长素反应元件,从而发挥转录激活子和抑制子的作用[50].GH3基因被报道为监测生长素浓度变化或细胞对生长素敏感性的分子标记[51],以及Gutierrez等人。[4]表明这些分子通过调节茉莉酸的稳态来影响不定根的形成答:芥.同样,生长素外排载体编码由销形成(销)在不定根的形成中起重要作用[52,53].此外,其中一个GH3同源基因“base and middle”在表2’中,切除后表达量显著增加,支持其作为不定根形成的候选基因c .粳稻(无花果。8).的单一同源物的转录销表2’中“base and middle”的基因在3 hpi时也被显著诱导,此后表达量增加(图2)。8).阿卡米等人[5研究表明,矮牵牛扦插中吲哚-3-乙酸的浓度在前2 hpe时增加,在6 hpe前短暂下降,然后在基部24 hpe时达到最大值,在48 hpe前保持初始水平,此后在叶片中持续增加。虽然不同物种的时间尺度不同,但我们的转录组数据与之前的生化研究结果相比较,表明生长素在不定根形成中起着积极的作用。
细胞分裂素影响生长素信号通路[54,55]并抑制不定根的形成。因此,Villacorta-Martin等人。[47显示细胞分裂素浓度较低反式在0 ~ 54 hpi的香石竹易根无性系中发现-玉米素,表明不定根的形成与生长素和细胞分裂素的比例有关。在我们手中,与细胞分裂素反应相关的基因(GO:0009735,图。6 b)在群集B4中富集(附加文件6:表S3B),并且随着时间的推移在底部逐渐被抑制。此外,还有四个同源词细胞分裂素b型反应调节剂(b RR)被包括在“基本和中间”的列表2中。该基因是细胞分裂素信号的正调控因子,因此是不定根形成的负调控因子[56].我们发现四个同源物中的一个(reCj19270)被极大地抑制直到1 dpi(图。8),表明该同源物与不定根的形成有关c .粳稻.结合生长素响应和细胞分裂素响应相关基因的表达数据,我们的转录组分析表明,生长素和细胞分裂素之间的相互作用对针叶树不定根的形成很重要,这在草本植物中已得到证实[47,56].
植物激素乙烯也与不定根形成过程中的生长素代谢有关[57,58],据报是由伤害[59,60].与细胞分裂素相反,乙烯负调控游离生长素积累,正调控根系生长素转运,负调控枝条生长素转运[61].在本研究中,乙烯代谢相关基因的表达模式被分为三个主要簇;乙烯激活信号通路相关基因(GO:0009873,图;6 b)富集于B8簇,与乙烯生物合成过程相关(GO:0009693,图;6 b),以及与乙烯激活信号通路相关的基因(GO:0009873,图;6 b)在群集B5中富集(附加文件6:表S3B)。在不定根形成过程中,这些基因的表达水平在基部发生了显著的特征性变化,在中间也发生了类似的变化。相反,乙烯生物合成调控同源物的表达模式华而且采访时表示从表2 '中的“base and middle”[62,63,64]底部和中间的位置不同。虽然这些基因在根部的表达水平表明它们与不定根的形成有关系,但还需要进一步的研究来揭示它们与中间基因的作用和相互作用。
不定根形成的其他候选基因
在不定根形成过程中,差异表达基因的功能群及其相关细胞事件已在前面进行了综述[65].在这些人和他们的家人中,SHORT-ROOT(月),稻草人(可控硅),b RR,NINE-CIS-EPOXYCAROTENOID加双氧酶(数控),东盟地区论坛,GH3,销,硝酸还原酶(NIA),1-AMINOCYCLOPROPANE-1-CARBOXYLATE氧化酶(华),乙烯过度生产(采访时表示)被纳入“base and middle”的本表2’中,其基因表达模式及注释如图所示。8和附加文件9分别月而且可控硅是肝家族和参与根干细胞生态位规范和不对称细胞分裂月活动是必要的可控硅表达式[66].这里,两个月同源词和五可控硅同源词包括在表2 '中的“base and middle”。表达月同源体reCj23597除基部和中部在0 hpe处有显著差异外,在水稻不定根的形成中发挥了重要作用c .粳稻.尽管表达水平的改变可控硅同源体在底部和中部的分布相似,但底部的分布更大。
的基因数控编码一种酶,催化降解独联体环氧类胡萝卜素独联体-neoxanthin和独联体-紫黄质转化为黄硫素,是ABA合成的直接前体,因此可以调节ABA的浓度[67,68].数控因此,据报道ABA在不定根形成中具有抑制作用[12];一个番茄突变体,基因中没有突变LeNCED1形成了比野生型更多的不定根[69],且易根无性系和难根无性系切除后内源ABA含量变化差异显著[70].同样,我们观察到恢复表达数控切除后基部同源体明显减少。此外,Abu-Abied等人。[71]的结果表明,不定根形成能力在幼苗向成熟期过渡过程中下降NIA去除后,幼嫩扦插中NO的表达量和相关NO的合成量高于成熟扦插桉树茅.在本研究中NIA3 hpi时,基部和中部均有明显同源性诱导,但仅在基部保持较高水平,中部恢复到原来水平。这些数据支持的重要作用NIA因此在不定根的形成中也会产生NO。
结论
在这项研究中,我们研究了针叶树扦插不定根形成过程中的转录组动态,c .粳稻(无花果。9).然后,我们描述了整个插枝中基因表达的时间变化,并确认了在各种其他植物不定根形成的生物学变化中具有报道作用的基因的表达谱。我们的结果表明扦插根部不定根形成的转录转折点。能量和植物激素代谢相关基因在扦插根部的表达行为基本支持了前人对草本植物生物化学和分子生物学的观察,通过扦插根部和扦插中部表达行为的比较,突出了这些基因在不定根形成中的重要性。在针叶中,基因的整体表达分为三个阶段。针叶中生长素代谢和光合作用相关基因的表达表明,这些基因有助于扦插基部不定根的形成。虽然还需要进一步的生化和生理研究,但我们的研究结果为针叶在不定根形成中的作用提供了转录组的见解c .粳稻.本研究为了解针叶植物不定根形成的生理机制提供了分子生物学基础。
缩写
- 阿坝:
-
脱落酸
- 华:
-
1-Aminocyclopropane-1-carboxylate氧化酶
- 论坛:
-
生长素反应因子
- Cy3:
-
Cyanine-3
- 大卫:
-
注释、可视化和综合发现数据库
- dpi:
-
天的时
- 接受采访时表示:
-
乙烯过度生产
- GH3:
-
格雷琴·哈根3
- 走:
-
基因本体论
- hpe:
-
小时post-excision
- 现病史:
-
个小时时
- nc:
-
Nine-cis-epoxycarotenoid加双氧酶
- NIA:
-
硝酸还原酶
- 没有:
-
一氧化氮
- 主成分分析:
-
主成分分析
- 销:
-
销形成
- 阿富汗二月:
-
Aux/iaa,小生长素向上rna
- 可控硅:
-
稻草人
- 月:
-
Short-root
- b RR:
-
细胞分裂素b型反应调节剂;wpi:插入数周后
参考文献
- 1.
Bellini C, Pacurar DI, Perrone I.不定根和侧根:异同。植物学报。2014;65:639-66。
- 2.
德克勒克GJ,范德克里肯W,德容JC。回顾不定根的形成:新概念,新可能性。中国生物医学工程学报。1999;35(3):189-99。
- 3.
Pop TI、Pamfil D、Bellini C.生长素对不定根形成的控制作用。机械工程学报。2011;39(1):307-16。
- 4.
Gutierrez L, Mongelard G, Floková K, pcurar DI, Novák O, Staswick P, Kowalczyk M, pcurar M, Demailly H, Geiss G, Bellini C.生长素通过调控茉莉酸稳态控制拟南芥不定根发生。植物学报。2012;24(6):2515-27。
- 5.
Ahkami AH, Melzer M, Ghaffari MR, Pollmann S, Javid MG, Shahinnia F, Hajirezaei MR, Druege u佩妮矮牵牛笋尖扦插及生长素转运、碳水化合物代谢与不定根形成的关系。足底。2013;238(3):499 - 517。
- 6.
Pacurar DI, Perrone I, Bellini C.生长素是控制不定根的激素交叉对话的中心参与者。植物科学进展。2014;29(3):344 - 344。
- 7.
Haissig。性成熟扦插繁殖过程中碳水化合物的关系松果体banksiana树。树物理学报。1989;5(3):319-28。
- 8.
李淑梅,梁德敏。淀粉积累与水稻下胚轴扦插不定根形成有关松果体放射虫纲.植物生长学报,2000;19(4):423-8。
- 9.
Ahkami AH, Lischewski S, Haensch KT, Porfirova S, Hofmann J, Rolletschek H, Melzer M, Franken P, Hause B, Druege U, Hajirezaei先生不定根形成的分子生理学佩妮矮牵牛插枝:涉及伤口反应和初级代谢。中国植物学报,2009;26(3):344 - 344。
- 10.
Klopotek Y, Haensch KT, Hause B, Hajirezaei MR, Druege U.矮牵牛扦插的黑暗暴露强烈地促进不定根的形成,并提高在光照下生根时碳水化合物的有效性。植物营养学报,2010;29(3):344 - 344。
- 11.
李文文,薛乐林,徐世杰,冯海燕,安立忠。不定根中的介质、基因和信号。机器人学报。2009;75(2):230-47。
- 12.
da Costa CT, de Almeida MR, Ruedell CM, Schwambach J, Maraschin FS, Fett-Neto AG。当压力和发育密切相关时:扦插不定根的主要激素控制。植物科学进展(英文版);
- 13.
Steffens B . Rasmussen A.不定根的生理学。中国生物医学工程学报,2016;30(2):344 - 344。
- 14.
杜瑞杰,李志刚,李志刚。扦插不定根形成过程中植物激素稳态、信号通路和功能的研究。前沿植物科学,2016;7:381。
- 15.
Sorin C, Bussell JD, Camus I, Ljung K, Kowalczyk M, Geiss G, McKhann H, Garcion C, Vaucheret H, Sandberg G, Bellini C.拟南芥生长素和光控制不定根需要ARGONAUTE1。植物学报。2005;17(5):1343-59。
- 16.
犬海Y,坂本T,上口田中M,柴田Y,果美K,梅村I,长谷川Y,足光M,北野H,松冈M。皇冠rootless1它是水稻冠根形成所必需的,是生长素信号通路中生长素响应因子的一个靶点。植物学报。2005;17(5):1387-96。
- 17.
Klopotek Y, Franken P, Klaering HP, Fischer K, Hause B, Hajirezaei MR, Druege U.根区较高的下沉竞争力和转化酶参与了暗刺激不定根的形成佩妮矮牵牛岩屑。植物科学进展(英文版);
- 18.
Alba R, Fei Z, Payton P, Liu Y, Moore SL, Debbie P, Cohn J, D'Ascenzo M, Gordon JS, Rose JKC, Martin G, Tanksley SD, Bouzayen M, Jahn MM, Giovannoni J. ESTs, cDNA微阵列和基因表达谱:解剖植物生理和发育的工具。植物学报,2004;39(5):697-714。
- 19.
全哲,孟S,郭恩恩,张松,赵忠,杨晓涛。新创外源吲哚-3-丁酸诱导四倍体刺槐扦插不定根发育的测序和转录组比较分析。BMC Genomics. 2017;18:179。
- 20.
Ahkami A, Scholz U, Steuernagel B, Strickert M, Haensch KT, Druege U, Reinhardt D, Nouri E, von Wirén N, Franken P, Hajirezaei MR.综合转录组分析揭示了在不定根形成过程中调节初级代谢的关键基因的存在佩妮矮牵牛.公共科学学报,2014;9(6):e100997。
- 21.
杨晓明,杨晓明,杨晓明,González-Martínez SC.植物重组对杂合度的贡献在不同进化谱系和生命形态中存在差异。中国生物医学工程学报。2010;10:22。
- 22.
里奇。针叶树根插枝在林业中的商业利用:世界概况。新杂志。1991;5(3):247-75。
- 23.
户田。日本林木改良的无性繁殖研究。《科学新热忱》,1974;4(2):410-7。
- 24.
关于日本各种族之间的关系日本柳杉粳稻它们的根在插枝中形成。九州大学学报(自然科学版)1951;13:277-81。(在日本)
- 25.
Satoo T,根岸K,中村K.生根与扦插树木年龄的关系。克隆实验利用克隆材料进行的实验学报学报,1953;35(3):69-70。(在日本)
- 26.
Jull LG, Warren SL, Blazich FA。受生长阶段、分枝顺序和IBA处理影响的“吉野”隐柳杉茎插枝Hortscience。1994;29(12):1532 - 5。
- 27.
涩谷T、谷口T、筑田S、盐崎S、板垣K.日本雪松不定根形成(日本柳杉粳稻D. Don)通过将岩屑的基部浸泡在温水中,同时冷却其顶端部分来刺激岩屑。新森林,2014;45(4):589-602。
- 28.
柳杉扦插不定根的起源。东京大学1948;36:55-62。(在日本)
- 29.
刘文华,刘文华,刘文华,李志强,刘文华。植物不定根发育过程中基因表达的分析松果体contorta.植物科学进展。2004;35(3):344 - 344。
- 30.
韩辉,孙晓明,谢玉华,冯军,张国光。杂交落叶松不定根发育的转录组和蛋白质组分析(落叶松属kaempferi×落叶松属olgensis).BMC植物生物学。2014;14:305。
- 31.
Garrido G, Guerrero JR, Cano EA, Acosta M, Sánchez-Bravo J.香石竹扦插生根IAA的起源和基部转运。中国生物医学工程学报。2002;29(2):344 - 344。
- 32.
威尔克森EG,盖茨RS,佐尼尔S,凯斯特ST,吉内夫RL。一品红扦插在不同生根阶段的蒸腾能力和扦插系数的制定。环境科学学报,2005;30(3):344 - 344。
- 33.
叶比与不定根率的关系日本柳杉粳稻.九州J为决议1959;12:29-30。(在日本)
- 34.
赤石竹难根无性系生根试验日本柳杉粳稻.九州J为决议1966;20:13-5。(在日本)
- 35.
黑木S.生根试验日本柳杉粳稻(1)愈伤组织形成与光照强度的关系。九州J For Res. 1967; 21:55-6。(在日本)
- 36.
三岛K,平尾T, Tsubomura M,田村M,栗田M, Nose M, Hanaoka S,高桥M, Watanabe A.日本雪松雄性不育新致病基因和遗传标记的鉴定(日本柳杉粳稻D.Don)。BMC基因组学。2018;19:277。
- 37.
黄DW, Sherman BT, Lempicki RA。利用DAVID生物信息学资源对大型基因列表进行系统和综合分析。网络学报。2009;4(1):44-57。
- 38.
Mishima K, Fujiwara T, Iki T, Kuroda K, Yamashita K, Tamura M, Fujisawa Y, Watanabe A.日本雪松形成层和分化木质部表达基因的转录组测序和分析(日本柳杉粳稻).BMC Genomics. 2014;15:219。
- 39.
Nose M, Watanabe A.日本雪松夏季和冬季时钟基因和昼夜转录组动态(日本柳杉粳稻(L.f)。D.Don)。BMC植物生物学。2014;14:308。
- 40.
Kevers C, Hausman JF, Faivre-Rampant O, Evers D, Gaspar T.激素控制不定根:进展与问题。应用物理学报,1997;29(3):344 - 344。
- 41.
李文杰,李文杰,李文杰。植物生长过程中碳水化合物有效性、光合作用和不定根形成的相互作用天竺葵属植物岩屑。植物科学进展,2005;26(6):344 - 344。
- 42.
Tombesi S, Palliotti A, Poni S, Farinelli D.扦插不定根形成过程中光、笋发育阶段对叶片光合作用和碳水化合物状态的影响Corylus avellanaL.前沿植物科学,2015;6:973。
- 43.
Machida H, Ooishi A, Hosoi T, Komatsu H, Kamota F.扦插繁殖过程中光合作用的研究:一、几种植物扦插种植后表观光合作用速率的变化。J Jpn Soc。科学通报1977;46(2):274-82。(在日本)
- 44.
Smalley TJ, Dirr MA, Armitage AM, Wood BW, Teskey RO, Severson RF。块茎扦插生根过程中光合作用和叶片水分、碳水化合物及激素状态宏碁石.植物生态学报,2001;26(6):344 - 344。
- 45.
根岸浩,李志强,李志强,等。杉属植物光合作用、呼吸作用与储备消耗的研究(日本柳杉粳稻)岩屑。学报学报,1956;38(2):63-70。(在日本)
- 46.
李文文,史文峰,冷云。新创利用RNA-Seq对绿豆转录组的特征和幼苗不定根的转录组分析。公共科学学报。2015;10(7):e0132969。
- 47.
Villacorta-Martín C, Sánchez-García AB, Villanova J, Cano A, van de Rhee M, de Haan J, Acosta M, Passarinho P, Pérez-Pérez JM。石竹茎扦插不定根形成过程中的基因表达谱。BMC基因组学。2015;16:789。
- 48.
Plaxton WC, Podestá FE。植物呼吸的功能组织和控制。中国植物科学,2006;25(2):159-98。
- 49.
徐敏,李志刚,李志刚,李志刚,李志刚,李志刚。植物生长素过量产生过程中醛氧化酶活性的研究superroot1突变体的拟南芥.植物科学进展。1998;36(2):366 - 366。
- 50.
黄志刚,张志刚,张志刚,等。植物生长素应答因子域在植物生长素应答转录中的作用。植物学报。2003;15(2):533-43。
- 51.
李艳,吴永华,李永华,李永华。植物生长素诱导GH3启动子/GUS融合基因的表达及其在植物生长素生理中的应用。植物生理学报。1999;40(7):675-82。
- 52.
刘素萍,王俊杰,王玲,王晓峰,薛玉华,吴鹏,寿海霞。水稻不定根的形成需要OsGNOM1,并由OsPINs家族介导。Cell res 2009;19(9): 1110-9。
- 53.
苏库玛P,马洛尼GS,穆迪GK。atp结合盒B19生长素转运体的局部诱导增强了拟南芥不定根的形成。中国生物医学工程学报,2013;29(3):344 - 344。
- 54.
Müller B, Sheen J.细胞分裂素和生长素在早期胚胎发生过程中根干细胞规范的相互作用。大自然。2008;453(7198):1094 - 7。
- 55.
李文杰,李志强,李志强。细胞分裂素-生长素串扰。植物科学进展,2009;14(10):557-62。
- 56.
Ramírez-Carvajal GA, Morse AM, Dervinis C, Davis JM。细胞分裂素b型反应调节因子PtRR13是植物不定根发育的负调控因子杨树.植物科学进展。2009;30(2):339 - 344。
- 57.
Druege U, Franken P, Lischewski S, Ahkami AH, Zerche S, Hause B, Hajirezaei MR.转录组分析表明乙烯是矮牵牛扦插不定根形成的刺激因子,生长素是调节因子。植物科学进展(英文版);
- 58.
Veloccia A, Fattorini L, Della Rovere F, Sofo A, D'angeli S, Betti C, Falasca G, Altamura MM.乙烯与生长素相互作用对不定根的控制拟南芥.中国生物医学工程学报,2016;26(3):344 - 344。
- 59.
郑艳华,张海生,王霞,朱涛,栾山。拟南芥损伤、病原、非生物胁迫和激素反应的转录谱分析。植物科学进展。2002;29(2):366 - 366。
- 60.
王克昌,李华,艾克尔JR.乙烯生物合成与信号网络。《植物科学》2002;14:S131-51。
- 61.
李国强,李国强,李国强,李国强。乙烯在调节番茄生长素依赖的侧根和不定根形成中的作用的遗传解剖。植物学报,2010;36(1):1 - 5。
- 62.
王克昌,吉田,吕林,Ecker JR.乙烯气体生物合成的调控拟南芥ETO1蛋白质。大自然。2004;428:945-50。
- 63.
吉田H,永田M,齐藤K,凯文WLC,埃克JR。拟南芥ETO1与2型1-氨基环丙烷-1-羧酸合酶特异性相互作用并负调控。BMC植物生物学,2005;5:14。
- 64.
christian MJ, Gingerich DJ, Hansen M, Binder BM, Kieber JJ, Vierstra RD. BTB泛素连接酶ETO1, EOL1和EOL2通过控制2型ACC合成酶水平共同调控拟南芥乙烯生物合成。植物学报(英文版);2009;
- 65.
管玲,Murphy AS, Peer WA,甘丽娟,李勇,程志明。不定根形成的生理和分子调控。中国植物科学,2015;34(5):506-21。
- 66.
Helariutta Y, Fukaki H, wysokka - diller J, Nakajima K, Jung J, Sena G, Hauser MT, Benfey PN。的SHORT-ROOT基因控制的径向模式拟南芥通过径向信号。细胞。2000;101(5):555 - 67。
- 67.
Iuchi S, Kobayashi M, Taji T, Naramoto M, Seki M, Kato T, Tabata S, Kakubari Y, Yamaguchi-Shinozaki K, Shinozaki K. 9-基因调控对抗旱性的调控独联体-环氧类胡萝卜素双加氧酶是脱落酸生物合成中的关键酶拟南芥.植物学报,2001;27(4):325-33。
- 68.
熊林林,朱建科。脱落酸生物合成的调控。植物科学进展。2003;33(1):29-36。
- 69.
Thompson AJ, Thorne ET, Burbidge A, Jackson AC, Sharp RE, Taylor IBnotabilis,一个番茄脱落缺酸突变体:序列上下文的重要性和部分互补的效用。植物细胞环境。2004;27(4):459-71。
- 70.
李志强,李志强,李志强。苹果微插枝内源吲哚-3-乙酸和脱落酸与不定根形成的关系。植物生长学报。1992;11(1):63-7。
- 71.
Abu-Abied M, Szwerdszarf D, Mordehaev I, Levy A, Rogovoy Stelmakh O, Belausov E, Yaniv Y, Uliel S, Katzenellenbogen M, Riov J, Ophir R, Sadot E.微阵列分析显示,大桉幼枝扦插中硝酸盐还原酶的上调与一氧化氮生成和不定根形成有关。植物学报,2012;26(5):344 - 344。
确认
我们感谢FTBC的Mine Nose博士和Soichiro Nagano博士对我们的研究进行了有益的讨论、评论和建议。
资金
本研究由中国林业与林产研究所资助。
数据和材料的可用性
微阵列数据已提交给NCBI基因表达综合(GEO;http://www.ncbi.nlm.nih.gov/geo/),登记编号为GSE102874。
作者信息
从属关系
贡献
AW构思并监督了这项研究。YF, TH和KM设计了实验。YF、TH、KM、MO、YH和MT制备植物材料。YF进行实验,分析数据并起草手稿。TH, KM, MO, YH和MT帮助分析数据并起草手稿。所有作者都协助了稿件的准备工作,并阅读并批准了最终稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
附加文件
附加文件1:
图S1。基于qRT-PCR的微阵列数据验证。柱状表示三个生物重复的平均值±标准差。(docx142 kb)
附加文件2:
图S2。中间采用qRT-PCR验证芯片数据。柱状表示三个生物重复的平均值±标准差。(docx143 kb)
附加文件3:
图S3。用qRT-PCR方法验证针叶芯片数据。柱状表示三个生物重复的平均值±标准差。(docx141kb)
附加文件4:
表S1。qRT-PCR分析引物。(xlsx10kb)
附加文件5:
表S2。(A)“all”,(B)“base and middle”和(C)“needles”基因簇注释。(xlsx1006 kb)
附加文件6:
表S3。(A)“所有”,(B)“基本和中间”和(C)“针”中的功能注释。(xlsx22 kb)
附加文件7:
表S4。PC1系数最大的前100个基因的注释。(xlsx16kb)
附加文件8:
表S5。PC1最大的前100个基因的功能富集注释。(xlsx10kb)
附加文件9:
表S6。表2’中“base and middle”的不定根形成相关基因的注释。基因名称由DAVID给出。(xlsx11kb)
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
福田,Y,平尾,T,三岛,K。et al。扦插不定根形成过程中生根区和地上部分转录组动态日本柳杉粳稻d .堂。BMC植物生物学18日,201(2018)。https://doi.org/10.1186/s12870-018-1401-7
收到了:
接受:
发表:
关键字
- 日本柳杉粳稻
- 不定根形成
- 转录组
- 针叶树
- 针
- 微阵列