- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
拟南芥乙烯反应因子8 (ERF8)在ABA信号转导和免疫中具有双重功能gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba18gydF4y2Ba,文章号:gydF4y2Ba211gydF4y2Ba(gydF4y2Ba2018gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
乙烯反应因子(ERF) 8是植物中最大的转录因子家族之一,aptala2 /乙烯反应因子(AP2/ERF)超家族的成员。这个超级家族的成员已经涉及到各种各样的过程,如发展和环境应激反应。gydF4y2Ba
结果gydF4y2Ba
在这项研究中,我们证明了ERF8参与ABA和免疫信号的传递。ERF8过表达在拟南芥中诱导程序性细胞死亡(PCD)gydF4y2Ba烟草benthamiana。gydF4y2Ba这种PCD不依赖于水杨酸(SA),表明ERF8在下游或不依赖于SA。ERF8诱导的PCD被erf相关的两亲性抑制(EAR) motif的突变所消除,这表明ERF8通过其转录抑制活性诱导细胞死亡。两种免疫相关的丝裂原激活蛋白激酶,丝裂原激活蛋白激酶4 (MPK4)和MPK11被鉴定为ERF8相互作用蛋白,并在体外直接磷酸化ERF8。在ERF8中发现了四个推测的MPK磷酸化位点,其中一个(Ser103)在体外被确定为主要的磷酸化残基,而所有四个推测的磷酸化位点的突变都被部分抑制gydF4y2BaERF8gydF4y2Ba-诱导细胞死亡gydF4y2Ban benthamianagydF4y2Ba.全基因组转录组分析和病原体生长分析证实了ERF8在介导免疫中的积极作用,如gydF4y2BaERF8gydF4y2Ba敲低或过表达系对半生物细菌病原体的抗性减弱或增强gydF4y2Ba两gydF4y2Ba,分别。gydF4y2Ba
结论gydF4y2Ba
这些数据揭示了ABA诱导的转录抑制因子ERF8在ABA信号转导和病原体防御中具有双重作用,进一步强调了ABA在植物-微生物相互作用中的复杂影响。gydF4y2Ba
背景gydF4y2Ba
复杂的细胞信号通路控制着植物对不同环境刺激的反应。植物激素水杨酸(SA)、乙烯和茉莉酸(JA)在植物免疫中发挥重要作用[gydF4y2Ba1gydF4y2Ba].特别是,SA在促进对生物营养性病原体的防御反应中发挥着充分证明的关键作用[gydF4y2Ba2gydF4y2Ba].其他植物激素的防御相关作用,包括生长素、赤霉素酸(GA)和脱落酸(ABA),虽然特征较少,但也有文献记载[gydF4y2Ba1gydF4y2Ba].特别是ABA,它被彻底地描述为既能调节对干旱、盐度和寒冷等非生物胁迫的反应,也能调节如萌发等发育过程[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba];然而,最近的证据表明ABA在调节植物免疫方面也起着复杂的作用[gydF4y2Ba5gydF4y2Ba].gydF4y2Ba
免疫相关表型先前已记录了几个ABA相关突变体,包括ABA受体gydF4y2Ba耐Pyrabactin类8gydF4y2Ba(gydF4y2BaPYL8gydF4y2Ba),gydF4y2BaPYL10gydF4y2Ba而且gydF4y2BaPYL11gydF4y2Ba,即蛋白质磷酸酶2C (PP2C)gydF4y2Ba对aba1过敏gydF4y2Ba(gydF4y2BaHAB1gydF4y2Ba),gydF4y2Basnf1相关激酶2.6gydF4y2Ba(gydF4y2BaSNRK2.6gydF4y2Ba),以及ABA生物合成基因gydF4y2BaAba缺乏1gydF4y2Ba(gydF4y2BaABA1gydF4y2Ba),gydF4y2BaABA2gydF4y2Ba而且gydF4y2BaABA3gydF4y2Ba[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba].ABA对植物-病原菌互作结果的影响还取决于研究的病理系统、ABA的施用方法、病原菌侵染的方式和阶段等诸多因素[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba].虽然ABA影响免疫的分子机制尚不清楚[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba9gydF4y2Ba],已报道ABA与SA信号通路之间存在多个拮抗点,提示ABA可能通过抑制SA信号通路来抑制免疫[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba].虽然ABA-SA的拮抗作用可能来自于多个串音点[gydF4y2Ba15gydF4y2Ba],对这些观点的实证研究仍然很少。因此,对ABA-SA拮抗作用的精细理解可以为非生物和生物胁迫信号通路之间的平衡提供有价值的见解。gydF4y2Ba
植物能够通过一套细胞表面模式识别受体(PRRs)识别保守的微生物或病原体相关的分子模式(分别为MAMPs或PAMPs)来防御大多数微生物[gydF4y2Ba16gydF4y2Ba].MAMPs/PAMPs的同源PRRs识别激活了细胞内信号的级联,最终导致模式触发免疫(PTI),这足以防止大多数潜在致病微生物的增殖[gydF4y2Ba16gydF4y2Ba].为了保持毒性,一些病原体进化出了效应蛋白,扰乱宿主细胞进程,最终抑制防御。半生物细菌病原体gydF4y2Ba两gydF4y2Ba例如,利用III型分泌系统将效应器输送到植物细胞[gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba],植物激素信号通路已被确定为多种病原体效应物的靶点[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba19gydF4y2Ba].例如,gydF4y2Bap .两gydF4y2Ba效应子AvrPtoB和HopAM1激活ABA信号通路以促进细菌毒力,尽管其具体的分子机制尚不清楚[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba].植物-病原体相互作用的结果在很大程度上取决于植物直接或间接识别效应蛋白的能力,因为这种识别引发了第二层防御反应,称为效应蛋白触发免疫(ETI) [gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba].针对生物营养病原体的特征性ETI反应是在感染部位建立强大的程序性细胞死亡(PCD),称为超敏反应(HR),这被认为可以隔离死亡细胞簇中的入侵病原体并防止全身感染[gydF4y2Ba24gydF4y2Ba].gydF4y2Ba
转录因子是参与非生物和生物胁迫响应的信号通路中至关重要的共同元素[gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba].aptala2 /乙烯响应因子(AP2/ERF)转录因子超家族是植物中最大的转录因子家族之一,其特征是具有一个或多个保守的n端ERF DNA结合域。这个超级家族的成员在各种各样的过程中都有牵连,包括发育和环境应激反应,以及激素信号和病原体防御[gydF4y2Ba25gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba].值得注意的是,ERF家族中第VII、VIII组和主要是第IX组的特定成员已被证明在拟南芥免疫中发挥作用[gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba].第II类ERF转录抑制因子是第VIII类ERF (a亚组)的一部分,以植物中最丰富的抑制基序之一为特征,即ERF相关的两亲性抑制(EAR)基序-L/FDLNL/F(x)P [gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba].在拟南芥中,这一小群含有EAR基序的ERFs有8个成员,功能表征有限。ERF4有助于衰老(与ERF8一起)以及对坏死性真菌病原体的敏感性gydF4y2Ba尖孢镰刀菌gydF4y2Ba[gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba], ERF9有助于抵抗坏死真菌,gydF4y2Ba葡萄孢菌gydF4y2Ba[gydF4y2Ba38gydF4y2Ba],而ERF7和ERF11可能分别是ABA或乙烯和GA信号转导中的转录抑制因子复合物的一部分[gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba].有趣的是,这个亚家族的一个成员ERF8是由ABA转录调节的蛋白质-蛋白质相互作用复杂网络的一部分[gydF4y2Ba42gydF4y2Ba],因此有望在ABA信号传导中发挥作用。gydF4y2Ba
在这里,我们证明了ERF8在aba介导的反应和免疫中的作用。我们发现ERF8的过表达足以诱导pcd样细胞死亡,并且ERF8正调控对pcd的免疫gydF4y2Bap .两gydF4y2Ba.此外,ERF8与两种免疫相关的丝裂原活化蛋白激酶(MPKs) MPK4和MPK11相互作用并被其磷酸化。MPK4和MPK11都被细菌PAMPs激活[gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba],而MPK4也被证明对许多sa依赖的病原体防御反应很重要[gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba,gydF4y2Ba47gydF4y2Ba].RNA-Seq分析显示,ERF8过表达导致ABA信号通路、病原体防御和细胞死亡调控相关基因的转录改变。因此,ERF8代表了aba介导的非生物应激反应和sa介导的病原体防御之间的潜在串扰点。gydF4y2Ba
结果gydF4y2Ba
ERF8是aba介导反应的负调控因子gydF4y2Ba
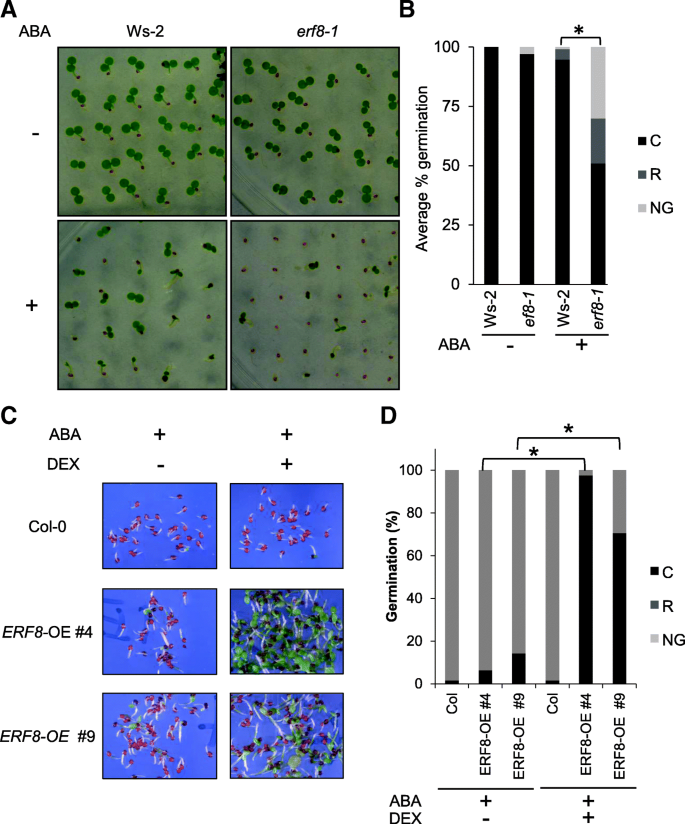
ERF8先前已被证明是转录调控的ABA相互作用组网络的一个组成部分[gydF4y2Ba42gydF4y2Ba],提示其在ABA信号传导中起作用。此外,微阵列数据显示gydF4y2BaERF8gydF4y2Ba萌发期间的表达(附加文件gydF4y2Ba1gydF4y2Ba) [gydF4y2Ba48gydF4y2Ba].因此,为了研究ERF8在ABA信号通路中的作用,采用ABA介导的种子萌发抑制实验gydF4y2BaERF8gydF4y2Ba功能获得和功能丧失突变种子。对于这些分析,我们使用了确认gydF4y2BaERF8gydF4y2Ba击倒线[gydF4y2Ba36gydF4y2Ba],以下简称为gydF4y2Baerf8-1gydF4y2Ba(Ws-2背景),以及地塞米松(DEX)诱导gydF4y2BaERF8gydF4y2Ba过表达线(gydF4y2BaERF8-OE,gydF4y2BaCol-0背景)。Western blot检测证实DEX处理后这些细胞系ERF8表达过高(附加文件gydF4y2Ba1 bgydF4y2Ba).如图所示。gydF4y2Ba1gydF4y2Ba,gydF4y2Baerf8-1gydF4y2Ba种子对ABA的敏感性增加(图;gydF4y2Ba1 a, bgydF4y2Ba),而gydF4y2BaERF8-OEgydF4y2Ba种子敏感性降低(图;gydF4y2Ba1 c, dgydF4y2Ba),表明ERF8在aba介导的萌发和幼苗建立中起负作用。gydF4y2Ba
的种子gydF4y2BaERF8gydF4y2Ba击倒(gydF4y2Baerf8-1gydF4y2Ba)和过表达式行(gydF4y2BaERF8-OE)gydF4y2BaABA敏感性改变gydF4y2Ba.gydF4y2BaWildtype Ws-2和gydF4y2Baerf8-1gydF4y2Ba将敲除的种子播种在0.5 X MS琼脂板上,添加或不添加0.8 μM ABA。(gydF4y2Ba一个gydF4y2Ba)分层后5 d光照24 h下的代表性种子种群(dps)。(gydF4y2BabgydF4y2Ba) 5 dps两次重复的平均发芽率。该图描述了未发芽(NG)、胚根(R)或子叶(C)萌发的种子的比例。(gydF4y2BacgydF4y2Ba) DEX-inducible的两个独立系gydF4y2Ba小块土地gydF4y2Ba8 -gydF4y2BaOEgydF4y2Ba在1 μM ABA和50 nM DEX的存在下种子都能萌发。(gydF4y2BadgydF4y2Ba) DEX-inducible的两个独立系gydF4y2Ba小块土地gydF4y2Ba8 -gydF4y2BaOEgydF4y2Ba在添加1 μM ABA和50 nM DEX的条件下,种子都能萌发。平均发芽率14dpsgydF4y2BapgydF4y2Ba≤0.01gydF4y2Ba
ERF8过表达可诱导南芥和南芥程序性细胞死亡(PCD)gydF4y2Ba
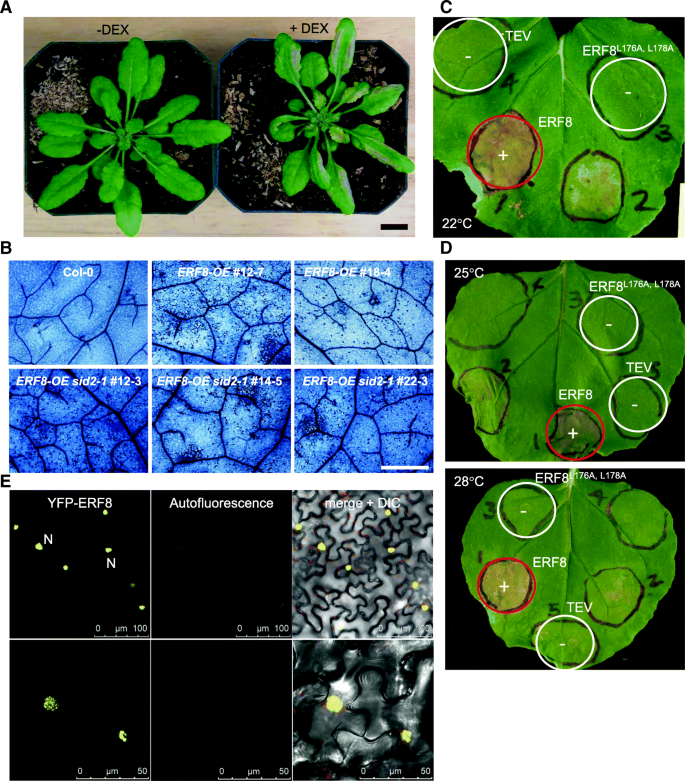
的本构表达式gydF4y2BaERF8gydF4y2Ba导致子叶和真叶受损,并与开花前较高的过早死亡率有关[gydF4y2Ba36gydF4y2Ba].因此,我们鉴定了dex诱导的细胞死亡与ERF8相关gydF4y2BaERF8-OEgydF4y2Ba行。如图所示。gydF4y2Ba2gydF4y2Ba, DEX治疗后2天,微观和宏观PCD均清晰可见(图;gydF4y2Ba2 a, bgydF4y2Ba).此外,还观察到细胞死亡诱导gydF4y2Ba农杆菌属gydF4y2Ba-介导的ERF8短暂过表达gydF4y2Ba烟草benthamianagydF4y2Ba浸润后3天(图;gydF4y2Ba2摄氏度gydF4y2Ba).HR细胞死亡是一种描述良好的、sa依赖的与防御相关的PCD形式,通常在感染无毒的生物营养型和半生物营养型病原体后观察到[gydF4y2Ba49gydF4y2Ba,gydF4y2Ba50gydF4y2Ba].为了测试ERF8诱导的细胞死亡的sa依赖性,dex诱导的ERF8过表达系与gydF4y2Ba水杨酸诱导不足gydF4y2Ba2 (gydF4y2Basid2-1)gydF4y2Ba突变体。有趣的是,ERF8gydF4y2Ba-gydF4y2Ba诱导PCD的发生程度相似gydF4y2Basid2-1gydF4y2Ba如Col-0野生型背景植物(图。gydF4y2Ba2 bgydF4y2Ba),将ERF8定位在下游或独立于SA生物合成。为了证实这一发现,我们接下来测试了erf8诱导的细胞死亡的温度敏感性。以前的研究表明,升高的温度可以抑制发育gydF4y2Ba电阻gydF4y2Ba(gydF4y2BaRgydF4y2Ba)基因介导的HR [gydF4y2Ba51gydF4y2Ba],以及许多sa依赖的自身免疫突变体,如gydF4y2Banpr1-1的抑制因子,本构1gydF4y2Ba(gydF4y2Basnc1gydF4y2Ba),gydF4y2Ba抑制水杨酸不敏感4gydF4y2Ba(gydF4y2Bassi4)gydF4y2Ba,gydF4y2BaPR基因的本构表达体22gydF4y2Ba(gydF4y2Bacpr22gydF4y2Ba)显示在适度升高的温度(即28°C)下,免疫反应受到抑制,包括类似hr的自发细胞死亡[gydF4y2Ba51gydF4y2Ba],表明温度与HR细胞死亡之间存在联系。erf8诱导细胞死亡gydF4y2Ban benthamianagydF4y2Ba然而,不受升高温度(28°C)的影响(图。gydF4y2Ba二维gydF4y2Ba),证实ERF8可能作用于下游或独立于SA积累。gydF4y2Ba
表达的gydF4y2BaERF8gydF4y2Ba引发程序性细胞死亡(PCD)。(gydF4y2Ba一个gydF4y2Ba) dex诱导的过表达gydF4y2BaERF8gydF4y2BaDEX处理48 h后,诱导转基因拟南芥细胞死亡。比例尺= 1厘米(gydF4y2BabgydF4y2Ba的dex诱导表达gydF4y2BaERF8gydF4y2Ba在col0和gydF4y2Basid2-1gydF4y2Ba背景导致拟南芥PCD。叶片从Col-0和各种dex诱导gydF4y2BaERF8-OEgydF4y2Ba用30 μM DEX喷纹,台盼蓝染色。DEX治疗后2天拍摄图像。比例尺= 1毫米。(gydF4y2BacgydF4y2Ba)野生型ERF8,但不是ERF8gydF4y2BaL176A, L178AgydF4y2Ba引起强烈的细胞死亡gydF4y2Ban benthamianagydF4y2Ba.接种后6天(dpi)(+/红圈=细胞死亡,- /白圈=无细胞死亡)。(gydF4y2BadgydF4y2Ba) ERF8过表达诱导小鼠细胞死亡gydF4y2Ban benthamianagydF4y2Ba在25°C和28°C 3 dpi。(gydF4y2BaegydF4y2Ba), yfp标记的瞬时表达gydF4y2BaERF8gydF4y2Ba在gydF4y2Ban benthamianagydF4y2Ba定位于核(例如标记为N的核)。比例尺顶部= 100 μm,底部= 50 μmgydF4y2Ba
EAR motif是erf8诱导的细胞死亡所必需的gydF4y2Ba
绪方等人[gydF4y2Ba52gydF4y2Ba]报道了包括ERF8在内的几种含EAR基序的erf的瞬时表达诱导的细胞死亡gydF4y2Ba烟草gydF4y2Ba.c端EAR motif已被证明对其转录抑制功能至关重要[gydF4y2Ba35gydF4y2Ba,gydF4y2Ba53gydF4y2Ba].鉴于ERF8中存在这种EAR motif,我们开始确定ERF8的转录抑制因子活性是否是其促进细胞死亡功能所必需的。ERF8瞬时表达于gydF4y2Ban benthamianagydF4y2Ba当黄色荧光蛋白(YFP)融合时,我们在核内观察到清晰的信号,正如预期的转录抑制因子(图。gydF4y2Ba2 egydF4y2Ba,最高)。高倍率图像显示,ERF8并不是均匀分布在细胞核中,而是分布在离散的核体中(图2)。gydF4y2Ba2 fgydF4y2Ba,底部)。类似的模式在ERF4和TCP14 TCP (TEOSINTE BRANCHED1, CYCLOIDEA, prolifising CELL FACTORS 1和2)中也有报道,并提示这些是蛋白质失活和降解的位点[gydF4y2Ba54gydF4y2Ba,gydF4y2Ba55gydF4y2Ba].gydF4y2Ba
EAR序列中双亮氨酸向丙氨酸突变(L/FDLNL/F(x)P [gydF4y2Ba56gydF4y2Ba,gydF4y2Ba57gydF4y2Ba],用于破坏EAR基序的功能(ERF8gydF4y2BaL176A / L178AgydF4y2Ba)(图。gydF4y2Ba3gydF4y2Ba).虽然L176A/L178A突变不影响ERF8-YFP的核定位(附加文件gydF4y2Ba2gydF4y2Ba),它消除了ha标记的ERF8诱导细胞死亡的能力(图。gydF4y2Ba2 c, dgydF4y2Ba).Western blotting证实了ERF8gydF4y2BaL176A / L178AgydF4y2Ba表达与野生型ERF8相比没有减少(附加文件gydF4y2Ba2 bgydF4y2Ba),以及ERF8gydF4y2BaL176A / L178AgydF4y2Ba最终积累到高于野生型ERF8的水平,因为后者诱导细胞死亡。有趣的是,据报道,杨树转录抑制因子PtiZFP1的EAR基序部分重叠于MAP激酶的二部对接位点(R/K)。gydF4y2BangydF4y2BaXgydF4y2BangydF4y2Ba(LXL),也存在于VIIIa组erf的C端[gydF4y2Ba58gydF4y2Ba].为了区分通过EAR motif或ERF8潜在的激酶对接/相互作用功能的转录抑制是否对细胞死亡诱导重要,ERF8和ERF8的能力gydF4y2BaL176A / L178AgydF4y2Ba与MAP激酶相互作用。在这项分析中,使用了MPK11,因为它之前在酵母双杂交(Y2H)试验中被确定为ERF8相互作用蛋白(附加文件)gydF4y2Ba3gydF4y2Ba).我们能够验证ERF8和MPK11以及相关激酶MPK4之间的相互作用gydF4y2Ba在足底gydF4y2Ba采用双分子荧光互补(BiFC)分析gydF4y2Ban benthamianagydF4y2Ba(附加文件gydF4y2Ba3 bgydF4y2Ba).都是ERF8和ERF8gydF4y2BaL176A / L178AgydF4y2Ba在细胞核中与MPK4和MPK11明显相互作用,表明L176A/L178A双突变特异性地破坏了EAR motif,而不是假定的MPK对接位点。因此,转录抑制活性对于erf8诱导的细胞死亡至关重要。gydF4y2Ba
体外MPKs对ERF8磷酸化的研究。(gydF4y2Ba一个gydF4y2BaERF8的氨基酸序列。粗体和下划线为4个假定的磷酸化位点(S93, S103, T111, S171),双下划线为两亲性抑制(EAR)基序。绿色残基是假定的激酶对接位点(Hamel et al. 2011)。(gydF4y2Bab, c)gydF4y2Ba放射自显影(上)和考马斯雷R-250染色硝化纤维(下)显示。所使用的所有蛋白质都进行了gst标记。在含有MPK11的反应中(gydF4y2BabgydF4y2Ba)或MPK4 (gydF4y2BacgydF4y2Ba)及GST-ERF8;图像上方显示WT或突变(Mu)蛋白的存在。四个潜在的磷酸化位点通过位点定向突变改变为丙氨酸:S171A、T111A、S103A和S93A(四A =四突变体)。CA-MKK6是MAP激酶激酶6的组成型活性版本,可磷酸化MPK4和MPK11gydF4y2Ba
MPK4和11磷酸化ERF8gydF4y2Ba
考虑到gydF4y2Ba在足底gydF4y2Ba在ERF8和MPK4或MPK11之间的相互作用中,我们使用重组表达的gst融合蛋白在体外测试了这些MPKs直接磷酸化ERF8的能力。gst标记的MPK4或MPK11都能磷酸化GST-ERF8gydF4y2Ba32gydF4y2BaP-γ-ATP激酶在组成型活性MAP激酶(MKK)存在下的测定,CA-MKK6 [gydF4y2Ba59gydF4y2Ba(图。gydF4y2Ba3 b, cgydF4y2Ba).4个潜在的MPK磷酸化位点,Ser93, Ser103, Thr111和Ser171。gydF4y2Ba3gydF4y2Ba),在ERF8中使用PhosPhAt在硅片中预测[gydF4y2Ba60gydF4y2Ba].使用定点诱变法生成单、双、三和四重磷酸死亡突变体(Ser/Thr to Ala),并在体外用MPKs进行磷酸化测试。的ERF8gydF4y2BaS171A / T111A / S93AgydF4y2Ba三位点突变体和其他Ser103不变的突变体与野生型ERF8磷酸化相同(图2)。gydF4y2Ba3.gydF4y2Ba).然而,这两种四重突变体(ERF8gydF4y2BaS171A / T111A S93A / S103AgydF4y2Ba= ERF8gydF4y2Ba四个gydF4y2Ba)或ERF8gydF4y2BaS103AgydF4y2Ba单个突变体不再被MPK4或MPK11磷酸化。gydF4y2Ba3.gydF4y2Ba).这些结果表明Ser103是这些mpk主要的ERF8磷酸化位点。液相色谱-质谱(LC-MS/MS)磷酸肽分析进一步证实了这一发现,体外经MPK4或MPK11磷酸化后发现的ERF8磷酸化肽含量最多,含有Ser103,且有1和3 h激酶反应(表2)gydF4y2Ba1gydF4y2Ba).此外,Ser103突变为丙氨酸或天冬氨酸并不影响ERF8其他潜在磷酸化残基的体外磷酸化(附加文件)gydF4y2Ba4gydF4y2Ba),表明Ser103磷酸化可能不需要后续磷酸化其他残基(s)。gydF4y2Ba
Ser103突变本身不足以改变erf8诱导的细胞死亡gydF4y2Ba
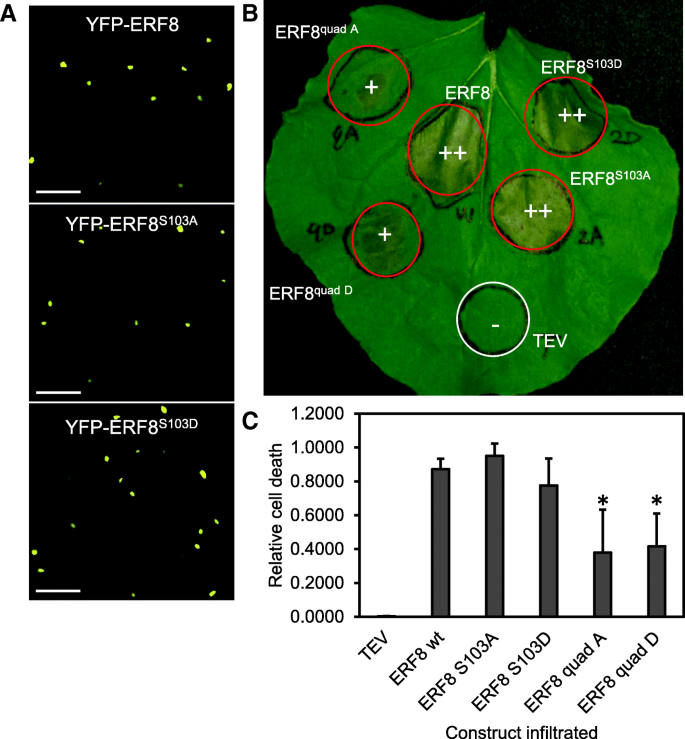
为了研究ERF8磷酸化对细胞死亡诱导的影响,采用拟磷(ERF8gydF4y2BaS103DgydF4y2Ba)和磷酸化死亡(ERF8gydF4y2BaS103AgydF4y2Ba)中瞬时表达的变体gydF4y2Ban benthamianagydF4y2Ba.两种突变均未影响ERF8在细胞核中的定位(图2)。gydF4y2Ba4gydF4y2Ba),而ERF8的表达gydF4y2BaS103DgydF4y2Ba或ERF8gydF4y2BaS103AgydF4y2Ba每种诱导细胞死亡的方式与野生型ERF8相似。gydF4y2Ba4 b, cgydF4y2Ba).然而,当所有4个磷酸化残基,Ser93, Ser103, Thr111和Ser171均突变为丙氨酸或天冬氨酸(ERF8gydF4y2Ba四个gydF4y2Ba, ERF8gydF4y2Ba四维gydF4y2Ba),与野生型ERF8诱导的细胞死亡相比,细胞死亡延迟且较弱(图2)。gydF4y2Ba4 b, cgydF4y2Ba).Western Blot结果显示,两种突变体蛋白水平均低于野生型(附加文件)gydF4y2Ba5gydF4y2Ba),而RT-PCR分析显示,野生型和突变型的mRNA水平gydF4y2BaERF8gydF4y2Ba有可比性(附加文件gydF4y2Ba5 bgydF4y2Ba),表明蛋白质稳定性在四倍突变体中受到影响。gydF4y2Ba
所有四个磷酸化位点突变减弱gydF4y2BaERF8gydF4y2Ba-诱导细胞死亡。(gydF4y2Ba一个gydF4y2Ba)在S103A和S103A突变体中,yfp标记的ERF8的核定位没有改变。ERF8的瞬时表达gydF4y2Ban benthamianagydF4y2Ba1 dpi。比例尺= 50 μm。(gydF4y2BabgydF4y2Ba) ERF8 (W)、ERF8引发细胞死亡gydF4y2BaS103AgydF4y2Ba, ERF8gydF4y2BaS103DgydF4y2Ba, ERF8gydF4y2Ba四个gydF4y2Ba和ERF8gydF4y2Ba四维gydF4y2Ba在4 dpi。++:强细胞死亡,+:弱/延迟细胞死亡,−:无细胞死亡。(gydF4y2BacgydF4y2Ba)在4 dpi时,对ERF8变体浸润的叶片照片进行细胞死亡程度分析。使用ImageJ基于宏观疾病图像的定量(PIDIQ)方法对每张图像中细胞死亡与健康叶片组织的比例进行量化(LaFlamme等人,2016)。所示为平均值±SD (gydF4y2BangydF4y2Ba= 3)。星号表示ERF8 wt(学生t检验;gydF4y2BapgydF4y2Ba< 0.01)gydF4y2Ba
此前有报道称,flg22是一种来源于细菌鞭毛蛋白的PAMP,它可以触发具有转录抑制因子拟南芥SH4-RELATED 3 (ASR3)的EAR-motif的mpk4依赖性磷酸化,从而调节防御相关的转录反应[gydF4y2Ba61gydF4y2Ba].由于MPK4和MPK11在感知flg22后被激活,我们测试了flg22处理后ERF8的磷酸化状态。gydF4y2BaERF8gydF4y2Ba经flg22或ABA处理后,拟南芥原生质体中表达的细胞进行了迁移转移,表明存在磷酸化。如附加文件所示gydF4y2Ba6gydF4y2Ba在经过flg22或ABA处理后,我们没有观察到ERF8的分子量有明显的迁移率变化。这一观察结果可能是由于ERF8上推定的mpk磷酸化位点数量较少,这可能不足以引起电泳迁移率的可检测变化。gydF4y2Ba
ERF8过表达导致ABA信号通路、细胞死亡调控和免疫相关基因的差异表达gydF4y2Ba
我们的数据表明ERF8对靶基因的转录抑制与其诱导PCD的能力有关。为了检测ERF8的下游靶点和信号转导,采用RNA-Seq技术使用DEX-inducible进行全基因组转录组分析gydF4y2BaERF8 -gydF4y2BaOE转基因拟南芥植株。DEX处理8小时后,收获植物组织进行RNA提取,并进行下一代测序。DEX处理后,大量基因表现出差异表达gydF4y2BaERF8gydF4y2Ba-OE与空病媒控制样品比较。11721个基因显示其表达发生了2倍的变化,其中5886个基因表达上调,5835个基因表达下调(附加文件)gydF4y2Ba7gydF4y2Ba).基因上调gydF4y2BaERF8gydF4y2Ba基因本体(Gene Ontology, GO)表达丰富了与植物免疫相关的生物学过程,包括系统性获得性抗性和sa介导的信号通路、细胞死亡和hr相关的防御反应。另一方面,GO术语下调基因包括代谢途径、光合作用和硫代葡萄糖苷生物合成(附加文件)gydF4y2Ba8gydF4y2Ba).gydF4y2Ba
正如预期的ERF8是ABA反应的抑制因子,ABA标记物gydF4y2BaRD29AgydF4y2Ba多个ABA直接靶基因下调(表gydF4y2Ba2gydF4y2Ba).此外,在被ABA直接上调的169个基因中[gydF4y2Ba42gydF4y2Ba], 61例ERF8过表达后下调(附加文件gydF4y2Ba9gydF4y2Ba).这些基因包括生物合成基因gydF4y2BaABA1gydF4y2Ba而且gydF4y2BaNCED3gydF4y2Ba, PP2C AHG3,gydF4y2BaSnRK3.14gydF4y2Ba,以及转录因子gydF4y2BaABF3gydF4y2Ba,gydF4y2BaRgl3, nac18, nac72 (rd26), myb77, cir1gydF4y2Ba,gydF4y2BaAt-HB12,gydF4y2Ba所有这些都与aba相关的过程有关[gydF4y2Ba42gydF4y2Ba].然而有趣的是,一些aba标记基因喜欢gydF4y2Ba响应aba 18gydF4y2Ba(gydF4y2BaRAB18gydF4y2Ba),gydF4y2Ba响应干燥29bgydF4y2Ba(gydF4y2BaRD29BgydF4y2Ba),gydF4y2BaKIN1gydF4y2Ba显著上调,生物合成基因也是如此,gydF4y2BaNINE-CIS-EPOXYCAROTENOID DIOXYGENASE5gydF4y2Ba(gydF4y2BaNCED5gydF4y2Ba)和脱落gydF4y2Ba醛OXIDASE3gydF4y2Ba(gydF4y2BaAAO3gydF4y2Ba).ABA受体gydF4y2BaPYL6, PYL4gydF4y2Ba和所有gydF4y2Ba1gydF4y2Ba还有gydF4y2BaSnRK3.15gydF4y2Ba也上调了(表gydF4y2Ba2gydF4y2Ba),而强aba诱导的pp2c的表达gydF4y2Ba高aba诱导的pp2c基因1gydF4y2Ba(gydF4y2BaHAI1gydF4y2Ba),gydF4y2Ba阿坝INSENSITIVE1gydF4y2Ba(gydF4y2BaABI1gydF4y2Ba) [gydF4y2Ba12gydF4y2Ba,gydF4y2Ba42gydF4y2Ba没有改变。细胞死亡诱导时aba相关基因表达的这种差异也在sa相关自身免疫突变体中观察到,gydF4y2Bacpr22gydF4y2Ba而且gydF4y2Bassi4gydF4y2Ba[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba15gydF4y2Ba],证实了ERF8在ABA-SA串扰中的作用。gydF4y2Ba
虽然erf8诱导的细胞死亡不依赖于SA的生物合成(图。gydF4y2Ba2 bgydF4y2Ba),包括sa介导的病原防御相关基因gydF4y2Ba发病相关基因无表达gydF4y2Ba(gydF4y2BaNPR1gydF4y2Ba),gydF4y2Ba植物抗毒素DEFICIENT4gydF4y2Ba(gydF4y2BaPAD4gydF4y2Ba),gydF4y2Ba疾病易感性增强gydF4y2Ba(gydF4y2BaEDS1gydF4y2Ba),gydF4y2BaRPM1-INTERACTING4gydF4y2Ba(gydF4y2BaRIN4gydF4y2Ba)gydF4y2Ba, pr1 pr5,gydF4y2Ba以及SA生物合成基因gydF4y2BaSID2gydF4y2Ba显著诱导(表gydF4y2Ba2gydF4y2Ba).SA生物合成和信号转导相关基因的上调可归因于SA正反馈回路的激活[gydF4y2Ba62gydF4y2Ba,gydF4y2Ba63gydF4y2Ba],符合我们的假设,ERF8作用于SA积累的下游。此外,还诱导了病原体防御相关的MAP激酶级联成分。这些包括gydF4y2BaMPK3gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba6gydF4y2Ba而且gydF4y2Ba11gydF4y2Ba,他们的上游mkk以及下游目标gydF4y2BaWrky DNA结合蛋白33 (wrky33), erf104, acc合成酶2 (acs2)gydF4y2Ba而且gydF4y2BaACS6gydF4y2Ba在病原体入侵时介导防御相关基因的转录变化[gydF4y2Ba64gydF4y2Ba,gydF4y2Ba65gydF4y2Ba,gydF4y2Ba66gydF4y2Ba,gydF4y2Ba67gydF4y2Ba].有趣的是,gydF4y2BaMPK11gydF4y2Ba上调了200多倍。与SA信号的上调相反,大多数乙烯相关基因包括标记基因gydF4y2BaPDF1.2gydF4y2Ba而且gydF4y2BaCHI-BgydF4y2Ba即使乙烯生物合成基因也没有表现出显著的转录变化gydF4y2BaACC合酶gydF4y2Ba(gydF4y2BaACSgydF4y2Ba)gydF4y2Ba7gydF4y2Ba,gydF4y2BaACS6gydF4y2Ba而且gydF4y2BaACS2gydF4y2Ba诱导(表gydF4y2Ba2gydF4y2Ba).若干IX类gydF4y2Ba小块土地gydF4y2Ba的基因,gydF4y2BaERF1gydF4y2Ba,gydF4y2BaERF2,gydF4y2Ba而且gydF4y2BaERF6,gydF4y2Ba它们与免疫有关[gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba],也上调,而大多数其他VIII类EAR阻滞剂gydF4y2Ba小块土地gydF4y2Ba没有明显的表达变化。然而,gydF4y2BaERF8gydF4y2Ba最接近的para,gydF4y2BaERF4,gydF4y2Ba强烈下调(29倍),表明转录反馈调控。与ja相关的标记基因表现为无变化(gydF4y2BaMyc2gydF4y2Ba,gydF4y2BaLOX2gydF4y2Ba)或被调低(gydF4y2BaVSP2gydF4y2Ba,gydF4y2Ba先进的gydF4y2Ba).这可能是由于在8 h时间点SA信号的上调。gydF4y2Ba
正如预期的那样,许多细胞死亡相关基因表达差异。这些基因包括编码细胞死亡的阳性和阴性调控因子的基因,以及当它们被错误调控时引发PCD的基因。例如,I型和II型metacaspases的表达(gydF4y2BaMC2-8gydF4y2Ba) [gydF4y2Ba68gydF4y2Ba],它们被认为是PCD的正向调节因子[gydF4y2Ba69gydF4y2Ba],增长了2.2- 378倍(表gydF4y2Ba2gydF4y2Ba).此外,一组基因负调控hr样PCD,包括gydF4y2Ba加速细胞死亡11gydF4y2Ba(gydF4y2BaACD11gydF4y2Ba),gydF4y2Ba病变刺激疾病抵抗反应1gydF4y2Ba(gydF4y2BaLSD1gydF4y2Ba),gydF4y2Ba防御,不死之身gydF4y2Ba而且gydF4y2Ba2gydF4y2Ba(gydF4y2BaDND1gydF4y2Ba,gydF4y2BaDND2gydF4y2Ba) [gydF4y2Ba70gydF4y2Ba,gydF4y2Ba71gydF4y2Ba,gydF4y2Ba72gydF4y2Ba],均被下调(表gydF4y2Ba2gydF4y2Ba).综上所述,转录组变化与gydF4y2BaERF8gydF4y2Ba支持其作为PCD正向调节因子的作用,并提示其在病原体防御中的潜在作用。gydF4y2Ba
ERF8正向调节细菌免疫gydF4y2Ba
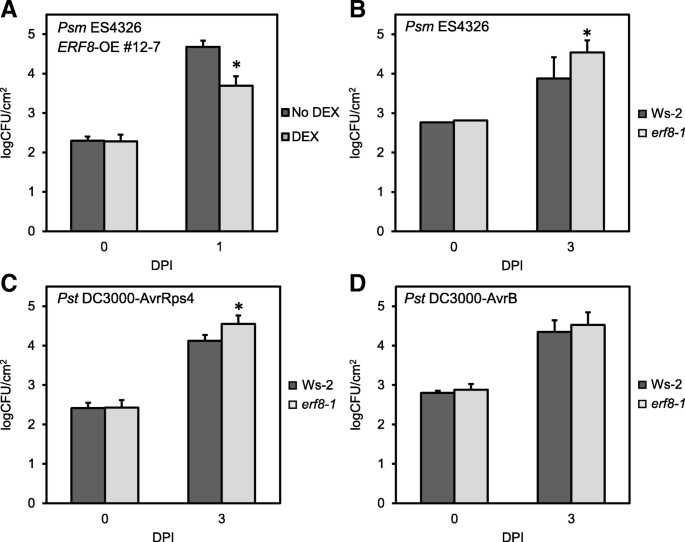
根据我们的细胞死亡分析和全基因组转录分析的结果,我们研究了ERF8是否在植物免疫中起作用。gydF4y2BaERF8-OEgydF4y2Ba或gydF4y2Baerf8-1gydF4y2Ba植物被不同的半生物致病菌感染,gydF4y2Bap .两gydF4y2Ba.如图所示。gydF4y2Ba5gydF4y2Ba, DEX-treatedgydF4y2BaERF8-OEgydF4y2Ba拟南芥表现出对毒性菌株的增强抗性,gydF4y2Bap .两gydF4y2Ba光伏gydF4y2Ba.maculicolagydF4y2BaES4326gydF4y2Ba(PsmgydF4y2BaES4326)与对照植物相比,表明ERF8在病原体抗性中起积极作用(图。gydF4y2Ba5gydF4y2Ba).为了支持这一观点,gydF4y2Baerf8-1gydF4y2Ba与相应的野生型相比,植物对Ws-2的敏感性增强gydF4y2BaPsmgydF4y2BaES4326(无花果。gydF4y2Ba5 bgydF4y2Ba).有趣的是,gydF4y2Baerf8-1gydF4y2Ba植株表现出更多的无毒生长gydF4y2Bap .两gydF4y2Ba光伏gydF4y2Ba.番茄gydF4y2Ba(gydF4y2BaPst)gydF4y2BaDC3000携带AvrRps4(图;gydF4y2Ba5度gydF4y2Ba),而未观察到病原菌生长的变化gydF4y2Ba太平洋标准时间gydF4y2BaDC3000携带AvrB(图;gydF4y2Ba5 dgydF4y2Ba),表明ERF8在免疫中的作用。gydF4y2Ba
ERF8gydF4y2Ba是否涉及防御gydF4y2Ba两。gydF4y2Ba致命的gydF4y2Ba附:gydF4y2Ba.pv maculicola ES4326 (gydF4y2BaPsmgydF4y2Ba)为外径处的压力渗透gydF4y2Ba600gydF4y2Ba0.0001到对照或dex处理gydF4y2BaERF8-OEgydF4y2Ba植物(gydF4y2Ba一个gydF4y2Ba)或gydF4y2Baerf8-1gydF4y2Ba拆卸植物(gydF4y2BabgydF4y2Ba).无毒gydF4y2Ba两gydF4y2Bapv。gydF4y2Ba番茄gydF4y2BaDC3000 (Pst)携带AvrRps4 (gydF4y2BacgydF4y2Ba)或AvrB (gydF4y2BadgydF4y2Ba)压力渗透到野生型Ws-2和gydF4y2Baerf8-1gydF4y2Ba可拆卸的植物。gydF4y2Ba在足底gydF4y2Ba在接种后1或3天定量细菌生长(dpi)。星号表示统计学显著性(学生t检验;gydF4y2BapgydF4y2Ba< 0.01)。实验进行2次(C&D)或3次(A&B),结果可重复(0 dpi n = 3,gydF4y2BangydF4y2Ba= 8-10为1或3 dpi)gydF4y2Ba
讨论gydF4y2Ba
在这项研究中,我们研究了一类ERF转录抑制因子ERF8,它在两种模式植物中诱导PCD,gydF4y2Ba答:芥gydF4y2Ba而且gydF4y2Ban benthamianagydF4y2Ba.突变保守的EAR基序转录抑制能力完全被废除gydF4y2BaERF8gydF4y2Ba诱导细胞死亡,表明其转录抑制活性对诱导细胞死亡至关重要。这些数据证实了先前关于II类erf在细胞死亡诱导中的作用的研究[gydF4y2Ba36gydF4y2Ba,gydF4y2Ba52gydF4y2Ba,gydF4y2Ba53gydF4y2Ba].gydF4y2Ba
先前的研究揭示了ERF转录因子的不同调控模式,包括共转录调控因子、miRNA、选择性多聚腺苷酸化、磷酸化和蛋白酶体介导的降解[gydF4y2Ba28gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba,gydF4y2Ba36gydF4y2Ba,gydF4y2Ba73gydF4y2Ba].ERF8包含一个推测的MAP激酶对接位点,在本研究中,我们证明了两种免疫相关激酶,MPK4和MPK11,与ERF8相互作用并直接磷酸化。MPK4在植物免疫方面得到了广泛的研究[gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba,gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba,gydF4y2Ba47gydF4y2Ba].的gydF4y2Bampk4gydF4y2Ba突变体表现出极端矮化表型和自身免疫,包括自发性PCD [gydF4y2Ba45gydF4y2Ba,gydF4y2Ba74gydF4y2Ba].先前已经确定了几种MPK4相互作用物和/或底物,包括MAP激酶底物1 (MKS1),它是sa依赖的自身免疫表型所必需的gydF4y2Bampk4gydF4y2Ba[gydF4y2Ba75gydF4y2Ba].病原体感染后MKS1被MPK4磷酸化,导致wrky33诱导的PAD3表达,这是抗菌植物抗毒素camalexin生物合成所必需的[gydF4y2Ba65gydF4y2Ba].MPK4的另一个靶点是与拓扑异构酶II (PAT1)相关的蛋白质,PAT1是mRNA脱冠机制的组成部分[gydF4y2Ba76gydF4y2Ba].PAT1还与CC-NB-LRR蛋白SUMM2 (SUPPRESSOR OF mkk1 mkk2)相互作用,SUMM2的突变可部分抑制自身免疫表型gydF4y2Bampk4gydF4y2Ba[gydF4y2Ba76gydF4y2Ba,gydF4y2Ba77gydF4y2Ba].PAT1缺失触发summ2依赖免疫,基于这些发现,有人提出gydF4y2BaMPK4gydF4y2Ba正向调节PTI,同时也起到保护作用,这表明MPK4的缺失诱导了summ2介导的ETI [gydF4y2Ba76gydF4y2Ba,gydF4y2Ba77gydF4y2Ba].另一个MPK4相互作用子是转录抑制因子拟南芥SH4-RELATED3 (ASR3),它负调控flg22诱导的基因的一个大子集。MPK4磷酸化ASR3增强其DNA结合活性抑制基因表达[gydF4y2Ba61gydF4y2Ba].确定ERF8是否与MPK4的一些已知靶标相互作用,并在相同的蛋白质复合物中或在重叠的信号转导途径中发挥作用,从而导致病原体耐药和PCD诱导将是有趣的。gydF4y2Ba
考虑到gydF4y2BaMPK4gydF4y2Ba而且gydF4y2BaMPK11gydF4y2Ba在免疫理论中,我们假设gydF4y2BaERF8gydF4y2Ba-诱导的细胞死亡由磷酸化调节。我们的体外激酶实验和LC-MS/MS结果表明,MPK4和MPK11主要磷酸化ERF8的Ser103残基。因此,这一单一残基中的拟磷和磷化变异(ERF8gydF4y2BaS103D /gydF4y2Ba)中生成并过表达gydF4y2Ban benthamianagydF4y2Ba,但与野生型ERF8相比,未观察到细胞死亡的显著差异。然而,相反,当所有4个潜在的磷酸化残基Ser93, Ser103, Thr111和Ser171突变为丙氨酸或天冬氨酸时,erf8诱导的细胞死亡可重复延迟和减弱。拟磷突变很可能无法复制由磷酸化引起的ERF8的变化,这是由于天冬氨酸残基和磷酸基之间电荷和大小的差异[gydF4y2Ba78gydF4y2Ba],这表明MPK4磷酸化和MPK11正调控ERF8诱导细胞死亡。在我们的LC-MS/MS数据中,第4位潜在磷酸化残基Ser171的序列覆盖率较低(表2)gydF4y2Ba1gydF4y2Ba),可能是由于其靠近蛋白的c端,因此在体内,其他位点和Ser103一起被MPK4和MPK11磷酸化以调节细胞死亡仍然是可能的。磷酸化可以稳定ERF8蛋白水平,因为四磷酸突变体显示出较低的蛋白质积累gydF4y2Ba在足底gydF4y2Ba,而mRNA水平不受影响(附加文件gydF4y2Ba5gydF4y2Ba).诱导或激活gydF4y2BaMPK11gydF4y2Ba和/或gydF4y2BaMPK4gydF4y2Ba因此,病原体感染可能会减少ERF8的周转,并有助于PCD的形成。26S蛋白酶体通过周转率调控ERF8已在之前被提出[gydF4y2Ba36gydF4y2Ba];研究表明,用蛋白酶体抑制剂MG132治疗可以减缓蛋白质的周转。ERF8(和ERF4)的蛋白质周转也随着植物的衰老而减慢,有人认为这有助于诱导或执行衰老相关的细胞死亡[gydF4y2Ba36gydF4y2Ba].ERF8磷酸化调控机制的进一步分析正在进行中。gydF4y2Ba
如前所述的其他VII类erf,包括gydF4y2BaERF7gydF4y2Ba而且gydF4y2BaERF4, ERF8gydF4y2Ba作为ABA反应的负调节因子[gydF4y2Ba39gydF4y2Ba,gydF4y2Ba42gydF4y2Ba,gydF4y2Ba54gydF4y2Ba(图。gydF4y2Ba1gydF4y2Ba).erf被认为与启动子中的GCC和DRE元件结合,并与辅抑制子(如TOPLESS、组蛋白去乙酰化酶HDA19及其相互作用子Sin3)形成抑制复合体[gydF4y2Ba39gydF4y2Ba,gydF4y2Ba79gydF4y2Ba].gydF4y2Ba
在本研究中,ERF8过表达导致5835个基因下调。其中许多基因可能是由于SA水平升高而产生的次要影响而改变的,但事实上,ABA直接诱导的基因中有36% [gydF4y2Ba42gydF4y2Ba的诱导后下调gydF4y2BaERF8gydF4y2BaERF8的表达强烈提示ERF8确实是ABA应答的转录抑制因子。有趣的是,其中一个强烈下调的基因是gydF4y2BaERF4gydF4y2Ba的最接近的段落gydF4y2BaERF8gydF4y2Ba,表明这些转录因子之间存在交叉调控。有研究表明,ERF4和ERF8都通过它们的抑制功能共同调节衰老,其中任何一个基因的过表达都会导致ABA敏感性降低[gydF4y2Ba36gydF4y2Ba,gydF4y2Ba54gydF4y2Ba(图。gydF4y2Ba1gydF4y2Ba),然而,Caarls等人(2017)[gydF4y2Ba80gydF4y2Ba显示ERF8而不是ERF4调控gydF4y2BaPDF1.2gydF4y2Ba而且gydF4y2BaPR1gydF4y2Ba基因表达,提示这两种转录因子的不同作用。ERF8最近也被确定为ERF转录因子网络的一部分(与ERF6, ERF9, ERF59和ERF98一起),控制渗透胁迫[gydF4y2Ba81gydF4y2Ba].gydF4y2Ba
Olvera-Carrillo等人(2015)[gydF4y2Ba82gydF4y2Ba]先前鉴定的区分hr样(生物应激)细胞死亡与发育性细胞死亡的转录谱。ERF8组在28个生物应激组上调的基因中有27个重叠,而25个发育性PCD标记基因中只有8个上调,11个没有改变,6个下调,证实了ERF8诱导细胞死亡的免疫特异性。然而,在我们选择的时间点(8小时后),转录发生了变化gydF4y2BaERF8gydF4y2Ba诱导)似乎足以在拟南芥中引发广泛的次级转录重编程。特别是SA生物合成基因gydF4y2BaICS1gydF4y2Ba(gydF4y2BaSID2gydF4y2Ba)强烈上调,因此很可能导致sa介导的次级转录变化(一个阳性扩增环),使得很难识别直接的ERF8靶基因。300个启动子中有GCC框的基因(- 2000到+ 200;[gydF4y2Ba83gydF4y2Ba)下调,249个上调。类似地,超过200个启动子中含有DRE元素的基因分别被上调或下调(附加文件)gydF4y2Ba8gydF4y2Ba).有趣的是,在我们的数据集中,有61个基因被ABA直接上调但下调(附加文件gydF4y2Ba9gydF4y2Ba33个(54%)启动子中含有DRE元件,3个含有GCC元件,4个同时含有GCC和DRE元件。此外,aba相关基因下调gydF4y2BaRD29AgydF4y2Ba,gydF4y2BaRD26 / NAC072gydF4y2Ba也包含一个DRE元素,gydF4y2BaSnRK3.14gydF4y2BaGCC元素,和gydF4y2BaNCED3gydF4y2Ba而且gydF4y2BaHB12gydF4y2Ba其启动子中的GCC和DRE元素。这些可能是aba相关ERF8的直接靶点。下调的细胞死亡相关基因gydF4y2BaDND1gydF4y2Ba而且gydF4y2BaACD11,gydF4y2Ba在其启动子中也含有DRE元素。gydF4y2BaDND1gydF4y2Ba已被证明是TPR1的靶点[gydF4y2Ba72gydF4y2Ba]和赤裸蛋白已被证明与ERF8相互作用[gydF4y2Ba79gydF4y2Ba提高了ERF8和赤裸蛋白可能共同抑制的可能性gydF4y2BaDND1gydF4y2Ba可能还有我们数据集中的其他基因。进一步分析以确定ERF8的直接靶标将是理解这种转录抑制因子如何整合ABA和细胞死亡的关键。gydF4y2Ba
最后,我们证明了ERF8在免疫中的功能作用,因为在拟南芥中过表达增加了抗性gydF4y2BaPsmgydF4y2BaES4326,而gydF4y2Baerf8-1gydF4y2Ba植物对毒力的敏感性增强gydF4y2BaPsmgydF4y2BaES4326以及gydF4y2Ba太平洋标准时间gydF4y2BaDC3000表达AvrRps4。总的来说,我们的数据表明ERF8在ABA信号转导和细菌免疫中都有作用。电阻的衰减gydF4y2Ba太平洋标准时间gydF4y2BaAvrRps4表明与TIR-NB-LRR类授予的ETI有关gydF4y2BaRgydF4y2Ba基因像gydF4y2BaSNC1gydF4y2Ba[gydF4y2Ba72gydF4y2Ba].事实上,在另一项单独的研究中(Cao等人提交),我们表明ERF8被多种靶向gydF4y2Bap .两gydF4y2BaIII型效应蛋白,进一步证实了ERF8在植物免疫中的重要作用。进一步研究erf8介导的与ABA信号的串扰将是理解非生物和生物反应中的转录网络的一个有前途的途径。gydF4y2Ba
结论gydF4y2Ba
在本研究中,我们发现ABA诱导的转录抑制因子ERF8在ABA信号转导和免疫中具有双重作用。ERF8作为ABA信号的负调控因子gydF4y2Baerf8gydF4y2Ba敲低系ABA敏感性增强,过表达系敏感性降低。此外,ERF8的过表达引起了sa不依赖的PCD,并增强了对病原体的抗性,这表明ERF8在植物免疫中具有积极作用。然而,EAR抑制域是PCD形成所必需的,在ERF8过表达系中,许多PCD相关基因下调,这表明ERF8可能下调免疫信号转导的负调控因子。最后,我们发现ERF8被两个免疫相关的MAP激酶,MPK4和MPK11磷酸化。Ser103在体外主要磷酸化;然而,所有四个假定的磷酸化位点的突变似乎是部分抑制的必要条件gydF4y2BaERF8gydF4y2Ba-诱导细胞死亡gydF4y2Ban benthamiana。gydF4y2Ba
方法gydF4y2Ba
植物生长条件gydF4y2Ba
拟南芥gydF4y2Ba而且gydF4y2Ba烟草benthamianagydF4y2Ba种子在Sunshine Mix(加拿大sungro园艺公司)的生长室中分别在22°C和20°C的光照下生长9小时和黑暗中生长16小时。光强约130 μE mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba.gydF4y2Ba
拟南芥转基因植物的生成gydF4y2Ba
采用花浸法对拟南芥进行转化gydF4y2Ba农杆菌属gydF4y2Ba(菌株GV3101)携带含有dex诱导物的二元植物表达载体pMAC14gydF4y2BaERF8-HA-taggydF4y2Ba构造。选择抗basta的植株,用30 μM DEX处理5周龄T1转化植株叶片2 d后,将叶片冷冻在液氮中进行western blotting检测转基因蛋白的表达。确定转基因表达的T1个体转入下一代,采用纯合子T3转基因株系进行实验。的gydF4y2BaERF8gydF4y2Ba击倒线FLAG157D10从ABRC库存中心获得。gydF4y2Ba
发芽试验gydF4y2Ba
无菌种子镀于0.5X Murashige和Skoog (MS)培养基上(pH为5.8;西格玛)补充ABA(西格玛)或地塞米松(DEX;Bioshop)。在解剖显微镜下观察胚根或子叶的萌发情况,对萌发情况进行评分。gydF4y2Ba
农杆菌介导的本草农杆菌的克隆及瞬时表达gydF4y2Ba
的野生型和突变变体gydF4y2BaERF8gydF4y2Ba,gydF4y2BaMPK4gydF4y2Ba,gydF4y2BaMPK11gydF4y2Ba使用网关LR克隆酶II (Invitrogen)亚克隆到二元表达载体pbwgy2或pBWGYc2(用于双分子荧光互补,BiFC)、pEARLEY201(用于c端HA标记的蛋白表达)或pEARLEY104(用于细胞定位分析的n端YFP标记)。gydF4y2Ba农gydF4y2Ba(GV2260或C58C1)与结构进行转换,并按所述进行瞬态实验[gydF4y2Ba84gydF4y2Ba].gydF4y2Ba农杆菌属gydF4y2Ba携带CaMV35S::HC-ProgydF4y2Ba烟草腐蚀病毒gydF4y2Ba(TEV)与结构物共同浸润以抑制基因沉默。对于BiFC和共浸润实验,在浸润前混合等量的培养物。6周大gydF4y2Ban benthamianagydF4y2Ba如前所述,使用无针注射器从叶片底部渗透[gydF4y2Ba84gydF4y2Ba].gydF4y2Ba
共焦显微镜gydF4y2Ba
椎间盘因浸润而取芯gydF4y2Ban benthamianagydF4y2Ba叶面积和成像使用徕卡TCS SP5共焦系统(徕卡微系统)。氩气激光功率设置为20%,514 nm激发,525 ~ 600 nm发射,进行YFP检测。叶绿体的自发荧光在650 - 700 nm之间被检测到[gydF4y2Ba36gydF4y2Ba].gydF4y2Ba
西方墨点法gydF4y2Ba
拟南芥和gydF4y2Ban benthamianagydF4y2Ba组织被冷冻在液氮中,研磨成细粉。蛋白质在20 mM TRIS-HCl pH 8.0, 100 mM NaCl, 1 mM DTT和1.25% Triton X-100中提取。样品在6000×离心gydF4y2BaggydF4y2Ba在4°C下浸泡10分钟,以清除碎屑。所得到的蛋白质提取物在90°C的1X SDS负载染料中煮沸5分钟。Western blotting后,使用α-HA抗体(1:10 00;Roche)和过氧化物酶偶联小鼠α -兔IgG(1:3万;细胞信号)。使用ECL蛋白印迹试剂盒检测免疫反应条带(GE Healthcare)。gydF4y2Ba
体外激酶测定gydF4y2Ba
ERF8、MPK和CA-MKK蛋白在激酶实验中表达为重组gst融合蛋白gydF4y2Ba大肠杆菌gydF4y2BaBL21密码子+细胞使用pGEX4T3表达载体。gst -融合蛋白通过GSH-琼脂糖层析纯化,用50 mM HEPES、100 mM NaCl、5%甘油、1 mM DTT、pH 7.5洗脱,加入10 mM还原GSH。蛋白质被量化并储存在−80°C直到使用。1 μg GST-ERF8(如图所示为WT或突变体)与0.5 μg GST-CA-MKK和0.5 μg GST-MPK在25 mM Tris-Cl和10 mM MgCl中孵育gydF4y2Ba2gydF4y2Ba, 1mm NagydF4y2Ba3.gydF4y2Ba签证官gydF4y2Ba4gydF4y2Ba, 1 mM β-甘油磷酸,pH 7.5。ATP(终浓度100 μM ATP + 2 μCi [γ-])的加入引起反应gydF4y2Ba32gydF4y2BaP] atp)。在30°C孵卵2小时后,通过加入1X SDS负载染料并加热到95°C 10分钟来停止反应。蛋白质在15% SDS- page上分离并转移到硝化纤维中。通过胶片曝光检测放射性标记蛋白的时间如图所示。gydF4y2Ba
质/女士gydF4y2Ba
体外激酶试验进行如上所述,但有以下变化。用未标记的ATP进行检测,使用5 μg GST-ERF8蛋白和1 μg GST-CA-MKK6和GST-MPK4或GST-MPK11(如图所示)。如图所示,反应孵育1或3小时。GST-ERF8蛋白在SDS-PAGE分离和考马斯氏R-250染色后被切除,并送往凝胶内胰蛋白酶消化和LC-MS/MS磷酸肽分析(SPARC生物中心质谱设备)。gydF4y2Ba
台盼蓝染色显微镜下细胞死亡的观察gydF4y2Ba
将叶片浸泡在乳酸酚-台潘蓝溶液中,在通风柜中用沸水加热3-5分钟,然后在室温下染色2小时。样品在50%水合氯醛(gydF4y2BawgydF4y2Ba/gydF4y2BavgydF4y2Ba)过夜,清洗并储存在50%的甘油中,然后安装在玻片上进行图像分析和摄影。gydF4y2Ba
细胞死亡的量化gydF4y2Ba
使用Photoshop对图像进行预处理。单独的渗透点被裁剪并保存为单独的图像。浸润组织外区域用红色填充,以区分浸润叶片组织与未浸润叶片组织。使用ImageJ基于宏观疾病图像的定量(PIDIQ)对每张图像中细胞死亡与健康叶片组织的比例进行量化[gydF4y2Ba85gydF4y2Ba绿色区域(色相:50-104;饱和度:151 - 255;亮度:0 - 255);细胞死亡区(色调:0-255;饱和度:0 - 150;亮度:0 - 255)。从至少3片叶子中细胞死亡的平均比例用图表描述。gydF4y2Ba
原生质体转染试验gydF4y2Ba
原生质体转染试验如前所述(Li et al., 2015)。简单地说,200 μl拟南芥原生质体在2 × 10gydF4y2Ba5gydF4y2Ba细胞/ml转染40 μg ERF8或其变体或MKP磷酸酶质粒。转染12小时后,用100 nM flg22处理原生质体15分钟,或用10 μM ABA处理15或30分钟。K252a处理时,在转染后立即向原生质体中添加1 μM K252a。分离出原生质体进行抗ha抗体Western Blot分析。gydF4y2Ba
RNA提取和Illumina mRNA-Seq方法gydF4y2Ba
每种基因型(空载体和gydF4y2BaERF8gydF4y2BaDEX治疗后8小时-OE)。每个副本包含3片叶子,来自3株4周的植物。RNA从植物组织中提取,使用TRIzol试剂,遵循制造商的协议(赛默飞世尔科学公司,沃尔瑟姆,MA USA)。使用PureLink™RNA Mini Kit (Thermo Fisher Scientific, Waltham, MA USA)进一步纯化RNA。RNA按照制造商的规程进行结合、洗涤和洗脱。用Turbo DNA-处理洗脱的rnagydF4y2Ba免费的gydF4y2Ba™试剂盒(赛默飞世尔科学公司,沃尔瑟姆,MA USA),按照制造商的协议去除残留的双链DNA。RNA的质量和数量使用Bioanalyzer 2100 (Agilent Technologies, Palo Alto, CA)的RNA纳米试剂盒进行评估。使用Dynabeads®mRNA纯化试剂盒(Thermo Fisher Scientific, Waltham, MA USA)按照推荐的方案从总RNA中分离mRNA。使用Covaris S2超声波仪(Covaris, Woburn, MA)将mRNA剪切至300碱基大小,协议如下:占比= 10%;强度= 5%;每脉冲周期= 200,时间= 35 s x2。剪切后的mRNA过夜沉淀,重悬于14ul无rnase的水中。gydF4y2Ba
Illumina文库的制备使用NEBNext®mRNA Library Prep Master Mix set for Illumina kit (New England Biolabs, Ipswich, MA, USA),从第一链cDNA合成步骤开始,并遵循推荐的方案。添加NEB单索引条形码用于多路复用。根据制造商的说明,使用150周期Mid Output V2测序试剂盒在NextSeq500测序仪(Illumina, San diego, CA)上对最终文库进行测序,并生成150X2配对末端reads。gydF4y2Ba
RNA-Seq数据处理gydF4y2Ba
RNA-Seq序列用短序列测序仪novoalign (gydF4y2Banovocraft.comgydF4y2Ba).对质量较低的均聚物和reads进行了筛选。随后计算每个样本中每个基因的reads数。读取计数数据输入R包edgeR [gydF4y2Ba86gydF4y2Ba]用于基因差异表达分析。差异表达基因分为上调基因和下调基因。gydF4y2Ba
每个ERF8-OE或空载体(EV)对照样品的序列读数在820 ~ 1760万之间,其中超过83%的序列被唯一映射到拟南芥基因,只有0.4%的序列被多个位置映射。由于是均聚物,约0.6%的读数被对准器过滤。大约14%的读取没有报告匹配,可能是由于质量低。用基因级读计数数据的决定系数评估样本的重现性,同一基因型内为96-98%,不同基因型之间为36-46%。在-2000 bp ~ + 200 bp启动子区寻找1)GCC box/motif (TAAGAGCCGCC或AGCCGCC)和/或2)DRE motif (A/GCCGAC)在-2000 bp ~ 0 bp启动子区寻找差异表达基因。gydF4y2Ba
P.丁香生长测定gydF4y2Ba
p .两gydF4y2Ba以OD接种菌株gydF4y2Ba600gydF4y2Ba0.002gydF4y2BaPmagydF4y2BaES4326, ODgydF4y2Ba600gydF4y2Ba0.001gydF4y2Ba太平洋标准时间gydF4y2BaDC3000或ODgydF4y2Ba600gydF4y2Ba0.002gydF4y2Ba太平洋标准时间gydF4y2BaDC3000-AvrRps4和gydF4y2Ba太平洋标准时间gydF4y2BaDC3000-AvrB。量化gydF4y2Ba在足底gydF4y2Ba细菌生长,四盘(1厘米gydF4y2Ba2gydF4y2Ba)每株收获,用10mm MgCl研磨gydF4y2Ba2gydF4y2Ba,并在King 's broth (KB)上镀上适当的抗生素进行菌落计数。将30 μM DEX提前1天喷施于可诱导转基因植物诱导转基因表达。gydF4y2Ba
缩写gydF4y2Ba
- 阿坝:gydF4y2Ba
-
脱落酸gydF4y2Ba
- BiFC:gydF4y2Ba
-
双分子荧光互补gydF4y2Ba
- 敏捷:gydF4y2Ba
-
地塞米松gydF4y2Ba
- 耳朵:gydF4y2Ba
-
erf相关的两亲性抑制gydF4y2Ba
- 人力资源:gydF4y2Ba
-
过敏的反应gydF4y2Ba
- OE:gydF4y2Ba
-
over-expressergydF4y2Ba
- 纤毛运动:gydF4y2Ba
-
程序性细胞死亡gydF4y2Ba
- 太平洋标准时间gydF4y2Ba:gydF4y2Ba
-
p .两gydF4y2Ba光伏gydF4y2Ba.番茄gydF4y2Ba
- 山:gydF4y2Ba
-
水杨酸gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
李志强,李志强,李志强。植物防御中激素信号网络的研究进展。Annu Rev Phytopathol[互联网]。2017; 55: annurev -发朵- 080516 - 035544。可以从:gydF4y2Bahttp://www.annualreviews.org/doi/10.1146/annurev-phyto-080516-035544gydF4y2Ba.gydF4y2Ba
- 2.gydF4y2Ba
Vlot AC, Dempsey DA, Klessig DF。水杨酸,一种对抗疾病的多面激素。Annu Rev Phytopathol[互联网]。2009; 47:177 - 206。可以从:gydF4y2Bahttp://www.annualreviews.org/doi/10.1146/annurev.phyto.050908.135202gydF4y2Ba.gydF4y2Ba
- 3.gydF4y2Ba
孙晓霞,李建平,李建平。植物抗脱落酸和非生物胁迫的研究进展。前沿植物科学,2016;7:571。gydF4y2Ba
- 4.gydF4y2Ba
Vishwakarma K, Upadhyay N, Kumar N, Yadav G, Singh J, Mishra RK,等。植物脱落酸信号与非生物胁迫耐受性:研究现状与展望。前沿植物科学[互联网]。2017;8可从:gydF4y2Bahttp://journal.frontiersin.org/article/10.3389/fpls.2017.00161/fullgydF4y2Ba.gydF4y2Ba
- 5.gydF4y2Ba
李文杰,李志强,李志强,李志强,等。脱落酸在病原和免疫调节中的作用。前沿植物科学[互联网]。2017; 8:1-15。可以从:gydF4y2Bahttp://journal.frontiersin.org/article/10.3389/fpls.2017.00587/fullgydF4y2Ba.gydF4y2Ba
- 6.gydF4y2Ba
林长青,李世生。拟南芥脱落酸受体在抗病中的重要作用。植物分子生物学杂志2015;88:313-24。gydF4y2Ba
- 7.gydF4y2Ba
林春霞,栾淑娟,李秀娟。rcar3介导的ABA信号通路在紫丁香假单胞菌感染中的作用。拟南芥番茄DC3000侵染。中国生物医学工程学报。2014;gydF4y2Ba
- 8.gydF4y2Ba
梅洛托M,安德伍德W,高赞J,野村K,何志勇。植物气孔在抵御细菌入侵的先天免疫中的作用。细胞。2006;126:969 - 80。gydF4y2Ba
- 9.gydF4y2Ba
曹云云,吉冈K, Desveaux D. ABA在植物-病原菌相互作用中的作用。植物资源[互联网]。2011[引2014年8月5日];124:489-99。可以从:gydF4y2Bahttp://www.ncbi.nlm.nih.gov/pubmed/21380629gydF4y2Ba.gydF4y2Ba
- 10.gydF4y2Ba
Asselbergh B, De Vleesschauwer D, Höfte M.全局开关和微调aba调节植物病原体防御。Mol植物-微生物相互作用[互联网]。2008; 21:709-19。可以从:gydF4y2Bahttp://apsjournals.apsnet.org/doi/10.1094/MPMI-21-6-0709gydF4y2Ba.gydF4y2Ba
- 11.gydF4y2Ba
安田M,石川A,吉丸Y,关M,梅泽T,麻美T,等。拟南芥系统性获得性抗性与脱落酸介导的非生物胁迫反应的拮抗相互作用。《植物细胞》杂志2008;20:1678-92。gydF4y2Ba
- 12.gydF4y2Ba
李志刚,李志刚,李志刚,李志刚,等。损伤模拟突变体cpr22以水杨酸依赖的方式显示脱落酸信号和脱落酸不敏感的改变。植物物理[互联网]。2010[引2014年9月10日];152:1901-13。可以从:gydF4y2Bahttp://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=2850030&tool=pmcentrez&rendertype=abstractgydF4y2Ba.gydF4y2Ba
- 13.gydF4y2Ba
徐军,李志强,李志强,等。脱落酸通过抑制水杨酸介导的水稻叶枯病病原Xanthomonas oryzae pv oryzae的免疫应答促进水稻叶枯病病原的易感性。8.公共科学图书馆,2013;gydF4y2Ba
- 14.gydF4y2Ba
蒋春杰,下野M,菅野S,小岛M,雅泽K,吉田R,等。脱落酸与水杨酸信号通路在水稻-稻瘟病菌互作中的拮抗作用。植物与微生物相互作用。2010;23:791-8。gydF4y2Ba
- 15.gydF4y2Ba
杨晓明,王晓明,杨晓明,杨晓明。aba拮抗作用在免疫应答中的作用。植物学报。2010;5:1231-3。gydF4y2Ba
- 16.gydF4y2Ba
张志刚,张志刚。植物模式识别受体信号通路的调控。免疫生物学杂志,2016;16:537-52。gydF4y2Ba
- 17.gydF4y2Ba
Khan M, Subramaniam R, Desveaux D.守卫,诱饵,诱饵和陷阱:植物中的病原体感知III型效应传感器。《微生物学》2016:49-55。gydF4y2Ba
- 18.gydF4y2Ba
Buttner D.幕后——植物细胞中细菌III型效应蛋白的作用。FEMS微生物学修订版2016;40:894-937。gydF4y2Ba
- 19.gydF4y2Ba
李志强,李志强,李志强,等。植物激素通路受病原菌影响的研究。《植物科学》2014;26:2285-309。gydF4y2Ba
- 20.gydF4y2Ba
de Torres-Zabala M, Truman W, Bennett MHMH, Lafforgue G, Mansfield JWJW, Rodriguez Egea P,等。丁香假单胞菌。番茄劫持拟南芥脱落酸信号通路引起疾病。Embo j . 2007; 26:1434-43。gydF4y2Ba
- 21.gydF4y2Ba
Goel AK, Lundberg D, Torres MA, Matthews R, Akimoto-Tomiyama C, Farmer L,等。丁香假单胞菌III型效应子HopAM1增强了对缺水植物的毒力。植物与微生物相互作用。2008;21:361-70。gydF4y2Ba
- 22.gydF4y2Ba
吴林,陈华,Curtis C,付志强。去杀人吧。毒性。2014;5:710-21。gydF4y2Ba
- 23.gydF4y2Ba
Jones JDG, Dangl JL。植物免疫系统。大自然。2006;444:323-9。gydF4y2Ba
- 24.gydF4y2Ba
Huysmans M, Lema SA, Coll NS, Nowack MK. Science Direct dying two death -发育和疾病中的程序性细胞死亡调控。Curr Opin植物生物学[互联网]。Elsevier Ltd. 2017; 35:37-44。可以从:gydF4y2Bahttps://doi.org/10.1016/j.pbi.2016.11.005gydF4y2Ba.gydF4y2Ba
- 25.gydF4y2Ba
Müller M, Munné-Bosch S.乙烯反应因子:激素和应激信号的关键调控枢纽。植物物理[互联网]。2015; 169:32-41。可以从:gydF4y2Bahttp://www.plantphysiol.org/lookup/doi/10.1104/pp.15.00677gydF4y2Ba.gydF4y2Ba
- 26.gydF4y2Ba
植物生物和非生物胁迫的相互作用:从基因到田间。中国科学(d辑),2012;gydF4y2Ba
- 27.gydF4y2Ba
藤田M,藤田Y,本敏Y,高桥F, Narusaka Y,山口筱崎K,等。非生物和生物应激反应之间的串扰:来自应激信号网络收敛点的当前观点。植物学报,2006;9:436-42。gydF4y2Ba
- 28.gydF4y2Ba
陈志伟,陈志伟。单子叶植物胁迫响应过程中的乙烯响应因子。前沿植物科学[互联网]。2015; 6:1-7。可以从:gydF4y2Bahttp://journal.frontiersin.org/Article/10.3389/fpls.2015.00640/abstractgydF4y2Ba.gydF4y2Ba
- 29.gydF4y2Ba
黄佩平,王晓明,王晓明,等。拟南芥乙烯反应因子的研究进展。中国科学(d辑),2016;gydF4y2Ba
- 30.gydF4y2Ba
孟X,徐洁,何勇,杨凯勇,Mordorski B,刘勇,等。拟南芥MPK3/MPK6对ERF转录因子的磷酸化调控植物防御基因诱导和真菌抗性。植物细胞[互联网]2013; 25:1126-42。可以从:gydF4y2Bahttp://www.plantcell.org/cgi/doi/10.1105/tpc.112.109074gydF4y2Ba.gydF4y2Ba
- 31.gydF4y2Ba
王鹏,杜勇,赵旭,苗勇,宋昌平。mpk6 - erf6 - ros响应顺式作用Element7/GCC Box复合物调节拟南芥氧化基因转录和氧化反应植物物理[互联网]。2013; 161:1392 - 408。可以从:gydF4y2Bahttp://www.plantphysiol.org/cgi/doi/10.1104/pp.112.210724gydF4y2Ba
- 32.gydF4y2Ba
孙海辉,万杰,金海杰,阮小春,钟文伟,洪继杰,等。乙烯反应元件结合因子5 (ERF5)参与几丁质诱导的先天免疫反应。Mol植物-微生物相互作用[互联网]。2012; 25:48-60。可以从:gydF4y2Bahttp://apsjournals.apsnet.org/doi/10.1094/MPMI-06-11-0165gydF4y2Ba
- 33.gydF4y2Ba
王晓明,王晓明,王晓明,等。植物EAR基序介导的转录抑制:基因表达表观遗传调控的潜在机制。表观遗传学。2011;6:141-6。gydF4y2Ba
- 34.gydF4y2Ba
Nakano T, Suzuki K, Fujimura T, Shinshi H. ERF基因家族全基因组分析。植物物理学报。2006;140:411-32。gydF4y2Ba
- 35.gydF4y2Ba
Ohta M, Matsui K, Hiratsu K, Shinshi H, Ohme-Takagi M. II类ERF转录抑制因子的抑制域共享一个积极抑制的基本基序。植物细胞,2001;13:59 - 68。gydF4y2Ba
- 36.gydF4y2Ba
小山T, Nii H, Mitsuda N, Ohta M,北岛S, Ohme-Takagi M,等。涉及II类乙烯反应因子转录抑制因子的级联调控在叶片衰老过程中起作用。植物物理[互联网]。2013; 162:991 - 1005。可以从:gydF4y2Bahttp://www.plantphysiol.org/cgi/doi/10.1104/pp.113.218115gydF4y2Ba
- 37.gydF4y2Ba
Mcgrath KC, Dombrecht B, Manners JM, Schenk PM, Edgar CI, Udvardi MK,等。通过拟南芥转录因子基因表达的全基因组筛选,发现抑制因子和激活因子型乙烯反应因子在茉莉酸信号通路和抗病中的作用[w]。2005; 139:949-59。gydF4y2Ba
- 38.gydF4y2Ba
Maruyama Y, Yamoto N, Suzuki Y, Chiba Y, Yamazaki K. Ichi, Sato T,等。拟南芥转录抑制因子ERF9参与对坏死真菌的抗性。植物科学[互联网]。Elsevier Ireland Ltd. 2013; 213:79-87。可以从:gydF4y2Bahttps://doi.org/10.1016/j.plantsci.2013.08.008gydF4y2Ba
- 39.gydF4y2Ba
宋春萍,王鹏,郭艳,王鹏,王平。拟南芥AP2 / erebp型转录抑制因子在干旱胁迫和脱落酸应答中的作用。《植物科学》2005;17(4):344 - 344。gydF4y2Ba
- 40.gydF4y2Ba
李震,张磊,于勇,权荣,张震,张宏,等。乙烯反应因子AtERF11由bZIP转录因子HY5转录调控,是拟南芥乙烯生物合成的关键抑制因子。植物J. 2011; 68:88-99。gydF4y2Ba
- 41.gydF4y2Ba
周旭,张志林,玉介,邱凯,朴杰,南艺,等。ERF11通过激活赤霉素生物合成和信号通路促进拟南芥节间伸长。植物物理[互联网]。2016; pp.00154.2016。可以从:gydF4y2Bahttp://www.plantphysiol.org/lookup/doi/10.1104/pp.16.00154gydF4y2Ba
- 42.gydF4y2Ba
Lumba S, Toh S, Handfield LF, Swan M, Liu R, youjy,等。一个中尺度脱落酸激素相互作用组揭示了拟南芥的动态信号景观。科学通报。2014;29:360-72。gydF4y2Ba
- 43.gydF4y2Ba
艾申-利波德,贝斯克,M,帕姆-福斯特,P,鲍尔N, Glazebrook J,等。拟南芥中第四诱导反应的丝裂原活化蛋白激酶mpk11。植物学报。2012;7:1203-5。gydF4y2Ba
- 44.gydF4y2Ba
贝斯克G, Pecher P, Eschen-Lippold L, Tsuda K, Katagiri F, Glazebrook J,等。激活gydF4y2Ba拟南芥gydF4y2Ba由鞭毛蛋白衍生的激发肽flg22激活的丝裂原激活蛋白激酶MPK11。Mol植物-微生物相互作用[互联网]。2012; 25:471 - 80。可以从:gydF4y2Bahttp://apsjournals.apsnet.org/doi/10.1094/MPMI-11-11-0281gydF4y2Ba
- 45.gydF4y2Ba
杨晓东,刘志强,张志强,等。拟南芥MAP激酶4负向调控系统性获得性抗性。2000;103:1111-20。gydF4y2Ba
- 46.gydF4y2Ba
贝瑞瑞,加西亚,弗雷·迪特·弗雷,罗忠,帕特龙,莱昂哈特,等。拟南芥MPK4在病原体防御信号传导中的功能植物学报。2012;24:1-14。gydF4y2Ba
- 47.gydF4y2Ba
孔强,曲宁,高敏,张震,丁霞,杨峰,等。拟南芥MEKK1-MKK1/MKK2-MPK4激酶级联负调控丝裂原活化蛋白激酶激酶介导的免疫植物细胞[互联网]2012; 24:2225-36。可以从:gydF4y2Bahttp://www.plantcell.org/cgi/doi/10.1105/tpc.112.097253gydF4y2Ba
- 48.gydF4y2Ba
徐丽娟,刘志刚,王丽娟,王丽娟。拟南芥种子萌发过程中RNA加工和细胞器代谢机制的研究进展。植物物理[互联网]。2011; 157:1342 - 62。可以从:gydF4y2Bahttp://www.plantphysiol.org/cgi/doi/10.1104/pp.111.183129gydF4y2Ba
- 49.gydF4y2Ba
吴林,陈华,Curtis C,付志强。去杀:植物如何部署效应器触发的免疫来对抗病原体。毒性。2014;5:710-21。gydF4y2Ba
- 50.gydF4y2Ba
穆尔杰,刘志刚,李志刚,李志刚。高敏感反应;百年纪念即将来临,但我们知道多少?J实验学报,2008:501-20。gydF4y2Ba
- 51.gydF4y2Ba
王志强,王志强,王志强,等。拟南芥抗性突变体的环境敏感性研究。信号串扰植物胁迫响应。2009:113-35。gydF4y2Ba
- 52.gydF4y2Ba
Ogata T, Kida Y, Tochigi M, Matsushita Y. AP2/ERF家族第八组乙烯反应因子诱导细胞死亡能力的分析。植物科学[互联网]。爱思唯尔爱尔兰有限公司2013;209:12-23。可以从:gydF4y2Bahttps://doi.org/10.1016/j.plantsci.2013.04.003gydF4y2Ba
- 53.gydF4y2Ba
绪方T,木田Y,新井T,岸西Y,马纳果Y,村井M,等。烟草乙烯反应因子NtERF3基因及其同源物在烟草和水稻中过表达可诱导烟草超敏反应样细胞死亡。《植物病理学杂志》2012;78:8-17。gydF4y2Ba
- 54.gydF4y2Ba
杨震,田玲,吴凯。拟南芥ERF4是一种调控乙烯和脱落酸反应的转录抑制因子。植物化学学报,2005;gydF4y2Ba
- 55.gydF4y2Ba
杨林,特谢拉,比斯瓦斯,芬克尔,何勇,萨拉斯-冈萨雷斯,等。丁香假单胞菌III型效应子HopBB1促进宿主转录抑制因子降解,调节植物激素反应和毒力。细胞宿主微生物,2017;21:156-68。gydF4y2Ba
- 56.gydF4y2Ba
第II类ERF转录抑制因子的抑制域共享一个积极抑制的基本基序。植物细胞在线[互联网]。2001; 13:1959 - 68。可以从:gydF4y2Bahttp://www.plantcell.org/content/13/8/1959gydF4y2Ba.gydF4y2Ba
- 57.gydF4y2Ba
Kagale S, Links MG, Rozwadowski K.拟南芥乙烯响应元件结合因子相关两亲性抑制基序转录调控因子的全基因组分析。植物物理[互联网]。2010; 152:1109-34。可以从:gydF4y2Bahttp://www.plantphysiol.org/cgi/doi/10.1104/pp.109.151704gydF4y2Ba
- 58.gydF4y2Ba
Hamel L-P, Benchabane M, Nicole M- c, Major IT, Morency M- j, Pelletier G,等。胁迫响应性丝裂原活化蛋白激酶与杨树锌指蛋白的EAR基序相互作用,并通过26S蛋白酶体介导其降解。植物物理学报,2011;gydF4y2Ba
- 59.gydF4y2Ba
李JS,许KW,巴尔加瓦A,埃利斯BE。综合分析拟南芥MAPKs和MAPK激酶之间的蛋白-蛋白相互作用有助于定义潜在的MAPK信号模块。植物信号行为[互联网]。2008; 3:1037-41。可以从:gydF4y2Bahttp://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=2634456&tool=pmcentrez&rendertype=abstractgydF4y2Ba
- 60.gydF4y2Ba
杜瑞克,史密,赫泽勒伍德,琼斯,麦克莱恩,纳格尔,等。PhosPhAt:拟南芥磷酸化位点数据库。核酸决议2009;38:828-34的更新。gydF4y2Ba
- 61.gydF4y2Ba
李斌,姜松,于旭,程超,陈松,程勇,等。MAP KINASE4对拟南芥三螺旋转录抑制因子ASR3的磷酸化对拟南芥免疫具有负向调控作用。植物细胞[互联网]2015; 27:839-56。可以从:gydF4y2Bahttp://www.plantcell.org/lookup/doi/10.1105/tpc.114.134809gydF4y2Ba
- 62.gydF4y2Ba
李志刚,李志刚,李志刚,李志刚。植物NB-LRR细胞内天然免疫受体信号通路的研究进展。9 .公共科学图书馆,2013gydF4y2Ba
- 63.gydF4y2Ba
植物防御中的水杨酸环。植物学报,2003;6:365-71。gydF4y2Ba
- 64.gydF4y2Ba
植物抗病性信号通路中的MAPK级联。植物学报。2013;51:245-66。gydF4y2Ba
- 65.gydF4y2Ba
邱建林,Fiil BK, Petersen K, Nielsen HB, Botanga CJ, Thorgrimsen S,等。拟南芥MAP激酶4通过核内转录因子的释放调控基因表达。Embo j . 2008; 27:2214-21。gydF4y2Ba
- 66.gydF4y2Ba
贝斯克·G, Unthan T, Uhrig JF, Poschl Y, Gust AA, Scheel D,等。Flg22通过乙烯信号通路调控拟南芥MAP激酶6中乙烯反应因子底物的释放。Proc Natl Acad Sci[互联网]。2009; 106:8067 - 72。可以从:gydF4y2Bahttp://www.pnas.org/cgi/doi/10.1073/pnas.0810206106gydF4y2Ba
- 67.gydF4y2Ba
毛李G,孟X,王R, G,汉族L,刘Y, et al。乙烯诱导过程中MPK3/MPK6级联及其下游WRKY转录因子对ACC合成酶活性的双水平调控8 .公共科学图书馆,2012gydF4y2Ba
- 68.gydF4y2Ba
Fagundes D, Bohn B, Cabreira C, Leipelt F, Dias N, Bodanese-Zanettini MH,等。植物中的半胱天冬酶:植物胁迫反应中的元半胱天冬酶基因家族。功能。中国。基因组学,2015:639-49。gydF4y2Ba
- 69.gydF4y2Ba
王志刚,王志刚,王志刚,等。拟南芥metacaspase的自溶和钙依赖性活化研究。中国生物化学杂志,2011;gydF4y2Ba
- 70.gydF4y2Ba
布鲁格曼Q,雷诺C,本哈默德M,德拉鲁M,死还是不死?病变模拟突变体的教训。前沿植物科学[互联网]。2015; 6:1-22。可以从:gydF4y2Bahttp://journal.frontiersin.org/article/10.3389/fpls.2015.00024/abstractgydF4y2Ba
- 71.gydF4y2Ba
Moeder W, Yoshioka K.病变模拟突变体:一种经典的,但仍然是研究程序性细胞死亡的基本方法。植物学报。2008;3:764-7。gydF4y2Ba
- 72.gydF4y2Ba
朱震,徐峰,张勇,程奕婷,Wiermer M,李旭,等。拟南芥抗性蛋白SNC1通过与转录辅阻遏因子结合激活免疫反应。Proc Natl Acad Sci[互联网]。2010; 107:13960-5。可以从:gydF4y2Bahttp://www.pnas.org/cgi/doi/10.1073/pnas.1002828107gydF4y2Ba
- 73.gydF4y2Ba
Lyons R, Iwase A, Gänsewig T, Sherstnev A, Duc C, Geoffrey J. FPA通过选择性聚腺苷酸化调节flg22引发的反应和转录因子活性。gydF4y2Ba
- 74.gydF4y2Ba
高敏,刘杰,毕达,张震,程峰,陈松,等。MEKK1, MKK1/MKK2和MPK4共同在丝裂原激活蛋白激酶级联中调节植物的先天免疫。Cell Res. 2008; 18:1190-8。gydF4y2Ba
- 75.gydF4y2Ba
杨晓东,杨晓东,朱晓东,等。MAP激酶底物MKS1是植物防御反应的调节因子。中国科学(d辑),2005;gydF4y2Ba
- 76.gydF4y2Ba
Roux ME, Rasmussen MW, Palma K, Lolle S, Mateu À, Bethke G,等。mRNA衰变因子PAT 1在包括MAP激酶4和免疫受体SUMM 2的通路中起作用。2015; 1 - 16。gydF4y2Ba
- 77.gydF4y2Ba
张震,吴勇,高敏,张杰,孔强,刘勇,等。由丁香假单胞菌效应物破坏pamp诱导的MAP激酶级联激活了NB-LRR蛋白SUMM2介导的植物免疫。细胞宿主微生物。爱思唯尔有限公司;2012; 11:253 - 63。gydF4y2Ba
- 78.gydF4y2Ba
Dephoure N, Gould KL, Gygi SP, Kellogg DR, Drubin DG。磷酸化位点的映射和分析:细胞生物学家的快速指南2013;24。gydF4y2Ba
- 79.gydF4y2Ba
郭伟,郭文杰。拟南芥toppless互作组基因抑制的研究框架。植物物理[互联网]。2012; 158:423-38。可以从:gydF4y2Bahttp://www.plantphysiol.org/cgi/doi/10.1104/pp.111.186999gydF4y2Ba
- 80.gydF4y2Ba
Der Does D Van, Hickman R, Jansen W, Van Verk MC, Proietti S, Lorenzo O,等。评估乙烯反应因子转录抑制因子在水杨酸介导的茉莉酸反应基因的抑制作用lotte caarl1,5。中国生物医学工程学报,2017;gydF4y2Ba
- 81.gydF4y2Ba
Van den Broeck L, Dubois M, Vermeersch M, Storme V, Matsui M, Inzé D.从网络到表型:渗透胁迫诱导拟南芥转录网络的动态连接。Mol Syst Biol[互联网]。2017; 13: -961。可以从:gydF4y2Bahttp://msb.embopress.org/lookup/doi/10.15252/msb.20177840gydF4y2Ba
- 82.gydF4y2Ba
Olvera-Carrillo Y, Van Bel M, Van Hautegem T, Fendrych M, Van Durme M, Huysmans M,等。一个保守的PCD指示基因核心可以区分植物发育和环境诱导的程序性细胞死亡。植物物理[互联网]。2015; 169: pp.00769.2015。可以从:gydF4y2Bahttp://www.plantphysiol.org/lookup/doi/10.1104/pp.15.00769gydF4y2Ba
- 83.gydF4y2Ba
于春萍,林建军,李文华。转录因子结合位点的位置分布gydF4y2Ba拟南芥gydF4y2Ba.科学代表[互联网]。Nat Publ Group. 2016;6:25164。可以从:gydF4y2Bahttp://www.nature.com/articles/srep25164gydF4y2Ba
- 84.gydF4y2Ba
德法尔科,马歇尔·CB,孟罗·K,康海格,Moeder W, Ikura M,等。多个钙调素结合位点正向和负向调控拟南芥环核苷酸门控通道12。植物细胞[互联网]2016; 28: tpc.00870.2015。可以从:gydF4y2Bahttp://www.plantcell.org/lookup/doi/10.1105/tpc.15.00870gydF4y2Ba
- 85.gydF4y2Ba
Laflamme B, Middleton M, Lo T, Desveaux D, Guttman DS。基于图像的植物免疫和疾病定量研究。Mol植物-微生物相互作用[互联网]。2016; 29: mpmi - 07 - 16 - 0129。可以从:gydF4y2Bahttp://apsjournals.apsnet.org/doi/10.1094/MPMI-07-16-0129-TAgydF4y2Ba
- 86.gydF4y2Ba
王志强,王志强,王志强,等。一种用于基因表达数据差异分析的生物导体包2010;26:139-140。gydF4y2Ba
- 87.gydF4y2Ba
Moeder, W., Cao F.Y., DeFalco, t.a., Li, B., Gong, Y., Lumba, S., Toh, S., Shan, L., Ellis, B., Desveaux, D., Yoshioka, K.拟南芥乙烯反应因子8 (ERF8)在ABA信号转导和免疫中的双重功能。植物生物学2018,蒙特利尔,QC,加拿大,2018年7月14-18日。gydF4y2Ba
确认gydF4y2Ba
我们感谢基因组进化与功能分析中心(CAGEF)和Pauline Wang博士对RNA-seq分析的大力支持,以及Huoi Ung博士对质粒构建的技术支持。我们也感谢Morten Petersen博士分享未发表的微阵列数据和富有成效的讨论。gydF4y2Ba
资金gydF4y2Ba
该项目由加拿大自然科学与工程研究委员会(NSERC)、加拿大创新基金会(CFI)和安大略省研究基金(ORF)资助KY和DD,罗伯特a .韦尔奇基金会(a -1795)资助LS。这项工作得到了自然科学与工程研究委员会(NSERC)向FYC和TAD提供的博士奖学金的支持。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
在当前研究期间生成和分析的数据集可根据要求从通讯作者处获得。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
FYC和TAD进行了最多的实验。MT、SL和DD进行Y2H分析。ST公司创建了ERF8-OX系列。ML和BE参与MAPK分析,YG进行RNA-Seq生物信息学分析,BL和LS进行原生质体磷酸化研究,WM、TAD、FYC和KY撰写稿件。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
发表同意书gydF4y2Ba
该摘要发表于Plant Biology 2018 (Montreal, QC, Canada, abstract ID: 455888)。我们已与美国植物生物学家协会联系,并确认我们有权利重复使用本文中的摘要[gydF4y2Ba87gydF4y2Ba].gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们之间没有利益冲突。gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
附加文件gydF4y2Ba
附加文件1:gydF4y2Ba
图S1。gydF4y2BaERF8在种子及DEX处理后的表达。(PPTX 512kb)gydF4y2Ba
附加文件2:gydF4y2Ba
图S2。gydF4y2BaERF8野生型和L176A突变型的定位和表达gydF4y2Ban benthamianagydF4y2Ba.(PPTX 6667 kb)gydF4y2Ba
附加文件3:gydF4y2Ba
图S3。gydF4y2BaERF8和MPK11在Y2H中的相互作用。(PPTX 1630kb)gydF4y2Ba
附加文件4:gydF4y2Ba
图S4。gydF4y2BaSer103的磷酸化在体外不影响其他ERF8残基的磷酸化。(PPTX 204kb)gydF4y2Ba
附加文件5:gydF4y2Ba
瞬态表达式gydF4y2BaERF8gydF4y2BaWt和变体gydF4y2Ban benthamianagydF4y2Ba.(pptx129kb)gydF4y2Ba
附加文件6:gydF4y2Ba
图S6。gydF4y2BaERF8在不同条件下的磷酸化状态分析。(PPTX 154kb)gydF4y2Ba
附加文件7:gydF4y2Ba
表S7。gydF4y2Ba差异调节基因gydF4y2BaERF8gydF4y2BaDEX处理后8小时-OX生长。(xlsx789 kb)gydF4y2Ba
附加文件8:gydF4y2Ba
图S8。gydF4y2Ba差异表达基因分析。(pptx39 kb)gydF4y2Ba
附加文件9:gydF4y2Ba
表S9。gydF4y2Ba在ERF8-OX植株中ABA基因上调下调。(xlsx11kb)gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文根据创作共用属性4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)除另有说明外,适用于本条所提供的资料。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
曹f.y., DeFalco, t.a., Moeder, W。gydF4y2Baet al。gydF4y2Ba拟南芥乙烯反应因子8 (ERF8)在ABA信号转导和免疫中具有双重功能。gydF4y2BaBMC植物生物学gydF4y2Ba18日,gydF4y2Ba211(2018)。https://doi.org/10.1186/s12870-018-1402-6gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-018-1402-6gydF4y2Ba
关键字gydF4y2Ba
- 小块土地gydF4y2Ba
- 乙烯响应因子gydF4y2Ba
- 细胞死亡gydF4y2Ba
- Map激酶gydF4y2Ba
- MPK4gydF4y2Ba
- MPK11gydF4y2Ba
- ERF8gydF4y2Ba
- 丝裂原活化蛋白激酶gydF4y2Ba
- 阿坝gydF4y2Ba