- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
核和质体靶向膜联蛋白5在拟南芥中促进生殖发育,对花粉和胚的形成至关重要gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba18gydF4y2Ba文章编号:gydF4y2Ba183gydF4y2Ba(gydF4y2Ba2018gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
花粉发育是一个严格控制的减数分裂后的过程,在此过程中,小孢子分化为小配子体,细胞器发生深刻的结构和功能变化。膜联蛋白5是一种钙和脂质结合蛋白,在花粉粒中高度表达,调节花粉发育和生理为了深入了解ANN5在拟南芥发育中的作用,我们用修饰的ANN5对拟南芥植物进行了详细的表型表征gydF4y2BaANN5gydF4y2Ba此外,还分析了ANN5的相互作用伙伴和亚细胞定位,以研究ANN5在细胞水平上的潜在功能。gydF4y2Ba
结果gydF4y2Ba
在这里,我们报道了rnai介导的抑制gydF4y2BaANN5gydF4y2Ba结果形成较小的花粉粒,提高花粉致死率,延迟花粉管生长。gydF4y2BaANN5gydF4y2BaRNAi敲除的植株在营养向生殖阶段的转变和胚胎发生过程中也表现出异常发育,分别表现为抽薹时间延迟和胚胎大小减小。在亚细胞水平,ANN5被传递到细胞核、核仁和细胞质,并经常定位于质体核仁,提示其可能在胞间通讯中发挥作用。此外,ANN5-YFP与RABE1b(推测的GTPase)共免疫沉淀,并相互作用gydF4y2Ba在足底gydF4y2Ba经flimt - fret分析证实为质体类核。gydF4y2Ba
结论gydF4y2Ba
我们的研究结果表明,ANN5通过调节花粉成熟过程中质体的活性来影响基底细胞的稳态。我们假设ANN5的作用是通过蛋白质-蛋白质相互作用协调质体和核基因组的活动,但不仅在成熟的花粉中,而且在从营养生长到生殖生长和种子发育的过渡中。gydF4y2Ba
背景gydF4y2Ba
在被子植物中,雄性配子体(小配子体或花粉粒)对物种的繁殖成功起着至关重要的作用,在具有挑战性的环境条件下正常发育花粉是各种作物非常需要的农艺性状。雄配子体的发育是一个复杂的过程,它发生在花药室,小孢子母细胞减数分裂产生单倍体小孢子[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba].发育中的小孢子从绒毡层吸收营养,绒毡层是花药室的内层细胞。这种分泌组织为小孢子的生长提供可溶性碳水化合物,为花粉细胞壁的形成提供脂质[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba].尽管小孢子质体依赖于绒毡层的营养输送,但随着小孢子成熟,它经历了密集的结构重组[gydF4y2Ba2gydF4y2Ba].在年轻的小孢子中,质体分化差,缺乏任何内部膜系统。在第一次有丝分裂之前,质体发育少数类囊体并分化为淀粉体,短暂积累淀粉,直至小配子发生的双细胞阶段。第二次有丝分裂后,成熟的三细胞花粉粒由一个营养细胞(VC)和两个精子细胞组成。在这一阶段,花粉质体中所含的淀粉几乎可以忽略不计,因为大部分淀粉已被水解[gydF4y2Ba5gydF4y2Ba].虽然发育中的小孢子数量有限,但这些质体对花粉活力至关重要,因为质体碳水化合物代谢缺陷的各种突变体表现出花粉不育[gydF4y2Ba6gydF4y2Ba].gydF4y2Ba
根据其时空表达模式,对雄性配子体发育起重要作用的基因可以分为“早”基因和“晚”基因。“早期”基因是小孢子中最先被激活的基因,它们的表达水平随着花粉成熟的临近而降低。“晚期”基因在第一次小孢子有丝分裂后被激活,它们的转录本在花粉成熟过程中积累[gydF4y2Ba7gydF4y2Ba].小孢子发育的晚期基因之一是膜联蛋白5 (gydF4y2BaANN5gydF4y2Ba).gydF4y2BaANN5gydF4y2Ba在双细胞小孢子中检测到启动子活性,最大值为gydF4y2BaANN5gydF4y2Ba转录本丰度与花粉成熟相关[gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba]膜联蛋白属于真核生物中普遍存在的蛋白质家族[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba]局限于不同的亚细胞区[gydF4y2Ba11gydF4y2Ba].由于膜层蛋白具有钙和膜结合能力,已知膜层蛋白参与多种细胞过程,如肌动蛋白结合、囊泡运输的维持、细胞氧化还原稳态和离子运输[gydF4y2Ba12gydF4y2Ba].ANN5以前被生物化学鉴定过,像其他膜联蛋白一样,以钙依赖的方式与脂质体结合,并与肌动蛋白结合[gydF4y2Ba13gydF4y2Ba].花粉管overexpressinggydF4y2BaANN5gydF4y2Ba结果表明,ANN5对囊泡蛋白运输抑制剂Brefeldin A (BFA)的抗性增强,表明ANN5促进了BFA阻断下游的膜运输。支持这一点,基于rnai的下调gydF4y2BaANN5gydF4y2Ba导致花粉致死性增强[gydF4y2Ba8gydF4y2Ba]然而,ANN5影响小孢子发育的机制尚不清楚。我们的结果表明,ANN5的功能不仅限于雄配子体的发育,而且在整个拟南芥生殖发育过程中起着核心作用。我们进一步表明,ANN5定位于细胞核和质体,暗示ANN5参与维持细胞内稳态所必需的细胞间的串扰。gydF4y2Ba
方法gydF4y2Ba
植物材料和生长条件gydF4y2Ba
实验进行了gydF4y2Ba拟南芥gydF4y2Ba和gydF4y2Ba烟草benthamianagydF4y2Ba植物。修改gydF4y2BaANN5gydF4y2Ba在拟南芥Col-0背景下引入表达。其他拟南芥材料:An-1、Bay-0、C24、Ler-1、Mr-0、Oy-0和Wa-1gydF4y2Bahttp://arabidopsis.info/gydF4y2Ba).拟南芥植株在Jiffy7盆栽中(Percival Scientific, Iowa, USA)在22°C、40%湿度、8 h光照条件下生长4周,随后16 h光照条件。拟南芥幼苗培养保持在固化的Murashige和Skoog (MS)培养基上(Duchefa, Amsterdam, Netherlands),含1.5% (gydF4y2BawgydF4y2Ba/gydF4y2BavgydF4y2Ba)蔗糖和1%(w/v)琼脂(Duchefa,阿姆斯特丹,荷兰)置于22°C、8小时光照下的受控环境室内。gydF4y2Ban benthamianagydF4y2Ba植物在受控环境条件下(21°C,16小时光照)在土壤中生长。gydF4y2Ba
拟南芥表达载体的构建与转化gydF4y2Ba
编码序列gydF4y2BaANN5gydF4y2Ba使用添加BglII BamHI限制性位点的引物进行PCR扩增:正向5'-AgatCgatggCgactCttAgttCt-3'和反向5'-GgatCttCttCtCtCccGagAA-3',并克隆到带有YFP全长cDNA序列的改良pSAT4A质粒中。表达盒35S:ANN5-YFP被亚克隆到pPZP-RCS2二元质粒中[gydF4y2Ba14gydF4y2Ba].gydF4y2Ba
Agrikola二元质粒(gydF4y2Bahttp://www.agrikola.org/gydF4y2Ba)目标gydF4y2BaANN5gydF4y2Ba从NASC获得RNAi沉默(gydF4y2Bahttp://arabidopsis.info/gydF4y2Ba) [gydF4y2Ba15gydF4y2Ba].pAgrikola质粒包含一个基因编码序列片段,称为基因特异性标签(GST),在35S启动子的控制下,可以产生靶向基因沉默所必需的双链发夹RNA (hpRNA) [gydF4y2Ba15gydF4y2Ba].pAgrikola 35S的消费税gydF4y2Ba: ANN5gydF4y2Ba(GST)-RNAi对应于214 bp长片段gydF4y2BaANN5gydF4y2Ba编码序列从668号开始,到881号结束。本研究中使用的二元质粒列于附加文件中gydF4y2Ba1gydF4y2BaS1:表。gydF4y2Ba
将野生型拟南芥col0植株转化为pPZP-RCS2gydF4y2Ba35 s: ANN5-YFPgydF4y2Ba, pAgrikolagydF4y2Ba35 s: ANN5gydF4y2Ba(GST)-RNAi和pCAMBIA 1302 35SgydF4y2Ba:绿色荧光蛋白gydF4y2Ba[gydF4y2Ba16gydF4y2Ba用花浸渍法[gydF4y2Ba17gydF4y2Ba),gydF4y2Ba根癌土壤杆菌gydF4y2Ba菌株GV3101携带合适的质粒和辅助质粒pMP90。基于rnai的沉默gydF4y2BaANN5gydF4y2Ba附加辅助质粒pSOUP (gydF4y2Bahttp://www.agrikola.org/gydF4y2Ba)被引入gydF4y2Ba农杆菌gydF4y2Ba.gydF4y2BaANN5gydF4y2Ba-RNAi转化子采用基于basta的选择程序(gydF4y2Bahttp://www.agrikola.org/gydF4y2Ba),而选择35S:gydF4y2BaANN5-YFPgydF4y2Ba和35S:gydF4y2Ba绿色荧光蛋白gydF4y2Ba转化体在荧光立体显微镜尼康SMZ1500(尼康仪器欧洲公司,荷兰阿姆斯特丹)下直接在MS板上进行。gydF4y2Ba
RNA提取和RT-qPCRgydF4y2Ba
利用Syngen Plant RNA Mini Kit (Syngen, Wroclaw, Poland)从拟南芥营养和生殖组织中分离出总RNA。根据前面描述的步骤,在0.3 M的冰点甘露醇上采集成熟的花粉粒[gydF4y2Ba18gydF4y2Ba].使用NanoDrop ND-1000分光光度计(美国赛默飞世尔科学公司)对分离的RNA进行定量,并进行DNA消化(赛默飞世尔科学公司的快速DNA去除试剂盒)。使用2μg RNA和上标III试剂盒(美国赛默飞世尔科学公司)合成第一个cDNA。使用SYBR绿色主混合物进行qPCR(Thermo Fisher Scientific,USA)使用Light Cycler 480(瑞士巴塞尔罗氏公司)。使用三种不同的cDNA制备进行三次反应。相对表达水平与参考基因的表达标准化(gydF4y2BaUBC21gydF4y2Ba,gydF4y2BaPP2AgydF4y2Ba和gydF4y2BaYLS8gydF4y2Ba),并采用ΔCt方法进行量化。RT-qPCR引物列于附加文件gydF4y2Ba1gydF4y2BaS2:表。gydF4y2Ba
拟南芥表型特征gydF4y2Ba
为了进行表型研究,我们选用了两种选择的种子gydF4y2BaANN5gydF4y2Ba-RNAi谱线:gydF4y2BaANN5gydF4y2Ba-RNAi_13,gydF4y2BaANN5gydF4y2Ba-RNAi_15、OE_2系和野生型拟南芥Col-0。每个Jiffy7花盆放置5粒各基因型种子,4℃分层2天后,置于合适的光照条件下。实验进行了生长室(珀西瓦尔科学、爱荷华州,美国)在两个不同的光政权:1)12 h光/ 12 h黑暗的光周期在整个实验,2)在短日(8 h(光)4周之后,漫长的一天(16 h(光)条件(sd / ld)。白天的光线由荧光灯管和白炽灯混合提供。土壤总光子通量密度为120 μE mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba.达到两个子叶期后,每盆只培养一株,其余的去除掉。每个基因型记录了7-10株单株的发育阶段。从萌发到角果成熟,每天对所有植株进行检查。抽薹时间是指从萌发到花茎在0.1 cm高度第一次伸长的天数。花期是指从萌发到第一朵花开放的天数。第一朵花凋谢后,记录了角花形成的时间。放置生长植物的托盘每周旋转三次,以使植物发育均匀。在这两种光照条件下进行了三个完全独立的实验。使用Microsoft Excel和R免费软件(gydF4y2Bahttp://www.r-project.orggydF4y2Ba).gydF4y2Ba
雌蕊中花粉管的生长gydF4y2Ba
从花序上切下封闭的花蕾和新开的花梗短的花,并将其安装在水琼脂平板上,每个基因型放在一个单独的平板上:Col-0野生型,gydF4y2BaANN5gydF4y2Ba-RNAi_13,gydF4y2BaANN5gydF4y2Ba-RNAi_15和gydF4y2BaANN5gydF4y2Ba-OE_2。从现在起,每一步都是在奥林巴斯SZ60(奥林巴斯,东京,日本)立体显微镜下完成的。花瓣、萼片和花药用镊子从花蕾上取下,而雌蕊则固定在平板上。然后,从成熟花中分离出花药开裂的雄蕊,将花粉粒铺到离体雌蕊的柱头上。授粉后3、6、24 h采集授粉雌蕊,将其固定在Carnoy 's固定液中[60% (gydF4y2BawgydF4y2Ba/gydF4y2BavgydF4y2Ba)乙醇,30%氯仿,10%乙酸]。按照Mori等人的描述对花粉管进行苯胺蓝染色[gydF4y2Ba19gydF4y2Ba].进行了三个独立的实验。每次人工授粉5-7个雌蕊,每个基因型。使用尼康E800荧光显微镜(尼康仪器B.V. Europe, Amsterdam, The Netherlands)采集苯胺蓝染色样品的图像。用ImageJ软件从花柱顶部到最长花粉管前部测量花粉管长度。gydF4y2Ba
种子大小的测量gydF4y2Ba
在拟南芥生长过程中,所有的辅助芽都被去除。一旦主螺栓上的角状物形成,几乎完全变成棕色,它们就会被收集到一个微离心管中。在测量前,角钢在开口管中风干数天。将干燥的种子分散在显微镜载玻片上,在尼康SMZ1500立体显微镜下采集若干图像。使用ImageJ软件的阈值函数将图像转换为黑白图像后,按前面所述计算单个种子的面积[gydF4y2Ba20.gydF4y2Ba].gydF4y2Ba
蛋白质提取与免疫沉淀gydF4y2Ba
将12天龄拟南芥幼苗中ANN5-YFP或GFP组成性表达的样品研磨在液氮中。然后在2ml提取缓冲液(50 mM Tris-HCl, pH 7.5;50 mM氯化钠;6毫米EDTA;蛋白酶抑制剂PMSF;0.5% (gydF4y2BavgydF4y2Ba/v] Triton X-100),每1g纸巾粉。样品在13000 rpm和4°C下离心20分钟。将收集的上清液调节至总蛋白质的3 mg ml-1,并在4°C下与GFP TrapA珠(Chromotek,USA)孵育4小时。孵育后,丢弃上清液,并使用50 mM Tris-HCl(pH 7.5)、150 mM NaCl和2 mM EDTA缓冲液清洗珠。使用200mM甘氨酸(pH 2.5)洗脱蛋白质。洗脱的蛋白质经胰蛋白酶消化并进行质谱分析。gydF4y2Ba
质谱分析gydF4y2Ba
肽混合物的液相色谱-质谱分析在Orbitrap光谱仪(Thermo Fisher Scientific, USA)上进行,Mascot程序用于数据库搜索,如前所述[gydF4y2Ba21gydF4y2Ba].gydF4y2Ba
叶绿素提取与测量gydF4y2Ba
Col-0野生型,gydF4y2BaANN5gydF4y2Ba-OE_2和gydF4y2BaANN5gydF4y2Ba_OE1种子用75%乙醇表面灭菌2分钟,然后用10%次氯酸钠表面灭菌10分钟。然后,用无菌水清洗种子三次,并将其摊铺在凝固的琼脂上(1%gydF4y2BawgydF4y2Ba/gydF4y2BavgydF4y2Ba) MS培养基是否添加1.5% (gydF4y2BawgydF4y2Ba/gydF4y2BavgydF4y2Ba)蔗糖。4°C分层2天后,在220 μE m的光子通量密度下放入生长室gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba在架子层。幼苗在短日照条件下(8 h光照)生长10 d。采收10日龄幼苗地上部分,称重并保持在−80°C。样品由珠磨机(TissueLyser II, Qiagen, Hilden, Germany)在带有两颗不锈钢珠的2ml微离心管中机械研磨。用1 ml 80%的冷丙酮提取后,在4°C下6000 rpm离心5 min。用新鲜溶剂重复提取两次。用分光光度计(UV-1202,岛津,京都,日本)在664和647 nm处测定混合提取物的吸光度。叶绿素含量用前面所述的公式计算[gydF4y2Ba22gydF4y2Ba].gydF4y2Ba
瞬时表达的质粒结构gydF4y2Ban benthamianagydF4y2Ba
编码序列gydF4y2BaANN5gydF4y2Ba引物添加salie - ecorv酶切位点:正向5 ' -GTCGACATGGCAACAATGAA-3 '和反向5 ' - gatatccaacgttggggcctaaaagagag -3 '进行PCR扩增,克隆到与Gateway系统兼容的pENTR1A载体中。将获得的质粒LR重组成GWB441、、gwb551和gwb552二元质粒[gydF4y2Ba23gydF4y2Ba].编码序列gydF4y2BaRABE1bgydF4y2Ba引物添加salix - xhoi酶切位点:正向5 ' - gtcgacatggcgaagatgatgttgc -3 '和反向5 ' -CTCGAGGCTTGAAGAACAAGTTTCTTGCTCAG-3 '。将扩增的编码序列克隆到pENTR1A载体上,然后将LR重组到GWB 441和GWB444 [gydF4y2Ba23gydF4y2Ba].本研究构建的二元质粒列于附加文件中gydF4y2Ba1gydF4y2BaS1:表。gydF4y2Ba
所得二元质粒转化为gydF4y2Ba农杆菌gydF4y2Ba应变GV3101。随后,gydF4y2Ba农杆菌gydF4y2Ba将携带适当结构物的培养物渗透到叶中gydF4y2Ban . benthamianagydF4y2Ba72 h后,用激光扫描共聚焦显微镜对叶片样品进行分析。gydF4y2Ba
生物信息学gydF4y2Ba
基于网络的生物信息学工具用于预测蛋白质亚细胞定位:PSORT和WoLF PSORT (gydF4y2Bawww.genscript.comgydF4y2Ba),Nuc Plos[gydF4y2Ba24gydF4y2Ba].gydF4y2Ba
共聚焦激光扫描显微术gydF4y2Ba
融合蛋白的亚细胞定位采用尼康C1共聚焦系统,建立在TE2000E上,配备60× Plan-Apochromat油浸物镜(Nikon Instruments B.V. Europe, Amsterdam, the Netherlands)。用蓝宝石488 nm激光(Coherent, Santa Clara, CA, USA)激发GFP/YFP融合蛋白,并用515/530 nm发射滤光片观察。用408 nm二极管激光激发CFP融合蛋白和DAPI荧光,并用450/35 nm发射滤光片检测。使用ImageJ软件对共焦图像进行反卷积和伪彩色处理。gydF4y2Ba
FLIM-fretgydF4y2Ba
在flime - fret(荧光寿命成像Microscopy-Förster共振能量转移)中,RABE1b融合到CFP(供体)中瞬时表达gydF4y2Ban benthamianagydF4y2Ba在有或没有潜在的相互作用伙伴ANN5融合到YFP(受体)的情况下叶子。细胞成像采用FV100共焦系统(Olympus, Tokyo, Japan),配备60×水浸物镜。对于FLIM, CFP融合蛋白用440nm脉冲二极管激光器(Sepia II, PicoQuant, Berlin, Germany)激发并使用482/35带通滤波器检测。获取图像的帧大小为256 × 256像素。光子用SPAD探测器收集,并用PicoHarp 300 TCSPC模块(Picoquant)计数。所得数据用Symphotime软件(PicoQuant)进行分析。采用双指数衰减模型拟合CFP在质体核仁中的荧光寿命。gydF4y2Ba
透射和扫描电子显微镜gydF4y2Ba
从拟南芥Col-0野生型中采集初生花序的茎尖,带有花芽和花,gydF4y2BaANN5gydF4y2Ba-RNAi_13,gydF4y2BaANN5gydF4y2Ba-RNAi_15和gydF4y2BaANN5gydF4y2Ba-OE_2基因型。每个基因型7个样本固定在2%多聚甲醛的混合物中(gydF4y2BawgydF4y2Ba/gydF4y2BavgydF4y2Ba)和2%戊二醛(gydF4y2BavgydF4y2Ba/v),室温下用0.05 M卡可酸钠缓冲液浸泡2 h。从两次单独试验中采集了植物样本。固定后,根据Smyth等人的分类,将每个基因型的样本分为3类:花芽期6 - 9,闭花芽期10 - 12,开放花芽期13 - 15。gydF4y2Ba25gydF4y2Ba].样品经四氧化锇柱固定,乙醇脱水,EPON树脂包埋gydF4y2Ba26gydF4y2Ba].超薄切片在FEI 268d ' Morgagni ' (FEI公司,Hillsboro, OR, USA)透射电子显微镜下检查,该显微镜配有SIS ' Morada '数码相机(Olympus SIS, Münster,德国)。gydF4y2Ba
将成熟的花粉粒直接收集到微囊管的帽内。如前所述,对它们进行扫描电子显微镜检查[gydF4y2Ba27gydF4y2Ba]使用蔡司Spura 40VP(蔡司,德国耶拿)扫描电子显微镜在10kV电压下进行成像。gydF4y2Ba
结果gydF4y2Ba
ANN5gydF4y2Ba以组织特异性的方式表达gydF4y2Ba
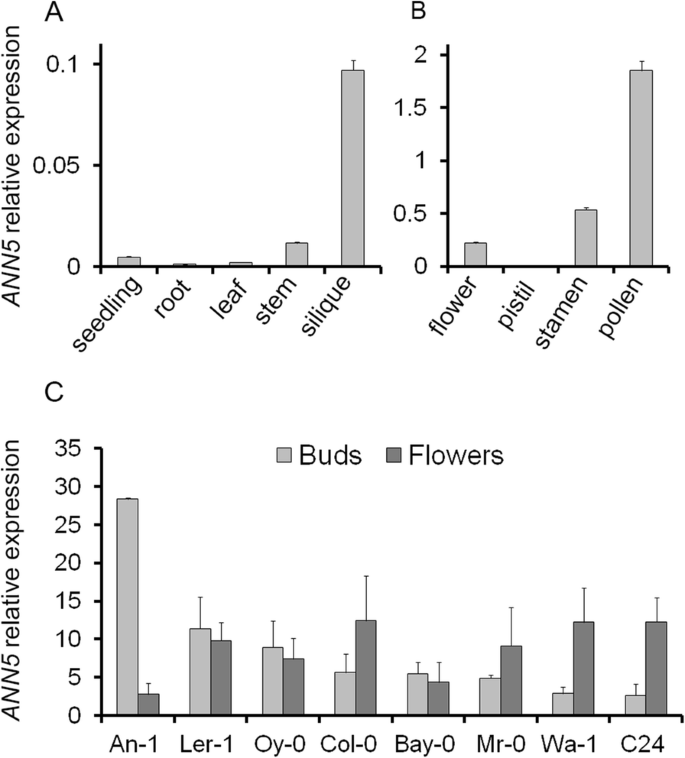
早期的研究表明gydF4y2BaANN5gydF4y2Ba主要在成熟花中表达[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba28gydF4y2Ba].为了进一步描述gydF4y2BaANN5gydF4y2Ba利用RT-qPCR分析拟南芥营养器官和生殖器官的表达。gydF4y2BaANN5gydF4y2Ba与拟南芥生殖组织相比,拟南芥营养生长过程中的转录本较少(图。gydF4y2Ba1gydF4y2Ba),在3日龄幼苗、莲座叶和根中几乎检测不到。过渡到生育阶段后,在gydF4y2BaANN5gydF4y2Ba在发育中的茎中观察到了表达水平,而在发育中的年轻西力克中检测到了强表达。对雌蕊和雄蕊的单独分析表明,最强的gydF4y2BaANN5gydF4y2Ba表达见于男性器官,以最高gydF4y2BaANN5gydF4y2Ba在成熟花粉中观察到的转录本丰度(图。gydF4y2Ba1 bgydF4y2Ba).gydF4y2Ba
拟南芥的种类在gydF4y2BaANN5gydF4y2Ba表达式gydF4y2Ba
高的表达gydF4y2BaANN5gydF4y2Ba与col0植株花粉粒成熟相关(图。gydF4y2Ba1 bgydF4y2Ba),我们希望确定这是否在拟南芥材料中是一致的。选择8份来自不同生境的拟南芥(An-1、C24、Col-0、le -1、Bay-0、Wa-1、Oy-0、Mr-0),在短日照和长日照条件下培养至开花。从花蕾和成熟花中分离到的RNA进行RT-qPCR分析,发现其差异gydF4y2BaANN5gydF4y2Ba表达(图。gydF4y2Ba1 cgydF4y2Ba).Wa-1、C24和Mr-0呈col0型表达模式,且表达量较高gydF4y2BaANN5gydF4y2Ba成熟花中的mRNA水平高于芽中的mRNA水平。在Bay-0、Oy-0和Ler-1中,gydF4y2BaANN5gydF4y2Ba在花蕾中表达已经升高,并在花期保持相同水平。An-1表现得最不寻常gydF4y2BaANN5gydF4y2Ba表达谱:花蕾中表达量很高,成熟花中表达量急剧下降。Accession-specific模式gydF4y2BaANN5gydF4y2Ba表达可能反映了拟南芥雄性配子体发育的可能差异。gydF4y2Ba
抑制gydF4y2BaANN5gydF4y2Ba导致拟南芥的生殖发育延迟gydF4y2Ba
以往的研究表明,基于RNAi (RNA干扰)的抑制gydF4y2BaANN5gydF4y2Ba由花粉特异启动子驱动gydF4y2BaLAT52gydF4y2Ba导致花粉的杀伤力增强[gydF4y2Ba8gydF4y2Ba]这表明基因敲除可能是致命的或雄性不育的gydF4y2BaANN5gydF4y2Ba利用携带214 bp的AGRIKOLA RNAi质粒进行敲除gydF4y2BaANN5gydF4y2Ba35S启动子控制下的编码序列[gydF4y2Ba15gydF4y2Ba].所获得的RNAi品系在开花时表现出中度抑制gydF4y2BaANN5gydF4y2Ba与控制Col-0植物相比,水平降低20-80%(附加文件gydF4y2Ba1gydF4y2Ba:图S1)二gydF4y2BaANN5gydF4y2BaRNAi线,gydF4y2BaANN5gydF4y2Ba-RNAi_13和gydF4y2BaANN5gydF4y2Ba-RNAi_15,进行详细的表型分析。也产生了异位过表达的细胞系gydF4y2BaANN5gydF4y2Ba(OE)在35S启动子的控制下。OE线显示出极高的高度gydF4y2BaANN5gydF4y2Ba与野生型相比,转录本丰度(大约增加100倍)(附加文件gydF4y2Ba1gydF4y2Ba:图S1)。gydF4y2Ba
在两种光照条件下进行了发育分析:1)12 h的光照确保了从营养发育到生殖发育的稳定过渡;2)短日照后转入长日照条件以加速开花时间。发芽的野生型,gydF4y2BaANN5gydF4y2Ba-RNAi_13和gydF4y2BaANN5gydF4y2Ba-RNAi_15和OE线在两种光照条件下是等效的。在从营养发育到生殖发育的转变过程中,即在抽薹(花茎形成),RNAi品系和col0野生型植株之间的发育差异变得明显gydF4y2Ba1gydF4y2Ba额外的文件gydF4y2Ba1gydF4y2Ba:图S2和表S3)。gydF4y2BaANN5gydF4y2Ba在sd/ld光照条件下,RNAi沉默系比野生型植物栓接大约晚8天(表1)gydF4y2Ba1gydF4y2Ba).相比之下,在光照12 h的条件下,抽薹延迟仅约2天gydF4y2Ba1gydF4y2Ba:表S3)。随后的生长阶段,即开始开花和第一次西力克的形成被推迟了大约11天gydF4y2BaANN5gydF4y2BaRNAi植物与对照植物相比,但只在sd/ld条件下。在12 h光照条件下,RNAi株系与野生型植株开花和角果形成时间相近。转基因拟南芥过表达的研究进展gydF4y2BaANN5gydF4y2Ba与野生型植物在两种光照条件下的表现相似(表gydF4y2Ba1gydF4y2Ba额外的文件gydF4y2Ba1gydF4y2Ba:表S3)。与对照相比,OE植株在莲座形成和茎伸长过程中生长速率略有提高gydF4y2Ba1gydF4y2Ba:图S2)。综上所述,这些结果表明拟南芥的生殖发育(抽薹、开花、角果形成)受到了影响gydF4y2BaANN5gydF4y2Ba可拆卸的。在发育过程中有统计学意义的畸变gydF4y2BaANN5gydF4y2Ba只有将植株从短光周期转到长光周期后,才能观察到RNAi品系。这一发现表明gydF4y2BaANN5gydF4y2Ba敲除对光周期长度的变化更敏感,并且进一步暗示ANN5参与光反应。gydF4y2Ba
花粉活力与花粉粒大小相关gydF4y2BaANN5gydF4y2Ba表达水平gydF4y2Ba
表型研究表明,生殖阶段的开始在小鼠体内延迟gydF4y2BaANN5gydF4y2Ba与野生型Col-0植物相比,RNAi敲除植物的形态特征,即叶丛形成、叶片形态和花序结构,通常不受影响。然而,在野生型Col-0植物中观察到具有额外花瓣和/或缺失雄蕊的异常花gydF4y2BaANN5gydF4y2Barnai沉默的植物(附加文件gydF4y2Ba1gydF4y2Ba:图S3)。我们接下来测试是否抑制gydF4y2BaANN5gydF4y2Ba表达影响花粉活力,利用亚历山大溶液区分败育和未败育花粉粒。囊里的gydF4y2BaANN5gydF4y2Ba与野生型相比,rnai沉默系含有大量败育的花粉粒(绿色)和少量鲜艳的花粉粒(粉红色)gydF4y2BaANN5gydF4y2Ba-OE_2电厂(附加文件gydF4y2Ba1gydF4y2Ba:图S3)。gydF4y2Ba
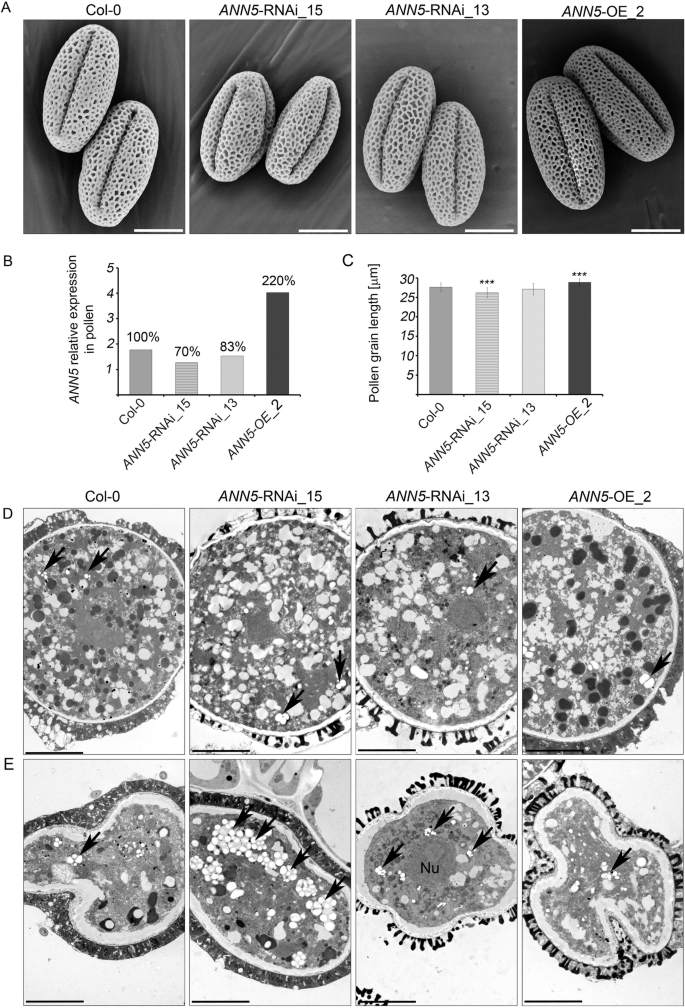
花粉粒gydF4y2BaANN5gydF4y2Ba用扫描电镜进一步观察rnai沉默系。细胞壁形成不受影响gydF4y2BaANN5gydF4y2BaRNAi-silenced和gydF4y2BaANN5gydF4y2Ba-OE_2花粉,但平均花粉粒大小受影响。gydF4y2BaANN5gydF4y2Barnai沉默的花粉粒明显短于gydF4y2BaANN5gydF4y2Ba-OE_2花粉粒和野生型花粉粒(图。gydF4y2Ba2gydF4y2Ba和gydF4y2BacgydF4y2Ba).gydF4y2BaANN5gydF4y2Ba在col0植物中,转录本丰度与花粉成熟相关。gydF4y2Ba1 cgydF4y2Ba) [gydF4y2Ba7gydF4y2Ba]因此,我们用透射电子显微镜检查了变异株系和野生株系的花粉成熟情况。花期前后收集的花粉粒显微照片表明,所有拟南芥基因型的花粉粒成熟过程相似(图。gydF4y2Ba二维gydF4y2Ba额外的文件gydF4y2Ba1gydF4y2Ba:图S4)。VC的深度重组包括:i)沉积在质体内的淀粉粒的部分水解,ii)大量最初的小泡的形成,最终产生形成“泡沫”细胞质的复杂结构,iii)沉积在油体中的储存脂质的转换。与野生型成熟花粉粒不同的是,野生型成熟花粉粒通常每个质体含有一个淀粉粒gydF4y2BaANN5gydF4y2Barnai沉默的花粉粒通常含有几个淀粉粒(图。gydF4y2Ba二维gydF4y2Ba).塌缩的花粉粒gydF4y2BaANN5gydF4y2BaRNAi击倒植物(特别是那些gydF4y2BaANN5gydF4y2Ba-RNAi_15系)含有比野生型和野生型败育花粉大得多的淀粉粒gydF4y2BaANN5gydF4y2Ba-OE_2植物(图。gydF4y2Ba2 egydF4y2Ba).塌缩花粉粒淀粉含量高gydF4y2BaANN5gydF4y2BaRNAi沉默株系表明,小孢子败育可能发生在淀粉水解之前,而淀粉水解通常发生在双细胞期之后,即精子形成时[gydF4y2Ba2gydF4y2Ba].gydF4y2Ba
的影响gydF4y2BaANN5gydF4y2Ba在成熟花粉粒大小上的表达。(gydF4y2Ba一个gydF4y2Ba)野生型拟南芥花粉粒扫描电镜图(Col-0);gydF4y2BaANN5gydF4y2Ba-RNAi_15,gydF4y2BaANN5gydF4y2Ba-RNAi_13,gydF4y2BaANN5gydF4y2Ba-OE_2。比例尺= 10 μm。(gydF4y2BabgydF4y2Ba的相对表达gydF4y2BaANN5gydF4y2Ba在野生型拟南芥(Col-0)成熟花粉粒中,gydF4y2BaANN5gydF4y2Ba-RNAi_15,gydF4y2BaANN5gydF4y2Ba-RNAi_13,gydF4y2BaANN5gydF4y2Ba-OE_2。每一列以上的值表示为gydF4y2BaANN5gydF4y2Ba表达量与野生型相比(100%)。(gydF4y2BacgydF4y2Ba)野生型拟南芥成熟花粉粒平均长度(Col-0);gydF4y2BaANN5gydF4y2Ba-RNAi_15,gydF4y2BaANN5gydF4y2Ba-RNAi_13,gydF4y2BaANN5gydF4y2Ba-OE_2。gydF4y2BangydF4y2Ba= 50。星号表示与野生型花粉值有显著差异(单因素方差分析,Dunnett post - hoc检验,*gydF4y2BapgydF4y2Ba< 0.05;Arunachal Pradesh,gydF4y2BapgydF4y2Ba< 0.01;***gydF4y2BapgydF4y2Ba < 0.001)。条形代表SD(gydF4y2BadgydF4y2Ba)和(gydF4y2BaegydF4y2Ba基因型突变拟南芥花粉粒超微结构的研究gydF4y2BaANN5gydF4y2Ba表情(gydF4y2BadgydF4y2Ba透射电子显微照片显示了可存活的成熟花粉粒的超微结构细节,而(gydF4y2BaegydF4y2Ba)显示野生型拟南芥Col-0,gydF4y2BaANN5gydF4y2Ba-RNAi_15,gydF4y2BaANN5gydF4y2Ba-RNAi_13,gydF4y2BaANN5gydF4y2Ba-OE_2。参见附加文件gydF4y2Ba1gydF4y2Ba:图S3和S4。核,黑色箭头:质体。比例尺= 5 μmgydF4y2Ba
ANN5gydF4y2Ba是雌蕊花粉管生长所必需的gydF4y2Ba
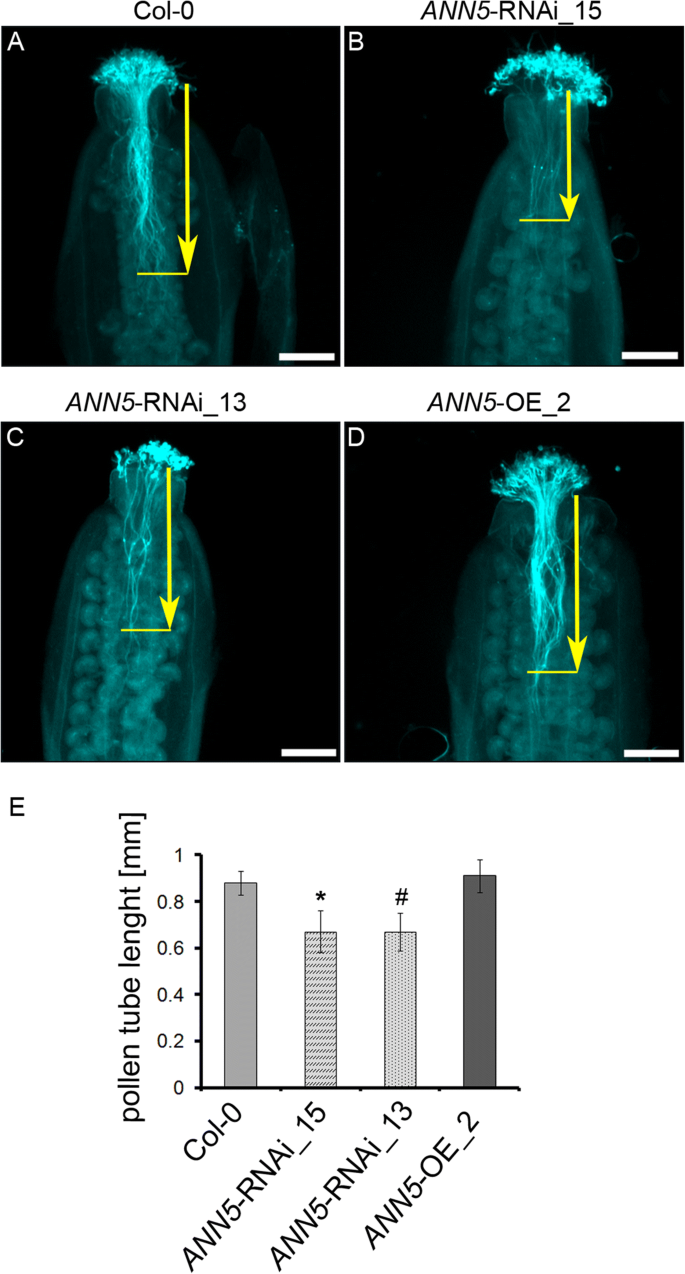
影响花粉粒大小和活力gydF4y2BaANN5gydF4y2Ba.前人研究表明,种子发芽率和花粉管生长gydF4y2BaANN5gydF4y2Ba固体培养基上的rnai沉默、OE和野生型花粉相似,试管没有形态畸变[gydF4y2Ba13gydF4y2Ba]这里,用人工授粉雌蕊来评估gydF4y2BaANN5gydF4y2Barnai沉默和OE花粉粒在自然条件下在柱头上萌发和伸长。分别采集雌蕊3,6和gydF4y2Ba24gydF4y2BahgydF4y2Ba后gydF4y2Ba授粉和gydF4y2Ba检查gydF4y2Ba为gydF4y2Ba花粉管生长gydF4y2Ba使用荧光技术。由同一花粉粒衍生的单个花粉管之间的生长速率反复观察到很大的差异gydF4y2BaANN5gydF4y2Ba相比之下,野生型和OE系的花粉管生长速率更为相似。授粉后3和6小时,大多数花粉管的生长速率与野生型和OE系相当gydF4y2BaANN5gydF4y2BaRNAi沉默的花粉管没有进入雌蕊传递组织,尽管使用了过量的花粉粒gydF4y2BaANN5gydF4y2BaRNAi敲除植株的花粉管较野生型短。经验证,差异具有统计学意义(图。gydF4y2Ba3.gydF4y2Ba).两种植物花粉管长度无显著性差异gydF4y2BaANN5gydF4y2Ba-OE_2和野生型。然而,这种差异gydF4y2BaANN5gydF4y2Ba24h后不再观察到RNAi敲除和野生型(附加文件)gydF4y2Ba1gydF4y2Ba(图S5),此时所有基因型的花粉管都已穿过子房到达胚珠。花粉管生长速度是花粉竞争能力的主要决定因素,花粉管生长受阻或延迟gydF4y2BaANN5gydF4y2Ba雌蕊中rnai沉默的花粉管表明雄配子体竞争力较低。gydF4y2Ba
花粉管的生长在雌蕊gydF4y2BaANN5gydF4y2BaRNAi-silenced线。人工授粉6h后,花粉管固定并苯胺蓝染色。gydF4y2Ba一个gydF4y2Ba)野生型Col-0, (gydF4y2BabgydF4y2Ba)gydF4y2BaANN5gydF4y2Ba-RNAi_15 (gydF4y2BacgydF4y2Ba)gydF4y2BaANN5gydF4y2Ba-RNAi_13, (gydF4y2BadgydF4y2Ba)gydF4y2BaANN5 -gydF4y2BaOE_2植物。花粉管苯胺蓝染色按[gydF4y2Ba19gydF4y2Ba].黄色箭头表示花粉管从花柱顶部到最长花粉管前部的长度。(gydF4y2BaegydF4y2Ba)雌蕊花粉管的平均长度。gydF4y2BangydF4y2Ba= 3个独立实验。星号表示与野生型相比有显著差异(单因素方差分析,Dunnett事后检验,(gydF4y2Ba#gydF4y2BapgydF4y2Ba = 0.0501; *gydF4y2BapgydF4y2Ba< 0.05;* * p < 0.01;***gydF4y2BapgydF4y2Ba< 0.001)。参见附加文件gydF4y2Ba1gydF4y2Ba:图S5。比例尺= 200 μmgydF4y2Ba
种子总产量与产量相关gydF4y2BaANN5gydF4y2Ba表达水平gydF4y2Ba
虽然花粉活力降低,gydF4y2BaANN5gydF4y2BaRNAi敲除的植株仍能产生足够数量的活花粉,以成功进行生殖。以量化经改良的品系的最终种子产量gydF4y2BaANN5gydF4y2Ba表达,每个基因型收集1000个种子,并在立体显微镜下测量单个种子面积。gydF4y2BaANN5gydF4y2Barnai沉默的种子较小gydF4y2BaANN5gydF4y2Ba-OE_2种子比col0野生型种子大。gydF4y2Ba4gydF4y2Ba).为了检验主螺栓上的角质层位置是否影响种子大小,将单个角质层分组,由5个连续的角质层组成,计算每组的平均种子大小。在所有被测基因型中,平均种子大小向茎部向上下降(图。gydF4y2Ba4摄氏度gydF4y2Ba).在主栓第15角柱处,col0和col0野生型种子发育均匀gydF4y2BaANN5gydF4y2BaRNAi击倒的植物。在15角果以上,平均种子大小较低gydF4y2BaANN5gydF4y2Ba与野生型相比,RNAi细胞系的数量有所增加。平均种子大小从主螺栓到最后检查的角,在第40节连续减小。收集的种子gydF4y2BaANN5gydF4y2Ba-OE_2植株在主栓第11节和第40节之间的种子始终大于野生型。gydF4y2Ba
的影响gydF4y2BaANN5gydF4y2Ba种子产量的表达。(gydF4y2Ba一个gydF4y2Ba野生型拟南芥(Col-0)主要茎杆第36-40位角果分离干燥种子和复水后的胚;gydF4y2BaANN5gydF4y2Ba-RNAi_15,gydF4y2BaANN5gydF4y2Ba-RNAi_13,gydF4y2BaANN5gydF4y2Ba-OE_2。比例尺= 500 μm。(gydF4y2BabgydF4y2Ba)单个生物复制的集合种子的平均大小。gydF4y2BangydF4y2Ba= 1000。三个独立的实验都得到了类似的结果。星号表示与野生型种子相比有显著差异(单因素方差分析,Dunnett post hoc检验,*gydF4y2BapgydF4y2Ba< 0.05;Arunachal Pradesh,gydF4y2BapgydF4y2Ba< 0.01;***gydF4y2BapgydF4y2Ba < 0.001)。条形代表SD(gydF4y2BacgydF4y2Ba)从主螺栓上指定位置的角果中收集的种子的平均大小,从单个生物复制中收集。gydF4y2BangydF4y2Ba= 120 - 150。酒吧代表SDgydF4y2Ba
在拟南芥中,胚占成熟种子总体积的大部分,因此,干种子的最终大小主要取决于胚的大小。胚胎切割的gydF4y2BaANN5gydF4y2Barnai沉默的种子比野生型种子小。gydF4y2Ba4gydF4y2Ba).这些结果表明,ANN5在拟南芥生命周期的生殖阶段影响花和种子的发育。gydF4y2Ba
多室靶向ANN5-GFPgydF4y2Ba
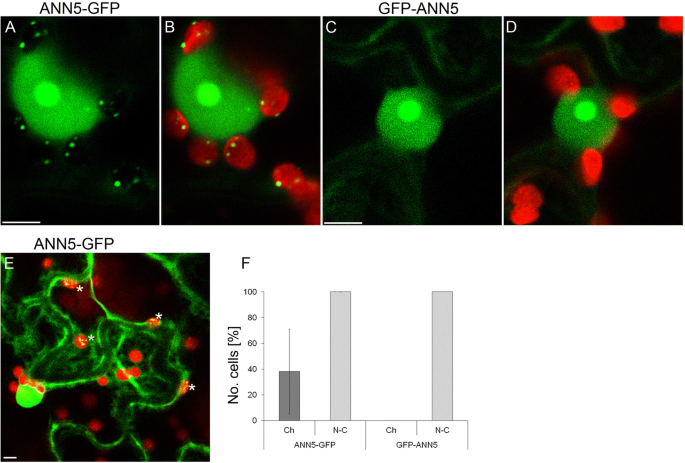
分析了ANN5的亚细胞定位,以了解其功能背后的机制。氨基酸序列的生物信息学分析表明其具有多室定位。PSORT预测核定位,而WoLF PSORT和nucl - plos分别预测质体定位或核仁定位。瞬态的表达gydF4y2Ba35 s: ANN5-GFPgydF4y2Ba和gydF4y2Ba35 s: GFP-ANN5gydF4y2Ba基因结构gydF4y2Ba烟草benthamianagydF4y2Ba叶片用于检测ANN5在体内的亚细胞定位。共聚焦显微镜分析显示,ANN5-GFP定位于所有被检测表皮细胞的细胞核、核仁和细胞质(图。gydF4y2Ba5gydF4y2Ba).在许多细胞中,gydF4y2BaANN5-GFPgydF4y2Ba在表皮质体内部也积累了斑点,因此与预测完全一致。gydF4y2Ba
ANN5在表皮细胞中的亚细胞定位。共焦光学截面gydF4y2Ban benthamianagydF4y2Ba叶表皮细胞描绘了细胞的定位(gydF4y2Ba一个gydF4y2Ba标记ANN5的c端(35S:ANN5- gfp), (gydF4y2BabgydF4y2Ba) ANN5-GFP定位与叶绿素自身荧光融合,(gydF4y2BacgydF4y2Ban端标记ANN5 (35S:GFP-ANN5),和(gydF4y2BadgydF4y2Ba) GFP-ANN5定位与叶绿素自身荧光融合。比例尺= 10 μm。(gydF4y2BaegydF4y2Ba)两个相邻表皮细胞的共聚焦光学切片显示ANN5-GFP在质体内定位的不同模式。白色星号表示含有ANN5-GFP的质体。比例尺= 10 μm。(gydF4y2BafgydF4y2Ba) ANN5-GFP和GFP-ANN5在核质(N-C)或质体(Ch)定位的细胞百分比。这些数据是通过三个独立的实验获得的。酒吧代表SDgydF4y2Ba
在不同的实验中,ANN5-GFP定位于质体的细胞数量差异显著。值得注意的是,当在一个细胞的质体中发现ANN5时,该细胞的所有质体中都含有ANN5(图5)。gydF4y2Ba5 egydF4y2Ba).n端GFP标记导致ANN5定位于细胞核、核仁和细胞质,但消除了质体分布(图)。gydF4y2Ba5度gydF4y2Ba和gydF4y2BadgydF4y2Ba).ANN5在质体内的点状分布与类核的定位相似。为了测试这一点,叶子样本表达gydF4y2Ba35 s: ANN5-YFPgydF4y2Ba用DAPI染色:与DAPI染色的质体DNA完全共定位的质体中ANN5斑点(图。gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
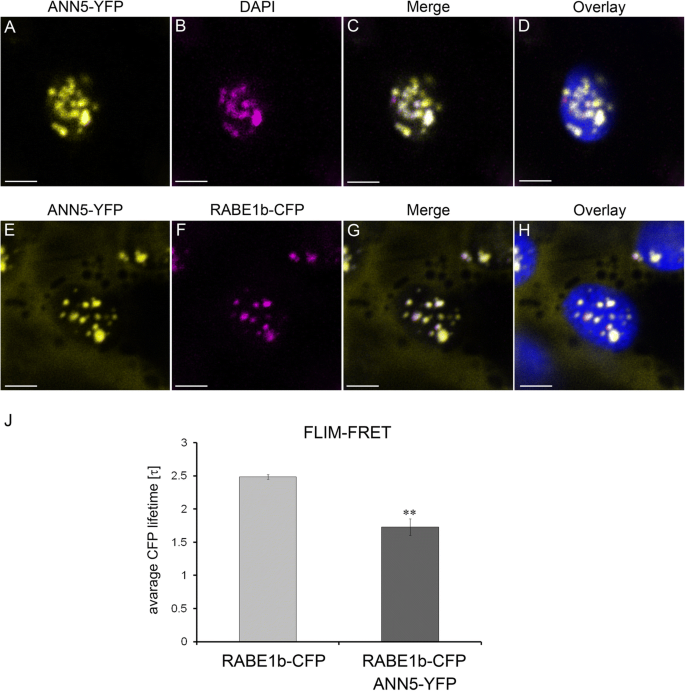
ANN5与RABE1b在质体类核中相互作用。上面板(gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BabgydF4y2Ba):激光共聚焦光学部分gydF4y2Ban benthamianagydF4y2Ba瞬时表达ANN5-YFP的叶表皮质体(gydF4y2Ba一个gydF4y2Ba), DAPI (1 μg ml-1,室温下保存15 min), 2%多聚甲醛固定(4℃下保存24 h) (gydF4y2BabgydF4y2Ba).ANN5-YFP(黄色)的假彩色荧光(gydF4y2BabgydF4y2Ba) DAPI(洋红色),(gydF4y2BacgydF4y2Ba)合并ANN5-YFP和DAPI通道,(gydF4y2BadgydF4y2Ba)覆盖叶绿素自身荧光(蓝色)。下面板(E-H):共焦光学截面gydF4y2Ban benthamianagydF4y2Ba叶表皮质体瞬时共表达ANN5-YFP (E)和RABE1b-CFP (gydF4y2BafgydF4y2Ba).假彩色荧光(gydF4y2BaegydF4y2Ba) ANN5-YFP(黄色),(gydF4y2BafgydF4y2Ba) RABE1b-CFP(品红),(gydF4y2BaggydF4y2Ba)ANN5-YFP和RABE1b CFP的合并通道,以及(gydF4y2BahgydF4y2Ba)覆盖叶绿素自身荧光(蓝色)。参见附加文件gydF4y2Ba1gydF4y2Ba:图S6.比例尺 = 10μm(gydF4y2BajgydF4y2Ba) FLIM-FRET分析ANN5和RABE1b在质体核仁中的相互作用。在供体叶片样品中测量了CFP的平均寿命gydF4y2Ban benthamianagydF4y2Ba仅表达RABE1b-CFP且在共表达RABE1b-CFP和ANN5-YFP的样品中存在受体。gydF4y2BangydF4y2Ba= 7个独立的表皮细胞。测量是在每个细胞的单个质体上进行的,**表示有统计学意义的差异(学生的t检验,gydF4y2BapgydF4y2Ba < 0.05)gydF4y2Ba
在质体类核中,ANN5与RABE1b相互作用gydF4y2Ba
以鉴定ANN5结合伙伴,12日龄拟南芥幼苗表达gydF4y2Ba35 s: ANN5-YFPgydF4y2Ba使用GFP-TRAP系统和质谱法进行共免疫沉淀实验。在ANN5-YFP样品和对照GFP样品之间比较鉴定的蛋白质,排除与GFP非特异性共纯化的蛋白质。预测许多鉴定的蛋白质定位于质体中,表明其中许多结合可能发生在质体核仁中。为了进一步研究ANN5在质体中的特异性相互作用,从预测定位于质体中的蛋白质中确定了潜在的结合伙伴(附加文件gydF4y2Ba1gydF4y2Ba:表S4)。其中,RABE1b具有最高的Mascot得分,并且是推测的与质体相关的GTPase,我们选择它进行进一步的鉴定。gydF4y2Ba
瞬时共表达gydF4y2Ba35 s: ANN5-YFPgydF4y2Ba和gydF4y2Ba35 s: RABE1b-CFPgydF4y2Ba在gydF4y2Ban benthamianagydF4y2Ba用于确定ANN5和RABE1b是否定位于同一细胞室。当单独表达时,ANN5定位于细胞核、核仁和质体核仁(图。gydF4y2Ba5gydF4y2Ba), RABE1b-GFP主要在质体核仁中发现,在细胞质中发现较少(附文件)gydF4y2Ba1gydF4y2Ba:图S6)。当共表达时,在相同的质体核仁内检测到RABE1b CFP和ANN5-YFP(图。gydF4y2Ba6ggydF4y2Ba).使用flimt - fret分析确定ANN5和RABE1b是否相互作用。在质体中,供体RABE1b-CFP的平均寿命在假定的受体ANN5-YFP存在时显著降低(图5)。gydF4y2Ba6jgydF4y2Ba)这证实了质体核仁中ANN5和RABE1b之间的物理相互作用。gydF4y2Ba
ANN5gydF4y2Ba影响拟南芥幼苗子叶叶绿素含量gydF4y2Ba
为了验证ANN5是否影响质体相关功能,我们分析了不同拟南芥幼苗的绿化gydF4y2BaANN5gydF4y2Ba表达水平。为此,将幼苗在不含或不含蔗糖的MS培养基上培养10天(附加文件gydF4y2Ba1gydF4y2Ba:图S7A)。鉴于gydF4y2BaANN5gydF4y2Ba在野生型幼苗中几乎检测不到表达,异位表达gydF4y2BaANN5gydF4y2Ba导致丰富的转录水平(附加文件gydF4y2Ba1gydF4y2Ba:图S7C)。用分光光度法测定了苗期叶绿素a和b的含量gydF4y2BaANN5gydF4y2Ba在这两种培养基上,OE系显著低于野生型幼苗(补充文件gydF4y2Ba1gydF4y2Ba:图S7B)。接下来我们比较了与叶绿素代谢相关的基因的表达,通过RT-qPCR分析(附加文件)gydF4y2Ba1gydF4y2Ba:图S7C和D)。两者gydF4y2BaANN5gydF4y2BaOE系叶绿素生物合成相关基因表达减少(gydF4y2BaHEMA1gydF4y2Ba,gydF4y2Ba枪4gydF4y2Ba,gydF4y2Ba枪5gydF4y2BaCgydF4y2BaHLI1gydF4y2Ba)光合作用(gydF4y2BaPsbAgydF4y2Ba,gydF4y2BaLHCB1gydF4y2Ba),而叶绿素分解基因的表达(gydF4y2BaNYC1gydF4y2Ba,gydF4y2BaNYE1gydF4y2Ba,gydF4y2Ba传奇29gydF4y2Ba),但仅在蔗糖存在的情况下。这些数据表明gydF4y2BaANN5gydF4y2Ba过表达影响拟南芥幼苗叶绿素积累。gydF4y2Ba
讨论gydF4y2Ba
ANN5在拟南芥的生殖发育过程中起着重要的作用gydF4y2Ba
这项研究的结果为ANN5在拟南芥发育过程中的功能提供了新的见解gydF4y2BaANN5gydF4y2Ba野生型拟南芥各器官间存在转录积累(图。gydF4y2Ba1gydF4y2Ba),其mRNA水平在成熟花粉中最高。这些结果与之前的研究一致,表明rnai介导的抑制gydF4y2BaANN5gydF4y2Ba影响花粉发育,导致花粉活力降低[gydF4y2Ba8gydF4y2Ba].与野生型花粉粒相比,我们的RNAi敲除系的活花粉粒尺寸较小,并且它们在雌蕊中的生长受到阻碍(图。gydF4y2Ba2gydF4y2Ba和gydF4y2Ba3.gydF4y2Ba).除了在花粉粒发育中发挥作用外,通过表型研究,我们发现ANN5还参与了胚胎发育和从营养生长到生殖生长的转变(表)gydF4y2Ba1gydF4y2Ba,图。gydF4y2Ba4gydF4y2Ba).抑制gydF4y2BaANN5gydF4y2Ba导致延长营养体发育和减少胚胎大小,而gydF4y2BaANN5gydF4y2Ba对花粉和胚的大小都有积极的影响。因此,我们推断ANN5在拟南芥的生殖发育过程中主要促进细胞生长。gydF4y2Ba
ANN5在质体功能中的作用gydF4y2Ba
与观察到的其他植物膜联蛋白的主要胞质定位相比,ANN5显示出一种不寻常的亚细胞定位模式[gydF4y2Ba11gydF4y2Ba].ANN5占据了两个含有dna的细胞室(细胞核和质体),并与显著的亚细胞器结构(核仁和质体类核)相关联(图5)。gydF4y2Ba5gydF4y2Ba和gydF4y2Ba6gydF4y2Ba)。ANN5在一部分细胞中的质体定位表明ANN5是可移动的,可能会流向质体。带有GFP的ANN5的N端标记抑制了其对质体的靶向性,而其核分布保持不变(图。gydF4y2Ba5gydF4y2Ba).这证实了n端结构域是ANN5导入质体的关键。此外,质谱分析ANN5的GFP c端融合检测到n端衍生的肽,表明这个信号是不可剪切的。然而,不能排除ANN5核导入不需要加工,但导入质体需要切割n端信号肽的情况。这种情况意味着ANN5从细胞核到质体的运输是单向的,或者,n端序列在质体中被保护不被切割,从而允许ANN5在室间穿梭。gydF4y2Ba
质体是植物特有的细胞器,拥有自己的基因组和完整的基因表达系统[gydF4y2Ba29gydF4y2Ba].除老年质体外,每一种类型的质体都含有多个质体DNA的拷贝,这些拷贝排列成紧凑的结构,称为类核。质体核仁包含RNA和大量参与维持核仁功能的蛋白质,如转录、复制、RNA加工和核糖体组装[gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba].然而,大多数质体功能所需的蛋白质是由核基因组编码的。质体功能的调节因此不断地与核基因组的活动协调。越来越多的证据表明,许多核蛋白也以质体为目标。许多蛋白质的双重靶向机制尚不清楚。然而,以前的研究表明双重靶向可能是同时的或顺序的[gydF4y2Ba32gydF4y2Ba].最初针对质体并随后转移到细胞核的蛋白质可能在逆行信号中发挥作用。这种易位机制最近被证实为HEMERA/pTAC12,它首先靶向质体,在其过境肽裂解后转移到细胞核[gydF4y2Ba33gydF4y2Ba].我们的结果表明,ANN5主要定位于细胞核,然后转移到质体。我们假设ANN5直接从细胞核转位到质体类核,然后改变质体的功能。与此模型一致的是,ANN5对叶绿素含量和叶绿素代谢相关基因的表达有负向影响。gydF4y2BaHEMA1gydF4y2Ba,gydF4y2Ba枪4gydF4y2Ba,gydF4y2Ba枪5gydF4y2BaCgydF4y2BaHLI1gydF4y2Ba,gydF4y2BaPsbAgydF4y2Ba,gydF4y2BaLHCB1gydF4y2Ba(附加文件gydF4y2Ba1gydF4y2Ba:图S7)。对这些基因的表达水平进行主成分分析(PCA),发现Col-0和Col-0对应的组之间存在明显的差异gydF4y2BaANN5gydF4y2Ba-过表达系,表明ANN5的存在对叶绿素代谢的全球影响。被检测基因的表达对质体信号很敏感[gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba]提示ANN5参与质体与细胞核之间的通讯。有趣的是,在生长培养基中添加蔗糖上调了与叶绿素降解相关的基因gydF4y2BaANN5gydF4y2Ba-overexpressing行(gydF4y2BaNYC1gydF4y2Ba,gydF4y2BaNYE1gydF4y2Ba,gydF4y2Ba传奇29gydF4y2Ba),表明ANN5参与蔗糖信号通路。需要进一步的工作来识别驱动ann5依赖的质体功能重编程的特定信号。最近的研究表明,核基因表达的逆行调节涉及钙信号[gydF4y2Ba39gydF4y2Ba].钙离子从质体中释放到胞质中是对特定刺激的反应[gydF4y2Ba40gydF4y2Ba].胞质钙瞬态是由质体定位的钙敏感受体CAS介导的。这一过程激活了MAP(丝裂原活化蛋白)激酶级联,进而调节细胞核中转录因子ABI4的活性。ANN5的亚细胞分布模式及其钙依赖的脂质结合能力可能反映了其在细胞核与质体间的串音或胞内钙信号传导中的作用。值得注意的是,以前的研究表明,针对特定环境刺激,膜蛋白的胞内再分配是由胞质中的瞬时钙离子诱导的[gydF4y2Ba41gydF4y2Ba].gydF4y2Ba
总之,我们假设ANN5作为一个特定的钙信号解码器,协调质体和核基因组活动响应发育和环境线索。核与质体间双向通讯的紊乱可能是导致生殖发育迟滞的原因gydF4y2BaANN5gydF4y2BaRNAi-silenced植物。然而,我们的ANN5细胞内再分配依赖于钙的假说需要实验验证。gydF4y2Ba
在质体分化过程中,核仁经历了强烈的重塑和空间排列的改变,但仍与质体的内膜有关[gydF4y2Ba31gydF4y2Ba]尽管发育不良,但人们认为拟南芥花粉粒质体的内膜系统具有光合作用活性[gydF4y2Ba2gydF4y2Ba].由于花粉和胚胎都是吸收植物其他部位营养的器官,它们的光合结构可能与光能转化为糖以外的过程有关。花粉粒质体中的光合复合物的作用可能与胚胎相似,产生活性氧来调节质体内部的过程,以及对逆行信号的响应,在细胞核中[gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba].最近的研究表明,质体核仁充当了参与质体代谢的蛋白质的对接平台,这些蛋白质受光合器官氧化还原变化的调节[gydF4y2Ba45gydF4y2Ba].因此,我们可以推测,通过结合膜离子和钙离子的结合能力,ANN5可能在核仁和塑质内膜之间的界面起作用。大多数质体/核靶向蛋白被证明参与质体DNA/RNA代谢或翻译[gydF4y2Ba46gydF4y2Ba].因此,我们认为ANN5与膜结合核仁的关联可能是信号从光合器官传递到质体的转录/翻译机制所必需的。gydF4y2Ba
ANN5gydF4y2Ba表达与小孢子减数分裂后发育相关,伴随着质体功能的实质性重组。gydF4y2BaANN5gydF4y2Ba双细胞小孢子启动子活性观察[gydF4y2Ba8gydF4y2Ba],鉴于gydF4y2BaANN5gydF4y2BamRNA水平在三细胞小孢子中最高,在成熟花粉中保持较高水平[gydF4y2Ba7gydF4y2Ba].在花粉粒发育的最初阶段,质体集中积累淀粉,这些淀粉沉积下来,直到小孢子发育的双细胞阶段[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba47gydF4y2Ba].从这一阶段到花粉粒成熟,沉积的淀粉粒几乎完全水解。以前的研究报道质体通过糖酵解产生能量以支持花粉成熟和花粉管生长[gydF4y2Ba6gydF4y2Ba].这些发现以及我们观察到的ANN5定位于质体并影响编码质体蛋白的核基因的表达,提高了ANN5可能参与花粉发育后期质体重组的可能性。淀粉粒在败育的花粉粒中积累gydF4y2BaANN5gydF4y2BaRNAi_15线。这表明花粉粒败育发生在双细胞期,这与前人的研究一致[gydF4y2Ba8gydF4y2Ba].我们因此得出结论,抑制gydF4y2BaANN5gydF4y2Ba在双细胞发育阶段,阻碍花粉进入下一个发育阶段,最终导致花粉败育。虽然平均花粉粒大小显著降低gydF4y2BaANN5gydF4y2BaRNAi系、单个花粉粒发育无明显畸变(图2)。gydF4y2Ba2gydF4y2Ba),可能是因为gydF4y2BaANN5gydF4y2Ba未被完全抑制(图。gydF4y2Ba2 bgydF4y2Ba).的gydF4y2BaANN5gydF4y2Ba基因敲除表型与拟南芥突变株的表型相似,这些突变株与质体功能相关的基因有缺陷,包括质体糖酵解,影响花粉形成、花粉管生长和胚胎发生[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba48gydF4y2Ba,gydF4y2Ba49gydF4y2Ba].抑制gydF4y2BaANN5gydF4y2Ba可能导致质体功能障碍,进而影响细胞的能量状态,从而导致细胞生长减少或崩溃,我们假设发生在花粉成熟和胚胎生长过程中。gydF4y2Ba
ANN5和RABE1b相互作用对质体功能的重要性gydF4y2Ba
大量预测的质体靶向蛋白被鉴定为与ANN5共纯化,包括3-磷酸甘油醛脱氢酶(GAPDH)的RABE1b、GAPA和GAPB亚单位、质体伴侣和核糖体蛋白(附加文件gydF4y2Ba1gydF4y2Ba:表S4)。进一步表征RABE1b揭示了在质体核仁内与ANN5的物理相互作用(图。gydF4y2Ba6jgydF4y2Ba).虽然RABE1b的生物学功能尚不清楚,但该蛋白含有一个GTPase结构域,属于rabb GTPase家族成员,提示其可能参与细胞内运输[gydF4y2Ba50gydF4y2Ba].一些参与转运机制的蛋白质被预测是质体靶向的,提出了质体内囊泡转运的建议[gydF4y2Ba51gydF4y2Ba].鉴于膜联蛋白和rabb GTPases都参与膜运输,因此ANN5和RABE1b似乎都需要维持附着在质体内膜上的质体核仁的组织和功能。gydF4y2Ba
RABE1b与翻译延伸因子EFTu/EF1A (gydF4y2Bawww.arabidopsis.orggydF4y2Ba)因此,它很可能属于翻译GTP酶[gydF4y2Ba52gydF4y2Ba].在我们假设的ANN5功能模型中,我们提出ANN5与RABE1b的相互作用发生在双细胞小孢子的质体核仁中。我们推测ANN5和RABE1b的协同作用可能驱动了花粉粒成熟过程中质体功能的重编程。需要进一步研究来阐明ANN5和RABE1b在质体类核中的相互作用,并确定它们的功能是否与DNA/RNA代谢或蛋白质合成有关。gydF4y2Ba
结论gydF4y2Ba
总之,通过这项工作,我们表明ANN5在营养生长到生殖生长、雄性配子体发育和胚胎生长的基础发育过程中是必需的。ANN5可能通过其在细胞核和质体类核中的膜运输功能来完成这些活动。我们未来的工作将集中在ANN5和RABE1b的相互作用如何影响质体功能,特别是在花粉粒发育过程中。gydF4y2Ba
缩写gydF4y2Ba
- FLIM-FRET:gydF4y2Ba
-
荧光寿命成像显微镜-Förster共振能量转移gydF4y2Ba
- ld:gydF4y2Ba
-
漫长的一天gydF4y2Ba
- OE:gydF4y2Ba
-
超表达gydF4y2Ba
- 主成分分析:gydF4y2Ba
-
主成分分析gydF4y2Ba
- RNAi:gydF4y2Ba
-
RNA干扰gydF4y2Ba
- sd:gydF4y2Ba
-
短暂的一天gydF4y2Ba
- SD:gydF4y2Ba
-
标准偏差gydF4y2Ba
- 风险投资:gydF4y2Ba
-
营养细胞gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
Owen HA,Makaroff CA.。小鼠小孢子发生和微配子发生的超微结构gydF4y2Ba拟南芥gydF4y2Ba(l)Heynh。生态型Wassilewskija(十字花科)。原生质。1995;185:7-21。gydF4y2Ba
- 2.gydF4y2Ba
匡A,我是马斯格雷夫。拟南芥生殖细胞形成和花粉成熟过程中营养细胞质的动态。原生质。1996;194:81 - 90。gydF4y2Ba
- 3.gydF4y2Ba
这是一个时间问题:花粉发育的异步性及其对被子植物花粉性能的影响。原生质。2017;254(1):57 - 73。gydF4y2Ba
- 4.gydF4y2Ba
花粉发育、呈现和扩散过程中的碳水化合物和水分含量:一个简短的综述。原生质。2006;228(1 - 3):73 - 7。gydF4y2Ba
- 5.gydF4y2Ba
王志强,王志强,王志强,等。花粉中碳水化合物储量的类型:定位、系统分布和生态生理意义。植物。1996;191:143-59。gydF4y2Ba
- 6.gydF4y2Ba
Selinski J,Scheibe R.花粉管生长:能量从何而来?植物信号行为.2014;9(12):e977200。gydF4y2Ba
- 7.gydF4y2Ba
Rutley N,Twell D.《花粉转录组学十年》。植物繁殖。2015;28(2):73-89。gydF4y2Ba
- 8.gydF4y2Ba
朱军,袁松,魏刚,钱东,吴旭,贾洪,桂明,刘伟,安亮,向宇。拟南芥花粉发育的关键因子是Annexin5。摩尔。2014;7(4):751 - 4。gydF4y2Ba
- 9gydF4y2Ba
Konopka Postopolska D,Clark G.被忽视的植物细胞膜转运调节因子的膜联蛋白.国际分子科学杂志,2017;18(4)gydF4y2Ba
- 10.gydF4y2Ba
戴维斯JM。植物膜联蛋白介导的钙信号。植物(巴塞尔)。2014; 3(1): 128 - 40。gydF4y2Ba
- 11.gydF4y2Ba
《新植物志》2011;189(1):40-53。gydF4y2Ba
- 12.gydF4y2Ba
lahavisit A, Brown AT, Cicuta P, Davies JM。膜联蛋白:钙和活性氧信号网络的组成部分。植物杂志。2010;152(4):1824 - 9。gydF4y2Ba
- 13.gydF4y2Ba
朱杰,吴X,袁S,钱D,南Q,安利,项Y。附件5通过Ca2在拟南芥花粉发育中起着重要作用+−依赖性膜转运,《公共科学图书馆综合》2014;9(7):2014。gydF4y2Ba
- 14.gydF4y2Ba
李莉、方美杰、邝莉、格尔文。多色双分子荧光互补载体,用于研究活体植物细胞中的蛋白质-蛋白质相互作用。植物方法。2008;4:24.gydF4y2Ba
- 15.gydF4y2Ba
Hilson P, Allemeersch J, Altmann T, Aubourg S, Avon A, Beynon J, Bhalerao RP, Bitton F, Caboche M, Cannoot B, et al.;用于拟南芥功能基因组学的通用基因特异性序列标签:转录谱分析和反向遗传学应用。基因组研究》2004;14 b(10): 2176 - 89。gydF4y2Ba
- 16.gydF4y2Ba
农杆菌二元载体pPZP家族用于植物转化。acta botanica sinica(云南植物学报),1994;25(6):989-94。gydF4y2Ba
- 17.gydF4y2Ba
农杆菌介导的拟南芥转化的一种简化方法。植物j . 1998; 16(6): 735 - 43。gydF4y2Ba
- 18gydF4y2Ba
吕勇。拟南芥花粉的RNA分离。Bio-protocol。2011; Bio101: e67。gydF4y2Bahttps://doi.org/10.21769/BioProtoc.67gydF4y2Ba.gydF4y2Ba
- 19gydF4y2Ba
在被子植物受精过程中,生殖细胞SPECIFIC 1是必不可少的。细胞生物学杂志。2006;8(1):64-71。gydF4y2Ba
- 20.gydF4y2Ba
Herridge R,Day R,Baldwin S,Macknight R.用于突变体和QTL发现的拟南芥种子大小的快速分析.植物方法.2011;7(1):3。gydF4y2Ba
- 21.gydF4y2Ba
Giska F, Lichocka M, Piechocki M, Dadlez M, Schmelzer E, Hennig J, Krzymowska M.来自假单胞菌的III型效应体HopQ1的磷酸化,创造了宿主14-3-3蛋白的结合位点。植物杂志。2013;161(4):2049 - 61。gydF4y2Ba
- 22.gydF4y2Ba
对烟草叶盘胁迫耐性的研究。Bio-protocol。2015; 5 (7)gydF4y2Ba
- 23.gydF4y2Ba
Nakagawa T, Suzuki T, Murata S, Nakamura S, Hino T, Maeo K, Tabata R, Kawai T, Tanaka K, Niwa Y,等。改进的门户二元载体:在植物转基因分析中创建融合结构的高性能载体。生物技术与生物化学。2007;71(8):2095-100。gydF4y2Ba
- 24.gydF4y2Ba
Shen HB, Chou KC. nucl - ploc:一种基于PsePSSM和PseAA组合的蛋白质亚核定位预测网络服务器。蛋白质工程。2007;20(11):561-7。gydF4y2Ba
- 25.gydF4y2Ba
(1)拟南芥花的早期发育。植物细胞。1990;2(8):755 - 67。gydF4y2Ba
- 26.gydF4y2Ba
王志强,王志强,王志强,等。拟南芥植物寄生性线虫发育过程中结构的变化。原生质。1996;194(1 - 2):103 - 16。gydF4y2Ba
- 27.gydF4y2Ba
Kleemann J,Rivera LJ,Takahara H,Neumann U,Ver Loren van Themaat E,van der does HC,Hacquard S,Stuber K,Will I,Schmalenbach W,et al.植物病原炭疽菌附着胞和细胞内菌丝对寄主诱导的毒力效应物的顺序传递。PLoS Pathog.2012;8(4):e1002643。gydF4y2Ba
- 28.gydF4y2Ba
Clark GB, Sessions A, Eastburn DJ, Roux SJ。拟南芥膜联蛋白多基因家族成员的差异表达。植物杂志。2001;126(3):1072 - 84。gydF4y2Ba
- 29.gydF4y2Ba
张志强,张志强,张志强,等。拟南芥叶绿体基因组结构的初步研究。DNA研究》1999;6(5):283 - 90。gydF4y2Ba
- 30gydF4y2Ba
马吉兰W,弗里索G, Asakura Y,曲旭,黄敏,Ponnala L, Watkins KP, Barkan A, van Wijk KJ。玉米叶片中质体和叶绿体发育中的核丰富蛋白质组:核类功能的新概念框架。植物杂志。2012;158(1):156 - 89。gydF4y2Ba
- 31gydF4y2Ba
Powikrowska M,Oetke S,Jensen PE,Krupinska K.质体类核的动态组成、形成和组织。前沿植物科学。2014;5:424。gydF4y2Ba
- 32gydF4y2Ba
Krause K,Krupinska K.《在细胞器中有第二个家的核调节器》,《趋势植物科学》2009;14(4):194-9。gydF4y2Ba
- 33gydF4y2Ba
PaNevarez,Qiu Y,Inoue H,Yoo CY,Benfey PN,Schnell DJ,Chen M.光敏色素信号成分HEMERA/pTAC12对质体和细胞核双重靶向的机制。植物生理学。2017;173(4):1953-66。gydF4y2Ba
- 34.gydF4y2Ba
麦考马克AC,特里乔丹。拟南芥叶绿体发育过程中HEMA1和Lhcb协同表达的光信号途径。植物j . 2002; 32(4): 549 - 59。gydF4y2Ba
- 35.gydF4y2Ba
麦考马克AC,特里乔丹。核基因Lhcb和HEMA1对质体信号的敏感性不同,提示GUN1和GUN5质体信号通路在去黄化过程中发挥不同的作用。植物j . 2004; 40(5): 672 - 85。gydF4y2Ba
- 36.gydF4y2Ba
Ikegami A, Yoshimura N, Motohashi K, Takahashi S, Romano PG, Hisabori T, Takamiya K, Masuda T.拟南芥镁螯合酶CHLI1亚基是叶绿体硫氧还蛋白的靶蛋白。中国生物化学杂志。2007;282(27):19282-91。gydF4y2Ba
- 37.gydF4y2Ba
Brzezowski P, Sharifi MN, Dent RM, Morhard MK, Niyogi KK, Grimm B. Mg螯合酶在莱茵衣藻叶绿素合成和逆行信号转导中的作用:CHLI2不能替代CHLI1。J Exp Bot. 2016;67(13): 3925-38。gydF4y2Ba
- 38.gydF4y2Ba
Mochizuki N, Tanaka R, Tanaka A, Masuda T, Nagatani A. mg-原卟啉IX的稳态水平不是拟南芥质体到核信号的决定因素。中国科学(d辑:地球科学)2008;105(39):15184-9。gydF4y2Ba
- 39.gydF4y2Ba
郭华,冯鹏,迟伟,孙旭,徐旭,李勇,任东,卢超,David Rochaix J, Leister D,等。质体与细胞核的通讯涉及钙调节的MAPK信号。Nat Commun。2016;7:12173。gydF4y2Ba
- 40gydF4y2Ba
Stael S, Wurzinger B, Mair A, Mehlmer N, Vothknecht UC, Teige M.植物细胞器钙信号转导:一个新兴领域。中国生物医学工程学报。2012;63(4):1525-42。gydF4y2Ba
- 41.gydF4y2Ba
Clark GB, Morgan RO, Fernandez MP, Roux SJ。植物膜联蛋白的进化适应使其分子结构、相互作用和功能作用多样化。新植醇。2012;196(3):695 - 712。gydF4y2Ba
- 42.gydF4y2Ba
Allorent G, Osorio S, Vu JL, Falconet D, Jouhet J, Kuntz M, Fernie AR, lebs - mache S, Macherel D, Courtois F, et al., et al.,等。胚胎光合活性的调节调节拟南芥种子的适合度。新植醇。2015;205(2):707 - 19所示。gydF4y2Ba
- 43.gydF4y2Ba
Kim C, Lee KP, Baruah A, Nater M, Gobel C, Feussner I, Apel K。gydF4y2Ba(gydF4y2Ba1) 在胚胎发生后期,O2介导的逆行信号通过补充脱落酸预先决定了幼苗的质体分化。2009年美国科学院学报;106(24):9920–4.gydF4y2Ba
- 44.gydF4y2Ba
吉田K,Hisabori T.两个不同的氧化还原级联协同调节叶绿体功能并维持植物活力。2016年美国科学院学报;113(27):E3967-76。gydF4y2Ba
- 45.gydF4y2Ba
利用蛋白质组学分析揭示质体核仁的多功能性。生物物理学报。2016;1864(8):1016-38。gydF4y2Ba
- 46.gydF4y2Ba
Krause K,Oetke S,Krupinska K.双重靶向和逆行易位:植物核基因表达的调节因子可以被质体隔离.国际分子科学杂志,2012;13(9):11085-101。gydF4y2Ba
- 47.gydF4y2Ba
7、拟南芥绒毡层超微结构和花粉外壁发育的新认识。安机器人。2014;114(6):1189 - 201。gydF4y2Ba
- 48.gydF4y2Ba
拟南芥叶绿体葡萄糖6-磷酸/磷酸转运体GPT1在花粉成熟和胚囊发育中起重要作用。植物细胞。2005;17(3):760 - 75。gydF4y2Ba
- 49.gydF4y2Ba
玉米花粉成熟过程中淀粉的生物合成与基因表达模式的改变有关。植物杂志。2002;130(4):1645 - 56。gydF4y2Ba
- 50.gydF4y2Ba
杨志强,王志强,王志强,等。拟南芥GTPase基因超家族的分析。植物杂志。2003;131(3):1191 - 208。gydF4y2Ba
- 51.gydF4y2Ba
李志刚,李志刚,李志刚,等。植物囊泡运输因子的同源性研究。《公共科学图书馆•综合》。2014;9 (5):e97745。gydF4y2Ba
- 52.gydF4y2Ba
马拉奇C,罗德尼娜MV。点评:平移gtpase。生物聚合物。2016;105(8):463 - 75。gydF4y2Ba
资金gydF4y2Ba
这项工作得到了波兰国家科学中心2012/05/B/NZ9/00984号拨款的支持,拨款给Malgorzata Lichocka。gydF4y2Ba
实验使用由欧盟资助的CePT基础设施进行:欧洲区域发展基金(创新经济2007-13,协议POIG.02.02.00-14-024/08-00)。gydF4y2Ba
资助方在研究设计、数据收集和分析、决定发表或手稿准备方面没有作用。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
本研究过程中产生或分析的所有数据均包含在本发表的文章及其补充信息文件中。拟南芥供试材料:Col-0, An-1, bay0, C24, Ler-1, Mr-0, Oy-0和Wa-1gydF4y2Bahttp://arabidopsis.info/gydF4y2Ba)Agrikola二元质粒(gydF4y2Bahttp://www.agrikola.org/gydF4y2Ba)目标gydF4y2BaANN5gydF4y2Ba从NASC获得RNAi沉默(gydF4y2Bahttp://arabidopsis.info/gydF4y2Ba).在这项研究中生成的拟南芥株系和与本文发现整合的材料可在波兰华沙(波兰)波兰科学院生物化学和生物物理研究所的通讯作者Malgorzata Lichocka (mlichocka@ibb.waw.pl)的实验室索取。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
ML和JH构思并指导了这项研究。ML、WR、MK和JH设计了实验。ML、WR、KM、IBF、ACh、MS、ES进行研究并分析数据。ML、MAS、MK、JH撰写论文。所有作者都已阅读并批准了手稿的最终版本。gydF4y2Ba
通讯作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明他们没有相互竞争的利益。gydF4y2Ba
出版商说明gydF4y2Ba
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。gydF4y2Ba
额外的文件gydF4y2Ba
附加文件1:gydF4y2Ba
表S1。gydF4y2Ba本研究使用的二元质粒列表。gydF4y2Ba表S2。gydF4y2Ba用于RT-qPCR的寡核苷酸。gydF4y2Ba图S1。gydF4y2Ba分析gydF4y2BaANN5gydF4y2Ba从中国采集的花在花期的转录本丰度gydF4y2BaANN5gydF4y2Barnai沉默和过表达线gydF4y2Ba.gydF4y2Ba图S2。gydF4y2Ba拟南芥表型特征的改变gydF4y2BaANN5gydF4y2Ba在12h光照条件下培养表达。gydF4y2Ba表S3。gydF4y2Ba拟南芥基因型生殖发育时间的改变gydF4y2BaANN5gydF4y2Ba在12h光照条件下培养表达。gydF4y2Ba图S3。gydF4y2Barnai介导的抑制作用gydF4y2BaANN5gydF4y2Ba花粉活力。gydF4y2Ba图S4。gydF4y2Ba拟南芥双细胞小配子体超微结构的研究gydF4y2BaANN5gydF4y2Ba表达式。gydF4y2Ba图S5。gydF4y2Ba人工授粉后24小时雌蕊花粉管的生长。gydF4y2Ba表S4。gydF4y2Ba与ANN5-YFP共纯化并经质谱鉴定的质体蛋白列表。gydF4y2Ba图S6。gydF4y2BaRABE1b-GFP的亚细胞定位gydF4y2Ban benthamianagydF4y2Ba叶表皮细胞。gydF4y2Ba图S7。gydF4y2Ba过度的gydF4y2BaANN5gydF4y2Ba影响拟南芥幼苗叶绿素含量并改变与叶绿素代谢相关基因的表达。(PDF 1160 kb)gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条中提供的数据,除非另有说明。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
里奇卡,M.,莱马斯泽夫斯基,W.,莫吉维茨,K。gydF4y2Baet al。gydF4y2Ba以细胞核和质体为靶点的膜联蛋白5促进拟南芥的生殖发育,对花粉和胚胎形成至关重要。gydF4y2BaBMC植物杂志gydF4y2Ba18,gydF4y2Ba183(2018)。https://doi.org/10.1186/s12870-018-1405-3gydF4y2Ba
收到gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
内政部gydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-018-1405-3gydF4y2Ba
关键词gydF4y2Ba
- 拟南芥gydF4y2Ba
- 加入gydF4y2Ba
- 膜联蛋白gydF4y2Ba
- 花粉粒gydF4y2Ba
- 种子gydF4y2Ba
- 胚胎gydF4y2Ba
- 质体gydF4y2Ba
- 类核gydF4y2Ba
- 叶绿素gydF4y2Ba
- Rab-GTPasegydF4y2Ba