- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
识别和表征gydF4y2BaGmMYB118gydF4y2Ba对干旱和盐胁迫的反应gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba18gydF4y2Ba,文章号:gydF4y2Ba320gydF4y2Ba(gydF4y2Ba2018gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
非生物胁迫严重影响植物的生长发育。MYB转录因子(TF)是最大的TF家族之一,在非生物应激反应中发挥重要作用。gydF4y2Ba
结果gydF4y2Ba
我们鉴定出139个大豆myb相关基因;这些基因根据其保守结构域分为6组,分布在20条染色体(Chrs)中。实时荧光定量PCR (qRT-PCR)结果表明gydF4y2BaGmMYB118gydF4y2Ba对干旱、盐和高温胁迫反应灵敏;因此,选择该基因进行进一步分析。亚细胞定位显示GmMYB118蛋白位于细胞核内。的异位表达gydF4y2BaGmMYB118gydF4y2Ba增加了对干旱和盐胁迫的耐受性,并调节了几个胁迫相关基因的表达gydF4y2Ba拟南芥gydF4y2Ba植物。同样的,gydF4y2BaGmMYB118gydF4y2Ba-过表达(OE)大豆植株通过gydF4y2Ba农杆菌属rhizogenesgydF4y2Ba(gydF4y2Ba答:rhizogenesgydF4y2Ba)介导的转化表现出较好的耐旱性和耐盐性。此外,与对照(CK)植物相比,集群、规则间隔、短回文重复(CRISPR)转化植物表现出较低的耐旱性和耐盐性。在干旱和盐胁迫条件下,OE植株的脯氨酸和叶绿素含量显著高于CK植株,CK植株的脯氨酸和叶绿素含量高于CRISPR植株。而OE植株的活性氧(reactive oxygen species, ROS)和丙二醛(malondialdehyde, MDA)含量显著低于CK植株,CK植株在胁迫条件下的含量低于CRISPR植株。gydF4y2Ba
结论gydF4y2Ba
这些结果表明gydF4y2BaGmMYB118gydF4y2Ba通过促进胁迫相关基因的表达,调节渗透和氧化物质,维持细胞稳态,提高对干旱和盐胁迫的耐受性。gydF4y2Ba
背景gydF4y2Ba
干旱、盐胁迫和温度胁迫严重影响植物生长和农业生产,威胁植物的生存。在应激条件下,转录组变化是植物最早的反应[gydF4y2Ba1gydF4y2Ba].植物中的基因表达分析表明,胁迫响应基因可分为效应基因和调控基因两类[gydF4y2Ba2gydF4y2Ba].调控基因的产物,包括膜定位受体、钙传感器、激酶和转录因子(TFs),参与进一步的信号转导调控和基因表达[gydF4y2Ba1gydF4y2Ba].转录因子通过特异性结合蛋白调控基因表达gydF4y2Ba独联体gydF4y2Ba下游基因的作用元件影响许多重要的细胞过程,如信号转导、形态发生和环境应激反应[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba].gydF4y2Ba
根据tf的dna结合域(DBD)特征,将其分为bZIP、MYB、NAC、ERF、WRKY和AP2等不同家族[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba].MYB转录因子是植物中最大的家族,根据MYB结构域内相邻重复序列的数量,可以分为不同的亚家族。每个重复序列形成一个由大约53个氨基酸组成的螺旋-旋-螺旋结构[gydF4y2Ba10gydF4y2Ba].有一个重复的MYB样蛋白被认为是MYB相关的(包含一个或部分MYB重复),有两个重复的被认为是r2r3型MYB (2R-MYB),有三个重复的被认为是r1r2r3型MYB (3r -MYB),有四个重复的被认为是4r -MYB [gydF4y2Ba5gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba].gydF4y2Ba
大多数MYB tf,特别是r2r3 -MYB,在响应非生物胁迫中发挥重要作用[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba].例如,Chen在花生中发现了30个响应多种非生物胁迫的MYB基因[gydF4y2Ba19gydF4y2Ba].gydF4y2BaTaMYB80gydF4y2Ba小麦对高温和干旱的耐受性提高[gydF4y2Ba6gydF4y2Ba].gydF4y2BaTaMYB56-BgydF4y2Ba转基因植物对冰冻和盐胁迫的耐受性增强gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba16gydF4y2Ba].与R2R3-MYB tf相比,myb相关基因主要在细胞形态发生、类黄酮生物合成、下胚轴伸长和昼夜节律控制等过程中发挥作用[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba].gydF4y2Ba自动白平衡gydF4y2Ba是根和下胚轴中表皮细胞命运的早期调节因子[gydF4y2Ba21gydF4y2Ba].gydF4y2BaAmmixtagydF4y2Ba参与表皮细胞形态的转录控制[gydF4y2Ba22gydF4y2Ba].Yi等报道了R1 MYB转录因子,gydF4y2BaGmMYB176gydF4y2Ba,调节gydF4y2BaGmCHS8gydF4y2Ba大豆中异黄酮的表达及合成gydF4y2Ba25gydF4y2Ba].然而,myb相关基因参与非生物胁迫的报道很少[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba26gydF4y2Ba].弄清楚是否有更多myb相关基因参与非生物胁迫是很重要的。gydF4y2Ba
大豆(gydF4y2Ba大豆gydF4y2Ba)被广泛种植,因其蛋白质和油脂含量高,是最重要的经济作物之一。然而,干旱和盐胁迫严重影响其生长和产量。在某些作物中,不同的MYB tf具有支持特定作用的特征,以应对水分亏缺和盐胁迫[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba19gydF4y2Ba].尽管大豆的全基因组数年前就已测序[gydF4y2Ba27gydF4y2Ba],很少有研究对该物种中myb相关的tf进行研究。在本研究中,我们提供了一份基于大豆基因组测序的myb相关家族成员列表。进一步的调查显示,myb相关基因,gydF4y2BaGmMYB118gydF4y2Ba,盐和干旱处理显著调控gydF4y2BaGmMYB118gydF4y2Ba提高了两者对干旱和盐的耐受性gydF4y2Ba拟南芥gydF4y2Ba和大豆。相比之下,转基因植物gydF4y2BaGmMYB118gydF4y2Ba通过聚类,规则间隔,短回文重复(CRISPR)系统表现出较低的耐旱和耐盐性。本研究为进一步了解其功能提供了基础gydF4y2BaGmMYB118gydF4y2Ba基因在非生物应激反应中的作用。gydF4y2Ba
结果gydF4y2Ba
大豆myb相关基因的鉴定及染色体分布gydF4y2Ba
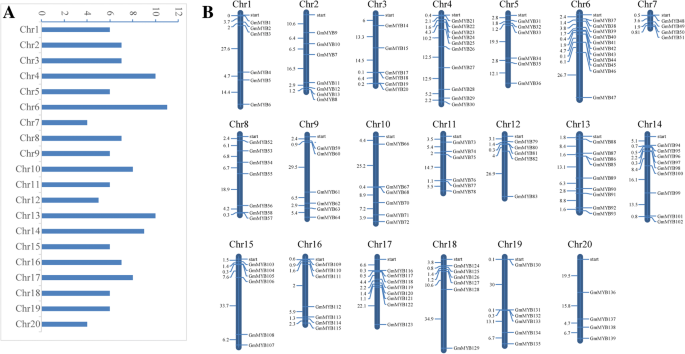
myb相关TF基因的种类在不同的物种中是不同的(表gydF4y2Ba1gydF4y2Ba).为了分析大豆myb相关家族,我们查询了Phytozome、TFDB、Pfam、SMART和ScanProsite等多个数据库[gydF4y2Ba10gydF4y2Ba].之前的工作在大豆中发现了127个myb相关的TF基因[gydF4y2Ba28gydF4y2Ba];这些基因被搜索到上面的网站。通过删除冗余序列,筛选典型myb相关结构域,在大豆中鉴定出139个基因。MapInspect软件将myb相关基因全部定位在20条染色体上(Chrs)。大豆的Chrs 4和6含有较多myb相关基因(约14.8%),而位于Chrs 7和20上的myb相关基因较少。Chrs 5 ~ 9呈现相对均匀的分布(图;gydF4y2Ba1gydF4y2Baa).如图所示。gydF4y2Ba1gydF4y2Bab, myb相关基因倾向于分布在第9、10、11、12、15、16、17和18 Chrs的两个臂上。在另一个Chrs上,myb相关基因均匀分布(Chrs 7、8和13)或在两端大量分布。gydF4y2Ba
139个myb相关基因氨基酸序列的系统发育树分析gydF4y2Ba
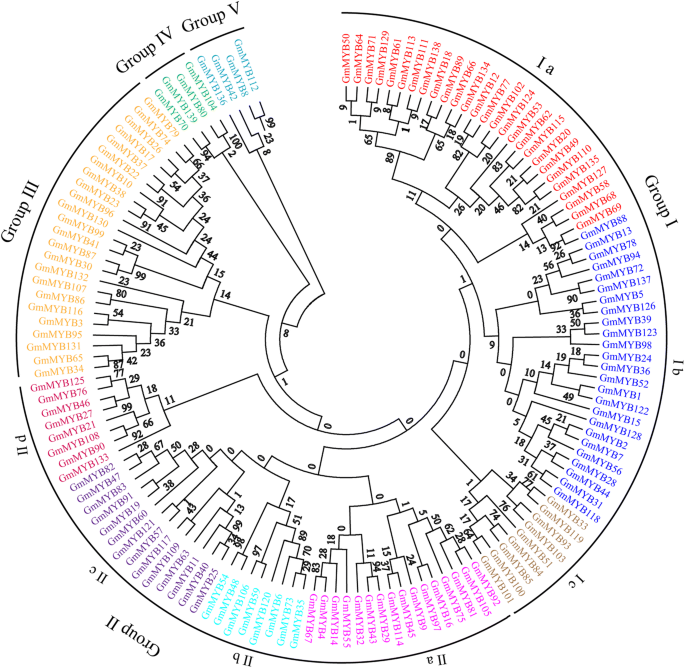
通过邻域连接法(neighbor-joining, NJ)对氨基酸序列进行比对,利用MEGA 6构建系统发育树。如图所示。gydF4y2Ba2gydF4y2Ba,系统发育树分为5组(I-V)。SHAQK(Y/F) F序列在i组中高度保守,II组具有一致的DLKDKW序列。对于其他组,虽然这些MYB蛋白没有保守结构域,但它们有保守的氨基酸位点。该节点的高自举值支持139个MYB蛋白的其他成员分别聚在三组(III、IV和V)中。gydF4y2Ba
筛选候选基因作进一步分析gydF4y2Ba
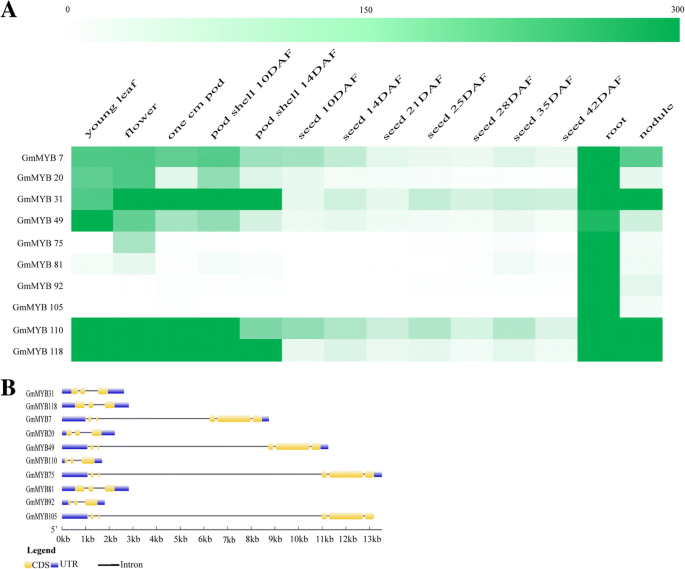
根据我们提交给soybase网站的基因登录号(gydF4y2Bahttp://soybase.org/soyseq/gydF4y2Ba) [gydF4y2Ba10gydF4y2Ba],我们获得了14种不同组织类型的定量预测的组织表达数据(附加文件gydF4y2Ba1gydF4y2Ba:图S1)。结果表明,根、叶节、叶和花中部分基因的表达量高于种子和豆荚。这可能表明这些基因在大豆生长发育中起着至关重要的作用。为了进一步分析,我们从139个MYB基因中筛选了10个成员,根据表达量的水平从大豆碱网站预测的根中超过300个,包括gydF4y2BaGmMYB7/20/31/49/75/81/92/105/110/118gydF4y2Ba(无花果。gydF4y2Ba3.gydF4y2Baa).这可能表明这些基因在大豆根系中起重要作用。gydF4y2Ba
大豆组织表达的定量预测及10个myb相关TF基因的序列保守性分析。根据SoyBase提供的14个组织表达的定量预测,从139个myb相关基因中筛选出10个根据定量表达水平超过300个的myb相关TF基因进行进一步分析。颜色越深,数量越大(gydF4y2Ba一个gydF4y2Ba).我们使用基因结构显示服务器(gydF4y2Bahttp://gsds.cbi.pku.edu.cn/gydF4y2Ba),并提交cds和基因组序列(gydF4y2BabgydF4y2Ba)gydF4y2Ba
所选10个myb相关tf的基因结构分析gydF4y2Ba
为了鉴定这10个myb相关基因的特征,我们使用基因结构显示服务器(gydF4y2Bahttp://gsds.cbi.pku.edu.cn/gydF4y2Ba),通过提交编码DNA序列(CDS)和基因组序列,检索基本信息(表gydF4y2Ba2gydF4y2Ba).如图所示。gydF4y2Ba3.gydF4y2Bab, 10个myb相关基因呈外显子-内含子结构。结果表明,myb相关基因往往具有更紧密的遗传关系和更相似的结构。例如,gydF4y2BaGmMYB7/31/118gydF4y2Ba,gydF4y2BaGmMYB75/92/105gydF4y2Ba而且gydF4y2BaGmMYB20/31/110gydF4y2Ba表现出相似的基因结构,这表明它们是从相同的模式进化而来的。gydF4y2Ba
10个myb相关基因的启动子区域包含各种胁迫响应元件gydF4y2Ba
选取了10个myb相关基因启动子中ATG起始密码子上游2000 bp的区域。研究植物对非生物胁迫的响应机制gydF4y2Ba独联体gydF4y2Ba-作用元素和PLACE (gydF4y2Bahttp://bioinformatics.psb.ugent.be/webtools/plantcare/html/gydF4y2Ba)对10个基因启动子的区域进行分析。研究发现了一系列响应干旱和盐胁迫的调控元件,包括ABRE (aba诱导)、DRE(干旱诱导)、GT-1(盐诱导)、MYB(干旱)和MYC(干旱和寒冷)元件。此外,数字gydF4y2Ba独联体gydF4y2BaMYB、MYC和GT-1 tf的-元素均大于其他tfgydF4y2Ba独联体gydF4y2Ba-这10个基因的启动子中的元素(表gydF4y2Ba3.gydF4y2Ba).这一信息揭示了10个myb相关基因可能参与非生物胁迫反应,如干旱、盐和寒冷反应。gydF4y2Ba
一些候选生物涉及多种非生物应激gydF4y2Ba
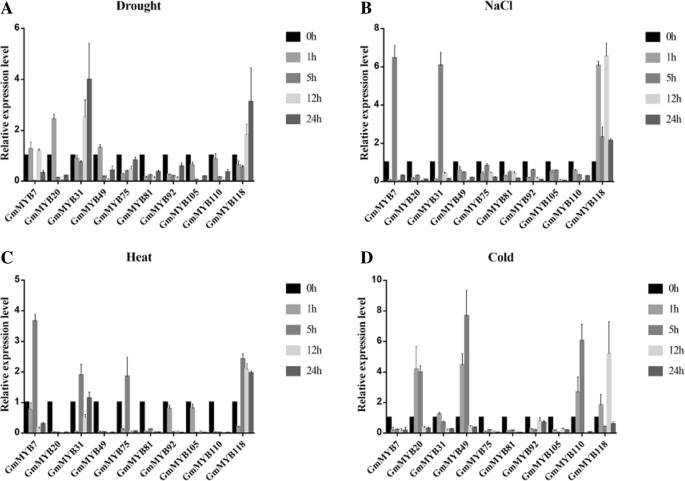
为了深入了解其潜在功能,我们首先通过实时荧光定量PCR (qRT-PCR)检测了10个myb相关基因在各种非生物胁迫下的表达模式(图2)。gydF4y2Ba4gydF4y2Ba).在干旱处理下,表达gydF4y2BaGmMYB20/31/118gydF4y2Ba在1、5和5 h时,基因的转录水平分别增加了2.42、3.98和3.11倍,其他基因的转录水平没有显著变化(A)gydF4y2BaGmMYB7/31/118gydF4y2Ba分别发生在5、5和12 h,分别相当于增加了6.45、6.06和6.54倍。其他基因的表达变化不明显(B)gydF4y2BaGmMYB7/31/75/118gydF4y2Ba在5 h时分别增加3.41、1.96、1.89和2.40倍,其他基因的表达水平无明显变化(C)gydF4y2BaGmMYB20/49/110/118gydF4y2Ba转录量逐渐增加,在1、5、5、12 h达到峰值;然而,积累了gydF4y2BaGmMYB118gydF4y2Ba12 h时,转录水平迅速下降,与对照植株相似。最高水平的gydF4y2BaGmMYB20/49/110/118gydF4y2Ba分别增加了4.16倍、7.6倍、6.05倍和5.2倍(D)。这些结果表明gydF4y2BaGmMYB7/20/31/118gydF4y2Ba受到各种非生物胁迫的影响。在这些基因中,gydF4y2BaGmMYB118gydF4y2Ba对干旱、盐、热、冷等多种非生物胁迫均有明显的反应。gydF4y2Ba4gydF4y2Ba).出于这个原因,gydF4y2BaGmMYB118gydF4y2Ba被选作进一步调查。gydF4y2Ba
10个myb相关TF基因在盐、干旱、冷、热处理下的表达谱15年生大豆幼苗经干旱处理(gydF4y2Ba一个gydF4y2Ba), NaCl (gydF4y2BabgydF4y2Ba)、热量(gydF4y2BacgydF4y2Ba)及冷(gydF4y2BadgydF4y2Ba)进行0、1、5、12及24小时。采用qRT-PCR方法定量分析了10个myb相关TF基因在各种非生物胁迫下的表达模式。gydF4y2BaGmMYB118gydF4y2Ba对干旱、盐、冷、热等多种非生物胁迫均有明显反应(gydF4y2Ba一个gydF4y2Ba-gydF4y2BadgydF4y2Ba).数据以三次实验的均值±SDs表示gydF4y2Ba
GmMYB118的亚细胞定位gydF4y2Ba拟南芥gydF4y2Ba
为了确定GmMYB118的亚细胞定位,gydF4y2BaGmMYB118gydF4y2Ba在花椰菜花叶病毒(CaMV) 35S启动子的控制下,将其融合到人源化绿色荧光蛋白(hGFP)报告基因的n端,并连接到16318hGFP表达载体上。的cDNA编码序列gydF4y2BaAtWRKY25gydF4y2Ba(At2g30250),位于细胞核[gydF4y2Ba29gydF4y2Ba的n端融合gydF4y2Ba招标书gydF4y2Ba基因受CaMV 35S启动子控制。GFP和RFP表达的亚细胞定位gydF4y2Ba拟南芥gydF4y2Ba共转化后观察到叶肉原生质体。的gydF4y2BaGmMYB118: hGFPgydF4y2Ba融合蛋白定位于细胞核(附加文件gydF4y2Ba1gydF4y2Ba:图S2A)。这些观察结果表明GmMYB118可以进入细胞核发挥作用。gydF4y2Ba
GmMYB118gydF4y2Ba提供耐旱性gydF4y2Ba拟南芥gydF4y2Ba
植物过表达胁迫诱导基因是提高非生物胁迫耐受性的有效策略[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba].为进一步研究其生物学功能gydF4y2BaGmMYB118gydF4y2Ba选择3株T3异位表达系(EX)在聚乙二醇(PEG6000)处理下进行模拟干旱胁迫分析。在进行实验前,三周大gydF4y2Ba拟南芥gydF4y2Ba进行qRT-PCR分析gydF4y2BaGmMYB118gydF4y2Ba基因表达在异位表达和野生型(WT)植物(附加文件gydF4y2Ba1gydF4y2Ba:图S2B)。的表达gydF4y2BaAtActingydF4y2Ba作为加载控制进行分析(附加文件gydF4y2Ba1gydF4y2Ba:表S1)。的相对表达量gydF4y2BaGmMYB118gydF4y2Ba相当于8~12倍gydF4y2Ba拟南芥gydF4y2Ba.gydF4y2Ba
在含不同浓度PEG6000的1/2倍Murashige和Skoog (MS)培养基上,测定EX和WT种子在0、12、24、36、48、60和72 h的发芽率。所有品系在1/2倍的MS培养基上发芽率相近。但在PEG6000的存在下,EX种子的萌发受到抑制,且抑制程度大于WT种子(附加文件)gydF4y2Ba1gydF4y2Ba:图S3A)。正常条件下,WT和EX种子在72 h的发芽率约为94~96%(附加文件)gydF4y2Ba1gydF4y2Ba图S3B)。在3% PEG6000处理下,EX种子在24 h的发芽率为64.06~72.91%,低于WT种子的81.77%(附加文件)gydF4y2Ba1gydF4y2Ba:图S3C)。在6% PEG6000处理下,EX种子在24 h发芽率为33.85~34.89%,比WT种子低63.02%(附加文件)gydF4y2Ba1gydF4y2Ba:图S3D)。在9% PEG6000处理下,EX种子48 h发芽率为76.56~81.77%,低于WT种子的94.79%(附加文件)gydF4y2Ba1gydF4y2Ba:图S3E)。gydF4y2Ba
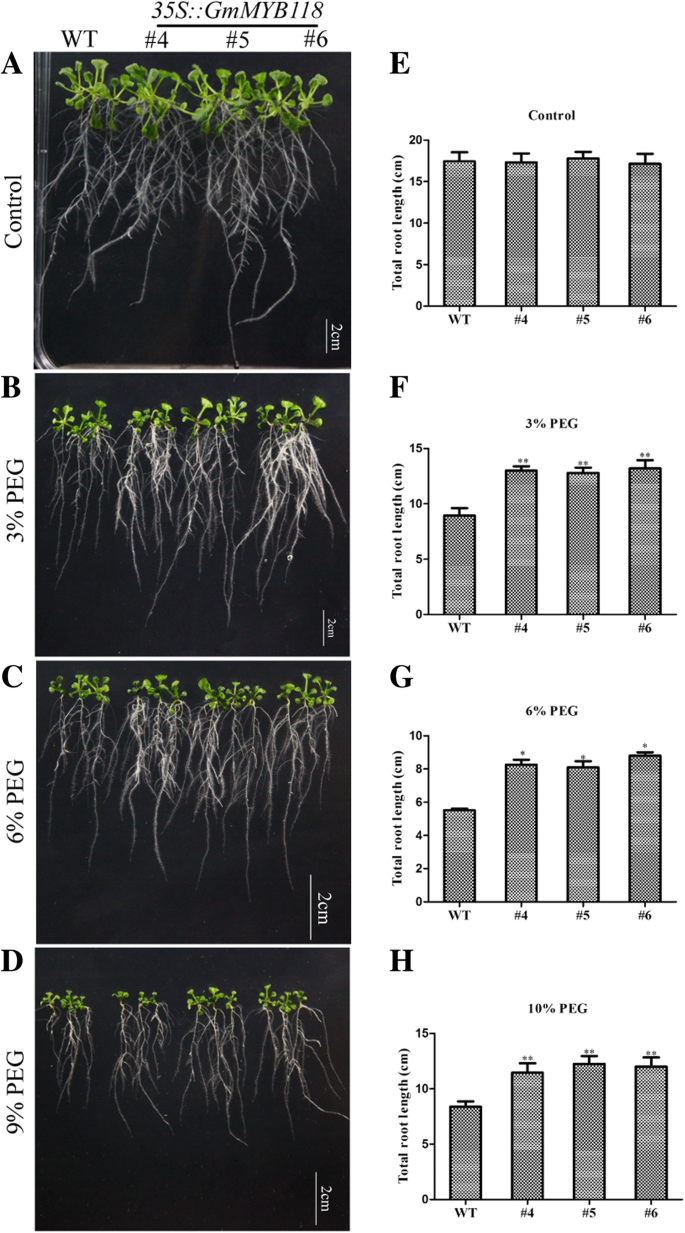
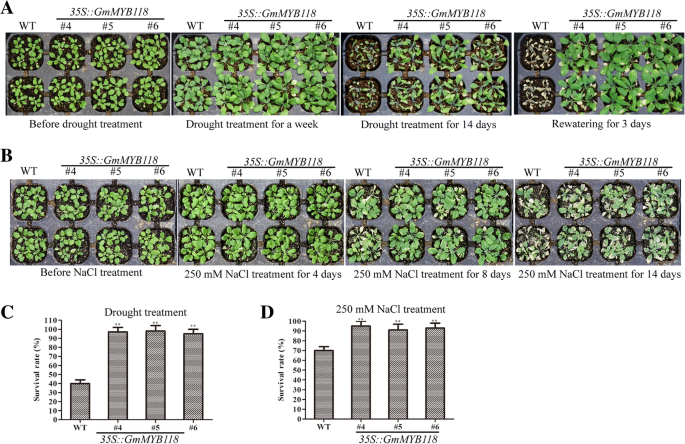
对于幼苗的表型,6日龄gydF4y2Ba拟南芥gydF4y2Ba幼苗转移到含有不同浓度PEG6000的1/2倍浓度MS培养基上7天。转基因幼苗的表型与正常条件下的WT幼苗相似(图2)。gydF4y2Ba5gydF4y2Baa).如图所示。gydF4y2Ba5gydF4y2Ba, PEG6000处理在一定程度上抑制了EX和WT幼苗的根系生长(图6)。gydF4y2Ba5gydF4y2Ba罪犯)。在3和9% PEG6000处理下,根长均显著高于对照组gydF4y2BaGmMYB118gydF4y2Ba线长分别为11.86~13.65 cm和9.34~10.39 cm,显著长于WT线(分别为8.38 cm和6.36 cm)。gydF4y2Ba5gydF4y2Baf, h). 6% PEG6000处理下,WT苗的根长也比EX苗短(图6)。gydF4y2Ba5gydF4y2Bag).此外,在苗期后期,3周龄的EX和WT幼苗不浇水14天,在浇水3天后拍照(图2)。gydF4y2Ba7gydF4y2Baa).补水3 d后,EX系的存活率为90.05~95.63%,显著高于WT系(40.50%)(图5)。gydF4y2Ba7gydF4y2Bac).这些结果表明gydF4y2BaGmMYB118gydF4y2Ba可能具有提高转基因植物对干旱胁迫的耐受性的潜在作用。gydF4y2Ba
PEG处理下EX系根长表型。在1/2 MS上生长的6天大的幼苗转移到含有不同浓度PEG6000的1/2 MS培养基上。一周后,分别对0、3、6和9% PEG6000处理下的EX和WT (Col-0)幼苗的根系生长进行拍照(gydF4y2Ba一个gydF4y2Ba-gydF4y2BadgydF4y2Ba).与WT (Col-0)幼苗相比,0、3、6和9% PEG处理下EX幼苗根系总长度的统计结果(gydF4y2BaegydF4y2Ba-gydF4y2BahgydF4y2Ba).数据以平均值±SDs (gydF4y2BangydF4y2Ba= 30)的三个实验。方差分析(ANOVA)检验,差异有显著性(gydF4y2Ba∗gydF4y2BaPgydF4y2Ba< 0.05,gydF4y2Ba∗gydF4y2Ba∗gydF4y2BaPgydF4y2Ba< 0.01)gydF4y2Ba
GmMYB118gydF4y2Ba提供耐盐性gydF4y2Ba拟南芥gydF4y2Ba
来阐明的作用gydF4y2BaGmMYB118gydF4y2Ba在高盐条件下的植物生长发育中,开展了转基因和WT系的耐盐实验。以EX和WT系种子为试验材料,在含不同浓度NaCl的1/2倍浓度MS培养基上萌发,分别于0、12、24、36、48、60和72 h测定发芽率。在不加NaCl的1/2倍浓度MS培养基上,EX和WT种子的发芽率相似gydF4y2Ba1gydF4y2Ba:图S4B)。在NaCl胁迫下,EX和WT种子的萌发均受到抑制gydF4y2Ba1gydF4y2Ba:图S4A)。75 mM NaCl处理48 h时,EX种子的发芽率为30.18~35.37%,低于WT种子的55.23%(附文件)gydF4y2Ba1gydF4y2Ba:图S4C)。100 mM NaCl处理48 h时,EX种子的发芽率为50.47~53.29%,低于WT种子的69.52%(附文件)gydF4y2Ba1gydF4y2Ba:图S4D)。在125 mM NaCl处理下,EX种子的萌发抑制比WT种子更严重。EX种子的发芽率为14.28~18.86%,低于WT种子的47.62%(附加文件)gydF4y2Ba1gydF4y2Ba:图S4E)。gydF4y2Ba
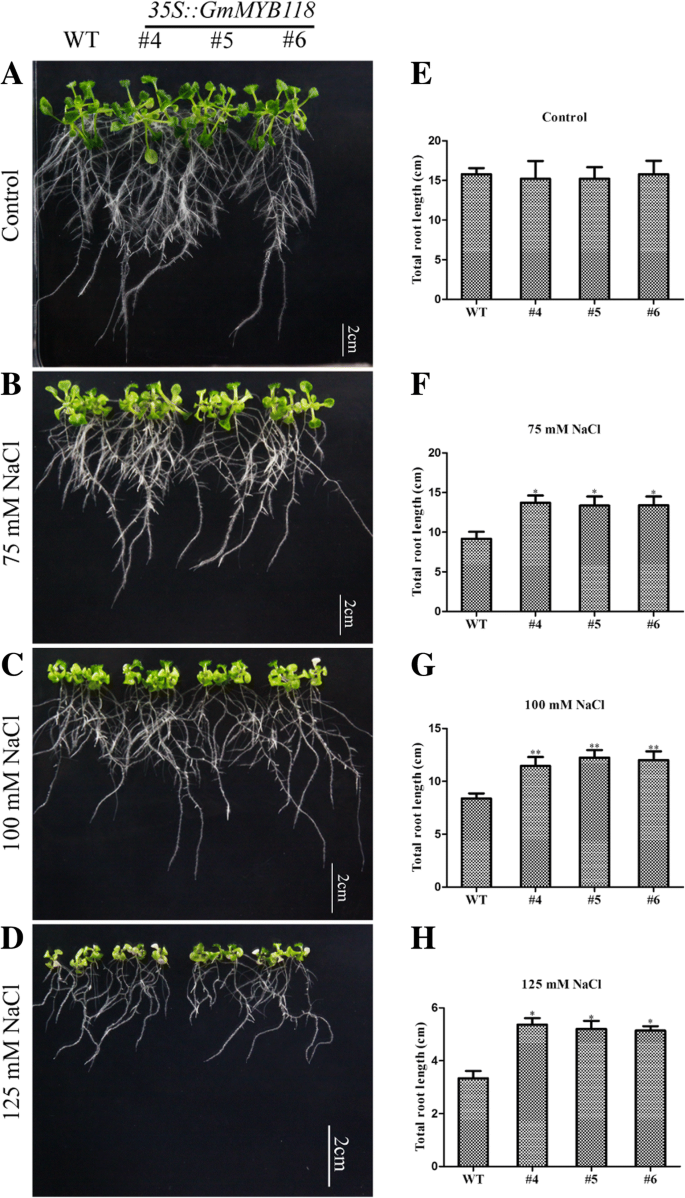
对于表型,转基因和WTgydF4y2Ba拟南芥gydF4y2Ba种子在22°C的1/2 MS培养基上生长6天,然后转移到含有不同浓度NaCl的1/2倍MS培养基上生长7天。在正常条件下,EX幼苗的表型与WT幼苗的表型相似(图2)。gydF4y2Ba6gydF4y2Baa).如图所示。gydF4y2Ba6gydF4y2Ba在75、100和125 mM NaCl处理下,EX系的根长显著长于WT系(图2)。gydF4y2Ba6gydF4y2Ba罪犯)。在75和125 mM NaCl处理下,野生型株系的根长分别为13.11~15.51和9.86~10.80 cm,显著短于转基因株系,分别为9.39和7.69 cm。gydF4y2Ba6gydF4y2Baf, h)。这一差异在100 mM NaCl处理下最为明显:EX系的总根长为11.24~13.51 cm,显著大于WT系(8.37 cm)(图3)。gydF4y2Ba6gydF4y2Bag).育苗后期,3周龄的EX和WT幼苗在250 mM NaCl下孵育14 d;其表型如图所示。gydF4y2Ba7gydF4y2Bab. EX系的存活率为88.32~92.16%,显著高于WT系的68.94%(图2)。gydF4y2Ba7gydF4y2Bad).总的来说,这些结果表明gydF4y2BaGmMYB118gydF4y2Ba可用于提高转基因植物对盐胁迫的耐受性。gydF4y2Ba
NaCl处理下EX系根长表型。将在1/ 2ms条件下生长的6天大的幼苗转移到含不同浓度NaCl的1/ 2ms培养基中。一周后,分别在0、75、100和125 mM NaCl处理下拍摄EX和WT (Col-0)幼苗的根系生长(gydF4y2Ba一个gydF4y2Ba-gydF4y2BadgydF4y2Ba).与WT幼苗相比,0、75、100和125 mM NaCl处理下EX幼苗根系总长度的统计结果(gydF4y2BaegydF4y2Ba-gydF4y2BahgydF4y2Ba).数据以三次实验的平均值±SDs (n = 30)表示。方差分析(ANOVA)检验,差异有显著性(gydF4y2Ba∗gydF4y2BaPgydF4y2Ba< 0.05,gydF4y2Ba∗gydF4y2Ba∗gydF4y2BaPgydF4y2Ba< 0.01)gydF4y2Ba
干旱和盐处理下晚期EX系的表型。三周龄的幼苗经干旱和盐处理两周。EX和WT (Col-0)系在水分亏缺条件下的耐旱表型(gydF4y2Ba一个gydF4y2Ba).EX和WT (Col-0)系在250 mM NaCl条件下的耐盐表型(gydF4y2BabgydF4y2Ba).复水后3 d监测水分胁迫植株的成活率(gydF4y2BacgydF4y2Ba).转基因和WT (Col-0)系在250 mM NaCl胁迫下14 d的存活率(gydF4y2BadgydF4y2Ba).数据以三次实验的平均值±SDs (n = 30)表示。方差分析(ANOVA)检验,差异有显著性(gydF4y2Ba∗gydF4y2Bap < 0.05,gydF4y2Ba∗gydF4y2Ba∗gydF4y2Bap < 0.01)gydF4y2Ba
GmMYB118gydF4y2Ba激活应激反应基因gydF4y2Ba拟南芥gydF4y2Ba
阐明其可能参与的分子机制gydF4y2BaGmMYB118gydF4y2Ba在胁迫反应中,干旱和盐反应标记基因的表达包括gydF4y2BaAtP5CS1gydF4y2Ba[gydF4y2Ba33gydF4y2Ba],gydF4y2BaAtDREB2AgydF4y2Ba[gydF4y2Ba34gydF4y2Ba],gydF4y2BaAtCOR47gydF4y2Ba[gydF4y2Ba30.gydF4y2Ba],gydF4y2BaAtCOR15AgydF4y2Ba[gydF4y2Ba4gydF4y2Ba],gydF4y2BaAtRD29AgydF4y2Ba[gydF4y2Ba35gydF4y2Ba],gydF4y2BaAtKIN1gydF4y2Ba[gydF4y2Ba36gydF4y2Ba],gydF4y2BaAtKIN2gydF4y2Ba[gydF4y2Ba37gydF4y2Ba],gydF4y2BaAtRD22gydF4y2Ba[gydF4y2Ba38gydF4y2Ba],gydF4y2BaAtRAB18gydF4y2Ba[gydF4y2Ba39gydF4y2Ba],gydF4y2BaAtADH1gydF4y2Ba[gydF4y2Ba40gydF4y2Ba),而gydF4y2BaAtNCED3gydF4y2Ba[gydF4y2Ba41gydF4y2Ba]在EX系中进行了研究。2倍的表达变化被任意认为代表阳性表达诱导。gydF4y2Ba
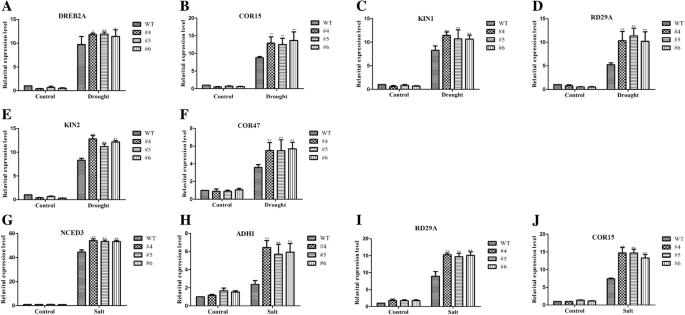
qRT-PCR分析显示,基因表达水平无显著差异gydF4y2BaAtCOR47gydF4y2Ba,gydF4y2BaAtDREB2AgydF4y2Ba,gydF4y2BaAtKIN1gydF4y2Ba,gydF4y2BaAtKIN2gydF4y2Ba,gydF4y2BaAtRD29AgydF4y2Ba而且gydF4y2BaAtCOR15gydF4y2Ba正常情况下EX线与WT线之间的差异(图;gydF4y2Ba8gydF4y2Baf)。干旱条件下,这些基因在EX系中的表达量显著高于WT系(图2)。gydF4y2Ba8gydF4y2BaA-f),虽然表达水平gydF4y2BaAtP5CS1gydF4y2Ba而且gydF4y2BaAtRAB18gydF4y2Ba没有差异(数据未显示)。另一方面,与WT系相比,表达水平明显降低gydF4y2BaAtADH1gydF4y2Ba,gydF4y2BaAtNCED3gydF4y2Ba,gydF4y2BaAtCOR15gydF4y2Ba而且gydF4y2BaAtRD29AgydF4y2Ba在盐条件下,EX系的显着增加(图;gydF4y2Ba8gydF4y2Bag-j),但在正常情况下,这些水平没有显著差异(图。gydF4y2Ba8gydF4y2Bag-j)。表达水平gydF4y2BaAtRD22gydF4y2Ba在正常或干旱条件下,EX系和WT系之间没有显著差异(数据未显示)。这些结果表明gydF4y2BaGmMYB118gydF4y2Ba可能激活干旱或盐反应基因的表达gydF4y2Ba拟南芥gydF4y2Ba提高了转基因株系的抗旱性和耐盐性。gydF4y2Ba
GmMYB118gydF4y2Ba调节胁迫响应基因在转基因中的表达gydF4y2Ba拟南芥gydF4y2Ba植物。在1/2 MS的培养基上,用干旱和NaCl (100 mM)处理2小时,从两周大的幼苗中提取RNA。采用qRT-PCR检测基因表达水平。的表达gydF4y2BaAtActingydF4y2Ba作为对照进行分析。利用基因特异性引物检测胁迫相关基因的表达水平。干旱相关基因在转基因中的表达量显著增加gydF4y2Ba拟南芥gydF4y2Ba经干旱处理的植物(gydF4y2Ba一个gydF4y2Ba-gydF4y2BafgydF4y2Ba).转基因后盐相关基因的表达量显著增加gydF4y2Ba拟南芥gydF4y2Ba经盐处理的植物(gydF4y2BaggydF4y2Ba-gydF4y2BajgydF4y2Ba).数据为三个实验的平均值±SDs。方差分析(ANOVA)检验,差异有显著性(gydF4y2Ba∗gydF4y2Bap < 0.05,gydF4y2Ba∗gydF4y2Ba∗gydF4y2Bap < 0.01)gydF4y2Ba
大豆毛状根的靶向诱变及GUS染色gydF4y2Ba
进一步确认了其功能gydF4y2BaGmMYB118gydF4y2Ba基因pCAMBIA3301-gydF4y2BaGmMYB118gydF4y2Ba和pCas9-GmU6-sgRNA)用于大豆毛状根的过表达和使用CRISPR- cas9系统(分别为OE和CRISPR构建)进行基因编辑分析。gydF4y2Ba
由于pCAMBIA3301载体携带了GUS报告基因,我们按照GUS组织化学检测试剂盒的方案检测了GUS的表达水平,以检测载体的转化效率gydF4y2Ba发根农杆菌(A. rhizogenes)gydF4y2Ba介导的转换。转换效率约为50%(附加文件gydF4y2Ba1gydF4y2Ba:图S5A)。从GUS染色结果可以推断,每个OE和CRISPR植株的根中约有50%是阳性根。为了检测大豆毛状根的靶基因突变,收集和提取基因组DNA,进一步检测毛状根的靶基因突变。用特异性引物扩增目标基因并测序,结果显示部分碱基被替换,没有任何插入或删除(附加文件gydF4y2Ba1gydF4y2Ba:图S5B)。的编码序列的10%的根gydF4y2BaGmMYB118gydF4y2Ba在每个CRISPR植物中进行编辑。氨基酸(IgydF4y2Ba17gydF4y2Ba,我gydF4y2Ba18gydF4y2BaFgydF4y2Ba19gydF4y2Ba在77.5%的CRISPR植株中,GmMYB118基因发生了改变,如从IgydF4y2Ba17gydF4y2BaMgydF4y2Ba17gydF4y2Ba,我gydF4y2Ba18gydF4y2Ba到一个gydF4y2Ba18gydF4y2BaFgydF4y2Ba19gydF4y2Ba到SgydF4y2Ba19gydF4y2Ba.这些发现表明,CRISPR-Cas9系统在毛状根发育过程中修饰了该基因。gydF4y2Ba
GmMYB118gydF4y2Ba转基因大豆毛状根抗旱性和耐盐性的提高gydF4y2Ba
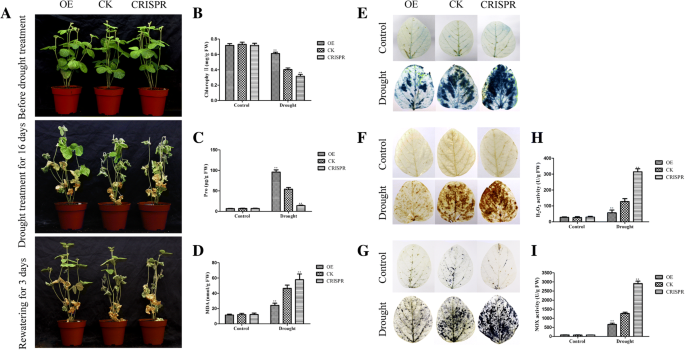
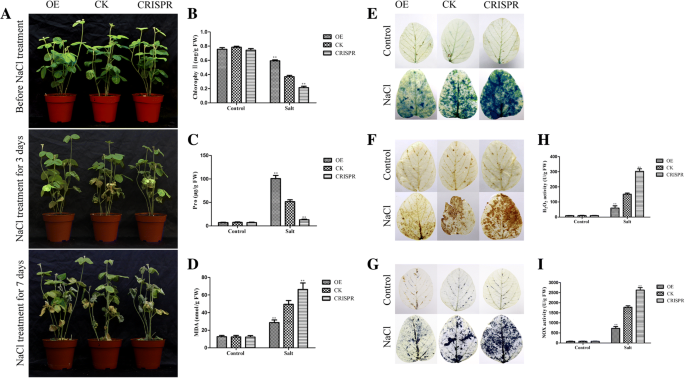
分析OE和CRISPR系的耐旱性[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba].干旱处理时,幼苗毛状根先不浇水14天,再补水3天。OE植株的成活率为83.33%,明显高于CK植株的33.33%;然而,CRISPR植株的存活率为16.67%,比CK植株的存活率低(图2)。gydF4y2Ba9gydF4y2Baa).同样,OE植株在盐胁迫下的存活率为66.67%,明显高于CK植株的48.33%。CRISPR植株的存活率比CK植株低25.00%(图2)。gydF4y2Ba10gydF4y2Ba一个)。gydF4y2Ba
通用汽车gydF4y2BaMYB118gydF4y2Ba转基因大豆毛状根抗旱性的提高。将2 ~ 5 cm毛状根的幼苗在正常条件下盆栽生长5 d,然后脱水16 d。复水后3 d监测水分胁迫植株的成活率。展示了OE、CK和CRISPR植物在干旱条件下的抗旱性表型图像(gydF4y2Ba一个gydF4y2Ba).叶片叶绿素含量(gydF4y2BabgydF4y2Ba)、脯氨酸(gydF4y2BacgydF4y2Ba)及MDA (gydF4y2BadgydF4y2Ba)分别在干旱或正常生长条件下的OE、CK和CRISPR植物中检测到。无灌溉大豆叶片台盼蓝染色14天(gydF4y2BaegydF4y2Ba)时,死亡细胞可以被过滤,而活细胞则不能。轻拍(gydF4y2BafgydF4y2Ba)及NBT (gydF4y2BaggydF4y2Ba)分别对OE、CK和CRISPR植物叶片进行干旱处理或正常条件下7天的染色。颜色的深浅表示H的浓度gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba和OgydF4y2Ba2gydF4y2Ba−gydF4y2Ba在树叶里(gydF4y2BafgydF4y2Ba-gydF4y2BaggydF4y2Ba).H的含量gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba(gydF4y2BahgydF4y2Ba)和OgydF4y2Ba2gydF4y2Ba−gydF4y2Ba(gydF4y2Ba我gydF4y2Ba)在OE、CK和CRISPR植物叶片经干旱处理或正常处理7天后。数据为三个实验的平均值±SDs。方差分析(ANOVA)检验,差异有显著性(gydF4y2Ba∗gydF4y2Bap < 0.05,gydF4y2Ba∗gydF4y2Ba∗gydF4y2Bap < 0.01)gydF4y2Ba
通用汽车gydF4y2BaMYB118gydF4y2Ba转基因大豆毛状根耐盐性的提高。将2 ~ 5 cm毛状根的幼苗在正常条件下盆栽生长5天,然后用250 mM NaCl处理1周。展示了OE、CK和CRISPR植物在盐条件下的耐盐表型图像(gydF4y2Ba一个gydF4y2Ba).叶片叶绿素含量(gydF4y2BabgydF4y2Ba)、脯氨酸(gydF4y2BacgydF4y2Ba)及MDA (gydF4y2BadgydF4y2Ba)在处理250 mM NaCl或正常生长条件下,分别在OE、CK和CRISPR植株中检测3 d。不灌溉大豆叶片台盼蓝染色一周(gydF4y2BaegydF4y2Ba)时,死亡细胞可以被过滤,而活细胞则不能。轻拍(gydF4y2BafgydF4y2Ba)及NBT (gydF4y2BaggydF4y2Ba)在250 mM NaCl处理或正常条件下,对OE、CK和CRISPR植物叶片进行3天的染色。颜色的深浅表示H的浓度gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba和OgydF4y2Ba2gydF4y2Ba−gydF4y2Ba在树叶里(gydF4y2BafgydF4y2Ba-gydF4y2BaggydF4y2Ba).H的含量gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba(gydF4y2BahgydF4y2Ba)和OgydF4y2Ba2gydF4y2Ba−gydF4y2Ba(gydF4y2Ba我gydF4y2Ba)在250 mM NaCl处理或正常条件下处理3 d后,OE、CK和CRISPR植物的叶片中。数据为三个实验的平均值±SDs。方差分析(ANOVA)检验,差异有显著性(gydF4y2Ba∗gydF4y2Bap < 0.05,gydF4y2Ba∗gydF4y2Ba∗gydF4y2Bap < 0.01)gydF4y2Ba
为探讨提高OE品系抗旱性的潜在生理机制,分别在正常生长和胁迫条件下测定了OE、CK和CRISPR植株的脯氨酸、丙二醛(MDA)和叶绿素含量。该方法描述了应力条件。脯氨酸和叶绿素含量分别为86.41 μg/g和0.65 mg/g, OE显著高于CK(分别为47.16 μg/g和0.39 mg/g)。干旱条件下,CRISPR植株的脯氨酸和叶绿素含量(分别为16.44 μg/g和0.29 mg/g)明显低于对照(图2)。gydF4y2Ba9gydF4y2Bab, c)。OE植株脯氨酸和叶绿素含量分别为88.17 μg/g和0.62 mg/g,显著高于CK植株(分别为46.70 μg/g和0.37 mg/g)。在盐胁迫下,CRISPR植株的同样含量分别比对照植株低12.45 μg/g和0.20 mg/g(图2)。gydF4y2Ba10gydF4y2Bab, c).在干旱和盐胁迫条件下,OE植株的MDA含量均低于CK和CRISPR植株(图5)。gydF4y2Ba9gydF4y2Bad和gydF4y2Ba10gydF4y2Bad).而在正常条件下,各植物间MDA含量无明显差异(图2)。gydF4y2Ba9gydF4y2Ba罪犯和gydF4y2Ba10gydF4y2Ba罪犯)。gydF4y2Ba
我们检测到的表情gydF4y2BaGmMYB118gydF4y2Ba在干旱和NaCl处理下转基因植物的毛状根中。与CK植株相比,NaCl处理下OE植株的表达量提高了7.9倍,而CRISPR植株的表达量下降了2.3倍。在干旱处理下,OE植株中的表达量是CK植株的5倍,而CRISPR植株中的表达量是CK植株的2倍(附加文件)gydF4y2Ba1gydF4y2Ba:图S6)。gydF4y2Ba
Gm过表达gydF4y2BaMYB118gydF4y2Ba降低O的浓度gydF4y2Ba2gydF4y2Ba−gydF4y2Ba和HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba
由于胁迫和细胞内活性氧(ROS)含量影响植物的生长发育,我们用3,3-二氨基联苯胺(DAB)和硝基蓝四氮唑(NBT)对大豆叶片进行染色,检测HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba和OgydF4y2Ba2gydF4y2Ba−gydF4y2BaOE、CK和CRISPR植物在正常或胁迫条件下的含量。该方法描述了应力条件。在正常生长条件下,所有植物叶片的DAB和NBT染色均无差异(图2)。gydF4y2Ba9gydF4y2Ba做减法,gydF4y2Ba10gydF4y2Ba做减法)。在水分亏缺和250 mM NaCl胁迫下,OE植株的色深显著低于CK植株。相比之下,CRISPR植株的颜色深度明显大于CK植株(图2)。gydF4y2Ba9gydF4y2Ba做减法,gydF4y2Ba10gydF4y2Ba做减法)。这些结果表明,HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba和OgydF4y2Ba2gydF4y2Ba−gydF4y2BaCK组的含量高于OE组,而CRISPR组的含量低于CK组。gydF4y2Ba
NADPH氧化酶(NOX)活性与O的形成密切相关gydF4y2Ba2gydF4y2Ba-gydF4y2Ba为H的中间产物gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba退化(gydF4y2Ba18gydF4y2Ba,gydF4y2Ba44gydF4y2Ba,gydF4y2Ba45gydF4y2Ba].因此,我们测量了H的浓度gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba大豆根和叶中氮氧化物的活性与HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba比色测定试剂盒和氮氧化物测定试剂盒。结果与DAB、NBT染色结果一致;H的浓度gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2BaCK植株在干旱条件下的NOX活性分别为54.09 U/g和600.95 U/g,高于OE植株(分别为130.77 U/g和1325.62 U/g),而CK植株的相同浓度和活性分别低于CRISPR植株(分别为295.52 U/g和2896.18 U/g)(图。gydF4y2Ba9gydF4y2Bah, i). h的浓度gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2BaCK植株的NOX活性分别为52.93 U/g和641.35 U/g,高于OE植株(分别为151.15 U/g和1658.93 U/g);此外,在盐胁迫条件下,CK植株的相同浓度和活性均低于CRISPR植株(分别为276.55 U/g和2530.05 U/g)(图。gydF4y2Ba10gydF4y2Bah, i)。gydF4y2Ba
此外,我们用台盼蓝染色大豆叶片,检测正常和胁迫条件下的细胞活性。如图所示。gydF4y2Ba9gydF4y2Bae和gydF4y2Ba10gydF4y2Bae,在干旱和盐胁迫条件下,OE植物叶片的蓝色面积明显小于CK植物叶片,CK植物明显小于CRISPR植物。正常生长条件下,植物叶片无差异(图2)。gydF4y2Ba9gydF4y2Bae和gydF4y2Ba10gydF4y2Bae).这些结果表明CK植物叶片中的细胞活性低于OE植物叶片,但高于CRISPR植物叶片中的细胞活性。gydF4y2Ba
讨论gydF4y2Ba
在本研究中,我们分离并鉴定了gydF4y2BaGmMYB118gydF4y2Ba139个myb相关转录因子。我们获得了转基因gydF4y2Ba拟南芥gydF4y2Ba并考察大豆的潜在作用gydF4y2BaGmMYB118gydF4y2Ba.我们的结果表明gydF4y2BaGmMYB118gydF4y2Ba能提高对干旱和盐胁迫的耐受性gydF4y2Ba拟南芥gydF4y2Ba与大豆对照对照比较。在目前的结果中,编码序列为gydF4y2BaGmMYB118gydF4y2Ba在CRISPR毛发根中进行编辑。有趣的是,表达水平gydF4y2BaGmMYB118gydF4y2Ba在CRISPR植物中显著低于CK植物(附加文件gydF4y2Ba1gydF4y2Ba:图S6)。提示基因编辑后可能会影响mRNA的稳定性gydF4y2BaGmMYB118gydF4y2Ba基因,或减少时的表达gydF4y2BaGmMYB118gydF4y2Ba可能是由于CRISPR编辑后从宿主本身移除或修复机制。gydF4y2Ba
根是植物的主要营养器官之一,负责吸收水和溶解在水中的矿物质,将水和矿物质输送到茎叶,储存营养物质[gydF4y2Ba46gydF4y2Ba].在干旱和高盐条件下,根系面临的问题是如何保持水分以维持渗透平衡,控制细胞膜内外的离子保持离子平衡,从而增加植物生存的可能性。在我们的结果中,的表达式gydF4y2BaGmMYB118gydF4y2Ba在根中最高(图;gydF4y2Ba3.gydF4y2Baa).以前没有研究表明myb相关基因在根中表达最多,并具有一定的功能。可以假定gydF4y2BaGmMYB118gydF4y2Ba在胁迫条件下,能改善根系中水分的渗透平衡和细胞中阴离子和阳离子的平衡,直接或间接地提高植物的抗旱性和耐盐性。gydF4y2Ba
前期研究表明,R2R3-MYB tf可以通过参与多种生物化学和生理过程来增强对各种非生物胁迫的耐受性[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba].很少有报道表明myb相关的转录因子参与植物对非生物胁迫的响应。myb相关基因主要参与光敏色素调控、类黄酮生物合成、下胚轴伸长和昼夜节律等过程[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba].目前,我们已经发现的表达式gydF4y2BaGmMYB118gydF4y2Ba是由干旱、盐、热、冷引起的。Pi等人报道gydF4y2BaGmMYB173gydF4y2Ba(gydF4y2BaGmMYB118gydF4y2Ba)与大豆细胞中GmCHS5启动子相互作用,调节类黄酮的生物合成[gydF4y2Ba49gydF4y2Ba].异黄酮具有多种生物学功能,在植物与环境的相互作用中发挥着重要作用[gydF4y2Ba47gydF4y2Ba,gydF4y2Ba50gydF4y2Ba].Chu等报道红薯的绿色、紫色叶和洋葱的外叶中黄酮类化合物含量较高,对自由基的清除活性评价在85%以上[gydF4y2Ba51gydF4y2Ba它暗示着gydF4y2BaGmMYB118gydF4y2Ba通过调节类黄酮的生物合成参与非生物胁迫。这也表明myb相关的转录因子能够响应非生物胁迫和类黄酮生物合成过程。gydF4y2Ba
在本研究中,表型和分子机制实验表明gydF4y2BaGmMYB118gydF4y2Ba通过OE和CRISPR两种方法提高大豆的抗旱性和耐盐性gydF4y2Ba答:rhizogenesgydF4y2Ba-介导转化系统。然而,几个月前,Pi等人报道了盐引发的磷酸化gydF4y2BaGmMYB173gydF4y2Ba,随后增加了其亲和力gydF4y2BaGmCHS5gydF4y2Ba启动子和蛋白表达的升高gydF4y2BaGmCHS5gydF4y2Ba可能通过增强二羟基b环类黄酮的积累来促进大豆的耐盐性[gydF4y2Ba49gydF4y2Ba].不幸的是,在干旱条件下,我们还没有发现直接调控下游基因gydF4y2BaGmMYB118gydF4y2Ba本研究存在一定的局限性。在未来,有必要调查是否gydF4y2BaGmMYB118gydF4y2Ba提高表达gydF4y2BaGmCHS5gydF4y2Ba目的:提高干旱条件下大豆细胞中黄酮类化合物的积累。它可能会揭示是否gydF4y2BaGmMYB118gydF4y2Ba可以调控下游相同基因提高抗旱耐盐能力,也可以调控下游不同基因提高抗旱耐盐能力。在作物科学研究中,gydF4y2BaGmMYB118gydF4y2Ba可作为大豆抗逆境分子育种的候选基因之一。gydF4y2Ba
结论gydF4y2Ba
GmMYB118gydF4y2Ba通过降低ROS和MDA的含量来提高对干旱和盐胁迫的耐受性。gydF4y2Ba
方法gydF4y2Ba
大豆myb相关转录因子的鉴定gydF4y2Ba
为了获得可能的候选myb相关TF家族成员,一些来源如Phytozome (gydF4y2Bahttp://www.phytozome.net/gydF4y2Ba)及TFDB (gydF4y2Bahttp://planttfdb.cbi.pku.edu.cn/gydF4y2Ba)获取序列数据,用于大豆myb相关TF家族成员的生物信息学分析。然后使用SMART/Pfam工具的隐马尔可夫模型检查所得到的蛋白质序列是否存在MYB motif (gydF4y2Bahttp://smart.embl-heidelberg.de/gydF4y2Ba而且gydF4y2Bahttp://pfam.xfam.org/gydF4y2Ba).没有MYB基序的蛋白质从数据集中被省略。通过比对和剔除冗余序列,我们获得了139个myb相关的TF基因,通过SoyBase (gydF4y2Bahttp://soybase.org/sbt/gydF4y2Ba).gydF4y2Ba
myb相关基因的染色体分布gydF4y2Ba
利用Phytozome染色体位点进行染色体分布研究。使用MapInspect程序绘制染色体分布。深蓝色条代表Chrs, Chr数字显示在条的顶部。杆的长度不表示Chr的大小。柱状图左侧的数字表示相邻基因之间的距离(以Mb为单位)。gydF4y2Ba
myb相关tf的定位及系统发育分析gydF4y2Ba
通过ClustalX对氨基酸序列进行多次比对,并手动校正比对。采用MEGA 6和NJ方法构建系统发育树,采用1000个重复的自举分析评估节点的显著性[gydF4y2Ba52gydF4y2Ba].gydF4y2Ba
植物材料和胁迫处理gydF4y2Ba
将大豆(铁风8号)种子在蛭石罐中发芽15天。然后对这些幼苗进行各种非生物胁迫,包括干旱、盐度、热和冷胁迫。对于干旱胁迫,将大豆幼苗放在滤纸上诱导快速干旱0、1、5、12和24 h。对于温度处理,将大豆幼苗分别放置在4°C或42°C的室中进行冷处理或热处理,时间分别为0、1、5、12和24 h。盐处理时,将幼苗转移到250 mM NaCl溶液中,分别孵育0、1、5、12和24 h。所有收获的幼苗立即浸泡在液氮中,并在−80°C保存以提取RNA。gydF4y2Ba
拟南芥gydF4y2Ba本研究采用Col-0生态型。种子在含2%蔗糖的1/ 2ms培养基上萌发,4℃春化3 d后,放置于温度22℃、辐照度40 μmol/m的生长室中gydF4y2Ba2gydF4y2Ba/秒gydF4y2Ba1gydF4y2Ba,光周期为16小时亮/8小时暗。gydF4y2Ba
RNA提取和qRT-PCRgydF4y2Ba
使用Trizol试剂按照制造商的方案(TIANGEN,中国)提取总RNA,并使用DNase I (TaKaRa,日本)处理总RNA以去除基因组DNA污染。qRT-PCR使用PrimeScript™RT试剂试剂盒(TaKaRa, Japan)按照制造商的方案完成。根据大豆myb相关基因和胁迫响应基因,设计了一对基因特异性引物gydF4y2Ba拟南芥gydF4y2Ba通过Primer Premier 5.0。的gydF4y2Ba拟南芥gydF4y2Ba以大豆肌动蛋白基因为对照(RT-AtActin和RT-GmActin,附加文件)gydF4y2Ba1gydF4y2Ba:表S1)。qRT-PCR采用ABI Prism 7500实时PCR系统(ThermoFisher Scientific, USA),按照Liu [gydF4y2Ba30.gydF4y2Ba].定量分析采用2gydF4y2Ba——ΔΔCTgydF4y2Ba方法(gydF4y2Ba53gydF4y2Ba].用于qRT-PCR的引物列在附加文件中gydF4y2Ba1gydF4y2Ba:表S1。gydF4y2Ba
向量构造gydF4y2Ba
的编码序列gydF4y2BaGmMYB118gydF4y2Ba采用PCR引物(MYB118-F: ATGTCTCGCGCCTCCTC, MYB118-R: AGCAACACTAATGATGCTTTCT)扩增。然后,酶切位点(NcoI和BsTEII)与基因特异性引物(MYB118-3301,附加文件)结合gydF4y2Ba1gydF4y2Ba:表S2)添加到gydF4y2BaGmMYB118gydF4y2Ba序列。PCR产物和pCAMBIA3301载体经NcoI和BsTEII酶切(ThermoFisher Scientific, USA),在CaMV 35S启动子的控制下连接到pCAMBIA3301中,生成pCAMBIA3301- gmmyb118。的sgRNA种子为CRISPR载体gydF4y2BaGmMYB118gydF4y2Ba由CRISPR-P 2.0设计(gydF4y2Bahttp://crispr.hzau.edu.cngydF4y2Ba),提供网页服务,让电脑辅助设计高效率的sgRNA,使偏离目标的影响减至最少[gydF4y2Ba54gydF4y2Ba].sgRNA种子序列为GAACAGTATGATCTCACCGG,位于该基因的第1外显子上gydF4y2BaGmMYB118gydF4y2Ba基因。限制性内切酶位点(BsaI)序列(ATTG和AAAC)分别添加到种子及其反向序列(sgRNA种子,附加文件)的末端gydF4y2Ba1gydF4y2Ba:表S2),获取sgrna。pUC57-GmU6载体用BsaI (NEB, USA)完全消化;然后将sgrna连接到pUC57-GmU6中,得到pUC57-GmU6- sgrna。引物U6-sgRNA(附加文件gydF4y2Ba1gydF4y2Ba:表S2)用于检测序列是否正确。用EcoRI和HindIII (ThermoFisher Scientific, USA)对pUC57-GmU6-sgRNA和pCAMBIA3301-Cas9载体进行完全酶切,得到GmU6-sgRNA片段,并对载体进行酶切。消化后,GmU6-sgRNA片段用T4 DNA连接酶(TransGene, China)克隆到pCAMBIA3301-Cas9载体中,生成pCas9-GmU6-sgRNA载体。引物pCas9(附加文件gydF4y2Ba1gydF4y2Ba:表S2)用于检测序列是否正确。所有引物都列在附加文件中gydF4y2Ba1gydF4y2Ba:表S2。gydF4y2Ba
答:rhizogenesgydF4y2Ba大豆毛状根的介导转化gydF4y2Ba
以大豆品种威廉姆斯82为材料,进行了大豆毛状根转化试验gydF4y2Ba答:rhizogenesgydF4y2Ba-介导转化[gydF4y2Ba43gydF4y2Ba].种子在25℃、光照16 h /暗光周期8 h的湿度箱中萌发。一周后,健康的植物被注射gydF4y2Ba答:rhizogenesgydF4y2Ba含有pCAMBIA3301 (CK)的菌株K599或含有上述结构的K599 (pCAMBIA3301或pcas9 - gmu6 - sgrna -结构载体)。然后将受感染的植物转移到室内,保持在高湿度下,直到感染部位产生毛状根,并长到2-5厘米长。将原主根从侵染部位下方0.5 cm处拔除,然后将有2-5 cm毛状根的幼苗移栽盆栽5天。随后,将植株置于干旱和250 mM NaCl处理下,分别处理16天和7天[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba42gydF4y2Ba].gydF4y2Ba
10个精选myb相关tf的启动子分析gydF4y2Ba
选择MYB家族相关基因启动子ATG起始密码子上游2000 bp区域进行鉴定gydF4y2Ba独联体gydF4y2Ba通过将启动子区域提交给PLACE (gydF4y2Bahttp://bioinformatics.psb.ugent.be/webtools/plantcare/html/gydF4y2Ba).然后手工统计每种元素的数量。gydF4y2Ba
台盼蓝、DAB、NBT染色gydF4y2Ba
有2-5厘米毛状根的幼苗转移到花盆中5天,然后在生长室中干旱(不灌溉)一周或250 mM NaCl处理3天。从处理过的幼苗分离的叶子分别染色。DAB染色时,样品在DAB溶液(Solarbio, China)中浸泡12小时,然后在75%乙醇中脱色,直到叶片变白。NBT染色时,将样品浸泡在NBT染色液(Creek Huizhi, China)中12小时,然后在75%乙醇中[gydF4y2Ba18gydF4y2Ba脱色,直到叶子变白。对于台盼蓝染色,不同的是,将植株置于干旱条件下16天。样品在0.5%台番蓝(BioDee, China)溶液中浸泡12小时,然后在75%乙醇中脱色,直到叶片变白。图片由佳能50D(佳能,日本)相机拍摄。gydF4y2Ba
HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2BaNOX含量及活性gydF4y2Ba
在H之前gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba试验结果表明,移栽5 d的大豆植株在干旱和250 mM NaCl胁迫下处理1周3天。之后,HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba按照HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba比色测定试剂盒(Beyotime,中国)[gydF4y2Ba18gydF4y2Ba].同样,根据制造商的方案,使用NOX检测试剂盒(Solarbio, China)测定叶片的NOX活性。所有测量均重复3次,采用方差分析进行统计学分析。gydF4y2Ba
亚细胞定位测定gydF4y2Ba
的全长cDNA序列gydF4y2BaGmMYB118gydF4y2Ba被融合到gydF4y2BahGFPgydF4y2Ba基因MYB118-GFP,附加文件gydF4y2Ba1gydF4y2Ba:表S2),由CaMV 35S启动器控制。的cDNA编码序列gydF4y2BaAtWRKY25gydF4y2Ba(At2g30250),位于细胞核[gydF4y2Ba29gydF4y2Ba的n端融合gydF4y2BamCherrygydF4y2Ba基因(WRKY25-RFP,附加文件gydF4y2Ba1gydF4y2Ba:表S2),由CaMV 35S启动器控制。重组质粒gydF4y2BaGmMYB118 -gydF4y2BaGFP和gydF4y2BaAtWRKY25-RFPgydF4y2Ba共同转化为gydF4y2Ba拟南芥gydF4y2Ba通过peg4000介导的方法[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba55gydF4y2Ba].在黑暗条件下观察融合蛋白的表达12小时,用激光扫描共聚焦显微镜检测GFP和RFP (Zeiss LSM 700,德国)[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba].gydF4y2Ba
转基因作物的干旱和盐胁迫研究gydF4y2Ba拟南芥gydF4y2Ba植物gydF4y2Ba
为获得EX植株,对其cDNA全长序列进行分析gydF4y2BaGmMYB118gydF4y2Ba导入pCAMBIA1302植物转化载体(MYB118-3301,附加文件gydF4y2Ba1gydF4y2Ba:表S2)。重组载体经测序确认后转化成gydF4y2Ba根癌土壤杆菌gydF4y2Ba(GV3101)。WTgydF4y2Ba拟南芥gydF4y2Ba将转化后的细菌用花浸法感染(Col-0)植株[gydF4y2Ba56gydF4y2Ba].gydF4y2Ba
用次氯酸钠消毒WT和EX(独立转基因株系4、5和6)种子。在4°C下春化3天后,将含有种子的板转移到生长室。3个gydF4y2Ba拟南芥gydF4y2Ba进行qRT-PCR分析gydF4y2BaGmMYB118gydF4y2Ba基因在异位表达和WT (Col-0)植物中的表达(附加文件gydF4y2Ba1gydF4y2Ba:图S2B)。的表达gydF4y2BaAtActingydF4y2Ba作为加载控制进行分析(附加文件gydF4y2Ba1gydF4y2Ba:表S1)。gydF4y2Ba
为了进行发芽试验,将WT和EX每种基因型的大约80粒无菌种子播种在1/2倍强度的MS生长培养基上,培养基中添加了不同浓度的PEG6000(0,3,6和9%)(Merck, USA)或NaCl(0,75,100和125 mM) (XiLONG, China)。生长室温度为22℃,辐照度为40 μmol/mgydF4y2Ba2gydF4y2Ba/秒gydF4y2Ba1gydF4y2Ba,光周期为16小时亮/8小时暗,如上文所述[gydF4y2Ba57gydF4y2Ba,gydF4y2Ba58gydF4y2Ba].每12小时计数发芽种子的数量,每个基因型至少测量80个种子。gydF4y2Ba
为了进行根系生长测定,无菌的WT和EX种子播种在1/2倍的MS生长介质上。将5天大的幼苗转移到含有不同浓度PEG6000(0,3,6和9%)(Merck, USA)或NaCl(0,75,100和125 mM) (XiLONG, China)的生长介质中一周。生长7天后采集图像,并用Epson Expression 11000XL根系扫描分析仪(Epson,日本)评估根系长度[gydF4y2Ba57gydF4y2Ba].每个基因型测得至少30株幼苗。gydF4y2Ba
为了测试发育后期的干旱和耐盐性,三周大的幼苗被脱水或250 mM NaCl处理14天。对植株表型进行成像,并对植株进行计数以确定成活率。在每个处理中,每系至少测量30株幼苗,所有胁迫试验至少进行三次。gydF4y2Ba
转基因植物的热胁迫和冷冻胁迫研究gydF4y2Ba拟南芥gydF4y2Ba植物gydF4y2Ba
为测定种子苗期的耐热性,将无菌WT和EX种子播种于1/2倍强度的MS培养基上。5天大的幼苗在37℃下放置1 h,在22℃下恢复2 h,然后在44℃下放置4.5 h [gydF4y2Ba59gydF4y2Ba].为了进行耐冻性测定,5天大的幼苗被置于−4°C下4小时[gydF4y2Ba34gydF4y2Ba].幼苗恢复5 d后,对其表型进行成像,并对植株进行计数,以确定成活率。在每个处理中,每系至少测量60株幼苗,所有胁迫试验至少进行三次。gydF4y2Ba
脯氨酸和丙二醛含量测定gydF4y2Ba
在测量之前,将转入盆栽5天的大豆植株置于干旱或250 mM NaCl胁迫下一周或3天,之后按照前面所述测量叶片脯氨酸含量[gydF4y2Ba60gydF4y2Ba].同样,根据制造商的方案,使用MDA检测试剂盒(Comin,中国)测定叶片的MDA含量。所有测量均重复3次,采用方差分析进行统计学分析。gydF4y2Ba
缩写gydF4y2Ba
- 答:rhizogenesgydF4y2Ba:gydF4y2Ba
-
农杆菌属rhizogenesgydF4y2Ba
- 阿坝:gydF4y2Ba
-
脱落酸gydF4y2Ba
- 装备:gydF4y2Ba
-
染色体gydF4y2Ba
- 轻拍:gydF4y2Ba
-
3, 3-diaminobenzidinegydF4y2Ba
- DBD:gydF4y2Ba
-
dna结合域gydF4y2Ba
- 格斯:gydF4y2Ba
-
β葡萄糖醛酸酶gydF4y2Ba
- MDA:gydF4y2Ba
-
丙二醛gydF4y2Ba
- 电视台:gydF4y2Ba
-
氮蓝四唑gydF4y2Ba
- 氮:gydF4y2Ba
-
NADPH氧化酶gydF4y2Ba
- 挂钩:gydF4y2Ba
-
聚乙二醇gydF4y2Ba
- 存在:gydF4y2Ba
-
实时定量PCRgydF4y2Ba
- ROS:gydF4y2Ba
-
活性氧gydF4y2Ba
- TF:gydF4y2Ba
-
转录因子gydF4y2Ba
- WT:gydF4y2Ba
-
野生型gydF4y2Ba
参考文献gydF4y2Ba
王峰,陈宏伟,李广涛,魏伟,李伟,张伟科,马波,毕永德,赖玉春,刘小林,等。GmWRKY27与GmMYB174相互作用,降低GmNAC29的表达,提高大豆植株的抗逆性。中国植物学报,2015;36(2):344 - 344。gydF4y2Ba
Yamaguchi-Shinozaki K, Shinozaki K.细胞对脱水和冷胁迫的应答和耐受性的转录调节网络。植物学报。2006;57:781-803。gydF4y2Ba
徐志生,陈敏,李立龙,马一智。ERF转录因子家族在植物中的功能。植物学。2008;86(9):969 - 77。gydF4y2Ba
徐志生,陈敏,李立龙,马一智。AP2/ERF转录因子家族在作物改良中的功能及应用中国生物工程学报,2011;29(7):379 - 379。gydF4y2Ba
C彦辉,Y晓远,H坤,梅花,L吉刚,G兆峰,L志强,Z云飞,肖晓,W晓明,Q晓明,等。拟南芥MYB转录因子超家族:与水稻MYB家族的表达分析及系统发育比较。植物分子生物学杂志,2006;60(1):107-24。gydF4y2Ba
赵颖,田霞,王峰,张玲,辛敏,胡震,姚勇,倪震,孙强,彭慧。小麦MYB基因对高温响应的特征分析。中国生物医学工程学报,2017;17(1):208。gydF4y2Ba
褚松,王杰,朱勇,刘松,周旭,张辉,王策,杨伟,田志,程辉,等。r2r3型MYB转录因子GmMYB29调控大豆异黄酮的生物合成。公共科学学报,2017;13(5):e1006770。gydF4y2Ba
刘玲。MYB转录因子在植物防御反应中的作用及其分子机制。Hereditas(北京)。2008; 30(10): 1265 - 71。gydF4y2Ba
王志强,王志强,王志强,等。植物MYB转录因子的研究进展。植物学报,1997;13(2):67-73。gydF4y2Ba
边三明,金德华,李荣荣,谢欣,高光亮,孙伟科,李玉军,翟丽玲,李学勇。大豆cca1样蛋白全基因组分析及GmMYB138a功能鉴定中华分子化学杂志,2017;18(10)。gydF4y2Bahttps://doi.org/10.3390/ijms18102040gydF4y2Ba.gydF4y2Ba
王峰,索燕,魏红,李敏,谢超,王玲,陈霞,张哲。40个地黄MYB家族基因的鉴定与鉴定及其对遮荫和连作响应的表达谱。中华分子化学杂志,2015;16(7):1509 - 30。gydF4y2Ba
熊红,李娟,刘鹏,段娟,赵颖,郭霞,李颖,张宏,阿里娟,李忠。水稻myb转录因子OsMYB48-1的过表达增强水稻抗旱耐盐能力。PLoS One. 2014;9(3):e92913。gydF4y2Ba
植物MYB转录因子在干旱响应机制中的作用。中华分子化学杂志,2015;16(7):15811-51。gydF4y2Ba
Dubos C, Stracke R, Grotewold E, Weisshaar B, Martin C, Lepiniec L.拟南芥MYB转录因子研究。植物科学进展,2010;15(10):573-81。gydF4y2Ba
冯g, Burleigh JG, Braun EL, Mei W, Barbazuk WB。3R-MYB基因家族在植物中的进化。中国生物医学工程学报,2017;9(4):1013-29。gydF4y2Ba
张玲,赵刚,夏春,贾军,刘霞,孔霞。转基因拟南芥MYB转录因子TaMYB56-B基因的过表达增强了小麦对冻盐胁迫的耐受性。基因。2012;505(1):100 - 7。gydF4y2Ba
徐蓉,王勇,郑辉,陆伟,吴超,黄娟,闫凯,杨刚,郑超。拟南芥盐诱导转录因子MYB74受rna定向DNA甲基化途径调控。中国生物医学工程学报,2015;26(4):539 - 544。gydF4y2Ba
王宁,张文喜,秦美美,李松,乔敏,刘志华,项宁。大豆的耐旱性(Glycine max。L)由一种新的R2R3-MYB转录因子GmMYB84表达。中国生物医学工程学报,2017;36(4):344 - 344。gydF4y2Ba
陈楠,杨强,潘磊,迟霞,陈明,胡东,杨铮,王涛,王明,余松。30个MYB转录因子基因的鉴定及其在花生非生物胁迫下的表达分析。基因。2014;533(1):332 - 45。gydF4y2Ba
Kobayashi S, Ishimaru M, Hiraoka K, Honda C. Kyoho葡萄myb相关基因调控花青素生物合成足底。2002;215(6):924 - 33所示。gydF4y2Ba
狼人(WEREWOLF)是拟南芥中myb相关蛋白,是一种位置依赖的表皮细胞模式调节因子。细胞。1999;99(5):473 - 83。gydF4y2Ba
杨春华,杨春华,杨春华,杨春华。花的颜色强度取决于myb相关转录因子控制的特化细胞形状。大自然。1994;369(6482):661 - 4。gydF4y2Ba
拟南芥myb相关转录因子在生物钟和花青素生物合成中的调节作用。植物信号行为研究。2016;11(3)。gydF4y2Bahttps://doi.org/10.1080/15592324.2016.1139278gydF4y2Ba.gydF4y2Ba
张志刚,张志刚,张志刚。植物myb相关转录因子可调控多种表皮细胞类型的发育。发展。1998;125(17):3497 - 508。gydF4y2Ba
易j, Derynck MR, Li X, Telmer P, Marsolais F, Dhaubhadel S.一种单重复MYB转录因子GmMYB176调控大豆CHS8基因表达并影响异黄酮生物合成。植物学报,2010;36(6):344 - 344。gydF4y2Ba
Urao T, Noji M, YamaguchiShinozaki K, Shinozaki K.干旱诱导拟南芥myb相关蛋白ATMYB2的转录激活域。植物学报,1996;10(6):1145-8。gydF4y2Ba
Schmutz J, Cannon SB, Schlueter J, Ma J, Mitros T, Nelson W, Hyten DL,宋q, Thelen JJ,程杰,等。古多倍体大豆基因组序列。自然。2010;463(7278):178 - 83。gydF4y2Ba
杜辉,王亚波,谢勇,梁志,姜世杰,张世生,黄亚波,唐玉玉。陆地植物myb相关基因的全基因组鉴定及进化与表达分析。DNA, 2013;20(5): 437-48。gydF4y2Ba
蒋永强,王晓明,王晓明。拟南芥WRKY25和WRKY33转录因子在非生物胁迫下的功能研究。植物分子生物学杂志,2009;69(1-2):91-105。gydF4y2Ba
刘鹏,徐志生,陆鹏,胡东,陈明,李立龙,马一智。一个具有苏氨酸自磷酸化活性的小麦PI4K基因赋予拟南芥耐旱耐盐能力。中国机械工程学报,2013;26(3):344 - 344。gydF4y2Ba
Riechmann JL, Heard J, Martin G, Reuber L, Jiang CZ, Keddie J, Adam L, Pineda O, Ratcliffe OJ, Samaha RR,等。拟南芥转录因子:真核生物全基因组比较分析。科学。2000;290(5499):2105 - 10。gydF4y2Ba
花TJ。提高作物耐盐性。中国机械工程学报,2004;29(3):344 - 344。gydF4y2Ba
程琳,李霞,黄霞,马涛,梁燕,马霞,彭霞,贾杰,陈松,陈勇,等。过表达羊草R1-MYB转录因子LcMYB1使转基因拟南芥具有耐盐性。植物化学学报,2013;gydF4y2Ba
Liu Q, Kasuga M, Sakuma Y, Abe H, Miura S, Yamaguchi-Shinozaki K, Shinozaki K, Baek D.两个具有EREBP/AP2 DNA结合域的转录因子DREB1和DREB2在拟南芥干旱和低温响应基因表达中分别分离了两条细胞信号转导通路。植物学报。1998;10(8):1391-406。gydF4y2Ba
拟南芥基因1s中参与干旱、低温或高盐胁迫响应的no1顺式作用元件。中国生物医学工程学报,2004,26(2):344 - 344。gydF4y2Ba
杨晓明,张晓明,张晓明,等。冷诱导拟南芥基因的克隆与鉴定。植物分子生物学。1990;15(1):137-44。gydF4y2Ba
Kurkela S, borgg - franck M.拟南芥低温和aba诱导基因之一kin2的结构和表达。植物分子生物学。1992;19(4):689-92。gydF4y2Ba
Harshavardhan VT, Van Son L, Seiler C, Junker A, Weigelt-Fischer K, Klukas C, Altmann T, Sreenivasulu N, Baumlein H, Kuhlmann M. AtRD22和AtUSPL1,植物特异性BURP结构域家族成员,涉及拟南芥耐旱性。公共科学学报,2014;9(10):e110065。gydF4y2Ba
Lang V, Palva ET.拟南芥冷驯化过程中脱落酸诱导rab18相关基因的表达。Heynh。植物分子生物学。1992;20(5):951-62。gydF4y2Ba
傅海仁,吴勇,王文杰,李志强。AtMYB2在低氧诱导拟南芥醇脱氢酶基因(ADH1)中作用的证据遗传学。1998;149(2):479 - 90。gydF4y2Ba
Ruggiero B, Koiwa H, Manabe Y, Quist TM, Inan G, Saccardo F, Joly RJ, Hasegawa PM, Bressan RA, Maggio A.脱落酸对植物生长和水分关系的解偶联效应。拟南芥脱落酸缺乏耐盐胁迫突变体sto1/nced3的分析植物科学进展。2004;36(2):334 - 434。gydF4y2Ba
孙旭,胡忠,陈锐,姜青,宋刚,张宏,奚艳。利用CRISPR-Cas9系统对大豆进行靶向诱变。科学通报2015;5:10342。gydF4y2Ba
Kereszt A, Li DX, Indrasumunar A, Nguyen CDT, Nontachaiyapoom S, Kinkema M, Gresshoff PM。发根农杆菌介导大豆转化研究根系生物学。物理学报。2007;2(4):948-52。gydF4y2Ba
米特勒R, Vanderauwera S, Gollery M, Van Breusegem F.植物活性氧基因网络。植物科学进展,2004;9(10):490-8。gydF4y2Ba
Foreman J, Demidchik V, Bothwell JHF, Mylona P, Miedema H, Torres MA, Linstead P, Costa S, Brownlee C, Jones JDG,等。NADPH氧化酶产生的活性氧调节植物细胞的生长。大自然。2003;422(6930):442 - 6。gydF4y2Ba
Schachtman DP, Goodger JQD。干旱下化学根梢信号。植物科学进展,2008;13(6):281-7。gydF4y2Ba
Czemmel S, Heppel SC, Bogs J. R2R3 MYB转录因子:葡萄类黄酮生物合成途径的关键调控因子。原生质体。2012;249(增刊2):S109-18。gydF4y2Ba
杜华,杨士生,梁志,冯斌斌,刘林,黄一斌,唐玉玉。大豆MYB转录因子超家族全基因组分析。BMC植物生物学。2012;12:106。gydF4y2Ba
皮娥,朱超,范伟,黄燕,曲林,李勇,赵强,丁峰,邱林,王华,等。定量磷蛋白组学和代谢组学分析揭示GmMYB173在盐胁迫下优化大豆类黄酮代谢。MCP论文出版,2018;17(5):MCP . ra117.000417。gydF4y2Ba
Koes RE, Quattrocchio F, Mol JNM。植物类黄酮生物合成途径:功能与进化。Bioessays。1994;16(2):123 - 32。gydF4y2Ba
褚玉华,常春林,夏芬。几种蔬菜类黄酮含量及其抗氧化活性研究。中国食品科学,2000;80(5):561-6。gydF4y2Ba
Tamura K, Stecher G, Peterson D, Filipski A, Kumar S. MEGA6:分子进化遗传学分析版本6.0。中国生物医学杂志,2013;30(12):2725-9。gydF4y2Ba
Le DT,西山R,渡边Y,望田K,山口信崎K,信崎K, Tran LS。脱水胁迫下大豆根和茎组织中大豆双组分系统基因的全基因组表达谱。DNA Res. 2011;18(1): 17-29。gydF4y2Ba
雷勇,卢磊,刘海宇,李松,邢峰,陈丽丽。CRISPR-P:用于植物中crispr系统的合成单导RNA设计的网络工具。植物学报。2014;7(9):1494-6。gydF4y2Ba
何光华,徐建勇,王彦彦,刘建民,李普生,陈敏,马一智,徐志生。来自小麦的干旱应答WRKY转录因子基因TaWRKY1和TaWRKY33赋予拟南芥抗旱性和耐热性。BMC植物生物学。2016;16:116。gydF4y2Ba
刘志刚,张志刚,张志刚。农杆菌介导拟南芥转化的一种简化方法。植物学报,1998;16(6):735-43。gydF4y2Ba
赵世平,徐志生,郑文军,赵伟,王彦彦,于廷峰,陈明,周一斌,闵德华,马永智,等。大豆RAV家族全基因组分析及GmRAV-03参与盐、干旱胁迫和外源ABA处理的功能鉴定中国植物科学,2017;8:905。gydF4y2Ba
冯长忠,陈勇,王超,孔永华,吴文华,陈玉峰。拟南芥RAV1转录因子被SnRK2激酶磷酸化,在种子萌发和幼苗早期发育过程中调控ABI3、ABI4和ABI5的表达。植物学报,2014;30(4):344 - 344。gydF4y2Ba
李世祥,刘建新,刘志智,李小荣,吴福杰,何玉凯。拟南芥热诱导TAS1 TARGET1通过热胁迫转录因子a1a介导耐热性植物学报。2014;26(4):1764-80。gydF4y2Ba
卜启勇,吕天祥,沈辉,梁鹏,王杰,王志智,黄志刚,肖丽婷,工程师C,金涛,等。拟南芥F-box蛋白MAX2的抗旱性调控(1[C][W][OPEN])。中国生物医学工程学报,2014;29(1):344 - 344。gydF4y2Ba
确认gydF4y2Ba
我们非常感谢dr。张辉(中国农业科学院作物科学研究所)提供了pCAMBIA3301载体和pUC57-GmU6-sgRNA。感谢中国农业科学院作物研究所邱丽娟博士为我们提供大豆种子(铁风8号)。gydF4y2Ba
资金gydF4y2Ba
本研究的设计和数据收集得到了农业部国家转基因重点项目(2018ZX0800909B)的支持。本研究的数据分析与解释由北京市食品营养与人体健康先进创新中心资助项目、北京工商大学北京市植物资源研究与开发重点实验室开放研究基金项目支持。本文由《抗枯萎病小麦种质资源及分子标记辅助育种》(1639630D)资助完成。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
位于细胞核的创客基因的登录号为At2g30250。GmMYB118基因的登录号为GLYMA_17G094400。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
ZSX统筹项目,构思设计实验,编辑稿件;YTD进行实验并撰写初稿;MJZ、CTW和YG开展了生物信息学工作并进行了相关实验;YXW、YWL、YBZ提供分析工具,对数据进行分析;MC和JC进行了有价值的讨论;YZM协调项目。所有作者均已阅读并批准最终稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们之间没有利益冲突。gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
额外的文件gydF4y2Ba
附加文件1:gydF4y2Ba
拟南芥种子消毒,采用次氯酸钠消毒WT和EX(独立转基因株系4、5和6)种子。在4°C下春化3天后,将含有种子的板转移到生长室。对于数据的统计方法,所示数据为三次实验的平均值±SDs (n = 80)。方差分析(ANOVA)检验显示有显著差异(gydF4y2Ba∗gydF4y2BaPgydF4y2Ba< 0.05,gydF4y2Ba∗gydF4y2Ba∗gydF4y2BaPgydF4y2Ba< 0.01)。的表达gydF4y2BaAtActingydF4y2Ba被分析为负载控制gydF4y2Ba拟南芥gydF4y2Ba(gydF4y2Ba表S1gydF4y2Ba).的表达gydF4y2BaGmActingydF4y2Ba作为对照分析大豆(gydF4y2Ba表S1。gydF4y2Ba)gydF4y2Ba图S1。gydF4y2Ba大豆myb相关TF家族成员基因的定量表达。来自soybase网站的14种不同组织类型的定量预测组织表达数据(gydF4y2Bahttp://soybase.org/soyseq/gydF4y2Ba).gydF4y2Ba图S2。gydF4y2BaGmMYB118的亚细胞定位及表达水平。GmMYB118定位于拟南芥叶肉原生质体的细胞核(A)。比例尺= 20 μm。gydF4y2BaGmMYB118gydF4y2Ba基因在异位表达和WT (Col-0)植物中的表达(B)。gydF4y2Ba图S3。gydF4y2BaPEG处理下OE品系的发芽率。0、3、6和9% PEG6000处理下EX和WT (Col-0)种子发芽72 h后的图像(A)。在1/2倍浓度的MS培养基上,分别添加0% (B)、3% (C)、6% (D)和9% PEG6000 (E),监测WT和EX种子的发芽至72 h。gydF4y2Ba图S4。gydF4y2BaNaCl处理下EX系的萌发率。0、75、100和125 mM NaCl处理(A)下EX和WT (Col-0)种子发芽72 h后的图像。在1/2倍强度的MS培养基上,分别添加0 (B)、75 (C)、100 (D)和125 mM NaCl (E),监测WT和EX植株的发芽情况,直至72 h。gydF4y2Ba图S5。gydF4y2Ba大豆毛状根的靶向诱变及GUS染色。转基因毛状根GUS染色显示转化效率约为50% (a)。目的基因用特异性引物扩增并测序(AuGCT, China)。结果表明,部分碱基已被取代(B)。gydF4y2Ba图S6。gydF4y2Ba表达水平gydF4y2BaGmMYB118gydF4y2Ba在干旱和盐处理下。表达水平gydF4y2BaGmMYB118gydF4y2Ba在干旱(B)和盐(C)处理下,采用qRT-PCR方法定量分析。表达水平gydF4y2BaGmMYB118gydF4y2Ba在正常情况下显示为gydF4y2Ba图S6A。gydF4y2Ba表S1。gydF4y2Ba用于qRT-PCR的基因特异性引物。gydF4y2Ba表S2gydF4y2Ba.用于构建重组载体的引物。(PDF 753 kb)gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文根据创作共用属性4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)除另有说明外,适用于本条所提供的资料。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
杜,欧美。,Zhao, MJ., Wang, CT.et al。gydF4y2Ba识别和表征gydF4y2BaGmMYB118gydF4y2Ba对干旱和盐胁迫的反应。gydF4y2BaBMC植物生物学gydF4y2Ba18,gydF4y2Ba320(2018)。https://doi.org/10.1186/s12870-018-1551-7gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-018-1551-7gydF4y2Ba
关键字gydF4y2Ba
- MYB转录因子gydF4y2Ba
- 全基因组分析gydF4y2Ba
- 耐旱gydF4y2Ba
- 盐耐受性gydF4y2Ba
- CRISPRgydF4y2Ba
- 大豆gydF4y2Ba