- 研究文章GydF4y2Ba
- 开放访问GydF4y2Ba
- 发布:GydF4y2Ba
基于比较rna测序的开花茂盛'秦冠'和弱开花' Nagafu no '花蕾转录组分析2’苹果品种揭示了花诱导调控机制的新见解GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba18.GydF4y2Ba文章编号:GydF4y2Ba370.GydF4y2Ba(GydF4y2Ba2018GydF4y2Ba)GydF4y2Ba
抽象的GydF4y2Ba
背景GydF4y2Ba
花诱导是苹果树生命周期中的一个重要阶段。从“富士”花蕾运动衍生而来的“长福2号”的花蕾形成存在严重的问题,如花蕾少且次、幼期长、杂交表现型等。此外,苹果成花诱导的分子调控机制尚不清楚。为了研究这些机制,我们比较了开花繁茂的‘青冠’和开花弱的‘长肥2号’苹果品种花诱导过程中芽的rna测序转录组谱。GydF4y2Ba
结果GydF4y2Ba
两个品种的芽之间差异表达的基因主要涉及碳水化合物,脂肪酸,和脂质途径。此外,the steady up-regulated expression of genes related to the fatty acid and lipid pathways and the down-regulated expression of starch synthesis-related genes in the carbon metabolic pathway of ‘Qinguan’ relative to ‘Nagafu No. 2’ were observed to contribute to the higher flowering rate of ‘Qinguan’. Additionally, global gene expression profiling revealed that genes related to cytokinin, indole-3-acetic acid, and gibberellin synthesis, signalling, and responses (i.e., factors contributing to cell division and differentiation and bud growth) were significantly differentially expressed between the two varieties. The up-regulated expression of genes involved in abscisic acid and salicylic acid biosynthesis via shikimate pathways as well as jasmonic acid production through fatty acid pathways in ‘Qinguan’ buds were also revealed to contribute to the floral induction and relatively high flowering rate of this variety. The differential expression of transcription factor genes (i.e.,SPLGydF4y2Ba那GydF4y2BaBzip.GydF4y2Ba那GydF4y2Ba德国GydF4y2Ba,GydF4y2BaMYBGydF4y2Ba还观察到涉及多种生物学过程的基因以在花卉诱导中起着关键作用。最后,重要的开花基因(即,GydF4y2BaFT.GydF4y2Ba那GydF4y2BaFD.GydF4y2Ba,GydF4y2BaAFLGydF4y2Ba)在诱导花过程中,在‘青冠’芽中表达量显著高于‘长肥2号’芽。GydF4y2Ba
结论GydF4y2Ba
一个复杂的调控机制的遗传网络涉及碳水化合物、脂肪酸、脂质和激素途径可能介导了苹果树开花的诱导。GydF4y2Ba
背景GydF4y2Ba
苹果GydF4y2BaMalus Domestica.GydF4y2BaBorkh.GydF4y2Ba.GydF4y2Ba)是全球经济上重要的果树品种[GydF4y2Ba1GydF4y2Ba].苹果品种的开花特性有很大的不同。例如,“长富号2”,表示在中国[总栽培苹果面积的65%的主导各种GydF4y2Ba2GydF4y2Ba那GydF4y2Ba3.GydF4y2Ba[表现出关于花卉诱导和形成的严重问题,例如长幼年相,交替轴质型和低花和水果生产。相比之下,中国精英品种的“Quinguan”具有强大的开花能力,产量高,抗病性强烈[GydF4y2Ba4.GydF4y2Ba].因此,在不同苹果品种中的花卉诱导和芽形成下面的生理和分子调节机制的综合表征对于解决开花问题非常重要。GydF4y2Ba
成花诱导是植物生命周期中一个重要的阶段,它由复杂的网络调控,涉及多种环境和内部信号,以确保开花的合适时机[GydF4y2Ba5.GydF4y2Ba].6个主要的开花途径与花的诱导调控过程有关,即春化、自主、光周期、赤霉素(GA)、热感觉和衰老途径[GydF4y2Ba6.GydF4y2Ba那GydF4y2Ba7.GydF4y2Ba].此外,研究表明,开花的关键基因(GydF4y2BaFT,SOC1,LEAF,声压级,GydF4y2Ba和GydF4y2BaAP1.GydF4y2Ba)参与多个开花途径在花卉诱导中起重要作用[GydF4y2Ba6.GydF4y2Ba那GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba9.GydF4y2Ba].GydF4y2Ba
碳水化合物(如蔗糖、葡萄糖和淀粉)在多个开花途径的成花诱导中具有重要的信号传递和能量作用[GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba10.GydF4y2Ba].海藻糖-6-磷酸(T6P)是一种主要存在于茎尖分生组织和叶片中的关键糖信号物质,对环境胁迫和碳水化合物水平表现出年龄依赖性的反应,以促进开花[GydF4y2Ba9.GydF4y2Ba].此外,糖信号可与光周期开花中转录因子(TF) AtIDD8调控相关的开花通路相联系[GydF4y2Ba11.GydF4y2Ba].其他研究表明,碳和脂类代谢物质[如:脂肪酸和磷脂酰胆碱(PC)]对植物的成花诱导也很重要[GydF4y2Ba12.GydF4y2Ba那GydF4y2Ba13.GydF4y2Ba].GydF4y2Ba
植物激素调节多个花卉诱导相关的途径,如Ga [GydF4y2Ba8.GydF4y2Ba,自主GydF4y2Ba14.GydF4y2Ba],以及光周期[GydF4y2Ba15.GydF4y2Ba]的途径,除了应激反应[GydF4y2Ba16.GydF4y2Ba].逆境相关激素脱落酸(ABA)主要通过光周期和糖信号途径调控开花[GydF4y2Ba17.GydF4y2Ba那GydF4y2Ba18.GydF4y2Ba].此外,先前的研究证明,外源性细胞蛋白(CTK)的应用可以在木质植物中促进开花[GydF4y2Ba19.GydF4y2Ba[CTK通过影响花卉相关基因的表达,直接调节开花(即,GydF4y2BaFT.GydF4y2Ba和GydF4y2BaSOC1GydF4y2Ba)[GydF4y2Ba6.GydF4y2Ba那GydF4y2Ba20.GydF4y2Ba].此外,GA分别在木质中分别具有积极和负面的监管角色[GydF4y2Ba21.GydF4y2Ba那GydF4y2Ba22.GydF4y2Ba]及一年生植物模型[GydF4y2Ba23.GydF4y2Ba].其他植物激素如水杨酸(SA)、茉莉酸(JA)等具有与开花相关的关键功能,并参与多个生物过程[GydF4y2Ba16.GydF4y2Ba那GydF4y2Ba24.GydF4y2Ba].GydF4y2Ba
虽然已经研究了暴露于各种环境压力的植物中的开花的调节,但长时间已经过了植物,而木质果树花卉诱导的分子调节机制仍然未知。在这项研究中,我们应用RNA测序(RNA-SEQ)在Illumina平台上,比较在生长和花卉诱导期间,在弱弦勃勃的“Quingan”和弱开花的“Nagafu No.2”苹果品种之间的基因表达模式。我们观察到,一种复杂的碳,脂肪酸,脂质和激素相关信号传导调节机制的复杂遗传网络介导苹果树花卉诱导。在定量的实时聚合酶链反应(QRT-PCR)测定中,我们还分析了苹果品种的芽中的糖,激素和开花相关的基因表达模式。我们的研究结果对于进一步表征苹果树中花卉诱导的分子调节机制。GydF4y2Ba
结果GydF4y2Ba
‘青冠’和‘长肥2号’苹果品种上芽生长、开花率、破芽率及分枝类型的动态变化GydF4y2Ba
长肥2号的茎长在开花期后0 ~ 28 d逐渐增加,在开花期后14 d达到峰值,在开花期后28 ~ 42 d无进一步变化GydF4y2Ba1GydF4y2Ba:图S1)。‘青冠’树的茎长增加高峰出现在7 DAFB,且在14 ~ 42 DAFB的茎长显著低于‘长肥2号’GydF4y2Ba1GydF4y2Ba:图S1)。在3年的研究期间(2013-2015年),‘青关’的骨刺比例显著高于‘长肥2号’,而‘长肥2号’的骨刺比例显著高于‘青关’GydF4y2Ba1GydF4y2Ba:图S2)。虽然在2013年和2014年的两个品种之间观察到在中间枝的比例没有显著差异,该值在2015年在“秦冠”比'长富2号的更高(附加文件GydF4y2Ba1GydF4y2Ba:图S2)。GydF4y2Ba
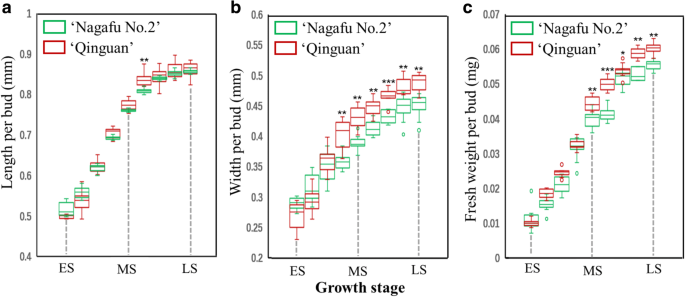
从早期阶段(2013年5月5日)到阶段(2013年5月5日)的“Qugaa”和“Nagafu No.2”之间没有显着差异。(LS; 2013年6月25日)的花芽生理分化(图。GydF4y2Ba1GydF4y2Baa),而在花诱导后期(大致为中期(MS;2013年6月1日至LS](图。GydF4y2Ba1GydF4y2Bab)。此外,在“Quinguan”中,来自LS的MS到LS的芽鲜重比在“Nagafu No. 2”中显着更高(图。GydF4y2Ba1GydF4y2BaC)。GydF4y2Ba
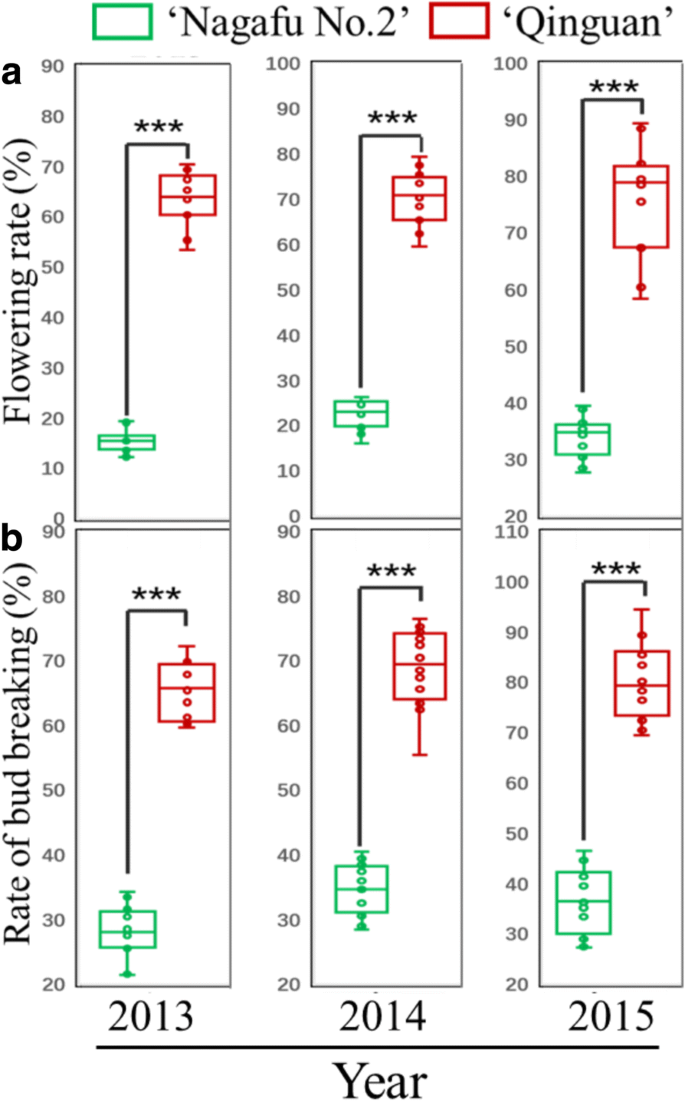
在2013年3月、2014年3月和2015年3月,‘青冠’的破芽率显著高于‘长肥2号’(图2)。GydF4y2Ba2GydF4y2Ba).统计分析表明,2013 - 2015年,‘青冠’的开花率也显著高于‘长肥2号’(图2)。GydF4y2Ba2GydF4y2Ba).GydF4y2Ba
‘青冠’和‘长肥2号’苹果品种花诱导过程中芽内糖和激素水平的动态变化GydF4y2Ba
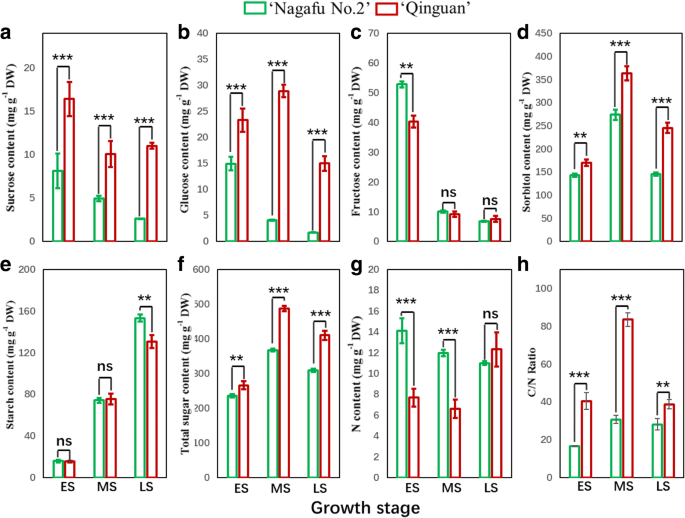
在花卉诱导期间的蔗糖,葡萄糖,山梨糖醇和芽的总糖含量在“Quinguan”中比在“Nagafu No. 2”中显着更高(图。GydF4y2Ba3.GydF4y2Ba而长肥2号在ES期间的芽体果糖含量和LS期间的淀粉含量较高(图2)。GydF4y2Ba3.GydF4y2Ba).此外,花诱导ES和MS中芽的N含量显著低于长肥2号(图2)。GydF4y2Ba3.GydF4y2Ba).从ES到LS,‘青冠’芽的碳氮比显著高于‘长肥2号’芽(图2)。GydF4y2Ba3.GydF4y2Ba).GydF4y2Ba
苹果‘青冠’和‘长肥2号’花芽生理分化阶段的氮、糖含量和碳氮比GydF4y2Ba一种GydF4y2Ba蔗糖。GydF4y2BaB.GydF4y2Ba葡萄糖。GydF4y2BaCGydF4y2Ba果糖。GydF4y2BaD.GydF4y2Ba山梨糖醇。GydF4y2BaE.GydF4y2Ba淀粉。GydF4y2BaFGydF4y2Ba总糖。GydF4y2BaGGydF4y2Ba氮。GydF4y2BaHGydF4y2BaC / N。N%:含氮百分比;C/N:碳氮比。ES、MS和LS分别对应花芽分化的早期、中期和晚期。数据以平均值±标准误差表示,GydF4y2BaNGydF4y2Ba= 3. *P.GydF4y2Ba<0.05;**GydF4y2BaP.GydF4y2Ba< 0.01; ***P.GydF4y2Ba<0.001;ns,非重要(GydF4y2BaP.GydF4y2Ba> 0.05)GydF4y2Ba
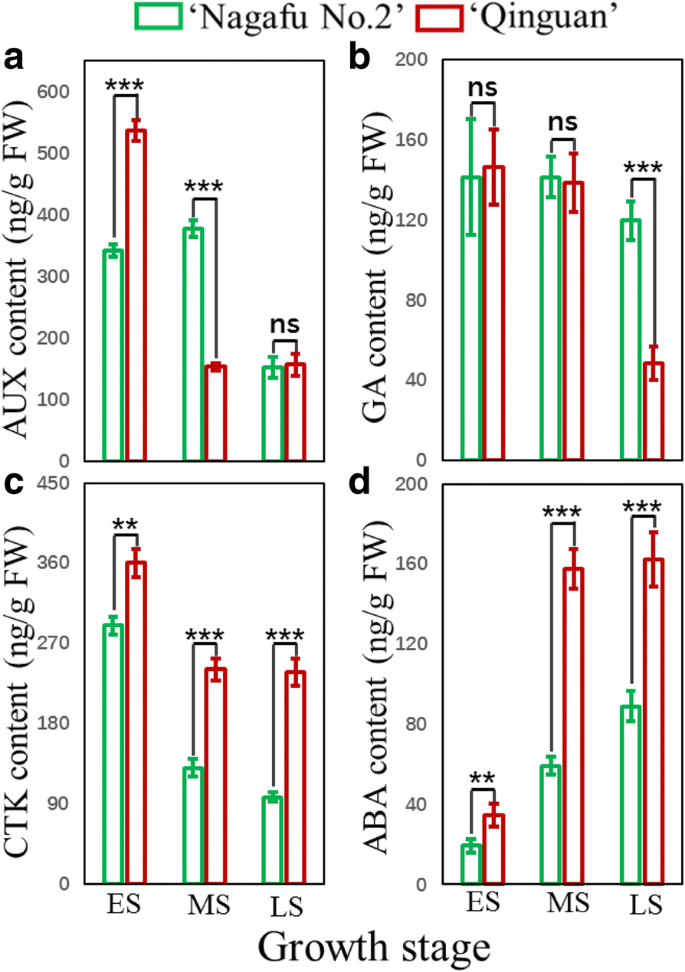
ES期间,‘青冠’的芽生长素含量显著高于‘长肥2号’,而MS期间则相反。GydF4y2Ba4.GydF4y2Baa).只有LS期间,‘青冠’的芽体赤霉素含量显著低于‘长肥2号’(图2)。GydF4y2Ba4.GydF4y2Bab).此外,在整个芽生理分化期(ES - LS),‘青管’芽的ABA和CTK含量均显著高于‘长肥2号’芽(图2)。GydF4y2Ba4.GydF4y2Bac和d)。GydF4y2Ba
‘青冠’和‘长肥2号’苹果品种花芽生理分化阶段芽内激素含量GydF4y2Ba一种GydF4y2Ba生长素(AUX)。GydF4y2BaB.GydF4y2Ba细胞分裂素(CTK)。GydF4y2BaCGydF4y2Ba赤霉素(GA)。GydF4y2BaD.GydF4y2Ba脱落酸(ABA)。ES、MS和LS分别对应花芽分化的早期、中期和晚期。数据以平均值±标准误差表示,GydF4y2BaNGydF4y2Ba= 3. *P.GydF4y2Ba<0.05;**GydF4y2BaP.GydF4y2Ba< 0.01; ***P.GydF4y2Ba<0.001;ns,非重要(GydF4y2BaP.GydF4y2Ba> 0.05)GydF4y2Ba
苹果品种‘青冠’和‘长肥2号’花诱导期芽转录组序列分析GydF4y2Ba
构建了6个独立的芽RNA-seq文库,并对‘Qinguan’和‘Nagafu No. 2’在不同芽生长阶段(ES、MS和LS)进行了测序。每个样本的详细测序数据在附加文件中给出GydF4y2Ba1GydF4y2Ba:表S1和S2。附加文件中提供了染色体上的样品读取密度的分布GydF4y2Ba1GydF4y2Ba:图S3。在花诱导过程中,‘青冠’芽相对于‘长肥2号’芽的1151 (QE_FE)、1114 (QM_FM)和1440 (QL_FL)差异表达基因(DEGs)表达水平上调(附加文件)GydF4y2Ba1GydF4y2Ba:图S4),而1043(QE_FE),1025(QM_FM),和1285(QL_FL)DEGS个下调(附加文件GydF4y2Ba1GydF4y2Ba:图S4)。GydF4y2Ba
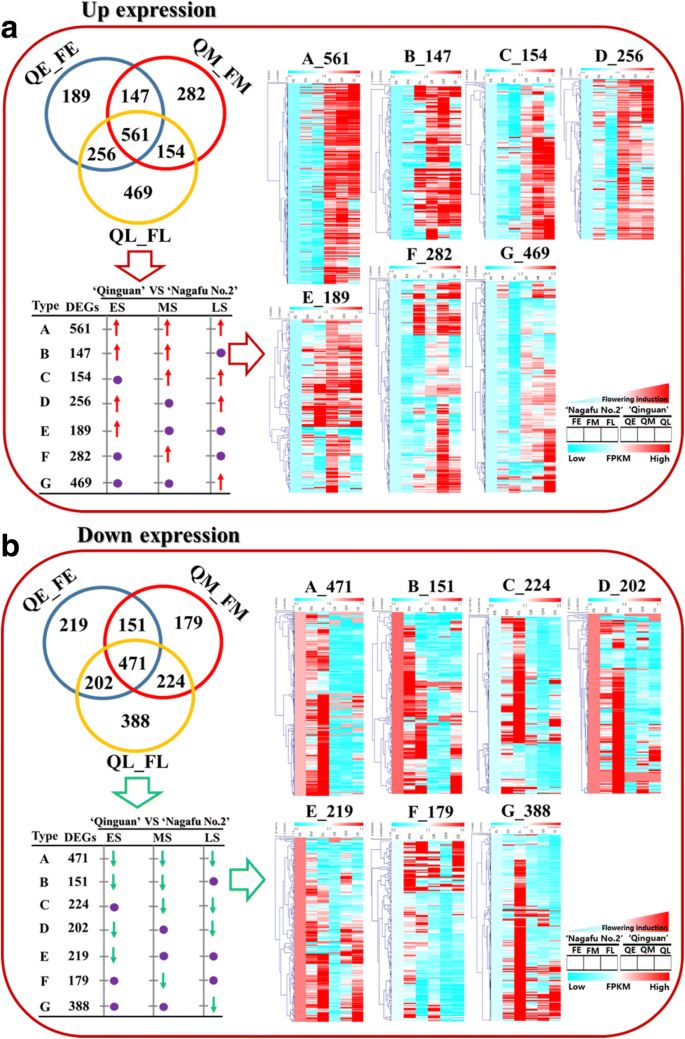
Venn diagram and cluster analyses allowed us to categorize the up- and down-regulated DEGs of ‘Qinguan’ and ‘Nagafu No. 2’ buds into the following seven expression pattern groups: a-type, b-type, c-type, d-type, e-type, f-type, and g-type (Fig.5.GydF4y2Ba一种)。另外,在相对于'nagafu No.2'中在“Quinguan”中上调的561次展示了一种型图案(即,ES,MS和LS的花卉诱导期间的表达水平显着更高)(图。GydF4y2Ba5.GydF4y2Baa).在ES和MS (b型)、MS和LS (c型)以及ES和LS (d型)中,‘清关’中分别有147、154和256个高表达的deg(图)。GydF4y2Ba5.GydF4y2Baa).此外,e型、f型和g型组分别检测到189、282和469个DEGs,相应的在ES、MS和LS中表达水平显著升高(图)。GydF4y2Ba5.GydF4y2Ba一种)。GydF4y2Ba
苹果‘青冠’和‘长肥2号’花诱导过程中芽转录组的整体分析GydF4y2Ba一种GydF4y2Ba在花诱导过程中,‘青冠’芽与‘长肥2号’芽的差异表达基因(DEGs)上调。GydF4y2BaB.GydF4y2Ba与在花卉诱导期间的“纳迦第2号”芽相比,在“Quinguan”芽中下调。Venn diagrams and the results of a cluster analysis of seven expression pattern types (a-, b-, c-, d-, e-, f-, and g-type) of up- and down-regulated DEGs between ‘Qinguan’ and ‘Nagafu No. 2’ are shown. QE_FE, QM_FM, and QL_FL correspond to the early, middle, and late stages of flower bud differentiation, respectively. The FPKM values were used for the cluster analysis
在‘青冠’相对于‘长肥2号’下调的DEGs中,471是a型基因,在花诱导的ES、MS和LS中表达量显著降低(图2)。GydF4y2Ba5.GydF4y2Ba而在ES和MS、MS和LS以及ES和LS期间,分别有151、224和202个属于b型、c型和d型组的DEGs表达水平显著降低(图2)。GydF4y2Ba5.GydF4y2Bab)。最后,219,179和388℃表现出E型,F型和G型表达模式,分别在ES,MS和LS期间具有显着性的表达水平(图。GydF4y2Ba5.GydF4y2Bab)。GydF4y2Ba
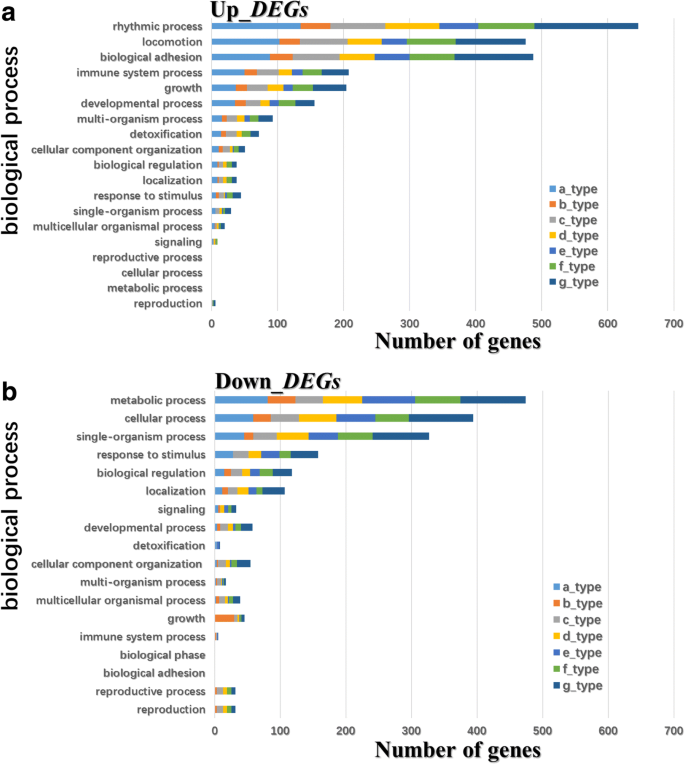
为了鉴定生物过程,细胞组分,和花的诱导过程中苹果芽富集分子功能,我们进行了基因本体(GO)在上述上和下调节DEGS的功能分析(图GydF4y2Ba6.GydF4y2Ba,附加文件GydF4y2Ba1GydF4y2Ba:图S5和S6)。相对于“长肥2号”上调的DEGs,节奏过程、运动过程、生物粘附过程和免疫系统过程是4个高度富集的生物过程类别(图2)。GydF4y2Ba6.GydF4y2Ba),而代谢,细胞,单生体过程,以及对刺激的反应是与“QuaGaFu”2'相比,在“Quingan”中下调的四个最重视的生物过程类别(图。GydF4y2Ba6.GydF4y2Ba).此外,《京都基因和基因组百科全书》(KEGG)对上调和下调基因的分析,包括“秦官”芽相对于“长肥2号”芽的7种表达模式类型(a-、b-、c-、d-、e-、f-和g型)的详细信息,详见附加文件GydF4y2Ba2GydF4y2Ba.GydF4y2Ba
在花卉诱导过程中涉及生物过程的“Quingan”和“纳卡非洲第2号”之间的差异表达基因(DEGS)的数量。GydF4y2Ba一种GydF4y2Ba在“Quinguan”芽相对于'Nagafu No. 2'芽中的调控下降。GydF4y2BaB.GydF4y2BaDEGS下调“秦冠”芽相对于'长富2号的芽。该七种DEG表达模式(A,B,C,D-,E-,F-,和G型)是相同的那些在图1的聚类分析。GydF4y2Ba7.GydF4y2Ba
为了验证RNA-seq结果,我们利用qRT-PCR检测了‘青冠’和‘长肥2号’芽在不同发育阶段(ES、MS和LS)芽中碳水化合物、激素和开花相关基因的表达水平。GydF4y2Ba7.GydF4y2Ba那GydF4y2Ba10.GydF4y2Ba,GydF4y2Ba12.GydF4y2Ba).的线性关系(GydF4y2BaR.GydF4y2Ba2GydF4y2Ba= 0.7962,GydF4y2BaP.GydF4y2BaQRT-PCR结果与芽中相关基因的RNA-SEQ数据之间的<0.01)显示在附加文件中GydF4y2Ba1GydF4y2Ba:图S10。GydF4y2Ba
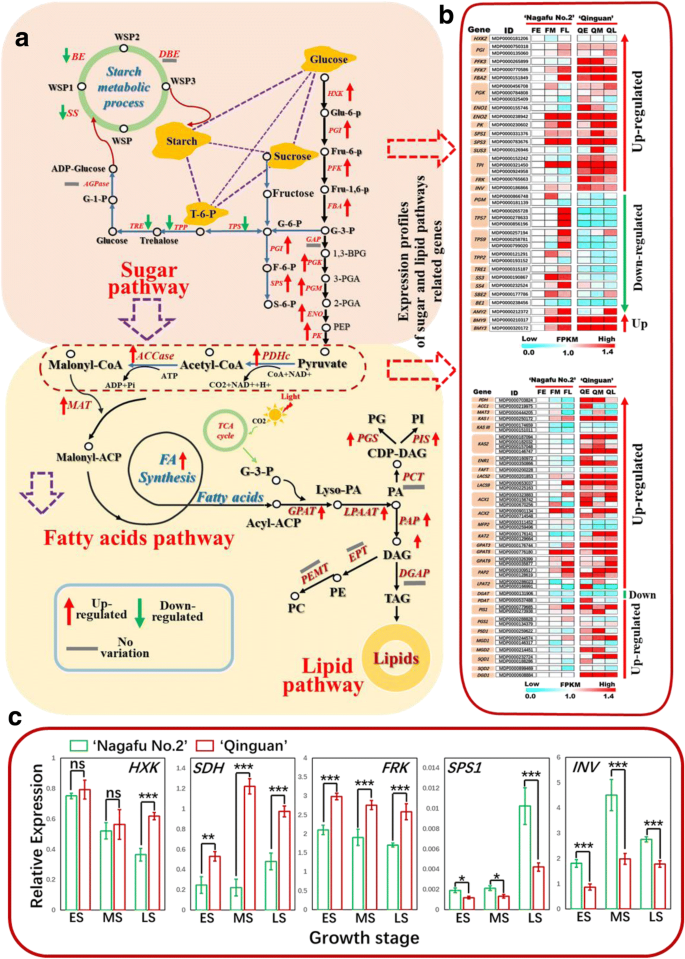
“秦冠”和“长肥2号”芽中围绕特定代谢途径(碳水化合物、脂肪酸和脂类)的基因表达差异。GydF4y2Ba一种GydF4y2Ba从转录组证据重建的两个苹果品种碳水化合物、脂肪酸和脂类代谢及其调控模型。表达式趋势用箭头表示。GydF4y2BaB.GydF4y2Ba碳水化合物,脂肪酸和脂质途径参与的差异表达基因(DEGS)的表达谱测序和(GydF4y2BaCGydF4y2Ba)实时荧光定量PCR。(A)中的缩写为G-1-P, glucose-1-phosphate;TP, triosephosphate;G-6-P glucose-6-phosphate;S-6-P sorbitol-6-phosphate;F-6-P fructose-6-phosphate;S-6-P sucrose-6-phosphate;UDPG UDP-glucose;ADPG ADP-glucose;的PGM phosphoglucomutase; SUS, sucrose synthase; HXK, hexokinase; PGI, phosphoglucose isomerase; FRK, fructokinase; UGP, UDP-glucose pyrophosphorylase; AGP, ADP-glucose pyrophosphorylase; SPS, sucrose phosphate synthase; SPP, sucrose phosphate phosphatase; AMY, α-amylase; BAM, β-amylase; A/N-INV, alkaline/neutral invertase; TPS, trehalose-6-phosphate synthase; T6P, trehalose-6-phosphate; SBE, starch branching enzymes; SS, starch synthase; TPP, trehalose-6-phosphatase; TRE, trehalase; SP, starch phosphorylase; DAG, diacylglycerol; DHAP, dihydroxyacetone phosphate; Gly3P, glyceraldehyde-3-phosphate; G3P, glycerol-3-phosphate; GL, galactoglycerolipids; Lyso-PA, lyso-phosphatidic acid; Lyso-PL, lyso-phospholipids; PA, phosphatidic acid; PE, phosphatidyl-ethanolamine; PG, phosphatidylglycerol; PI, phosphatidylinositol; PL, phospholipids; TAG, triacylglycerol. Chloroplast and endoplasmic reticulum glycerolipid pathways are indicated by the transfer of fatty acids from acyl-ACP and acyl-CoA, respectively. Key metabolism genes are indicated by red italics: DGAT, DAG acyltransferase; GK, glycerol kinase; GPAT, G3P acyltransferase; GPD, G3P dehydrogenase; GPP, G3P phosphatase; LPAAT, lyso-PA acyltransferase; PAP, PA phosphatase; PDAT, phospholipid:DAG acyltransferase. In (B), the early, middle, and late stages of flower bud differentiation are respectively denoted as FE, FM, and FL (‘Nagafu No. 2’) and QE, QM, and QL (‘Qinguan’). Data are presented as the mean ± standard error,NGydF4y2Ba= 3. *P.GydF4y2Ba<0.05;**GydF4y2BaP.GydF4y2Ba< 0.01; ***P.GydF4y2Ba<0.001;ns,非重要(GydF4y2BaP.GydF4y2Ba> 0.05)GydF4y2Ba
“秦冠”和“长肥2号”芽特异代谢途径中碳水化合物、脂肪酸和脂质途径的优势表达GydF4y2Ba
“青冠”和“长肥2号”芽在花诱导过程中差异表达的基因的功能主要集中在碳水化合物和脂类复杂代谢网络上。GydF4y2Ba7.GydF4y2Ba和附加文件GydF4y2Ba2GydF4y2Ba).例如,GydF4y2BaHXK2.GydF4y2Ba那GydF4y2BaPGIGydF4y2Ba(2),GydF4y2BaPFK3GydF4y2Ba那GydF4y2BaPFK7.GydF4y2Ba,GydF4y2BaFBA2GydF4y2Ba将葡萄糖转化为甘油-3-磷酸盐(G-3-P)的基因在碳水化合物代谢中,“Quinguan”的成绩累积明显高于“Nagafu No. 2”芽(图。GydF4y2Ba7.GydF4y2Ba).三个蔗糖合成相关基因的表达水平,GydF4y2BaSPS1GydF4y2Ba和GydF4y2BaSPS3.GydF4y2Ba在es和es的基因GydF4y2BaSUS3GydF4y2Ba在MS中,‘青冠’芽显著高于‘长肥2号’芽(图2)。GydF4y2Ba7.GydF4y2Ba).这GydF4y2BafrGydF4y2Ba基因是果糖-6-磷酸生物合成的重要基因,在‘青冠’芽中的表达量显著高于‘长肥2号’芽(图。GydF4y2Ba7.GydF4y2Ba).三GydF4y2BaTPIGydF4y2Ba“Quinguan”的基因表达水平明显高于来自es到LS的“Nagafu No.2”(图。GydF4y2Ba3.GydF4y2Ba).六大重点GydF4y2BaTPSGydF4y2Ba基因(三GydF4y2BaTPS7.GydF4y2Ba基因和三个GydF4y2BaTPS9.GydF4y2Ba基因涉及T6P合成,两个关键GydF4y2BaTPP2GydF4y2Ba参与海藻糖合成的基因GydF4y2BaTRE1GydF4y2Ba‘青冠’芽的表达量显著低于‘长肥2号’芽(图2)。GydF4y2Ba7.GydF4y2Ba).与淀粉生物合成有关的基因,包括GydF4y2BaSS3GydF4y2Ba那GydF4y2BaSS4GydF4y2Ba那GydF4y2BaSBE2GydF4y2Ba,GydF4y2BaBE1GydF4y2Ba与‘长肥2号’芽相比,‘青冠’芽的表达量显著降低(图2)。GydF4y2Ba7.GydF4y2Ba),具有三种淀粉降解基因(GydF4y2BaAMY2GydF4y2Ba那GydF4y2BaBMYBGydF4y2Ba,GydF4y2BaBMY3GydF4y2Ba)显示出相反的模式(图。GydF4y2Ba7.GydF4y2Ba).GydF4y2Ba
这GydF4y2BaPKGydF4y2Ba那GydF4y2Ba三、GydF4y2Ba,GydF4y2BaENO2GydF4y2Ba丙酮酸是卡尔文循环中乙酰辅酶a的前体,它具有连接碳水化合物、氮和脂质途径的关键功能。这些基因在‘青冠’芽中的表达显著高于‘长肥2号’芽(图2)。GydF4y2Ba7.GydF4y2Ba).GydF4y2Ba
与丙二酰辅酶a生物合成相关的两个关键基因(GydF4y2BaPDHGydF4y2Ba和GydF4y2BaACC1GydF4y2Ba)和GydF4y2BaMAT3GydF4y2Ba与丙二酰- acp生物合成相关的基因在‘青冠’芽中的表达显著高于‘长肥2号’芽(图2)。GydF4y2Ba7.GydF4y2Ba).与此同时,GydF4y2Bakas1.GydF4y2Ba那GydF4y2BaKASIIIGydF4y2Ba(2),GydF4y2Bakas2.GydF4y2Ba(4)GydF4y2BaENR1GydF4y2Ba(2),其参与脂肪酸生物合成,是在显著“秦冠”芽比“长富2号的芽(图3中更高度表达。GydF4y2Ba7.GydF4y2Ba).同样是真正的GydF4y2BaLACS2GydF4y2Ba那GydF4y2BaLACS9GydF4y2Ba(2),GydF4y2BaACX1GydF4y2Ba(3),GydF4y2BaACX2GydF4y2Ba(2和GydF4y2Bakat2.GydF4y2Ba(2),它们参与脂肪酸形成酰辅酶a池,脂肪酸是合成油的重要物质(图2)。GydF4y2Ba7.GydF4y2Ba).TAG的组装路径基因转录水平,包括GydF4y2BaGPAT3GydF4y2Ba那GydF4y2BaGPAT5GydF4y2Ba那GydF4y2BaGPAT9GydF4y2Ba(2),GydF4y2BaLPAT2GydF4y2Ba(2),GydF4y2BaPAP2GydF4y2Ba(2和GydF4y2BaPDATGydF4y2Ba,在“Quinguan”中比在“Nagafu No. 2”中更高(图。GydF4y2Ba7.GydF4y2Ba),则观察到与之相反的趋势GydF4y2BaDGATGydF4y2Ba基因(图。GydF4y2Ba7.GydF4y2Ba).GydF4y2Ba
与脂质代谢途径有关的以下三种基因在“Quinguan”芽中的表达水平明显高于'Nagafu No. 2'芽:GydF4y2BaPIS1GydF4y2Ba(2)与磷脂酰肌醇(PI)的形成有关GydF4y2BaPSD1GydF4y2Ba与磷脂酰甘油(PG)的形成有关(图。GydF4y2Ba7.GydF4y2Ba).这GydF4y2BaMGD1GydF4y2Ba和GydF4y2BaMGD2GydF4y2Ba参与MGDG形成的基因和A.GydF4y2BaDGD1GydF4y2Ba参与DGDG合成的基因在‘青冠’芽中表达量高于‘长肥2号’芽(图2)。GydF4y2Ba7.GydF4y2Ba).此外,三个基因,GydF4y2BaSQD1GydF4y2Ba(2和GydF4y2BaSQD2GydF4y2Ba,分别参与二酰基甘油(DAG)降解后SQDG和ASQD的形成,在‘青冠’中显著高于‘长肥2号’(图。GydF4y2Ba7.GydF4y2Ba).GydF4y2Ba
秦冠芽与长肥2号芽诱导过程中激素代谢和信号通路的差异表达GydF4y2Ba
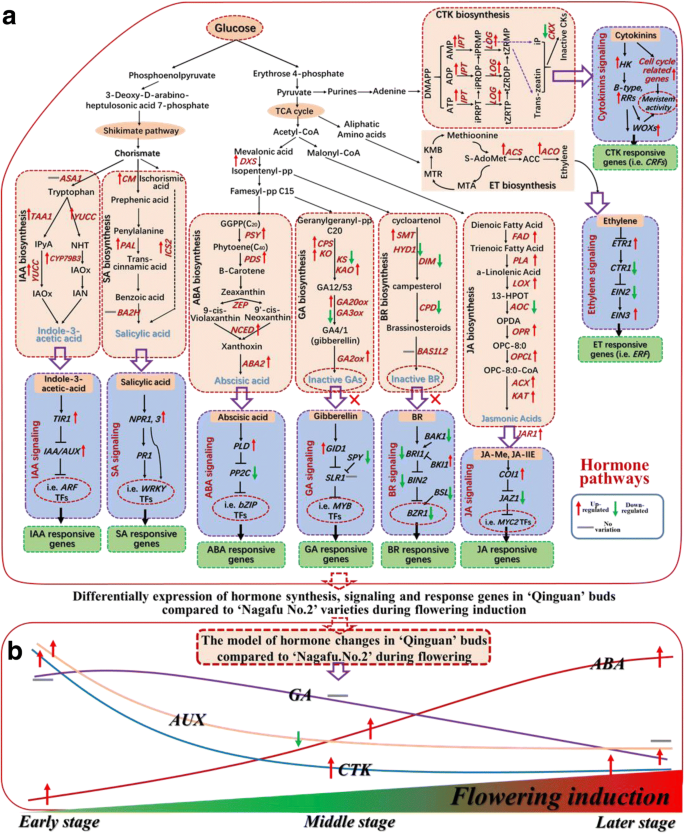
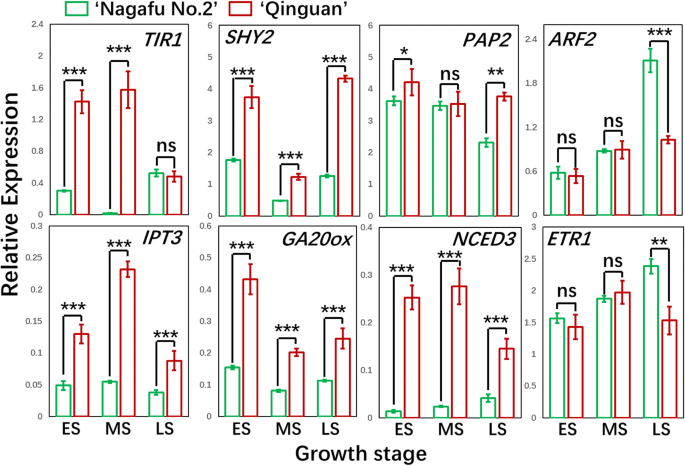
我们对‘Qinguan’和‘Nagafu No. 2’芽的DEG表达谱进行了比较转录组和聚类分析,揭示了与多种激素合成、动力学和信号通路相关的复杂调控网络的存在(Figs。GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba10.GydF4y2Ba和附加文件GydF4y2Ba2GydF4y2Ba).莽草酸途径下游的基因,即吲哚-3-乙酸(IAA)生物合成基因,如GydF4y2BaYUCCGydF4y2Ba(4)和GydF4y2BaTAA1GydF4y2Ba(2)ES期间和GydF4y2BaCYP79B3GydF4y2Ba在LS和SA生物合成基因,包括GydF4y2BaPAL1GydF4y2Ba(3)和GydF4y2BaICS2GydF4y2Ba在es和GydF4y2BaCM1GydF4y2Ba在ES和LS期间,‘青冠’芽的表达量显著高于‘长肥2号’芽。GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba10.GydF4y2Ba).的表达水平GydF4y2BaTIR1GydF4y2Ba(2)在ES和MS以及AUX/IAA转录调节家族基因中[即,GydF4y2BaIAA4GydF4y2Ba(2)GydF4y2Ba, 8, 11, 12, 14, 19, 21GydF4y2Ba那GydF4y2BaSHY2GydF4y2Ba(2),GydF4y2BaPAP1,GydF4y2Ba和GydF4y2BaPAP2GydF4y2Ba(GydF4y2Ba2GydF4y2Ba与IAA信号通路相关的‘青冠’基因也相对于‘Nagafu No. 2’显著上调。GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba10.GydF4y2Ba).GydF4y2Ba小型助线GydF4y2Ba(GydF4y2Ba畜群GydF4y2Ba)构成最大的早期营养素响应基因的家庭,在“Quinguan”和“Nagafu No. 2”芽之间差异化。特别是12GydF4y2Ba畜群GydF4y2Ba(例如,GydF4y2BaM286931,M186167,M285050GydF4y2Ba,GydF4y2BaM668689GydF4y2Ba)的表达高于“长府2号”(补充文件)GydF4y2Ba1GydF4y2Ba:图S7)。另外,基因的表达水平如GydF4y2BaTGA4GydF4y2Ba和GydF4y2BaTGA6GydF4y2Ba与长肥2号芽相比,‘青冠’芽中SA信号通路和响应显著上调。GydF4y2Ba8.GydF4y2Ba和GydF4y2Ba9.GydF4y2Ba).GydF4y2Ba
与图中模型相关的激素合成、信号传递和反应相关基因的聚类分析结果。GydF4y2Ba11.GydF4y2Ba.早期,中间和晚期的花芽分化分别表示为FE,FM和QE,QM,QM,QM和QL中的FF,FM和FLGydF4y2Ba
之间的基因发挥作用的三羧酸的下游(TCA)循环通路,ABA生物合成基因[即,GydF4y2BaDXS PSYGydF4y2Ba(2),GydF4y2Banced.GydF4y2Ba(4)GydF4y2BaABA2GydF4y2Ba从ES到LS]和JA生物合成基因GydF4y2Ba时尚GydF4y2Ba(7) ES和MS期间;GydF4y2Ba中国人民解放军GydF4y2Ba(3),GydF4y2BaLOX1GydF4y2Ba(2),GydF4y2BaOPCL1,KAT2GydF4y2Ba(2和GydF4y2BaACX1GydF4y2Ba(3)从ES到LS;和GydF4y2BaOPR2GydF4y2Ba(3)在MS和LS期间)]的显著更高度在“秦冠”芽中表达比在'长富2号的芽(图GydF4y2Ba8.GydF4y2Ba和GydF4y2Ba9.GydF4y2Ba).表达水平的两个GydF4y2BaPLD1GydF4y2BaABA信号转导相关基因(GydF4y2BaM274843GydF4y2Ba和GydF4y2BaM280145GydF4y2Ba)中显著在“秦冠”芽相对于'长富2号的芽(图的ES中上调。GydF4y2Ba8.GydF4y2Ba和GydF4y2Ba9.GydF4y2Ba).观察到相反的模式GydF4y2BaPP2CGydF4y2Ba(5) MS和LS期间(图5)。GydF4y2Ba8.GydF4y2Ba和GydF4y2Ba9.GydF4y2Ba).此外,GydF4y2BaJAR1GydF4y2Ba和GydF4y2BaCOI1.GydF4y2Ba(2)参与JA信号转导的基因在ES至LS的‘青冠’芽中表达量显著高于‘长肥2号’芽(图2)。GydF4y2Ba8.GydF4y2Ba和GydF4y2Ba9.GydF4y2Ba),观察到相反的模式GydF4y2BaJAZ1GydF4y2Ba(2)在ES和MS期间(图。GydF4y2Ba8.GydF4y2Ba和GydF4y2Ba9.GydF4y2Ba).GydF4y2Ba
间在GA生物合成途径的基因,下面分别显著更高度在“秦冠”芽中表达比在'长富2号的芽:GydF4y2BaCPS1GydF4y2Ba(2)在MS和LS时,GydF4y2BaKAO1GydF4y2Ba(2和GydF4y2BaKO1GydF4y2Ba(2)从es到ls,GydF4y2BaKAO2GydF4y2Ba在es,和GydF4y2BaGA20oxGydF4y2Ba(4) ES和MS期间(图4)。GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba10.GydF4y2Ba).相比之下,GydF4y2BaGA3oxGydF4y2Ba在LS期间,长肥2号的表达量高于秦观。GydF4y2Ba8.GydF4y2Ba).与此同时,五GydF4y2BaGa2ox.GydF4y2Ba基因(GydF4y2BaM145827GydF4y2Ba那GydF4y2BaM247490、M226405 M269990,GydF4y2Ba和GydF4y2BaM132878GydF4y2Ba)GydF4y2Ba那GydF4y2Ba这对非活性GAs的合成非常重要,在‘Qinguan’中比在‘Nagafu No. 2’中表达更高。GydF4y2Ba8.GydF4y2Ba和GydF4y2Ba9.GydF4y2Ba).此外,与GA信号转导和反应途径相关的基因GydF4y2Ba稻草人样子GydF4y2Ba家族的基因(例如,GydF4y2BaM943929, M227056GydF4y2Ba,GydF4y2BaM264347GydF4y2Ba),从ES到LS和两个GydF4y2Ba间谍GydF4y2Ba基因(GydF4y2BaM208893GydF4y2Ba和GydF4y2BaM212192GydF4y2Ba)MS和LS时,表现出相反的趋势(图GydF4y2Ba8.GydF4y2Ba和GydF4y2Ba9.GydF4y2Ba).关于油菜素内酯(BR)特异性生物合成途径,GydF4y2BaSMT2GydF4y2Ba那GydF4y2Ba暗淡GydF4y2Ba,GydF4y2BaCPDGydF4y2Ba在ES和MS和MS和GydF4y2BaHYD1.GydF4y2Ba从ES到LS,‘青冠’芽的表达量显著低于‘长肥2号’芽。GydF4y2Ba8.GydF4y2Ba和GydF4y2Ba9.GydF4y2Ba).几个重要的BR信号转导基因的表达水平,包括GydF4y2BaBRI1GydF4y2Ba在LS,GydF4y2BaBak1.GydF4y2Ba从ES到LS,还有GydF4y2BaBZR1GydF4y2Ba(2和GydF4y2Ba声波测井GydF4y2Ba(4)在MS和LS时期,‘青冠’芽的表达显著低于‘长肥2号’芽。GydF4y2Ba8.GydF4y2Ba和GydF4y2Ba9.GydF4y2Ba),而观察到相反的模式GydF4y2BaBKI1GydF4y2Ba从ES到LS(图。GydF4y2Ba8.GydF4y2Ba和GydF4y2Ba9.GydF4y2Ba).GydF4y2Ba
乙烯生物合成途径相关基因的表达水平,包括GydF4y2BaSAM1GydF4y2Ba(2) ES和LS期间,GydF4y2BaSAM2GydF4y2Ba(2),GydF4y2BaACS10GydF4y2Ba(2和GydF4y2BaACO4.GydF4y2Ba(3)从ES向LS、ET信号转导基因,包括GydF4y2BaETR1GydF4y2Ba中,ES和MS,并且在GydF4y2BaEIN3.GydF4y2Ba(2),相对于'Nagafu No. 2'芽的“Quinguan”芽中有显着上调(图。GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba10.GydF4y2Ba).相比之下,GydF4y2BaCTR1GydF4y2Ba表达水平表现出相反的趋势(图GydF4y2Ba8.GydF4y2Ba和GydF4y2Ba9.GydF4y2Ba).相似地,GydF4y2BaIPTGydF4y2Ba(GydF4y2BaM286203GydF4y2Ba那GydF4y2BaM190470GydF4y2Ba那GydF4y2BaM013380GydF4y2Ba,GydF4y2BaM232324GydF4y2Ba),GydF4y2BaLOG1GydF4y2Ba(GydF4y2BaM232585GydF4y2Ba和GydF4y2BaM289041GydF4y2Ba从ES到LS,与CTK生物合成相关的基因在‘青冠’芽中的表达量显著高于‘长肥2号’芽(fig .;GydF4y2Ba8.GydF4y2Ba和GydF4y2Ba9.GydF4y2Ba),而非活性的CTK生物合成基因则相反GydF4y2BaCKX5.GydF4y2Ba(无花果。GydF4y2Ba8.GydF4y2Ba和GydF4y2Ba9.GydF4y2Ba).参与CTK信号转导的基因GydF4y2BaHK1.GydF4y2Ba和GydF4y2BaHK4.GydF4y2Ba在ES和MS和MS和GydF4y2BaCKI1.GydF4y2Ba在ES和LS期间,‘青冠’芽的表达量显著高于‘长肥2号’芽。GydF4y2Ba8.GydF4y2Ba和GydF4y2Ba9.GydF4y2Ba).对于CTK响应基因,观察到类似的结果,例如GydF4y2BaCRFGydF4y2Ba(4)和GydF4y2BaWOXGydF4y2Ba(3)从ES到LS(图3)GydF4y2Ba8.GydF4y2Ba和GydF4y2Ba9.GydF4y2Ba).此外,大约有四组deg与细胞分裂、细胞分化和细胞周期(即细胞周期)有关。GydF4y2BaCYCGydF4y2Ba和GydF4y2BaCDKGydF4y2Ba基因)GydF4y2Ba1GydF4y2Ba:图S8)。与长肥2号芽相比,秦冠芽中以下两组基因的表达水平显著上调:GydF4y2BaCYCD6:1 CYCA3; 1, CYCD3:1GydF4y2Ba,GydF4y2BaCYCD3:2GydF4y2Ba),由ES到LS和c-簇组成,共20个基因(例如,GydF4y2BaCDKB1:2GydF4y2Ba那GydF4y2BaCDKB2:2GydF4y2Ba那GydF4y2BaCDKB2:4GydF4y2Ba那GydF4y2BaCYCD1:1GydF4y2Ba,GydF4y2BaCYCD2:1GydF4y2Ba)ES和LS时(附加文件GydF4y2Ba1GydF4y2Ba:图S8)。相比之下,b-cluster中的基因表达水平(例如,GydF4y2BaCYCH:1GydF4y2Ba那GydF4y2BaCYCD1:3GydF4y2Ba,GydF4y2BaCYCD5:1GydF4y2Ba在'长富2号的(附加文件)中显著上调GydF4y2Ba1GydF4y2Ba:图S8)。GydF4y2Ba
‘青冠’与‘长肥2号’花蕾分化过程中转录因子差异表达的响应GydF4y2Ba
在我们的转录组数据的基础上,我们确定了500个课题组隶属于45个科,其中每一个TF的家庭成员是差异“秦冠”和“长富2号”在花的诱导过程芽(附加文件之间表达GydF4y2Ba1GydF4y2Ba:图S9和附加文件GydF4y2Ba2GydF4y2Ba).从ES到LS的多个TF基因中,‘Qinguan’的表达量显著低于‘Nagafu No. 2’GydF4y2BabHLHGydF4y2Ba(50),GydF4y2Ba小块土地GydF4y2Ba(43),和GydF4y2BaWRKYGydF4y2Ba(37) TF家庭(附加文件GydF4y2Ba1GydF4y2Ba:图S9),尽管有一些来自GydF4y2BaCPPGydF4y2Ba(1),Whirly(1),GydF4y2BaVOZGydF4y2Ba(2和GydF4y2BaDBB.GydF4y2Ba(2) TF家族(附加文件GydF4y2Ba1GydF4y2Ba:图S9)。一些GydF4y2BaWRKYGydF4y2Ba参与压力反应和花卉发展的家庭基因,如GydF4y2BaM268364GydF4y2Ba那GydF4y2BaM228304GydF4y2Ba那GydF4y2BaM175240 M253189,GydF4y2Ba和GydF4y2BaM496268GydF4y2Ba,在MS和LS期间的“Quinguan”比“Quafu No. 2”中显着更高度表达(附加文件GydF4y2Ba1GydF4y2Ba:图S9)。类似地,键的表达式级别GydF4y2BaBzip.GydF4y2Ba与ABA反应相关的家族基因(GydF4y2BaM320524GydF4y2Ba那GydF4y2BaM169473 M891899,GydF4y2Ba和GydF4y2BaM863909.GydF4y2Ba)以及一些NAC家族基因(GydF4y2BaM121265GydF4y2Ba那GydF4y2BaM690168GydF4y2Ba那GydF4y2BaM239596,M138340,GydF4y2Ba和GydF4y2BaM868556GydF4y2Ba)在‘青冠’芽中表达量高于‘长肥2号’芽(附文件GydF4y2Ba1GydF4y2Ba:图S9)。相反,表达水平GydF4y2BaAP2.GydF4y2Ba家族基因(GydF4y2BaM296716GydF4y2Ba那GydF4y2BaM181606GydF4y2Ba那GydF4y2BaM130802GydF4y2Ba,GydF4y2BaM161347GydF4y2Ba与长肥2号相比,在ES期间‘青冠’芽的花、果发育和阶段转变的相关基因均下调(附加文件GydF4y2Ba1GydF4y2Ba:图S9)。此外,一些GydF4y2Ba德国GydF4y2Ba家庭成员 (GydF4y2BaM373134,M233477GydF4y2Ba那GydF4y2BaM171492,GydF4y2Ba和GydF4y2BaM122321GydF4y2Ba)和参与糖途径调控开花的C2H2转录因子在‘青冠’芽中表达量高于‘长肥2号’芽(附加文件)GydF4y2Ba1GydF4y2Ba:图S9)。与多种调节途径相关的这些差异表达的TF基因可用于调节“Quinguan”和'Nagafu No.2'苹果树的花卉诱导。GydF4y2Ba
‘青冠’和‘长肥2号’花蕾诱导开花途径基因的差异表达GydF4y2Ba
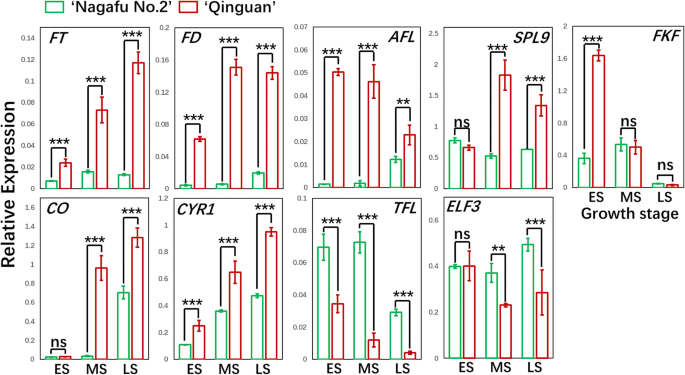
构建了包含190个开花基因的遗传连锁图谱,明确了‘长肥2号’与‘青冠’之间的关联。GydF4y2Ba11.GydF4y2Ba和GydF4y2Ba12.GydF4y2Ba和附加文件GydF4y2Ba2GydF4y2Ba).这些开花基因对17个苹果染色体的表达谱在'Nagafu No. 2'和'Quinguan'之间有显着差异(图。GydF4y2Ba11.GydF4y2Ba).与花发育相关的几个重要基因在‘青冠’花蕾中的表达明显高于‘长肥2号’花蕾。这些基因包括花分生组织特性控制蛋白基因GydF4y2Ba叶子GydF4y2Ba(GydF4y2BaM186703GydF4y2Ba)在第14染色体上(从ES到LS),开花时间调节蛋白基因PFT1 (GydF4y2BaM188336GydF4y2Ba)在染色体16和GydF4y2BaFT.GydF4y2Ba(GydF4y2BaM132050GydF4y2Ba)的第12染色体(从ES到LS),基本亮氨酸拉链TF家族蛋白基因GydF4y2BaFD.GydF4y2Ba(GydF4y2BaM169473.GydF4y2Ba)的染色体(从ES到LS)和MADS-box基因GydF4y2Ba富裕GydF4y2Ba(GydF4y2BaM289836.GydF4y2Ba)对ES和LS中14号染色体()和GydF4y2BaSOC1GydF4y2Ba(GydF4y2BaM314765GydF4y2Ba)从染色体2上的ES到LS(图。GydF4y2Ba11.GydF4y2Ba和GydF4y2Ba12.GydF4y2Ba).其他基因在“青冠”中的表达水平也同样显著高于“长肥2号”GydF4y2BaSquamosa启动子结合蛋白样GydF4y2Ba(GydF4y2BaSPLGydF4y2Ba)基因GydF4y2BaSPL5GydF4y2Ba(GydF4y2BaM861601GydF4y2Ba)在3号染色体和GydF4y2BaSPL9.GydF4y2Ba(GydF4y2BaM29978GydF4y2Ba)在第14染色体上的LS期间,若干昼夜节律相关基因[GydF4y2BaCRY1GydF4y2Ba(GydF4y2BaM229393GydF4y2Ba)与LS 13号染色体(从ES上),GydF4y2BaPRR5GydF4y2Ba(GydF4y2BaM248765GydF4y2Ba)在第7染色体上(从ES到LS)GydF4y2BaPIF3GydF4y2Ba(GydF4y2BaM141365GydF4y2Ba)在染色体12(从ES到LS)上],和GydF4y2BaCO.GydF4y2Ba基因[GydF4y2BaM713113GydF4y2Ba在第16染色体上(在ES和MS期间)GydF4y2BaM177126GydF4y2Ba在第3染色体上(在MS期间)]与光周期和开花有关(图。GydF4y2Ba11.GydF4y2Ba和GydF4y2Ba12.GydF4y2Ba).相比之下,在“Quinguan”芽的水平明显低于'Nagafu No. 2'芽中,表达了以下基因:Pebp家族基因GydF4y2BaTfl1.GydF4y2Ba(GydF4y2BaM255437.GydF4y2Ba)在第12染色体上(ES和MS期间),MADS-box TF基因GydF4y2Ba高级副总裁GydF4y2Ba(GydF4y2BaM233843GydF4y2Ba)在第11染色体上(MS和LS期间),循环DOF因子2基因GydF4y2BaCDF2GydF4y2Ba(GydF4y2BaM598637GydF4y2Ba第9染色体上的MS和LS,GydF4y2BaELF3GydF4y2Ba(GydF4y2BaM127365GydF4y2Ba)在第15号染色体上(MS和LS期间)GydF4y2BaAP2.GydF4y2Ba(GydF4y2BaM137561GydF4y2Ba)在第10染色体上(MS和LS期间)(图。GydF4y2Ba11.GydF4y2Ba和GydF4y2Ba12.GydF4y2Ba).GydF4y2Ba
讨论GydF4y2Ba
之间大汗开花“秦冠”和弱开花“长富2号”在农艺和花卉相关性状的差异GydF4y2Ba
1960年中国在中国开发的苹果品种的“Quinguan”展示了丰富的开花,高收益率和强烈的压力和抗病性[GydF4y2Ba4.GydF4y2Ba那GydF4y2Ba25.GydF4y2Ba],而苹果品种‘长福2号’花芽发育困难,表现出交替承重表型和营养生长旺盛的缺点[GydF4y2Ba26.GydF4y2Ba那GydF4y2Ba27.GydF4y2Ba].与这些特性相一致的是,2013 - 2015年,‘青冠’乔木的开花率和破芽率显著高于‘长肥2号’乔木(图2)。GydF4y2Ba2GydF4y2Ba).这些结果表明,两种苹果品种之间的花卉相关性状的存在巨大差异。当我们比较“Quinguan”和'Nagafu No.2'的芽增长时,我们发现在“Quinguan”的花芽生理分化中的芽宽和新鲜的阶段中和晚期阶段显着高得多(图。GydF4y2Ba1GydF4y2Ba),从而有助于其优越的开花特性。其他研究人员报告了类似的研究结果[GydF4y2Ba1GydF4y2Ba那GydF4y2Ba27.GydF4y2Ba].先前的研究也揭示了木质果树营养生长相对较弱的原因是营养枝生长过早停止[GydF4y2Ba1GydF4y2Ba].另外,弯枝通过抑制树木营养生长,降低长枝比例,可显著促进花芽的形成[GydF4y2Ba19.GydF4y2Ba].从我们的结果可以推断出一个类似的结论(图。GydF4y2Ba2GydF4y2Ba),这表明缺乏较小的枝条比例和“Quinguan”树的弱营养生长有助于这种品种的较高的花蕾。GydF4y2Ba
花期丰富的‘青冠’和弱花期的‘长肥2号’苹果品种在诱导花期芽糖和激素水平上存在显著差异GydF4y2Ba
糖作为能量的主要来源,参与植物开花过程[GydF4y2Ba28.GydF4y2Ba].碳水化合物代谢是指淀粉与糖的合成、分解代谢和相互转化,如蔗糖,在植物生长、诱导花等过程中具有重要作用[GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba29.GydF4y2Ba].In our study, significant differences were found in the contents of various sugars during floral induction between the ‘Qinguan’ and ‘Nagafu No. 2’ buds, which contributed to the contrasting levels of bud growth and flower bud formation observed between the two varieties (Fig.3.GydF4y2Ba).类似的研究表明,苹果芽中芽弯曲诱导的糖组合物的变化可以有助于加速的花芽形成[GydF4y2Ba30.GydF4y2Ba].GydF4y2Ba
植物激素在花器官转变的复杂调控中起关键作用[GydF4y2Ba31.GydF4y2Ba].我们检测到开花旺盛的‘秦官’和开花弱的‘长肥2号’(图2)的芽之间的植物激素(如CTK、ABA、GA和生长素)有显著差异。GydF4y2Ba4.GydF4y2Ba).先前的研究证实,CTK主要涉及植物中花芽形成的开始[GydF4y2Ba6.GydF4y2Ba],这与我们的研究结果一致,CTK水平在早期最高,在两个品种中从ES到LS下降(但仍显著高于长肥2号)(图2)。GydF4y2Ba4.GydF4y2Ba).这表明CTK在花芽形成中起着积极作用。同样,在所有三个芽分化阶段的“Quinguan”芽中,ABA水平明显高于“Nagafu No. 2”芽。早期调查显示,ABA含量在花芽分化期间增加,特别是在花心脏发生过程中[GydF4y2Ba32.GydF4y2Ba].此外,ABA有助于调节种子发育和花卉和相变响应环境胁迫[GydF4y2Ba18.GydF4y2Ba].相比之下,只有在ES期间,‘青冠’芽的IAA含量显著高于‘长肥2号’芽(图2)。GydF4y2Ba4.GydF4y2Ba).以前的研究表明,IAA影响芽增长和发展,以帮助调节花卉诱导[GydF4y2Ba33.GydF4y2Ba].与其他研究的结果相似[GydF4y2Ba21.GydF4y2Ba那GydF4y2Ba22.GydF4y2Ba]我们的数据表明,GA在木质果树的花卉诱导中具有负调节作用(图。GydF4y2Ba4.GydF4y2Ba).GydF4y2Ba
开花旺盛的‘秦冠’和开花弱的‘长肥2号’花芽形成差异的碳水化合物和脂质途径的差异表达基因GydF4y2Ba
对全球转录组数据的分析显示,大多数deg与碳水化合物、氮和脂质途径的复杂调控网络有关,丙酮酸作为中转站(图)。GydF4y2Ba7.GydF4y2Ba和附加文件GydF4y2Ba2GydF4y2Ba).在负责果糖的碳水化合物代谢的整个基因调控网络中转化为G-3-P的通路的端部的两个发散路径可以解释更高GydF4y2BaHXK.GydF4y2Ba那GydF4y2BaPGIGydF4y2Ba那GydF4y2BafrGydF4y2Ba,GydF4y2BaFBAGydF4y2Ba“Quegan”芽中的表达水平比“Nagafu No. 2”芽(图。GydF4y2Ba7.GydF4y2Ba).第一条路径,负责淀粉合成基因的下调表达(即,GydF4y2BaSS3GydF4y2Ba那GydF4y2BaSS4GydF4y2Ba那GydF4y2BaSBE2GydF4y2Ba,GydF4y2BaBE1GydF4y2Ba)在'Quegan'的芽中,涉及使用T-6-P作为中间体合成淀粉。早期的研究得出结论,T-6-P可以作为植物中的碳水化合物状态的代理,并通过调节开花GydF4y2BaFT.GydF4y2Ba表达式[GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba18.GydF4y2Ba].另外,T-6-P据说充当参与碳水化合物代谢调节剂,如蔗糖合成和淀粉代谢[中心GydF4y2Ba34.GydF4y2Ba].此外,蔗糖丰度越高,蔗糖合成基因(如GydF4y2BaSPS1GydF4y2Ba那GydF4y2BaSPS3.GydF4y2Ba,GydF4y2BaSUS3GydF4y2Ba而长肥2号的花芽发育较长肥2号的花芽发育较慢,这可能是导致长肥2号花芽发育加快的主要原因。GydF4y2Ba7.GydF4y2Ba).一项类似的研究显示,1% (GydF4y2BaW.GydF4y2Ba/GydF4y2BaV.GydF4y2Ba)蔗糖溶液促进开花[GydF4y2Ba35.GydF4y2Ba],而上调蔗糖合成酶基因的表达(GydF4y2BaSUS1GydF4y2Ba和GydF4y2BaSUS4GydF4y2Ba)在35S:IDD8植株中增强光周期开花[GydF4y2Ba11.GydF4y2Ba].第二可能的路径涉及将G-3-P转化为甘油途径中的丙酮酸(图。GydF4y2Ba7.GydF4y2Ba),其次是脂质和氮代谢途径(图。GydF4y2Ba7.GydF4y2Ba).这条路径涉及上调的表达GydF4y2BaPGKGydF4y2Ba那GydF4y2Ba伊诺GydF4y2Ba,GydF4y2BaPKGydF4y2Bain ‘Qinguan’ buds, which suggests that differences in the expression levels of these carbohydrate-related genes between the profusely flowering ‘Qinguan’ and the weakly flowering ‘Nagafu No. 2’ contribute to the contrasting levels of flower bud formation in these two apple varieties.
基因如GydF4y2Ba博士学位GydF4y2Ba那GydF4y2BaACC1GydF4y2Ba那GydF4y2Bakasi.GydF4y2Ba,GydF4y2BaKASIIIGydF4y2Ba在脂肪酸合成途径中表达于丙酮酸下游,参与某些化合物的合成和代谢(如acetyl-CoA, malonyl-CoA, acyl-ACP)。这些基因在‘青冠’芽中表达量高于‘长肥2号’芽(图2)。GydF4y2Ba7.GydF4y2Ba).Compared with their fate in ‘Nagafu No. 2’ buds, energy and photosynthetic products are more likely to be converted into fatty acids via acyl-ACP and then channelled into lipid pathways in ‘Qinguan’ (rather than direct starch formation through central carbon pathways). Additionally, lipids reportedly influence signalling pathways that control plant reproductive development [12.GydF4y2Ba那GydF4y2Ba36.GydF4y2Ba].GydF4y2Ba
关键基因的更大表达GydF4y2BaLACS2GydF4y2Ba和GydF4y2BaLACS9GydF4y2Ba在'Quinguan'芽中的芽比'Nagafu No. 2'芽导致将更多脂肪酸转化为细胞质/ ER中的酰基-CoA,以及来自TCA循环的G-3-P(图。GydF4y2Ba7.GydF4y2Ba),进入复合脂质合成和动力学途径[GydF4y2Ba36.GydF4y2Ba].这表明,与长肥2号芽相比,‘青冠’芽中磷脂酸(PA)、磷脂酰乙醇胺(PE)、磷脂酰胆碱(PC)、磷脂酰甘油(PG)、磷脂酰肌醇(PI)和三酰基甘油(TAG)等代谢产物的分解和合成更为明显。从而使‘秦观’开花率较高(图。GydF4y2Ba7.GydF4y2Ba).研究表明,FT在茎尖与每天变化的分子PC物种结合,主要是18:1-PC,以促进开花[GydF4y2Ba12.GydF4y2Ba].过度表达GydF4y2Ba脂肪酸DESATURASE3GydF4y2Ba(GydF4y2BaFAD3.GydF4y2Ba)产生比18:1-PC更高比例的18:3-PC延迟开花[GydF4y2Ba12.GydF4y2Ba那GydF4y2Ba13.GydF4y2Ba].此外,基因参与脂类沉积和油(TAG)的形成(即GydF4y2BaPDATGydF4y2Ba和GydF4y2BaPAP2GydF4y2Ba)在'Quinguan'芽中比在“Nagafu No. 2”芽中更高度表达(图。GydF4y2Ba7.GydF4y2Ba).这一结果与早期的一项研究结果相似GydF4y2Ba芸苔属植物显著GydF4y2Ba,其中发现了一种油合成的中心调节因子皱纹1,它通过调节油积累和脂质合成代谢之间的脂质稳态来加速植物开花[GydF4y2Ba13.GydF4y2Ba].皱纹还通过增强作用加速开花GydF4y2BaFT.GydF4y2Ba表达和不断增加的个人电脑水平[GydF4y2Ba12.GydF4y2Ba那GydF4y2Ba13.GydF4y2Ba].GydF4y2Ba
开花旺盛的‘秦冠’和开花弱的‘长肥2号’花芽形成差异的激素代谢和信号通路的差异表达基因GydF4y2Ba
Towards the elucidation of the regulatory mechanism of hormones during floral induction, we comprehensively analysed the genes involved in eight plant hormone metabolic, signalling, and response pathways that were differentially expressed between the profusely flowering ‘Qinguan’ and weakly flowering ‘Nagafu No. 2’ (Fig.8.GydF4y2Ba).这些Degs包括基因,如GydF4y2BaYUCCGydF4y2Ba和GydF4y2BaTAA1GydF4y2Ba,负责通过莽草酸途径合成IAA和SA [GydF4y2Ba37.GydF4y2Ba].IAA关键生物合成基因的表达水平最初在‘青冠’芽中上调。GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba10.GydF4y2Ba),这表明IAA在芽增长和花香诱导的启动中发挥着关键作用。芽的相对高的IAA水平可以刺激芽生长,积极影响花卉诱导的启动[GydF4y2Ba33.GydF4y2Ba].此外,据报道,SA在开花中发挥着积极的作用,主要是通过其参与压力反应[GydF4y2Ba38.GydF4y2Ba].这种激素还通过影响关键花基因的表达来调节开花(例如,GydF4y2BaFLC.GydF4y2Ba和GydF4y2BaFT.GydF4y2Ba)[GydF4y2Ba16.GydF4y2Ba那GydF4y2Ba24.GydF4y2Ba]以及SA信号和响应基因,包括GydF4y2BaNPR1GydF4y2Ba[GydF4y2Ba16.GydF4y2Ba].可以从我们的数据进行类似的推理(图。GydF4y2Ba8.GydF4y2Ba),表明‘青冠’的优良花特性与SA信号转导和开花途径中的基因具有较强的抗性密切相关。GydF4y2Ba
CTK在开花中的作用已经被研究过[GydF4y2Ba6.GydF4y2Ba那GydF4y2Ba14.GydF4y2Ba].施用外源CTK可显著提高苹果开花率[GydF4y2Ba19.GydF4y2Ba].我们观察到CTK水平显著升高,CTK生物合成基因和部分细胞周期相关基因表达水平上调(GydF4y2BaCyca3; 1GydF4y2Ba和GydF4y2BaCYCP1; 1GydF4y2Ba)在花卉诱导期间,在完全开花的“Quinguan”芽(附加文件GydF4y2Ba1GydF4y2Ba:图S8)。因此,CTK似乎在这种品种中影响花芽形成。其他研究表明,CTK通过上调花卉相关基因的表达,调节花卉诱导如GydF4y2BaFT.GydF4y2Ba[GydF4y2Ba39.GydF4y2Ba] 和GydF4y2BaSOC1GydF4y2Ba[GydF4y2Ba6.GydF4y2Ba那GydF4y2Ba20.GydF4y2Ba].在我们的研究中,与花卉相关基因的表达水平,例如GydF4y2BaFT.GydF4y2Ba那GydF4y2BaFD.GydF4y2Ba,GydF4y2BaSOC1GydF4y2Ba的表达上调至与CTK相似的水平(图。GydF4y2Ba11.GydF4y2Ba和GydF4y2Ba12.GydF4y2Ba).此外,由b型编码的蛋白质GydF4y2Baarr.GydF4y2Ba基因(CTK-responsive genes)与SPLs结合激活表达GydF4y2BaSOC1GydF4y2Ba和GydF4y2BaAGL24GydF4y2Ba,与CTK信令相关联[GydF4y2Ba40GydF4y2Ba].我们观察到B型GydF4y2Baarr.GydF4y2Ba基因在‘秦官’芽中的表达量高于‘长肥2号’芽中的表达量。GydF4y2Ba8.GydF4y2Ba和GydF4y2Ba9.GydF4y2Ba).此外,参与乙烯合成和信号传导的基因的表达水平(GydF4y2BaSAM1GydF4y2Ba那GydF4y2BaACS10GydF4y2Ba,GydF4y2BaETR1GydF4y2Ba)在'Quinguan'芽中上调(图。GydF4y2Ba8.GydF4y2Ba和GydF4y2Ba10.GydF4y2Ba).乙烯在花诱导调控中起关键作用[GydF4y2Ba41.GydF4y2Ba].GydF4y2Ba
在TCA循环通路下游,ABA和JA参与胁迫反应,对花的诱导和形成具有积极的调控作用[GydF4y2Ba16.GydF4y2Ba].ABA信令在开花中的主要功能涉及调节昼夜节律和表达相比之相关的基因,如GydF4y2BaEDL3.GydF4y2Ba那GydF4y2BaCO.GydF4y2Ba,GydF4y2BaGI.GydF4y2Ba[GydF4y2Ba15.GydF4y2Ba那GydF4y2Ba42.GydF4y2Ba].此外,GI还可以通过增加诱导开花GydF4y2BaFT.GydF4y2Ba和GydF4y2BaTFSGydF4y2BaABA信号的表达水平[GydF4y2Ba43.GydF4y2Ba那GydF4y2Ba44.GydF4y2Ba].此外,ABA连接的糖信号传导影响植物中的营养发展,开花时间和压力反应的调节[GydF4y2Ba18.GydF4y2Ba].ABA生物合成与开花相关基因的表达水平(GydF4y2BaFT.GydF4y2Ba那GydF4y2BaSOC1GydF4y2Ba,GydF4y2BaCO.GydF4y2Ba在满头开花“秦冠”(图)表达上调。GydF4y2Ba12.GydF4y2Ba),暗示ABA是有助于调节花卉诱导的多种途径(即糖,光周期和昼夜节律途径)中的核心因素。另一种植物激素,JA,通过将对生物和非生物胁迫的反应与CoI1和jaz从光周期途径进行调节,诱导开花[GydF4y2Ba16.GydF4y2Ba].与这一发现一致的是,“秦冠”株系相对于“长肥2号”株系较高的开花率与JA合成相关基因的上调表达密切相关(即:GydF4y2Ba时尚GydF4y2Ba那GydF4y2Ba中国人民解放军GydF4y2Ba那GydF4y2Ba液态氧GydF4y2Ba,GydF4y2Ba凯特GydF4y2Ba)(无花果。GydF4y2Ba8.GydF4y2Ba和GydF4y2Ba9.GydF4y2Ba).GydF4y2Ba
与此相反的上述激素,外源GA抑制开花在木本果树物种(例如,芒果和苹果树)通过抑制GydF4y2BaFT.GydF4y2Ba表达式[GydF4y2Ba45.GydF4y2Ba那GydF4y2Ba46.GydF4y2Ba].我们同样观察到GA水平和表达GydF4y2BaGA3oxGydF4y2Ba赤霉素的关键合成基因“青冠”的芽数显著低于“长肥2号”的芽数。GydF4y2Ba8.GydF4y2Ba和GydF4y2Ba9.GydF4y2Ba).另一个植物激素,BR主要参与植物生长和发展,对开花的影响相反,与调节有关GydF4y2Ba方法,LDGydF4y2Ba,GydF4y2Ba葬礼GydF4y2Ba在自主途径表达[GydF4y2Ba47.GydF4y2Ba].我们的数据表明,涉及BR合成中涉及的基因的下调表达(GydF4y2BaSMT2GydF4y2Ba那GydF4y2Ba暗淡GydF4y2Ba,GydF4y2BaCPDGydF4y2Ba)对苹果品种(无花果)的高开花率起着重要作用。GydF4y2Ba8.GydF4y2Ba和GydF4y2Ba9.GydF4y2Ba).因此,潜在的花卉诱导的分子调节机制可包括涉及多种植物激素的复杂调节过程。GydF4y2Ba
多花'秦冠'和弱花'长肥2号'花芽形成调控潜在转录因子的整体比较分析GydF4y2Ba
植物生命周期涉及许多生物过程,例如细胞分裂和分化,胚胎发育,种子萌发,生殖生长和开花,由复杂的转录网络调节[GydF4y2Ba48.GydF4y2Ba].在花诱导过程中,‘青冠’和‘长肥2号’花蕾之间鉴定出45个家系的差异转录因子约500个(附文件)GydF4y2Ba1GydF4y2Ba:图S9和附加文件GydF4y2Ba2GydF4y2Ba).在这些差异表达的转录因子都与激素反应,如bZIPs,ERFS,ARFs和MYBS [GydF4y2Ba49.GydF4y2Ba那GydF4y2Ba50.GydF4y2Ba那GydF4y2Ba51.GydF4y2Ba].其他已确定的TFs (wrky和NACs)主要与应激反应有关[GydF4y2Ba52.GydF4y2Ba那GydF4y2Ba53.GydF4y2Ba],而有些则通过多种开花途径直接调控开花[GydF4y2Ba22.GydF4y2Ba那GydF4y2Ba54.GydF4y2Ba那GydF4y2Ba55.GydF4y2Ba].例如,属于C2H2家族的IDD转录因子参与糖通路的开花调控[GydF4y2Ba56.GydF4y2Ba那GydF4y2Ba57.GydF4y2Ba],而NF-YA、NF-YB和NF-YC则通过响应光信号调节开花[GydF4y2Ba58.GydF4y2Ba].此外,SPL和AP2转录因子是两种microrna (miRNA156和miR172)的靶点,主要调节年龄相关通路的阶段转变[GydF4y2Ba54.GydF4y2Ba那GydF4y2Ba59.GydF4y2Ba].因此,这些在“秦冠”和“长肥2号”花蕾间差异表达的转录因子可能参与了与多种生物学过程相关的成花诱导。GydF4y2Ba
开花途径基因,差异地表达了与“Quinguan”和弱开花的“Nagafu No. 2”之间的差异表达GydF4y2Ba
为了充分描述开花繁茂的‘青冠’和开花弱的‘长肥2号’苹果品种的花性状差异,我们利用遗传连锁图谱分析了大约190个开花基因(图2)。GydF4y2Ba11.GydF4y2Ba).多项研究证实,关键开花基因通过多种途径直接控制花的诱导[GydF4y2Ba49.GydF4y2Ba那GydF4y2Ba60.GydF4y2Ba].与这些研究一致,我们观察到关键的开花基因,包括GydF4y2Ba英国《金融时报》,FDGydF4y2Ba,GydF4y2Ba叶子GydF4y2Ba,在‘秦官’芽中表达量高于‘长肥2号’芽(无花果;GydF4y2Ba11.GydF4y2Ba和GydF4y2Ba12.GydF4y2Ba和附加文件GydF4y2Ba2GydF4y2Ba).此外,GydF4y2BaSOC1GydF4y2Ba表达由SPL9和MIR156在年龄依赖性开花途径中调节[GydF4y2Ba61.GydF4y2Ba].我们观察到更高的表达水平GydF4y2BaSPL9.GydF4y2Ba在花诱导期(无花果;GydF4y2Ba11.GydF4y2Ba和GydF4y2Ba12.GydF4y2Ba),这可能是该品种开花率较高的原因。其他基因,包括GydF4y2BaTfl1.GydF4y2Ba和负调节器GydF4y2Ba高级副总裁GydF4y2Ba的表达量低于‘长肥2号’的表达量。GydF4y2Ba11.GydF4y2Ba和GydF4y2Ba12.GydF4y2Ba).编码的蛋白质GydF4y2Ba高级副总裁GydF4y2Ba形成了一个花卉阻遏复杂,结合到GydF4y2BaSOC1GydF4y2Ba抑制表达的启动子[GydF4y2Ba6.GydF4y2Ba那GydF4y2Ba62.GydF4y2Ba],而TFL1是一种花抑制因子,通过调节开花基因的表达来抑制开花GydF4y2BaAP1.GydF4y2Ba那GydF4y2Ba叶子GydF4y2Ba,GydF4y2BaFT.GydF4y2Ba[GydF4y2Ba63.GydF4y2Ba].因此,我们的研究结果表明,两个苹果品种的花特性差异与开花基因表达水平密切相关。GydF4y2Ba
结论GydF4y2Ba
我们利用RNA-seq数据比较了开花繁茂的‘青冠’和开花弱的‘长肥2号’苹果品种在生长和诱导花期芽的基因表达模式。我们观察到一个复杂的遗传网络,涉及碳、脂肪酸、脂质和激素相关的信号调节机制介导了苹果树的成花诱导。我们还完成了qRT-PCR分析两个苹果品种芽中糖、激素和开花相关基因的表达模式。本研究结果可能有助于阐明苹果花诱导的分子调控机制。GydF4y2Ba
方法GydF4y2Ba
植物材料和样品收集GydF4y2Ba
On 7 March 2008, 6-year-old trees of profusely flowering ‘Qinguan’ and weakly flowering ‘Nagafu No. 2’ apple varieties grafted on M.26 rootstocks were planted in the Apple Demonstration Nursery of Yangling Modern Agriculture Technology Park (Northwest Agriculture & Forestry University), Shaanxi, China (34°52′N, 108°7′E). Buds on the top spurs of ‘Qinguan’ and ‘Nagafu No. 2’ trees were collected during the early (ES; 5 May 2013), middle (MS; 1 June 2013), and late (LS; 25 June 2013) stages of flower bud physiological differentiation. For each variety, bud samples from 48 trees were combined. The bud samples were immediately placed in liquid nitrogen and stored at − 80 °C until used for the subsequent extraction and analysis of sugars and hormones as well as an RNA extraction and RNA-seq library construction. Total RNA was isolated from each sample using a modified version of a published method [2GydF4y2Ba那GydF4y2Ba59.GydF4y2Ba].GydF4y2Ba
芽断率、开花率、芽生长动态变化及芽型分析GydF4y2Ba
2013 - 2015年,分别计算了“秦冠”和“长肥2号”(各6株)的破芽率和开花率,以及枝干(< 5 cm)、中间枝(5 - 15 cm)和长枝(> 15 cm)等茎型的比例。计算开花率和破芽率的方法如前所述[GydF4y2Ba25.GydF4y2Ba那GydF4y2Ba64.GydF4y2Ba].用卷尺和数字显示游标卡尺测量和计算芽和芽的生长和类型。GydF4y2Ba
糖和激素含量的测量GydF4y2Ba
Sugars (i.e., sucrose, glucose, fructose, and sorbitol) and starch were extracted from approximately 0.3-mg (dry weight) samples of buds collected from ‘Qinguan’ and ‘Nagafu No. 2’ trees during the ES (5 May 2013), MS (1 June 2013), and LS (25 June 2013) flower bud differentiation stages. Extractions were performed as previously described [65.GydF4y2Ba].糖含量采用高效液相色谱法(Waters 2414折光检测器/Waters 1525二元高效液相色谱泵;中国陕西)如前所述[GydF4y2Ba66.GydF4y2Ba].GydF4y2Ba
Phytohormones were extracted from approximately 0.5-mg (fresh weight) samples of buds collected from ‘Qinguan’ and ‘Nagafu No. 2’ trees at three developmental stages [i.e., ES (5 May 2013), MS (1 June 2013), and LS (25 June 2013) floral induction stages] [66.GydF4y2Ba].采用高效液相色谱(Waters 2498 UV-Visible检测器;中国陕西)如前所述[GydF4y2Ba67.GydF4y2Ba].GydF4y2Ba
文库构建和RNA深度测序GydF4y2Ba
六个独立RNA-seq库从三个“Qinguan”芽样品(早期(量化宽松政策:2013年5月5日),中间阶段(QM: 2013年6月1日)和后期(QL: 2013年6月25日)]和三个“Nagafu 2号”芽样品(早期(FE: 2013年5月5日),中间阶段(FM: 2013年6月1日)和后期(FL:生物标志物生物技术公司(北京,中国)在Illumina基因组分析仪上构建并测序。从每个芽样本构建一个RNA-seq库,RNA-seq库构建按照前面描述的方法进行[GydF4y2Ba2GydF4y2Ba].对于每个RNA-SEQ样品,基于每百万映射读取(FPKM)值的每千碱基碎片的比率计算转录性丰度[GydF4y2Ba68.GydF4y2Ba].如前所述检测到差异表达基因[GydF4y2Ba69.GydF4y2Ba].对每个基因进行GO分析,以确定丰富的生物过程、分子功能和细胞成分GydF4y2BaP.GydF4y2Ba<0.05作为显着富集的阈值(GydF4y2Bahttp://www.geneontology.orgGydF4y2Ba/) (GydF4y2Ba70GydF4y2Ba].分析Kegg数据库以基于校正的态度检测显着富集的途径GydF4y2BaP.GydF4y2Ba-value < 0.05 (GydF4y2Bahttps://www.genome.jp/kegg/pathway.htmlGydF4y2Ba).为方便起见,每个原始基因ID(如MDP0000600078)中的前缀“MDP0000”被缩写为“M”(如M600078)。GydF4y2Ba
差异表达基因的Venn图和它们的表达谱分析GydF4y2Ba
来自'Qeinguan'(QE,QM和QL)和'Nagafu No.2'(Fe,FM和FL)的DEGS的VENN图分析了[GydF4y2Ba71GydF4y2Ba那GydF4y2Ba72GydF4y2Ba]使用venture软件(GydF4y2Bahttps://www.nia.nih.gov/research/resource/venthture.GydF4y2Ba).此外,利用MultiExperiment Viewer 4.2软件(MEV4.2)进行聚类分析,生成分层聚类热图(GydF4y2Bahttp://mev.tm4.org/GydF4y2Ba)使用每个基因的FPKM值。GydF4y2Ba
在定量RT-PCR测定的DEGS验证GydF4y2Ba
这relative expression levels of carbohydrate-, hormone-, and flowering-related genes in ‘Qinguan’ (QE, QM, and QL) and ‘Nagafu No. 2’ (FE, FM, and FL) buds during floral induction were detected by qRT-PCR using a previously described method [2GydF4y2Ba].qRT-PCR引物的详细信息请参见附加文件GydF4y2Ba1GydF4y2Ba:表S3。GydF4y2Ba
统计分析GydF4y2Ba
为了评价‘青冠’和‘长肥2号’在形态(即开花率、芽生长和茎长)、生理(即糖和激素含量)指标和qRT-PCR数据上的差异,采用DPS 7.0(浙江大学,中国杭州)软件进行单因素方差分析和Tukey-Kramer多重比较检验。GydF4y2Ba
缩写GydF4y2Ba
- ADPG:GydF4y2Ba
-
ADP-glucoseGydF4y2Ba
- F-6-P:GydF4y2Ba
-
Fructose-6-phosphateGydF4y2Ba
- G-1-P:GydF4y2Ba
-
Glucose-1-phosphateGydF4y2Ba
- G-6-P:GydF4y2Ba
-
葡萄糖-6-磷酸盐GydF4y2Ba
- 的PGM:GydF4y2Ba
-
葡萄糖磷酸GydF4y2Ba
- S-6-P:GydF4y2Ba
-
Sorbitol-6-phosphateGydF4y2Ba
- S-6-P:GydF4y2Ba
-
Sucrose-6-phosphateGydF4y2Ba
- SUS:GydF4y2Ba
-
蔗糖合酶GydF4y2Ba
- TP:GydF4y2Ba
-
磷酸丙糖GydF4y2Ba
- UDPG:GydF4y2Ba
-
UDP-glucoseGydF4y2Ba
参考文献GydF4y2Ba
- 1。GydF4y2Ba
xing l,张d,zhao c,li y,ma j,n,等。射击弯曲通过MiRNA介导的苹果调节促进花芽形成(GydF4y2BaMalus Domestica.GydF4y2BaBorkh)。生物科技植物》。j .[网络]。2016 [cited 2017 Feb 17]; 14:749-70。可从:GydF4y2Bahttp://onlinelibrary.wiley.com/doi/10.1111/pbi.12425/abstractGydF4y2Ba.GydF4y2Ba
- 2。GydF4y2Ba
邢立波,张东,李永明,沈永伟,赵春平,马建军,等。转录谱揭示了糖和激素信号通路介导苹果(Malus家蝇)的花诱导。植物生理学报。2015;56:2052-68。GydF4y2Ba
- 3。GydF4y2Ba
杨卫东,杨卫东,杨卫东,韩明。长期水分胁迫对苹果植株结构和产量的影响与苹果营养生长和生殖生长之间的转变有关。树杂志。2016;36:1369 - 81。GydF4y2Ba
- 4.GydF4y2Ba
邢林,张东,宋旭,翁锴,沈勇,李勇,等。苹果‘长肥2号’和‘秦冠’全基因组序列变异鉴定及花相关性状比较GydF4y2BaMalus Domestica.GydF4y2BaBorkh)。前面。植物科学。(互联网)。2016[引用2017年2月17日];可从:GydF4y2Bahttp://www.ncbi.nlm.nih.gov/pmc/articles/pmc4921462/GydF4y2Ba
- 5。GydF4y2Ba
武Kurokura NM。蔷薇科植物季节性开花的规律。J Exp Bot, 2013。可从:GydF4y2Bahttps://www.ncbi.nlm.nih.gov/pubmed/23929655.GydF4y2Ba.GydF4y2Ba
- 6。GydF4y2Ba
李志强,李志强。植物开花途径整合子SOC1的调控与功能研究。j . Exp。机器人。(互联网)。2010 [cited 2014 Nov 22]; 61:2247-54。可从:GydF4y2Bahttp://jxb.oxfordjournals.org/content/61/9/2247GydF4y2Ba
- 7.GydF4y2Ba
陈志强。开花时间的远程调控。j . Exp。机器人。(互联网)。2011 [cited 2014 Nov 22]; 62:4399-413。可从:GydF4y2Bahttp://jxb.oxfordjournals.org/content/62/13/4399GydF4y2Ba
- 8.GydF4y2Ba
赤霉素在植物调控网络中的作用。j . Exp。机器人。(互联网)。2009[引用2014年11月22日];60:1979-89。可从:GydF4y2Bahttp://jxb.oxfordjournals.org/content/60/7/1979GydF4y2Ba
- 9.GydF4y2Ba
张晓东,张晓东,张晓东,等。海藻糖-6-磷酸信号对植物开花的调控GydF4y2Ba拟南芥GydF4y2Ba.科学(互联网)。2013 [引用的2014年11月22]; 339:704-7。可从:GydF4y2Bahttp://www.sciencemag.org/content/339/6120/704GydF4y2Ba
- 10。GydF4y2Ba
李L,郑,朱y,叶h,唐b,arendsee zw等。QQS孤儿基因通过NF-YC相互作用调节跨物种的碳和氮分配。Proc。国家的。学会科学。(互联网)。2015年[引用2017年6月3日]; 112:14734-9。可从:GydF4y2Bahttp://www.pnas.org/content/112/47/14734GydF4y2Ba
- 11.GydF4y2Ba
徐PJ,柳Ĵ康SK,园C-M。通过一个不确定的域的转录因子有助于在拟南芥中光周期开花糖代谢的调节作用。植物细胞与分子生物学杂志。2011; 65:418-29。GydF4y2Ba
- 12.GydF4y2Ba
Nakamura Y, Andrés F, Kanehara K, Liu Y, Dörmann P, Coupland g。Commun Nat。(互联网)。2014[引用2017年5月24日];可从:GydF4y2Bahttp://www.nature.com/ncomms/2014/140404/ncomms4553/full/ncomms4553.htmlGydF4y2Ba
- 13。GydF4y2Ba
李强,邵军,唐胜,沈强,王涛,陈伟,等。勘误:皱纹1加速油菜开花并调节油脂积累和膜脂合成代谢之间的脂质稳态。植物科学学报2015;6:1270。GydF4y2Ba
- 14。GydF4y2Ba
Amasino R.开花的季节性和发育时间。植物j .[网络]。2010年[引用2014年11月22]; 61:1001-13。可从:GydF4y2Bahttp://onlineLibrary.wiley.com/doi/10.1111/j.1365-313x.2010.04148.x/abstract.GydF4y2Ba
- 15.GydF4y2Ba
de Montaigu A, Tóth R, Coupland g。趋势麝猫。(互联网)。2010 [cited 2014 Nov 22]; 26:296-306。可从:GydF4y2Bahttp://www.sciencedirect.com/science/article/pii/S0168952510000843GydF4y2Ba
- 16。GydF4y2Ba
Kazan K,Lyons R.开花时间与压力耐受性之间的联系。J Exp Bot。2016; 67:47-60。GydF4y2Ba
- 17.GydF4y2Ba
李志强,李志强,李志强,等。ABA信号网络中昼夜时钟依赖的门控机制。原生质(互联网)。2012[引用2014年11月22日];249:445-57。可从:GydF4y2Bahttp://link.springer.com/article/10.1007/s00709-011-0304-3GydF4y2Ba
- 18.GydF4y2Ba
Gazzarrini S, Tsai AY-L。海藻糖-6-磷酸和SnRK1激酶在植物发育和信号转导中的作用植物杂志。(互联网)。2014[引用2014 11月22日];5:119。可从:GydF4y2Bahttp://journal.frontiersin.org/journal/10.3389/fpls.2014.00119/fullGydF4y2Ba
- 19.GydF4y2Ba
李义,张达,邢升,张某,赵开,汉米嘌呤(6-BA)对“富士”苹果植物型,花卉诱导和启动的影响(6-BA)(GydF4y2BaMalus Domestica.GydF4y2BaBorkh)。植物生长调节。(互联网)。2016 [引用的2017年10月31日]; 79:65-70。可从:GydF4y2Bahttps://link.springer.com/article/10.1007/S10725-015-0111-5.GydF4y2Ba
- 20.GydF4y2Ba
Rashotte AM,卡森SDB,要JPC,基贝尔JJ。细胞分裂素行动表达谱拟南芥。植物杂志。(互联网)。2003 [引用的2017年10月31日]; 132:1998年至2011年。可从:GydF4y2Bahttps://www.ncbi.nlm.nih.gov/pmc/articles/pmc181285/GydF4y2Ba
- 21.GydF4y2Ba
Koshita Y,Takahara T,Ogata T,Goto A.萨摩普通话叶片和花芽形成中内源性植物激素(IAA,ABA,GAIL)的参与(柑橘Unshiu Marc。)。科学。Hortic。(互联网)。1999年[11月23日引用2014年11月]; 79:185-94。可从:GydF4y2Bahttp://www.sciencedirect.com/science/article/pii/S030442389800209XGydF4y2Ba
- 22.GydF4y2Ba
王志强,王志强,王志强,等。园艺树种花分化的调控。j . Exp。机器人。(互联网)。2008[引用2014年11月23日];59:3215-28。可以从http://dx.doi.org/GydF4y2Bahttps://doi.org/10.1093/jxb/ern188GydF4y2Ba
- 23.GydF4y2Ba
吴明福,山口等。赤霉素对拟南芥花的形成起先正后负的控制作用。科学。2014;344:638-41。GydF4y2Ba
- 24.GydF4y2Ba
Yamada M, Takeno K.胁迫和水杨酸诱导PnFT2表达调控胁迫诱导的牵牛开花。j .植物杂志。(互联网)。2014 [cited 2015 Jan 29]; 171:205-12。可从:GydF4y2Bahttp://www.sciencedirect.com/science/article/pii/S0176161713002952GydF4y2Ba
- 25.GydF4y2Ba
杨W-W,陈X-L,Saudreau男,张X-Y,张M-R,刘H-K,等人。冠层结构及光截获分区从虚拟树木估计芽中:生长在不同矮化中间砧对中国黄土高原苹果品种之间的比较。树木。2016年1-12。可从:GydF4y2Bahttps://link.springer.com/article/10.1007/s00468-016-1403-8GydF4y2Ba.GydF4y2Ba
- 26。GydF4y2Ba
韩HH,Lauri Pe,Coutand C.横向发展受到在积极增长期间弯曲的射击重新评估的位置,在下列冬季弯曲。在:Prange RK,Bishop SD,编辑。Proc。int。Symp。维持。积分。org。Hortic。鲁汶1:国际园艺学会科学; 2008. p. 435–9. Available from:http://agris.fao.org/agris-search/search.do?recordID=LV2016011889GydF4y2Ba.GydF4y2Ba
- 27。GydF4y2Ba
劳里·P-E。趋势苹果培训在法国 - 建筑和生理生态视角。在:帕尔默JW,编辑。Proc。int。Symp。加强经济舱。环境。维持。水果刺。 Glob. Econ. Leuven 1: International Society Horticultural Science; 2008. p. 483–90. Available fromhttps://www.actahort.org/books/772/772_80.htmGydF4y2Ba.GydF4y2Ba
- 28。GydF4y2Ba
吉布森SI。通过糖信号植物发育和基因表达的控制。咕咕叫。当今。植物医学杂志。(互联网)。2005 [引用的2014年11月22]; 8:93-102。可从:GydF4y2Bahttp://www.sciencedirect.com/science/article/pii/S1369526604001542GydF4y2Ba
- 29。GydF4y2Ba
Shalom L,Samuels S,Zur N,Shlizerman L,Doron-Faigenboim A,Blumwald E等人。水果载荷会诱导全局基因表达的变化以及柑橘芽中的吲哚酸(ABA)和吲哚乙酸(IAA)稳态。J Exp Bot。2014; 65:3029-44。GydF4y2Ba
- 30.GydF4y2Ba
ITO A,Yoshioka H,Hayama H,Kashimura Y.将芽的重新定向为水平位置,影响侧芽的糖代谢和日本梨子中的拍摄间(GydF4y2BaPyrus pyrifoliaGydF4y2Ba(缅甸。)nak。)。j hortic sci biotechnol。2004; 79:416-22。可从:GydF4y2Bahttps://www.tandfonline.com/doi/abs/10.1080/14620316.2004.11511783GydF4y2Ba.GydF4y2Ba
- 31.GydF4y2Ba
戴维斯SJ。集成激素进入拟南芥花转变途径。植物细胞环境。2009; 32:1201年至1210年。GydF4y2Ba
- 32.GydF4y2Ba
Fitzpatrick AH, Shrestha N, Bhandari J, Crowell DN。法尼醇和ABA在拟南芥花发育中的作用。植物信号行为。2011;6:1189-91。GydF4y2Ba
- 33。GydF4y2Ba
巴尔山S,Johal GS,Carraro N.养鑫运输司机在单科科生发展中的作用。前面。植物科学。(互联网)。2014年[引用2017年10月31]; 5。可从:GydF4y2Bahttp://journal.frontiersin.org/article/10.3389/fpls.2014.00393/abstractGydF4y2Ba.GydF4y2Ba
- 34。GydF4y2Ba
王志强,王志强,王志强,等。糖信号和分子网络对植物生长的影响。咕咕叫。当今。植物医学杂志。(互联网)。2010[引用2014年11月22日];13:273-8。可从:GydF4y2Bahttp://www.sciencedirect.com/science/article/pii/S1369526609001782GydF4y2Ba
- 35。GydF4y2Ba
黄志强,黄志强,黄志强,黄志强。糖对拟南芥营养发育和花器官转化的影响。植物杂志。2001;127:252 - 61。GydF4y2Ba
- 36。GydF4y2Ba
樊建军,宁科,曾旭,罗勇,王东,胡建军,等。小球藻中淀粉-脂质转换的基因组基础。植物生理学。2015;169:2444-61。GydF4y2Ba
- 37。GydF4y2Ba
石竹酸和芳香族氨基酸的合成途径GydF4y2Ba拟南芥GydF4y2Ba.阿拉伯。本书上午。SOC。植物医学杂志。(互联网)。2010 [引用的2017年10月31日]; 8。可从:GydF4y2Bahttps://www.ncbi.nlm.nih.gov/pmc/articles/PMC3244902/GydF4y2Ba
- 38。GydF4y2Ba
Shimakawa A,Shiraya T,石冢Y,和田KC,三井T,竹野K.水杨酸参与饥饿的调节应激诱导开花GydF4y2Ba浮萍属paucicostataGydF4y2Ba.j .植物杂志。(互联网)。2012 [cited 2017 Nov 2]; 169:987-91。可从:GydF4y2Bahttp://www.sciencedirect.com/science/article/pii/S0176161712001009GydF4y2Ba
- 39。GydF4y2Ba
李志强,李志强,李志强,等。细胞分裂素通过转录激活FT模拟TSF促进拟南芥开花。植物j .[网络]。2011 [cited 2014 Nov 22]; 65:972-9。可从:GydF4y2Bahttp://onlinelibrary.wiley.com/doi/10.1111/j.1365-313X.2011.04482.x/abstractGydF4y2Ba
- 40。GydF4y2Ba
张t-q,连h,唐h,dolezal k,周c-m,yu s等人。内在的MicroRNA定时器调节植物中射击再生能力的逐步下降。植物细胞。2015; 27:349-60。GydF4y2Ba
- 41。GydF4y2Ba
坎波斯-Rivero的G,奥索里奥-蒙塔尔沃P,桑切斯 - 博尔赫斯R,我们 - 卡马斯R,路易斯-阿克女,德拉Pena的C.植物激素在开花信令:一个角度后生点。J植物理性。2017; 214:16-27。GydF4y2Ba
- 42。GydF4y2Ba
Koops P,Pelser S,IgnaTz M,Klose C,Marrocco-Selden K,Kretsch T. EDL3是一个F箱蛋白,参与了脱落酸信号中的调节GydF4y2Ba拟南芥GydF4y2Ba.j . Exp。机器人。(互联网)。2011年[11月22日引用2014年11月22]; 62:5547-60。可从:GydF4y2Bahttp://www.ncbi.nlm.nih.gov/pmc/articles/pmc3223051/GydF4y2Ba
- 43.GydF4y2Ba
Sawa M, Kay SA。GIGANTEA直接激活开花位点TGydF4y2Ba拟南芥GydF4y2Ba.Proc。国家的。学会科学。(互联网)。2011 [cited 2014 Nov 22]; 108:11698-703。可从:GydF4y2Bahttp://www.pnas.org/content/108/28/11698GydF4y2Ba
- 44.GydF4y2Ba
Riboni M, Robustelli Test A, Galbiati M, Tonelli C, Conti L.环境胁迫与开花时间。植物的信号。Behav。(互联网)。2014; 9: e29036。可从:GydF4y2Bahttps://doi.org/10.4161/psb.29036GydF4y2Ba
- 45.GydF4y2Ba
关键词:芒果树,开花位点T-like基因,赤霉素代谢基因,表达分析科学。Hortic。(互联网)。2012 [cited 2014 Nov 22]; 139:108-17。可从:GydF4y2Bahttp://www.sciencedirect.com/science/article/pii/S030442381200129XGydF4y2Ba
- 46.GydF4y2Ba
张胜,张东,范胜,杜磊,沈勇,邢磊,等。外源GA3及其抑制剂多效唑对‘富士’苹果成花、内源激素及开花相关基因的影响(GydF4y2BaMalus Domestica.GydF4y2BaBorkh)。植物杂志。物化学。(互联网)。2016 [cited 2017 Feb 17]; 107:178-86。可从:GydF4y2Bahttp://www.sciencedirect.com/science/article/pii/S0981942816302261GydF4y2Ba
- 47.GydF4y2Ba
李继,李义,陈某,芸苔类固醇信号在拟南芥花卉诱导网络中的参与。J Exp Bot。2010; 61:4221-30。GydF4y2Ba
- 48.GydF4y2Ba
张H,杨B,刘j,guo d,hou j,chen s等。马铃薯块茎中对花青素生物合成相关的结构基因及关键转录因子分析。SCI Hortic。2017; 225:310-6。GydF4y2Ba
- 49.GydF4y2Ba
Gocal GF,谢尔顿CC,的Gubler女,Moritz的T,巴格诺尔DJ,麦克米兰CP,等。GAMYB类似基因,开花和赤霉素信号在拟南芥中。植物杂志。2001; 127:1682年至1693年。GydF4y2Ba
- 50.GydF4y2Ba
Chagnéd,林王K,Espley RV,Volz的RK,如何NM,劳斯S等人。苹果MYB转录因子的古老复制负责新红水果果肉的表型。植物杂志。(互联网)。2013 [引用的2014年11月22]; 161:225-39。可从:GydF4y2Bahttp://www.plantphysiol.org/content/161/1/225GydF4y2Ba
- 51.GydF4y2Ba
钙依赖蛋白激酶负责bZIP转录因子FD的磷酸化,对成花素复合物的形成至关重要。科学。众议员(互联网)。2015 [cited 2017 May 24];5:8341。可从:GydF4y2Bahttp://www.nature.com/srep/2015/150209/srep08341/full/srep08341.htmlGydF4y2Ba
- 52.GydF4y2Ba
等。WRKY转录因子:脱落酸信号转导的关键成分。生物技术学报。2012;10:2-11。GydF4y2Ba
- 53.GydF4y2Ba
Hendelman A,STAV R,Zemach H,阿拉兹T的番茄NAC转录因子SlNAM2参与花边界形态发生。j . Exp。机器人。(互联网)。2013 [引用的2014年12月18]; 64:5497-507。可从:GydF4y2Bahttp://jxb.oxfordjournals.org/content/64/18/5497GydF4y2Ba
- 54.GydF4y2Ba
Wang J-W, Czech B, Weigel dGydF4y2Ba拟南芥GydF4y2Ba.细胞(互联网)。2009[引2014年11月23日];138:738-49。可从:GydF4y2Bahttp://www.sciencedirect.com/science/article/pii/S0092867409007132GydF4y2Ba
- 55.GydF4y2Ba
SEO PJ,Kim MJ,Ryu J-Y,Jeong E-Y,Park C-M。IDD14转录因子的两种剪接变体竞争力地形成可调节淀粉代谢的非官能异二聚体。Commun Nat。(互联网)。2011年[2017年2月17日]; 2:303。可从:GydF4y2Bahttp://www.nature.com/ncomms/journal/v2/n5/full/ncomms1303.htmlGydF4y2Ba
- 56.GydF4y2Ba
崔东,赵军,景勇,范敏,刘军,王铮,等。拟南芥IDD14、IDD15和IDD16通过促进生长素生物合成和转运协同调控侧根器官形态发生和向地性。公共科学图书馆麝猫(互联网)。2013 [cited 2014 Nov 25];9:e1003759。可以从http://dx.doi.org/GydF4y2Bahttps://doi.org/10.1371/journal.pgen1003759GydF4y2Ba
- 57。GydF4y2Ba
郑奕奕,徐pj,禹杰,朴昌明。在拟南芥中,AKIN10通过蛋白磷酸化使IDD8转录因子失活来延缓开花。BMC医学杂志。(互联网)。2015 [cited 2017 Feb 17];15:110。可以从http://dx.doi.org/GydF4y2Bahttps://doi.org/10.1186/s12870-015-0503-8GydF4y2Ba
- 58。GydF4y2Ba
Kumimoto RW, Adam L, Hymus GJ, Repetti PP, Reuber TL, Marion CM,等。核因子Y亚基NF-YB2和NF-YB3通过诱导长日照促进拟南芥开花。足底(互联网)。2008 [cited 2017 Nov 2]; 228:709-23。可从:GydF4y2Bahttps://link.springer.com/article/10.1007/s00425-008-0773-6GydF4y2Ba
- 59。GydF4y2Ba
邢林,张东,李勇,赵超,张胜,沈勇,等。河南海棠营养阶段转变相关microrna的全基因组鉴定及降解组测序靶预测BMC基因组学。2014;15:1125。GydF4y2Ba
- 60。GydF4y2Ba
等。FD,一个bZIP蛋白在茎尖介导花通路整合子FT的信号。科学(互联网)。2005[引用2014年11月22日];309:1052-6。可从:GydF4y2Bahttp://www.sciencemag.org/content/309/5737/1052GydF4y2Ba
- 61。GydF4y2Ba
Porri A,Torti S,Romera-Branchat M,胃纤维素在长光周期下促进拟南芥开花中的空间不同的调节作用。发展[互联网]。2012年11月22日引用2014年11月22日]; 139:2198-209。可从:GydF4y2Bahttp://dev.biologists.org/content/139/12/2198GydF4y2Ba
- 62。GydF4y2Ba
Lee JH, Yoo SJ, Park SH, Hwang I, Lee JS, Ahn JH。SVP在环境温度控制拟南芥开花时间中的作用。基因Dev。2007;21:397 - 402。GydF4y2Ba
- 63。GydF4y2Ba
Flachowsky H,Szankowski I,Waidmann S,Peil A,Trankner C,汉克MV。苹果的MdTFL1基因(海棠X家蝇Borkh。)降低的营养生长和生成时间。树生理。2012; 32:1288-301。GydF4y2Ba
- 64。GydF4y2Ba
ITO A,Yaegaki E,Hayama H,Kusaba S,Yamaguchi I,Yoshioka H.弯曲射击刺激日本梨侧芽的开花和影响激素水平。Hortscience。1999年; 34:1224-8。GydF4y2Ba
- 65。GydF4y2Ba
Rosa M, Hilal M, González JA, Prado FE。低温对盐胁迫和盐适应藜麦子叶蔗糖-淀粉分配酶活性的影响(GydF4y2Ba藜藜麦GydF4y2BaWilld。)幼苗。植物杂志。物化学。(互联网)。2009年[2014年11月28日]; 47:300-7。可从:GydF4y2Bahttp://www.sciencedirect.com/science/article/pii/S0981942808002350GydF4y2Ba
- 66。GydF4y2Ba
盐胁迫下植物组织中脱落酸、细胞分裂素和生长素含量的测定。在:Shabala S, Cuin TA,编辑。植物盐托勒。(互联网)。胡玛纳出版社;2012年[引用2014年11月22日]。p . 251 - 61。可从:GydF4y2Bahttp://link.springer.com/protocol/10.1007/978-1-61779-986-0_17GydF4y2Ba
- 67.GydF4y2Ba
dilianov DL, Dobrev PI, Moyankova DP, Vankova R, Georgieva DT, Gajdošová S,等。复活植物干燥和恢复过程中内源激素的动态GydF4y2BaHaberlea rhodopensisGydF4y2Ba.J.植物生长规律。(互联网)。2013 [cited 2014 Nov 22]; 32:564-74。可从:GydF4y2Bahttp://link.springer.com/article/10.1007/s00344-013-9323-yGydF4y2Ba
- 68.GydF4y2Ba
依赖条件下多重检测错误发现率的控制。安。Stat。[网络]。2001[引2014年11月22日];29:1165-88。可从:GydF4y2Bahttps://projecteuclid.org/euclid.aos/1013699998GydF4y2Ba
- 69.GydF4y2Ba
序列计数数据的差异表达分析。基因组医学杂志。(互联网)。2010 [cited 2012 Nov 20];11:R106。可从:GydF4y2Bahttp://genomebiology.com/2010/11/10/R106/abstractGydF4y2Ba
- 70.GydF4y2Ba
杜志华,周旭,凌云,张志华,苏志华。一种面向农业社区的GO分析工具。核酸Res.[互联网]。38: W64-70。可从:GydF4y2Bahttp://www.ncbi.nlm.nih.gov/pmc/articles/pmc2896167/1GydF4y2Ba
- 71.GydF4y2Ba
Botton A, Eccher G, Forcato C, Ferrarini A, Begheldo M, Zermiani M等。诱导苹果小果脱落的信号通路。植物杂志。(互联网)。2011 [cited 2014 Nov 22]; 155:185-208。可从:GydF4y2Bahttp://www.plantphysiol.org/content/155/1/185GydF4y2Ba
- 72.GydF4y2Ba
王志强,王志强,王志强,等。ventn -一种用于多药理学数据集分析的新型维恩图研究工具。《公共科学图书馆•综合》(互联网)。7. 2012[引用2015年2月16日];可从:GydF4y2Bahttp://www.ncbi.nlm.nih.gov/pmc/articles/pmc3351456/GydF4y2Ba
致谢GydF4y2Ba
我们感谢李文编集,Edanz编辑中国(GydF4y2Bawww.liwenbianji.cn/ac.GydF4y2Ba)编辑本手稿的草稿的英文文本。GydF4y2Ba
资金GydF4y2Ba
本研究由国家自然科学基金项目(31801813;陕西省科技创新工程项目(2016KTZDNY01-10;2017ZDXM-NY-017)和中国博士后科学基金(2018 M631207;2017 M623254)。GydF4y2Ba
数据和材料的可用性GydF4y2Ba
本研究中使用和分析的数据集可在合理要求下从通讯作者处获得。序列已在PRJNA493865项目下的NCBI序列读取归档中存储。GydF4y2Ba
同意发布GydF4y2Ba
不适用。GydF4y2Ba
作者信息GydF4y2Ba
从属关系GydF4y2Ba
贡献GydF4y2Ba
LX, XC和MH设计并构思了这个项目。LX、XC、DZ、CZ、NA进行实验。LX、XC、YL、KS、SQ对数据进行了分析。LX和XC写了手稿。所有作者都已阅读并批准了本手稿的最终版本。GydF4y2Ba
相应的作者GydF4y2Ba
伦理宣言GydF4y2Ba
伦理批准和同意参与GydF4y2Ba
不适用。GydF4y2Ba
相互竞争的利益GydF4y2Ba
两位作者宣称他们没有相互竞争的利益。GydF4y2Ba
出版商的注意GydF4y2Ba
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。GydF4y2Ba
附加文件GydF4y2Ba
额外的文件1:GydF4y2Ba
表S1。GydF4y2Ba每个样本中干净reads的测序数据总结。GydF4y2Ba表S2。GydF4y2Ba每个样本的测序数据总结。GydF4y2Ba表S3。GydF4y2Ba本研究使用的引物列表。GydF4y2Ba图S1。GydF4y2Ba‘青冠’和‘长肥2号’苹果品种开花后特定天数的茎长变化GydF4y2Ba图S2。GydF4y2Ba'Quinguan'和'Nagafu No.2'苹果品种的刺激,中间和长射击比例。GydF4y2Ba图S3。GydF4y2Ba染色体上的样本读取密度。GydF4y2Ba图S4。GydF4y2Ba苹果‘青冠’和‘长肥2号’花诱导芽中差异表达基因的数量GydF4y2Ba图S5。GydF4y2Ba在花卉诱导期间“Quinguan”和“Nagafu No.2”中差异表达细胞组分基因的数量。(a)上调和(b)在“Quinguan”和'Nagafu No. 2'芽中的下调差异表达基因(DEGS)。七种类型的参数(A-,B-,C-,D-,E-,F&G型)与图1中的聚类分析中的七种参数相同。GydF4y2Ba7.GydF4y2Ba.GydF4y2Ba图S6。GydF4y2Ba‘青冠’和‘长肥2号’花诱导过程中分子功能基因差异表达的研究GydF4y2Ba图S7。GydF4y2Ba差异表达的聚类分析GydF4y2BaSaur.GydF4y2Ba‘青冠’和‘长肥2号’花蕾生长素响应相关家族基因。GydF4y2Ba图S8。GydF4y2Ba花卉诱导期间“Quingan”和“纳卡非洲第2号芽”差异表达细胞周期相关基因的聚类分析。GydF4y2Ba图S9。GydF4y2Ba对‘青冠’和‘长肥2号’花蕾中转录因子差异表达基因进行聚类分析。GydF4y2Ba图S10。GydF4y2Ba相关基因的qRT-PCR数据与RNA-seq数据呈线性关系。(医生4856 kb)GydF4y2Ba
额外的文件2:GydF4y2Ba
表S4。GydF4y2Ba《京都基因与基因组百科全书》分析了“秦观”花蕾相对于“长长2号”花蕾的7种表达模式类型(a-、b-、c-、d-、e-、f-和g-)的上调基因。通过维恩图和聚类分析鉴定了上调基因。GydF4y2Ba5.GydF4y2Ba.GydF4y2Ba表S5。GydF4y2Ba《京都基因与基因组百科全书》分析了“秦观”芽相对于“长长2号”芽的7种表达模式类型(a-、b-、c-、d-、e-、f-和g-)的下调基因。通过维恩图和聚类分析鉴定下调基因。GydF4y2Ba5.GydF4y2Ba.GydF4y2Ba表S6。GydF4y2Ba“青冠”和“长肥2号”花蕾差异表达基因相关的碳水化合物、脂肪酸和脂质途径差异表达基因根据图中的模型进行检测。GydF4y2Ba7.GydF4y2Ba.GydF4y2Ba表S7。GydF4y2Ba与“Quinguan”和'Nagafu No. 2'芽相关的激素途径与差异表达基因相关。这些激素相关基因主要参与激素合成,信号传导和响应途径。这些基因的模型和聚类分析在图1和2中示出。GydF4y2Ba8.GydF4y2Ba和GydF4y2Ba9.GydF4y2Ba.GydF4y2Ba表S8。GydF4y2Ba‘青冠’和‘长肥2号’芽中转录因子家族成员的详细信息。GydF4y2Ba表S9。GydF4y2Ba在“Quinguan”和'Nagafu No.'芽中的差异表达开花相关基因。位于不同染色体上的开花相关基因如图2所示。GydF4y2Ba11.GydF4y2Ba.(XLSX 153 kb)GydF4y2Ba
权利和权限GydF4y2Ba
开放访问GydF4y2Ba本文根据创意公约署署署的条款分发了4.0国际许可证(GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)适用于本条提供的数据,除非另有说明。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
陈,X.,齐,S.,张,D。GydF4y2Ba等等。GydF4y2Ba基于比较rna测序的开花茂盛'秦冠'和弱开花' Nagafu no '花蕾转录组分析2’苹果品种揭示了花诱导调控机制的新见解。GydF4y2BaBMC植物BIOL.GydF4y2Ba18,GydF4y2Ba370(2018)。https://doi.org/10.1186/s12870-018-1555-3GydF4y2Ba
收到了GydF4y2Ba:GydF4y2Ba
公认GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
迪伊GydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-018-1555-3GydF4y2Ba
关键词GydF4y2Ba
- 苹果树GydF4y2Ba
- 碳GydF4y2Ba
- 脂肪酸GydF4y2Ba
- 荷尔蒙GydF4y2Ba
- 花卉诱导GydF4y2Ba
- RNA-SEQ.GydF4y2Ba