摘要
背景
在开花植物中,脂质在花药内的合成和运输是雄性生殖成功的关键。TaMs1,一个位于4BS染色体上的显性小麦育性基因,此前已被精细定位并鉴定为编码糖基磷脂酰肌醇(GPI)锚定非特异性脂质转移蛋白(nsLTP)。虽然该基因对花粉外壁发育至关重要,但其功能的细节仍不清楚。
结果
在这项研究中,我们报道Tams1.只在B亚基因组中表达,在包含小孢子的花药中检测到最高的转录丰度,这些小孢子经历减数分裂前到减数分裂。β-葡萄糖醛酸酶转录融合进一步揭示了这一点Tams1.在所有花药细胞类型中表达。Tams1.该基因在花药发育的早期阶段表达,与报道的孢粉素前体生物合成所必需的基因相关。在花药中缺失一功能Tams1.(MS1C.结果表明,TaMs1在花粉发育过程中具有独立的功能。外源激素对GUS报告系的处理表明Tams1.吲哚-3-乙酸(IAA)和脱落酸(ABA)均能增加表达。翻译融合结构表明TaMs1靶向于质膜。
结论
总之,Tams1.是小麦生育基因,在花药早期表达,并编码靶向血浆膜的GPI-LTP。提出的工作提供了新的洞察小麦花粉发育过程。
背景
小麦(Triticum Aestivum.L.)是最主要的粮食作物之一,占人类每日蛋白质和食物热量的20% (FAOSTAT, 2017)。预计到2050年,小麦需求将比2010年增长60%。因此,需要将全球产量增长率从目前的每年1%(2001-2010年)提高到每年1.6%(2010-2050年)。雄性生殖发育是影响籽粒产量的关键因素。花粉粒被一种称为外壁的复杂的多层细胞壁包裹,它形成一种物理屏障来抵御各种生物和非生物的胁迫[1].花粉外来主要由孢子蛋白组成,一种高度耐腐蚀的生物聚合物,提供刚性外骨骼的刚性外骨骼,其在草地上另外被多酚,酚类,蛋白质和脂肪酸衍生物的混合物覆盖[2,3.].
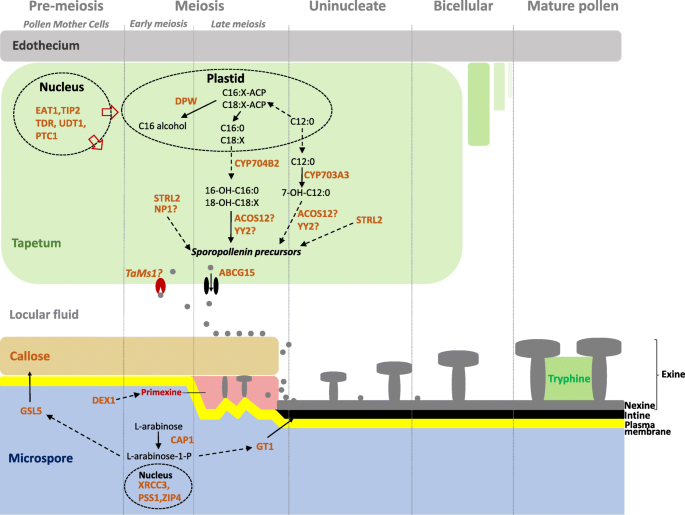
孢粉素对化学降解具有高度抗性的特性,这对阐明其生化组成是一个巨大的挑战。然而,花粉壁发育的潜在遗传学已被深入研究,通过使用外缺陷突变体的模式植物,如答:芥在其他物种中,水稻[1].这些遗传分析表明,孢粉素的生物合成包括3个保守的代谢途径和运输过程。第一个过程涉及从包括磷脂、脂肪酸和醇在内的前体中生产蜡和各种脂基化合物。该途径包括脂肪酸羟化酶如CYP703A3 [4,5]和CYP704B2 [6来自保守的P450基因家族。此外,男性不育2 (MS2)来自答:芥[7]及其在花粉壁缺陷的水稻同源物(DPW) [8编码脂肪酸还原酶,已被证明是花粉外壁形成所必需的。
第二种保守途径涉及酚类化合物的生物合成,酚类化合物是外泌素和色氨酸的重要组成部分[9].通过脂肪 - 酰基-CoA合成酶(ACOS5)从脂肪酸底物合成酚菌素[7]、聚酮合成酶(OsPKS1)和四酮α-吡酮还原酶(TKPR) [10].
第三种保守的途径涉及多糖代谢,胼胝质生物合成和降解的时机有利于花粉被形成[11,12].
新合成的孢粉素前体从绒毡层细胞层转运到发育的小孢子。孢粉素前体是如何分配到花粉被的形成尚不清楚。研究表明编码atp结合盒(ABC)转运蛋白的ABCG15除非特异性脂质转运蛋白外,也参与了孢粉素前体转运[13,14].此外,还表明答:芥III-LTPs类型将脂质化合物分配并纳入花粉壁[15].最近,一种小麦基因被称为Tams1.小麦雄性育性需要编码一种糖基磷酰肌醇(GPI)脂质转移蛋白[16,17].
已经在大多数植物物种中鉴定了非特异性脂质转移蛋白(NSLTP)基因家族的成员。它们在不同的发育阶段表现出一系列表达模式。这反映了它们在许多生物过程中的潜在参与,包括Cutin Biosynest [18、病原体防御反应[19[长距离信号通[20.,21,种子成熟[22,花粉管粘附[23].
nsltp具有在体外膜间穿梭脂质的能力[24].它们是植物特异脯氨蛋白超家族的一部分,由8个保守的半胱氨酸基序(8CM)骨干、低分子量和4到5个α -螺旋来识别[25,26].保守半胱氨酸结构域具有如下模式:C-Xn-C-Xn-CC-Xn-CXC-Xn-C-Xn-C - xn - c,具有形成四种二硫桥所需的半胱氨酸残基[27].在这种情况下,二硫桥能够稳定疏水腔,并能在体外结合各种脂质和其他疏水化合物[28].大多数nsltp还具有一种n端信号肽,通过泡状分泌途径将蛋白定位到外质体空间。nsltp还可以包含一个受翻译后修饰的保守的c端基序。这个基序被内质网(ER)腔内的糖磷脂酰肌醇(GPI)转氨酶识别,在这里它被剪切并被GPI的一部分取代。这部分GPI将蛋白质固定在质膜的细胞外侧。GPI锚定的nsltp可以被特异性的磷脂酶从膜上释放出来,这些磷脂酶可以裂解GPI分子[29].
水稻和水稻中nsltp基因的全基因组分析拟南芥分别报告77宗及79宗核泄漏事故[30.].在小麦156中,通过EST数据挖掘检索推定的NSLTP [31].nsltp至少分为九种类型,根据内含子位置、半胱氨酸间距和gpi -锚基序的存在进行区分[31,32].在报告的9种类型中,gpi锚定的nsltp, G型,在水稻和水稻中最具代表性答:芥[30.].
本研究探讨了TaMs1在花粉外壁形成过程中的生物学功能。我们报告了时空受限表达的证据Tams1.在小孢子发生的花药中。TaMs1的表达早于孢粉素生物合成所需的许多基因。最后,我们证明了信号肽和前肽GPI锚对TaMs1亚细胞定位的重要性,表明其在脂质转运中的作用。我们的研究结果为花粉发育机制提供了新的见解。
方法
植物材料和生长条件
小麦品种Chris和Chris- ems诱变系FS2 (MS1D.)进行细胞学检查和表达谱分析[33].每6 L(8英寸)播种5至6株。直径)花盆内的土壤混合。土壤混合成分为75% (v/v)椰泥炭,25% (v/v)苗圃切割砂(锐砂),750 mg/L CaSO4.2H2O(石膏)750 mg / L Ca(h2宝4)2.H20(过磷酸钙),feso1.9 g/L4, 125 mg/L饲料TA,1.9 克/升钙(无3.)、2.750 mg/L Scotts Micromax微量营养素和2.5 g/L Osmocote Plus缓释肥料(16:3:9)(Scotts澳大利亚Pty. co .)。有限公司)。用2份农用石灰和1份熟石灰将pH值调节到6.0 - 6.5之间。盆栽植物要么生长在控制环境的23°C(白天)和16°C(夜晚)的生长室内,要么生长在类似的温度调节的温室中,在冬季的几个月中,使用400瓦高压钠灯和金属卤化物灯将光周期延长到12小时。
qRT-PCR表达分析
使用来自小麦组织的分离物II RNA迷你试剂盒(Bioline,Sydney,Australia)分离出总RNA:根,射击和灌注,射击和植物,宫,含有术前分裂孢子孢子对成熟度的植物孢子。根据Burton等人进行定量实时PCR。,(2004) (34]使用引物组合显示在附加文件1.用乙酰胭脂红染色分阶段测定含发育小孢子的花药。取0.6 μg RNA,用上标IV逆转录酶(Thermo Fisher Scientific, Melbourne, Australia)合成oligo(dT)引物第一链cDNA。2 μL稀释1:20作为常规和实时荧光定量PCR的模板。TaGAPdH, TaActin和Ta14-3-3作为内参基因。
组织化学GUS染色及细胞学检查
构建pTOOL36 -TaMs1: gusplus[16)转化成小麦(cv。外野手)使用农杆菌肿瘤术根据Ainur等人的说法。,2014年(35].通过使用5-溴-4-氯-3-吲哚基 - β-D-葡糖醛酸(Gold Biotechnology,Inc)的组织化学染色,通过组织化学染色来分析来自因化学染色的叶子,根和含梭菌的转基因株的GUS活性。将样品在100mM磷酸钠,pH7.0,10mM乙二胺四乙酸钠,2毫米FEK中孵育在100mM X-Gluc溶液中。3.(CN)6, 2毫米K4铁(CN)60.1%的Triton X-100。样品在2600 Pa真空渗透20分钟后,在37℃孵育72 h。
将样品在4%蔗糖,1×PBS,4%多聚甲醛,0.25%戊二醛,4℃下孵育样品过夜。随后在乙醇系列中脱水的浓度(30,50,70,85,90,95和100%)中脱水。然后嵌入组织Technovit®树脂切片,8-14 μm切片,钌红染色,然后装入DPX溶液(Sigma, St. Louis, MO)。切片在徕卡DM1000显微镜和CCD相机上进行标准光镜观察。β-葡萄糖苷酶反应的沉淀产物在亮色下呈蓝色,暗色下呈粉红色。
启动子分析
NewPLACE [36],一个在线植物数据库独联体- 治愈调节性DNA元素(独联体-元素)被用来识别推定独联体- 在启动子地区的元素Tams1.及其homeologues。
激素响应分析
用吲哚-3-乙酸(IAA)处理植物(PytoTechnology Lab。,Lenexa, USA) and abscisic acid (ABA) (Sigma-Aldrich, Sidney, Australia). Hormone stock solutions were made with 100% ethanol. Wheat tillers were collected and dipped in hormone solutions for 9 h containing either 100 μM IAA or 100 μM ABA, to a final concentration of 0.05% ethanol. A 0.05% ethanol solution was used as a control treatment. For the drought treatment, plants were well watered until the stage of flag leaf emergence and water withheld until wilting. After sample collection, plants were re-watered. The effects of the cyclic drought treatment was assessed from the percentage of fertility of three spikes from well-watered and treated plants calculated according to Tucker et al. (2017) [16].
通过使用X-Gluc的组织化学染色分析来自治疗转基因的GUS活性,如前所述,通过组织化学染色分析。用乙酰胭脂红染色分阶段测定含发育小孢子的花药。每次治疗都使用六穗。
RNA测序的表达分析
小麦基石可育和不育(WT)的花药组织(MS1C.),每个重复4次,从含有减数分裂前小孢子的花药中分离出双核小孢子。组织样本收集后立即用液氮冷冻。采用RNeasy Plant mini试剂盒(Qiagen)提取总rna。每个样本都被用来创建库,并使用Illumina进行深度测序™Hi-Seq 2500系统产生100bp,对端读取。根据质量评分(Phred评分≥15)对Reads进行裁剪,剔除适配器序列。Reads被定位到IWGSC RefSeqv0.4小麦基因组组装中[37]使用TopHat2.0,除最大内含子大小50,000 bp外,其余参数为默认值;最小内含子大小:20 bp;1错配/ 100bp允许。对齐后的读数被装配在袖扣上[38],然后用卡夫范数进行量化和归一化。规范化表达式用FPKM表示,即每千基每百万次读取读取一次。WT与MS1C.本研究中感兴趣的基因采用双尾学生t检验进行计算。
氨基酸序列分析
用SignalP 4.1检测TaMs1氨基酸序列是否存在假定的信号肽[39].另外,使用大PI植物预测器预测GPI锚域的存在[40], PredGPI [41]和GPI-SOM [42].
TaMs1的亚细胞定位
融合构建体mCherry-TaMs1由GeneScript®合成并插入pUC57-Kan的BamHI和KpnI位点之间以产生pUC57-mCh-TaMs1。Tams1.小麦CV的编码序列。克里斯用作模板,并且麦克里记者在Tams1蛋白的Q24和P25之间插入。BamHI / KPNI消化PUC57-MCH-TAMS1,含有MCH-TAMS1的片段倒置并插入玉米泛素启动子(Zmubi)和Rubisco终止子之间导致pzmubipro.:: MCH-TAMS1。构造的P.zmubipro.::mCh-TaMs1被用于洋葱表皮细胞和小麦原生质体的瞬时表达,据Bart等人,2006和Shan等人,2014 [43,44].pzmubipro.::mCh被用作转换控件。共焦图像是通过尼康A1R激光扫描显微镜(尼康仪器公司,美国)与DS-Ri1 CCD相机耦合捕获的。采用488 nm激光进行GFP荧光(激发波长:488.0 nm;发射波长:525.0 nm)检测,561 nm激光用于RFP荧光(激发波长:561.1 nm;发射波长:595 nm)检测。采用0.8 M甘露醇进行质浆分离。
胼胝质染色
从雄性肥沃的植物(野生型)和无菌植物中收集了花药样品(MS1D.)包含减数分裂小孢子(减数分裂Ⅰ,二分体和四分体)和单核小孢子。通过丙酮胭脂红染色或细胞学检查确定发育阶段。胼胝质壁染色是在一滴苯胺蓝溶液(0.1%苯胺蓝0.1%)中压扁花药进行的 M磷酸盐缓冲液pH 7.0) [45].使用尼康Eclipse Nie光学显微镜进行亮场和荧光显微镜。
结果
Tams1.是否有花药特异性基因在花药发育早期表达
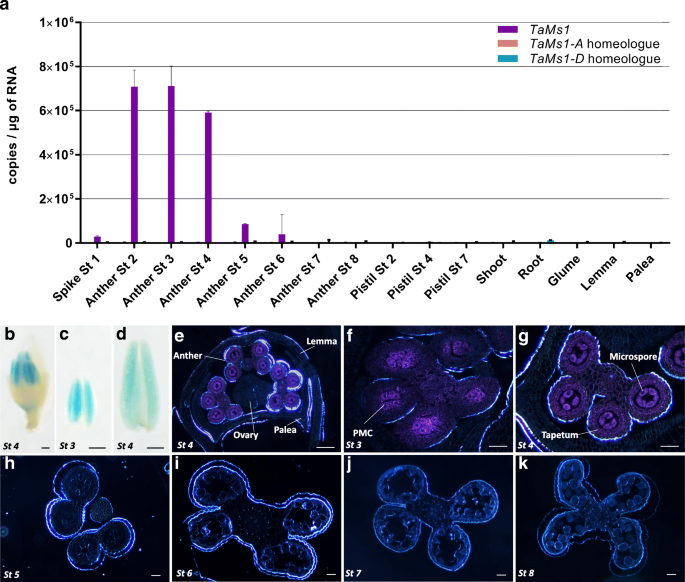
Tams1.在雌蕊、芽、根、颖、外稃和内稃中均未检测到转录本,而在小孢子减数分裂前到减数分裂阶段(st) 2 ~ 4时,转录本在花药组织中富集。1一个)。Tams1.在含有单核小孢子(st 5和st 6)的花药中,表达量明显下降。此外,只检测到B同源物,表明只有该亚基因组被转录。
此外,还分析了Tams1.转基因小麦的启动子活性。菲尔德是用TaMs1::Gusplus.转录融合结构。与qRT-PCR结果相似,在减数分裂前(st 3)到减数分裂(st 4)期间,只在含有小孢子的花药中观察到GUS活性(图4)。1b-g)。含减数分裂前小孢子(st 3)的花药横切面显示,GUS活性主要存在于花粉母细胞(PMCs)中,而在其他所有花药细胞中检测不到。1F)。然而,在含有早期减肥梭菌的花药中(ST 4),在微微孢子和胶质细胞中检测到高GUS活性,并且在花药的其他组织中呈较小程度(图。1g).从单核小孢子到花粉成熟(第5 ~ 8段)的花药横切面中未检测到GUS活性(图5 ~ 8段)。1H-K)。
因为胼胝质代谢与Tams1.表达式简介,我们测试了TAMS1是否参与了通过苯胺蓝染色的减数分裂期间的胼切割。在MeIosis期间愈合沉积在Meiocyte细胞壁上[查看附加文件2]然后在微孔TETRAD(右图中的右图)下降2),随后释放出单核小孢子。在胼胝质的沉积模式、数量和时间上,WT和WT之间没有观察到差异MS1D.,表明TaMs1在减数分裂过程中没有参与胼胝质的沉积。
外源激素对Tams1.表达式
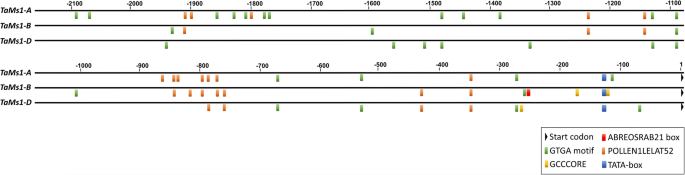
调查法规Tams1.存在于4B染色体上,我们在硅胶中鉴定独联体- 2 kB的推动者区域中的重组Tams1.及其自制(图。2).两种类型的独联体-花粉特异表达相关元件、GTGA基元和POLLEN1LELAT52 [46,使用newPLACE工具检测到[36].这三个同源基因的启动子区域均含有GTGA基序和POLLEN1LELAT52元件。GTGA motif富集于TaMs1-A启动子区,16次出现,而11和五次发生TaMs1-D TaMs1-B,分别。TaMs1-A和TaMs1-B分别包含12个和10份Pollen1lelat52元素,而只有四份副本被识别TaMs1-D启动子区域。
两个激素反应元件被鉴定TaMs1-B启动子区域,包括两个GCCCORE盒,一个茉莉酸/乙烯反应元件,位于− 103 bps和 − 155 起始密码子的bps和ABREOSRAB21,ABA反应元件转录激活因子[47,−234 bps。有趣的是,ABREOSRAB21只被识别在TaMs1-B启动子区域。此外,TaMs1-D启动子区仅包含一个假定的位于−237 bps的GCCCORE元件,在该基因中没有发现TaMs1-A启动子区域。
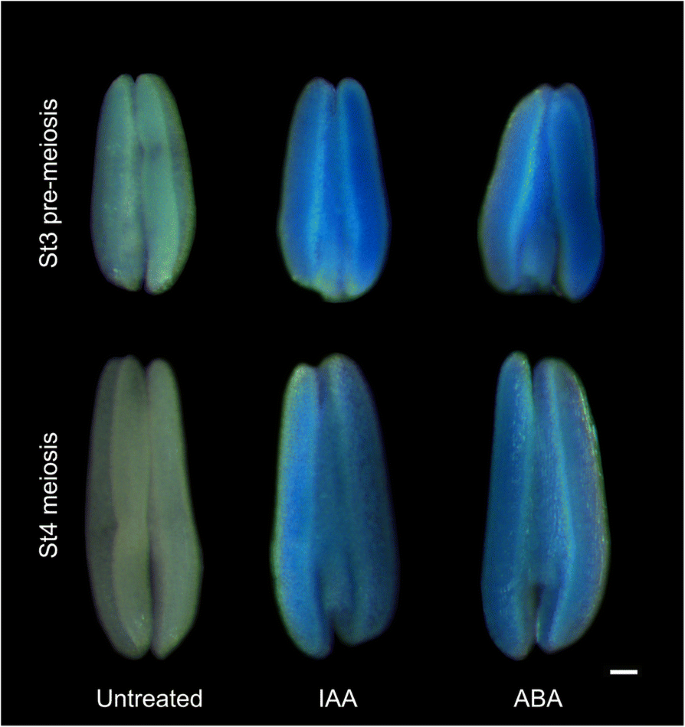
因为激素响应的分布独联体元素在Tams1.启动子区与其同源物不同,我们首先研究了外源激素对启动子区的影响Tams1.表达式使用TaMs1: gusplus行。不同处理间GUS活性的差异是通过改变染色时间来确定的。首先,蓝色饱和度为未处理TaMs1: gusplus在大约72处发现了一条线 h、 因此,当首次观察到治疗组和对照组之间的差异时,停止对治疗组进行GUS染色。这通常发生在大约48小时 GUS染色h。TaMs1: gusplus含减数分裂前和减数分裂小孢子的花药经IAA和脱落酸处理9小时后,与对照组相比染色更强烈。3.),建议Tams1.被这些激素转录激活。茉莉酸(JA)和赤霉素(GA)对GUS活性无明显影响3.)治疗(数据未显示)。
TaLTPG1比对花粉外来形成所需的其他基因表达
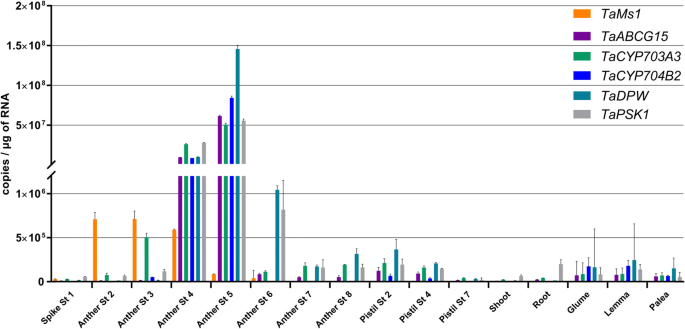
Tams1.在含有孢子细胞(第2阶段),花药早期阶段的花药中表达(图。1f).更好地理解Tams1.在水稻孢粉素生物合成基因的功能方面,我们研究了它相对于水稻孢粉素生物合成基因的小麦同源基因的表达时间Taabcg15,Tacyp703a3.,TaCYP704B2,塔德皮和TaPSK1[4,6,48(图。4).在含有减数分裂至单核小孢子的花药样本(第4期和第5期)中优先检测到这些基因的转录本。
Tams1.基因敲除不影响减数分裂时期花药和花粉壁发育相关基因的表达水平
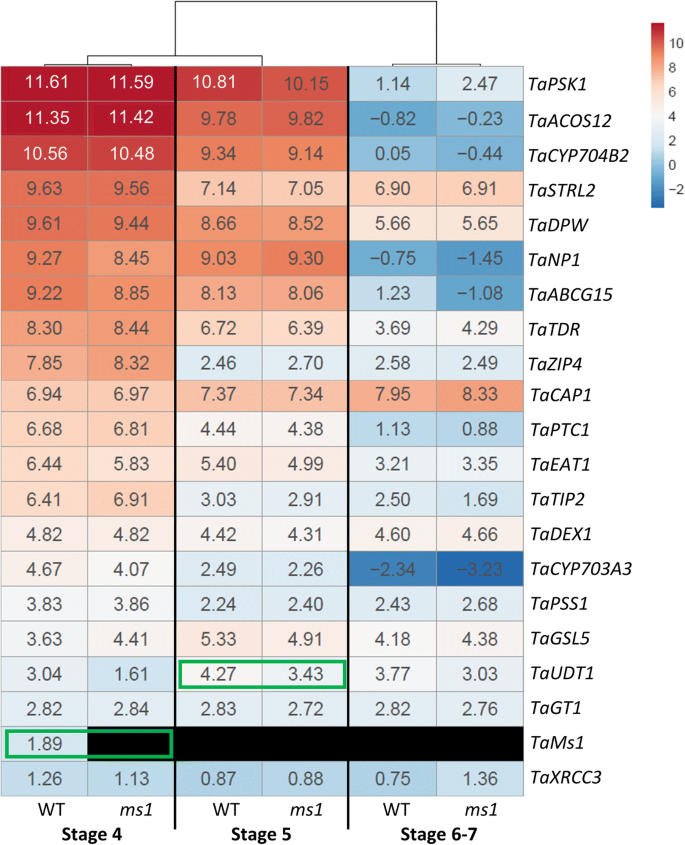
水稻雄性生殖发育过程中基因的相互依赖调节关系已在其他物种中得到报道。例如,被认为是花粉形成所必需的基因的水稻突变体,通常表现出许多被确定参与花粉外质形成的基因的不同表达模式[49].我们旨在通过检查野生型(WT)与野生型(WT)与ms1花药,20个被认为与水稻孢粉素生物合成基因同源的小麦,据报道是雄性生育所必需的。首先根据水稻雄性不育突变的报道确定基因,然后根据其功能特征确定是否对花药发育和花粉壁形成具有重要作用(图1)。5; 附加文件3.;无花果。6).
水稻花粉发育及外壁形成代谢网络的研究现状答:芥。(改编自Ariizumi和Toriyama(2011)和张等人。(2016年)进行修改(许可证号:4286200743277和4286240859506))。对于基因/酶的全名称,请参阅附加文件3.
令人惊讶的是,没有一个被选中的基因表现出异常的表达ms1花药含有减数分裂小孢子(第4期),除了Tams1.(无花果。6).在ms1含有单核微微孢子的花药(第5阶段)未开发TAPETUM1(taudt1)相对于wt显着下调。然而,它的表达在花粉发育的其他阶段没有改变。在该阶段可以观察到其他孢子蛋白生物合成基因的基因表达没有显着差异。米饭UDT1,一种bHLH转录因子,据报道对绒毡层早期发育和PMC减数分裂至关重要[50]. 在第6和第7阶段,孢子粉蛋白生物合成基因的表达水平不受影响Tams1突变。
Tams1蛋白质局部化为血浆膜
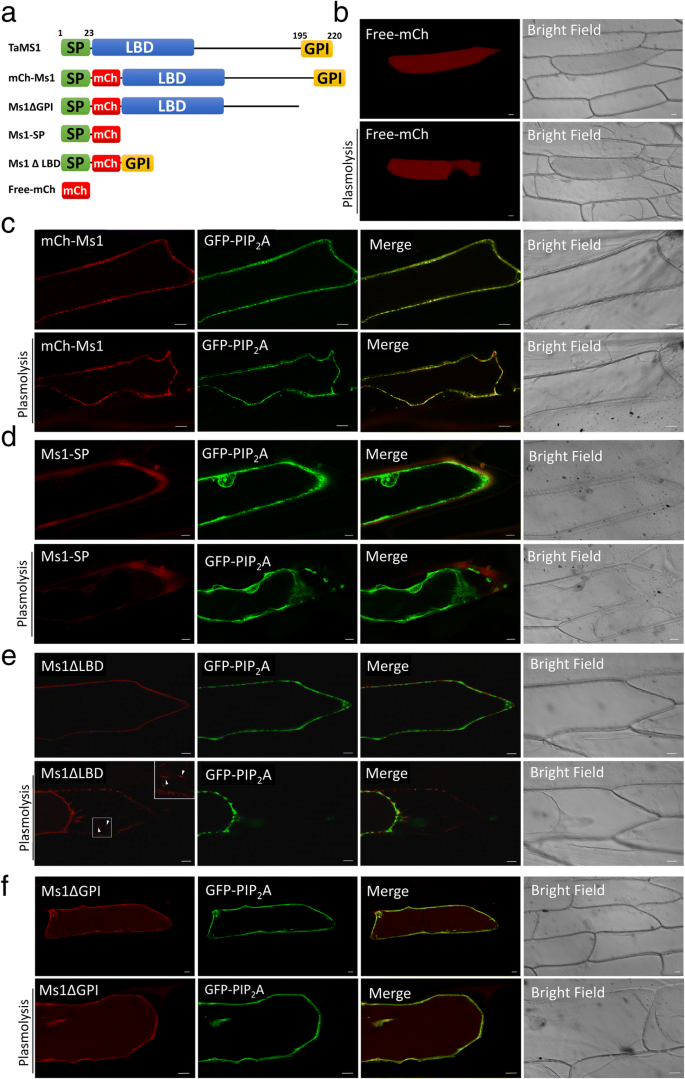
对TaMs1初级多肽的计算分析预测了(i)一个n端信号分泌肽(SP)的存在,长度为23个氨基酸,预计将成熟蛋白导向分泌途径,(ii)随后是LTPs脂质结合域(LBD)共识的8个半胱氨酸基序,(iii)和c端跨膜结构域,预计翻译后被剪切并被GPI-anchor取代(图)。7一个)。预计由其三个推定基序(SP-LBD-GPI)定义的TAMS1蛋白预计通过凹凸途径分泌,并通过GPI部分束缚到质膜的细胞外侧。为了确认在体内的底蜂窝定位,TAMS1与MCHERRY(MCH)融合,在洋葱表皮细胞中瞬时表达。
游离mCh荧光在细胞质内弥散(图。7b)。在电池周边观察MCH-TAMS1信号,并与PIP共同定位2A-GFP质膜标志物[51(图。7c).这种共定位在质酶解的洋葱表皮细胞中得到证实,这使得质膜和细胞壁之间有了区别。
还使用在洋葱表皮细胞中瞬时表达的截短的翻译融合来证明对分泌和细胞表面系束的每个推定的TAMS1基序(SP-LBD-GPI)的要求。我们首先使用MS1-SP测试N末端信号肽(SP)的功能。在Applast中累积的MS1-SP荧光(图。7d).这表明TaMs1是通过n端信号肽的存在靶向分泌途径的。
最后,我们利用Ms1研究了前肽GPI锚定的功能∆LBD和Ms1∆GPI。洋葱细胞与缺乏LBD和质膜固有蛋白2A(PIP)的TaMs1共转化2A-GFP)等离子体膜标记仅在等离子体膜的外表面上表达荧光(图。7e).胞浆裂解处理后,在缩回的细胞膜和形成细胞膜-细胞壁连续体的赫赫天链上均检测到RFP信号。在缺乏肽前gpi -锚定位点的情况下,Ms1∆LBD荧光与质膜标记物胞浆裂解前和胞浆裂解后共定位(图。7f).令人惊讶的是,我们还观察到胞浆内的荧光。我们解释这些发现意味着GPI-anchor对于TaMs1特异性靶向浆膜是必需的。
讨论
我们之前的鉴定报告Tams1.,位于4BS染色体上的小麦育性显性基因序列[16].Tams1.被证明是花粉外壁形成的必要条件。外壁形成异常的表型通常导致不育性降低或完全不育。据报道,花粉外壁缺陷突变体是绒毡层细胞层发育缺陷的结果,例如Tdr, tip2, eat1, ptc1和UDT1[14,50,52,53,54],(ii)破坏孢子醇蛋白前体合成和运输途径,包括ACOS12,STRL2,CYP703A3,PSK1,DPW和abcg15[5,8,13,55,56,57] (iii)胼胝质形成的中断(gls5)[58],(iv)异常的内、预胺形成,如gt1,cap1和dex1[59,60,61(v)和减肥缺陷,包括xrcc3,邮政编码和pss1[62,63,64].这些基因在涉及不同的途径时,表现出相互依赖的表达。例如,米饭DPW.表现出异常表达CYP704B2[8],np1misregulated在热带病研究和培训特别规划,法,CYP703A3, CYP704B2和ABCG15表达式[65]和功能缺失突变体CYP703A3有报道说法和CYP704B2[66].此外,热带病研究和培训特别规划,吃,PTC1在tip2[54,而不正常的表达CYP704B2,PTC1,PSK1,和法被检测到ptc1型花药[54].为了确定是否Tams1.基因的表达依赖于孢粉素生物合成,我们分析了小麦和水稻孢粉素生物合成基因的表达ms1我们确定了这一点Tams1.表达时间早于孢粉素前体生物合成。然而,令我们惊讶的是ms1突变并不影响生物合成基因的转录水平,在这些基因以前被报道是花粉发育所必需的阶段(图。6; 附加文件3.).最近,Tams1.结果表明,与未处理的花药相比,热诱导的不育性在含有单核小孢子的花药中被上调[67].这表明Tams1.在正常条件下,TaMs1主要在花粉发育早期(减数分裂前和减数分裂前)表达,而TaMs1可能在减数分裂后发挥重要作用,位于本研究列出的生物合成基因的下游。因为Tams1的表达之前涉及孢子蛋白生物合成中涉及的基因,需要进一步的实验,以确定TAMS1蛋白本身是否持续到过分症,最后可检测到的转录表达的时间,以与这些关键的孢子蛋白生物合成基因的表达一致。重要的是,这些小麦矫形器表达的时序符合水稻中报告的。
到目前为止,小麦雄性不育突变体连接到这些水稻基因尚未确定,除了TaCYP704B[68];这可以部分可以通过嵌入小麦的allohexaploid基因组内的基因冗余来解释。然而,鉴于具有在单个转基因事件中同时产生函数损失突变体的能力的新的基因组编辑技术的出现,有可能揭示孢子蛋白生物合成所需的额外基因。
Wang et al.(2017)的最新证据表明,TaMs1 (B基因组)在异源六倍体小麦中的优势可能是由于其同源等位基因的表观遗传抑制[17].此外,植物肠酮在雄蕊和花粉发育的调节中发挥着重要作用[69].这里,我们展示TaMs1-B与同源序列相比,启动子包含几个独特的基序,与ABA响应型(AbreOrab21)和茉莉酸/乙烯响应型(GCCCORE-box)同源独联体-Elements(图。2).我们表明,Tams1.ABA表达增强(图。3.)但外源性JA处理没有,而激素IAA和GA处理没有3.透露Tams1.只对生长素敏感。重要的是,据报道生长素在雄配子体发育的早期和后期阶段都是一个关键的调控因子,在这些阶段,生长素被证明对细胞分化、细胞延伸和分裂很重要[70].另一方面,ABA建议作为导致雄性不育的潜在信号[71].确认此类的重要性独联体-Elements在微生物发生过程中激素响应信号传导需要进一步的实验。
一般认为,蛋白质运输在蛋白质功能中起着中心作用。在这里,我们鉴定了TaMs1包含两个假定的信号序列:一个n端信号肽(SP)和一个c端gpi锚定前肽(图)。7a). SP有望靶向TaMs1通过ER进行易位,允许该蛋白进入囊泡通路[72],而GPI锚点则被期望将成熟蛋白保留在质膜的细胞外侧[73].与预期的一样,通过在洋葱表皮细胞中瞬时表达TaMs1与mCherry的翻译融合,我们确定TaMs1定位于质膜(图。7C)。为了验证TAMS1的预测信号序列的运输功能,我们使用截短的TAMS1转移融合蛋白。单独的信号肽被确定诱导蛋白质分泌(图。7d).尽管TaMs1缺少gpi -锚定前肽,截断的蛋白仍然靶向于质膜,但在细胞质中也能检测到较小程度的蛋白(图)。7f).这与AtLTP1形成对比,AtLTP1尽管缺少GPI锚点,但仅在质膜上被鉴定出来[74].尽管TaMs1的gpi -锚对蛋白靶向质膜不是必需的,但它似乎对其功能至关重要。这是由一项发现所支持的MS1J.该基因包含一个将丝氨酸195转化为苯丙氨酸(S195F)的SNP,是雄性不育[参见附加文件]4] [17].重要的是,预计该残余物预计在GPI-Anchor Pro-Peptide的Omega裂解位点,并且该点突变导致潜在的C末端GPI改性位点的损失[见附加文件4].为什么TaMs1 GPI-anchor pro-peptide至关重要的蛋白质活动可以解释的独特属性GPI-anchors: (i)已经提出的功能重要性GPI锚可能与它的特征,允许更大的三维弹性蛋白在细胞表面(29].(ii)此外,与跨膜蛋白不同,这种gpi -锚定蛋白也有可能通过磷脂酶的活性从细胞表面释放出来[75].考虑到这些特性,我们可以推测TaMs1既可以从绒毡层细胞层分泌,也可以从正在发育的小孢子中分泌,并依附于每个细胞表面。在GPI-anchor被磷脂酶裂解后,TaMs1可以将孢粉素前体从绒毡层细胞表面传递到发育中的小孢子表面。在这一点上,小孢子衍生的TaMs1蛋白可能作为前体受体,因此负责胞外膜在细胞表面的局部沉积。有趣的是,在一项类似的研究中,Wang等人。,报道TaMs1定位于洋葱表皮细胞的线粒体[17].相对于我们发现的TaMs1定位于细胞表面,很明显需要进一步的实验来确定TaMs1定位在哪里在足底,特别是小麦,而不是基于洋葱表皮细胞等原始系统的解释。此外,需要通过TAMS1荧光蛋白翻译融合的脂质结合的验证,以及确定平移融合是否具有补充的能力(即恢复男性生育率)ms1突变体。
结论
在本研究中,我们试图进一步了解TaMs1在花粉外壁形成中的作用。我们的研究结果对gpi锚定的LTPs在花药发育的早期阶段的重要性提供了新的见解。我们还鉴定了水稻孢粉素生物合成基因的同源基因。TaMs1蛋白在体内的功能作用有待进一步研究,以了解该蛋白是如何控制孢粉素在小麦小孢子上的沉积。
参考文献
- 1.
Ariizumi T,Toriyama K。孢粉素合成和花粉外壁发育的遗传调控。植物生物学年鉴。2011;62:437–60.
- 2.
陈建平,李建平。雄蕊结构与功能。北京:科学出版社。植物细胞。2004;16 (5):S46-60。
- 3.
黄志明,李建平,李建平,等。开花植物花粉壁发育的研究进展。植物学报。新植醇。2007;174:483 - 98。
- 4.
Morant M,JørgensenK,Schaller H,Pinot F,MøllerBL,Werck-Reichhart D等人。CYP703是一种古代细胞色素P450在催化月桂酸的链条羟基化的土地植物中,为花粉中的孢子醇素合成提供构建块。植物细胞。2007; 19:1473-87。
- 5.
田中文,田中文,田中文等。赤霉素通过GAMYB的转录调控调控水稻花药发育。植物细胞在线。2009;21:1453-72。
- 6.
李洪波,陈建平,陈建平,等。细胞色素P450家族成员CYP704B2催化脂肪酸的羟基化,是水稻花药角质生物合成和花粉外壁形成所必需的。植物细胞。2010;22:173 - 90。
- 7.
de Azevedo SC, Kim SS, Koch S, Kienow L, Schneider K, McKim SM等。拟南芥花粉发育和孢粉素合成需要一种新型脂肪酸酰基辅酶A合成酶。植物细胞在线。2009;21:507-25。
- 8.
Shi J,Tan H,Yu X-H,Liu Y,Liang W,Ranathunge K,等。在水稻中的花药和微孔发育需要有缺陷的花粉壁,并编码脂肪酰载体蛋白质还原酶。植物细胞。2011年6月23日:2225-2246。
- 9.
Quilichini TD, Grienenberger E, Douglas CJ。花粉外壁的生物合成、组成和组装:一个难以破解的难题。植物化学,2015;113:170 - 82。
- 10.
等。关键词:gegeloge, gegeloge, gegeloge, gegeloge, gegeloge分析TETRAKETIDEα吡喃酮还原酶函数拟南芥揭示了一个未知的,但保守的,在孢粉素单体生物合成的生化途径。植物细胞。2010;22:4067 - 83。
- 11.
甘蓝型油菜(Brassica napus)和拟南芥(Arabidopsis thaliana) A6基因编码的花药特异性蛋白与β -1,3-葡聚糖酶具有相似性。植物j . 1993; 4:1023-33。
- 12.
万磊,查伟,程旭,刘超,吕磊,刘超,等。一个水稻β-1,3-葡聚糖酶基因Osg1是花粉发育过程中胼胝质降解所必需的。足底。2011;233:309-23。
- 13.
秦p,ub,王y,deng l,quilichini td,li t等。ABCG15编码ABC转运蛋白,对大米后减数分裂症的花药和花粉外来发育至关重要。植物细胞生理。2013; 54:138-54。
- 14.
张DS,梁WQ,袁Z,李恩,施j,王杰等。Tapetum变性延迟对于水稻花粉发育过程中的脂族代谢和基因调节至关重要。莫尔植物。2008; 1:599-610。
- 15.
黄明德,陈廷立,黄宏昌。拟南芥绒毡层中丰富的III型脂质转运蛋白被分泌到子房室,成为花粉外壁的组成部分。植物杂志。2013;163:1218-29。
- 16.
Tucker EJ, Baumann U, Kouidri A, Suchecki R, Baes M, Garcia M,等。小麦雄性育性基因Ms1的分子鉴定及其杂种育种前景。Nat Commun。2017;8:869。
- 17.
王智,李军,陈松,恒勇,陈智,杨军,等。Poaceae-specificMS1在面包小麦中编码磷脂结合蛋白。PROC NATL ACAD SCI。2017; 114:12614-619。
- 18.
关键词:胡萝卜,脂质转移蛋白,EP2,细胞特异性表达植物细胞。1991;3:907-21。
- 19.
关键词:小麦,抗真菌,脂质转移蛋白,抗真菌活性植物生理学。2008;46:918-27。
- 20。
Maldonado AM, Doerner P, Dixon RA, Lamb CJ, Cameron RK。一种公认的脂质转移蛋白,参与系统抗性信号转导拟南芥.大自然。2002;419年9月:399 - 403。
- 21。
关键词:诱导抗性,诱导抗性,缺陷蛋白,结构拟南芥DIR1揭示了一种新的脂质转移蛋白。蛋白质Sci 2008; 17:1522 - 1530。
- 22。
Sossountzov L, ruez - avila L, Vignols F, Jolliot A, Arondel V, Tchang F,等。玉米脂质转移蛋白基因的时空表达。植物细胞。1991;3:923-33。
- 23。
Park SY, Jauh GY, Mollet JC, Eckard KJ, Nothnagel EA, wall LL等。百合花粉管与离体花柱基质的粘附需要一种脂质转移样蛋白。植物细胞。2000;12:151 - 64。
- 24。
就JC。蛋白质和细胞内脂质的交换。生物化学与生物物理学报。1975;380:31-44
- 25。
申德,李志义,黄基,Kyu Kim K, Suh SW。玉米幼苗非特异性脂质转移蛋白的高分辨率晶体结构。结构。1995;3:189 - 99。
- 26。
Gomar J,Petit MC,Sodano P,Sy D,Marion D,Kader JC等。从玉米种子中提取的非特异性脂质转移蛋白的溶液结构和脂质结合。蛋白质SCI。1996年; 5:565-77。
- 27。
José-Estanyol M, Gomis-Rüth FX, Puigdomènech P. 8 -半胱氨酸基序,植物蛋白中的一种多功能结构。植物生理学。2004;42:355-65。
- 28.
Zachowski A, Guerbette F, Grosbois M, Jolliot-Croquin A, Kader JC。植物脂质转移蛋白与酰基结合的特性。欧洲生物化学杂志1998;257:443-8。
- 29.
Paulick Mg,Bertozzi Cr。糖基膦酸酐肌醇锚固:复合膜锚定。生物学习。2008; 47:6991-7000。
- 30.
魏克,钟X.玉米非特异性脂质转移蛋白。BMC植物BIOL。2014; 14:281。
- 31.
Boutrot F,Chantret N,Gautier M-F。基因组分析水稻和拟南芥的非特异性脂质转移蛋白(NSLTP)基因家族及EST数据挖掘鉴定小麦NSLTP基因。BMC基因组学。2008; 9:86。
- 32.
EDSTAM mm,viitanen l,salminen ta,Edqvist J.非特异性脂质转移蛋白的进化史。莫尔植物。2011; 4:947-64。
- 33.
Sasakuma T、Maan SS、Williams和。EMS诱导小麦雄性不育突变体的研究。作物科学。1978;18:850.
- 34.
伯顿RA。大麦CesA基因家族。转录本的定量分析显示了两组共同表达的基因。植物杂志。2004;134:224-36。
- 35.
农杆菌介导的大麦转化(大麦芽l .)。中国生物医学工程学报,2014;
- 36.
植物顺式作用调控DNA元件(PLACE)数据库:1999。核酸研究1999;27:297-300。
- 37.
国际小麦基因组测序联盟。利用完全注释的参考基因组改变小麦研究和育种的限制。科学。2018;361:eaar7191。
- 38.
Trapnell C, Williams BA, Pertea G, Mortazavi A, Kwan G, Van Baren MJ等。转录本组装和定量的RNA-Seq揭示了在细胞分化过程中未注释的转录本和亚型转换。生物科技Nat》。2010;28:511-5。
- 39.
蛋白质功能预测。方法:中华医学杂志。2017;1611:59-73。
- 40
关键词:植物蛋白,糖基磷脂酰肌醇,脂质锚定拟南芥和水稻全序列和全基因组研究的敏感预测。植物杂志。2003;133:1691 - 701。
- 41.
PredGPI:一个gpi锚预测器。BMC生物信息学。2008;9:392。
- 42.
Fankhauser N,Mäser P。用Kohonen自组织映射识别GPI锚定信号。生物信息学。2005;21:1846–52.
- 43.
陈敏华,陈敏华,陈敏华,陈敏华。利用sirna在水稻叶片和茎源原生质体中进行基因沉默的新系统。工厂方法。2006;13。
- 44。
关键词:CRISPR/Cas,水稻,小麦,基因组编辑Nat Protoc。2014;9:2395 - 410。
- 45。
拟南芥减数分裂后径向微管阵列的不稳定诱导产生二倍体雄配子。植物杂志。2012;160:1808-26。
- 46。
周DX。gt元件和gt因子对植物基因转录的调控机制。植物科学,1999;4:10 - 10。
- 47。
BUSK PK。脱落酸诱导转录的调节。植物mol biol。1998年; 37:425-35。
- 48。
Hirano K, Aya K, Hobo T, Sakakibara H, Kojima M, Shim RA,等。水稻小孢子/花粉和绒毡层中植物激素生物合成和信号基因的综合转录组分析。植物细胞生理学。2008;49:1429-50。
- 49。
关键词:水稻,花药,花粉发育,基因共表达网络植物j . 2017; 92:1076 - 91。
- 50。
jung k-h。稻米未发育的Tapetum1是早期Tapetum开发的主要调节因子。在线植物细胞。2005; 17:2705-22。
- 51。
Nelson CJ, Hegeman AD, Harms AC, Sussman先生的定量分析拟南芥用胰蛋白酶催化的质膜18O标记。分子细胞蛋白质组学。2006;5:1382-95。
- 52。
牛楠,梁伟,杨欣,金伟,Wilson ZA,胡娟,等。在水稻雄性生殖发育过程中,EAT1通过调节天冬氨酸蛋白酶促进绒毡层细胞死亡。Nat Commun。2013;4:1445。
- 53。
Ranjan R,Khurana R,Malik N,Badoni S,Parida Sk,Kapoor S等人。BHLH142调节各种代谢途径相关基因,以影响水稻花粉发育和花药裂缝。SCI REP。2017; 7:43397。
- 54。
李浩,袁志,Vizcay-Barrena G,杨超,梁伟,宗杰,等。持久绒毡层细胞1编码一种PHD-finger蛋白,该蛋白是水稻绒毡层细胞死亡和花粉发育所必需的。植物杂志。2011;156:615-30。
- 55.
王Y,林YC,如同J,Du Y,Lo C.烟草和水稻孢子素前体形成的保守代谢步骤。physiol植物。2013; 149:13-24。
- 56.
Zou T,Li S,Liu M,Wang T,Xiao Q,Chen D等。一种非典型的Strickidine Synthase Osstrl2,在水稻中的花粉壁形成中起着关键作用。SCI REP。2017; 7:6863。
- 57.
杨X,梁W,陈M,张D,赵X,史J。水稻脂肪酰辅酶A合成酶OsACOS12是绒毡层程序性细胞死亡和雄性不育所必需的。足底。2017;246:105–22.
- 58.
acta botanica botanica(云南植物研究中心),云南植物研究中心,云南植物研究中心。植物科学与技术,2015;
- 59.
上田K、吉村F、宫崎骏A、广岛H、野村基、和比科H。编码拟南芥激酶样蛋白的突变体POLLEN1基因参与水稻花粉发育。植物生理学。2013;6月162日:858–871。
- 60
Zhao G, Yi J, Yoo Y, Jin P,等。水稻糖基转移酶e1编码花粉壁形成所必需的糖基转移酶。植物杂志。2013;161:663 - 75。
- 61
yu J,Meng Z,Liang W,Behera S,Kudla J,Tucker Mr,等。Tapetum功能和花粉形成需要水稻Ca 2+结合蛋白[打开]。2016年11月172日:1772-86。
- 62
沉义,唐德,王克,王米,黄茹,罗文等。ZIP4在稻米病的同源染色体突触和交叉形成。J Cell SCI。2012; 125:2581-91。
- 63
李旭,高胜,唐勇,李玲,张峰,冯斌,等。小麦bZIP转录因子及其亲缘关系的全基因组鉴定与进化分析及花药发育相关TabZIP基因的表达谱分析BMC基因组学。2015;16:976。
- 64
周某,王义,李文,赵Z,任y,王y等。花粉半菌液1编码了对雄性大小症,花药裂开和水稻生育率重要的Kinesin-1样蛋白。植物细胞。2011; 23:111-29。
- 65.
常震,陈震,王宁,谢刚,陆军,闫伟,等。利用核雄性不育基因构建杂交水稻雄性不育系及制种。国家科学院学报2016;113:14145-150。
- 66.
张Y,Butelli e,Martin C.工业植物中的花青素生物合成。CurrOp植物BIOL。2014; 19:81-90。
- 67.
王杰,李超,乔璐,王鑫,李娟,等。高温诱导小麦雄性不育花药中碳水化合物代谢和孢粉素主要相关基因的表型特征及表达模式分析(Triticum Aestivum.).农作物牧场sci。2018; 69 CSIRO出版:469-478。
- 68。
Singh M, Kumar M, Thilges K, Cho MJ, Cigan AM。MS26/CYP704B在面包小麦花药和花粉壁发育中是必需的(Triticum Aestivum.同时结合所有三个同源基因的突变导致雄性不育。《公共科学图书馆•综合》。2017;12:1-16。
- 69。
钱德勒JW。花发育的激素调节。植物生长学报2011;30:42 - 54。
- 70.
植物生长素在生殖发育过程中的活性。冷泉Harb展望生物。2009;1:1-15。
- 71.
Kovaleva LV,Voronkov As。ABA和IAA控制豆类杂交菌L.原生质的微孢子发生。2017; 255(3):751-9。
- 72.
von heijne g.信号肽。J Membr Biol。1990; 115:195-201。
- 73.
Debono A、Yeats TH、Rose JKC、Bird D、Jetter R、Kunst L等。拟南芥LTPG是一种糖基磷脂酰肌醇锚定的脂质转移蛋白,是脂质输出到植物表面所必需的。植物细胞。2009;4月21日:1230–1238。
- 74。
Potocka I, Baldwin TC, Kurczynska EU。拟南芥体细胞胚胎发生中与形态发生事件相关的脂质转移蛋白1 (LTP1)表位的分布植物细胞代表2012;31:2031-45。
- 75。
链接本文:Müller A, Klöppel C, wang J, wang J, wang J . phosplipase Selective and程化cloning of GPI-anchored protein from the surface membrane . biochem bioophys Acta bioembr . 1818;2012: 113 - 116。
致谢
我们感谢,贵族华纳和袁李为技术援助,Gwen Mayo博士(阿德莱德显微镜)对于微观辅助,Ursula Langridge博士为Plasshouse Management,玛格丽特Pallotta为项目建议提供帮助,以及Nathan S. Watson博士 -Haigh和Juan Carlos Sanchez为他们的生物信息学援助。我们感谢杜邦先锋Hi-Bred International Inc.和阿德莱德大学提供的支持。
资金
这项研究得到了杜邦先锋HieldInternational Inc.和阿得雷德大学的支持。
数据和材料的可用性
本研究中使用和/或分析的数据集可在合理要求下从通讯作者处获得。
作者信息
隶属关系
贡献
AK设计并进行了实验,分析了数据并起草了手稿。RW和UB构思了这个项目,协助数据分析和修改手稿。MB辅助克隆载体和数据分析。ET辅助项目构思和qRT-PCR实验。对胼胝质染色实验进行分析。所有的作者都为修改手稿作了贡献。所有作者都阅读并批准了最后的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者们宣称他们没有相互竞争的利益。
出版商的注意事项
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
附加文件
额外的文件1:
用于QRT-PCR的引物。(DOCX 15 KB)
附加文件2:
野生型和野生型在减数分裂过程中胼胝质沉积MS1D.突变体花药。取含减数细胞(mei)、二分体、四分体花药,用苯胺蓝染色。WT(上)MS1D.(底部)显示了每个阶段的样品。右图显示四分体小孢子经历胼胝质壁降解并转变为单核小孢子。顶部为胼胝质染色图像,底部为同一四分体小孢子的DIC图像。所有面板中的钢筋 = 50 μm(文件163 kb)
附加文件3:
报告的选定基因列表是在水稻中进行男性生育所需的。(DOCX 20 KB)
附加文件4:
MS1J.导致潜在的GPI改性位点丢失。测试TAMS1和TAMS1J肽序列使用大PI植物预测器预测潜在的GPI改性位点(Eisenhaber等,2003)。(DOCX 15 KB)
权利和权限
开放获取本文根据知识共享署名4.0国际许可的条款分发(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介中不受限制地使用、分发和复制,只要您给予原作者和来源适当的信任,提供知识共享许可的链接,并说明是否有更改。“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用本文
Kouidri,A.,Baumann,U.,Okada,T.等。小麦TaMs1是一种糖基磷脂酰肌醇锚定的脂质转移蛋白,是花粉发育所必需的。BMC植物杂志18日,332(2018)。https://doi.org/10.1186/s12870-018-1557-1
收到了:
接受:
发表:
关键词
- 小麦
- LTP
- 糖基磷脂酰肌醇锚定脂质转移蛋白
- 孢粉素
- 花粉外膜
- 雄性不育