摘要
背景
植物胱抑素(PhyCys)作为半胱氨酸蛋白酶(CysProt)的内源性调节因子参与多种生理过程。此外,PhyCys参与了植物对干旱或黑暗等非生物胁迫的反应,并被用作有效的分子对抗不同的害虫和病原体。大麦PhyCys-CysProt系统被认为是蛋白酶抑制剂调节蛋白质周转的模型。13种大麦胱抑素(HvCPI-1到HvCPI-13)已经被鉴定和表征。其中HvCPI-2已经被证明在植物对病原体和害虫的反应以及植物对干旱的反应中具有相关的作用。
结果
目前的工作探索了这种大麦PhyCys在响应生物和非生物胁迫中的多重作用,重点是沉默该基因的影响。Hvicy-2沉默系对植物病原真菌的表现不同Magnaporthe oryzae以及光剥夺治疗。的诱导表达Hvicy-2真菌胁迫与较高的沉默敏感性相关Hvicy-2植物。相比之下,表示的减少Hvicy-2在Compeopsin-L和-B类似的沉默中Hvicy-2植株对光剥夺的反应与对照植株无明显的表型差异。
结论
这些结果突出了PhyCys对不同外部提示的响应的特异性,以及导致对特定胁迫响应的调节事件的复杂性。这些应激反应的调控机制似乎集中在维持CysProt和PhyCys水平的平衡,这对于调节生物或非生物胁迫诱导的生理过程至关重要。
背景
在植物蛋白酶抑制剂中,被称为植物胱抑素(PhyCys)的半胱氨酸蛋白酶(CysProt)抑制剂由于参与许多生理过程而被广泛研究。PhyCys在基因组和结构水平上的复杂性,具有多个成员和特定的表达模式,以及与CysProt的亲和,表明了功能的巨大多样性[1那2那3.那4.].Phycys在许多生理过程中作为蛋白质周转的内源调节剂,如植物生长和发育,成熟,积累和动员储存蛋白,以及编程的细胞死亡,[2那5.那6.那7.].PhyCys也参与了植物对干旱或黑暗等非生物胁迫的反应[5.那8.那9.那10那11那12那13那14]和衰老过程[15].它们已经被证明在缺水的情况下被上调了[16那17那18那19],但相反地,在干旱胁迫后,它们的表达也有所减少[14那20.].在转基因增强抗旱能力拟南芥蒂利亚纳那大豆和马吕斯有明显由于PhyCys的过表达,植物已被报道[21那22].Phycys响应其他非生物胁迫,如极端的温度和它们的过表达使植物更容易耐受[23那24].同样,两种胱抑素AtCYSa和AtCYSb的过表达增加了拟南芥对干旱、盐胁迫、寒冷和氧化胁迫等非生物胁迫组合的抗性[9.].
PhyCys超科是研究最多的植物诱导防御之一,PhyCys已被用作有效的分子对抗不同的害虫和病原体[25那26那27那28那29那30.那31].重组PhyCys已经显示出抑制由许多食草动物消化蛋白酶的活性,影响其发育和繁殖当害虫在含有重组PhyCys人工饲料或在转基因植物中过表达基因PhyCys [喂3.那4.].同样,一些出版物报道了真菌感染介导的植物中PhyCys的诱导[32那33].重组PhyCys已经能够影响一些植物病原真菌的体外生长[34那35].转基因方法也有助于理解植物过度表达或沉默PhyCys基因是如何应对病原体攻击的。沉默cystatin-9基因的玉米植株的侵染率降低黑粉菌属maydis,表明该PhyCys通过抑制质外体半胱氨酸蛋白酶抑制宿主免疫[32].相反,过度表达胱抑素TaMDC1的番茄植株表现出较高的抗性alternaria alternata.和高架容忍反对灰霉病[36].虽然PhyCys抑制真菌生长的机制尚未阐明,但它被认为与抑制真菌半胱氨酸蛋白酶有关[37那38那39但它也可能影响真菌膜的渗透性[40].此外,PHYCYS可以作为植物中重组蛋白质产生的稳定融合伙伴[41那42那43].
大麦(大麦芽鉴于其Cysprot和Phycys家庭的全面了解,鉴于其Cysprot和Phycys家庭的综合了解,代表了一种良好的模型,研究胱抑素对生物和非生物胁迫的反应。在以前的作用中,已经鉴定了13个胱抑素(HVCPI-1至HVCPI-13)并表征[1那2].它们在应对非生物胁迫、防御生物胁迫以及参与植物内源过程中发挥作用。它们对害虫的防御功能是由它们利用非自然饮食或稳定转化大麦PhyCys基因的植物抑制昆虫和螨消化蛋白酶活性的能力所决定的[4.那28那29那30.那44].来自大麦的三种半胱抑素(HvCPI-1、HvCPI-2和HvCPI-6)和突变变体HvCPI-1 C68→G已经在大麦、拟南芥、土豆、番茄和玉米中转基因表达,以确定它们如何影响昆虫和螨的性能[28那29那45那46].然而,关于在体大麦PhyCys对病原菌的影响,人们所知甚少。从大麦中提取的HvCPI-6抑制了一些植物病原真菌的体外生长,包括Magnaporthe oryzae但是,与未转化的植物相比,表达这种Phycys的拟南芥植物表现出真菌和细菌抗性水平的差异[47].另一方面,大麦胱抑素家族成员在非生物胁迫响应中的参与与调节内源性蛋白酶降解活性的特定作用有关[12那48].黑暗诱导大麦PhyCys HvCPI-3-6和8-9的表达[12]、HvCPI-2和HvCPI-4在大麦叶片中水分剥夺后表达量最高[48].
HVCPI-2已被证明在植物对生物应激的反应中具有相关的作用,因为我们本集团的早期工作表现出对一些植物致病真菌的真菌生长的体外抑制m . oryzae[47]以及几种植食性节肢动物组织蛋白酶L-和b -样活性的体外抑制活性[4.].此外,最近的研究报道,番茄植株过度表达这种胱抑素影响鳞翅虫的表现Tuta absoluta[45].Hvicy-2基因在黑暗和干旱等非生物胁迫下也被分析过。而Hvicy-2基因被显着干旱条件[下上调48]在光剥夺处理后没有观察到差异[12].在沉默的hvpi -2株系中也观察到在生长初期对干旱的耐受性增强,以及在植物生命周期的最后阶段保持绿色的表型[48].为了进一步探讨该大麦PhyCys在生物和非生物胁迫下的多重作用及其对半胱氨酸蛋白酶-蛋白酶抑制剂系统的影响,我们在本工作中分析了其表型和分子响应Hvicy-2沉默线真菌应力或到光剥夺治疗。
结果
的表达Hvicy-2是在响应诱导子和m . oryzae治疗方法
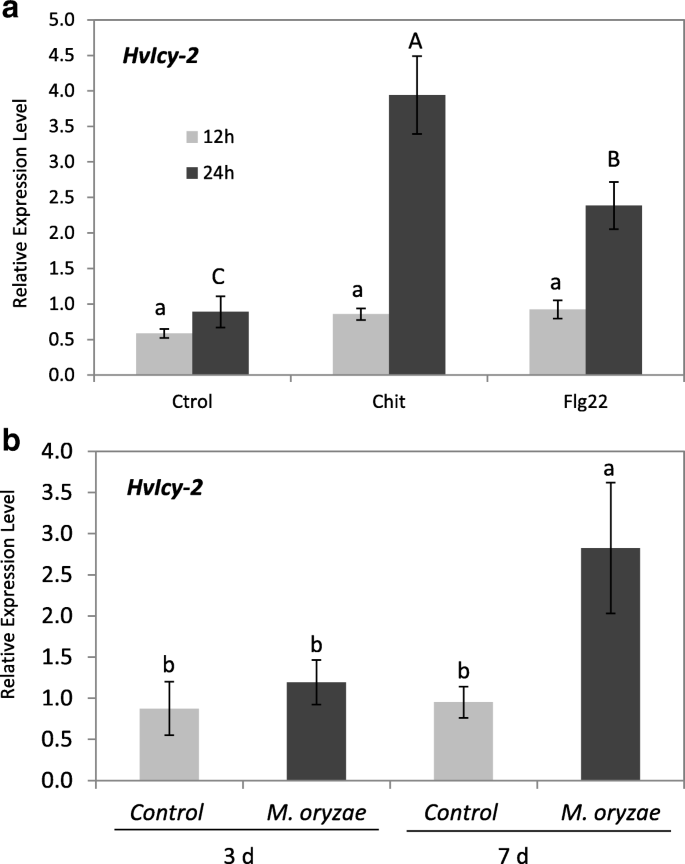
对一些植物病原真菌生长的体外抑制作用m . oryzae指出HvCPI-2在植物对病原体反应中的相关作用,[47].要检查的表达Hvicy-2在生物胁迫下被上调,已知的激活植物对细菌和真菌的防御机制的激发子被选择[49].在细菌应答处理中,检测了细菌鞭毛蛋白保守n端22氨基酸序列的激发子flg22。对于真菌的反应,也尝试了激发子壳聚糖,真菌的细胞壁结构元件的作用。通过mRNA定量分析,确定其表达模式Hvicy-2对激发子处理的反应进行了分析,并进行了分子表征(图。1这些结果表明Hvicy-2flg22和壳聚糖处理24 h后,在处理过的叶片样品中显著诱导了基因的表达。1一种)。数据表达为MRNA水平标准化为还有大麦中的基因组成活性。
两种诱导子都诱导表达Hvicy-2壳聚糖处理后观察基因,和最高水平,因此,未来的做法是评估真菌病原体的影响,m . oryzae在处理大麦叶。结果在3 dpi的但后7 DPI的显示没有差异m . oryzae感染的Hvicy-2基因显著上调(图。1b)。
大麦中的表达Hvicy-2基因表现不同m . oryzae或黑暗胁迫沉默KD Icy2系
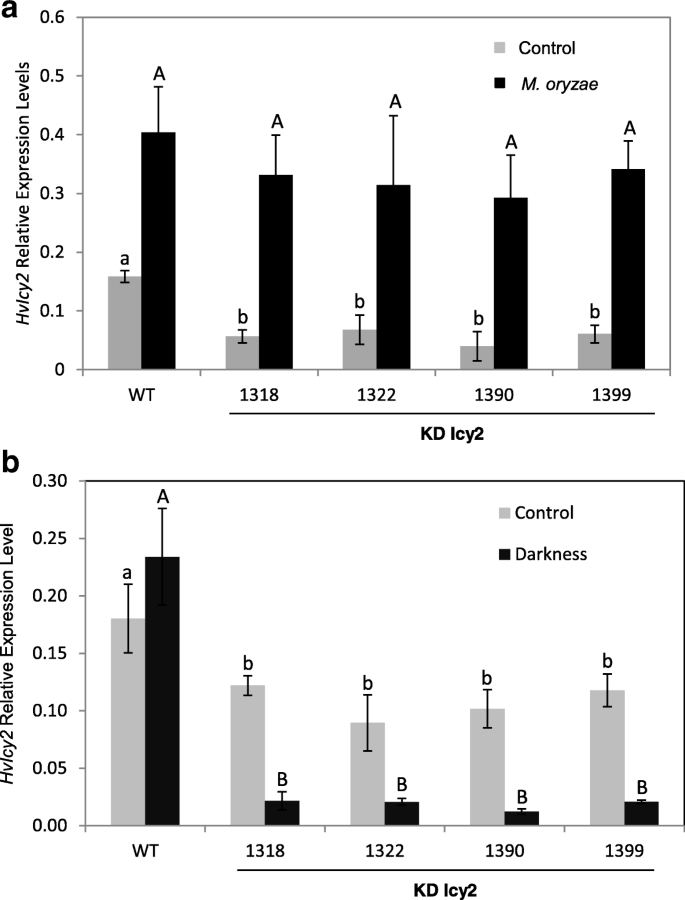
纯合的大麦植物沉默Hvicy-2基因(KD Icy 1318、1322、1390和1399系)已被用于进行体内实验,以测试转基因植物对干旱的响应[50].了解如何表达Hvicy-2变化响应不同的非生物或生物的压力,相同的KD Icy2系用于测量信使Hvicy-2水平在m . oryzae黑暗或治疗。
在图中。2它可以观察到明显的归纳法Hvicy-2基因后m . oryzae感染Hvicy-2与对照条件相比,使大麦株系和野生型植株沉默。然而,在光剥夺之后,Hvicy-2基因在转基因系,而不是增加是下调比较控制条件和比较WT,其中没有观察到差异显著(图2b)。
转基因大麦Hvicy-2沉默系表现出表型差异m . oryzae感染
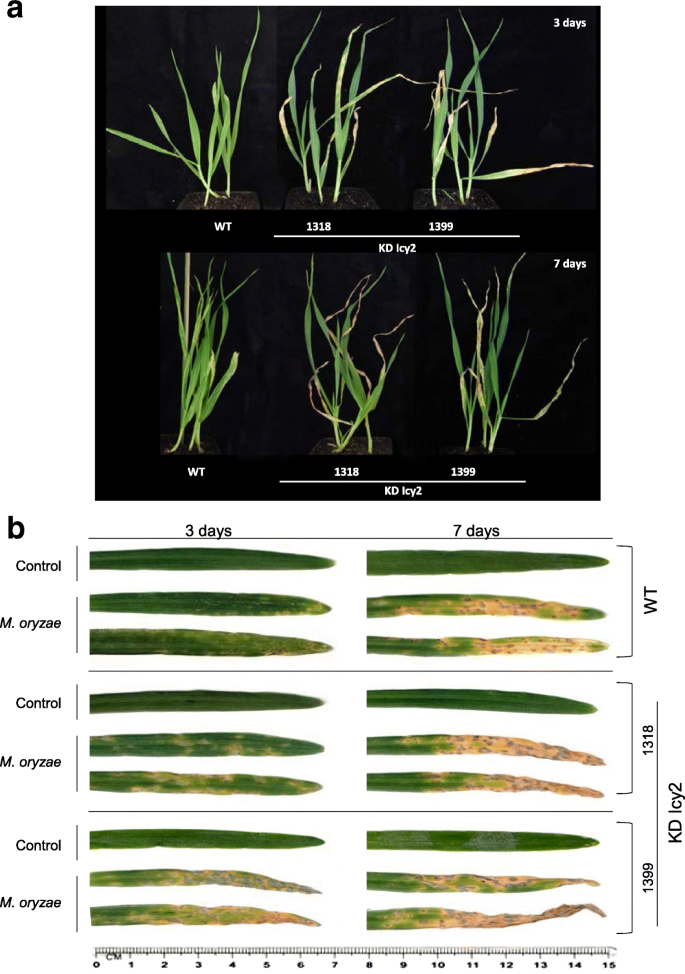
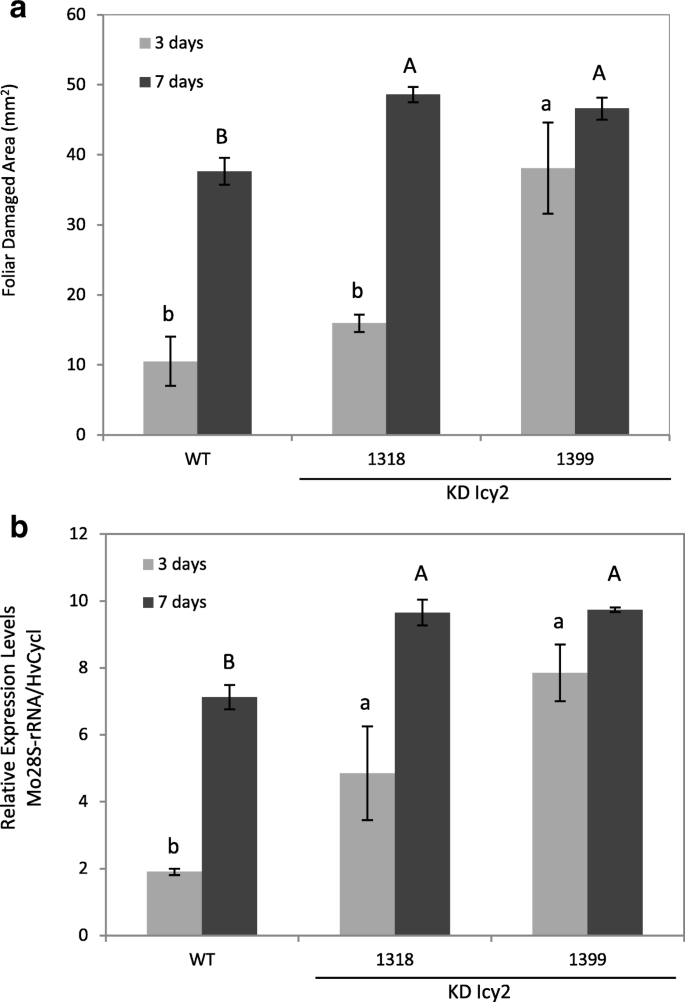
Hvicy-2似乎在植物对m . oryzae由于感染治疗后上调。因此,KD ICY2大麦植物用于测试改性植物对在体内实验中进行这种真菌的攻击的抗性或脆弱性。野生型和转基因植物的行为比较真菌感染后,参与Hvicy-2基因的反应m . oryzae分析了(图。3.A-B)。在叶中观察到了来自不同于控制条件下生长的感染的植物进一步的损害,如被预期(图3.b).此外,KD型Icy2株系的叶片在侵染3 d后,比野生型(WT)大麦植株表现出更高的损伤(图2)。3.b).随后,在第7天m . oryzae攻击更明显是KD ICY2植物的最高脆弱性(图。3.b).全植物图像突出显示WT植物受损症状减轻,与KD Icy2植物相比,WT植物更不容易受到真菌的影响(图2)。3.一种)。在图中。4.a对WT和转基因侵染品系侵染后的叶面积进行量化,比较总侵染面积。这些结果支持了之前的观察结果。WT植物,特别是在7天m . oryzae感染,呈现比KD Icy2植物显著受伤较轻叶面面积。
定量测定了转化(KD Icy2 1318和1399)和未转化(WT)大麦植株在3(浅灰色)和7(深灰色)d后的叶片损伤情况m . oryzae感染(一个).损伤测量为mm2受伤的叶面区域,并表示为七个旧叶片的平均值±SE从七个独立植物的每次治疗中测量。转基因大麦线沉默的影响HvIcy2基因(KD Icy2 1318和1399)与野生型(WT)的比较m . oryzae性能(b).量化的m . oryzae核糖体RNA的小亚基(Mo28S-rRNA) mRNA的表达水平,在3(浅灰色)和7(深灰色)天后m . oryzae感染。染病后提取总RNA,数据以mRNA水平归一化后的大麦嗜环素mRNA含量表示。不同字母间差异显著(P < 0.01,单因素方差分析学生纽曼- keuls检验)
的存在m . oryzae通过测量真菌核糖体RNA小亚基的mRNA水平(Mo28S-rRNA),以分析转基因大麦植株对真菌行为的影响(图。4.b).在侵染的第3天和第7天,KD Icy2大麦株系中检测到的真菌mRNA量显著增加,这证实了这些植物仍然更加脆弱m . oryzae比WT植物。
转基因大麦Hvicy-2消沉线在轻剥夺后显示出小的生化差异
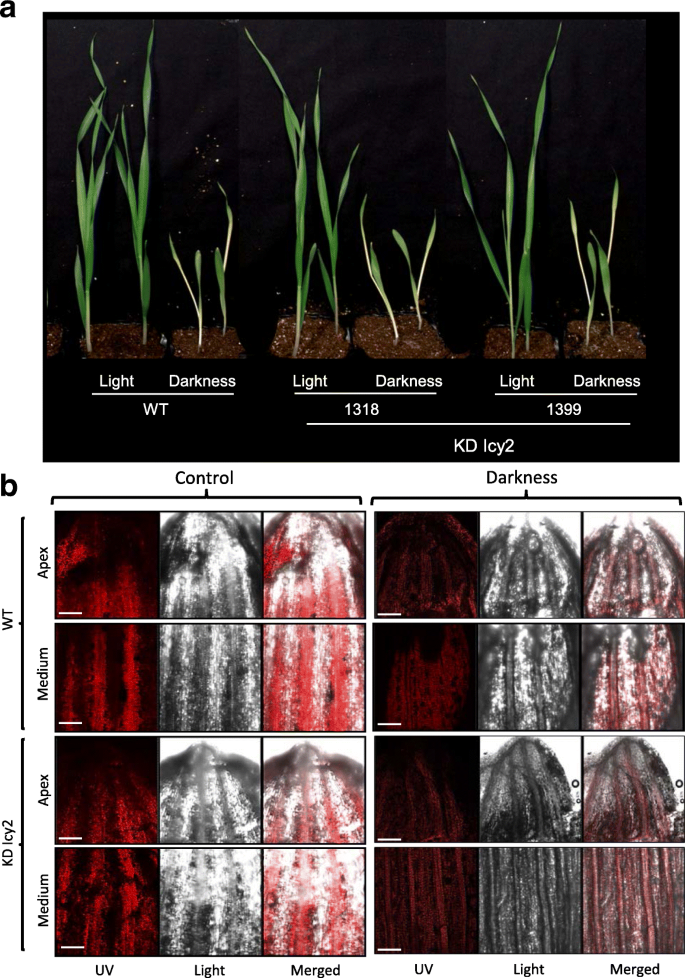
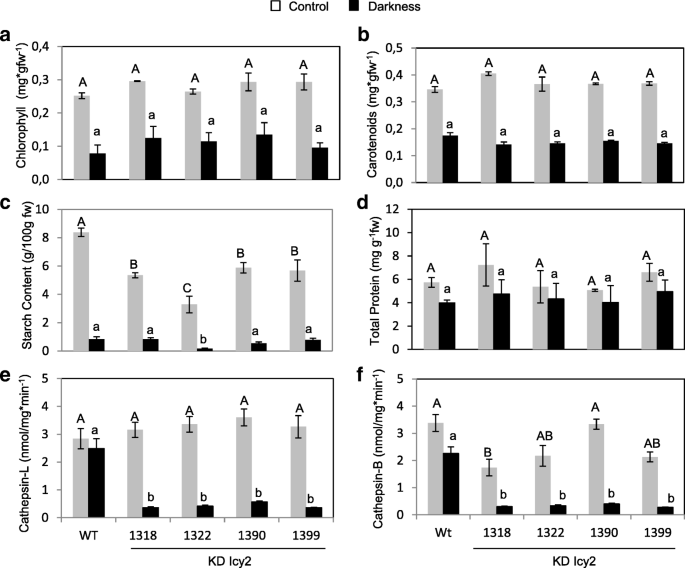
一旦证实了Hvicy-2在对生物胁迫的反应中,我们决定进一步分析其后果Hvicy-2黑暗治疗后镇压。After 14 days of darkness treatment, no phenotypical differences were observed in KD Icy2 silencing barley lines compared to WT (Fig.5.一种)。通过在共聚焦显微镜下检测其自荧光来观察最旧叶片的叶绿素含量(图。5.b).在对照条件下,转基因和野生型植物叶片的中间段叶绿素荧光均最高。与WT相比,在黑暗条件下,KD Icy2系的顶端和培养基中也检测到类似的荧光发射。在控制或黑暗处理下的明亮田野中观察到的叶组织结构也发现了类似的模式(图)。5.b).与对照条件相比,黑暗14天后,植物的整个空中生物量的光合色素也进行了分析。然而,转基因和WT样品之间并没有检测到显著差异(图2)。6.与野生型相比,KD型Icy2植株的叶绿素含量与野生型相似,所有光胁迫植株的叶绿素总量均有所减少(图2)。6.一种)。该结果支持叶绿素自动荧光观察结果(图。5.b)。为了定量类胡萝卜素,在所有线中发现类似的结果(图。6.b).测定叶片淀粉和蛋白质含量(图。6.c和d)。与预期一样,所有14天的黑暗处理均显著降低了淀粉积累。虽然在光周期下生长的KD Icy2转基因叶片的淀粉含量显著低于野生型叶片,但在黑暗条件下转基因叶片与野生型叶片的淀粉含量没有显著差异(图2)。6.C)。不同的,在在光周期或脱脂条件下生长时,在KD ICY2线和非转基因中没有发现蛋白质含量的显着差异(图。6.d).最后,利用特定底物,测定在黑暗或对照条件下生长的KD Icy2和WT植物的组织蛋白酶L-和b -样蛋白水解活性。在光照条件下,转基因植株与野生型植株的组织蛋白酶L-like活性无显著差异(图2)。6.e)。好奇地,在黑暗条件下,与WT植物相比,KD ICY2线的表达素L样活性显着降低(图。6.e).对比数据来自于对组织蛋白酶b样活性的分析。6.F)。
光合色素、叶绿素(一个)及类胡萝卜素(b),即每克初始鲜重所含色素的毫克数。淀粉含量(c),即每100克鲜重所含转化淀粉的克数。总蛋白质含量(d)是指每克初始鲜重所含总可溶性蛋白的毫克数。由组织蛋白酶L/F-like降解的特定底物的蛋白水解活性(e)及B-like (f).HvIcy2沉默(KD ICY2:1318,1322,1390,1399线)和野生型(WT)大麦植物在持续暗度下或16小时H / 8 H Photopheriod的土壤中生长14天。数据是至少三个独立分析的平均值±标准误差。不同的字母表示行之间的显著差异。(P< 0.05,先进行单因素方差分析,再进行学生Newman-Keuls检验)
对不同应力的反应显示分子改变在转录水平上具有引人注目的补偿效应
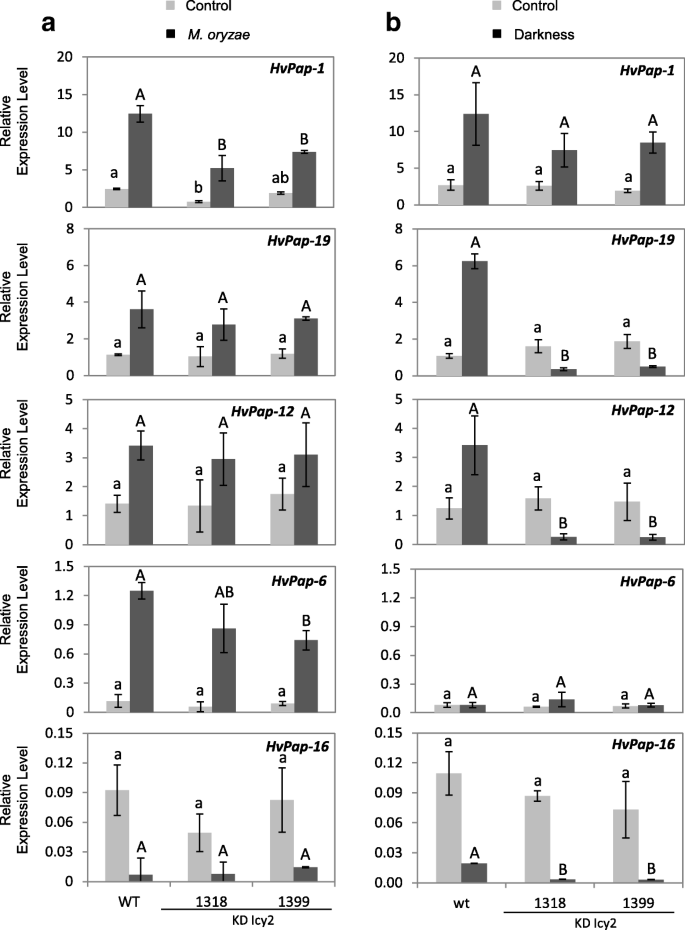
pHycys的转录物含量的变化可能对其蛋白酶靶标的表达有影响[48那50].采用RT-qPCR分析了不同C1A亚群(F-、L-、H-、b -样组织蛋白酶)的CysProt的表达模式m . oryzae攻击或光剥夺处理(图。7.).成绩单HvPap-1CysProt基因植物强调独立于治疗的增加,m . oryzae感染或黑暗中,用HvPap-1WT的水平高于Icy2后的KDm . oryzae治疗(图。7.).相似地,HvPap-19那HvPap-12和HvPap-6CysProt基因后增加m . oryzae在野生型和KD型Icy2植株上的感染(图。7.a)然而,经过光剥夺治疗后,HvPap-19和HvPap-12与控制条件和表达相比,在KD ICY2中,基因在野生型和下调中调节。HvPap-6在任何线中脱剥性处理后,基因没有变化(图。7.A和B)。HvPap-16在胁迫处理后显示出类似的表达模式,在KD ICY2系中的暗度之后大于野生型在黑暗之后更大(图。7.b)。基于这些结果,对不同应力处理的植物反应的可变性可能使得响应中涉及的Cysprot基因的特异性提高了对蛋白水解相关蛋白的补偿效应在通过植物的表达的改变引起的转录水平。
C1A CysProt基因的信使表达量(−19、−12、−6和 − 16)转基因HvIcy2用RT-qPCR方法检测了不同株系(KD Icy2, 1318和1399)和野生型(WT)大麦植株。(一个) 7 d后提取叶片总RNAm . oryzae感染(深灰色)和非感染的叶片(浅灰色)。(b)在连续暗度(深灰色)或16h / 8h光周期(浅灰色)下,从WT和KD ICY2大麦植物中从WT和KD ICY2大麦植物中提取的总RNA,或者用16h / 8h光灰度)14天。数据表达为对大麦的C1A CySprot基因的mRNA水平还有信使rna的内容。数据是至少三个独立分析的平均值±标准误差。不同的字母表示行之间的显著差异。(P< 0.05,先进行单因素方差分析,再进行学生Newman-Keuls检验)
讨论
半胱氨酸蛋白酶抑制剂家族成员在生物和非生物胁迫响应的参与已被广泛描述3.].它们的参与涉及到一个精确的调控,其中蛋白酶抑制剂有一个特定的作用,调节内源性蛋白酶以及害虫或病原体蛋白酶的降解活性。然而,单个胱抑素在几种应激中的作用的相关性还没有被方便地解决。基于之前的研究结果表明其参与了对生物和非生物胁迫的响应,我们选择了大麦HvCPI-2胱抑素,以进一步探索胱抑素对多种威胁的功能作用[51].本课题组早期的研究显示HvCPI-2对几种植食性节肢动物组织蛋白酶L-和b -样活性的体外抑制活性[4.]以及体外抑制一些植物致病真菌的真菌生长m . oryzae[47].报道了真菌感染介导的植物中Phycys的诱导[33那52,重组PhyCys已经能够在体外影响一些植物病原真菌的生长[35那40,强调了PhyCys在应对病原体方面的重要性。同样的,转录诱导Hvicy-2在诱导子和m . oryzae治疗的进一步支持HvCPI-2的抗病原体侵袭的保护作用。据此,转基因大麦Hvicy-2沉默线保持到真菌攻击比野生型线更敏感。虽然Hvicy-2在真菌治疗后,表达在与野生型相比的转基因系中没有显着差异,我们仍然发现沉默的真菌感染植物中的叶子面积损伤的一些增加。这可能是由于减少表达Hvicy-2转基因株系在感染前的基因足以较少地保护受真菌攻击的植物。换句话说,较低的水平Hvicy-2转基因株系中的基因是这些植物对真菌攻击敏感性较高的原因。即使植株在受到攻击后试图过度表达该基因,其时间和数量都不足以在野生型植株的同等水平上得到保护。因此,我们建议Hvicy-2可能有保护真菌的作用。我们的结果与[36]显示出高度抗性答:alternata和高架容忍反对b .灰质在番茄植株中过度表达胱抑素TaMDC1。相反,[52通过沉默cystatin-9基因的转基因植物观察到感染减少美国maydis,但他们认为该PhyCys通过抑制质外体半胱氨酸蛋白酶抑制宿主免疫。除了这种特殊的physys - cysprot相互作用外,关于胱抑素基因修饰表达改变植物抗性/敏感性的生理机制还知之甚少。我们应该考虑两个假设。第一个是胱抑素对病原体的直接毒性作用。PhyCys抑制真菌生长的机制尚未阐明。一些作者指出了对真菌半胱氨酸蛋白酶的直接抑制。来自芋头和苋菜的重组胱抑素抑制真菌生长的活性与部分抑制真菌菌丝体的半胱氨酸蛋白酶活性有关[37那38那39].与此相反,其他研究表明,大麦和芝麻半胱氨酸蛋白酶抑制活性不足的半胱氨酸抑制素变异株对几种植物病原真菌的菌丝生长或孢子萌发具有相当的抑制能力。这表明了另一种作用机制,可能与真菌膜通透性的变化有关[40那53].第二种假说被观察到的由基因修饰引发的转录重编程所支持。大麦植株过度表达Hvicy-6.基因在光合作用相关基因的表达上有下调,这表明一种加速防御反应的启动状态[46].此外,番茄植株过度表达Hvicy-2表现出番茄伤口诱导的丝氨酸蛋白酶抑制剂的更高表达(PIN2.) [45].在任何情况下,需要做进一步的研究需要了解如何植物过表达或病原体沉默PhyCys基因攻击作出响应。Hvicy-2在非生物胁迫下也对基因进行了分析。而Hvicy-2基因被显着干旱条件[下上调48]在光剥夺处理后没有观察到差异[12].然而,无反应的表达模式并不意味着生理作用的缺失。为了阐明HvCPI-2活性是否影响黑暗反应,沉默Hvicy-2植物是一个关键工具。有趣的是Hvicy-2暗处理后沉默线减少,但较低Hvicy-2表达伴随组织蛋白酶活性的下降。此外,这些变化没有转化为生化或表型差异。这种惊人的行为可能是由于PhyCys表达的转录重编程来补偿Hvicy-2沉默。大多数对非生物胁迫的反应是直接抑制植物蛋白酶靶点的结果[13,不同的PhyCys可能参与这种抑制。例如,大麦PhyCys的表达HvIcy3 - 6和8-9被黑暗引起的[12),Hvicy-2在一起Hvicy-4.显示出最高的表达水平在大麦叶水剥夺[后48].相互补偿式Hvicy-2和Hvicy-4.缺水后沉默系的基因支持这两种胱抑素的合作作用[48].同样,PhyCys表达的转录变化可能伴随着其CysProt靶标表达的转录变化。事实上,黑暗对转录水平有相反的影响HvPap-12和-19年发现控制和沉默的线之间。这种效果可以部分解释由沉默显示的较低的组织蛋白酶活动Hvicy-2结果表明,对不同胁迫的反应伴随着分子改变,在转录水平上具有显著的补偿效应。
结论
在这项研究中,已经表明了转基因大麦Hvicy-2沉默线执行下生物或非生物应力不同。结果突出PhyCys在应对多样化的外部提示的特殊性以及与监管事件导致响应特别强调的复杂性。Hvicy-2沉默线不仅对生物或非生物应激的差异差异,而且对抗两种非生物胁迫,如干旱和脱剥。这些压力反应的调节机制似乎集中在维持中普罗茨和胱抑素积聚水平的平衡,这对于对生物或非生物胁迫引起的生理过程的调节至关重要。因此,HVCPI-2可以直接参与应力,这将解释KD ICY2大麦植物对真菌攻击的最高易感性,或者可能发生不同PHYCYS和CYSPROT表达的转录重编程以补偿Hvicy-2沉默,这可能解释了沉默表现出的低半胱氨酸蛋白酶活性Hvicy-2暗处理后的线条。需要做进一步的研究来破译cystatins和CysProt在体内可能的作用,并加深对不同应激反应背后的蛋白水解事件的现有认识。
方法
植物材料及生长条件
植物来源:大麦属植物h . vulgare简历。黄金承诺被使用。大麦转基因株系沉默Hvicy-2基因(KD Icy2)的产生如[50].野生型和转基因大麦的谷物在土壤中发芽并生长,如[50[插入结构的纯合转基因大麦线相应验证。
这些植物标本取自于大麦的种子大麦芽春天的简历类型。由IPK Gatersleben提供的黄金承诺,植物生殖生物学小组。大麦转基因株系沉默大麦Icy-2基因(KD Icy2)也是与IPK Gatersleben植物生殖生物学小组合作产生的。
本研究中用于感染检测的真菌分离物为Magnaporthe oryzae野生型菌株GUY11 [54,由马德里CBGP-UPM-INIA的Sesma博士提供。我们研究中使用的植物和真菌符合机构、国家或国际指南。
实时RT-qPCR分析
用酚/氯仿法从冷冻大麦叶片中提取总RNA,并用DNase进行酶切,如上文所述[55].根据制造商的说明,使用高逆转录试剂盒(Applied Biosystems)从2 μg RNA合成cdna。采用SYBR Green检测系统进行RT-qPCR分析m . oryzae核糖体RNA的小亚基(Mo28S-rRNA)如[49].量化标准为大麦嗜环素(HvCycl基因)的mRNA水平以下的[12].使用的引物示于附加文件1:表S1。
蛋白质定量和蛋白酶活性
总蛋白从处理和对照叶片中提取,如[56]并根据[57],使用牛血清白蛋白作为标准。蛋白酶活性如[56[通过测量含有AMC(7-氨基-4-甲基香豆素)荧光团以微升平板形式进行的底物的水解。
光合色素测量和淀粉量化
叶绿素一个和b,从叶片中提取总类胡萝卜素(叶黄素和胡萝卜素),色素含量计算方法见[56].为了检测来自叶绿素的红色自动荧光,在Leica SP8共聚焦显微镜(Leica,Wetzlar,德国)下,观察到每种转基因和野生型植物的最旧的叶子,其中633nm激光激发线。来自野生型和转基因大麦线的30mg新鲜叶子用于使用如[中的STA20套件(Sigma)的总淀粉定量,如[56].
诱导子处理
具有氨基酸序列QRLSTGSRINSAKDDAAGLQIA的鞭毛蛋白肽(flg22) (AnaSpec实验室)和从蟹壳中纯化的壳聚糖(Sigma Aldrich)用于激发子处理,如[49].Elicitor溶液在7天内施加超过7天的野生型大麦叶,因为叶面喷雾和植物进一步温育在前面描述的同一生长条件下。进行三个独立的实验,每次治疗使用3罐3罐。在Elicitor处理12和24小时后收获大麦叶,冷冻成液氮并储存在-80℃以进一步分析。
m . oryzae感染
野生型的七天大麦植物和转基因株系沉默Hvicy-2基因被真菌感染m . oryzae如[描述49].的m . oryzae使用Sesma博士提供的野生型菌株Guy11 (CBGP-UPM-INIA, Madrid)为真菌分离株。感染化验按[58通过在整个植物叶中使用喷枪喷雾器压缩机喷射接种。进行三个独立实验,每次治疗7种植物。在真菌处理3和7天后收获大麦叶,冷冻成液氮并储存在-80℃以进一步分析。
损害量化分析
m . oryzae使用HP ScanJet 5590扫描大麦叶片的损伤,数字平板扫描仪和叶面损坏如[49]使用Fiji-ImageJ软件[59].进行了三个独立的实验,分析了7个重复。数据表示为叶面受损区域(mm2)七个测量值的平均值±SE。
数据分析
采用单因素方差分析(one-way ANOVA)分析处理或系间的统计差异,然后采用软R Project (v.3.1.2)软件包进行学生纽曼- keuls (Student Newman-Keuls, SNK)多元比较检验的研究范围分布。所有实验至少进行了3次生物学重复和3次技术重复。
缩写
- AMC:
-
7-氨基-4-甲基香豆素
- CysProt:
-
半胱氨酸蛋白酶
- FLG22:
-
鞭毛蛋白肽22
- PhyCys:
-
植物甾脂蛋白
- RT-QPCR:
-
实时荧光定量PCR分析
- SNK:
-
学生Newman-Keuls多重比较测验
参考
- 1.
植物胱抑素及其靶半胱氨酸蛋白酶的起源和进化表明了一种复杂的功能关系。BMC Evol Biol. 2008;8:198。https://doi.org/10.1186/1471-2148-8-198.
- 2.
大麦全胱抑素基因家族的特征及其目标组织蛋白酶L-样半胱氨酸酶,在种子萌发过程中hordein动员中的伙伴。植物杂志。2009;151:1531-45。https://doi.org/10.1104/pp.109.146019.
- 3.
Benchabane M,SchlüterU,Vorster J,Goulet MC,Michaud D.植物胱抑素。生物chimie。2010; 92:1657-66。https://doi.org/10.1016/j.biochi.2010.06.006.
- 4.
植物胱抑素:对植食性昆虫和蜱螨亚种的防御蛋白。见:国际分子科学杂志,第17卷;2016.https://doi.org/10.3390/ijms17101747.
- 5.
Neuteboom LW,Matsumoto Ko,Christopher Da。分泌的菠萝胱抑素中的富含AE的N末端躯干增强了果实溴纤维的抑制,在成熟过程中被发生了后期除去。植物理性。2009; 151:515-27。
- 6.
蛋白酶和蛋白酶抑制剂的发育相关变化表明马铃薯多菌素在调节马铃薯块茎蛋白质含量方面发挥了作用。足底。2009;230:73 - 84。
- 7.
Cambra I,Martinez M,Dader B,Gonzalez-Melendi P,Gandullo J,Santamaria Me,Diaz I.涉及大麦籽粒蛋白蛋白的肽酶,HVPAP-1,通过其自身的肽和胱氨酸调节。J Exp Bot。2012; 63:4615-29。https://doi.org/10.1093/jxb/ers137.
- 8.
Prins A,Van Heerden Pd,Olmos E,Kunert KJ,Foyer Ch。半胱氨酸蛋白酶调节烟草蛋白含量和组合物中的烟叶:一种与核糖糖-1,5-双磷酸羧酶/氧酶(Rubisco)囊泡体的动态相互作用的模型。J Exp Bot。2008; 59:1935-50。
- 9.
张旭,刘胜,高野。两种半胱氨酸蛋白酶抑制剂的合成拟南芥蒂利亚纳,Atcysa和Atcysb,增加盐,干旱,氧化和耐寒性。植物mol biol。2008; 68:131-43。
- 10.
菠菜衰老相关半胱氨酸蛋白酶-半胱氨酸抑制素复合物的分子生物学特性。杂志。2011;141:97 - 116。
- 11.
陈HJ,蔡yj,沉迪,蔡廷,黄戈姆,林毅。甘薯半胱氨酸蛋白酶异位表达SPCP3在转基因拟南芥植物涂改的表型性状,并增强干旱胁迫敏感。J工厂增长调节。2013; 32:108-21。
- 12.
c - 1a半胱氨酸蛋白酶-半胱抑素在叶片衰老中的相互作用。J Exp Bot. 2014; 65:3825-33。https://doi.org/10.1093/jxb/eru043.
- 13.
植物胱抑素在作物改良中的潜在应用,特别是在豆科植物上。J Exp Bot. 2015; 66:3559-70。
- 14.
Massonneau A,Condamine P,Wisniewski JP,Zivy M,Rogowsky PM。玉米胱抑素应对发育线索,冷应激和干旱。生物学习生物魔Acta。2008; 1729:186-99。
- 15.
关键词:大麦,暗诱导,衰老,基因表达,基因克隆足底。1997;203:332-40。
- 16.
塞其M, Narusaka M,石田J, Nanjo T, Fujita M, Oono Y, Kamiya A, M,只是Enju,樱井T, Satou M,秋山K,塔基T, Yamaguchi-Shinozaki K, Carninci P,卡瓦依J,崎Y, Shinozaki K .监测7000个拟南芥基因的表达谱在干旱、寒冷和盐碱地强调使用全长cDNA微阵列。植物j . 2002; 31:279 - 92。
- 17.
DioP NN,儿童,雷培A,Gareil M,D'Arcy-Lameta A,Pham Thi At,Zuily-Fodil Y.通过豇豆的干旱胁迫诱导多碘辛肽(豇豆属unguiculata(l)Walp)。树叶。2月。2004;577:545-50。
- 18.
中国苹果cystatin基因家族的全基因组鉴定及表达谱分析马吕斯×释放有Borkh)。植物理性生物化学。2014; 79:88-97。
- 19.
朱德,李旭东,胡艳艳,闫燕。植物的分子特征及表达谱分析Brachypodium distachyonL.胱抑素基因揭示了响应非生物胁迫的高进化守恒和功能性分歧。前植物SCI。2017; 8:743。
- 20。
干旱胁迫下蛋白酶抑制剂的半定量RT-PCR分析小麦.植物生理学报。2014;4:57-67。
- 21。
Quain MD, Makgopa ME, Márquez-García B, Comadira G, Fernandez-Garcia N, Olmos E, Schnaubelt D, Kunert KJ, Foyer C.异位植物胱抑素表达增强大豆对干旱胁迫的耐受性(大豆),拟南芥蒂利亚纳通过影响独角金内酯途径,也可导致种子性状的改善。中国生物技术学报(英文版);
- 22.
Tan Y,Li M,Yang Y,Sun X,Wang N,Liang B,MA F.HMCYS4的过表达,来自Malus Prunifolia(Willd。)Borkh的植物孢菌素基因。,增强了在转基因Arabropsis和苹果中赋予干旱耐受的气孔闭合.前植物SCI。2017年。https://doi.org/10.3389/fpls.2017.00033.
- 23.
Van der Vyver C, Schneidereit J, Driscoll S, Turner J, Kunert K, Foyer CH. Oryzacystatin I在转化烟草中的表达产生条件生长表型并提高耐冷性。生物技术学报2003;1:101-12。
- 24.
jej, Song C, Hwang Je, Chung WS, Lim CO. . DREB2C作为与热耐受性相关的植物胱抑素4 (AtCYS4)基因的转录激活子。转基因研究》2014;23:109-23。
- 25.
警卫室农协。利用蛋白酶抑制剂保护转基因植物免受草食昆虫侵害的前景。生物谷biosciences . 2011; 12:409-16。
- 26.
植物叶片损伤诱导的蛋白酶抑制剂:一种可能的昆虫防御机制。科学。1972;175:776-7。https://doi.org/10.1126/science.175.4023.776.
- 27.
Schlüteru,Benchabane M,Munger A,Kiggundu A,Vorster J,Goulet MC,等。食草动物虫害控制的重组蛋白酶抑制剂:多重型视角。J Exp Bot。2010; 61:4169-83。https://doi.org/10.1093/jxb/erq166.
- 28.
Carrillo L,Martinez M,Alvarez-Alfageme F,Castanera P,Smagghe G,Diaz I,Ortego F.大麦半胱氨酸蛋白酶抑制剂降低了人工饮食和转基因拟南芥植物中的两个蚜虫种类的性能。riss res。2011A; 20:305-19。https://doi.org/10.1007/s11248-010-9417-2.
- 29.
Carrillo L,Martinez M,ramessar K,Cambra I,Castanera P,Ortego F,Diaz I.玉米中大麦胱抑素基因的表达通过改变其半胱氨酸 - 蛋白酶来增强对植物螨虫的抗性。植物细胞代表2011B; 30:101-12。https://doi.org/10.1007/s00299-010-0948-z.
- 30.
等。肽酶抑制剂的基因堆积增强了植物对蜘蛛螨的抗性测定了.Plos一个。2012; 7:E43011。https://doi.org/10.1371/journal.pone.0043011.
- 31。
Martinez M,Cambra I,Gonzalez-Melendi P,Santamaria Me,Diaz I. C1A半胱氨酸 - 蛋白酶及其在植物中的抑制剂。physiol植物。2012; 145:85-94。https://doi.org/10.1111/j.1399-3054.2012.01569.x.
- 32。
Van der Linde K, Hemetsberger C, Kastner C, Kaschani F, Van der Hoorn RA, Kumlehn J,等。玉米胱抑素通过抑制外体细胞半胱氨酸蛋白酶来抑制宿主免疫。植物细胞。2012;24:1285 - 300。https://doi.org/10.1105/tpc.111.093732.
- 33。
王志强,王志强,王志强,等。茉莉酸信号诱导小麦半胱抑素基因的表达。植物学报。2011;6(6):821-30。
- 34.
Martinez M, Abraham Z, Gambardella M, Echaide M, Carbonero P, Diaz I.草莓基因Cyf1编码具有抗真菌活性的phytocystatins。J Exp Bot。2005; 56:1821-9。
- 35.
Lima Am,Dos Reis SP,De Souza Cr。植物甾汀及其潜力控制真菌引起的植物疾病。蛋白质pept。2015; 22:104-11。
- 36.
Christova PK,Christov NK,Mladenov PV,Imai R.小麦多域Cystatin Tamdc1在Planta中显示抗真菌,抗菌和杀虫活动。植物细胞代表2018年。https://doi.org/10.1007/s00299-018-2279-4.
- 37.
王克明,杨安华,叶伟华。芋头1、2类植物胱抑素的抑菌机理及抑菌活性研究(Colocasia esculenta).FEBS J. 2008; 275:4980-9。
- 38.
Valdes-Rodriguez S, Guerrero-Rangel A, Melgoza-Villagomez C, chagola - lopez A, Delgado-Vargas F, Martinez-Gallardo N, Sanchez-Hernandez C, Delano-Frier J. cDNA Cloning of A cystatin from grain amaranth苋属hypochondriacus)表现出被发芽和非生物胁迫修饰的组织特异性表达。植物生理与生物化学。2007;45:790-198。
- 39.
杨啊,yeh kw。来自芋头的分子克隆,重组基因表达和胱抑素的抗真菌活性(Colocasia esculenta简历。刺猬第一)。足底。2005;221:493 - 501。
- 40.
Martinez的男,洛佩兹-Solanilla E,罗德里格斯帕伦苏埃拉P,Carbonero P,植物致病真菌的迪亚兹I.抑制由大麦半胱氨酸蛋白酶抑制剂HV-CPI(基因冰冷的)与半胱氨酸蛋白酶抑制特性无关。微生物与植物的互动。2003;16:876-83。
- 41.
cystatin SlCYS8在植物丝氨酸蛋白表达中的稳定融合伙伴。生物技术学报。2013。https://doi.org/10.1111/pbi.12098.
- 42.
Grosse-Holz F,Madeira L,Zahid Ma,Songer M,Kourelis J,Fesenko M,Ninck S,Kaschani F,Kaiser M,Van der Hoorn Ral。三种无关蛋白酶抑制剂增强药物重组蛋白的积累尼古利亚娜·宾夕法尼亚州.生物技术学报。2018。https://doi.org/10.1111/pbi.12916.
- 43。
桑托斯RB,Chandrasekar B,曼德尔MK,Kaschani女,凯瑟男,这两个L,范德霍恩RAL,Schiermeyer A,在Abranches R.低蛋白酶含量Medicago truncatula细胞培养物有利于重组蛋白的生产。生物技术J. 2018。https://doi.org/10.1002/biot.201800050.
- 44。
马铃薯中大麦胱抑素的表达及其对蛴螬的影响Podisus maculiventris通过以植物为食的食草性猎物。反式杂志2007;16:1-13。https://doi.org/10.1007/s11248-006-9022-6.
- 45。
Hamza R, Pérez-Hedo M, Urbaneja, Rambla JL, Granell A, Gaddour K, Beltrán JP, Cañas洛杉矶。两种大麦蛋白酶抑制剂在番茄中的表达促进了番茄的内源防御反应,增强了番茄的抗性Tuta absoluta.BMC植物BIOL。2018; 18:24。https://doi.org/10.1186/s12870-018-1240-6.
- 46.
安圣玛丽亚ME,迪亚兹-门多萨男,佩雷斯 - Herguedas d,汉森G,KumlehnĴ,迪亚兹I,HvIcy6在打击二斑叶螨大麦提高电阻Martinez的M.过表达和需要局部转录重编程。诠释J分子科学。2018年。https://doi.org/10.3390/ijms19030697.
- 47.
卡里L,赫雷罗I,坎布拉I,桑切斯 - Monge的R,迪亚兹I,Martinez的M.差分在vitro和在活的有机体内大麦半胱氨酸和丝氨酸蛋白酶抑制剂对植物病原微生物的影响。植物生理生化。2011c; 49:1191-200。https://doi.org/10.1016/j.plaphy.2011.03.012.
- 48.
Velasco-Arroyo B, diazmendoza M, Gomez-Sanchez A, Moreno-Garcia B, Santamaria ME, Torija-Bonilla M, Hensel G, Kumlehn J, Martinez M, Diaz I.沉默大麦胱抑素HvCPI-2和HvCPI-4特异性改变叶片对干旱胁迫的响应。植物学报2018。https://doi.org/10.1111/pce.13178.
- 49.
hvpa -1 C1A蛋白酶在大麦对病原体和草食动物的反应中有不同的参与。植物学报2017;8:1585。https://doi.org/10.3389/fpls.2017.01585.
- 50。
Diaz-Mendoza M,Dominguez-Figueroa J,Velasco-Arroyo B,Cambra I,Gonzalez-Melendi P,Lopez-Gonzalvez A等。HVPAP-1 C1A蛋白酶和HVCPI-2胱抑素有助于大麦颗粒填充和发芽。植物理性。2016; 170:2511-24。https://doi.org/10.1104/pp.15.01944.
- 51.
贝拉斯科阿罗约B,迪亚兹-门多萨男,安圣玛丽亚ME,冈萨雷斯梅伦迪P,Gomez的桑切斯A,Arnaiz A,Martinez的男,响应于非生物/生物胁迫迪亚兹I.衰老相关的基因。PROG博特。2017年。https://doi.org/10.1007/124_2017_1。
- 52.
van der Linde K,Mueller An,Hemeterber C,Kashani F,Van der Hoorn Ra,Doehlemann G.玉米胱抑素CC9与妊娠期半胱氨酸蛋白酶相互作用。植物信号表现。2012B; 7:1397-401。https://doi.org/10.4161/psb.21902.
- 53.
郑丽敏,岑JTC,施玉DJH,周文敏。芝麻类植物胱抑素的n端和c端结构域的功能特征。机器人钉。2014;55:18。https://doi.org/10.1186/1999-3110-55-18.
- 54.
梁h,博罗梅欧ES, MA Bernardo, Notteghem JL。稻瘟病菌毒力的遗传分析。植物病理学。1988;78年,1227 - 33所示。
- 55。
oñate-sánchezl,维森特-Carbajosa J.免费RNA隔离协议拟南芥蒂利亚纳,包括种子和角果。BMC Res Notes. 2008;1:93。https://doi.org/10.1186/1756-0500-1-93.
- 56。
Velasco-Arroyo B, Diaz-Mendoza M, Gandullo J, Gonzalez-Melendi P, Santamaria ME, Dominguez-Figueroa JD,等。HvPap-1 C1A蛋白酶积极参与非生物胁迫介导的大麦蛋白水解。中国生物医学工程学报。2016;(14):4297-310。https://doi.org/10.1093/jxb/erw212.
- 57。
一种利用蛋白质-染料结合原理快速、灵敏地定量微量蛋白质的方法。学生物化学肛门。1976;72:248-54。
- 58.
sessma A, osbourne AE。稻瘟病菌经历了侵根真菌典型的发育过程。大自然。2004;431:582-6。https://doi.org/10.1038/nature02880.
- 59.
李志刚,李志刚,李志刚,等。斐济:生物图像分析的开源平台。Nat方法。2012;9:676 - 82。https://doi.org/10.1038/nmeth.2019.
确认
我们承认从CBGP-UPM-INIA安逸塞斯马博士和胡里奥·罗德里格斯·罗梅罗博士为他们的那种意见m . oryzae处理。
资金
这项工作得到了西班牙经济竞争力部长项目(项目BIO2014-53508-R)的支持。资助机构在研究的设计、数据的收集、分析和解释以及手稿的撰写中没有作用。
可用性数据和材料
与本研究有关的大部分数据已包括在手稿的表格/图表中。如果需要,作者很乐意分享其余的原始数据。
作者信息
隶属关系
贡献
ID,MM和MDM构思了这项研究。BVA和MDM进行了实验研究。所有作者均致力于稿件的最终版本。所有作者阅读并认可的终稿。
通讯作者
道德声明
伦理批准和同意参与
这些植物标本取自于大麦的种子大麦芽春天的简历类型。由IPK Gatersleben提供的黄金承诺,植物生殖生物学小组。与IPK Gatersleben, Plant Reproductive Biology Group合作,获得了沉默大麦Icy-2基因(KD Icy2)的转基因大麦株系。
本研究中用于感染检测的真菌分离物为Magnaporthe oryzae野生型菌株GUY11 [54,由马德里CBGP-UPM-INIA的Sesma博士提供。我们研究中使用的植物和真菌符合机构、国家或国际指南。
同意出版
不适用。
利益争夺
两位作者宣称他们没有相互竞争的利益。
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
额外的文件
附加文件1:
表S1。引物列表。(多克斯17 kb)
权利和权限
开放获取本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
贝拉斯科-阿罗约,B,马丁内斯,M,迪亚兹,I。等等。沉默的差异响应HvIcy2大麦植物反对Magnaporthe oryzae感染和光线剥夺。BMC植物杂志18,337(2018)。https://doi.org/10.1186/s12870-018-1560-6
已收到:
公认:
发表:
关键词
- 半胱氨酸蛋白酶抑制物
- Biotic-abiotic压力
- 蛋白水解作用
- 植物防御