抽象的
背景
收获果实和蔬菜的收获污染沙门氏菌在田地中是食物传播疫情的原因之一。众所周知,天然开口,如气孔,Hadahodes和果实裂缝,作为入口点。虽然有报告表明这一点沙门氏菌通过横向根出来的区域进行殖民和进入root,进一步调查如何获得沙门氏菌到侧根是从植物致病菌不同,侧根的拆装方便的功效仍然未知。在这项研究中,我们试图探讨的侧根介导的条目沙门氏菌,并弥合知识的这种差距。
结果
不像植物病原体,沙门氏菌不能用纤维素作为唯一的碳源。通过降解植物纤维素和果胶,否定活性进入的事实。内皮糖沙门氏菌定植显示出与侧根的数量的相关性高。当同样的机会较高或较低的侧根拓殖植物,沙门氏菌侧根越多的植株内化程度越高。然而,这两种植物的附生定殖没有改变。为了了解其生态意义,我们通过增加土壤盐分,使植物易受土壤盐分的影响,从而诱导侧根产生沙门氏菌而植株则表现出较高的入侵率沙门氏菌在空中器官的负担。
结论
沙门氏菌,无法降解植物细胞壁材料严重依赖于天然开口。因此,它的入侵高度依赖于由于表皮重塑而提供进入点的侧根的数量。因此,当通过增加土壤盐度来增强侧根的数量时,植物变得易受影响沙门氏菌侵入根系并传播到气生器官。
背景
沙门氏菌塞洛瓦被认为是与家禽相关的重要食物传播病原体[1那2]和生植物产品[3.那4.].与生农产品有关的各种血清型人类感染病例有所增加[5.].在运输和处理过程中,原料植物产品污染了[6.].但是,在过去几十年中,报告显示了阿拉丁蔬菜预收获污染的证据[7.那8.].无论物种如何,植物生长在沙门氏菌- 用生物体殖民融合土壤[9.那10.].
各种生物和非生物组分在成功的殖民化方面发挥着重要作用沙门氏菌在根。de-novo.例如鞭毛[11.),菌毛(12.]和外寡糖[13.都能使病原体寄生于宿主。植物病原体的存在Xanthomonas.[14.会导致更高的殖民化沙门氏菌.但是,有益的生物喜欢Sinorhizobium meliloti众所周知,减轻了负担沙门氏菌在植物15.].Gu等人报道存在沙门氏菌在叶子和果实的脉管系统中没有引起任何明显症状[16.].
入学点沙门氏菌在植物中得到了很好的研究。他们可以通过诸如气孔等开口进入空中器官[17.],Hadathodes [18.]和水果裂缝[19.].与空中器官不同,地下器官直接与被污染的土壤接触。沙门氏菌,在进入植物后可以成为系统性,并且可以殖民殖民机关[20.那21.].Cooley等人展示了沙门氏菌纽波特和E.coli.O157:H7作为附生移植物。他们也报道过E.coli.O157:H7可以进入植物的脉管系统,但不是沙门氏菌纽波特。具有表皮破裂的侧根新出现区域,被显示与这些生物和鞭毛助长迁移到这些区域的植物[22.].许多细菌和真菌利用这种开口来获得对根组织的进入[23.那24.].虽然有报告表明横向根出现区域是网站沙门氏菌进入和殖民化[22.那25.],进入机制并不熟悉。关于如何获得横向根的调查沙门氏菌与植物病原不同,细菌特异诱导侧根形成的可能性仍未被探索。本研究的目的是了解侧根在调解中的作用沙门氏菌进入更令人难以捉摸的方式。我们使用与Col-0加入和番茄(品种Indam 535)的野生型拟南芥作为植物模型系统。作为研究的延伸,我们已经检查了传播中的土壤应力因子(盐度)沙门氏菌从土壤到空气器官。
结果
沙门氏菌根定殖是从植物 - 病原体的定植不同
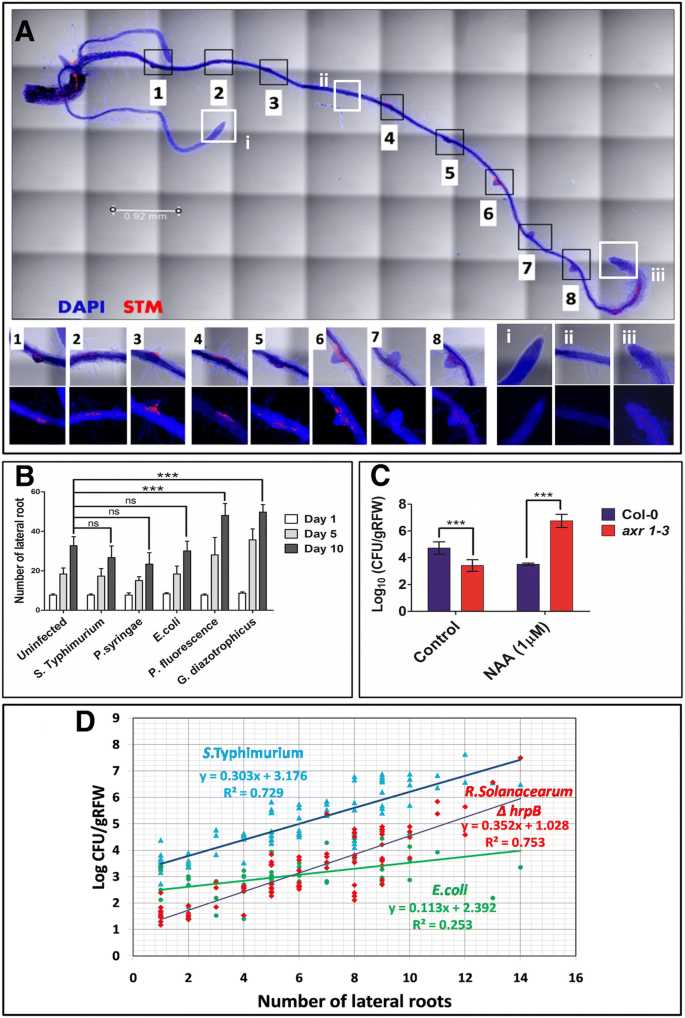
由于植物细胞壁和中隙分别由纤维素和果胶化学构成,因此产生纤维素酶和果胶酶的植物病变可以降解并进入宿主组织[26.].为了理解沙门氏菌这些多糖的活性降解,我们检查的生长轮廓沙门氏菌用纤维素和果胶作为唯一碳源的最小培养基。与植物病原体不同,就像丁香属,茄科和X. oryzae.那沙门氏菌无法使用纤维素/果胶(另加文件1:图S1A-B)。因此,不可能通过降解植物细胞壁的活性侵袭。观察到与这些生物体接种的番茄根以研究根组织内的定植模式。我们观察到植物病原体会导致组织降解但是沙门氏菌不能(附加文件1:图S1C-E)。根细胞沙门氏菌和青枯突变ΔHRPB.(III型分泌系统中的DEFICINT)受感染的植物保持身份(附加文件1:图S1E-F)。伴随着,我们观察到更高的植物病原体CFU青枯那Xanthomonas.和假单胞菌相比沙门氏菌在根组织中,但不在根平面中(附加文件1:图S1G)。我们没有看到这些生物中这些生物的任何生长缺陷在浓缩的番茄根渗出物中(附加档案1图S1H),从而确认植物衍生的秘书代谢物不是降低CFU的原因沙门氏菌.因此,我们在共聚焦显微镜下使用瓦片扫描对整个根进行了彻底的检查。我们观察到那里的殖民率很高沙门氏菌(图。1一种 [1那2那3.那4.那5.那6.那7.那8.),与其他区域相比(图1A [i-iii])。然而,我们在植物病原体中没有发现这种模式青枯,它同样占据侧根新兴和非新兴站点(附加文件1:图S1I)。我们知道,像菌根真菌这样的有益生物会通过侧根的出现部位进入体内[27.].植物生长促进菌根(PGPR)是已知的通过产生各种植物激素和触发根系发育来提高根系生物量[28.].然而,要理解是否沙门氏菌通过LR输入是一个机会事件或触发事件,我们在之前和之后计算了LR的数量沙门氏菌治疗并将其与未接种控制进行比较。与PGPRS相同G. diazotrophicus.(Endophyte)和p .荧光(根际和表面定殖细菌),沙门氏菌不能在拟南芥中诱导LR形成(图。1b)。
体外的殖民沙门氏菌依赖于侧根。(一种)代表性图像描绘沙门氏菌(MCHERRY标记)侧根新兴区域附近的殖民化。根用dapi染色。(B.)接种不同微生物后第1、5和10天侧根数。采用方差分析对数据进行分析。第10天为未染病株与染病株的比较。* * * =P. < 0.001; ns = not significant. (C)沙门氏菌抑制和诱导NAA对COL-0的侧向根系的殖民化AXR 1-3分别。采用方差分析评价显著性。* * * =P. < 0.001. Each experiment was repeated 3 times with 5 replicate each. (D.)的相关性沙门氏菌侧根定殖(95% CI)。青枯雷尔氏菌ΔhrpB作为阳性对照E.coli.用作非植物病原性细菌分别控制。N = 50 for each organism for calculating correlation
为了研究侧根依赖定殖的效果,我们使用了一个拟南芥突变体AXR1-3(来自Tair),产生较少的侧面根部[29.].然而,外源生长素可诱导侧根AXR1-3.[29.]我们使用萘乙酸(NAA),一种合成的养肝剂,诱导侧面根部。在NAA治疗后,在AXR1-3我们观察到侧重根数的浓度依赖性增加。另一方面,Col-0中的横向根,增加但大幅下降超过100nm naa(附加文件2:图S2A)。这些NAA处理的根部在浸泡沙门氏菌暂停分析殖民。在诱导侧根的时候AXR1-3用naa,沙门氏菌定殖显著增强(图。1c).与此相反,在1 μM NAA处理下,Col-0产生的侧根更少,定殖更少(图3)。1c).我们绘制了内生CFU作为侧根数的函数,并观察到高度相关(R2 = 0.729 at 95% confidence interval (CI)) for沙门氏菌, 但大肠杆菌DH5α(non-phytopathogen控制;R2 = 0.253 at 95%CI) had low correlation with the number of lateral roots (Fig.1d)。p .两也具有较低的定殖(植物病原体防治; R2= 0.309 (95%CI)(附加文件2:图S2C)。低相关性P.Syringae.可能是由于其能够降解细胞壁并通过根部的任何部件进入根组织(作为侧根根部出现位点的替代物)。青枯ΔHRPB.内生CFU显示出与(图侧根数目高相关性。1d)并用作阳性对照(r2= 0.762 (95% CI)。根平面定植(在根表面)不受侧根数的影响沙门氏菌那E.coli.dh5α和P.Syringae.(附加文件2:图S2D-F)。因此,横向根出现可以有效地用作植物内部组织的门户沙门氏菌不影响其表面殖民化。
原位殖民化沙门氏菌是依赖于侧根
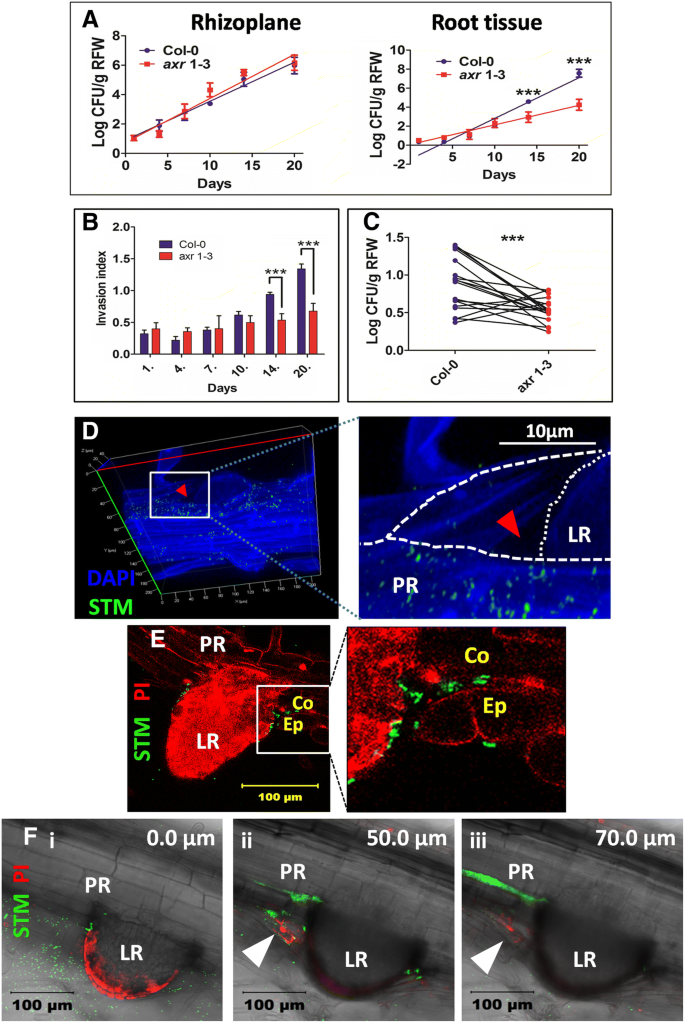
基于体外观察,我们在土壤中进行了类似的实验,通过预先治疗土壤的修饰沙门氏菌和10天大的Col-0或Axr1-3幼苗移植。测定根平面和根组织的细菌负荷。有趣的是,col0和col0根平面的CFUAXR1-3,但在14和20 d后,Col-0根组织中的CFU显著升高(图2)。2一种)。在COL-0观察到以时间依赖性方式的入侵指数(Log CFU根组织/ Log CFU Rhizoplane)显着增加,但不为AXR1-3(图。2b)。为了进一步了解横向根源作为入口点的作用,我们共同移植了COL-0和AXR1-3在同样的土壤中进行预处理沙门氏菌.在20个实验中,绘制和分析了来自17个实验的数据,因为一对或两者在剩余的盆中死于20天。COL-0根系组织中的平均CFU显着高于相比AXR1-3在同一个锅里(图。2c).因此,不论植物(野生型或AXR1-3)生长在同样的土壤上,沙门氏菌定植仅取决于由植物产生侧根的数量。
原位殖民化沙门氏菌依赖于侧根。(一种)殖民沙门氏菌在COL-0的rhizoplane(左)和根组织(右)和AXR1-3生长在土壤里去的。采用方差分析对数据进行分析。* * * =P. < 0.001; ns = not significant. Best fit line was plotted (at 95% CI). (B.)侵入索引(Log CFU根组织/ Log CFU Rhizoplane)用于COL-0和AXR 1-3在不同的日子里绘制。Anova的一种方式用于评估意义。* * * =P. < 0.001. Each experiment was repeated 3 times with 3 replicate each. (C)Col-0和Col-0的共移植过程中根组织定殖的一对一相关性AXR 1-3在含有相同锅沙门氏菌(108.细胞/ g土壤)。将实验重复3次,每次复制3次。Wilcoxan等级测试用于分析数据。*** = P <0.001。(D.)表示表皮和与侧根出现的重塑代表图像沙门氏菌殖民化。红色箭头头示出了当侧根(LR)从初生根(PR)浮出空间创建。(E.)拟南芥根横切面的代表性图像沙门氏菌在表皮细胞(Ep)和皮层细胞(Co)之间。(F)番茄中出现的横向根的横截面,具有3个代表性Z堆叠:一世.侧根(LR)和原色根(PR)的表面视图;II.表皮重塑(白色箭头)和沙门氏菌从PR和LR之间的空间进入;III.沙门氏菌在表皮和皮层细胞层之间定植
侧根起源于中柱鞘细胞,因为生长素回流在中柱鞘和内皮层之间[30.]但其出现需要与endodermis这样的邻近细胞合作[31.].这导致内胚层的肺细胞结的弱化,以允许侧根穿过内胚层。植物素信号从侧根传播到皮层和表皮,导致这些层的协调重塑[32.].因此,横向根出苗总是伴有表皮重塑,其中表皮开启了横向根出来的[33.]这导致了初级根和侧根之间的腔形成(图。2d;额外的文件3.:图S3A-B)。我们对出现的侧根进行了光学切片,之前接种了gfp标记沙门氏菌,然后生成了一幅3d图像。细菌位于52 μm深处,与根内皮层和中柱鞘之间的区域大致对应(附文件)3.:图S3C-D)。拟南芥根的横切面显示出沙门氏菌通过改造的表皮并在表皮和皮质之间定植区域(图。2e)。在土壤种植番茄植物中观察到相同的结果沙门氏菌能够殖民侧重根出现面积(图。2f i)。随后的光学切片显示表皮重塑和沙门氏菌进入表皮和皮层细胞层之间(图。2f ii和iii)。因此,我们得出结论沙门氏菌可以通过在主根和侧根之间产生的开口进入根组织,并且可以穿透根的深层层。
轻微的盐度诱导侧根使植物易受沙门氏菌侵犯
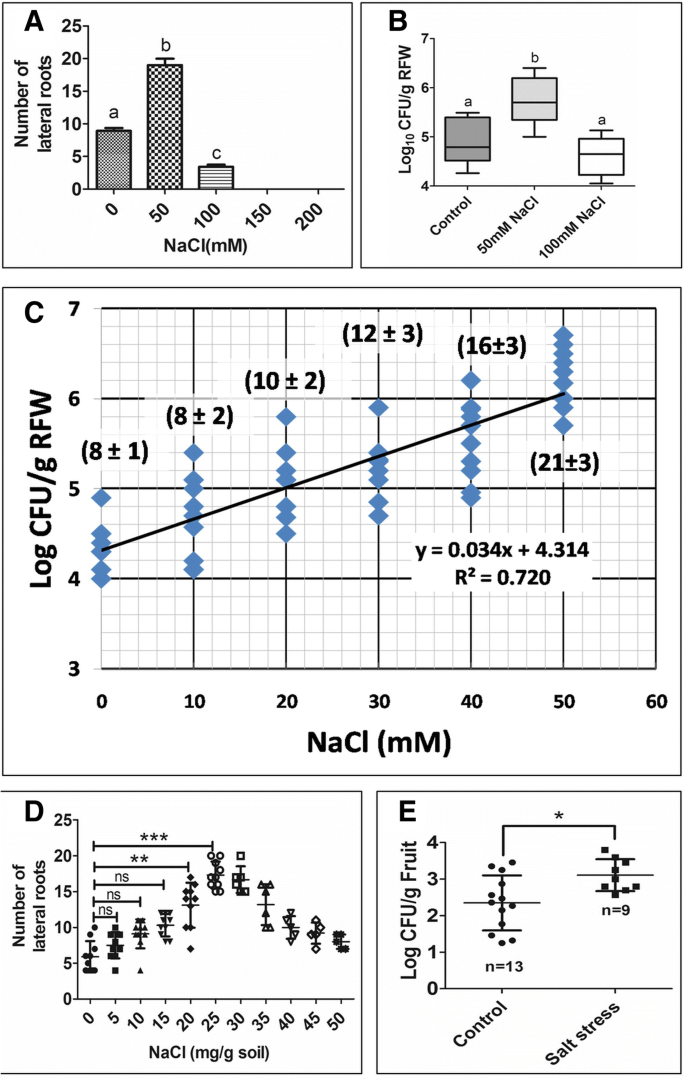
因为侧根容易进入沙门氏菌进入根部组织中,我们检查了可以诱导横向根部形成的条件。已知盐度等生物应激因子导致根部的形态发生变化[34.那35.].为了检验盐度对根系发育和定殖的影响沙门氏菌,将7天旧的拟南芥幼苗转移到补充有不同浓度的NaCl的MS琼脂平板。拟南芥幼苗直至50mM NaCl的侧根形成显着增加,超过该NaCl不大增加(图。3.一种;额外的文件4.:图S4)。这符合CFU / G RFW的增加(图。3.b).以100 mM NaCl处理的植株作为阴性对照,因为我们处理了胁迫源,但不诱导侧根。同时,我们观察到不同盐浓度的CFU呈剂量依赖性增加(图)。3.c).在土壤中,我们使用不同浓度的NaCl来提高导电性,并将20日龄的番茄幼苗移植。侧根数随着NaCl浓度的增加而增加,直到25 mg NaCl/g土壤,超过25 mg NaCl/g土壤侧根数减少。3.d).本研究NaCl浓度(25 mg NaCl/g土壤)对应的番茄电导率为2.24mS/cm,为轻度胁迫[36.].我们观察到CFU的增加,因为盐浓度从0到25mg / g土壤升高(附加文件5.:图S5)。我们检查了来自受感染植物的水果估算沙门氏菌负担。感染的水果的百分比沙门氏菌与对照土壤相比,在盐水中生长的植物较高(附加档案6.:图S6)。从这些植物获得的果实增强了沙门氏菌负担比在普通土壤上生长的负担(图。3.e)。因此,我们得出结论,盐度治疗增加了风险沙门氏菌根源上的定植及其对水果的传播。
盐度使植物容易受到影响沙门氏菌。(一种)用变化量的NaCl处理后侧面根数。(B.)沙门氏菌用50mM和100mM NaCl处理的拟南芥根系定植。单向ANOVA,后跟Bonferroni的后测试用于分析数据。不同的字母显示出意义P. < 0.05. (C盐胁迫与沙门氏菌拟南芥根的定殖(95% CI)。括号内为侧根数(Mean±SD)。(D.)番茄的侧根数绘制反对不同的盐胁迫。单向ANOVA,后跟Bonferroni的后测试用于分析数据。P. < 0.001 = ***; ns = not significant. (E.)番茄果实感染了沙门氏菌轻度盐胁迫(25 mg NaCl/g土壤;电子商务= 2.25 ds /米)。每个试验重复3次,每个重复3个。采用Mann-Whitney检验对数据进行分析。P. < 0.05 = *
讨论
过去几十年,食用受污染沙拉而感染肠道细菌的个案增加[37.].植物可以在作物生长期间污染。那在通过土壤收割之前。在土壤中,沙门氏菌已知生存300天[38.].格林等人报道了这一点沙门氏菌经由受污染的灌溉水进入番茄田[7.].植物病原体喜欢青枯和Xanthomonas.产生纤维素酶(内胃醛)[39.那40]由其III型分泌系统分泌的聚半乳酸酶(果胶甲酯酶和果胶裂解酶)[41.]并侵入植物根组织。我们筛选了植物植物病原体Ralstonia solanacearum.那Xanthomonas oryzae.和两它们在纤维素或果胶中作为唯一的碳源生长。这些微生物利用纤维素酶或果胶酶降解植物组织沙门氏菌不能水解纤维素和果胶。
病原体利用各种天然开口进入宿主组织。叶子有专门的结构,如气孔和Hadododes,但根源缺乏这种自然开口。然而,通过微生物可以利用在横向根出苗期间的表皮重塑,从而进入根组织[24.].早前有报道称非经典植物病原类沙门氏菌血清和entero-pathgenicE.coli.(O157:H7),定殖并通过侧根新生区进入根组织[22.众所周知,在植物中诱导防御反应[42.那43.].虽然观察结果虽然横向根出现可以作为入口点[22.那25.那44.],关于该过程的效力和病原菌特异性诱导侧根的问题仍然没有答案。
生长素在植物的侧根形成中是必不可少的,并且确实是一个受高度调控的发育过程[45.].侧根引发开始于围绕围栏和侧面根系创始人(LRFC)之间的植物素回流,其依赖于PIN1 AUXIN转运仪[30.]但它的出现需要与endodermis这样的邻近细胞合作[31.].这导致内胚层的荚膜结孔削弱,以允许侧根穿过内胚层。宫柱带的局部退化和其机械性能的变化允许侧根通过内胚层[46.].植物素信号从侧根传播到皮层和表皮,导致这些层的协调重塑[32.].我们使用了rapidopsis突变体AXR1-3它产生较少的侧面根,但可以在用1000nm毒素处理时产生侧根,以产生横向根系[29.].我们观察到,无论侧根的数量如何,根平面定殖都不受影响。内生菌群沙门氏菌与...相比,Col-0很高AXR1-3(uninduced)。当AXR1-3在1000nm NAA处理下,侧根显著增加,这证实了仅仅是根组织群体依赖于侧根的数量(体外和原位),而不是表面群体。我们筛选了植物致病菌Ralstonia solanacearum.那Xanthomonas oryzae.那胶杆Carotovorum.和两并发现只有P.Syringae.根接种时表现出的主机的最小的杀戮。P.Syringae.也exibit高rhizoplanic定植和组织侵入(附加文件7.:图S7)。青枯另一方面,接种植物,因为Xylem堵塞,枯萎了并死亡。相对高的生存P.Syringae.接种的植物可能是因为它是一种叶面病原体,而根不是感染的主要部位。E.coli.经过处理的植物显示100%存活,并且具有低的结果和内生殖殖民化(附加文件7.:图S7)。因此,P.Syringae.被用作植物病原控制和E.coli.作为非植物病理学控制。内生细胞的高相关性沙门氏菌CFU与侧根数(R2= 0.729 (95% CI))。这意味着沙门氏菌利用横向根出来非常有效地进入根组织。在共聚焦显微镜下,发现植物病原体同样地殖民地殖民化侧重根系和非新兴部位。不像Ralstonia solanacearum,植物病原体p .两发现在不杀死植物的情况下殖民殖民,相关性较低(R2 = 0.309) with lateral root number. This suggests that phytopathogens which use lateral root as an alternative to the active invasion by degrading cell wall.沙门氏菌仅仅取决于侧根以进入植物组织,由于其无法降解细胞壁。沙门氏菌那E.coli.和P.Syringae.不触发新的侧根的发展,这会影响相关性。当Col-0和AXR 1-3被移植到同一个花盆里沙门氏菌与土壤混合后,病原菌只在col0的根组织中富集。这就支持了一个事实,即如果给予col0和AXR1-3那沙门氏菌根内部的殖民化仅取决于横向根系。此外,附近的Col-0的存在不会影响突变体的定植AXR1-3.
已知有益微生物调节根生长和发育[47.].我们用g . diazotrophicus一个内生植物,48.] 和P.fluorescence中,根际细菌[49.]作为对照生物,监测其对侧根发育的影响。用这些生物处理植物不会导致死亡7.:图S7)。然而,与这些有益的生物不同,沙门氏菌不促进侧根发育。
植物的生长会受到土壤中各种应激因素的影响[50.].干旱,盐度,碱度,酸碱度是土壤中的主要非生物胁迫[51.].盐度是由于溶解离子的积累导致水势的降低而引起的,并可导致植物中某些代谢物的积累,如甘氨酸甜菜碱、脯氨酸等作为渗透剂[52.].在农业领域,克服含盐量是一个具有挑战性的问题。土壤含盐量增高的原因有蒸发蒸腾过度、化肥使用不当、使用含溶解盐的灌溉水等。在拟南芥中,已知温和的盐度会引起根系形态发生的变化[35.然而,高盐度对工厂的一般发展是有害的[53.].降低初级根长和次生根增殖被很好地研究在这方面[35.].我们选择与盐度胁迫一起工作,因为它促进了侧根的发育(附加文件4.:图S4)沙门氏菌访问进入根。总之我们的研究结果表明,植物根系不仅成为易受沙门氏菌入侵,但也增强其对空中食用器官的传播。已知各种环境和农艺因素影响生存沙门氏菌在季节性变异等土壤中,品种,病毒,来自之前的作物的残留物,灌溉制度[8.那54.].然而,目前对土壤应力参数的研究还知之甚少。我们首次尝试将土壤中的胁迫因素与人类病原体对植物的入侵联系起来。盐胁迫诱导侧根增殖和传递沙门氏菌可食用器官是这方面的新发现。因此,除气候、农艺和植物因素外,食用生水果和蔬菜导致的疾病暴发可归因于土壤胁迫因素。然而,其机制沙门氏菌克服土壤压力因子并不熟知。我们想研究三侧的互动沙门氏菌——未来植物和土壤的胁迫因子。除了非生物因素外,生物因素如菌根和其他PGPRs也会引起侧根增殖[27.那28.].我们还旨在探讨这种有益生物的可能性影响殖民化沙门氏菌在根。
结论
通过土壤收获植物产品的收获污染。沙门氏菌,一种人类病原体,已知可在土壤中持续约300天[38.].通过横向根出来的区域促进了从土壤到植物组织的病原体的传播。在侧根出现期间表皮的重塑产生了一种可以使用的腔沙门氏菌侵入根组织。这种对侧根的依赖性并非普遍存在,可能是由于侧根具有降解植物纤维素细胞壁的能力,因此,植物病原并不完全依赖侧根。但沙门氏菌可以用它作为进入根深蒂固的组织的门户,使其成为机会主义的生物。众所周知,环境和土壤因素会影响殖民化状态沙门氏菌[8.].我们的数据表明,土壤中溶解盐的渗透胁迫也可以影响定殖沙门氏菌.轻微的盐度可以引起根结构的形态发生变化,如侧根的增强,从而为病原体进入宿主组织提供更多通道。
方法
对于侧根数的植物和评估生长条件
拟南芥蒂利亚纳生态型Col-0和突变体AXR 1-3种子是表面灭菌(0.01%)W./V.SDS与70%V./v乙醇),置于Murashige and Skoog (MS)琼脂平板上分层4 d。平板在生长室(Geotech,韩国)中培养,光照和黑暗循环16/8小时,22℃,相对湿度75%。在萌发7 d后,将其转移到含NAA(0、50、100、500和1000 nM)的培养皿中,1周后计数侧根。另一组植株(14日龄)转移到含NaCl的平板(25、50、100、200 mM), 1周后进行侧根测定。当需要时,将幼苗转移到高压灭菌的盆栽混合物中。花盆放置在22°C的生长室内。光周期为16 h光照/8 h暗循环,相对湿度为75%,光照强度为~ 6000 lx。每天用15ml无菌水冲洗花盆。
菌株、培养基和培养条件
在补充有氨苄青霉素(50μg/ ml)的LB培养基或LB上覆盖细菌(用于沙门氏菌Typhimurium rucation ATCC 14028和S.鼠伤寒分别表达GFP/mcherry [55.])从甘油原液。镀到沙门氏菌志贺氏琼脂(SS琼脂),一个半选择性差动介质,用于确定S.必要时注射鼠伤寒。Escheichia Coli.DH5α(ATCC)[56.],Ralstonia solanacearum.菌株F1C1 [57.],胶杆Carotovorum.ATCC 15713和Xanthomonas oryzae.PV菌菌株189(惠赠自R Sonti教授NIPGR,印度)生长在LB平板上。青枯表达MCherrry的菌株(来自Sk Ray教授,Tezpur大学,印度的善意的礼物)在LB上生长为50μg/ ml庆大霉素。Gluconacetobacter diazotrophicus.SO01(来自印度班加罗尔UAS的N Earanna教授的好心礼物)是在LGIP培养基上用10%的蔗糖种植的。两pv.tomato DC3000(ATCC-BAA 871)(来自瑞吉教授,Nipgr,印度教授的善意的礼物)和荧光假单胞菌ATCC 13525是在King’s B培养基上生长的[58.](来自Nanagaraj,Uas,班加罗尔,印度州州教授的善意的礼物)。在30℃下生长细菌培养物(P. inringae,p.flooferess,r.colanacearum,X. oryzae,G. diazotrophicus,P.Carotovorum)36小时或37°C(S.猛干和E.coli.)24小时的板材。生长曲线S.刺血管,P.Syryrace,R.Solanacearum和X. oryzae.用0.3%纤维素或果胶作为唯一碳源在M9最小培养基中完成。
体外拟南芥根部接种
14天龄col0或AXR 1-3秧苗浸泡在108.细胞/ mL培养物S.刺血管,P.Syringae.要么E.coli.和一世NCubated for 72 h under similar growth conditions. Roots were washed twice with 1X PBS to remove the un-adhered cells and homogenized using 1 mm glass beads in bead-beader (Biospec MiSci, USA). The suspension was serially diluted and plated on SS agar (for沙门氏菌和E.coli.)或王'S B琼脂(用于p .两)。将CFU标准化为根部鲜重(RFW)。
原位植物接种通过土壤
沙门氏菌刺血管生长为光密度(OD600海里0.3,其对应于108. CFU/ml. Cells were centrifuged, re-suspended in 0.5X MS broth (only salt; without sucrose and hormones) and mixed thoroughly with the soil (1 ml suspension/g soil). The soil was allowed to dry and filled in pots. 10-day old Col-0 andAXR1-3幼苗在这些土壤中移植。沙门氏菌通过以下步骤在1,4,7,10,14和20天后在rhizoplane和根组织中评估负担:在从根部除去土壤后,将它们放入无菌PBS并涡旋20分钟以除去表面-Dreathered rhizoplanic人口。rhizoplanic悬浮液连续稀释并镀以评估rhizoplanic群体(详细程序在附加文件中提到8.:图S8和“附加”文件9.:图S9。涡流之前和之后的相同根图像显示在附加文件中8.:图S8B。手术的错误率小于0.001)。根部立即从悬浮液中取出,并用微型串珠机压碎。组织匀浆被连续稀释和镀以评估根组织群体。根平面和根组织的CFU归一化至根鲜重(RFW)。当用1%的次氯酸钠对根进行表面消毒1分钟时,侧根显露区域内的细菌因该区域存在开口而被杀死。因此,我们采用机械分离的根平面种群通过旋涡。通过PI染色证实了侧根显露区域内的细菌的生存能力(附文件)8.:图S8C)。此策略仅用于拟南芥根源。由于番茄根的机械损伤很高,未使用该方法,并在1%漂白剂1分钟内进行表面灭菌。另一方面,拟南芥根源没有受到伤害,并且观察到机械损坏(附加文件8.:图S8B)。侵入索引(Log CFU根组织/ log CFU Rhizoplane)并为每个时间点绘制。
Co-transplantation实验
在另一个集中,Col-0和AXR1-3在预处理的同一个锅中进行了共同移植沙门氏菌20天后测定组织中的CFU。检查3个这样的罐子,绘制Col-0和axr1-3的平均CFU。由于差异很大,实验重复了20次。与组织中Col-0和Col-0的平均CFU绘制出一一对应关系AXR1-3从每次实验中得到的。配对值为来自同一盆栽的平均cfu。采用Wilcoxan配对检验对数据进行分析。
盐度处理和沙门氏菌传给航空器官
番茄种子是表面灭菌(用1%漂白剂洗涤,用无菌水洗涤),并在高压灭菌的苗圃土壤中播种。将实验盆中的土壤与不同量的NaCl(0,25,50,75和100mg NaCl / G土壤混合。使用电导率计测量电导率,使用电导率计测量苗圃种植番茄幼苗(20天)在它们中移植。将罐子在26°C,相对湿度为70%的温室。每天使用微量移尖用200毫升无菌水灌溉罐,注意避免溅起土壤和细菌混合。7天后仔细地彻底拔除植物,而不伤害根,计算和侧根的数量。在另一种与25mg NaCl / g中混合的土壤中,将土壤移植20天番茄幼苗和沙门氏菌7天后通过灌溉水加入土壤中(108.CFU / 500毫升)。植物被允许生长1周或3个月。从1周龄的植株中,取根,用1%漂白剂消毒1分钟,用粉浆碾碎,连续稀释悬浮液并在SS琼脂上镀以评估沙门氏菌负担。从3个月大的植物中,果实被收获,表面灭菌5%漂白剂10分钟并评估沙门氏菌用灰浆粉彩压碎并镀在SS琼脂上。
根的共焦成像
2周龄拟南芥根(接种后3 d)用PBS洗涤2次,用碘化丙啶或DAPI (0.01 μg/ml)浸泡2 min。他们再次用PBS洗涤,并安装在一个封面滑动。对于土壤生长的植物,用无菌PBS洗涤5次。成像由蔡司共聚焦显微镜(LSM meta710,蔡司,德国)完成,并使用ZEN 2009光版软件进行分析。ZEN 2012黑色版平台用于创建3D图像。然后使用相同的平台对GFP通道进行深度编码,以评估来自不同深度根组织的细菌信号(附加文件3.:图S3C-D)。封闭重塑表皮的边界标记,选择了三个感兴趣区域(I,II和III)。使用彩虹色码分析细菌的位置,用红色表示顶层和表示最深层的蓝色。每种颜色代表来自特定深度的细菌信号(GFP)。来自封闭区域的信号指示了重塑根系结构内的细菌。来自封闭区域外部的信号是因为沿着根曲率存在的细菌(附加文件3.:图S3D)。整根成像用使用瓦片扫描徕卡SP8共聚焦显微镜进行。An average of 95 Z-stacks (1 μm interval) were taken for individual tiles (each square in Fig.1一种;额外的文件1:图S1B,含DIC图像)。利用LAS X软件进行三维重建和最大强度投影。
统计分析
确定平均值沙门氏菌根部的群体不同于Col-0和AXR 1-3,对种群进行对数变换,并使用Graph Pad Prism进行带有Welch校正的未配对t检验。采用双向方差分析检查NAA治疗与侧根数量和CFU的重要性。95%置信区间(CI)的线性回归使用Graph pad Prism版本7绘制。使用MATLAB 2016创建散点图,生成CFU与侧根的相关性。R2 < 0.666 was considered non significant as per Pearson’s correlation tables atP. < 0.05 (N=每个生物50)。采用单因素方差分析(One way ANOVA)和Bonferroni后检验来分析侵袭指数和体外的时间依赖性增加沙门氏菌盐胁迫下拟南芥的定殖。在共移植实验中,col0和AXR1-3被绘制,并用图形垫棱镜产生一对一的相关性7.威尔科共氧化匹配对试验用于分析数据。Mann-Whitney试验用于分析从番茄水果中获得的CFU。
参考文献
- 1。
质粒谱在肠道沙门菌血清Berta感染中的流行病学意义比较从人和家禽分离的菌株。学院。1992; 100:221-8。
- 2。
Baggesen DL,Wegener HC。Salmonella enticaIs SSP的噬菌体类型。从生产的动物和人类隔绝的enteica serovar typhimurium在丹麦。Acta Vet Scand。1994年; 35(4):349-54。
- 3.
Sivapalasingam S, Barrett E, Kimura A, Van Duyne S, De Witt W, Ying M, Frisch A, Phan Q, Gould E, Shillam P,等。与芒果消费有关的肠炎沙门氏菌新港血清型感染的多州暴发:水浸除虫技术的影响临床传染病:美国传染病学会的官方出版物2003;37(12):1585-90。
- 4.
Ward LR, Maguire C, Hampton MD, de Pinna E, Smith HR, Little CL, Gillespie IA, O'Brien SJ, Mitchell RT, Sharp C,等。2001年在英格兰和威尔士与即食色拉蔬菜有关的肠沙门氏菌血清型暴发的合作调查。公共卫生。2002;5(4):301-4。
- 5。
疾病预防控制中心:https://www.cdc.gov/salmonella/outbreaks.html.在.: CDC;2013-2017。
- 6。
凡多伦JM,布洛杰特RJ,POUILLOT R,韦斯特曼A,Kleinmeier d,Ziobro GC,马Y,Hammack TS,吉尔V,Muckenfuss MF。,等人。观测和模拟结果:患病率,进口辣椒和芝麻香料为进入美国提供的出货量沙门氏菌的水平和分布。食物微生物。2013; 36(2):149-60。
- 7。
Greene Sk,Daly ER,Talbot EA,Demma LJ,Holzbauer S,Patel NJ,Hill Ta,Walderhaug Mo,Hoekstra RM,Lynch MF等人。与污染的领域的番茄相关的沙门氏纽波特复发多态爆发,2005年。曲面膜。感染。2008; 136(2):157-65。
- 8。
Marvasi M,Hochmuth GJ,Giurcanu Mc,George As,Noel Jt,Bartz J,Teplitski M.影响番茄中沙门氏菌的增殖的因素:季节性效应,灌溉制度,作物和病原体基因型的作用。Plos一个。2013; 8(12):E80871。
- 9。
柯南。肠道沙门氏菌对农作物的不同附着和随后的污染。应用环境微生物学报。2008;74(17):5568-70。
- 10。
巴拉克JD,梁。土壤,作物碎片和一种植物病原体在番茄植物的沙门氏菌污染中的作用。Plos一个。2008; 3(2):E1657。
- 11.
Berger CN, Shaw RK, Brown DJ, Mather H, Clare S, Dougan G, Pallen MJ, Frankel G.肠道沙门氏菌与罗勒和其他沙拉叶的相互作用。ISME日报。3(2): 261 - 2009; 5。
- 12.
Barak JD, Gorski L, Naraghi-Arani P, Charkowski AO。肠道沙门氏菌的毒力基因是细菌附着在植物组织上所必需的。应用环境微生物学。2005;71(10):5685-91。
- 13。
Barak JD, Jahn CE, Gibson DL, Charkowski AO。纤维素和o抗原胶囊在肠道沙门氏菌定殖植物中的作用。植物-微生物分子相互作用:MPMI。2007; 20(9): 1083 - 91。
- 14。
Potnis N,Soto-Arias JP,Cowles Kn,Van Bruggen Ah,Jones JB,Barak JD。Xanthomonas Perforans殖民化会影响沙门氏菌肠道在番茄植物中。申请环境微生物。2014; 80(10):3173-80。
- 15.
n -酰基高丝氨酸内酯产生菌保护植物免受植物和人类病原体的侵害。生物科技活》。2014;7(6):580 - 8。
- 16。
顾刚,胡军,塞瓦洛斯-塞瓦洛斯,理查森,巴茨,范·布鲁根。番茄内生沙门氏菌的定殖研究。《公共科学图书馆•综合》。2011;6 (11):e27340。
- 17。
通过光诱导小肠沙门菌在叶片中的内化作用,并通过开放气孔进行趋化和渗透。应用环境微生物学报。2009;75(19):6076-86。
- 18。
Gu G, cevallos JM, van Bruggen AH。鼠伤寒肠沙门氏菌通过水囊侵入番茄叶片的研究。《公共科学图书馆•综合》。2013;8 (1):e53470。
- 19。
Gautam D,Dobhal S,Payton Me,Fletcher J,MA LM。通过在甜瓜枯萎病原体埃尔韦尼亚的Trachiphihila的瓜粒子果实中的天然裂缝通过天然裂缝进行地表存活和内化。Plos一个。2014; 9(8):E105248。
- 20。
罗勒中肠道沙门菌根的内化、转运及在植物体内的存活。环境微生物代表2013;5(1):151-9。
- 21。
洛佩斯-贝拉斯科G, Sbodio A, Tomas-Callejas A, Wei P, Tan KH,苏斯洛电视台。肠道沙门菌的根吸收和系统葡萄运输的评估。甜瓜(Cucumis melo)田间生产中鼠伤寒的发生。国际微生物学杂志。2012;158(1):65-72。
- 22。
关键词:拟南芥,肠道沙门氏菌,肠出血性大肠杆菌,O157:H7,定殖,拟南芥应用环境微生物学报,2003;69(8):4915-26。
- 23。
SørensenJ,Sessitsch - :植物相关的细菌生活方式和分子相互作用,2 EDN:CRC Press,2006;2015年。
- 24。
根内Glomus诱导水稻根系结构的改变独立于共同共生信号。新植醇。2009;182:829-37。
- 25。
Klerks MM, van Gent-Pelzer M, Franz E, Zijlstra C, van Bruggen AH。莴苣对都柏林肠沙门氏菌定殖的生理和分子反应。应用环境微生物学报。2007;73(15):4905-14。
- 26。
Bellincampi D,Cervone F,Lionetti V.植物细胞壁动力学和墙壁相关易感性在植物病原体相互作用中。前植物SCI。2014; 5:228。
- 27。
Gutjahr C,Paszkowski U.多种控制丛枝菌根共生中的根系重塑水平。前植物SCI。2013; 4。
- 28。
Vacheron J,Desbrosses G,Bouffaud ML,Touraine B,Moenne-Loccoz Y,Muller D,Legendre L,Wisniewski-Dye F,Prigent-Combaret C.植物生长促进无根瘤菌和根系功能。前植物SCI。2013; 4:356。
- 29。
(1)拟南芥侧根形成途径的研究。基因Dev。1995;9(17):2131 - 42。
- 30.
Marhavy P,Vanstraelen M,De Rybel B,Zhaojun D,Bennett MJ,Beeckman T,Benkova E. endodermis和Furicycle之间的植物素回流促进了侧根引发。2013年EMBO J. 2013; 32(1):149-58。
- 31。
Vermeer Je,von Wangenheim D,Barberon M,Lee Y,Stelzer eh,Maizel A,Geldner N.拟南芥中器官启动需要相邻细胞所需的空间住宿。科学。2014; 343(6167):178-83。
- 32。
比尔切斯-巴罗A,Maizel A.说话穿过墙壁:在拟南芥侧根出现的机制。CurrOp植物BIOL。2015; 23:31-8。
- 33。
Peret B, Larrieu A, Bennett MJ。侧根出苗:难产。中国农业科学。2009;60(13):3637-43。
- 34。
Zolla G,Heimer Ym,Barak S. MILD盐度刺激了拟南芥根系中的应激诱导的形态发生反应。J Exp Bot。2010; 61:211-24。
- 35。
Julkowska MM,Hoefsloot HCJ,Mol S,Feron R,De Boer GJ,Haring Ma,Testerink C.捕获具有根拟合的拟南芥根系结构动态揭示了对盐度的反应中的多样性。植物理性。2014; 166:1387-402。
- 36。
徐H,Qin F,Gautheir L,Gosselin A.绿屋番茄生长和对高营养溶液和电导率的生理反应以及低底物水含量。水果,蔬菜和谷物科学和。生物技术。2009; 3:54-61。
- 37。
陈志强,王志强,王志强,等。水果和蔬菜中微生物污染的风险因素分析。食品科学,2012;75(11):2055-81。
- 38。
鲍罗达SB,Christensen L,Trajcevska S. Salmonella Serovar毒蕈毒蕈醋栗DT12克隆的持久性,用沙门氏菌污染的浆液修正了沙门氏菌和农业土壤。申请环境微生物。2001; 67(6):2859-62。
- 39。
Poussier S,在此之前P,LuisettiĴ,海沃德C中,hrpB和内切葡聚糖酶的基因的确认菲凡M.部分测序,并扩大了青枯雷尔氏菌物种复合物内的公知的分集。SYST APPL MICROBIOL。2000; 23(4):479-86。
- 40。
XIA T,Li Y,Sun D,Zhuo T,风扇X,Zou H. Xanthomonas Citri Subsp中全毒力所需的细胞外内葡聚糖酶的鉴定。Citri。Plos一个。2016; 11(3):E0151017。
- 41。
坦克·克斯滕J,Guan Y,Allen C.RalstoniaSolanacearum果胶甲基酯酶是甲基化果胶的生长所必需的,但不适用于细菌枯萎病毒。申请环境微生物。1998; 64(12):4918-23。
- 42。
Roy D,Panchal S,Rosa Ba,Melotto M. eScherichia Coli O157:H7诱导强大的植物免疫比沙门氏菌肠杆菌SL1344。植物病理学。2013; 103(4):326-32。
- 43。
Garcia AV, Charrier A, Schikora A, Bigeard J, Pateyron S, de Tauzia-Moreau ML, Evrard A, Mithofer A, Martin-Magniette ML, virlogex - payant I, et al.;在拟南芥中,沙门氏菌鞭毛蛋白通过FLS2被识别并激活pamp触发的免疫。摩尔。2014;7(4):657 - 74。
- 44。
Klerks MM, Franz E, van Gent-Pelzer M, Zijlstra C, van Bruggen AH。肠道沙门菌与莴苣品种间的差异互作及影响定殖效率的植物-微生物因素。ISME日报。2007; 1(7): 620 - 31所示。
- 45。
Lavenus J,Goh T,Roberts I,GuyoMarc'h S,Lucas M,De Smet I,Fukaki H,Beeckman T,Bennett M,Laplaze L.拟南芥的侧根发育:五十岁的养肝症。趋势植物SCI。2013; 18(8):450-8。
- 46。
Lucas M,Kenobi K,Von Wangenheim D,Vobeta U,Swarup K,De Smet I,Van Damme D,Lawrence T,Peret B,Moscardi E等人。侧根形态发生依赖于覆盖组织的力学性能。Proc Natl Acad Sci U S A. 2013; 110(13):5229-34。
- 47。
微生物信号在植物生长发育中的作用。植物信号学报。2009;4(8):701-12。
- 48。
De Souza AR, De Souza SA, De Oliveira MVV, Ferraz TM, Figueiredo FAMMA, Da Silva ND, Rangel PL, Panisset CRS, Olivares FL, Campostrini E等。重氮嗜糖杆菌对拟南芥内生菌的定殖及其对植物生长、生理和防御的影响。土壤植物。2016;399(1 - 2):257 - 70。
- 49。
Rainey PB。荧光假单胞菌对植物根际环境的适应。环境Microbiol。1999;1(3):243 - 57。
- 50.
Brady NC,Weil Rr。土壤的性质和性质。在:皮尔逊教育;2016年。
- 51.
Pereira A.从不断变化的环境中植物非生物压力挑战。前植物SCI。2016; 7。
- 52。
Karmakar K, Rana A, Rajwar A, Sahgal M, Johri BN。胁迫下豆类-根瘤菌共生。印度:印度施普林格;2015年。
- 53。
Munns R,Tester M.盐度耐受机制。Annu Rev植物Biol。2008; 59:651-81。
- 54。
jacobsen cs,bech tb。沙门氏菌的土壤存活率,转移到淡水和新鲜农产品。食物res int。2012; 45:557-66。
- 55。
基质非生产者的渗透削弱了沙门氏菌的生物膜,降低了其抗菌耐受性和致病性。Microbiol前面。2015;6。
- 56。
Balakrishnan A,Chakravortty D.上皮细胞损伤激活肠上皮中的杀菌/渗透性增加 - 蛋白(BPI)表达。前微生物。2017; 8。
- 57。
rpoN1,而不是rpoN2,是茄科Ralstonia solanacearum的抽搐运动、自然能力、硝酸盐生长和毒力所必需的。Microbiol前面。2015;6:229。
- 58。
Worley Jn,Russell Ab,Wexler Ag,Bronstein Pa,Kvitko BH,Krasnoff SB,Munkvold Kr,Swingle B,Gibson DM,Collmer A.Pseudomonas Syringae PV。Tomato DC3000 CMAL(PSPTO4723),DUF1330家族成员需要生产L- allo-异氨酸,植物毒素冠状苷的前体。J细菌。2013; 195(2):287-96。
致谢
压力两PV。番茄DC3000和Xanthomonas oryzae.PV。菌189是从拉梅什Sonti博士(NIPGR,新德里,印度)惠赠。B.N.博士普拉卡什(土壤科学与Agril。化学,UAS,班加罗尔,印度的部)被确认为电导率实验。N. Earanna教授(Agril微生物学,UAS,班加罗尔,印度的部门)是公认的用于提供Gluconacetobacter diazotrophicus.应变SO-01。N. Nagaraj博士(印度班加罗尔UAS植物病理学系)因提供该技术而被公认荧光假单胞菌压力。Suvendra K Roy博士(印度阿萨姆邦Tezpur大学分子生物学和生物技术系)的证明获得认可Ralstonia solanacearum.应变F1C1。在IISC部门和部门共聚焦和中央绿屋设施得到确认。Kapudeep Karmakar先生是IISC奖学金,这是公认的接受者。
作者捐款
KK,UN,NNK和DC设计了研究实验。KK执行了该研究,分析了数据并写了稿件。所有作者阅读并认可的终稿。
资金
这项工作得到了DAE SRC奖学金(DAE00195)和DBT-IISC合作伞计划,用于生物科学的高级研究和生物工程到DC。ICMR基础设施支持(分子医学中的高级研究中心),DST(拳)和UGC(特别援助)得到了承认。KK承认从政府Mhrd的Iisc奖学金。印度。资金机构根据提案的优点为该项目提供资金。这些融资机构对实验方案的设计,数据分析或解释或写作稿件没有影响。
数据和材料的可用性
本研究期间生成或分析的所有数据都包含在本文(及其附加文件)中,或者可以从合理的请求中获取相应的作者。
作者信息
隶属关系
通讯作者
伦理宣言
伦理批准和同意参与
所有番茄和拟南芥土壤接种试验均按照生物安全委员会制定的标准操作规程(参考:IBSC/IISc/DC/07/2017)进行。
同意出版
不适用。
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
附加文件
附加文件1:
图S1。细菌生长对纤维素和植物培养基的培养基和植物根部定植模式。(a和b)增长沙门氏菌、假单胞菌、Ralstonia和Xanthomonas.在M9最小培养基上,分别为0.3%纤维素或果胶作为唯一碳源。番茄根接种(c)Ralstonia solanacearum.(mcherry), (D)两(GFP), (E)沙门氏菌Typhimurium(GFP)和r . solanacearumΔHRPB.(麦克里)。在感染后3天后服用图像。碘化丙啶和DAPI分别用于分别染色(E)和(F)的植物。pr = ferifycle和en = endodermis。虚线代表脉管系统。(g)cfu沙门氏菌和植物植物和组织中的植物病原体。ANOVA用于分析数据的方式。不同的字母表代表意义P. < 0.005. (H) Growth of沙门氏菌番茄根渗出物的植物病原体。(i)代表性的形象Ralstonia solanacearum.在拟南芥殖民。绿色箭头表示侧根出现区域,白色箭头表示非出现区域。请注意,mcherry荧光来自整个根(i),特别是在脉管系统(ii和iii)。
附加文件2:
图S2。萘乙酸(NAA)对侧根的诱导及其与CFU的相关性。(A) NAA浓度依赖于col0和col0的侧根数的减少或增加AXR 1-3分别。ANOVA用于分析数据。不同的字母表在P <0.005时表示显着性。秤杆= 1厘米。(b)沙门氏菌CFU在根系治疗的根部,不同浓度的NAA。(c)散点图显示两根组织内CFU与侧根数的关系。(D-F)散点图显示沙门氏菌(d),E.coli.DH5α(E)两(f)关于rhizoplane的CFU相对于侧根的数量。(TIF 603 KB)
附加文件3:
图S3。表皮中侧根的出现和细菌定植重塑。(A)代表性图像表示沙门氏菌进入横切面表皮重塑时主根与侧根之间的间隙。白色箭头代表空洞。(B) X-Y、Y-Z、X-Z三个平面的表皮缝隙和细菌进入的正交切片。白色箭头表示入口地点。(C)重塑表皮的代表性图像(用虚线标记)和沙门氏菌(GFP标记)集群在该区域内(红色箭头头)。(d)深度编码仅用于GFP通道,以估计位置沙门氏菌在重塑的表皮内部。彩虹色编码图被用来定位不同深度的细菌。(i, ii和iii是三个显示不同深度细菌的感兴趣区域。PR为主根,LR为侧根。(TIF 1058 kb)
附加文件4:
图S4。用于正常和50mM NaCl应力的横向根表型的代表性图像。括号中的值代表横向根部±SD的数量。图像是由Olympus Stylus VH520相机拍摄的。通过奥林巴斯SZX7立体镜观察到的新出现的横向根。(TIF 497 KB)
附加文件5:
图S5。土壤中不同盐胁迫的相关性沙门氏菌根殖民化(95%CI)。(TIF 154 KB)
额外的文件6:
图S6。感染的百分比水果沙门氏菌(25 mg NaCl/g Soil)。和控制条件。采用学生t检验进行数据分析。* * * =P. < 0.001; ** = P. < 0.01. (TIF 88 kb)
额外的文件7:
图S7。研究的参数来选择植物病原体和非植物病原体的控制。(A)在土壤中具有不同细菌STRANS接种的植物生长的代表性图像。Images were taken by Olympus STYLUS VH520 camera after 7 days of transplantation. (B) CFU of bacteria in the root tissue after 3 days of infection. (C) Survival curve of plants grown on soil mixed with various organisms (N= 60)。(D)番茄根的附生定殖沙门氏菌那E.coli.和p .两.(e)用于选择良好的殖民者和可怜的殖民主义的参数进行比较沙门氏菌.E.coli.被选为贫穷的殖民者,而P.Syringae.作为优秀的殖民者。(TIF 1109 kb)
额外的文件8:
图S8。从内化细菌中分离无根茎细菌的方案。(a)估算表面殖民化与入侵细菌的鉴定方案的光谱表示。(b)涡旋前后整根的代表共聚焦图像。请注意,这些在涡旋之前和之后显示的根。根部上的相同区域被放大(A和B)。涡旋200 00rpm导致对根部的机械损坏。(C和D)涡旋后细菌的活力和分别在1%次氧化氯化钠治疗后比较。请注意,涡旋后首次成像同样的根,然后在次氯化钠处理后首先成像。箭头显示内化沙门氏菌.EP =表皮;co =皮质。(TIF 2016 KB)
额外的文件9:
图S9。涡旋术治疗涡旋程序时间的标准化与验证。(a)示意图显示验证rhizoplanic群体的分离过程。(b)涡旋('X')旋转的最短时间,以将表面粘附在rhizoplane中的群体。CFU和稀释因子显示为阶段2(c)涡旋根(20分钟后)的交叉检查。再次将根部置于新鲜的PBS中,并将其涡旋5分钟并镀悬浮液。第0稀释时的CFU值和板上的菌落如表所示。计算菌落30至300的板。(d)通过[CFU在第2阶段(第0次稀释)/(在第1阶段2的第2阶段2的CFU时)计算出来的误差以百分比表示。请注意,所有有机体均采用X = 20分钟。(TIF 459 KB)
权利和权限
开放访问本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
Karmakar, K., Nath, U., Nataraja, K. n .et al。根介导吸收沙门氏菌与Phyto-病原体不同,与食用菌的殖民化有关。BMC植物BIOL.18,344(2018)。https://doi.org/10.1186/s12870-018-1578-9
已收到:
公认:
发表:
关键字
- 横向根
- 表皮重塑
- 沙门氏菌
- 番茄
- 盐度