摘要
背景
Foliicolous藻类是在热带森林中一种常见的发生。他们是可供参考的几个简单的形态(单细胞,sarcinoid状或丝状),这使得他们的用处有限的形态学分类研究和物种多样性评估。藻类群落及其主机叶围之间的关系尚不清楚。为了获得更准确的评估,我们使用了18S rDNA的基因的单分子实时测序鉴定真核藻类群落在中国西南地区的区域。
结果
共注释2922只OTUs,分属5个纲,分别为:褐藻科、Trebouxiophyceae、绿藻科、恐龙藻科和真藻科。由大量绿藻序列组成的新演化支在褐藻科的Trentepohliales和褐藻科的Watanabea(Trebouxiophyceae),表明这些叶状群落可能比目前所认识的更多样化,需要进一步研究。在Trentepohliales物种,Watanabea分支和apatococcus.被检测被检测到植物界群落中研究的核心成员。在不同宿主树和采样网站的社区在Otus组成方面没有显着差异。但是,社区的穆萨和Ravenala在属水平上与其他寄主植物显著不同,主要以附生trebouxiophysian植物为主。
结论
热带层圈中真核藻类,特别是绿藻的隐多样性非常高。物种水平上的群落结构与寄主层圈和位置没有显著的关系。热带phyllopshere的核心藻群由Trentepohliales的成员组成,Watanabea分支和apatococcus.进化枝。我们的研究提供了大量新的18S rDNA序列,这将有助于揭示叶圈真核藻类的隐性多样性,并与未来此类群落的类似研究进行比较。
背景
叶层由植物的地上部分组成,主要由树叶组成,可视为一种短暂的环境[1].由于直接暴露在大气中,寄生在层际的生物经常遭受营养不足的压力。在热带雨林中,以叶圈居民的身份生活的主要附生植物包括各种细菌、地衣、真菌、自由生活的藻类和苔藓植物[2,3.,4].由这些微生物组成的微生物群落常常产生不同颜色的斑块(即绿色、灰绿色、黄色或橙色),这主要是由于不同藻类或地衣的初级或次级色素。
对层际微生物生命的研究大多集中在细菌和真菌上。它们的群落组成、对叶层的适应和多种相互作用已被调查[1,5,6,7,8].然而,对层际藻类群落的研究较少。研究表明,这些附生藻类代表了一种异质性和进化多样性很强的组合,主要由蓝藻和绿藻微藻组成,如球藻treboxiocean藻类和分枝的trentepohliaceae藻类[9,10].由于大多数藻类是水生的,这些叶状藻类在过去通常很少受到关注,它们的分类和生态学知识近年来迅速增加[11,12,13,14,15].培养独立的研究报告称,真核藻类在热带雨林的叶子上非常丰富,而关于这些形式的现有知识表明,可能存在大量未知物种[16,17,18,19].此外,已经证明,具有相同或几乎相同形态的球粒绿藻,从遗传学的角度可能有本质上的不同,单细胞球粒微绿藻代表了一个多种类的隐种复合体[20.,21,22].从叶片中检索到的大部分球藻或SSU rDNA序列都嵌套在与属相对应的trebouxiophycean分支中小球藻,Auxenchlorella,Myrmecia,Coccomyxa,elliptochloris.,Diplosphaera,Stichococcus,Prasiola,共球藻属和Asterochloris[15,23,24,25,26,27,28],而丝状绿藻属Phycopeltis,Cephaleuros,Trentepohlia和Klebsormidium[9,17,29,30.].此外,黄藻属Heterococcus也被报道为地衣中的植菌体[26].
鉴于叶圈微生物在森林生态系统的功能中发挥着明确的作用,我们对它们的多样性和分布模式的了解是多么少,这是值得注意的[31].因此,对叶藻群落多样性的研究迫在眉睫。一些研究利用形态学方法和培养或各种培养无关的分子方法(如克隆库和Sanger测序)对几种陆地藻类群落的分类或多样性进行了研究[14,32].传统方法(例如形态学观察和培养的分子克隆)受到几个问题的影响(即,获得巨大序列的低效率,并且一些物种难以在文化中生长),并且不足以解开这些社区的全部多样性。广泛使用的高吞吐量平台(即454和Miseq)产生中等至多的高质量短序列,这通常不足以获得解决良好的结果。这些平台特征的社区经常遭受分类覆盖率的低分辨率。SSU RDNA基因是分子标记,其序列数据的最大量可获得,并且通常足以在Genus水平推理。使用近全长SSU可以提供对分类组成和社区多样性的高度解决评估。
本研究以西双版纳热带植物园为研究对象,收集了40个附生植物群落的样本,对其多样性进行了全面的研究,并对其进行了高分辨率的分析。我们选择了两对引物扩增SSU序列。为了获得较好的结果,我们使用单分子实时(SMRT)对PCR产物进行测序。在此基础上,我们对采集的40个附生藻类群落进行了分类组成和分子多样性评价。
结果
不同叶层间的分类学多样性
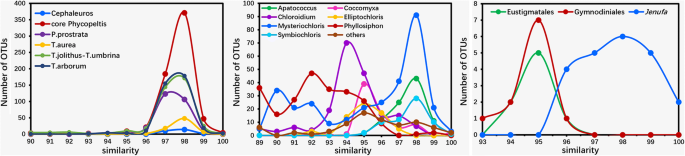
删除模糊序列和低质量序列(长度小于1500 bp的无模糊序列和嵌合序列)后,共得到152324条高质量序列。序列长度的频率在附加文件中为152,324高质量序列绘制1:图S1;大部分层序分布在1650 ~ 1850 bp之间。在98%的相似度下限下获得19,831个otu。对采样强度进行评估。测序深度从0到700进行随机子采样,每个样本100个序列。稀化曲线显示我们的测序深度是足够的(附加文件2:图S2)。一个是的BLASTn用于注释所有19831个OTU进行。其中,2922注释为真核藻类和主要由共球藻纲和Trentepohliales的,具有非常小的一部分,绿藻(团藻目和那次枝)、真叶螨目和裸子目(图。1).本研究以真核藻类为主,未考虑其他微生物类群。
与GenBank中最相似到每个OTU序列进行搜索的BLASTn检索,然后下载进行进一步系统发育分析。最后,分别由Trebouxiophyceaen,Trentepohliacean,绿藻,Dinophycean和Eustigmatophyceaen个OTU的1283,1922,194,93和64的序列的矩阵,被用于系统发生分析,其中鞘藻目和团藻目,刚毛藻目,鞘藻目,帕金和Xanthophyceae分别使用选择根。
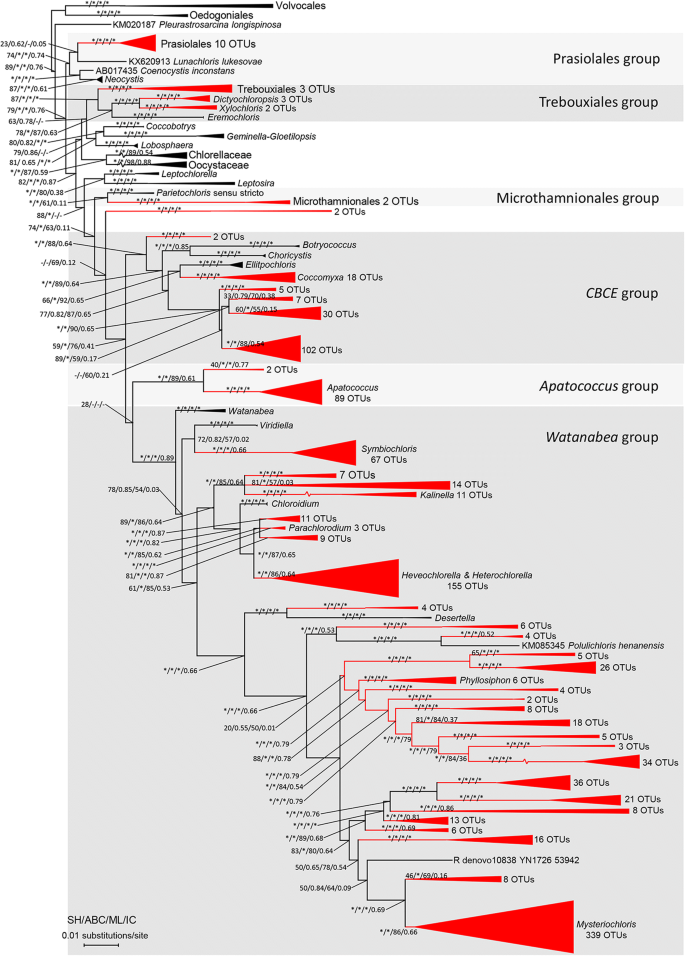
系统发育分析表明,Trebouxiphycean OTUs主要属于6个独立枝,即Prasiolales枝、Microthamniales枝、apatococcus.进化枝,Watanabea进化枝(包括Mysteriochloris.,Heveochlorella,异种蛋白酶,Phyllosiphon,Polulichloris,Desertella,Kalinella,Parachloroidium和Symbiochloris群),特布夏目支(包括Xylochloris,Eremochloris,Dictyochloropsis和Trebouxiales)和CBCE分支(Coccomyxa,Botryococcus,Choricystis和elliptochloris.进化枝。我们对Trebouxiophyceae的系统发育分析显示,Trebouxiophycean OTUs主要属于43个分支(图1)。2其中有39个支得到很好的支撑。
显示Trebouxiophycean OTUs系统发育关系的Trebouxiophyceae最大似然树及其序列从GenBank检索(https://www.ncbi.nlm.nih.gov/genbank/).带有星号的分支分别表示sh检验、贝叶斯检验、最大似然bootstrap和节间确定性≥90、0.90、90和0.90的统计支持。树的根为绿藻团藻目和叶藻目,6个目级系统群为灰色阴影。具有现有OTUs的支被涂成红色
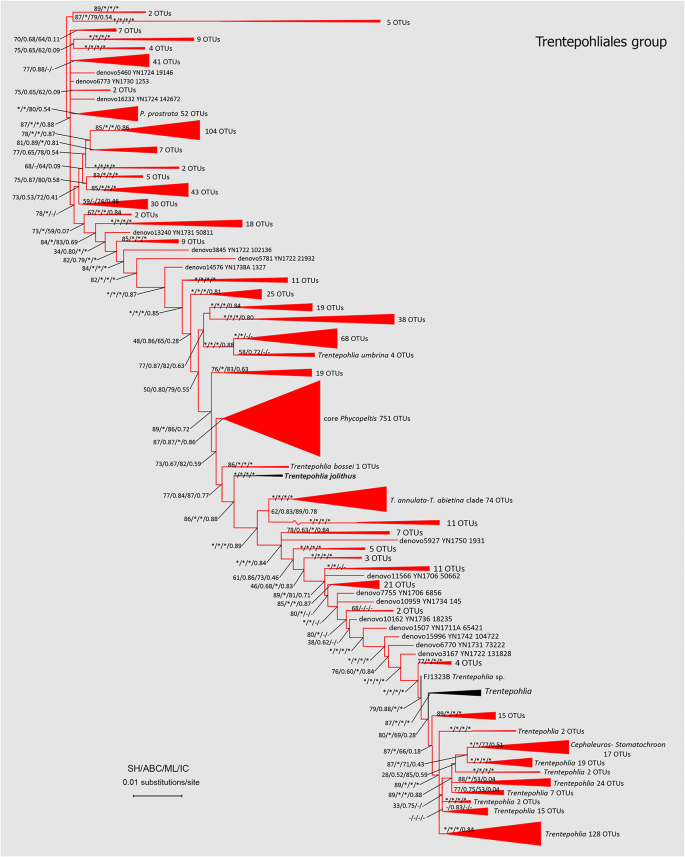
Trentepohliales的最大似然分析得到的拓扑如图所示。3..除主要血统外(Cephaleuros,Stomatochroon,Trentepohlia arborum进化枝,t .钻进,T. jolithus进化枝,T.菇进化枝,核心Phycopeltis,p . prostrata从以前的研究中恢复[33,34,我们还指定了几个新的血统。在目前的系统发育分析中,属Trentepohlia和Phycopeltis还放在原来的位置。重点是Phycopeltis和它的相关分支,核心Phycopeltis分支可能是最丰富的OTU,这是符合我们的预期还是单系。的意想不到的结果是回收的包括前面定义的若干新颖深谱系p . prostrata进化枝。OTU单板落入那些小说谱系具有约91至94%,他们最亲近的亲属的身份。
Trentepohliales的最大似然树表示的系统发育关系新获得Trentepohliacean个OTU和(从GenBank中检索到的序列https://www.ncbi.nlm.nih.gov/genbank/).带有星号的分支分别表示sh检验、贝叶斯检验、最大似然bootstrap和节间确定性≥90、0.90、90和0.90的统计支持。以Cladophorales为外类群的系统发育分析结果显示,该树的根系很深。具有现有OTUs的支被涂成红色
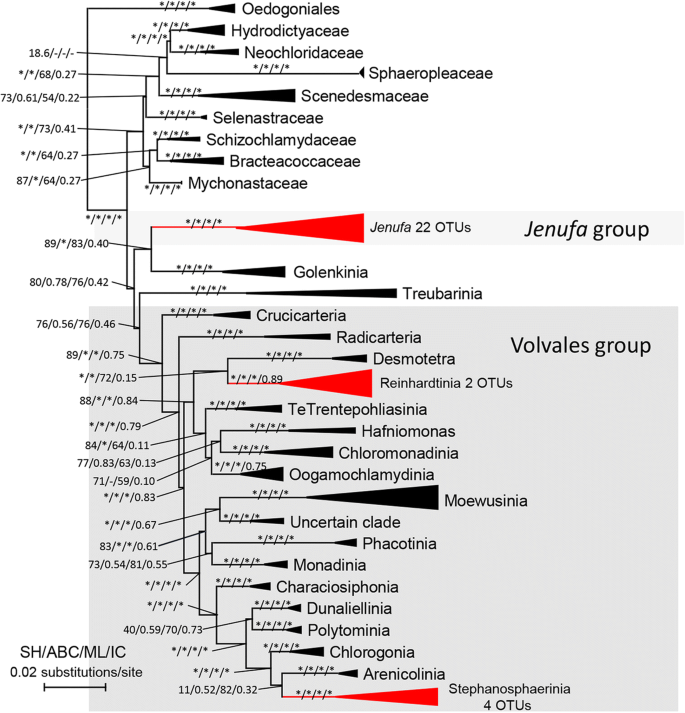
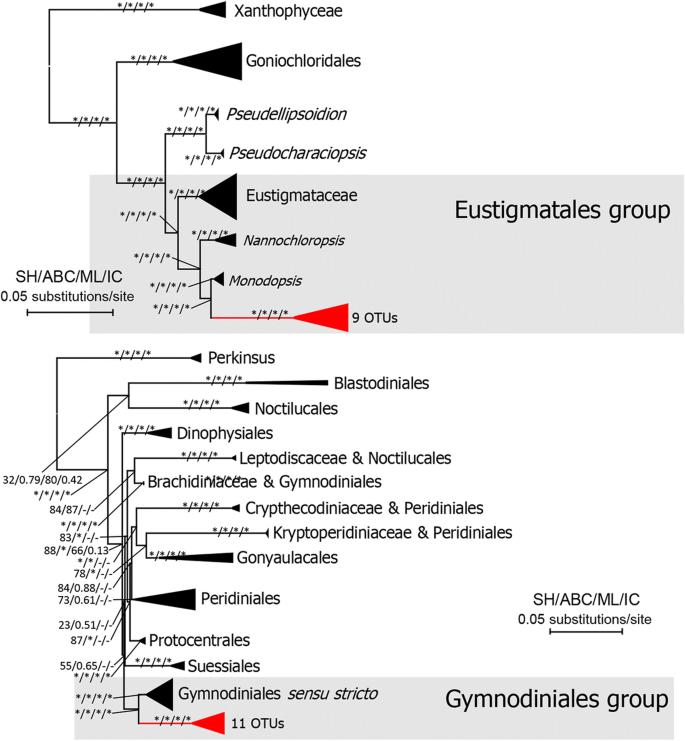
所有的吊兰类都嵌套在那次枝(incertae sedis)和团藻科。这些OTUs并没有形成单系群,而是与数据库中检索到的亲属聚集在一起(图1)。4).22个和6个otu注释为那次分别为枝和团藻科(2英寸Reinhardtia进化枝和4英寸Stephanosphaerinia进化枝)。有11个OTUs被标注为dinophyan类群,9个OTUs被标注为eustigmatophyan类群。与裸藻目(Gymnodiniales sensu stricto)和裸藻目(eustigmatophyceae OTUs)形成单系类群Monodopsis(Monodopsidaceae)分别(图5).
团藻目的最大似然树显示新获得的团藻目和那次从GenBank (https://www.ncbi.nlm.nih.gov/genbank/).带有星号的分支分别表示sh检验、贝叶斯检验、最大似然bootstrap和节间确定性≥90、0.90、90和0.90的统计支持。树是由oEdogoniales植根的。具有现有OTUs的支被涂成红色
获得Eustigmatales和Gymnodiniales个OTU和序列自GenBank(检索Eustigomatophycea(A)和甲藻纲(B)表示的新的亲缘关系的最大似然树https://www.ncbi.nlm.nih.gov/genbank/).带有星号的分支分别表示sh检验、贝叶斯检验、最大似然bootstrap和节间确定性≥90、0.90、90和0.90的统计支持。树是由oEdogoniales植根的。具有现有OTUs的支被涂成红色
研究区层际藻类群落组成
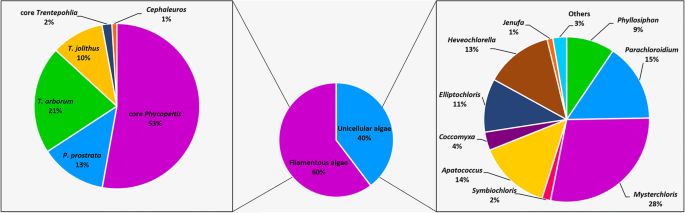
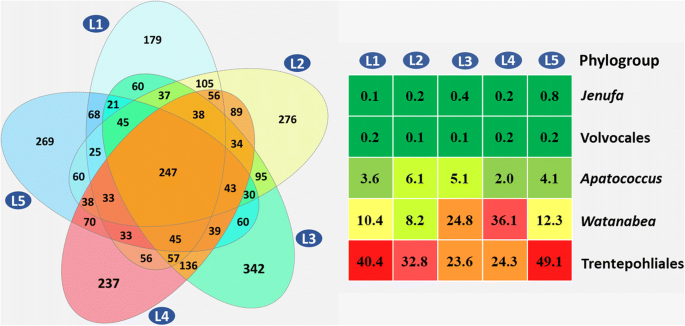
在来自所有样品的2922个OTU,丝状形式(Trentepohliales)表示的类群与1790年的最高百分比,约60%在单细胞群(1132个OTUs),则Mysteriochloris.集团的比例最高(28%),其次是Parachloroidium组(15%),apatococcus.组(14%),Heveochlorella组(13%),elliptochloris.组(11%),Phyllosiphon组(9%),Coccomyxa组(4%),Symbiochloris组(2%),那次组(1%)(图。6).
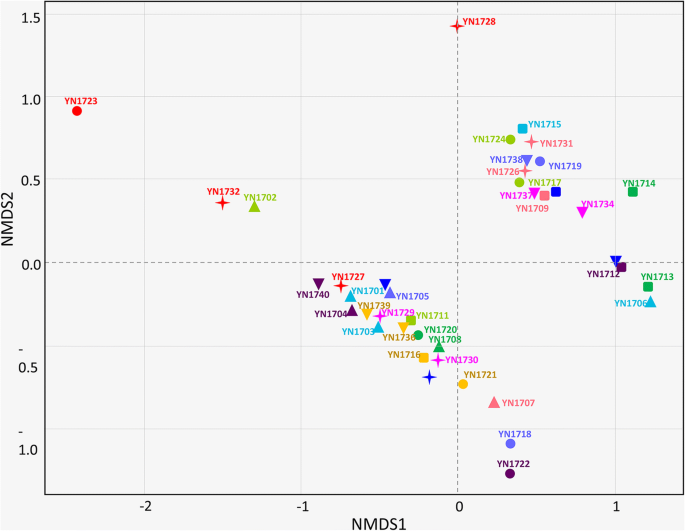
所有40个样品的alpha多样性均在附加文件中显示3.:图S3,包括丰富度(OTUs数量)、Shannon多样性和Simpson多样性。10棵宿主树的otu和藻类丰度分别为566 ~ 934和7248 ~ 12,466(附加文件)4:图S4), 5个不同的采样点分别为1085至1321和17,983至22,844(附加文件5:图S5)。方差分析和非度量多维尺度(NMDS)分析表明,不同寄主乔木和不同采样地点的藻类群落结构在物种水平上的α -多样性和β -多样性无显著差异(表2)1和无花果。7).
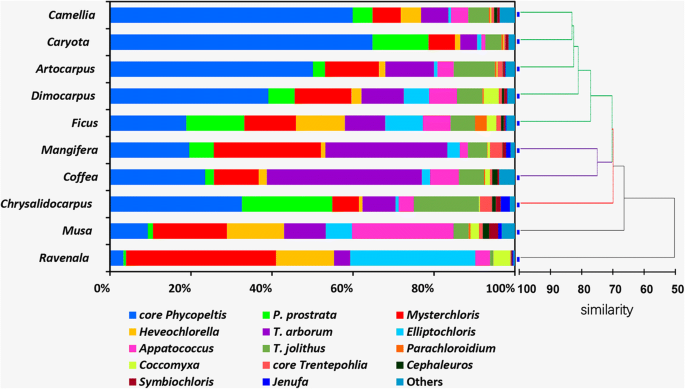
相似性剖面分析结果表明,10个群落在属水平上形成5个分支,其中3个分支得到显著支持(P< 0.05,在彩色线中,图。8).显然,大多数寄主树都有一个由核心藻类主导的群落Phycopeltis分支,即,山茶花,Caryota,arocarpus.,花芽(以绿线);Mangifera和Coffea有一个社区Trentepohlia arborum分支和核心Phycopeltis进化枝是显性的。穆萨和Ravenala与其他树种不同的是,它的群落以球藻为主(例如,Mysteriochloris.进化枝,Heveochlorella进化枝,apatococcus.分支和elliptochloris.进化枝);在这两种植物Trentepohliales有一个非常低丰度。
在目前的研究中,我们检测到所有网站上存在的常见和丰富的真核藻类藻类藻类藻类微生物的核心藻类微生物。VENN分析显示,在两个位点检测到56.45%(1689个OTU)的独特序列(图。9), 5个采样点仅发现8.26%(247个OTUs)(图2)。9).这247个OTUs被划分为5个分支,即Trentepohliales分支,Watanabea进化枝,apatococcus.进化枝,那次枝和团藻枝。我们很容易发现Trentepohlialean OTUs和WatanabeaOTUs丰度最高,其次Apatoccus分支的OTUs,而那次进化枝和团藻目分别为最低(图9).因此,我们认为研究区叶圈核心藻类微生物群主要由Trentepohliales的藻类组成,Watanabea分支和apatococcus.进化枝。
讨论
已用于分隔个OTU一个共同的身份阈值是97%;this threshold, however, has been mostly used for sequences of the 18S rDNA V4 or V9 regions with a length about 150–450 bp [35,36].本研究中使用的序列覆盖了几乎整个长度18S rDNA的基因,其在我们看来使我们的结果比仅基于V4或V9区域的结果更判别。我们同意与以往的研究议论,一个98%的身份门槛应该提供更好的分类决议,允许使用调查充分18S rDNA序列在种间的多样性[37].
本研究研究了来自十个不同的热带宿主树40个藻类群落,使用了18S rDNA基因的几乎全长,并提供了这些社区的真核藻类多样性的精确表征。我们的注释结果和系统发育结果恢复了植物岩中的五类真核藻类,即Trebouxiophyceae,叶绿素,Ulvophyceae,Eustigmatophyceae和Dinophyceae。许多属植物和特异性的TreBouxiophyceae,Tretephliales和Qeustigmatales主要来自不同的空中栖息地,即人造基质,树干,叶子,湿土壤甚至沙漠土壤[11,14,26,38,39,40,41].作为世界上最不为人所知的藻类栖息地之一,由于其分类学上的不确定性和巨大的隐多样性,对叶圈藻类类群的识别非常困难[2].根据传统形态学标准,热带森林中可能未描述和未识别的绿藻约为60% [17].根据我们的结果,这一比例很可能远高于60%。例如,目前记录的Trentepohliales约有80种,而在Watanabea在形态学基础上定义的分支(属于属)Watanabea,Desertella,Heveochlorella,异种蛋白酶,Phyllosiphon,Chloroidium,Parachloroidium,Polulichloris,Kalinella和Mysteriochloris.) (http://www.algaebase.org;2018年5月搜索)。我们的研究结果揭示了叶圈群落18S rDNA的多样性比预期的高得多,特别是在Watanabea进化枝和Trentepohliales。
Trentepohliales目是一组严格的陆地藻类,除了自由生活的形式外,还包括附生或内生形式以及地衣植生生物。最近对该类群的系统发育研究发现至少有7个谱系,Cephaleuros,Stomatochroon,Trentepohlia arborum进化枝,t .钻进进化枝,核心Phycopeltis分支,和其他几个Trentepohlia演化支(如T. jolithus进化枝,t . umbrina分支和T.菇进化枝)。到目前为止,我们对Trentepohliales的系统发育的知识基本上受到了限制,因为大多数序列数据来自培养菌株和有限的环境DNA序列[42].顺序的许多物种无法在实验室中成功地培养(尤其是属Phycopeltis,主要是附生在叶片上)。我们的结果再次表明Phycopeltis和Trentepohlia是多源的。此外,我们的系统发育分析表明,到目前为止发现的7个谱系只代表了trentepohlialean 18S rDNA多样性的很小一部分。我们的分析恢复了之前在18S rDNA系统发育中未被鉴定的几个谱系;我们认为这些谱系可能包括未被描述的物种。基于单细胞PCR等方法对叶生Trentepohliales的进一步研究,可能会对该目的分类有新的认识和重新评估。
据报道,许多Trebouxiophycean藻类来自陆地环境,或作为独立进化的共生体和内共生体,即:Lunachloris,Choricystis,共球藻属,Symbiochloris和Xylochloris[19,43,44,45].该纲分子系统发育恢复了4个目(小球藻目、Trebouxiales、Prasiolales、小thamnionales)和几个未明确定义的分支,即:Neocystis-Coenocystis进化枝,apatococcus.进化枝,Coccobotrys.进化枝,Choricystis-Botryococcus-Coccomyxa进化枝,elliptochloris.进化枝,Eremochloris进化枝,Xylochloris分支和Watanabea进化枝(11,22,45,46].几乎所有这些不同的谱系和目都包括来自陆地栖息地的属或种。本文研究的Trebouxiophycean OTUs分布在6个主要枝支(由43个支撑良好的小枝支组成)。属的许多种Stichococcus和apatococcus.在空中的栖息地[经常遇到47,48,49的种类共球藻属,elliptochloris.和Symbiochloris被描述为附生地衣的共生体[44,50,51,所以我们得到了这些属或枝的OTUs也就不足为奇了。虽然在某些属和种的分类上仍有混淆,但在本研究中发现了新的枝Symbiochloris,elliptochloris.而Trebouxiales分支让我们怀疑这些分类群的分子多样性远高于目前所认识的。
的Watanabea形态学上限定的分支包括主要存在于树皮或树叶表面等空中生境的属,例如:Watanabea,Viridiella,Chloroidium,Parachloridium,Heveochlorella,异种蛋白酶,Kalinella,Polulichloris和Mysteriochloris.[20.,52,53,54,55,56,57],其中大部分18S rDNA序列有限,已在数据库中公布(如属)Mysteriochloris.,Polulichloris和Kalinella).根据我们的研究结果中,Symbiochloris支也属于传统Watanabea分支,相对于以往的研究[44].本研究的大部分新序列与已发表的传统序列的相似性最大为89 ~ 95%Watanabea分支,尤指属Mysteriochloris.,Phyllosiphon和Heveochlorella.因此,大的遗传距离使得传统的排序水平Watanabea分支及其分支,如Mysterchloris,Phyllosiphon,Parachloroidium和Heveochlorella应在进一步研究中重新评估植物。
这并不奇怪那次在本研究中发现了类群和团藻目序列那次从热带或亚热带林中记录[18,58] 和Protosiphon物种(分为Stephanosphaerinia枝)亦有报道来自土壤等空中生境[40,59].只有4种那次的,只有2个OTU具有公开的序列100%的相似性。大多数的OTU与在95-99%的水平这些公布的序列相似,这表明那次支需要进一步深入的多样性研究。
据报道,黄藻科和真叶藻科等异质藻存在于空中生境,即岩石表面或森林皮质群落,自由生活或地衣化[43].大眼藻纲已经很少记录,通常认为包括几个属和种属于两个订单,Eustigmatales和Goniolchloridales [60].目前的环境序列形成了一个新的分支的姐妹Monodopsis,表明真鲷藻类可能具有较大的分布范围,需要进一步的多样性研究。热带森林树叶中甲藻序列的记录是一个意想不到的结果。令人惊讶的是,这是第一个从热带森林树叶中发现恐龙的记录。这些叶生甲藻可能代表了一个新的类群,因为在本研究中,11个恐龙植物OTUs形成了一个与裸子植物目(Gymnodiniales sensu stricto)密切相关的分支。
我们没有发现任何与另一种“旗舰”气生类群Klebsormidiales有关的OTUs,这种藻类通常在大多数气生表面发现,并在人造基质(如旧墙)上繁殖[29,47].摘要从热带森林叶中发现的Klebsormidiales的种类很少有报道。在热带叶圈藻类群落中,可能无优势种。
据我们所知,这是第一次提供基于大规模数据集的分子藻类foliicolous社区的全面比较。虽然采样点进行包围一个森林公园,真核藻类多样性,通过在这样的环境中18S rDNA的基因发现显然是非常高的。通常球虫藻类不发生在叶表面孤细胞,但作为骨料,非常类似于细菌[情况1].宿主树木对真菌和细菌群落的影响是众所周知的,对这些群落的研究表明,植物种类是一个重要的决定因素[7,61].许多研究证明,细菌和真菌的丰富受植物物种的影响[61,62,63].相比之下,根据我们的结果,藻类群落的物种/类群组成(OTU识别截断率为98%)与宿主树木和位置之间没有显著差异。
显然,大多数寄主树都有一个由Trentepohliales主导的群落,穆萨和Ravenala有球虫绿藻占优势(特别是Mysteriochloris.和elliptochloris.和Heveochlorella)社区。因此,在群落结构上没有显著差异Caryota,Chrysalidocarpus,山茶花,arocarpus.,Coffea,Mangifera和花芽无论是在物种层面还是在目层面。然而,在科或目水平上(与本研究定义的支系相同)的群落特征显示出显著的差异穆萨,Ravenala和其他树木(附加文件6:图S6)。自从八穆萨和八Ravenala从不同地点取样,这似乎与不同地点无关。然而,由于我们没有得到宿主功能性状(如叶片生长速率、金属离子浓度、磷和氮)以及这些藻类的生理需求的信息,很难解释treboxiophycean藻类与植物的相关性穆萨和Ravenala.植物等穆萨和Ravenala有比其他植物更薄的角质层吗Caryota,Coffea,花芽等等。这种叶子表面穆萨和Ravenala是不适合生存的Phycopeltis因为Phycopeltis主要存在于非常光滑的表面,如有厚角质层的叶子(革质叶子)和其他非生物基质(塑料标记,即),这导致一个具有优势的球藻群落。
以前的研究报道说,系统发育距离不能预测绿藻群落中的竞争,无论是在自然的还是实验中,都挑战了竞争相关的假设[64,65].虽然这一推论是由浮游植物群落得出的,但似乎也与我们对叶圈群落的观察相吻合。结果表明,同一叶片上的物种间多样性非常丰富,这可能预示着竞争的强度不强。对某些藻类及其最近亲属的系统发育分析,使我们能够探索向感兴趣的栖息地转变的数量和速度,并为这些转变中重要的生理特征提供见解[39].在目前的研究中,已经报道了藻类在Watanabea据报道,进化支含有几种菌孢素样氨基酸(MAAs),可在过度紫外线辐射下存活[66].未来对这些藻类生理学的研究可能为了解它们对叶层圈的适应提供更多线索。
结论
SMRT测序对于准确分析层际藻类群落非常有用。结果表明,热带层际真核藻类的多样性非常高。在这些生境中仍有许多未被描述的物种,尤其是绿藻类。Trentepohliales,Watanabea分支和apatococcus.枝藻类是热带森林叶面藻群落中的优势藻类。在物种水平上,群落结构与寄主植物和位置没有显著的关系。穆萨和Ravenala在属水平上与其他寄主植物差异显著,叶结构和生长速率均不同,主要以附生trebouxiophysian植物为主。本研究提供了大量新的18S rDNA序列,这将有助于揭示叶圈真核藻类的隐性多样性,并与今后此类群落的类似研究进行比较。
方法
采样地点及收集
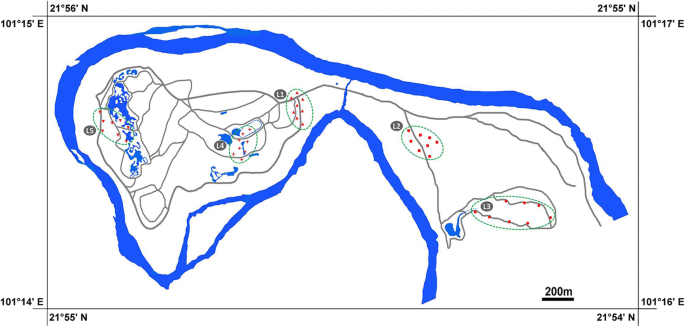
我们收集了真核藻类从陆地上的植物随机西双版纳热带植物园的叶面上在2017年八月样品从5点(图收集。10和额外的文件7:表S1);我们收集了8个样品从每个站点。Each sample was collected at a distance of at least 10 m from all other samples. We selected ten different host trees (Mangifera,arocarpus.,花芽,热带榕属植物,Coffea,山茶花,Chrysalidocarpus,Caryota,穆萨和Ravenala).每个样品在离地面2 m的地方采集(因此我们不能观察到阳性表面,以确保所有的叶子都是随机采集的),从不同的地点和不同的寄主树,从单个植物上剪下2 - 6片叶子放入牛皮纸纸袋中。本研究共采集了40个样本并带回实验室。用小手术刀和刷子在立体镜下轻轻刮拭可观察到的叶状肿块。将无明显海藻覆盖的叶子切成小碎片,用稀释的PBS(磷酸盐缓冲盐水,pH = 7.4)在小袋子中摇匀,然后在6000×g离心10分钟,将微生物团击碎。对于每个样品,用真空冷冻干燥机干燥一部分海藻块,在−80°C保存。其余标本用标本夹干燥,保存在中国科学院武汉水生生物研究所淡水藻类标本馆。
西双版纳热带植物园5个采样点和40个采样点分布图(作者根据国家测绘地理信息局的资料绘制)http://www.sbsm.gov.cn/).可以在附加文件中查看详细的采样站点7S1:表
DNA提取,扩增和测序
通过手动ω高等植物DNA试剂盒提取每种环境质量的总DNA(约0.05g)。我们使用了两个通用SSU RDNA引物,NS1F和NS8R,NS1F和1650R的夫妇[67]以扩增SSU rDNA的基因。For both couples of primers, the thermal-cycling profiles were as follows: 94 °C for 5 min, then 33 cycles of 94 °C for 30s, 54 °C for 45 s and 72 °C for 60s, followed by a final extension at 72 °C for 6 min. The products of each sample were mixed and purified with the QiaEX Gel Extraction Kit (Qiagen, Valencia, CA, USA) and sent to Shanghai Personal Biotechnology Co., Ltd. for SMRT sequencing by Pacbio Squeal platform. The products of each sample were assigned to unique forward and reverse barcode respectively, and then just one library was constructed for sequencing. We used circular consensus sequencing approach (CCS). With consensus sequencing at least three passes (≥3 CCS), the average error rate was guaranteed to decrease theoretically less than 1.0‰. All sequences have been deposited in the SRA of the NCBI database under the accession no. SRP14140.
生物信息分析
根据条形码将不带适配器的原始读取分配给不同的样本(附加文件8:表S2)。Any joined sequences with ambiguous bases (including sequences with more than 5 mismatches base-pairs at 5′ end and with more than 8 same sequential base-pairs and Chimera sequences) and lengths < 1500 bp were discarded by QIIME (Quantitive Insigts Into Micriobial Ecology, v1.8.0) [68].根据Schloss等人的建议,使用mothur (v. 1.34)对高质量序列进行进一步处理。[69].序列以98%的识别阈值聚类成操作分类单元(OTUs)。每个OTU的代表性序列由BLASTn注释,只对真核藻类OTU进行处理。将所有具有代表性的序列归为5个藻类纲,即Trebouxiophyceae、Ulvophyceae、绿藻纲、恐龙藻纲和真藻纲。将丰度低于0.001%的OTUs从群落数据矩阵中删除,但保留用于系统发育分析。
所有OTUs的分类学分析
利用OTUs构建了5个基质(Trebouxiophyceae, Ulvophyceae,绿藻科,恐龙藻科和真假藻科),并从GenBank (https://www.ncbi.nlm.nih.gov/genbank/).基质由Mafft 7.3对齐[70].使用Modelfinder根据AIC标准为每个矩阵选择最佳模型[71].在本研究中,我们使用IQ-TREE进行最大似然分析[72],并使用SH检验和节点间确定性来评估最大似然树的拓扑结构。使用UFboot2方法在最佳拟合模型下进行bootstrap分析[73].在所有五次UFboot2分析中,分裂发生频率的Bootstrap相关系数设置为0.99。然后使用从RaxML的IQtree中获得的bootstrap树测试节点间确定性[74].
根据系统发育推断的结果,我们将几乎所有otu划分为11个序级系统群(命名为apatococcus.组,Watanabea组,CBCE组,Prasiolales组,Trebouxiales组,Microthamnionales Group,Volvocales组,那次组、Trentepohliales组、Eustigmatales组和Gymnodiniales组)。OTUs又细分为丝状藻类和单细胞藻类两种形态。
统计分析
利用QIIME软件计算样本的多样性指数,包括Shannon-Wiener指数和Simpson多样性指数。维恩分析在维恩图包中进行[75在R版本3.2中[76].采用双向方差分析(ANOVA)方法,研究了寄主树和采样地点对不同藻类物种alpha多样性(OTUs数量、Shannon-Wiener指数和Simpson指数)和相对丰度的影响。采用SPSS 18.0软件包(SPSS, USA)进行方差分析p-value < 0.05表示显著性。原始数据在进行统计分析前采用标准化方法归一化,使用Primer 6.0进行ANOSIM (analysis of Similarity)、SIMPROF (Similarity Profile analysis)和NMDS (Non-parametric Multi-Dimensional Scaling) [77].采用Bray-Curtis不相似度测量数据矩阵的相似度。
缩写
- ANOSIM:
-
分析相似之处
- 方差分析:
-
方差分析
- CCS:
-
圆形的共识测序
- MAAs:
-
Mycosporine-like氨基酸
- nmd:
-
非参数的多维扩展
- 辣子鸡:
-
操作的分类单位
- SIMPROF:
-
相似剖面分析
- SMRT:
-
单分子实时测序
参考文献
- 1.
Vorholt农协。叶层中的微生物。微生物学报。2012;10(12):828-40。
- 2.
赫夫曼L.陆地栖息地的藻类。BOT Rev. 1989; 55(2):77-105。
- 3.
Gradstein SR。叶生苔藓植物的遗传多样性。社区ECOL。1997; 21(1):15-9。
- 4.
Lindow SE, Leveau JH。叶围微生物学。生态。2002;13(3):238 - 43。
- 5.
特纳Tr,詹姆斯ek。Poole PS。植物微生物组。基因组Biol。2013; 14:209。
- 6.
袁磊,王普文,王宝强。叶圈微生物群落的季节性演替。植物营养与肥料学报。2015;28(3):274-85。
- 7.
lforest - lapointe I, Messier C, Kembel SW。随着城市强度的增加,树木叶片细菌群落结构和多样性也有所不同。mSystems。2017; 2 (6): e00087-17。
- 8.
王光杰,王光杰,梁文忠,王光杰。噬菌体对叶圈细菌丰度和组成的影响。摩尔生态。2018;27:2025-38。
- 9.
刘志刚,刘志刚,刘志刚,等。新加坡热带低地森林中生长在树皮和木材上的藻类和蓝藻的多样性。acta botanica yunnanica(云南植物研究),2010;43(1):51-62。
- 10.
Leliaert楼史密斯博士,莫罗H,赫伦博士,维尔布鲁根H,Delwiche CF,Clerck OD。系统发育和绿藻类的分子进化。CRIT Rev Plant Sci。2012; 31(1):1-46。
- 11.
Rindi F, Allali HA, Lam DW, López-Bautista JM。陆生绿藻生物多样性与生物地理学综述。在:Rescigno V, Maletta S,编辑。生物多样性热点地区。纽约:新星科学出版社;2010.105 - 22页。
- 12.
Nelsen议员,Plata ER, Andrew CJ, Lücking R. Lumbsch HT。与地衣形成真菌相关的双翅目藻类系统发育多样性。J Phycol。2011;47(2):282 - 90。
- 13.
张志强,张志强,张志强,等。石墨藻科植物的系统发育位置和形态特征。Phycol研究》2014;62(3):170 - 86。
- 14.
陈志强,陈志强,陈志强,等。绿藻生物多样性的分子生物学研究进展[j]。J Phycol。2016;52(5):732 - 44。
- 15.
Hodač L, Hallmann C, Spitzer K, Elster J, Faßhauer F, Brinkmann N, Lepka D, Diwan V, Friedl t小球藻和Stichococcus展示极地-温带和热带-温带生物地理。微生物生态学杂志。2016;92(8):fiw122。
- 16.
属Phycopeltis(绿藻门,绿藻目)源自东南亚热带。Nova Hedwigia。2003;76(76):487 - 506。
- 17.
刘志刚,刘志刚,刘志刚,等。热带山地树皮上陆生藻类和蓝藻的多样性。Biologia。2008;63(6):806 - 12所示。
- 18.
Němcová Y, Eliáš M, P Š, Hodač L, Neustupa J。那次11月:一个球藻绿藻新属(绿藻科,incertae sedis),以前被环境测序记录。J Phycol。2011;(4):47 928 - 38。
- 19.
NeustupaĴ,Elias的男,ŠkaloudP,科娃Y,ŠejnohováL.Xylochloris irregularis一种新型的地面球藻绿藻。植物植物。2011; 50(50):57-66。
- 20.
Darienko T,Gustavs L,Mudimu O,Menendez Cr,Schumann R,Karsten U,Friedl T,PröscholdT。Chloroidium,一种常见的陆生球藻,以前被认为是小球藻(Trebouxiophyceae,绿藻门)。acta Phycol. 2010;45(1): 79-95。
- 21.
罗w,pröscholdt,bock c,krienitz l.泛型概念小球藻与球藻相关的绿藻(绿藻门,藻门)。植物医学杂志。2010;12(3):545 - 53年。
- 22.
陈志强,陈志强,陈志强。浮游球藻绿藻系统分类的研究现状。Hydrobiologia。2012;698(1):295 - 326。
- 23.
Krienitz L,黑格瓦尔德EH,Hepperle d,胡斯VAR,罗尔T,狼M.亲缘关系小球藻和Parachlorellagen. Nov.(绿藻门,trebouxiophysiaceae)。Phycologia。2004年,43(43):529 - 42。
- 24.
利亚男,Neustupa J.Pseudomarvania,Gen。十一月(绿藻,共球藻纲),为“萌芽”陆上绿藻一个新属Marvania aerophyticaNeustupa等Šejnohová和stichococcus ampulliformis.翰达岛。Fottea。2009;9(2):169 - 77。
- 25。
Pröschold T, Darienko T, Silva PC, Reisser W, Krienitz l虫绿藻重新讨论了采用综合方法。环境Microbiol。2011;13(2):350 - 64。
- 26。
Thüs H, Muggia L, Pérez-Ortega S, Favero-Longo SE, Joneson S, O 'Brien H, Nelsen MP, Duque-Thüs R, Grube M, Friedl T.回顾地衣科疣状菌科(子囊菌科)的光生物多样性。acta Phycol. 2011;46(4): 399-415。
- 27。
引用本文:Sadowska-Deś AD, Grande FD, Lumbsch HT, Beck A, Otte J, Hur J. classification of species in lichen photobiont . Sadowska-Deś AD, Grande FD, Lumbsch HT, Beck A, Otte J, Hur J共球藻属.中国生物医学工程学报。2014;76(1):202-10。
- 28。
Darienko T,Gustavs L,埃盖特A,狼W,PröscholdT.评价绿色微藻物种边界(Coccomyxa利用综合分类学和dna条形码技术对环境样品中的物种鉴定进行了研究。《公共科学图书馆•综合》。2015;10 (6):e0127838。
- 29.
Rindi F, Guiry M, López-Bautista JM。的分布、形态和系统发育Klebsormidium(Klebsormidiales, charophysiae)在欧洲城市环境中的研究。J Phycol。2008;44(6):1529 - 40。
- 30.
林迪F, Lam DW, López-Bautista JM。巴拿马绿藻目(褐藻门,绿藻门)。Nova Hedwigia。2008;87:421-44。
- 31。
绿色Ĵ,Bohannan BJM。微生物生物多样性的空间尺度。趋势ECOL EVOL。2006; 21(9):501-7。
- 32。
Procházková K, Némcová Y, Neustupa J。Phyllosiphon duini从皮质光营养生物膜中分离出来的一个物种。Cryptogamie算法。2018;39(1):23-34。
- 33.
林迪F, Lam DW, López-Bautista JM。系统发育关系和物种界限Trentepohlia和Printzina(Tretepohliales,叶绿藻)。mol phylocyet evol。2009; 52(2):329-39。
- 34.
朱华,胡振华,刘国刚。中国绿门绿爪目的形态和分子系统发育。acta Phycol. 2017;52(3): 1-12。
- 35.
Vargas CD, Audic S, Henry N, Decelle J, Mahé F, Logares R, Lara E, Berney C, Bescot NL, Probert I.阳光下海洋中的真核浮游生物多样性。科学。2016;348:29223618-25。
- 36.
Tragin男,Zingone A,从18S rRNA基因的V4和V9区域估计为重点的光合基和尤其是绿藻沿海浮游植物组合物Vaulot D.比较。环境微生物。2018; 20(2):506-20。
- 37.
Caron DA, Countway PD, Savai P, Gast RJ, Schnetzer A, Moorthi SD, Dennett MR, Moran DM, Jones AC.微生物-真核生物生态学中基于dna的操作分类单元的定义。应用环境微生物学报2009;75(18):5797-808。
- 38.
Thompson RH, Trentepohliales WDE。Cephaleuros,Phycopeltis, 和Stomatochroon:形态,分类,生态。新罕布什尔州:科学出版社;1997. p。1-149。
- 39.
LA刘易斯,刘易斯PO。发掘漠土绿藻(绿藻)的分子phylodiversity。系统中的生物学。2005; 54(6):936-47。
- 40.
路易斯·洛杉矶,特雷纳FRProtosiphon一串葡萄状的(绿藻科,绿藻门)从康涅狄格州的土壤干了43年。51 Phycologia。2012;(6):662 - 5。
- 41.
MA Song, OM Lee。韩国8种新报道的绿藻和褐藻植物的研究。生态环境学报,2014;37(4):341-50。
- 42.
黄志强,王志强,王志强,等。绿藻门(绿藻门,褐藻门):一种不同寻常的藻类目Cephaleuros.工厂说。2015;99(6):740 - 53年。
- 43.
林分内皮质微藻群落结构:评价树皮表面pH值和树种的影响。Fottea。2015;15(2):113 - 22所示。
- 44.
Škaloud P, Friedl T, Hallmann C, Beck A, Grande FD。修正球藻属绿藻属(绿藻门,Trebouxiophyceae,绿藻门)的分类学和物种划分。J Phycol。2016;52(4):599 - 617。
- 45.
Barcytėd,HodačL,NedbalováL.Lunachloris lukesovae根本。等SP。11月。(Trebouxiophyceae,叶绿素),从南波希米亚,捷克共和国的土壤中分离的新型椰子绿藻。欧语J Phycol。2017; 52(3):1-11。
- 46.
KulichováĴ,ŠkaloudP,由两个子地中海欧洲地区绿色生地微藻Neustupa J.分子多样性。欧语J Phycol。2014; 49(3):345-55。
- 47.
王志强,王志强,王志强,等。基于rDNA序列的链藻门(链藻门)系统发育及其二级结构模型研究Klebsormidium,Hormidiella, 和Entransia.J Phycol。2008;44(1):183 - 95。
- 48.
陈志强,陈志强,陈志强,等。陆生陆生绿藻生物膜形成机理的研究进展。J Phycol。2011;47(3):533 - 7。
- 49。
Zahradníková M, Andersen HL, Tønsberg T, Beck aapatococcus.,包括答:fuscideaesp。11月。,作为属的PhotobiontFuscidea.原生生物。2017;168(4):425 - 38。
- 50.
KROKEN S,TAYLOR JW。绿藻种,生殖模式和绿藻的特异性共球藻属形成地衣与真菌属Letharia.Bryologist。2000;103:645-60。
- 51。
光生物是否影响地衣的生态?共生绿藻环境偏好的个案研究Asterochloris(Trebouxiophyceae)。摩尔生态。2011;20(18):3936 - 48。
- 52。
Neustupa J, Němcová Y, Eliáš M, Škaloud P。Kalinellabambusicola gen. Et sp. nov.(绿藻门,Trebouxiophyceae),一种新的球虫小球藻,比如来自东南亚的陆生藻类。Phycol杂志2009;57(3):159 - 69。
- 53。
马胜,胡斯,谭东,孙旭,陈杰,谢勇,张建军。一种新属植物Heveochlorella(绿藻门,绿藻门)见证了树栖绿藻从附生到内生的进化过程。acta Phycol. 2013;48(2): 200-9。
- 54。
NeustupaĴ,科娃Y,VeseláĴ,SteinováĴ,ŠkaloudP.Parachloroidium来自陆地皮质生物膜的球藻新属(Trebouxiophyceae,绿藻门)。52 Phycologia。2013;(5):411 - 21所示。
- 55。
Procházková K, Nmcová Y, Kulichová J, Neustupa J.属寄生和自由生活成员的形态和系统发育Phyllosiphon(Trebouxiophyceae,绿藻门)。Nova Hedwigia。2015;101:501-18。
- 56。
宋华,张强,刘刚,胡智。Polulichloris henanensis一种新型的地面球藻绿藻。Phytotaxa。2015;218(2):137 - 46所示。
- 57.
宋辉,胡勇,朱辉,王强,刘国华,胡振中Watanabea进化枝(Trebouxiophyceae,绿藻门)。中国生物医学工程学报。2016;66(12):5465-77。
- 58.
宋辉,李胜,刘旭,王强,朱辉,刘刚,胡志强。Jenufa lobulosasp。十一月(绿藻绿藻),从中国所描述的石生新,陆地物种。植物植物。2018; 57(1):52-60。
- 59.
王志强,王志强,王志强,等。基于18S rRNA系统发育分析的叶绿素类分子系统学研究[j]。acta physica sinica, 2008;48(1): 281-91。
- 60.
Fawley KP,埃利亚斯男,Fawley兆瓦。商业重要的藻类大眼藻纲的多样性和系统发育,包括新的分支Goniochloridales。J Appl Phycol。2014; 26(4):1773至1782年。
- 61.
knife C, Ramette A, Frances L, Alonsoblanco C, Vorholt JA。地点和植物种类是决定植物层际甲基杆菌群落组成的重要因素。ISME j . 2010; 4(6): 719 - 28。
- 62.
Whipps JM,手P,粉红d,弯曲GD。叶围微生物学特别提到多样性和植物基因型。J appl microbiol。2008; 105(6):1744至1755年。
- 63.
肯贝尔SW, O'Connor TK, Arnold HK, Hubbell SP, Wright SJ, Green JL。新热带森林叶圈细菌群落与植物功能性状的关系。美国国立科学院。111(38): 13715 - 2014; 20。
- 64.
Narwani A, Alexandrou MA, Oakley TH, Carroll IT, Cardinale BJ。实验证据表明,进化亲缘关系并不影响淡水绿藻共存的生态机制。生态。2013;16(11):1373 - 81。
- 65.
Narwani A, Bentlage B, Alexandrou MA, Fritschie KJ, Delwiche C, Oakley TH, Cardinale BJ。通过基因表达相似性预测淡水绿藻的生态相互作用和共存。J Phycol。2017;105(3):580 - 91。
- 66.
卡斯滕U,弗里德尔T,舒曼R,霍尔K,Lembcke S.菌胞素样氨基酸和系统发育中绿藻:从共球藻纲(绿藻)prasiola及其亲属。J phycol。2005; 41(3):557-66。
- 67.
白TJ,布伦斯TD,李SB,泰勒JW。扩增和真菌核糖体RNA基因的系统发育直接测序。在:英尼斯N,盖尔范德d,SninskyĴ,白TJ,编辑。PCR-协议和应用程序,实验室手册。纽约:学术;1990年第315-22。
- 68.
等。关键词:生物力学,生物力学,生物力学,Stombaugh, Bushman FD, et al。QIIME允许分析高通量社区测序数据。Nat方法。2010;7:335-6。
- 69.
Schloss PD, Westcott SL, Ryabin T, Hall JR, Hartmann M, Hollister EB, Lesniewski RA, Oakley BB, Parks DH, Robinson CJ。介绍mothur:用于描述和比较微生物群落的开源、平台独立、社区支持的软件。应用环境微生物学报2009;75(23):7537-41。
- 70.
kaoh K, Standley DM. MAFFT多序列比对软件版本7:性能和可用性的改进。生物医学进展。2013;30(4):772-80。
- 71.
Kalyaanamoorthy S, Minh BQ, Wong TKF, Haeseler AV, Jermiin LS。ModelFinder:用于精确系统发育估计的快速模型选择。Nat方法。2017;14(6):587 - 9。
- 72.
Nguyen LT, Schmidt HA, Haeseler AV, Minh BQ。IQ-TREE:一种快速有效的估计最大似然系统发育的随机算法。生物医学进展。2015;32(1):268-74。
- 73.
黄志强,陈志强,冯亚明,黄志强。UFBoot2:改进超快速引导近似。生物化学学报。2017;35(2):518-22。
- 74.
Stamatakis a . RAxML版本8:系统发育分析和大系统发育后期分析的工具。生物信息学。2014;30(9):1312 - 3。
- 75。
陈H,布特罗斯PC。维恩图:在R. BMC生物信息学中生成高度可定制维恩图和欧拉图的软件包。2011;12(1):35。
- 76。
R开发核心团队。统计计算的语言和环境。统计计算基础,维也纳,奥地利。计算。2016;14:12-21。
- 77。
Clarke Kr,Gorley RN。PRIMER V6:用户手册/教程。2006年。
致谢
非常感谢Università politecnicica delle Marche的Fabio Rindi博士对这份手稿早期版本的建设性评论。
资金
基金资助:国家自然科学基金(批准号:no. 201430430429);中国科学院重点部署项目(批准号:31600168、31870189);zdrwzs - 2017 - 221)。两位支持者都没有参与研究的设计、标本的收集、数据的分析和手稿的撰写。
数据和材料的可用性
支持本文结论的数据集包含在本文及其附加文件中。样本采集遵循水生生物研究所淡水藻类标本室编制的指南。所有干燥样品均保存在中国科学院水生生物研究所淡水藻类标本馆。所有序列均保存在NCBI数据库的SRA中。SRP14140。
作者信息
从属关系
贡献
HZ, GL和ZH构思了这项研究。HZ和SL采集样本并进行实验。HZ分析数据并撰写稿件。所有作者均已阅读并批准本稿件。
通讯作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
利益争夺
两位作者宣称他们没有相互竞争的利益。
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
附加文件
附加文件1:
图S1。质量序列的长度分布。序列长度的频率(以碱基对计)绘制为152324个序列。(TIF 944 kb)
附加文件2:
图S2。稀疏分析显示40个样品的采样强度。测序深度为0 ~ 700条序列,随机分次采样。(TIF 1261 kb)
附加文件3:
图S3。40个样本的alpha多样性,包括OTUs数量、Shannon多样性和Simpson多样性。(TIF 1927 kb)
附加文件4:
图S4。的10种主机树木,包括丰富度(数个OTU的),丰度(序列数),香农多样性和Simpson多样性阿尔法多样性。(TIF 705 KB)
附加文件5:
图S5。5个采样点的alpha多样性,包括丰度(OTUs数量)、丰度(序列数量)、Shannon多样性和Simpson多样性。(TIF 541 kb)
额外的文件6:
图S6。基于阶级分类成分相似性(Bray-Crutis距离)的40种叶圈藻类群落结构的非线性多维尺度分析(TIF 850 kb)
额外的文件7:
表S1。采样从每个样品从西双版纳热带植物园40个叶子标本的位点和获得的序列的数量。(docx 18 kb)
额外的文件8:
表S2。用于在聚合测序运行中识别样品的40个条形码。(多克斯15 kb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
朱华,李淑芳,胡振宇。et al。基于18S rDNA基因实时测序的热带层际真核藻类群落分子特征研究BMC植物杂志18,365(2018)。https://doi.org/10.1186/s12870-018-1588-7
已收到:
接受:
发表:
关键字
- 空中藻类
- 群落结构
- 多样性
- 底影圈
- 种系发生
- SMRT测序
- 热带森林