抽象的
背景
开花过渡受复杂的基因调控网络控制,在植物后代的繁殖中起着重要作用。花发育的关键过渡状态及其调控基因的确定是一个挑战。随着大规模平行测序的出现,大量的时间-过程转录组数据极大地促进了对植物发育阶段转变的探索。尽管一些基于网络的生物信息学分析试图识别控制相变的基因,但它们通常忽略了调控的动态,导致了不可靠的结果。此外,这些方法的结果是无法自我解释的。
结果
在这项工作中,为了揭示关键的过渡状态并确定花发育的过渡特异性基因,我们对颞基因表达数据进行了基因组 - 宽的动态网络分析拟南芥通过动态网络生物标志物(DNB)方法。在分析中,可以利用在网络水平下利用集体波动和不同代谢物的相关性和相关性的DNB模型来检测即将发生临界过渡状态或尖端。控制相变的基因可以通过感兴趣的基因与全球网络中其他基因的加权相关性的差异来识别。为了构建调控开花过渡的基因调控网络,我们采用了能减少过渡特异基因表达数据的噪声、冗余和间接调控的狭缝算法。在结果中,在形成花期间检测到的临界过渡状态对应于第7至第9天开花的开发拟南芥.在233个基因中鉴定在过渡状态下高度波动的基因中,检测到具有最大花粉中具有最大表达的基因,验证了24个基因,参与应激反应过程,以及其他与花卉相关途径。由三个主要子网组成,发现具有150个节点和225个边缘的基因调节网络与开花过渡高度相关。途径富集分析的基因本体(GO)注释显示鉴定的基因富含催化活性,代谢过程和细胞过程。
结论
本研究为利用全基因组动态网络分析识别相变的真正因果关系提供了新的见解。
背景
在生命周期期间,开花植物在包括萌发,幼苗,开花和结果期间发生了一系列发展阶段。作为植物发育的特殊模式,相变对植物的存活和繁殖至关重要,相转移的失败实施将导致发育功能障碍[1那2那3.].与植物开发有关的相转变包括种子 - 幼苗过渡[4.,即从少年到成年的植物性过渡[5.],植物与生殖过渡[6.],异养 - 自养过渡[7.],开始达到成熟的花卉过渡[8.,等等。这些发展相转变形成植物的主要功能机制[9.].
在发育阶段的转变中,开花转变被实验生物学家广泛研究,因为开花是从营养生长到生殖生长的不可逆转变,是一个重要的定性过程,是植物发育的关键阶段,是后代的生殖[10].开花过程包括三个阶段,即花卉诱导阶段,花卉原始阶段和花卉器官发展阶段[8.].在这些阶段期间,一系列基因如开花时间控制基因,分生形式基因和花器官身份基因涉及开花过渡的调节[11].
为了了解开花过渡的机制,近年来开展了一系列关于花发育的深入研究,其结果提供了一些重要线索[12那13那14那15]. 例如,据报道,花的发育首先表现为形态的巨大变化,如花图案、花器官大小和花器官规格。这些变化受大量调控因子如转录因子和miRNA的调控[8.那16].在高等植物个体发生过程中,生长锥由叶的分化转变为花芽的分化,标志着营养生长向生殖生长的过渡或花发育的开始[11].
近年来,越来越清楚的是,相变由包含内源性和环境提示的不同遗传回路控制,例如NF-Yc和ClF之间的相互作用,MiR156和MiR173之间的相互作用[9.,等等。这些基因参与了阶段转变的调控,通过经历规律的变化形成一个复杂的基因调控网络(GRN) [11]. 模式植物的开花机理拟南芥相对清晰的是开花基因调控网络,涉及光周期、自主、春化和赤霉素途径等信号转导网络[17].越来越多的研究表明,开花发展基因监管网络提供了重要突破,以便更好地理解开花过渡的固有机制。
由于下一代测序技术的进步,生物信息学和计算生物学通过全基因组转录组分析加快了生物学研究的进程[18].转录组分析提供了研究生物学问题的完美方法,因为它不仅给予了基因表达模式的全局视图,包括生物学功能富集,而且通过鉴定一组共表达基因来提供预测尺寸[19那20.].随着优点的优点,高吞吐量转录组数据的生物信息学分析提供了一种强大的工具,以解决在基因组范围内探索相变机制的问题[21].
通过预测GN的转录组分析已被用于发现植物中的调节机制[22].人们已经开发了不同类型的工具来从基因表达数据推断出大规模grn,如基于相关性的方法[23],相互信息的方法[24那25[基于回归的方法[26那27那28].我们的团队之前已经开发了一些GRN推断工具,如窄带[29],pca-cmi [30.]和cmi2ni [31那32].这些方法通过降低嘈杂,冗余和间接法规,大大提高了GRN推断的准确性。
最近,预测性GRN被用于分析植物的相变和一些控制种子-幼苗相变的新基因拟南芥被确定(19那33].不仅如此拟南芥通过整合蛋白-蛋白相互作用网络和基因表达数据,破译了花的过渡过程[34].由于多基因相互作用的时空动态特征,传统的分析方法难以准确地反映复杂相变的真实情况。目前的研究主要集中在未分化干细胞作用下花的发育机制,而对花器官向成熟转化的机制研究较少[35].此外,目前的方法没有充分利用相变的动力学特性,也不一定能捕捉到控制相变的真实调节器[36].而具有多重复制的时间进程转录组数据则为生物信息学分析提供了材料,以确定相变的调控因子[37那38].
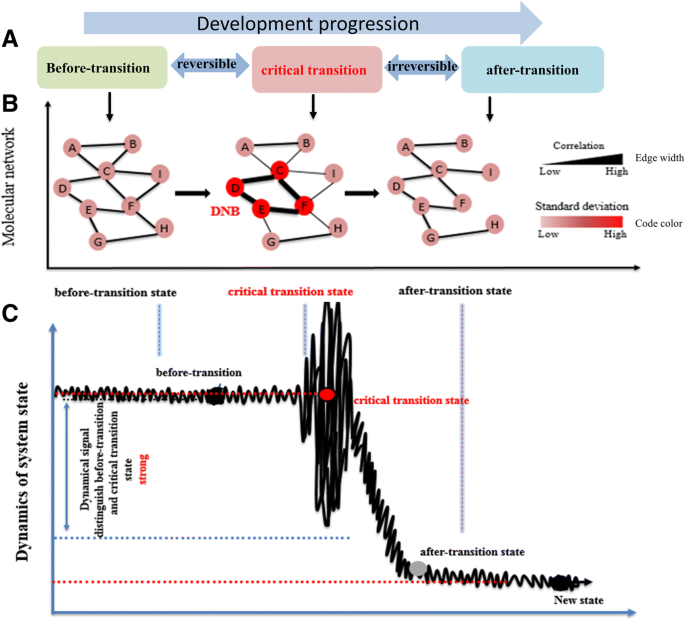
随着时间程高通量转录组数据的日益增多,一些基于动态网络分析的生物信息学工具被开发出来,并被广泛用于研究复杂的生物学机制[39那40].例如,开发了名为DNB的动态网络生物标志物识别工具以检测生物标志物[41].该方法将一个复杂的生物过程(如细胞周期的分化过程、衰老过程、相变等)分为三个阶段或状态,即过渡前状态、临界过渡状态和过渡后状态[42].在焦点系统中,从临界过渡状态到转变后状态的急剧或定性转变对应于动态系统理论中的分叉点[43].当系统接近临界点时,一组占主导地位的生物标志物就会分叉。生物标志物可以定义为三个条件:孤立的子网络或功能模块、成员波动性大、任意一对成员之间相关性强、成员与非成员之间相关性弱[44].具有坚实理论支撑的动态网络分析已成功应用于实际生物数据[43那44那45].
在本研究中,为了提供对开花发育转变的新认识,我们对时间进程的基因表达数据进行了全基因组动态网络分析拟南芥.该数据集包含从开花开始到成熟的14个花期,每个花期3个重复,提供了一个花期发育的动态过程。控制相变的基因可以通过感兴趣的基因与全球网络中其他基因的加权相关性的差异来识别。为了构建调控开花过渡的基因调控网络,我们采用了能减少过渡特异基因表达数据的噪声、冗余和间接调控的狭缝算法。结果通过生物学实验分析验证,预测的过渡状态与表型中开花的真实过渡状态一致。我们还对水稻花发育的时间基因表达谱数据集进行了类似的分析,以支持得出的结论。最终,我们发现了水稻花发育的一个临界过渡状态。通过对基因表达时间过程数据的动态网络分析,为确定开花过渡状态和控制开花过渡的关键致病基因提供了新的思路。
结果
用于检测复杂生物系统临界过渡状态的动态网络生物标志物(DNB)模型
In the phase transition model, a complex biological process (e.g., differentiation processes, aging processes, and changes in the phases of the cell cycle) can be generally divided into the three stages, i.e. the before-transition state, the critical transition state, and the after-transition state [42].在过渡之前的状态相对稳定,但由于某些内部和外部刺激器,可能逐渐变化(图。1).临界转换状态可以被理解为在临界转换之前的过渡前状态的极限。不仅如此,而且可以通过适当的外部干预措施轻松地恢复到过渡前状态,因此被认为是可逆的。虽然即使有强化干预措施,过渡状态也稳定且不可逆。通过识别动态网络生物标志物(DNBS),我们可以控制复杂的系统,以避免系统的发展朝向坏状态。换句话说,控制系统的发展的“原因”可以避免发生“效果”或改变“效果”的形状。粉碎鸡蛋中的麻烦源是至关重要的,以实现以较低的成本实现有效控制复杂系统的理想效果。
通过以下条件总结了检测DNB的理论依据(图。1b和c).简单地说,DNB是原始系统中由一组特殊分子组成的可观测子网,仅在临界状态下才满足以下四项要求[46]:
- 1.
DNB分子或标记高度波动,即DNB成员(基因)的偏差急剧增加(SD高)d).
- 2.
DNB的所有成员都是高度共同表达的,即DNB成员之间的相关性变得更强(高PCCd).
- 3.
DNB成员几乎独立于非DNB成员。DNB是一个孤立的子网络或功能模块,即任何DNB分子与其他非DNB分子之间的相关性降低(PCC低)o).
- 4.
系统中所有非DNB分子之间没有明显的偏差或相关性。
为了检测临界过渡状态的可靠和明确信号,提出了一种如下综合指数(CI)
在SDd和PCCd是平均标准偏差(SD)和平均值皮尔逊DNB模块中所有分子的相关系数(PCC)d分别在PCCo分子间的平均相关系数是多少d和其他不在的d.当生物系统接近临界过渡状态时,CI提供了可靠而重要的预警信号。在所有响应的CI模块中,最大的一个很可能是对应于系统关键阶段的DNB。
全基因组动态网络分析的管道
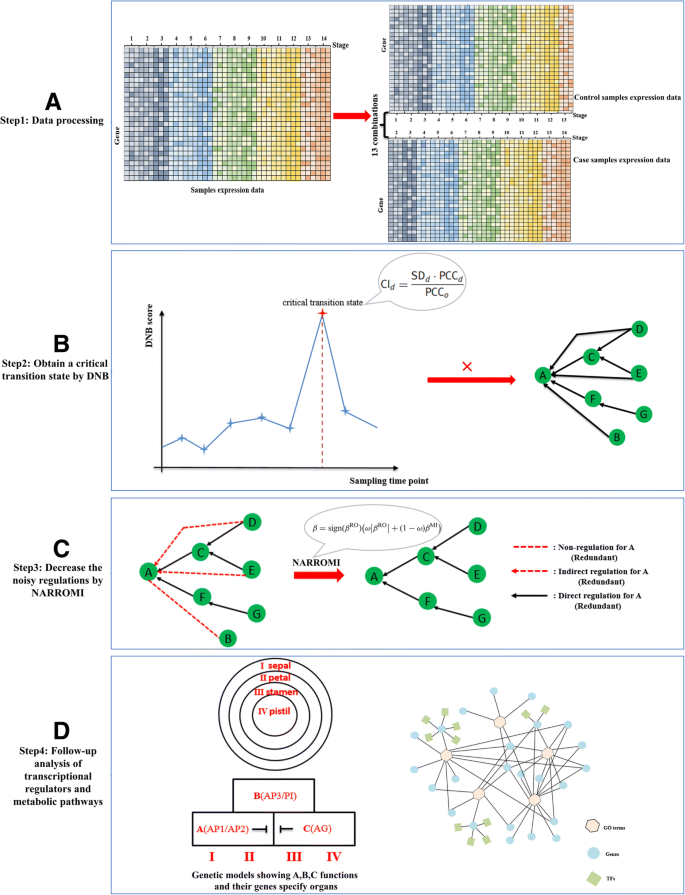
为了提供对开花发育转型的新洞察力,我们对时机基因表达数据进行了基因组 - 宽的动态网络分析拟南芥.该数据集包含从开花开始到成熟的14个花期,每个花期3个重复,提供了一个花期发育的动态过程。然而,动态网络分析有效地揭示了关键的子网仍然是一个挑战[8.].此外,没有匹配病例和对照样本的数据。因此,有效的数据处理对识别花发育过渡的DNBs至关重要。
以前的研究表明拟南芥花是按顺序被激活的,因此它们的花序处于不同的发育阶段[47].人们还发现,头顶上的花拟南芥整个花发育中的花序仍然非常同步,因此可以获得开花的时间序列基因表达数据[8.].为了克服匹配的情况和控制样品的数据缺乏数据,以前时间点的样品被指定为控制样品,并且邻居样品被设计为案例样本。然后,从初始到成熟的14个不同的发育阶段被分成13个案例控制组合,我们可以检测拟南芥花发育的相变(图。2a) 。
用于揭示临界过渡状态的流程图。一个使用先前的样品以及分别指定为控制和案例样本的当前时间点。从初始到成熟的14个不同的发育阶段分为13种组合。b我们应用DNB方法来揭示临界分化状态拟南芥通过对照和病例样品的比较来观察花的发育。c为了构建控制开花转换的基因调节网络,我们应用了在转变特定基因的表达数据上的Narromi算法。Narromi算法分别使用普通微分方式的递归优化(RO)和基于信息理论的相互信息(MI),从间接调节器的低对相关性和来自间接调节器的冗余规则的嘈杂规定。没有箭头的虚线表示非调节(冗余),虚线箭头表示间接调节(冗余),实心箭头表示真正的调节。d我们还分析了与阶段过渡密切相关的关键监管因素和关键代谢途径拟南芥花期的发育从开始到成熟的时间
基于传统差异表达分析的DNB模型被应用于从开始成熟时检测花发育的临界分化状态拟南芥(无花果。2b)。可以降低转变特定基因表达数据的嘈杂,冗余和间接规定的Narromi算法用于构建控制开花转变的基因调节网络(图。2c) (29].随着DNBs的鉴定,关键调控因子和代谢途径与细胞的相变密切相关拟南芥分析了花从起始到成熟的发育过程(图。2d)。
识别的临界过渡状态拟南芥花的发育
识别的临界分化阶段或临界过渡状态拟南芥从开花开始到成熟,花的发育过程是阐明植物开花调控分子机制的关键。然而,传统的基于差异表达分析的方法,由于在过渡前和临界过渡状态中分子缺乏显著的差异表达,无法检测到临界状态。为了克服这个问题,我们开发了DNB模型来测量分子的集体波动,取代了传统的微分表达式分析(见方法)。传统方法往往依赖分子的微分表达式,而DNB模型既使用分子间的微分相关性,也使用分子间的微分偏差[41那48].尽管在前进前的状态下基因之间的弱差异表达以及临界过渡状态,但在这两个状态中存在显着的差异相关性和基因之间的偏差。
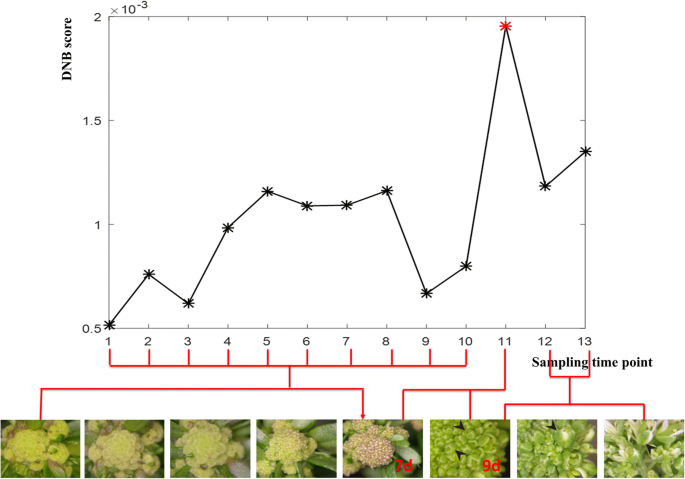
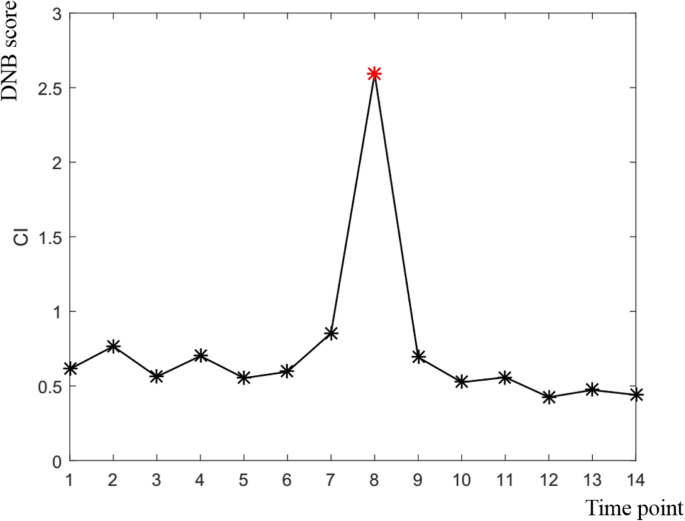
实现了DNB模型拟南芥花卉开发数据集(NCBI Access No.GSE64581),以确定从发起到成熟时的临界过渡和花卉开发基因。具体地,我们将先前的时间点中的样品与当前时间点中的样品与案例样本进行比较。最终,从初始到成熟的14个不同的发育阶段分为13个采样时间点。临界过渡状态拟南芥在红星所示的花形成的第11个采样点,在过渡前和过渡后状态检测到开花。3.).
图11中所示的第11个采样时间点。3.与第7到第9天的增长相对应拟南芥花的发育。此外,在第7天,花序开发在很大程度上是同步的。对于稍后的时间点,只有在表型评估后,只有在花序(箭头尖端)的尖端处的花朵的发育仍然同步(图。3.)[8.].为了验证所识别的DNB的生物学和统计学意义,我们进行了自举分析,结果表明,识别的DNB用于开花发展拟南芥与随机选择的基因组相比具有高度显著性(附加文件1:图S4)。
控制过渡的鉴定基因拟南芥花的发育
Ryan等人发现,直到第7天,拟南芥花序的发育基本上是同步的。此后,在表型评估后,只有花序顶端的花发育保持同步[8.]. 根据我们的分析结果,预测的从时间点7到9天的临界过渡状态与他们的实验结果一致。换句话说,在花形成过程中检测到的临界过渡状态对应于植物开花的发展拟南芥.所有识别的DNB成员对应于花卉形成的临界状态,以附加文件列出2:图S1, DNB成员的详细描述列在附加文件中3.:图S2。DNB模块中的上调基因的功能类别如表所示1,这些基因对于开花过渡至关重要。此外,DNB模块中其他基因的功能类别被示出在附加文件中4.:表S1。
一个更可靠的基因共表达网络控制关键转变
包含233个基因的DNB模块拟南芥使用DNB模型检测从发起成熟时的花卉开发[41].利用这些过渡特异基因的基因表达数据,采用剔除冗余和间接调控的窄带算法构建调控开花过渡的基因共表达网络。网络推理文件在附加文件中列出5.:表S3,通过处理该文件,我们得到了两个新文件。拟南芥花发育中每对DNB成员的相关程度列于附加文件中6.:表S4和网络的节点属性文件在附加文件中列出7.:表S5。
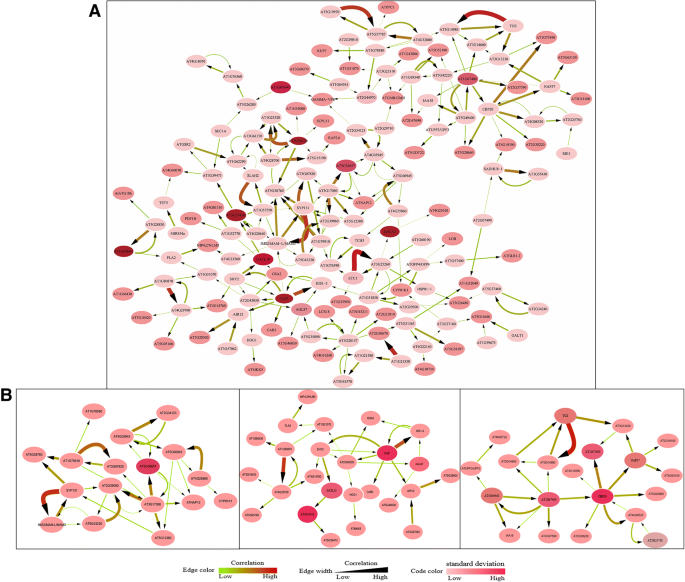
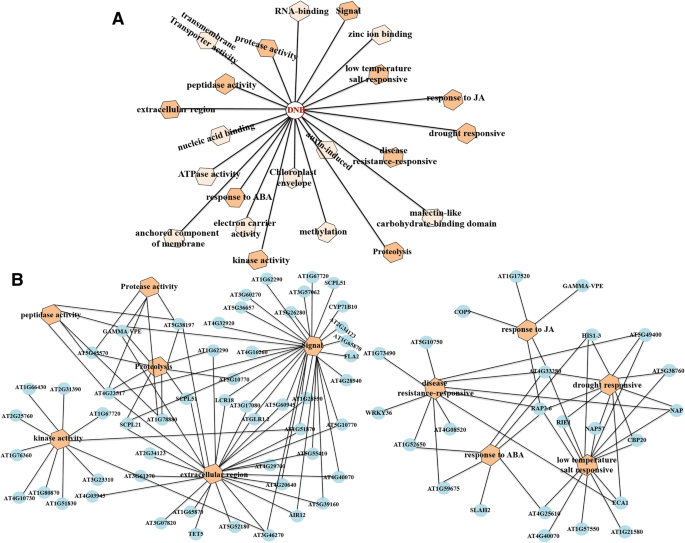
通过对DNB模块的233个基因进行狭口性分析,构建了更为准确可靠的基因调控网络拟南芥开花的过渡。基因调控网络的文件列在附加文件中8.:表S6。最终,将DNB模块的成员及其相互关系可视化为一个由150个节点和225条边组成的分子网络。在网络中,节点颜色反映了相应基因的标准差和边宽所反映的相关性强度,边宽对应的相关性越高(图2)。4.a). DNB模块中的三个关键子网络是单独聚类的,因为这些子网络中相应基因的标准差和相关强度存在显著差异,我们认为这些不同的区域是最能代表这一关键转变的区域(图3)。4.b)。
DNB成员临界过渡状态下的功能分类
通过DNB方法鉴定了鲜花形成过程中的关键过渡状态,与第7日至第9天开花的发展相对应拟南芥.为了评估DNB成员的潜在功能,采用GO赋值法对DNB成员在关键过渡时期的功能进行分类拟南芥花的发育。
在生物过程类别中,在大多数DNB成员中,两种GO术语,即小分子分解法和植物型细胞壁生物发生富集(图。5.a).在细胞成分范畴中,有大量与ap型膜外套适配器复合物、次级细胞壁、线粒体内膜固有成分相关的DNB成员(图2)。5.b).在分子功能范畴中,DNB模块的大多数基因都显著富集了离子反向转运体活性,而DNB模块中磷酸盐离子跨膜转运体活性、丝氨酸型内肽酶抑制剂活性和l -抗坏血酸结合也同样富集(图)。5.C)。
表中列出了DNB成员在氧化石墨烯三大类(生物过程、细胞组分和分子功能)中其他过高的氧化石墨烯术语2. 代谢途径在附加文件中列出9.S2:表。进一步分析控制起始到成熟阶段转变的关键调控因素拟南芥花卉开发,推断推断与其潜在目标链接关键监管因素的转录模块(图。6.).
检测到的关键基因的关键转变
我们不仅发现了第七和第九天之间发生的关键转变拟南芥花卉开发,还发现该DNB模块中的24个基因参与应力反应过程,以及其他花卉相关途径(图。6.b)。生物和非生物胁迫对植物生长和发育产生负面影响,包括开花,从而降低生产率[49].Adversity related genes included disease-, ABA-, JA-, drought-, low temperature and salt-related genes, i.e. CBP20, NAP, AT4G33280, RAP2.6, ECA1, AT5G38760, WRKY36, HIS1–3, AT1G73490, RIE1, AT1G52650, AT4G08520, AT1G59675, etc. Many of these genes such as RIE1, ECA1 and NAP were predominantly expressed from or after the 9th day which is the pollen formation stage. Thus, these genes might be play a vital role in the formation of microspores and the differentiation of pollen grains to a large extent.
cap结合蛋白复合物(CBC)在RNA代谢中起着重要作用,因为CBC与所有RNA聚合酶II转录本的cap结合。作为拟南芥CBC, Cap Binding Protein 20 (CBP20)被确定参与正常的植物生长发育和RNA代谢[50].研究发现了拟南芥CBP20 NULL突变体表现出叶子和花的异常发育,并显示出对盐胁迫的敏感性增加,这表明CBP20在盐应激反应中具有协同作用[51].此外,耐旱突变体cbp20能够在干旱胁迫下维持正常的生长发育,这也可能为ABA调控途径的新的细胞输出机制指明了方向[52].植物特异性NAM / ATAF1 / 2 / CUC2(NAC)转录因子在非生物应激响应信号中起重要作用。我们发现,作为涉及干旱应激响应的十二次前馈通路的两种重要DNB成员,其两种重要的DNB成员称为NAP和NAP57(激活的AP3 / PI)和它们在临界过渡状态下的表达不同其他时期。
此外,我们还发现NAP12参与了配子发生拟南芥具有两个ECA1 (Early Culture Abundant 1)配子发生相关家族基因AT5G60945和AT5G36657。ECA1家族蛋白在小孢子从配子体向胚性途径转变过程中可被转录激活。此外,发现DNB模块中的两个基因RIE1和LEA (AT5G38760)参与了胚胎发育拟南芥.鉴定了编码环-H2锌指蛋白的RIE1基因拟南芥,它可能是一种膜相关蛋白,可能与叶绿体有关。晚期胚胎发生丰富(LEA)蛋白质家族在干旱胁迫耐受性中起作用。如何通过这种转变改善生殖发展取决于监管因素之间的相互作用。这些监管机构对于控制转型来说是重要的拟南芥花的发育。
Apetala2(AP2)转录因子(TFS)在胚胎发育,苗木建造,开花和应力反应过程中起着重要的动态作用[53那54].通过DNB方法鉴定包括RAP2.6和AP2 / B3样(AT4G33280)的两个基因。的拟南芥转录因子RAP2.6和AP2 / ERF不仅在ABA,盐和干旱应激反应中涉及,而且还涉及雄蕊出现[55]. WRKY基因是从植物中分离出来的一个调控基因家族。WRKY基因编码的WRKY蛋白是植物特异性转录因子的一个大家族。WRKY36是WRKY基因家族成员之一,在DNB模块中被鉴定。最近的研究发现,UVR8与WRKY36相互作用,调节HY5的转录和下胚轴的伸长拟南芥,而我们发现WRKY36在临界转变中起着重要作用[56].
通过我们的分析,有233个基因在过渡状态下高度波动,形成了DNB模块。更重要的是,花粉中最高表达基因的比例很高,主要在第9天或之后表达。例如,我们发现作为DNB重要成员的两个na -like基因NAP和NAP57(被AP3/PI激活)参与了干旱胁迫反应的三叉前导通路,并在关键过渡状态上调[57].许多研究表明,B类MAD-BOX基因(AP3 / PI)对于雄蕊发育至关重要[58]. 因此,在花形成过程中检测到的临界过渡状态被视为花粉形成阶段。
在这个DNB模块中检测到一些参与细胞分化的基因,主要在花发育后期表达。这些基因主要在花粉形成第9天或之后表达。例如,胚珠和种子发育的调节因子SEEDSTICK (STK)在第7天至第9天显著上调[49].首次发现雄性生殖系发育调节剂DUO POLLEN1 (DUO1)在同一阶段表达[50].因此,这些基因可以在很大程度上涉及微微孢子的分化成花粉颗粒。基因本体(GO)分析还表明,在该关键转变中显着富集了二次细胞壁合成相关基因(GO:0009531)。Tapetum是从二级细胞壁开发的,这是花粉的重要组成部分[59].虽然许多基因表达的变化可能是由于花粉发育后期特定基因集的激活,但具有重要调控功能的基因,如编码aptala2 (AP2)转录因子和mads域蛋白的基因,往往在花发育的各个阶段呈现间歇性表达[54那55].
在该DNB模块中,还检测到涉及不同植物激素反应的基因,例如淤积酸,助体素和茉莉酸,如富集。这种发现与这些激素在后期花发育中的各种生物过程中的已知作用一致,例如雄蕊和花粉的形成以及花瓣的成熟[60].例如AGL46 (AT2G28700),编码为拟南芥发现疯狂箱转录因子参与CCKR信令图,促进的促促释放激素受体途径,PDGF信号通路,白细胞介素信号传导途径,RAS途径和P38 MAPK途径通过KEGG分析。研究表明,疯子箱基因家族的成员从早期测定花式器官原始身份的花卉公司标识的早期测定,从花卉开发中发挥重要作用[58].总之,在花形成过程中发现的关键过渡状态和在过渡过程中发现的关键调控因子可能回答了花器官形成的复杂机制。
水稻花发育的关键过渡状态
为支持上述结论,对水稻开花发育数据进行了类似的分析。该数据集从NCBI基因表达综合数据库(GEO)下载,登录号为GSE21396 (www.ncbi.nlm.nih.gov/geo).该数据集包括水稻开花发育从开始到成熟的15个时间点和3个重复[61].为了克服该数据集中案例样本和控制样本之间缺乏区别的问题,我们比较了之前和当前时间点的样本。将以前和现在时间点的样本分别指定为对照样本和病例样本。因此,15个不同的发育阶段从初始到成熟分为14个组合,以检测关键的过渡。对14个组合处理后的数据进行全基因组动态网络分析,检测到花发育的关键过渡状态(图2)。7.).在形成花期间检测到的临界过渡状态对应于大米中的特定花器官(花药和雌蕊)的发育[61].
不仅如此,我们还检测到具有206个基因的DNB生物标志物,可能导致鲜花期间迫在眉睫的临界过渡。在临界过渡状态中检测到的基因在附加文件中列出10:图S3。花药表现出一种独特的生长特征,大多数花药特异基因仅在特定的发育阶段表达[61].我们发现一个花粉特异的基因(LOC4341399)编码一个花粉特异的富含亮氨酸重复延伸素样蛋白(leucine repeat extensini -样蛋白)在关键转变中被上调。这一结果表明,我们的研究有助于揭示花药生长发育和花粉萌发过程中基因表达的复杂调控机制。
基因本体论(GO)分析表明,在下调基因中显着富集了蛋白激酶编码基因(表3.).结果表明,蛋白质磷酸化中涉及的几种信号转导途径可能在该关键转变期期间进行复杂的变化。在这种关键过渡阶段,几种转录因子包括3个F盒,1个,1个,2个MYB系列基因的调节。许多研究表明,F箱蛋白构成了一种真核蛋白质,这在调节植物的各种发育过程中起着关键作用。例如,F型箱基因DDF1是水稻花交量发展的关键遗传因素,含水稻花交[62]. CSA是一个编码R2R3 MYB转录因子的基因,在花药绒毡层细胞中优先表达[63].这些研究表明,在这一关键过渡阶段检测到的F-box-、U-box-、myb -家族基因可能在水稻花药发育调控中发挥关键作用。其他上调和下调基因在水稻花粉发育过程中也发挥着重要作用。
这些结果支持了在发展中得出的结论拟南芥花。因此,利用DNB和MARROMI方法进行转录组分析可以为研究拟南芥花的形成特征和检测调控花发育从开始到成熟的关键调控因子提供新的思路。
讨论
花的形成是研究植物生长发育调控机制的主要模型之一。在过去的植物学研究中,花的转变被认为是从营养生长到生殖生长的过程[34那38]. 尽管一些基于网络的生物信息学分析试图确定从营养生长到生殖生长的相变,但没有研究确定从起始到成熟的花形成的关键过渡阶段。花器官的分化比植物的其他部分更复杂,尤其是花粉的形成[61].在这项研究中,我们发现了一个关键的过渡阶段拟南芥用DNB理论研究花的发育。这是DNB模型首次用于植物研究。我们发现相变发生在第7天到第9天之间拟南芥花的发育。在给定的花序上的鲜花的发展均匀地同步至第7天,然后开花相关基因的表达发生急剧变化。不仅如此,我们发现在形成花期间检测到的这种关键转变状态对应于特定的花器官(花药)的发育。我们还检测到由233个基因组成的DNB成员,这些成员可能会使鲜花形成迫在眉睫的临界过渡。此外,这些基因之间的相互作用还调节关键过渡过程。
为了构建调控开花过渡的基因调控网络,我们采用了能减少过渡特异基因表达数据的噪声、冗余和间接调控的狭缝算法。我们进一步发现,该DNB模块中的24个基因参与应力反应过程,以及其他花卉相关途径,如配子发生和胚胎发育。我们的研究表明,过渡区域中鉴定的先前未知的监管基因可能是通过已知的调节机制来促进花的形成。因此,进一步研究过渡区域中的共表达基因可以应答共表达基因与关键转变之间的连接。
此外,本文的亮点是DNB和Narromi方法的有效组合。与基于分子的差异表达的传统方法或生物标志物相反,DNB方法可以基于网络水平不同代谢分子的集体波动和相关性的复杂生物学过程的临界过渡状态。因此,即使在过渡前状态和临界转换状态下没有显着的差分表达,我们也可以通过DNB方法检测这两个状态中的显着差异相关性和偏差[35].
与传统的构建调控开花过渡的基因调控网络的方法相比,狭缝算法可以减少对过渡特异性基因表达数据的噪声、冗余和间接调控。首先,通过对非线性相关互信息(MI)的量化,可以计算出基因对之间的因果强度,从而减少低相关性的干扰调节。然后,采用基于常微分方程的递归优化(RO)方法逐步减少冗余和间接规则。最后,通过网络整合得到了一个非线性稀疏基因调控网络的拓扑结构,该拓扑结构是与真实网络最相似的基因调控网络。narrow算法可以看作是对DNB模型的进一步改进。
我们还对水稻花发育的时间基因表达谱数据集进行了类似的分析,以支持得出的结论。最终,我们发现了水稻花发育的一个临界过渡状态。在水稻花的形成过程中发现的这一关键过渡状态与特定花器官(花药和雌蕊)的发育相对应。不仅如此,我们还检测到由206个基因组成的DNB成员,这些成员可能预示着花形成过程中即将到来的关键转变。我们发现,在这一关键过渡阶段检测到的基因可能在调控水稻花药发育中发挥关键作用。这些结果支持了关于拟南芥开花发育的结论。除了应用DNB和narrmi算法检测拟南芥开花过渡的临界状态外,它们还可以检测任何生物过程的临界过渡。
结论
从开始成熟时,我们研究了花发育相转变拟南芥使用动态网络生物标志模型。鉴定了检测到开花发育的关键转变状态,并鉴定了一种作为动态网络生物标志物,控制从对成熟开始的花发育的相变的动态网络生物标志物。与基于差分基因表达分析的传统方法相反,我们的分析可以利用网络水平的不同代谢物的集体波动和相关性以识别复杂生物过程的关键转变状态。我们还检测到由几种基因组成的动态网络生物标志物,这些基因可能会使花形成迫在眉睫的临界过渡。为了构建控制开花转换的基因调节网络,我们应用了在转变特定基因的表达数据上的Narromi算法。基于冗余的基于技术的网络重建方法Narromi算法可以作为动态网络生物标志物模型的进一步改进,这可以减少嘈杂和间接的规定,以提高网络推断的准确性。我们的研究表明,在过渡期间鉴定的鲜花和关键调节剂期间检测到的临界过渡状态可能回应花器官形成的复杂机制。本作作品中使用的生物信息学分析也可用于检测任何生物过程的临界状态。
方法
基因表达数据收集
的拟南芥花发育基因表达谱数据集从NCBI基因表达综合数据库(GEO)下载,登录号为GSE64581 (www.ncbi.nlm.nih.gov/geo).该数据集包含从起始到成熟的14个不同时间点,3个重复的基因表达数据,分别为0d、1d、1.5d、2d、2.5d、3d、3.5d、4d、4.5d、5d、7d、9d、11d和13d(图1)。6.a) 。数据从已预处理的Geo数据库下载,我们按照Ryan等人的过程中概述的过程。,2015年,2015年和其他一些协议。Ryan等人。的文章是在Creative Commons归因许可证的条款下分发的开放式文章(http://creativecommons.org/licenses/by/4.0.).
从GEO数据库下载数据,作为基因表达时间程矩阵。横行表示一个基因在不同样本中的表达值,列表示一个样本基因库的表达值。我们使用MATLAB中的' genelowvalfilter '函数对基因进行过滤。去除表达值小于某一阈值的基因后,我们将剩余的基因进行进一步处理。因为一些转录的变化是由特定的基因调控事件或巨大的改变在花花的大小和形态发展,我们比较基因表达水平之间的连续以及邻居(2 d时间间隔内)跨度为最小化形态变化的影响(8.].
网络推理
一般来说,基于质量作用动力学和Michaelis-Menten动力学的数学模型可以描述转录调控过程[64].然而,基因表达数据中遗传的噪声会降低这些模型的性能[65].因此,为了提高网络推断的准确性,Narromi算法用于减少嘈杂,冗余和间接的规定[29]. 它首先通过量化非线性相关互信息(MI)来计算基因对之间的因果强度,这可以减少基因表达数据中的噪声规则[66].然后,利用基于常微分方程的递归优化(RO)逐步减少冗余和间接调控,得到非线性稀疏基因调控网络的最终拓扑(图)。6.C)。用于应用Narromi算法的脚本在附加文件中列出111:脚本。通过与GENIE3、ARACNE等方法的比较,在大多数情况下,narrow的表现都优于这些流行的方法,从而验证了其有效性[29].
为了获得更可靠的基因共表达网络,提出了一种结合互信息(MI)和基于递归优化(RO)的参数估计的复合指标:
在哪里β心肌梗死是积极的mi值,β罗依为RO算法推导出的调控强度(正或负),符号(β罗依)是标志(+)的β罗依、|β罗依|是绝对的β罗依并且参数ω是加权系数。最终的监管强度由参数决定β然后确定网络拓扑。
富集和可视化
通过R包TOPGO 2.30.1分析了所识别的DNB成员进行功能性浓缩分析。Topgo软件包提供了用于测试GO条款的工具,同时考虑GO图表的拓扑。可以实现和应用不同的测试统计信息和用于消除GO项之间的局部相似之处和依赖性的不同方法。富集分析过程包括归一化基因表达测量的输入,基因明智的相关或差异表达分析,富集术语,解释和可视化的浓缩分析。在运行富集测试之前,数据准备过程至关重要。用户需要提供基因宇宙,GO注释和用于从基因宇宙中选择有趣的基因(例如差异表达基因)的标准或与每个基因相关的分数。我们的研究中使用的Go数据库是一组注释地图,描述了从Go版本的数据组装的整个基因本体:3.5.0。
此外,我们还分析了与DNB密切相关的关键调控因子和关键代谢途径拟南芥花从开始到成熟阶段的发育(图。6.d).基因调控网络导入Cytoscape的结果(www.cytoscape.org)可视化。
调节电路和调节预测
我们进一步预测了控制临界过渡的监管电路和监管机构拟南芥基因监管信息服务器(Agris;http://arabidopsis.med.ohio-state.edu)[67].我们可以获得全面的资源拟南芥来自AGRIS的基因调控研究有三个相互连接的数据库,AtTFDB, AtcisDB和AtRegNet。从转录因子数据库中获取最新和全面的转录因子信息,是研究转录因子的关键拟南芥基因调控网络。
缩写
- 阿巴:
-
脱盐酸
- CBC:
-
帽结合蛋白质复合物
- DNB:
-
动态网络生物标志物
- ECA1:
-
早期文化丰富1
- grn:
-
基因监管网络
- lea:
-
胚胎晚期丰富
- 小姐:
-
相互信息
- PCC:
-
Pearson相关系数
- 罗依:
-
递归优化
参考
- 1.
Rougvie AE。发育时间的内在和外在调节:从mirna到营养线索。发展。2005;132(17):3787 - 98。
- 2.
阿马西诺R。开花的季节和发育时间。植物J。2010;61(6):1001–13.
- 3.
Kubota A,Kita S,Ishizaki K,Nishihama R,Yamato Kt,Kohchi T.陆地植物演进过程中的光周期生长相变系统的共选。NAT Communce。2014; 5:3668。
- 4.
贾H,铃木M,McCarty Dr。用LaF1和Val转录因子网络调节种子以幼苗发育相转变。Wiley interdiscipl Rev Dev Biol。2014; 3(1):135-45。
- 5.
莫塞斯SP,Sisco pH。Glossy15控制玉米的表皮幼年血对成人相转变。植物细胞。1994年; 6(10):1343-55。
- 6.
从营养期到生殖期的转变。植物学报。2001;4(1):63-8。
- 7.
陈米,谢恩jj。在拟南芥中从异养的异常过渡到拟南芥中的自养生长,需要三糖磷酸异构酶的体层同种型。植物细胞。2010; 22(1):77-90。
- 8。
Ryan Pt,O'Maoileidigh DS,Drost HG,Kwasniewska K,Gabel A,Grosse I,Graciet E,Quint M,Weller F.从开始到成熟时拟南芥花发育过程中的基因表达模式。BMC基因组学。2015; 16:488。
- 9。
李志刚,李志刚。植物发育阶段转变的调控。植物学报。发展。2011;138(19):4117 - 29。
- 10。
Soltis de,Ma H,Frohlich MW,Soltis PS,Albert VA,Oppenheimer DG,Altman NS,Depamphilis C,Leebens-Mack J. The Floral Genome:基因复制的进化历史和基因表达的转移模式。趋势植物SCI。2007; 12(8):358-67。
- 11.
Weller F,Riechmann JL。基因网络控制开花发育的启动。趋势类型。2010; 26(12):519-27。
- 12.
龚x,沉l,彭yz,甘y,yu h. dna topoisomerase ialpha影响花卉过渡。植物理性。2017; 173(1):642-54。
- 13.
王磊,孔东,吕强,牛刚,韩涛,赵旭,孟S,程强,郭胜,杜军,等。四氢叶酸通过表观遗传沉默调节花的转变。植物杂志。2017;174(2):1274 - 84。
- 14.
姜L,Li D,Jin L,Ruan Y,Shen Wh,Liu C.组蛋白赖氨酸甲基转移酶BNASDG8.A和BNASDG8.C参与了Brassica Napus的花卉过渡。工厂J. 2018; 95(4):672-85。
- 15.
Brambilla V,Martignago D,Goretti D,Cerise M,Somssich M,De Rosa M,Galbiati F,Shrestha R,Lazzaro F,Simon R等。拮抗转录因子复合物调节水稻中的花卉过渡。植物细胞。2017; 29(11):2801-16。
- 16.
代谢和发育-整合显微计算机断层扫描数据和代谢谱揭示了从花的起始到角果发育的代谢重编程。新植醇。2014;202(1):322 - 35。
- 17.
Putelill J,Laurie R,Macknight R.现在是花:开花时间的遗传控制。生物。2004; 26(4):363-73。
- 18.
Huang J,Vendramin S,Shi L,McGinnis Km。使用RNA-SEQ数据玉米大基因共抑制网络的构建与优化。植物理性。2017; 175(1):568-83。
- 19。
Silva AT,Ribone Pa,Chan RL,Ligterink W,HiLhorst HW,预测共同抑制A.网络识别控制拟南芥中种子对幼苗阶段过渡的新基因。植物理性。2016; 170(4):2218-31。
- 20.
Vesty EF,y,Moody La,Holloway D,Whitbread A,需要S,Choudhary A,烧伤B,McLeod D,Bradshaw Sj,等。发芽的决定是由孢子和种子的不同分子网络调节。新植物。2016; 211(3):952-66。
- 21。
Chen P,Liu R,Li Y,Chen L.隐马尔可夫模型在复杂生物系统阶段过渡前检测临界状态。生物信息学。2016; 32(14):2143-50。
- 22。
Harkey AF, Watkins JM, Olex AL, DiNapoli KT, Lewis DR, Fetrow JS, Binder BM, Muday GK。鉴定控制根对乙烯反应的转录和受体网络。植物杂志。2018;176(3):2095 - 118。
- 23。
关键词:RNA-seq共表达网络,典型相关分析核酸学报2013;41(8):e95。
- 24.
王家,陈B,王Y,王,Garbey M,Tran-Son-Tay R,Berceli SA,Wu R.重建了来自相互信息的基因表达动态可塑性调控网络。核酸RES。2013; 41(8):E97。
- 25.
Basso K,Margolin AA,Stolovitzky G,Klein U,Dalla-Favera R,Califano A.人类B细胞中调节网络的逆向工程。NAT Genet。2005; 37(4):382-90。
- 26.
加德纳Ts,di bernardo d,lorenz d,柯林斯jj。推断遗传网络并通过表达分析鉴定复合作用模式。科学。2003; 301(5629):102-5。
- 27.
第一州、马鲁奇L州、伊奥里奥F州、利玛窦、贝尔卡斯特罗五世、班萨尔M州、桑蒂尼S州、贝尔纳多M州、贝尔纳多D州、Cosma议员。一个酵母合成网络,用于反向工程和建模方法的体内评估。牢房。2009;137(1):172–81.
- 28.
Honkela A,Girardot C,Gustafson EH,Liu Yh,富隆ee,劳伦斯Nd,Rattray M.基于模型的转录因子目标识别与有限数据的识别方法。Proc Natl Acad Sci U S A. 2010; 107(17):7793-8。
- 29.
张旭,刘凯,刘志平,杜val B, richjm,赵学明,郝建军,陈磊。狭值噪声和冗余降低技术提高基因调控网络推断的准确性。生物信息学。2013;29(1):106 - 13所示。
- 30.
张旭,赵晓明,何凯,陆璐,曹勇,刘杰,郝建军,刘志平,陈磊。基于条件互信息的路径一致性算法从基因表达数据推断基因调控网络。生物信息学,2012,28(1):98 - 104。
- 31.
Zhang X,Zhao J,Hao JK,Zhao XM,Chen L.条件相互包容信息可以准确地量化基因监管网络中的关联。核酸RES。2015; 43(5):E31。
- 32.
赵家,周y,张X,陈L.用于量化网络直接关联的零件互信。Proc Natl Acad Sci U S A. 2016; 113(18):5130-5。
- 33。
巴塞尔GW, Lan H, Glaab E, Gibbs DJ, Gerjets T, Krasnogor N, Bonner AJ, Holdsworth MJ, Provart NJ。捕获种子萌发的全基因组网络模型揭示了植物细胞阶段转变的协调调控。中国科学院院刊2011;108(23):9709-14。
- 34。
何F,Zhou Y,Zhang Z.通过整合蛋白质 - 蛋白质相互作用网络和基因表达数据来解读拟南芥的花卉过渡过程。植物理性。2010; 153(4):1492-505。
- 35。
DINH JL,FARCOT E,HODGMAN C.花卉过渡的逻辑:逆向工程控制横向器官的身份。PLOS计算BIOL。2017; 13(9):E1005744。
- 36.
Bouyer D, Roudier F, Heese M, Andersen ED, Gey D, Nowack MK, Goodrich J, Renou JP, Grini PE, Colot V,等。多冠抑制复合物2控制着胚-苗阶段的转变。公共科学图书馆麝猫。2011;7 (3):e1002014。
- 37.
拟南芥花序和花发育的基因调控网络。生物物理学报。2017;1860(1):95-105。
- 38.
东Z,丹尼列夫斯卡娅O,阿巴迪T,墨西拿C,科尔斯N,库珀M。玉米茎尖花转变的基因调控网络模型及其动态模拟。公共科学图书馆一号。2012;7(8):e43450。
- 39.
Varala K,Marshall-Colon A,Cirrone J,Brooks MD,Pasquino Av,Leran S,Mittal S,Rock TM,Edwards MB,Kim GJ等。动态调控网络底层信号传导和植物中的时间转录逻辑。Proc Natl Acad Sci U S A. 2018; 115(25):6494-9。
- 40
是时候建立良好的设计:解决基因调控网络的时间动态。中国科学(d辑:地球科学)2018;
- 41
Chen L,Liu R,Liu ZP,Li M,Aihara K.通过动态网络生物标志物检测复杂疾病突然恶化的早期警告信号。SCI REP。2012; 2:342。
- 42.
刘荣华,王学军,陈磊。基于分子生物标志物、网络生物标志物和动态网络生物标志物的复杂疾病早期诊断。医学文献2014;34(3):455-78。
- 43.
葛军,范学勇,薛晓丽,李桂平,钟绍生,沈鑫,尹海英,陈丽娜。利用多种组学技术和系统生物学发现动脉粥样硬化进展中的动态网络生物标志物(DNB)。J Am Coll Cardiol. 2017;70(16): C34-5。
- 44.
王志强,张伟,葛建军,周勇,Landzberg博士,王志强,韩旭,陈磊,尹海华。基于动态网络生物标志物的非酒精性脂肪肝向非酒精性脂肪肝过渡状态的研究。中国细胞生物学杂志。2016;8(3):195-206。
- 45。
李美美,曾涛,刘锐,陈丽娜。基于动态网络生物标志物检测复杂疾病的组织特异性早期预警信号:通过跨组织分析对2型糖尿病的研究短暂的Bioinform。2014;15(2):229 - 43。
- 46。
Chen P,Liu R,Chen L,Aihara K.通过动态网络生物标志物识别MCF-7细胞的临界分化状态。前群体。2015; 6:252。
- 47。
李志刚,李志刚。拟南芥花的早期发育。植物细胞。1990;2(8):755 - 67。
- 48.
Anders S,Huber W.序列计数数据的差异表达分析。基因组Biol。2010; 11(10):12。
- 49.
Sakuraba Y,Kim Ys,Han Sh,Lee Bd,Paek NC。拟南芥转录因子NaCO16通过涉及午睡的纤维前馈调节循环抑制β1转录来促进干旱应激反应。植物细胞。2015; 27(6):1771-87。
- 50。
Kierzkowski D, Kmieciak M, Piontek P, Wojtaszek P, Szweykowska-Kulinska Z, Jarmolowski A.拟南芥CBP20靶向于细胞核的帽结合复合物,并由CBP80稳定。植物j . 2009; 59(5): 814 - 25。
- 51。
kong x,ma l,yang l,陈q,xiang n,杨y,hu x。定量蛋白质组学分析显示,核帽结合复合蛋白拟南芥cbp20和cbp80调节盐应激反应。J蛋白质组。2014; 13(5):2495-510。
- 52
Jager K,Fabian A,Tompa G,Deak C,Hohn M,OlMedilla A,Barnabas B,PAPP I.耐旱性CBP20拟南芥的新表型变化了表皮形态。植物BIOL(斯图特)。2011; 13(1):78-84。
- 53
Krishnaswamy S,Verma S,Rahman Mh,Kav NN。拟南芥中四种Apetala2-Family基因(RAP2.6,RAP2.6L,DREB19和DREB26)的功能表征。植物mol biol。2011; 75(1-2):107-27。
- 54.
关键词:拟南芥,AP2/ERF转录因子,ABA,盐胁迫,渗透胁迫基因。2010;457(1 - 2):1 - 12。
- 55.
Nag A,Yang YZ,Jack T。拟南芥雄蕊出现所必需的AP2基因DORNROSCHEN-LIKE。植物分子生物学。2007;65(3):219–32.
- 56.
Yang Y, Liang T, Zhang L, Shao K, Gu X, Shang R, Shi N, Li X, Zhang P, Liu H. UVR8与WRKY36相互作用对拟南芥HY5转录和下胚轴伸长的调控。Nat植物。2018;4(2):98 - 107。
- 57。
王志强,王志强,王志强,等。拟南芥花发育的基因网络。新植醇。2014;201(1):30。
- 58。
陈F,张X,刘X,张L.裸子植物和植物植物中Mikcc型Mad-Box基因的进化分析。前植物SCI。2017; 8:895。
- 59。
张DS,梁某,袁Z,李,施j,王j,刘ym,yu wj,张db。Tapetum变性延迟对于水稻花粉发育过程中的脂族代谢和基因调节至关重要。莫尔植物。2008; 1(4):599-610。
- 60.
钱德勒JW。花发育的激素调节。植物生长调节。2010;30(2):242–54.
- 61。
Sato Y, Antonio B, Namiki N, Motoyama R, Sugimoto K, Takehisa H, Minami H, Kamatsuki K, Kusaba M, Hirochika H, et al. .田间转录组揭示了在粳稻中表达生长潜能的关键发育和生理转变。植物学报。2011;11(1):10。
- 62。
段勇,李胜,陈志,郑丽,刁忠,周勇,兰涛,管辉,潘锐,薛勇,等。编码F-box蛋白的矮化和畸形花1在水稻营养和花的发育中起关键作用(奥雅萨苜蓿l .)。植物j . 2012; 72(5): 829 - 42。
- 63。
张H,梁W,杨X,罗X,江九,马H,张达碳饥饿的花药编码了调节水稻花粉发育所需的糖分配的MyB结构域蛋白质。植物细胞。2010; 22(3):672-89。
- 64
田Th,Burrage K,Burrage PM,Carletti M.遗传监管网络的随机延迟微分方程。j计算appl math。2007; 205(2):696-707。
- 65
Lozoya OA,Santos Jh,Woychik RP。利用的信噪比(LSTNR)方法以从嘈杂和低复制RNASEQ数据中提取差异表达基因和表达式的多变量模式。前群体。2018; 9:24。
- 66.
Steuer R,Kurths J,Daub Co,Weise J,Selbig J.互信息:检测和评估变量之间的依赖性。生物信息学。2002; 18:S231-40。
- 67.
Davuluri RV,Sun H,Palaniswamy Sk,Matthews N,Molina C,Kurtz M,Grotewold E. Agris:Arabidopsis基因监管信息服务器,Arabidopsis CIS-Charmatory元素和转录因子的信息资源。BMC Bioinf。2003; 4:11。
确认
我们感谢P.T. Ryan博士(都柏林三一学院斯莫菲特遗传学研究所)提供的拟南芥花基因表达数据和我们实验室成员的讨论。我们也感谢O.O. Collins(中国科学院大学)为撰写本文提供的宝贵帮助。
资金
中国自然科学基金会(NSFC),CAS先驱百人才计划和国家原因控制理论项目,1716315xJ00200303,得到了这项工作得到的支持。
数据和材料的可用性
数据集包含在文章及其附加文件中。
作者信息
从属关系
贡献
x.z设计研究;fz进行了研究,fz分析了数据;l.c.、z.j.、X.L.、A.Z.对手稿提出了许多批评意见,并予以批准;这篇文章是f.z和x.z写的。所有作者阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
利益争夺
两位作者宣称他们没有相互竞争的利益。
出版商说明
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
附加文件
额外的文件1:
图S4。基于DNB的方法的比较结果,引导分析。(docx 313 kb)
附加文件2:
图S1。过程中DNB模块的基因列表拟南芥花的发育。(TXT 2 kb)
额外的文件3:
图S2。识别的DNB模块的详细描述拟南芥花的发育。(TXT 95 KB)
附加文件4:
表S1。Arabidopsis花卉发展的DNB成员的功能类别。(TXT 7 kb)
附加文件5:
表S3。网络推理文件。(TXT 32 KB)
附加文件6:
表S4。拟南芥花发育过程中每对DNB基因的相关程度。(TXT 7 kb)
附加文件7:
表S5。网络的节点属性文件。(TXT 4 KB)
额外的文件8:
表S6。基因调节网络cytoscape文件。(TXT 7 kb)
额外的文件9:
表S2。拟南芥花发育过程中的DNB成员丰富了氧化石墨烯的表达和代谢途径。(TXT 2 kb)
额外的文件10:
图S3。水稻花发育的DNB成员。(TXT 9 KB)
额外的文件11:
脚本1。Tair_DNB_narromi。(多克斯14 kb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
张,F.,刘,X.,张,A。等等。全基因组动态网络分析揭示了植物花发育的关键过渡状态拟南芥.BMC植物杂志19,11(2019)。https://doi.org/10.1186/s12870-018-1589-6
收到了:
公认:
发表:
关键词
- 基因表达的时间进程数据
- 基因监管网络(GRN)
- 动态网络生物标志物(DNB)
- 相变
- 花的发育