抽象的
背景
藻类生物燃料有潜力减少对化石燃料的依赖,同时抑制一氧化碳2排放。尽管有这些潜在的好处,但一个可扩展的、可持续的、商业上可行的系统还没有开发出来。其中一个关键的障碍是缺乏可行的方法来干扰藻类生物量来分离和提取生物制品。本研究实验研究了氯气作为藻类生物破坏剂的可行性。
结果
氯是用于破坏藻类细胞,这表现与细胞活力和SEM分析的有效试剂。For disruption studies conducted using algal suspension at 0.02% solids (0.2 g/L), 90% of the algal cells were disrupted in 6 min at 10 mg/L chlorine dose. Moreover, the results demonstrated that the estimated specific energy requirement, specific cost, and GWP for chlorine were lower than those of the existing methods. The energy requirement for chlorine was 3.73 MJ/ kg of dry algae disrupted, while the requirements for the existing methods ranged from 33 to 860 MJ/ kg of dry algae. The GWP for chlorine was 0.3 kg CO2情商。每公斤干藻,而现有的方法在5.9到369.8 CO之间变化2情商。/公斤干海藻。尽管有这些优点,但观察到残留的氯与细胞内容物发生反应并矿化,这是不可取的。
结论
今后的研究工作必须集中在消除或减少剩余氯与细胞内容物的反应。如果这一挑战得到解决,氯有潜力发展成为一种高效、经济、可持续的藻类生物破坏方法。这将进而克服一个技术瓶颈,最终增加藻类生物燃料的生产,减少对化石燃料的依赖,并抑制一氧化碳的排放2排放。
背景
由于藻类的高生产率,它已成为最有前途的长期和可持续的生物燃料生产原料[1],能力容忍范围广泛的生长条件[2],并且缺乏对土地和水与粮食作物[竞争3.].此外,CO2据估计,通过藻类进行的封存比陆生植物高一至两个数量级[4.].因此,藻类生物燃料有潜力帮助减少对化石燃料的依赖,同时抑制一氧化碳2排放。
目前的研究集中在所述藻类生物燃料领域是在两个主要藻类 - 燃料通路,即:(1)海藻生物产品的提取和升级[5.]和(2)整个藻类水热液化和升级[6.].在前一种途径中,关键的障碍之一是缺乏可行的方法来干扰藻类生物量以分离和提取生物制品[7.].目前可用于藻类生物量破坏的各种方法,包括珠粒研磨,高压均质化,高速均质化,流体动力空化,微波,超声波,脉冲电场,以及焦耳加热等[7.那8.那9.那10那11].这些方法大多来自食品工业,在食品工业中,能源效率和成本效益不是一项技术的可行性因素,因为食品产品在市场上售价很高。对现有藻类生物量破坏方法的科学文献的回顾表明,具体的能量需求从每公斤干藻类的33兆焦耳(MJ)水力空化到每公斤干藻类的860兆焦耳(MJ)脉冲电场[8.].据估计,整个藻类生物质的燃烧可获得的能量约为每公斤干物质22兆焦耳[12].因此,现有的生物质破坏方法导致负净能量平衡。已经通过投资能量回报(EROI)分析来证明了这一事实,对各种藻类生物制作提取和升级途径进行了分析,导致9.2×10的范围内的Erois−5到0.36 [13].
用原子力显微镜估计单个藻类细胞的压痕和破坏所需的能量为17皮焦耳(pJ) [14,估计相当于每公斤干藻细胞670 J。这表明,现有的破坏方法在向藻类细胞转移能量方面效率非常低。在水动力空化中,最“有效”的现有方法,只有0.002%的能量输入用于细胞分裂。这清楚地表明,对现有的生物质破坏方法的效率的任何渐进改进都不会给藻类生物燃料工业带来重大变化。
化学物质包括氯、臭氧、氢2O.2和表面活性剂已被提出作为可能的替代细胞破坏剂[15那16].然而,迄今为止的研究集中于这些化学物质的应用,以去除或控制富营养化、淡水中的藻类、藻类毒性或生物污染[17那18那19].本研究的目的是评估氯气对藻类生物质的破坏的可行性。我们不知道任何已发表或未发表的工作,其中氯气被用作破坏藻类生物质的剂。需要回答的一些问题包括:氯对藻类细胞活力、表面形态和细胞大小的影响是什么?是否有脂质提取的提高,因为藻类生物质与氯的破坏?氯的使用对脂质有影响吗?本研究试图解决这些问题。
方法
实验方法
研究了氯对藻类细胞的破坏:(1)含0.02%固体的稀释海藻悬浮液(2)含10%固体的海藻糊,两者都是在干质量基础上进行的。破坏实验的装置包括500毫升Erlenmeyer烧瓶(金布尔蔡斯)和一个锥形聚四氟乙烯塞。反应器的工作体积被设置为400毫升,以在为进行的各种分析定期提取样品后维持半批反应器。琥珀色的烧瓶被用来防止光线传递到藻类培养物。
在典型的海藻悬浮液破坏实验中,首先将海藻培养物10000 G离心10 min,弃上清液。剩余的膏体在pH为7.0的磷酸盐缓冲去离子水中重新悬浮。这是为了减少残余生长介质对氯的影响。然后将重新悬浮的藻类生物质转移到清洁和高压灭菌的玻璃瓶中。接下来,向瓶子中加入氯溶液,得到所需的剂量。然后,将反应器盖上盖子,并使用搅拌板将内容物连续混合。在处理过程中,定期从反应器中收集样品。最后,根据需要,使用细胞计和扫描电子显微镜(SEM)对细胞样品进行表征。
在清洁的VWR 50 ml离心管中进行10%海藻糊的破碎实验。在清洁的VWR管中,加入已知质量的藻糊和氯溶液,以达到所需的剂量和10%的藻细胞浓度。试管中的内容物用Heidolph UNimax 1010摇床混合。样品定期提取,并用Bligh和Dryer方法进行脂质提取[20.],最广泛地用于藻类脂质提取方法。During a typical lipid extraction process, 2 g of disrupted algae paste was transferred to 15-mL centrifuge tubes. Next, 4 mL of methanol and 2 mL of chloroform were added to the sample in the centrifuge tubes. Then the content of the tube was mixed for 2 min using a Thermolyne Maxi Mix Plus™ vortex (Dubuque, IA). Additional 2 mL of chloroform was added to the sample and the tube was mixed for 30 s using the vortex. Finally, 1.8 mL of DI water was added to the sample and then mixed for 30 s using the vortex. The lipid extraction process was performed at room temperature, in the range of 22 to 26 °C.
混合物使用Thermo Scientific Sorvall RC6+离心机(Waltham, MA)在10,000 G下离心15分钟。这使得氯仿/脂层在底部和甲醇/水层在顶部完全分离,而残余生物量在中间。底部氯仿层用巴斯德玻璃移液管除去,并放入预称重的125毫升Erlenmeyer烧瓶中。氯仿从烧瓶中蒸发,使用Heidolph Hei-VAP精密玻璃器皿设置为G5旋转蒸发器,浴温度为60°C,压力为375 mbar,转速为150 rpm。
材料
该研究中使用的化学品和试剂是从费恩斯科学(匹兹堡,PA)和Sigma-Aldrich Co.(圣路易斯,MO)获得的。对于项目,c .寻常的微藻是生物柴油生产中研究最广泛的藻类之一。c .寻常的培养物购自Carolina Biological Supply Company (Burlington, NC)。颗粒状伪君子钙,购自Fisher Scientific,用作氯的来源。
c .寻常的文化维护,培养和收获
c .寻常的培养物在MiracleGro万能水溶性植物食品的培养基中生长。该介质过去曾用于微藻的生长[21].
在典型的生长周期,很少菌落c .寻常的from agar-plate cultures were aseptically transferred into 25 mL medium contained in 50 mL VWR tests tubes, and then capped with sponge plug. The test-tube cultures were placed under fluorescent lighting system, 14 h light and 10 h dark, and were aerated once a day using a vortex. After the culture growth reached to ~ 0.3 to 0.4 abs at 600 nm, it was transferred to eight 500 mL VWR Erlenmeyer flasks containing 350 mL medium. These cultures were aerated using aquarium air pump and were placed on stirrer plates for mixing and under the fluorescent light for 14 days.
最后,在600 nm处达到~ 0.3 ~ 0.4 abs后,将培养物接种于8个4 L的VWR Erlenmeyer烧瓶中,培养基为3500ml。用含4.0% CO的气流对培养菌通气2总流速为200 mL/min或每个反应器25 mL/min。反应器放置在搅拌板上进行混合,并在荧光灯下进行14天。培养物在600 nm吸光度为~ 0.5的条件下收获。培养物经10000 G离心浓缩10 min。PI实验室之前的一项研究表明,这种离心力对细胞存活率没有任何影响[22].
分析方法
藻细胞浓度(#cell/mL)和存活率通过自动细胞计数(Nexcellom Cellometer autotox4)光学测定。将20 μl培养液与20 μl碘化丙啶(PI)染色液(Cellometer ViaStain™PI染色液)在1.5 mL微量离心管中旋转10 s。然后将20 μl的样品移到Cellometer计数室中,使其稳定2分钟。使用亮场电池,在501 nm处刺激样品,在595 nm处发射测量10秒的曝光。通过PI荧光识别死亡细胞,并自动计数荧光细胞。存活率的确定是亮场细胞数和荧光细胞数的差除以亮场细胞数。而细胞直径则由Cellometer直接测量。
用Thermo Scientific BioMate™3S分光光度计(Waltham, MA)测量600 nm处的吸光度。样品的pH值用HACH-HQ440d多参数仪测量,探针为hach - intelligent - phc101。余氯按标准方法测定[23].
在SDSU电子显微镜设备中使用Quanta 450 FEG扫描电子显微镜(FEI, OR)获得藻细胞的SEM图像。为了进行扫描电镜分析,经氯处理的藻类样品用含4% (V./v)戊二醛和0.2 M碳酸钠在pH 7.3。用0.1 M pH为7.3的碳酸钙酸钠缓慢洗涤细胞,然后用30、50和95%乙醇梯度浓度系列脱水10分钟。最后,将细胞浸泡在100%乙醇中。临界点烘干机被用来进一步干燥样品。然后样品被安装在存根上,并用溅射镀膜机涂上铂。在5.0 kV加速电压下,用扫描电镜观察破裂细胞的表面形貌。
结果与讨论
在悬浮状态下破坏藻类细胞
进行了几个实验以研究使用氯作为药剂的悬浮液中的破坏。平均而言,原料中藻类的浓度在干块基础上为0.02%(0.2g / L)。氯剂量为0(对照),5,6.5,8和10mg / L2.在0、3、6、15、30、45和60 min的处理过程中,定期从反应器中收集样品。
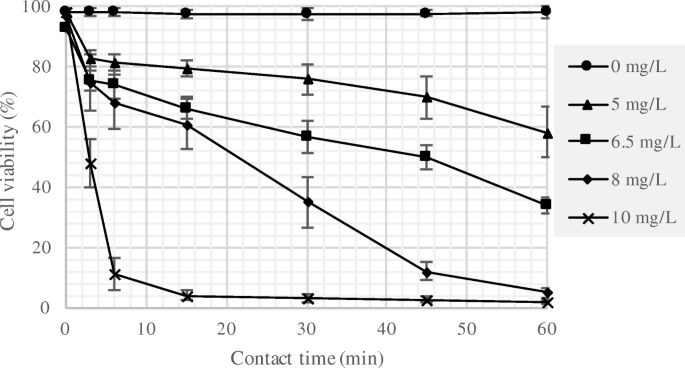
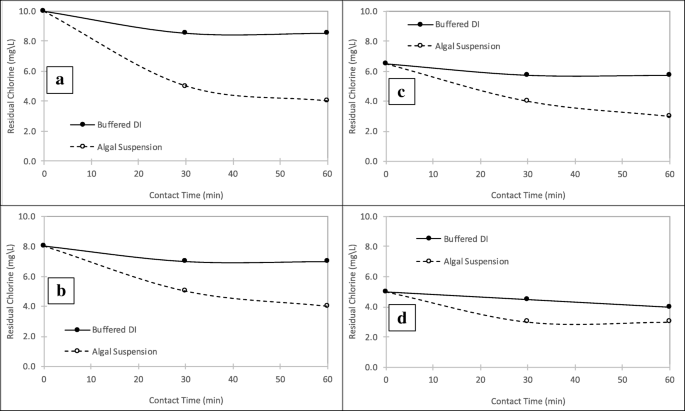
图中显示了细胞活力分析的结果。1.这些数据代表了来自6个重复分析的平均值,来自3个重复反应器的平均值,其中一个标准差(SD)高于或低于平均值。结果表明,在处理过程中,添加0 mg/L氯(对照)的反应器细胞活力保持在~ 100%,而添加5、6.5、8和10 mg/L氯(Cl)的样品细胞活力下降2.当氯浓度为10 mg/L时,细胞活力在6 min内下降到10%左右,而其他浓度的细胞活力下降逐渐。细胞活力的下降与氯的消耗量成正比。藻悬浮液和对照样品的氯残留如图所示。2.在对照中,使用磷酸盐缓冲的二水来估计悬浮液的氯需求。结果表明,通过分别用5,6.5,8和10mg / L氯的藻类悬浮液在一小时接触时间结束时消耗约1.0,2.75,3.0和4.5mg / L氯。
经氯处理后,用扫描电镜对细胞表面进行分析。表面形貌如图所示。3..数字3.A表示形态c .寻常的细胞表面未经处理,从控制反应堆。数字3.B为的形态c .寻常的用氯处理的细胞,与图1中的未处理(对照)细胞的球形相比,将细胞的破碎外观变为不规则形状。3.一种。此外,用氯处理的细胞表现出不均匀的收缩和折痕。
作用机制,化学药物如何抑制或杀灭细胞,可以包括:中断细胞壁和细胞膜,抑制呼吸或代谢反应,细胞划分的破坏以及DNA损伤,等等[24].在文献中,还没有已知或提出氯与藻类细胞反应的机制。此外,氯杀死或抑制微生物生长的机理尚不清楚,尽管它被用作消毒剂已有几十年。20世纪80年代以前进行的氯消毒研究主要集中在细菌上,推测氯与细菌细胞中的生物分子(如蛋白质)发生反应[25那26],巯基[27和α-氨基酸[28],导致氧化,水解和/或破坏细菌的脱氨反应。最近的研究假定细菌死亡可能是由氯攻击各种生物分子或目标的氯导致[29那30.那31那32包括酶活性、核酸、DNA和膜脂。
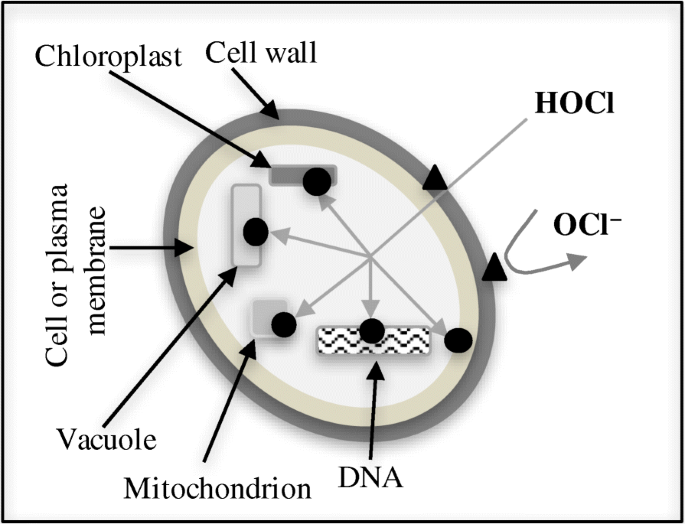
对于氯与藻类细胞的反应,我们提出了一种模型(图。4.)类似于Fukuzaki提出的氯对细菌的作用机制[29].在该模型中,提出了一种用于破坏藻类细胞的“多攻击”理论。作为消毒剂,氯作为氯气施用或以次氯酸盐溶液的形式。当使用氯气时,它与水反应形成Hocl,这反过来分离成OCL−和氢离子(H+).当NaOCl或Ca(OCl)2是用作消毒剂,它们会溶解在水中,产生OCl−,这又与水反应以形成次氯酸和OH−.HOCl和OCl−种,通常称为游离氯,是强氧化剂,可以与藻类细胞壁反应,如图所示。4.(三角形)。藻类细胞壁由多糖或糖蛋白组成,或两者兼而有之[33].多糖是聚合物碳水化合物分子,其由糖苷键合在一起的单糖单元的长链组成,而糖蛋白是含有少量附着在多肽侧链上的单糖链的蛋白质。先前的研究表明,水溶液中含有的多糖和糖蛋白使用氯有效地解聚[34那35,支持这个项目的前提。
藻类细胞或质膜是由磷脂分子的双层的[36,带净负电荷[37,成为OCl的一个障碍−进入藻类细胞的内部。这将限制OCL的行为机制−到藻类细胞壁。另一方面,HOCl由于其电中性和与水相当的分子大小,可以穿透脂质双分子层。水的分子半径为~ 0.76 Å [38],而HOCl的为~ 1.06 Å [39].因此,HOCl也可以与细胞成分发生反应,如图所示。4.(界)。
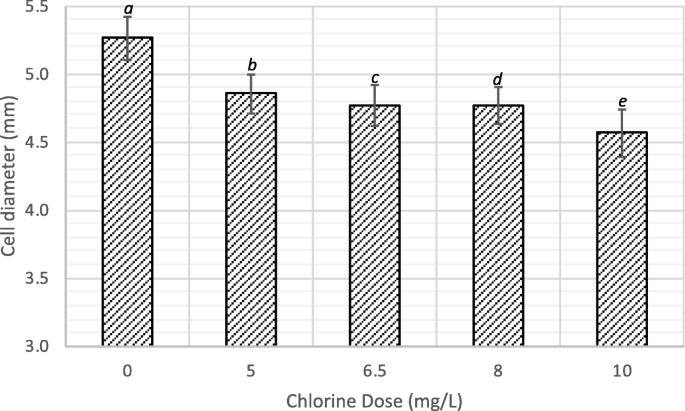
细胞破坏研究是在中性pH值附近进行的,HOCl和OCl的浓度−将是重要的,因此,两种氯都被认为有助于细胞分裂过程。从断裂细胞的SEM形貌可以推断,所观察到的细胞断裂可能是由HOCl和OCl反应引起的−与藻类细胞壁。观察到的细胞收缩可能是由于HOCl穿透藻类细胞壁并与细胞成分发生反应的结果。随着氯浓度的增加,藻细胞直径减小,如图。5..这证实了通过SEM分析观察到的细胞收缩。
糊状的藻类细胞被破坏
如前一小节的结果所示,在10 mg/L氯剂量下进行的破坏实验导致的细胞死亡百分比最高。这一剂量导致每克干藻类含有50毫克氯;以干质量为基础,原料中藻类生物量浓度为0.2 g/L。因此,用10%的海藻糊剂添加0(对照)、3、6、30和60 mg的氯作为Cl,对藻类生物量进行破坏2每克干藻类。接触时间30min后,对样品进行脂质提取。图中显示了每克干藻提取的脂质mg的结果。6..
数据显示,脂质萃取量随氯剂量的增加而减少,说明氯与细胞内容物发生反应并矿化。对于对照样品,脂质提取率保持在200 mg / gc .寻常的.脂质萃取量分别为192、148、135、122 mg / gc .寻常的每克海藻中分别加入3、6、30和60毫克氯。与对照组相比,在每克干藻中添加3、6、30和60 mg氯的样品中,脂质提取率分别降低了4、26、33和40%。
还预计,残余氯可能会影响其他组分,蛋白质和碳水化合物的完整性,一旦油脂被提取后,残留在残余生物质中。
氯的能源效率、成本效益和可持续性
如前几节所示,氯碱在破坏藻类细胞方面是有效的。然而,观察到残留的氯与细胞内容物反应并矿化,这是不可取的。氯作为一种潜在的细胞破坏剂,这条路是不是走到了尽头?是否有必要开展研究工作来应对这一挑战?作者认为后者是合理的;然而,在进行此类研究之前,应利用本研究收集的数据和文献中现成的数据,对氯作为藻类生物破坏剂的能源效率、成本效益和可持续性进行初步分析。在以下各段中,试图回答这些问题。
在美国和欧洲,氯主要是通过电解盐水溶液产生的,这个过程也会产生大约等量的氢氧化钠,也就是说,每生产一吨氯,就会产生1.1吨氢氧化钠。氯和氢氧化钠也会产生等量的氢。目前,隔膜电池、汞电池和膜电池被用来将阳极产生的氯与阴极产生的氢氧化钠和氢分开。三种方法的净能耗分别为10.12、12.15和10.07 MJ/kg产氯[40,氯的平均值为10.78 MJ/kg。
在使用海藻生物量进行悬浮细胞破坏实验中,10 mg/L的氯剂量导致最高的细胞死亡百分比(图。1).这一剂量导致每克干藻类含有50毫克氯;以干质量为基础,原料中藻类生物量浓度为0.2 g/L。因此,氯干扰藻类细胞所需的埋入比能估计为0.54 MJ/kg干藻类。
可以认为,必须考虑从生产现场到最终使用位置的氯生产和运输的总能量要求,特别是与安装后几乎没有供应链能量成本的机械方法相比。一项评估氯对水和废水行业的环境影响的研究报告称氯总能量为74.55 mJ / kg氯[41].假设藻类生物燃料设施与水和废水设施距离氯生产区大约相同的距离,估计含氯藻类生物质所需的总特定能量估计为3.73mJ / kg干藻。在表格中1,本研究估计的氯的特定能量要求以及文献中报告的其他藻类生物量破坏方法[8.]。氯的比能显著低于水动力空化所需的33 MJ / kg干藻,是目前最“有效”的藻类细胞破坏方法。其他方法的比能要求明显高于氯法;例如,脉冲电场是氯的230倍。
水和废水设施中使用的氯的全球变暖潜力(GWP)估计为6.13公斤CO2情商。每公斤氯[41,包括氯的生产和运输。以氯剂量为50 mg/g干藻为基础,估算出用于破坏藻类生物量的氯的GWP为0.3 kg CO2情商。/公斤干海藻。另一方面,占美国发电量66%的煤炭和天然气发电的平均GWP [42], was estimated as 180 g CO2情商。/千兆位的发电量[43].对于水动力空化,GWP估计为5.9 kg CO2情商。每公斤干藻(表1);显着高于氯。类似地,其他破坏方法的估计GWP显着高于氯,表1.
根据从加利福尼亚圣地亚哥当地水处理厂获得的数据,液体氯的价格估计为每加仑60美分或每公斤10.8美分;氯密度为1.467 kg/L。使用上述估计的氯剂量,一加仑液体氯可用于破坏约110公斤干藻类。据估计,由于使用氯而造成的额外成本为每千克干枯藻类细胞约0.54美分。这比从每公斤干藻的33兆焦耳(水动力空化)减少到3.73兆焦耳(氯的总能量)所节省的能量要少得多。使用每千瓦时10美分的零售能源价格,减少29.27 MJ的能源使用相当于每千克被破坏的干藻类细胞节省约80美分。
建议未来的工作
本研究表明,氯是有效破坏藻类细胞。估计的具体能源要求,具体成本和GWP清楚地表明,氯有可能发展成能量效率,成本效益和可持续的藻类生物质破坏的方法。然而,观察到残留的氯与细胞内容物反应并矿化,这是不可取的。因此,未来的研究工作必须集中于解决这一挑战。其中一种研究努力可以是开发方法,以最小化藻类生物量破坏后残留氯和细胞内容物之间的接触。这可以通过固定氯在表面上,然后允许藻悬浮液在流通系统中与表面接触来实现。
还可以淬灭残留的氯以使其与细胞内容物的反应最小化。为了此目的,可以研究水和废水行业中的一些最常用的化学猝灭剂,亚硫酸钠,抗坏血酸,亚硫酸钠和硫代硫酸钠。
结论
氯对破坏藻类细胞是有效的。此外,氯的估计特定能源需求、特定成本和全球变暖潜能值低于现有的藻类生物量破坏方法。对氯的比能需水量估计为3.73 MJ/kg,而对水动力空化的比能需水量为33 MJ/kg,是现有方法中最节能的。氯的GWP估计为0.3 kg CO2情商。每公斤干藻的破坏,而现有的方法在5.9到369.8 CO之间变化2情商。/公斤干海藻。
尽管有这些优点,但观察到残留的氯使细胞内容物矿化。因此,未来的研究工作必须集中于解决这一挑战。其中一项研究工作是探索将氯固定在表面的可能性,藻类细胞在流动系统中与表面接触。此外,剩余氯的猝灭也可以作为未来的研究工作。如果作为未来研究的一部分,氯与细胞内容物的反应被最小化或消除,那么氯有潜力发展成为一种高效、经济、可持续的破坏藻类细胞的方法。
缩写
- 迪:
-
去离子的
- 背景:
-
脱氧核糖核酸
- EROI:
-
能源投资回报
- 采用:
-
全球变暖潜力
- PI:
-
Propidium碘化
- 聚四氟乙烯:
-
聚四氟乙烯
- SD:
-
标准偏差
- SEM:
-
扫描电子显微镜
参考文献
- 1.
马塔TM,马丁斯AA,卡埃塔诺NS。微藻生产生物柴油和其他应用程序:审查。续订苏斯特ENERG修订版2010; 14(1):217-32。
- 2.
Borowitzka马。物种和品系选择。在:Borowitzka MA, Moheimani NR,编辑。用于生物燃料和能源的藻类。多德雷赫特:施普林格;2013.p。288。
- 3.
辛格a,nigam ps,墨菲jd。来自藻类的可再生燃料:借助于贬低陆地燃料的答案。贪婪的技术。2011; 102(1):10-6。
- 4.
王B,李勇,吴N,利用微藻兰C. CO2生物缓解。应用微生物生物技术。2008; 79(5):707-18。
- 5.
王志强,王志强。微藻油脂提取技术的研究进展。中国脂质科学。2011;113(5):539-47。
- 6.
朱勇,刘志强,刘志强,刘志强。水热液化藻类转化为液体燃料技术的研究进展。藻类研究》2013;2(4):455 - 64。
- 7.
Show K-Y, Lee D-J, Tay J-H, Lee T-M, Chang J-S。微藻干燥和细胞破坏-最新进展。Bioresour抛光工艺。2015;184:258 - 66。
- 8.
李AK,刘易斯DM,阿什曼PJ。提取生物燃料脂质的微藻细胞的破坏:过程和特定能量需求。生物质生物能源。2012;46(0):89 - 101。
- 9.
Günerken E, D'Hondt E, Eppink MHM, Garcia-Gonzalez L, Elst K, Wijffels RH。微藻生物炼制的细胞破坏。Biotechnol放置2015;33(2):243 - 60。
- 10.
Skorupskaite V,Makareviciene V,Ubartas M,Karosiene J,Gumbyte M.绿藻ankistrodesmus Fusiformis细胞中断使用不同模式。生物量生物能源。2017; 107:311-6。
- 11.
Yodsuwan n,Kamonpatana P,Chisti Y,Sirisansaneeyakul S.欧姆加热预处理生物柴油生产的藻类泥浆。j biotechnol。2018; 267:71-8。
- 12.
魏尔,布什D,达真斯A,威尔森b。生物能源研究杂志2010;3(2):204 - 13。
- 13.
Beal C,Hebner R,Webber M,Ruoff R,Seibert AF。藻类生物研究的能源回报:研究生产设施的结果。生物能源res。2012; 5(2):341-62。
- 14.
李AK,刘易斯DM,阿什曼PJ。微藻细胞破坏的力和能量需求:原子力显微镜评价。Bioresour抛光工艺。2013;128:199 - 206。
- 15.
Gutiérrez G, Cambiella Á, Benito JM, Pazos C, Coca J.真空蒸发处理油包水乳状液的效果。[J] .中华卫生杀菌剂杂志。2007;144(3):649-54。
- 16.
Keris-Sen UD, Gurol MD.利用臭氧破坏微藻细胞以改善细胞碳水化合物的酶糖化。生物质生物能源。2017;105:59 - 65。
- 17.
程永玲,庄永昌,廖国勇,何世华,叶桂玲,陈志勇,张建生,刘建昌,李德杰。小球藻的臭氧分散浮选。Bioresour抛光工艺。2010;101(23):9092 - 6。
- 18.
Ebenezer V, Nancharaiah YV, Venugopalan副总裁氯化诱导的海洋微藻,小球藻的细胞损伤和恢复。臭氧层。2012;89(9):1042 - 7。
- 19.
Nguyen TL,Lee Dj,Chang Js,Liu JC。臭氧和过氧化物对分散空气浮选藻类分离的影响。胶体冲浪B. 2013; 105(补充C):246-50。
- 20.
布莱EG,戴尔WJ。一种快速的总脂质提取和纯化方法。灿生物化学与物理学。1959; 37(8):911-7。
- 21.
克林格R,Garoma T.生长培养基影响由低频功率超声微藻易感性中断。Ĵ能源RESOUR TECHNOL。2018; 140(12):122004-5。
- 22.
王志强,王志强。微藻细胞浓度、电穿孔、微波和超声处理对脂质提取效率的影响。更新Energ。2016;86:117-23。
- 23.
Rice EW, Bridgewater L, Association APH, Association AWW, Federation WE。水和废水检验的标准方法:美国公共卫生协会;2012.
- 24.
Denyer SP,Stewart GSAB。消毒剂的作用机制。int生物仪生物毒。1998年; 41(3-4):261-8。
- 25.
贝克RWR。次氯酸钠与蛋白质反应的研究:1。反应过程的物理化学研究。j . 1947; 41(3): 337 - 42。
- 26.
Moris P.消毒剂的作用方式。Rev Sci Tech。1995年; 14(1):47-55。
- 27.
venkobhar C, Iyengar L, Prabhakara Rao AVS。消毒机理:氯对细胞膜功能的影响。水杂志1977;11(8):727 - 9。
- 28.
研究方向:氯化反应。次氯酸水溶液与胞嘧啶的反应。生物化学学报。1972;48(4):880-4。
- 29.
Fukuzaki S.次氯酸钠在清洁和消毒过程中的作用机制。Biocontrol SCI。2006; 11(4):147-57。
- 30.
陈志强,陈志强,陈志强,等。次氯酸胁迫对大肠杆菌抗氧化能力的影响。J Bacteriol。1996;178(21):6145 - 50。
- 31.
Virto R,Mañasp,alvarezi,坦止S,Raso J.膜损伤和氯在没有氯苛刻基材的情况下通过氯的氯灭活。申请环境微生物。2005; 71(9):5022-8。
- 32.
赵敏,金J,金JY,尹J,金J h。几种消毒剂灭活大肠杆菌的机理。水研究》2010年,44(11):3410 - 8。
- 33.
Sengbusch PV,在如通过FITC共轭的外源凝集素监测藻类细胞表面的糖缀合物的穆勒U.分布。研究选定物种fromCyanophyta,甲藻,针胞藻类,裸藻,Chromophyta和绿藻。原生质。1983; 114(1):103-13。
- 34.
陈志强。氯对小麦粉多糖的影响。谷物化学1968;45(2):183。
- 35.
蛋白质的氯化反应及其对腐殖质氯化反应的贡献。中国环境科学,1992;27(3):929-46。
- 36.
海藻的膜脂。印:Paul-André S, Norio M,编辑。《光合作用中的脂质:结构、功能和遗传学》,1998年第6卷。荷兰:施普林格。53 - 64页。
- 37.
Alberts B,Johnson A,Lewis J,Raff M,Roberts K,Walter P. Cell的分子生物学。第五届。纽约,花环科学;2007年。
- 38.
Tsiper EV。在水的极化部队从单分子数据推断。物理学快报牧师。2005; 94(1):013204。
- 39.
半极性XO键的性质。H3NO、H2NOH、H3PO、H2POH、H2P(O)F、H2SO、HSOH、HClO、ArO及相关分子的比较从头算研究acta Chem . J . Chem . 1979;101(11): 2804-14。
- 40.
Ayers R.氯的生命周期,第一部分:氯生产和氯气连接。J Ind Ecol。1997; 1(1):81-94。
- 41.
Beavis P,Lundie S.综合环境评估的第三级和残留物治疗 - LCA在废水产业中。水科技。2003; 47(7-8):109-16。
- 42.
IEA: 2016年7月电力月度数据。https://www.eia.gov/electricity/monthly/archive/september2016.pdf.在.国际能源机构2016。
- 43.
IPCC:附件二:指标和方法。见:气候变化:减缓气候变化。第三工作组对政府间气候变化专门委员会第五次评估报告的贡献。剑桥:剑桥大学出版社;2014.p . 1281 - 1328。
确认
不适用。
资金
这项研究没有从公共、商业或非营利部门的资助机构获得任何具体的资助。
可用性数据和材料
目前的研究过程中产生并分析数据集可从上合理请求相应的作者。
作者信息
从属关系
贡献
TG构思和设计了实验;REY进行了实验并分析了数据;TG和REY撰写了这篇论文。两位作者都阅读并批准了最终的手稿。
作者的信息
Temesgen Garoma是圣地亚哥州立大学的民用,建筑和环境工程教授。他也是环境工程中的Blasker椅子,并作为环境工程计划的主任和生物量工程实验室主任。他的研究和教学强调是水和废水处理,资源回收和可再生能源。他目前的研究专注于生物燃料从藻类生物量,废水中资源回收的生产,以及与能源生产的废水处理的整合。在过去,他曾研究过几个研究项目,专注于应用晚期氧化过程,例如,臭氧/紫外线,臭氧/小时2O.2,和H2O.2/Fenton以及饮用水和废水的臭氧化和氯化过程中消毒副产物的形成。
RAMIN E. YAZDI是圣地亚哥州立大学和加利福尼亚大学联合博士博士学位的博士学位。他分别在环境工程和土木工程中持有MS和BS学位。他的研究兴趣是在藻类生物量加工领域,特别是发展新型藻类生物测量和脱水技术。
相应的作者
道德声明
伦理批准和同意参与
本研究不包含任何需要伦理同意或批准的研究。
同意出版物
不适用。
利益争夺
两位作者宣称他们没有相互竞争的利益。
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
权利和权限
开放获取本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
氯气对藻类生物质的破坏研究。BMC植物杂志19,18(2019)。https://doi.org/10.1186/s12870-018-1614-9
收到了:
公认:
发表:
关键词
- 氯
- 细胞的破坏
- 细胞活力
- 特定能量
- 全球变暖潜力