摘要
背景
在各种害虫,褐飞虱,损害水稻是主要的破坏性的害虫。了解抗性机制是朝向有效控制BPH的一个关键步骤。本研究探讨BPH相互作用的具有三个水稻品种的蛋白质组学:第一耐(PR)至BPH,第二敏感(PS),以及第三混合(HR)在两者之间,以了解在稻褐飞虱抗性的机制.
结果
利用iTRAQ蛋白质组学研究从这三个水稻品种中鉴定了4900多个蛋白质。BPH感染后,PR、PS和HR分别检测到414、425和470个差异表达蛋白(DEPs)。已鉴定的dep主要富集于与次生代谢产物生物合成、碳代谢、乙醛酸盐和二羧酸盐代谢相关的类别。双组分反应调节蛋白(ORR22)可能参与BPH感染后的早期信号转导。在抗性水稻品种(PR)中,6个DEPs,即2个脂氧合酶(LOXs)、1个脂肪酶、2个直通蛋白(DIRs)和1个ent -cassa-12,15-二烯合酶(OsDTC1)与可遗传的BPH抗性有关。热激蛋白(HSP20)可能参与水稻对褐飞虱的生理反应,使其成为水稻分子标记辅助选择(MAS)的潜在靶点。定量实时聚合酶链反应(qRT-PCR)揭示了8个基因编码的不同代谢蛋白参与BPH耐药。在粮食发育过程中,这些基因的表达在转录和翻译水平上存在差异。
结论
本研究对褐飞虱侵染过程中亲和和不亲和交互作用下的关键蛋白进行了全面的研究,为进一步研究水稻抗褐飞虱的分子基础和选育抗褐飞虱水稻品种提供了理论依据。
背景
对于超过35亿人的稻米是一家主要的食物,供应> 20%的饮食卡路里摄入量以全球人类的人类。在亚太地区,主要是中国,印度,印度尼西亚和越南生产的大米的90%以上提供给世界[1].在这些地区,褐飞虱(BPH)nilaparvata leugens(Stål)(半翅目:飞蝗科)已成为危害农产品的主要害虫。褐飞虱是一种食草害虫,只侵害水稻植株(单食性),通常以维管汁液为食。褐飞虱用茎管吸取水稻叶鞘的韧皮部汁液,导致漏斗烧伤,在最严重的情况下,整株水稻在开花时死亡[2].BPH还可传播植物病毒,对水稻造成额外损害[3.].近年来,褐飞虱对水稻作物造成了毁灭性的破坏。仅在中国,每年就有10 - 15亿公斤的水稻因褐皮病而减产,相当于数十亿元的经济损失[4].化学杀虫剂的广泛使用已成为防治褐飞虱最常用的方法,这带来了许多问题,包括对天敌的毒性,可能对生态系统和人类健康造成长期损害,并增加了生产成本[5].在稻种进入易感但否则优选品种结合BPH抗性基因可以是朝向由BPH引起的[控制损害的有效和环境友好的方式6].
从20世纪60年代开始,农学家就致力于鉴定抗bph的种质,开发抗bph的水稻品种[7].此前已有至少30个BPH抗性基因和数量性状位点(qtl)被识别并整合到许多水稻品种中[8,9].这种方法已经被发现对BPH有帮助,并通过qtl的结合改善了防御。然而,由于水稻品种基因组的复杂性,qtl在水稻抗褐斑病机制中的作用一直难以明确。这阻碍了针对特定环境的抗BPH品种的后续开发[10].基因和蛋白质表达的整体变化是了解水稻品种在褐变胁迫下的分子响应的一种途径。它还有助于阐明在防御BPH过程中各种基因和蛋白质的相互作用,可用于育种抗BPH水稻[11].
以往基于各种转录组学和蛋白质组学分析的研究表明,BPH侵染诱导了复杂的生物学变化,影响了水稻中多个基因和蛋白质的表达。这些基因变化与信号通路、创伤反应和氧化应激的变化有关[12].举例来说,在负责产生活性氧物质(ROS)的BPH应力条件的基因,应激反应和蛋白质降解被上调在易感的水稻植物,而那些与光合作用中下调[13].
最近,一项cDNA微阵列研究表明,1467个差异探针集可能与本构阻力有关[14].发现两种BPH-敏感性和抗性水稻品种的叶鞘具有超过30种代谢物如糖,氨基酸,胆碱的代谢物,以及有机酸BPH引起的应力之后[14].转录组学和蛋白质组学工具的进展提供了独特的能力来区分植物对BPH胁迫的反应,并表明其在开发抗BPH水稻中的重要作用[15].最近的一项研究采用蛋白质组学策略由野生型IR64与BPH入侵期间损失和阻力的增益近等基因水稻突变体给出响应的调查。它导致了65种蛋白质的鉴定,在野生型IR64 BPH入侵过程中发生显着变化[10].
野生稻品种通常具有抗病虫害能力,但缺乏理想的农艺性状,如植株结构、品质和高产。将野生品种的抗性基因导入敏感水稻品种是培育抗bph品种的重要途径[16].在云南省,中国,稻属的一个重要的野生物种(土著) -药用野生稻结果表明,Wall exWatt (CC, 2n = 2x = 24)是水稻抗稻瘟病、褐飞虱、白背飞虱、白叶枯病(BB)、白背飞虱(WBPH)等抗病基因的库[17].通过种间杂交和回交,已将许多抗性基因导入品种中o . officinalis和o .漂白亚麻纤维卷.一些品种已被释放用于商业栽培[18].
为了深入了解水稻抗褐变的分子机制,本研究对杂交水稻F1系(HR)及其高度抗褐变的母体进行了研究药用野生稻Wall ex Watt line (PR) [19]和BPH易感父本栽培稻线扬稻6浩(PS),被评定为在分子水平上稻植物对BPH攻击。这些信息对于理解抗褐飞虱的生物学基础,并为可能为水稻育种被利用新的抗褐飞虱相关基因的鉴定。
结果
褐飞虱侵害期间的水稻表型
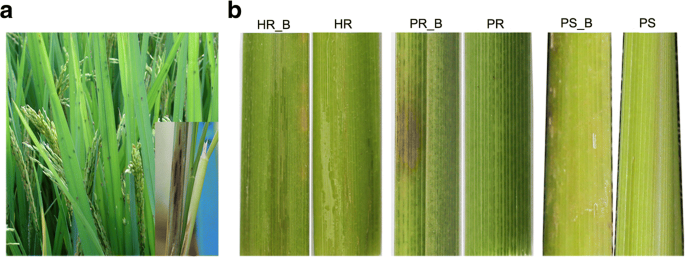
虫害发生后,褐飞虱会导致幼苗萎蔫,首先在敏感的水稻系PS上出现漏斗烧症状,然后是HR和PR(两个抗褐飞虱的水稻系)(图。1B).对叶片的明显伤害,PR最低,HR中间,PS最高。敏感(PS_B)水稻株系与抗性(PR_B和HR_B)水稻株系的表型差异相当明显,这与不同抗性水稻品种侵染BPH后的生理表型结果一致[20.].
接种BPH后3个品种间差异表达蛋白(DEPs)
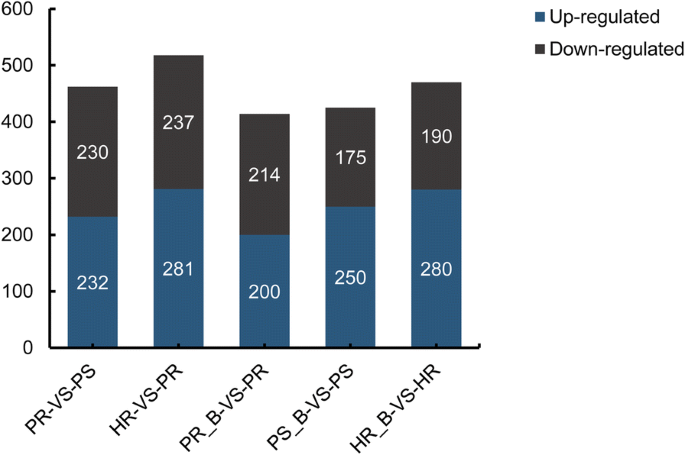
通过iTRAQ分析,从这三个品种中共鉴定出4907个蛋白(附加文件)1:表S1)。在PR和PS之间共鉴定出462个差异表达蛋白(DEPs),其中抗性PR与敏感PS相比增加了232个,减少了230个。与PS相比,HR增加了281个,减少了237个。接种BPH后,3个水稻品种的蛋白表达均发生了显著变化:PR中检测到414个DEPs,其中200个表达上调,214个表达下调2:表S2);接种后(附加文件在PS中检测到423级的DEP,与248是上调3.:表S3);HR中470个DEPs中有190个在接种后上调(附加文件)4:表S4)(图2).
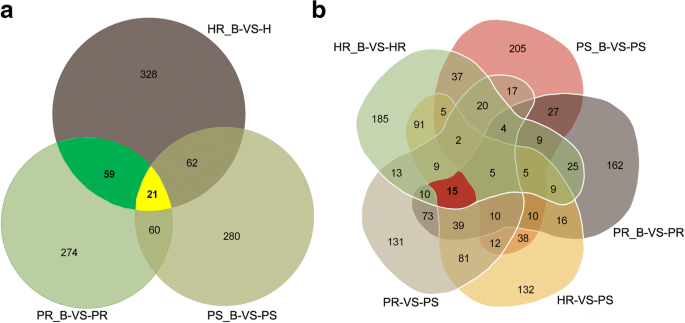
Inoculating with BPH resulted in 1084 identified DEPs (328 + 59 + 21 + 62 + 60 + 280 + 274) among three rice cultivars in response to BPH infection, as shown in the Venn diagram (Fig.3.一种)。21级的DEP通过HR_B与HR,PS_B与PS和PR_B与PR(附加文件共享5:表S5;桌子1)可能产生对BPH的广谱抗性[21].HR_B与HR和PR_B与PR共享的59 DEP有可能。与米饭的积极抗性有关抗体[22].由于本研究的一个主要目标是屏幕参与了抗褐飞虱基因内部的蛋白质生物标记,我们选择的是一贯差异背景之间表达和BPH感染的植物蛋白质。我们发现通过与HR_B HR,PR_B与PR,PR与PS和HR与PS(图4个比较组共享15级的DEP。3.b,表2),其中热休克蛋白HSP20、B0FFN6在BPH感染后各对照中均显著上调。这些结果表明抗性品种和敏感品种之间存在差异,对这些基因的进一步分析可能为抗病机制的研究提供依据。
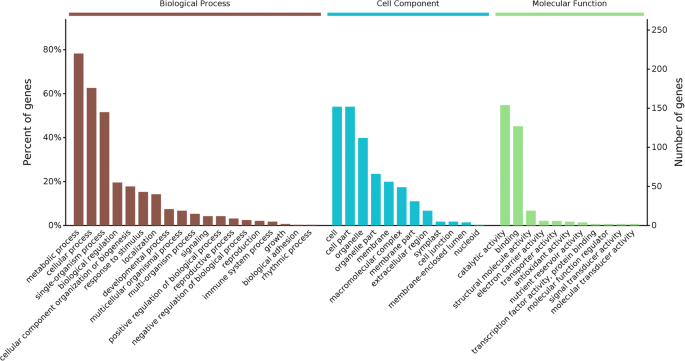
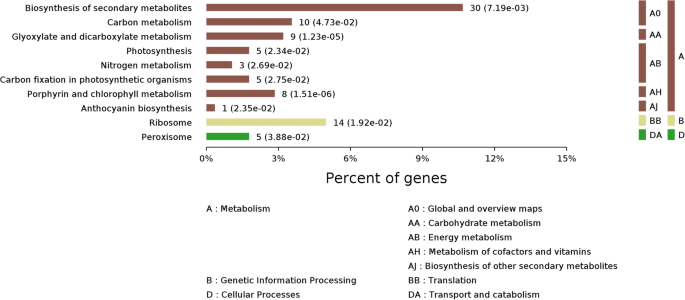
为了获得BHP感染后蛋白质组变化的全面表征,我们使用GO术语对所有1084 DEPs进行了注释,并对其进行了GO功能分析。这些dep所代表的主要生物过程类别有代谢过程、刺激反应、细胞过程和单生物过程。根据其分子功能性质,这些蛋白质主要分为催化活性、结合活性、结构分子活性、电子载体活性、转运活性、抗氧化活性和营养库活性(图1)。4).这些DEPs在次生代谢产物(10.7%)、核糖体(5.0%)、碳代谢(3.6%)、糖基和二羧酸盐代谢(3.2%)、卟啉和叶绿素代谢(2.8%)、光合作用(1.8%)、过氧化物酶体(1.8%)的生物合成中富集。光合作用生物的碳固定作用(1.7%)、氮代谢作用(1.1%)和花青素生物合成作用(0.4%)(图。5).
定量RT-PCR验证
对于涉及mRNA和其蛋白质的表达模式之间的相关性的定量结果确认,随机选择八种蛋白质为使用定量RT-PCR(Q-PCR)分析动态转录表达谱评估。桌子2和无花果。6显示编码Q7FAS1类似于蛋白表达模式的基因的该mRNA表达模式。基因Q6AVH9,Q6K832和Q6Z7B3在PS_B-VS-PS,HR_B-VS-HR和PR_B-VS-PR组显示mRNA和对应的蛋白之间是相似的表达谱。在另一方面中,编码Q2R1U4基因,Q6YUV3,Q7XRT6和Q8H7X8表明mRNA的表达模式相反的相关蛋白,其可能是由于翻译或翻译后修饰的。
讨论
褐飞虱是水稻的主要害虫之一,严重威胁着水稻的规模化生产。培育抗病品种是提高作物性能和控制农业害虫的最有效和最环保的方法。此外,该属的野生种oryza.具有丰富的遗传多样性实际上仍未得到开发,因此可以作为抗褐皮病的关键来源[23].目前已经鉴定出19个以上的bph抗性基因,并通过QTL定位将其分配到栽培稻和野生稻的染色体上[24].QTL已频繁用于预测标记辅助育种的表型。然而,管辖主要农艺性状的分子机制是相当复杂的,并且经常需要各种严格控制过程,如基因调控,翻译后修饰(翻译后修饰)和蛋白质的相互作用。蛋白丰度,翻译后修饰,蛋白质 - 蛋白质相互作用,并且细胞定位的分析可以通过定量蛋白质组学来促进。对于复杂的性状,涉及蛋白质修饰和丰富的传播,定量蛋白质估计可能是作为标记[非常有价值25].在这项工作中,使用比较的iTRAQ的蛋白质组学分析,以确定在野外栽培耐BPH-水稻品系PR [差异积累蛋白质19,26,27],BPH易感栽培稻研究结果有助于了解褐飞虱与水稻之间潜在的分子相互作用,以及水稻对褐飞虱的遗传抗性。与以往基于传统2d -蛋白质组学的研究相比,dep的数量显著增加[10,28].
BPH感染后参与早期信号转导的蛋白质
激素信号通路在水稻防御信号网络中起着至关重要的作用。水稻对褐皮病的防御和植物激素的作用是非常复杂的,而且在不同基因型之间也存在差异。BPH的入侵通常会增加水稻中乙烯(Et)、水杨酸(SA)和茉莉酸(JA)的产生[1].本研究发现,HR_B组与HR组、PS_B组与PS组、PR_B组与PR组接种BPH后共有21个DEPs。这些DEPs可能参与了水稻与褐飞虱的早期相互作用。利用Swissport蛋白序列数据库确定,这些DEPs包括15个功能未知的蛋白,一个过氧化物酶,两个微管蛋白,两个糖基转移酶和一个双组分反应调节蛋白(ORR22)。
双组分响应调节器与双组分系统(TCS)有关。基于TCS的信号转导机制包括一个触发细胞分裂素信号的磷传递。细胞分裂素感知导致AHK蛋白保守组氨酸(H)残基的自磷酸化[29].细胞分裂素是N6-取代腺嘌呤衍生物的发现基于它们在培养细胞中促进细胞分裂的能力。细胞分裂素是一种通过与水杨酸(SA)协同作用激活防御反应的感染信号,在这方面已经取得了很大进展。Li等发现水稻褐飞虱侵染后SA含量显著增加,SA在水稻对褐飞虱的抗性反应中起着至关重要的作用[7].在这项研究中,双组分反应调节器(ORR22)是由BPH感染后显着上调,通过2.61,在H,M,和W,分别9.86和1.64倍,这表明ORR22可以发挥关键作用到BPH阻力。
水稻抗褐飞虱遗传抗性相关蛋白
在寄生虫攻击涉及到的蛋白质及其相互作用的鉴定是必要的,以便了解植物抗性的基本机制。通常情况下,病原体相关蛋白有直接的关系植物防御过程和病原体/寄生虫侵袭的刺激。阻力在兼容和不兼容的相互作用可持续性取决于这些蛋白质的相互作用,他们积累的方式或激活植物的防御系统[30.].为了帮助了解水稻对BPH的可遗传性抵抗,我们鉴定了BPH侵扰后两种抗性品种(HR和PR)积累的59型DEPS(附加档案5:表S5)。这些59级的DEP通过SwissProt数据库数据库注释分析表明在这两个抗病品种是与水稻和BPH之间的相互作用6级的DEP全部被上调。这六个的DEP被认为是有关对BPH(图可继承电阻。7).
在植物中已经形成了一种复杂的防御机制,它可能利用多种防御途径的有组织的作用来对抗各种非生物和生物胁迫。参与植物防御反应的有多种有机化合物,如羟脂、乙烯、水杨酸等[31].Oxylipins是由多不饱和脂肪酸氧化修饰产生的一类化合物,作为植物信使。除各种发育过程外,oxylipin还参与介导作物对非生物和生物胁迫的防御反应。oxylipin的生物合成是由多不饱和脂肪酸氧化合成脂肪酸氢过氧化物引发的。为了确定第一步,脂肪酶在不同的oxylipin生物合成途径中与单个脂加氧酶(LOXs)协同工作[32].对水稻LOX最近的研究表明,LOX的上调可能是介导爆JA,阻力之间JA和SA,以及权衡之间的串扰害虫[主节点31,32,33,34].在本研究中,在BPH感染后,在HR和Pr中发现了两种LOXS(A2xLT7和B8BMH5)和一个脂肪酶(Q6K832),与LOX参与草食性诱导的JA生物合成(害虫诱导)的想法一致并对在水稻中控制咀嚼和植物饲喂食草动物的抗性至关重要。
另一方面,木脂素是植物中分布广泛、种类繁多的另一类次生代谢产物,具有丰富的药理活性。木脂素的产生与调控蛋白(DIRs)密切相关,并最终在植物抵御虫害中发挥重要作用[35,36].植物次生代谢物主要作为害虫取食的调节剂,但在少数情况下,它们也可能控制昆虫的特定生理功能[35].一项较早的研究表明木脂素和二苯乙烯类物质会干扰蜕皮[37].最近一项关于木脂素的研究表明,木脂素表现出类似于幼年激素的活性,阻止蛹和成虫形态发生,从而使昆虫处于未成熟状态[38,39].本研究发现BPH感染后HR和PR中有两个DIRs (A2Y980和Q2R0I1)上调。这可能说明DIR组分的增加促进了BPH感染后木脂素及其相关次生代谢产物的含量,这些物质可能是干扰BPH生长的物质[40].
植物对生物和非生物胁迫产生了广泛的防御反应,其中植物抗毒素的产生是植物主要的化学防御系统[41].植物抗毒素最近被分离为水稻二萜抗毒素,是坏死病变边缘积累最丰富的化合物,代表植物抗毒素可能有助于防止随后真菌从感染部位扩散[42].ent -cassa-12,15-二烯合酶(OsDTC1)被认为在植物cassane的生物合成中具有重要作用。BPH感染后,在HR和PS中OsDTC1表达上调,可能是提高植物cassanes水平,促进对BPH的抗性。
潜在的标记蛋白质养殖抗褐飞虱水稻
开发抗病品种被认为是保护水稻作物免受虫害的一种有效和环保的方法[43].传统的育种方法受到遗传复杂性、产量构成因素遗传方差低、选择方法低效、环境变异性和基因型-环境交互作用强等因素的限制[44].基本上,几种基于组学的方法增强了我们确定目标遗传成分和代谢途径的能力,这些遗传成分和代谢途径控制特定性状,因此使我们能够通过筛选和分析平台支持选择策略[45].在这项研究中,我们发现HR_B对人力资源的所有成对共享PR_B与PR,PR对PS和人力资源与PS,其中只有一个(热休克蛋白HSP20,B0FFN6)被认为是显著15级的DEPBPH感染后上调。由于各种应激条件下微小的热休克蛋白(sHSPs)/ HSP20被诱导和对生物和非生物胁迫s以后进行植物防御重要的作用[46].最近的一项研究表明,RSV感染的小水稻的小HSP20显着影响,其通过以无情和循环的传播方式通过小褐色Planthopper(SBPH)的活性转移[47].我们推测HSP20可能是一种生理上有利的反应,使其成为标记辅助选择(MAS)的潜在靶点,从而显著提高水稻抗BPH育种的效率。
结论
结合全面的蛋白质组学分析和定量RT-PCR分析表明,导致两BPH-抗感水稻品种复杂的蛋白质的变化是前列腺增生的侵袭。这项研究结果提供了新的线索,这将有助于了解前列腺增生症的侵扰复杂的分子和细胞事件和培育抗褐飞虱水稻潜在的有用的工具。回应BPH为患这两者共同BPH抗性和易感水稻植株被ORR22的激活,这可以通过持续推广SA的抗褐飞虱抗性响应早期信号转导中发挥作用凸显。重要的是,有抗性和易感栽培品种-的抗性水稻节目之间的可继承电阻实质差异针对BPH剧烈反应BPH侵染相对于它们的变化涉及蛋白的数量和程度。LOXs,的DIR和OsDTC1在对着BPH可继承电阻关键酶。此外,我们发现,HSP20可能是前列腺增生症抗性育种的潜在目标。
方法
昆虫培养和植物材料
良性前列腺增生(nilaparvata leugens在感病品种(之后,PS)在农业科学云南省林科院(云南省农业科学院),中国云南省。最初的BPH人口从附近的云南省农业科学院水稻田收集。对于侵入,采用妊娠女性获得同步料斗阶段。父系PS(栽培稻L.ssp.籼稻),母系PR(o . officinalis),以及它们的混合线路HR在本研究中使用。PR和HR表明,提高防御BPH的侵扰,而PS容易。Experimental plants were grown at 28 ± 2 °C with a photoperiod of 16 h day/8 h night under greenhouse conditions.
植物表型对BPH侵害
本研究包括6种治疗方法,即:o . officinalis有(PR_B)和没有(PR) BPH感染;o .漂白亚麻纤维卷与(PS_B)和不具有(PS)BPH感染;以及它们与(HR_B)混合和无(HR)BPH感染。植物生长,直到启动阶段,当BPH引入到三个感染治疗。Stem tissues were collected 30 days after BPH infestation began. Visually healthy plants were selected for sampling for treatments without BPH infection. For BPH infected treatments, plants with visual signs of heavy infestation were selected for sampling. Three independent replicates were collected for each treatment. Samples were snap-frozen immediately and kept at − 80 °C until processing.
蛋白质的提取
对于每个植物组织样本,称量1 g亚样本,在液氮中研磨均质。将粉末状样品迅速移至50ml预冷试管中,然后将25ml预冷丙酮(−20°C)(含10% (v/v)三氯乙酸(TCA)和65 mM二硫苏糖醇(DTT)。充分混合后,匀浆在−20°C下沉淀2 h,然后离心(16,000×g, 4°C) 30分钟。仔细去除上清,然后用20 mL冷冻丙酮(−20°C)洗涤小球三次。在−20°C保存30分钟,然后离心(20,000×g, 4°C) 30分钟。收集沉淀物,真空冷冻干燥。称取250mg冻干颗粒样品,并放入Eppendorf管(1.5 mL)中。将微球与SDT裂解缓冲液(4% SDS, 100 mM Tris-HCl, 100 mM DTT, pH 8.0)混合,煮沸5分钟。沸腾后,将混合物旋涡30 s,在冰浴中间歇性超声,超声5 s,然后在100 W下中断10 s,持续5 min。然后将混合物再次煮沸一段时间(5分钟),然后通过30分钟离心收集(12,000×g, 20℃)。上清收集在新鲜的Eppendorf管(1.5 mL)中,通过0.22 μm Millipore过滤器收集裂解液。 Protein concentration in the lysate was estimated using bicinchoninic acid (BCA) protein assay kit (Beyotime Institute of Biotechnology, China). The rest of the lysate was frozen at − 80 °C until use.
蛋白质消化
采用FASP程序进行蛋白质消化[48].简而言之,浓缩蛋白(300 μg)在超滤滤液管(30 kDa截止,德国哥廷根萨托里乌斯)中与200 μL UA缓冲液(8 M尿素,150 mM Tris-HCl, pH 8.0)混合,14000 g, 20°Χ离心30分钟。加200 μL UA洗涤2次,14000 g 20℃离心30 min。从集合中流过管被丢弃,其次是增加100μL IAA的解决方案(UA缓冲50 mM IAA)过滤管,混合在600 rpm全能料理机安慰孵化器(埃普多夫,德国)1分钟,孵化不搅拌30分钟在黑暗中在室温下,和离心14000 g为30分钟20°C。在过滤装置中加入100 μL UA, 14000 g离心20分钟,重复此步骤两次。在滤器上加入100 μL的溶解缓冲液(Applied Biosystems, Foster City, CA, USA), 14,000 g离心20分钟,重复两次。滤液管中的蛋白悬浮液经40 μL胰蛋白酶(40 μL的溶解缓冲液中含有4 μg胰蛋白酶)在37℃下酶解16-18 h。最后,将过滤单元转移到一个新的管中,以14000 g旋转30分钟。在滤液中收集多肽,用波长为280 nm (OD280)的光密度法测定多肽的浓度。
iTRAQ标记和高ph反相色谱分离
在制造商推荐的程序之后,用Itraq试剂(AB Sciex,Framingham,MA,USA)标记消化的肽。简而言之,来自样品HR_B,HR,PS_B,PS,PR_B和PR的肽分别用ITRAQ试剂115,116,117,118,119和121标记。将所有标记的肽合并在一起。在配备的1100系列HPLC值系统(Agilent)中,对标记和混合肽进行高pH反相(高pH rp)分馏(Agilent),配备了Gemini-nx(Phenomemex,00f-4453-E0)列(4.6×150 mm, 3 μm, 110 Å). Peptides were eluted at a flow rate of 0.8 mL/min. Buffer A consisted of 10 mM Ammonium acetate (pH 10.0) and buffer B consisted of 10 mM Ammonium acetate, 90%v/v CAN (pH 10.0)。缓冲液A和B都经过过滤杀菌。以下应用梯度进行分离:100%缓冲了40分钟,0 - 5%缓冲B为3分钟,5 - 35%的缓冲B为30分钟,35 - 70%的缓冲B 10分钟,70 - 75%的缓冲B 10分钟,75 - 100%的缓冲B 7分钟,100%的缓冲B 15分钟,最后100%的缓冲,持续15分钟。通过214 nm的吸光度监测洗脱过程,每75 s收集一次样品。最后,收集的分数(大约40个)被合并到15个池中。各馏分经真空离心浓缩,用40 μL 0.1% v/v三氟乙酸重建。所有样品保存在−80°C,直到进一步分析。
LC−MS/MS分析
每1 μg高ph反相组分肽经Easy-nLC 1000高效液相色谱系统耦合Orbitrap Elite质谱仪(Thermo Fisher Scientific, San Jose, CA, USA)测定。采用Thermo Scientific EASY trap柱(100 μm × 2 cm, 5 μm, 100 Å, C18)和分析柱(75 μm × 25 cm, 5 μm, 100 Å, C18)对多肽进行分离。流动相流速为150 nL/min,由缓冲液A(0.1%甲酸水溶液)和缓冲液B(0.1%甲酸100% ACN)组成。60分钟梯度从缓冲液A开始到35%缓冲液B 50分钟,然后是35-90%缓冲液B 6分钟,然后是90%缓冲液B 4分钟。质谱仪在正电离模式下工作。每个馏分的MS1光谱范围在350-2000之间m / z在60k的分辨率下,随后选择来自每个MS1光谱的16个最丰富的信号用于进一步碎片(MS2)分析。数据依赖性采集(DDA)和更高的能量碰撞解离(HCD)在MS2分析中的分辨率为15,000。最大离子注入时间和全扫描模式设定为50 ms和150ms,10×10−65 × 104分别在MS1和MS2分析中。动态排除时间为30秒。
数据分析
蛋白质组发现者2.1(赛默飞世尔科技)来分析原始数据。嵌入在蛋白质组发现者吉祥物2.1(Matrix Science公司)用于搜索原始数据针对Uniprot登录稻数据库(2016年10月9日; 168354个序列)。搜索参数如下:单一同位素质量;如胰蛋白酶裂解酶;两根最大遗漏分裂;iTRAQ标记和半胱氨酸作为固定修饰的甲基化脲;和蛋氨酸作为可变修饰的氧化。Peptide mass tolerance of ±20 ppm and fragment mass tolerance of 0.1 Da were used for parent and monoisotopic fragment ions, respectively. Results were filtered based on a false discovery rate of (FDR) ≤0.01. Relative quantitative analyses of proteins were based on ratios of iTRAQ reporter ions from all unique peptides representing each protein. Relative peak intensities of the iTRAQ reporter ions released in each of the MS/MS spectra were used. Final ratios obtained from relative protein quantifications were normalized based on the median average protein quantification ratio. A reported protein ratio represents the median of ratios of unique peptides of that protein. The mass spectrometry proteomics data have been deposited to the ProteomeXchange Consortium via the PRIDE [49使用数据集标识符PXD008926的伙伴存储库。
生物信息学
使用Perseus V1.4.1.3进行统计和层次聚类分析[48].P进一步分析了Perseus中benjaminii - hochberg FDR的-值< 0.05和两植物类群之间差异超过150%的蛋白的功能和生物学相关性。利用基因本体论联盟(gene ontology Consortium)提供的免费基因本体论(GO)数据库,这些蛋白质根据其基因功能和生物学途径进行了分类。http://geneontology.org/) (50].从UniProt知识库中提取已识别的蛋白质序列信息,并以FASTA格式进行检索。利用同源蛋白的功能信息对目标蛋白进行注释。e值小于1的前10个爆炸e-3为每个查询蛋白检索并加载到Blast2GO(版本2.7.2)[51],高通量基因本体论(GO)分析在线工具,对于GO映射和注释。富集的GO术语进行鉴定费希尔精确检验。与每个所识别蛋白相关信号通路被根据KEGG途径还注释(https://www.genome.jp/kegg/pathway.html).在这项研究中,有针对性的蛋白质反对使用KAAS(KEGG自动注解服务器)的KEGG基因数据库爆炸[52].Fisher’s Exact Test检测到富集的KEGG通路。
qRT-PCR验证蛋白表达
使用TaKaRa RNAiso试剂(Takara Bio公司,大津,日本)用于从六个大米样品提取总RNA。The purified RNA was reverse-transcribed into cDNA with M-MLV reverse transcriptase (Promega, Madison, WI, USA) and qRT–PCR reaction was performed in 96-well, 25 μL blocks using the CFX96 Real-time System (BioRad, Hercules, CA, USA). Each qRT-PCR was run in triplicate. Actin (GenBank: AY212324) was used as reference gene to normalize the data and 2-∆∆CT(循环阈值)方法被用于计算相对表达水平[53].
缩写
- BB:
-
白叶枯病
- BCA:
-
双子素素酸
- 良性前列腺增生:
-
褐飞虱
- 部:
-
差异表达的蛋白质
- DIRs:
-
两个dirigent蛋白质
- HSP20:
-
热休克蛋白
- 液态氧:
-
两个脂氧合酶
- ORR22:
-
双组分反应调节蛋白
- OsDTC1:
-
Ent-cassa-12, 15-diene合酶
- 经济价值:
-
数量性状位点
- ROS:
-
反应性氧气
- WBPH:
-
白背飞虱
- yaa:
-
云南省农业科学院
参考
- 1.
程旭,朱丽,贺国强。水稻与褐飞虱分子相互作用的研究进展。摩尔。2013;6:621-34。
- 2.
关键词:褐飞虱,基因组资源,转录组焦磷酸测序,基因芯片设计昆虫科学。2012;19:1-12。
- 3.
威非AE,福克BW,植物病毒罗滕贝格D.昆虫载体介导的传输。病毒学。2015; 479-480:278-89。
- 4.
赵凯,董崇武,Eizenga GC, Wright MH, Ali ML, Price AH,等。全基因组关联作图揭示了水稻复杂性状丰富的遗传结构。Nat Commun。2011;2:467。
- 5.
亚洲和非洲农业可持续集约化综合病虫害管理。昆虫。2015;6:152 - 82。
- 6.
薛Ĵ,宝Y-Y,李斌,程Y-B,鹏Z-Y,刘H,等人。褐飞虱褐的转录组分析飞虱。Plos一个。2010; 5:e14233。
- 7.
李超,罗超,周智,王锐,凌峰,肖林,等。两种水稻基因型对褐飞虱侵害反应的基因表达和植物激素水平。BMC Plant Biol. 2017;17:57。
- 8.
吴华,刘颖,何静,刘艳,姜玲,刘玲,等。水稻褐飞虱(Nilaparvata lugens Stål)抗性基因Bph28(t)的精细定位摩尔品种。2014;33:909-18。
- 9.
胡Ĵ,小C,在遗传学和水稻抗褐飞虱的分子育种他Y.进展。米。2016; 9:30。
- 10.
Sangha JS, Yolanda HC, Kaur J, Khan W, Abduljaleel Z, Alanazi MS, et al.;水稻(Oryza sativa L.)突变体的蛋白质组学分析揭示了褐飞虱(Nilaparvata lugens)侵染过程中的差异诱导蛋白。中华医学杂志。2013;14:3921-45。
- 11.
Agarwal P, Parida SK, Raghuvanshi S, Kapoor S, Khurana P, Khurana JP,等。通过基于基因组的功能分析和分子育种在印度的水稻改良。大米。2016;9(1)。
- 12.
张飞,朱丽,何国平。水稻褐飞虱摄食反应的基因表达差异。植物生理学报。2004;61:53 - 62。
- 13.
袁浩,陈晓霞,朱磊,何国强。水稻褐飞虱Stål的基因鉴定。足底。2005;221:105-12。
- 14.
刘超,郝芳,胡建军,张伟,万磊,朱磊,等。通过代谢组学和基因表达分析揭示水稻对褐飞虱侵害的不同系统响应。蛋白质组学杂志2010;
- 15.
阿格拉瓦尔GK,Rakwal R.水稻蛋白质组学:朝扩大蛋白质组覆盖一招比较和功能蛋白质组学揭示水稻和植物生物学的奥秘。蛋白质组学。2011; 11:1630至1649年。
- 16.
黄Z,他G,舒L,李X,张Q.鉴定及在两个水稻抗褐飞虱基因的图谱。TAG理论应用遗传学。2001; 102:929-34。
- 17.
宝Y,徐S,京X,蒙L,秦Z.德通过使用RNA-seq的从头组装和药用野生稻叶转录的表征。BioMed Res Int。2015; 2015:982065。
- 18.
田村元,武军。水稻抗褐飞虱基因BPH26的克隆与鉴定。籼稻品种ADR52。Sci众议员2014;4:5872。
- 19.
何斌,顾勇,陶晓霞,程晓霞,魏超,付建军,等。水稻新转录组测序鉴定抗病基因中华医学杂志。2015;16:29482-95。
- 20。
蒋伟,张海涛,乔玉华,等。水稻褐飞虱抗性基因Bph20(t)和Bph21(t)的高分辨率定位Theor Appl Genet 2009; 119:1237-46。
- 21.
范飞,李楠,陈勇,刘旭东,孙辉,王军,等。3系和2系杂交稻抗bph广谱恢复系的选育。植物学报,2017;
- 22.
褐飞虱在水稻种质资源上的取食行为及其抗性指标。《公共科学图书馆•综合》。2011;6:e22137。
- 23.
金H,赫尔维茨B,于Y,Collura K,吉尔N,SanMiguel P,等人。建设,对准和代表的十个基因组类型稻属十二框架物理图谱分析。基因组Biol。2008; 9:R45。
- 24.
张强。绿色超级稻的发展策略。中国科学院院刊2007;104:16402-9。
- 25.
靶向蛋白质组学方法在植物育种中的应用。J Proteome Res. 2016; 15:638-46。
- 26.
张伟,董勇,杨磊,马博,马锐,黄飞,等。野生稻(Oryza officinalis)的小褐飞虱抗性位点。基因组学。2014;289:373-82。
- 27.
高立志,葛胜,洪德勇。水稻的高水平遗传分化。瓦特。来自中国。J在这里。2001;92:511-6。
- 28.
魏志,胡伟,林强,程旭,童明,朱磊,等。水稻对褐飞虱(Nilaparvata lugens)抗性的蛋白质组学研究。蛋白质组学。2009;9:2798 - 808。
- 29.
拟南芥反应调节剂22抑制细胞分裂素调控的基因转录。原生质。2017;254:597 - 601。
- 30.
Chatterjee A, Pandey S, Singh PK, Pathak NP, Rai N, Ramachandran R,等。致病性和非致病性分枝杆菌酪氨酸磷酸酶的生化和功能特征:苯基环丙基甲基- /苯基丁烯基唑作为酪氨酸磷酸酶抑制剂的适应症。应用微生物生物技术。2015;99:7539-48。
- 31。
周刚,任宁,齐军,陆军,向成,鞠洪,等。9-脂加氧酶Osr9-LOX1与13-脂加氧酶介导的途径相互作用,调节水稻对咀嚼和刺吸食草动物的抗性。杂志。2014;152:59 - 69。
- 32。
王锐,沈伟,刘丽,姜玲,刘勇,苏宁,等。一个新的脂加氧酶基因在水稻种子发育中具有双重位置特异性,对伤害和昆虫攻击有反应。植物学报。2008;66:401-14。
- 33.
周刚,齐建军,任宁,程建军,Erb M,毛斌,等。沉默OsHI-LOX使水稻更容易受到咀嚼食草动物的影响,但提高了对韧皮部捕食者的抗性。植物j . 2009; 60:638-48。
- 34.
郝Z,王磊,他Y,梁Ĵ,防御基因和水稻条纹病毒和介体灰飞虱水稻抗抗氧化酶活性的陶R.表达。植物理性生物化学。2011; 49:744-51。
- 35.
王志强,王志强,王志强,等。木脂素和二苯乙烯类化合物在植物-昆虫相互作用中的生物活性。Phytochem启2003;2:321-30。
- 36.
引用本文:张志强,张志强,张志强,等。从结构和功能上与氧化烯环化酶和脂质磷脂相似而衍生的一种导向蛋白模型。2月j . 2012; 279:1980 - 93。
- 37.
加西亚ES,卡布拉尔的MM,绍布GA,戈特利布OR,在吸血臭虫,Rhodnius蝽lignoids的阿赞布雅P.影响:摄食,蜕皮和利尿。植物化学。2000; 55:611-6。
- 38.
抗甲戊二烯基因控制板栗甲虫进入变态。中国科学院院刊2007;104:10488-93。
- 39.
昆虫的木质类物质:用于研究蜕皮、排泄和克氏锥虫-锥蝽相互作用的化学探针。Toxicon。2004;44:431-40。
- 40。
李淑华,吴慧伟,方勇,安思博,朴德胜,宋慧华,等。鉴定扰乱昆虫幼年激素受体复合体的植物化合物。美国国家科学研究院2015;112:1733-8。
- 41。
Cho M-H,Lee S-W。水稻中酚类植物脂蛋素:生物功能和生物合成。int j mol sci。2015; 16:29120-33。
- 42。
赵东敏,冈田安,Kenmoku H, Otomo K, Toyomasu T, Mitsuhashi W,等。分子克隆和表征cDNA编码ent-cassa-12 15-diene合成酶,一个公认的二萜植物抗毒素生物合成的酶,从水稻悬浮细胞与甲壳素诱导子处理。植物j . 2004; 37:1-8。
- 43。
杜B,张伟,刘B,胡Ĵ,魏Z,石Z,等人。识别和Bph14,在褐飞虱基因抗性的表征。国家科学院院刊美A. 2009; 106:22163-8。
- 44。
Hajheidari男,Abdollahian-Noghabi男,阿斯卡里H,Heidari男,Sadeghian SY,奥伯ES。,等人。干旱胁迫下甜菜叶的蛋白质组分析。蛋白质组学。2005; 5:950-60。
- 45.
利用“组学”技术进行作物育种。生物科技趋势》。2011;29:33-40。
- 46.
4 .陈志强,陈志强,陈志强,等。小麦热休克蛋白(HSP20)家族基因的生物和非生物胁迫调控的全基因组鉴定与分析。植物生理学杂志,2017;
- 47.
李军,向春雨,杨军,陈建平,张慧敏。HSP20与病毒RdRp的相互作用改变了其在植物亚细胞中的定位和分布模式。Sci众议员2015;5:14016。
- 48.
陈璐,黄y,徐米,程Z,张达,郑j.Itraq的黑米籽粒发育的定量蛋白质组学分析揭示了与花青素生物合成相关的代谢途径。Plos一个。2016; 11:e0159238。
- 49.
Vizcaíno JA, Csordas A, Del-Toro N, Dianes JA, Griss J, Lavidas I,等。2016年PRIDE数据库及其相关工具的更新。核酸学报2015;44:D447-56。
- 50。
基因本体联盟。基因本体论财团:前进。核酸RES。2015; 43:D1049-56。
- 51。
Blast2GO:植物基因组学功能分析的综合套件。植物基因组学杂志。2008;1 - 12。
- 52。
Kanehisa M, Sato Y, Kawashima M, Furumichi M, Tanabe M. KEGG作为基因和蛋白质注释的参考资源。核酸Res. 2016;44: D457-62。
- 53。
Livak KJ,Schmittgen TD。分析使用实时定量PCR和2-ΔΔCT方法相对基因表达数据。方法。2001; 25:402-8。
确认
感谢沈阳农业大学植物保护学院梁悦教授对手稿的客观评论。
资金
国家自然科学基金(31460478);云南省应用基础研究基金(CN) (2015FB205(−013)和2015FB159);科技部国家科技重大专项(2016ZX08001001);云南省公益性项目(2016RA002)和国家科技部重点项目(2017YFD0100202)资助。
数据和材料的可用性
质谱蛋白质组数据已通过PRIDE合作伙伴存储库存储到ProteomeXchange联盟,数据集标识符为PXD008926。
作者信息
隶属关系
贡献
XYZ完成并撰写了这篇论文。FY、QFZ和TQY培养褐飞虱和植株。SQX和LC提取蛋白。CMJ和XK对数据进行分析。WJL和ZQC构思和设计了实验。所有作者阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
张旭,尹飞,肖绍。et al。水稻的蛋白质组学分析(药用野生稻)为褐飞虱抗性蛋白的分子标记研究提供了线索。BMC植物杂志19,30(2019)。https://doi.org/10.1186/s12870-018-1622-9
已收到:
接受:
发表:
关键字
- 米
- 褐飞虱(BPH)
- 蛋白质组学
- 反抗
- 分子机制