- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
差异共表达网络长非编码rna和mrnagydF4y2BaCleistogenes songoricagydF4y2Ba在水压力下和恢复期间gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba19gydF4y2Ba,文章号:gydF4y2Ba23gydF4y2Ba(gydF4y2Ba2019gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
水分胁迫严重制约植物生长和产量。长链非编码rna (Long non-coding RNAs, lncRNAs)是多种生物调控过程中的多功能调控因子。迄今为止,lncRNA的系统筛选和潜在功能尚未在gydF4y2BaCleistogenes songoricagydF4y2Ba,特别是在缺水的情况下。gydF4y2Ba
结果gydF4y2Ba
在本研究中,我们获得了幼苗的根和芽的转录组gydF4y2Bac . songoricagydF4y2Ba利用illumina RNA-seq对不同程度水分胁迫和恢复处理的植物进行了研究。通过生物信息学分析,共鉴定出3397个lncrna。LncRNA差异表达分析表明,在水分胁迫和恢复过程中,根的响应高于芽。我们进一步鉴定了1644个转录因子,其中189个对应于中163个lncrnagydF4y2Bac . songoricagydF4y2Ba.通过与稻瘟病科主要物种的比较分析,鉴定出81个与水胁迫相关的lncrna同源基因,这些同源基因是调控水稻家族水胁迫反应的重要进化保守基因核心。在这些靶基因中,发现2个基因参与ABA信号通路,4个基因富集淀粉和蔗糖代谢。此外,52个lncrna被预测为microRNAs (miRNAs)的目标模拟物gydF4y2Bac . songoricagydF4y2Ba.RT-qPCR结果表明,MSTRG.43964.1和mstrg . 44002分别作为水胁迫和恢复过程中的模拟靶标调控miRNA397和miRNA166的表达。最后,构建了基于lncRNAs、miRNAs、蛋白编码基因(PCgenes)和转录因子在水分胁迫和恢复过程中的共表达网络gydF4y2Bac . songoricagydF4y2Ba.gydF4y2Ba
结论gydF4y2Ba
在gydF4y2Bac . songoricagydF4y2Ba, lncrna、mirna、pc基因和转录因子构成了一个复杂的转录调控网络,lncrna可以在水分胁迫和恢复下调控pc基因和mirna。本研究为加深我们对泛在水胁迫下lncrna的认识提供了基础资源。gydF4y2Ba
背景gydF4y2Ba
随着全球人口不断增长,农业生产将需要大幅增加,以满足未来半个世纪的全球粮食需求[gydF4y2Ba1gydF4y2Ba].这一挑战进一步加剧了极端事件的强度和频率[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba].预计到2100年,全球气温将上升3-6℃,这可能导致干旱期的持续时间和频率增加[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba].目前,干旱是一种重要的非生物胁迫,在世界范围内限制植物的生长和产量[gydF4y2Ba6gydF4y2Ba].与动物不同,植物无法逃避环境压力,在其生命周期中不断暴露在各种环境中。为了在这些恶劣的环境中生存,植物发展出许多抵抗机制。例如,植物模型gydF4y2Ba拟南芥gydF4y2Ba通过形态和生理特征的变化对非生物胁迫作出反应[gydF4y2Ba7gydF4y2Ba].因此,了解植物应对干旱胁迫的分子和生理机制非常重要。gydF4y2Ba
真核生物基因组的相当一部分可以转录成rna,但不会翻译成蛋白质。非编码rna (Non-coding RNAs, ncRNAs)是一组不能编码蛋白质的rna。ncrna包括内务、调控和功能未知的ncrna。调控ncrna通常根据其长度分为mirna、小干扰rna和lncrna [gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba].一般情况下,lncrna长度大于200 nt,且缺乏蛋白编码区[gydF4y2Ba10gydF4y2Ba].lncrna通常根据pc基因与lncrna在基因组中的相对位置划分为不同的类型。例如,内含子lncRNAs和长基因间非编码rna (lincRNAs)分别从内含子和基因间区域转录[gydF4y2Ba11gydF4y2Ba].在gydF4y2Ba拟南芥gydF4y2Ba,超过30%的lncRNAs为lincRNAs,尽管反义lncRNAs也很丰富[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba].转录分析表明,lncRNAs在植物组织中具有低转录水平和特异性表达模式。此外,lncrna也表现出较低的保守性,并位于亚细胞区室。与pc基因相比,lncrna最初被认为是无关紧要的转录“噪声”。gydF4y2Ba
然而,越来越多的研究表明lncRNAs参与了开花时间、根器官发生、光形态建成和有性生殖等多种生物学过程[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba].此外,lncRNAs被认为在植物非生物胁迫下发挥关键调控机制[gydF4y2Ba11gydF4y2Ba].例如,棉花和木薯中有超过1000个lncrna受盐胁迫调控,318个lncrna分别对寒冷和/或干旱胁迫有反应[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba].gydF4y2Ba
一些lncrna的功能分析表明,它们可以调节邻近基因的表达(gydF4y2Bacis-actinggydF4y2Ba)或在远处(gydF4y2Batrans-actinggydF4y2Ba)通过多种机制,包括DNA甲基化、组蛋白修饰和辅助蛋白的活化/转运[gydF4y2Ba13gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba].与专注于哺乳动物中lncrna的研究相比,只有少数研究报道了lncrna在植物中的功能,尤其是在草中[gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba].例如,gydF4y2BaCOLDAIRgydF4y2Ba是一种内含子型的lncRNA,由中第一个内含子转录而成gydF4y2Ba开花位点cgydF4y2Ba(gydF4y2Ba方法gydF4y2Ba),并已被确定与沉默和表观遗传抑制有关gydF4y2Ba方法gydF4y2Ba调节开花时间gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba24gydF4y2Ba].gydF4y2BaAtIPS1gydF4y2Ba而且gydF4y2BaAt4gydF4y2Ba通过结合并隔离miRNA399和减少miRNA399介导的gydF4y2BaPHO2gydF4y2Ba,这对磷酸盐的吸收很重要gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba].在gydF4y2Ba陆地棉gydF4y2Ba, lnc_883可能通过调控基因的表达参与盐胁迫耐受的调控gydF4y2BaGh_D03G0339gydF4y2Ba[gydF4y2Ba18gydF4y2Ba].由于lncrna在植物中具有重要的功能,人们采用了几种策略来检测和发现新的lncrna [gydF4y2Ba27gydF4y2Ba].微阵列、平铺阵列和下一代测序已被用作全基因组分析的高通量工具,以识别新的转录本。在几种植物中已经鉴定出数千种lncRNA转录本。迄今为止,在绿色非编码数据库(GreeNC Database)中发现了来自44个植物物种的20多万个lncrna [gydF4y2Ba28gydF4y2Ba].gydF4y2Ba
Cleistogenes songoricagydF4y2Ba是CgydF4y2Ba4gydF4y2Ba禾本科禾草,是重要的多年生饲料和生态禾草。gydF4y2Bac . songoricagydF4y2Ba可生长在中国西北的盐碱化、半干旱和沙漠地区,如年平均降雨量为110毫米的内蒙古[gydF4y2Ba29gydF4y2Ba].目的:研究植物的耐旱机理gydF4y2Bac . songoricagydF4y2Ba,在干旱胁迫下对两个器官的表达序列标签(est)进行测序[gydF4y2Ba30.gydF4y2Ba].改变gydF4y2BaC. songorica LEAgydF4y2Ba而且gydF4y2BaALDHgydF4y2Ba基因转化成转基因苜蓿和gydF4y2Ba拟南芥gydF4y2Ba抗旱性和耐盐性提高[gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba].这一证据表明gydF4y2Bac . songoricagydF4y2Ba是鉴定耐旱赋能基因的理想候选植物体系。我们最近完成了全基因组测序gydF4y2Bac . songoricagydF4y2Ba(数据未公布)。然而,这些研究并没有探索和研究干旱胁迫下的lncRNAs和mRNAsgydF4y2Bac . songoricagydF4y2Ba而lncRNAs和PCgenes参与耐旱的机制尚不清楚,有待进一步探索。在这里,我们使用链特异性RNA-seq对24个cDNA文库进行了全基因组扫描研究,以发现和表征来自的lncrna和mrnagydF4y2Bac . songoricagydF4y2Ba在水的压力和恢复过程中受到挑战。gydF4y2Ba
结果gydF4y2Ba
水分胁迫和恢复对光合作用的影响gydF4y2Ba
研究水胁迫和恢复过程中对gydF4y2Bac . songoricagydF4y2Ba光合作用过程,8周大gydF4y2Bac . songoricagydF4y2Ba不同水分胁迫和恢复处理对幼苗进行了处理。在水分胁迫和恢复条件下,叶片相对含水量(RWC)、光合速率(Pn)、胞间CO2浓度(Ci)、气孔导度(Gs)、蒸腾速率(Tr)和叶绿素含量(Chl)在严重水分胁迫前均呈持续下降趋势,且均显著降低(gydF4y2BapgydF4y2Ba< 0.05)低于对照组(附加文件gydF4y2Ba1gydF4y2Ba).引人注目的是,gydF4y2Bac . songoricagydF4y2Ba在严重水分胁迫(2%土壤含水量)下仍保持约50% RWC。与对照组相比,恢复48 h后RWC、Chl、Ci、Tr无显著性差异。但恢复处理48 h后,Pn和Gs分别达到对照组水平的80.43和62.2%(附加文件gydF4y2Ba1gydF4y2Ba).最后,采用对照(CK)、轻水胁迫(LS)、重度水胁迫(SS)和48 h恢复(R)样品进行高通量测序。gydF4y2Ba
中lncrna的全基因组鉴定和表征gydF4y2Bac . songoricagydF4y2Ba
在这项研究中,我们对24个样本(4个处理,2个组织,3个生物重复)进行了链特异性RNA测序。我们从RNA-seq数据中去除低质量的reads后获得了干净的reads。为了评估数据质量,从清洁数据中计算Fast QC和GC含量。所有干净数据集都映射到gydF4y2Bac . songoricagydF4y2Ba基因组用HISAT2重建gydF4y2Bac . songoricagydF4y2Ba转录组。映射率大多大于85%。这些文本是使用StringTie组装和注释的。这些结果表明RNA-seq数据是高度可靠的(附加文件gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
按照图中所示的流水线进行lncrna鉴定。gydF4y2Ba1gydF4y2Ba.使用该管道,分别用编码-非编码指数(CNCI)、编码潜力计算器(CPC)、Pfam扫描(Pfam)和编码潜力评估工具(CPAT)预测了5397、19,805、15,791和17,833个候选lncrna(图)。gydF4y2Ba1 bgydF4y2Ba).lncrna可以根据其基因组位置分为不同的类别。四种分析方法交叉共得到3397个lncrna,其中lincrna 1730个,反义lncrna 1016个,内含子lncrna 284个,有义lncrna 367个(图2)。gydF4y2Ba1 cgydF4y2Ba).gydF4y2Ba
一种用于系统鉴定和lncrna特征的综合计算管道gydF4y2Bac . songoricagydF4y2Ba.gydF4y2Ba一个gydF4y2Ba用于鉴定lncrna的信息学管道gydF4y2Bac . songoricagydF4y2Ba.gydF4y2BabgydF4y2Ba维恩图显示了候选lncrna经Pfam、CPC、CPAT和CNCI组合或两者组合过滤后的数量。Pfam: Pfam扫描,CPC:编码潜力计算器,CPAT:编码潜力评估工具,CNCI:编码-非编码指数。gydF4y2BacgydF4y2Ba不同类型lncrna的组成。gydF4y2BadgydF4y2Ba拼接的数量分布gydF4y2Bac . songoricagydF4y2BalncRNAs和mRNAs。gydF4y2BaegydF4y2BamRNAs和lncRNAs每次转录的外显子数量。gydF4y2BafgydF4y2Ba所有mrna和lncrna的转录本大小分布。gydF4y2BaggydF4y2Ba所有mrna和lncrna的开放阅读框(ORF)分布gydF4y2Ba
我们鉴定了lncRNAs和mrna的基本基因组特征,包括转录物丰度、转录物长度、外显子数和ORFgydF4y2Bac . songoricagydF4y2Ba(无花果。gydF4y2Ba1 dgydF4y2Ba).然后,我们使用每千碱基外显子每百万片段映射(FPKM)估计每个转录本的表达水平,发现lncrna在对照组和水胁迫组的表达水平相似。有趣的是,mrna的整体表达水平高于lncrna(附加文件)gydF4y2Ba3.gydF4y2Ba).与mrna相比gydF4y2Bac . songoricagydF4y2Ba,在我们的研究中,78.5%的lncrna被剪接(图;gydF4y2Ba1 dgydF4y2Ba).大多数lncrna(~ 75%)含有两个外显子,而mrna的外显子更多,外显子数量分布范围更广(图。gydF4y2Ba1 egydF4y2Ba).的完整和ORF长度gydF4y2Bac . songoricagydF4y2Balncrna较短。例如,大多数lncrna(52.2%)的ORF长度小于600 nt,而只有21.3%的mRNA ORF长度小于1200 nt(图2)。gydF4y2Ba1gydF4y2Bag).大多数lncrna(52%)长度为200 - 600 nt,而大多数mrna(41%)长度超过3000 nt(图2)。gydF4y2Ba1gydF4y2Baf).作为比较gydF4y2Bac . songoricagydF4y2Ba具有两种单子叶植物和两种全子叶植物基因组序列的lncRNAs。结果显示,只有一小部分的lncrna(从0.2%之间gydF4y2Bac . songoricagydF4y2Ba而且gydF4y2Ba拟南芥gydF4y2Ba到3.8%之间gydF4y2Bac . songoricagydF4y2Ba和水稻受到了重大打击,这表明保护程度非常低(附加文件)gydF4y2Ba4gydF4y2Ba).gydF4y2Ba
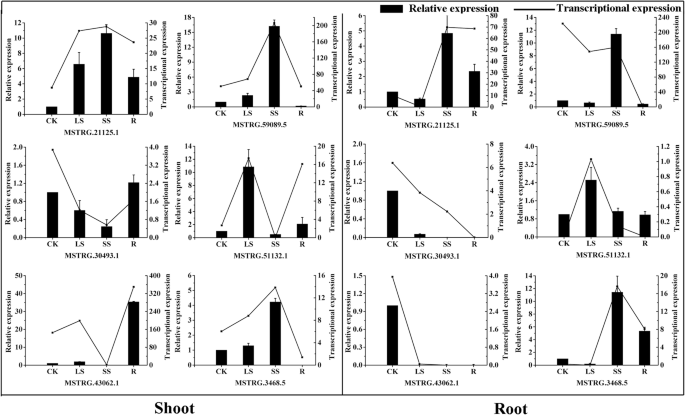
为了表征lncrna的表达模式,随机选取6个在水分胁迫和恢复下的lncrna,通过RT-qPCR进行分析。如图所示。gydF4y2Ba2gydF4y2Ba,通过RNA-seq和RT-qPCR对胁迫响应型lncRNAs的表达模式比较一致,趋势相似,说明基于RNA-seq数据的lncRNAs表达是可靠的。结果表明,3个和2个lncrna在水分胁迫下分别在茎和根中表达上调。2个lncrna在根系水分胁迫和恢复过程中下调(图。gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
RNA-seq鉴定差异表达基因(DEGs)和lncRNAs (DE-lncRNAsgydF4y2Ba
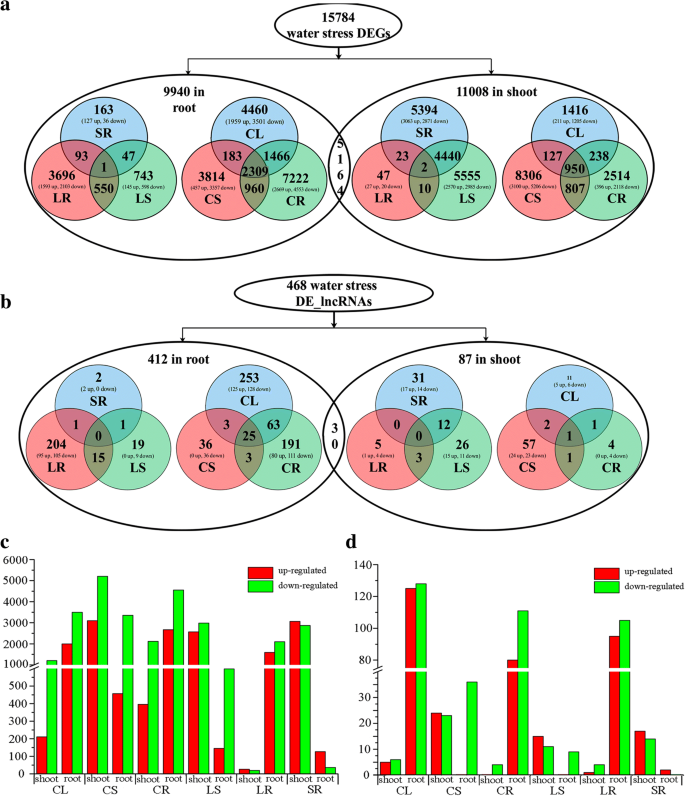
水分胁迫、恢复与控制的基因表达谱分析gydF4y2Bac . songoricagydF4y2Ba在上述四个生理阶段的植物中,我们可以识别出在水处理后表达水平发生显著变化的PCgenes和lncrna。共有15784个pc基因和468个lncrna在三种胁迫条件(CK vs. LS、CK vs. SS、CK vs. R、LS vs. SS、SS vs. R)中至少有一种表现出差异表达,茎和根中的DEGs数量大致相同(分别为11008个和9940个DEGs;无花果。gydF4y2Ba3gydF4y2Ba).然而,de - lncrna的数量(分别为87个和412个)在芽和根中存在显著差异(图。gydF4y2Ba3 bgydF4y2Ba).gydF4y2Ba
DEGs和de - lncrna综述(Fold change≥4;FDR≤0.01)gydF4y2Bac . songoricagydF4y2Ba水分压力和恢复。gydF4y2Ba一个gydF4y2Ba不同条件下水分胁迫和恢复处理上调/下调基因数(gydF4y2BaCLgydF4y2Ba:对照与轻度水分胁迫,gydF4y2BaCSgydF4y2Ba:控制vs.严重的水压力,gydF4y2BaCRgydF4y2Ba控制vs.恢复,gydF4y2BaLSgydF4y2Ba:轻度水胁迫与重度水胁迫,gydF4y2BaLRgydF4y2Ba:轻度水分压力与恢复,gydF4y2Ba老gydF4y2Ba:严重的水分胁迫与恢复)。gydF4y2BabgydF4y2Ba不同条件下水分胁迫和恢复处理的lncrna数量上调/下调。gydF4y2BacgydF4y2Ba不同条件下受调控基因的数量。gydF4y2Ba红酒吧gydF4y2Ba调节基因;gydF4y2Ba绿色的酒吧gydF4y2Ba表达下调的基因。gydF4y2BadgydF4y2Ba不同条件下受调控的lncrna数量。gydF4y2Ba红酒吧gydF4y2Ba调节lncRNAs;gydF4y2Ba绿色的酒吧gydF4y2Ba表达下调lncRNAsgydF4y2Ba
为了研究来自不同处理样本的转录组之间的关系,我们对所有样本的归一化表达值进行了相关性分析,并生成了热图(附加文件)gydF4y2Ba5gydF4y2Ba).热图显示,与SS处理相比,CK、LS和R处理在嫩枝上聚集在一起(附加文件)gydF4y2Ba5gydF4y2Ba).然而,与LS和CK处理相比,SS和R处理在根部聚集在一起(附加文件)gydF4y2Ba5gydF4y2Ba).gydF4y2Ba
对每个器官条件之间的DEGs和de - lncrna的数量和身份的详细评估证实了这一观察结果;在幼苗中,CK与LS之间分别有1416个deg和11个de - lncrna, CK与SS之间分别有8306个deg和57个de - lncrna, CK与R之间分别有2514个deg和4个deg - lncrna, SS与R之间分别有5394个deg和31个de - lncrna, LS与R之间分别有47个deg和5个de - lncrna。根中的DEGs和de - lncrna也观察到类似的趋势(附加文件)gydF4y2Ba6gydF4y2Ba而且gydF4y2Ba7gydF4y2Ba).通过比较,在器官之间共鉴定出5164个共同的deg和30个共同的de - lncrna(图。gydF4y2Ba3gydF4y2Ba而且gydF4y2BabgydF4y2Ba).器官间表达变化的总体方向保守,多数表达下调而非上调;下调和上调的de - lncrna表现出几乎相同的趋势(图。gydF4y2Ba3 cgydF4y2Ba而且gydF4y2BadgydF4y2Ba).gydF4y2Ba
de - lncrna和DEGs的功能分析gydF4y2Ba
位于基因上游的LncRNAs可能通过与启动子或其他启动子相互作用参与转录调控gydF4y2Ba独联体gydF4y2Ba-作用元件,下游lncrna可能参与其他调控活动。在这项研究中,我们通过扫描长达100 kb的基因上下游来注释lncrna,并使用lntar软件分析反义lncrna和mrna之间的互补碱基配对[gydF4y2Ba35gydF4y2Ba].在表gydF4y2Ba1gydF4y2Ba上游或下游lncrna 3332个,反义lncrna 161个,与31,812个(60.7%)相互作用。gydF4y2Ba独联体gydF4y2Ba-目标基因和202gydF4y2Ba反式gydF4y2Ba-目标基因,分别(附加文件gydF4y2Ba8gydF4y2Ba).此外,27455人(86.3%)gydF4y2Ba独联体gydF4y2Ba-靶基因和166个(82.2%)gydF4y2Ba反式gydF4y2Ba-靶基因在水分胁迫和恢复条件下表达。其中9321人(29.3%)gydF4y2Ba独联体gydF4y2Ba-靶基因和75 (37.1%)gydF4y2Ba反式gydF4y2Ba-靶基因在水分胁迫和恢复条件下表达差异显著(表gydF4y2Ba1gydF4y2Ba和附加文件gydF4y2Ba8gydF4y2Ba).为了确定DE-lncRNA与靶基因的关系,随机选取3个lncRNA和3个靶基因(DEGs),通过RT-qPCR进行分析。我们发现MSTRG.62661及其推测的靶基因在严重水分胁迫下共表达并显著上调(附加文件)gydF4y2Ba9gydF4y2Ba).此外,MSTRG.18766及其推测的靶基因在严重水分胁迫下表达下调。同时,MSTRG.22617.1和靶基因在水分胁迫下表达下调(附加文件gydF4y2Ba9gydF4y2Ba).这些结果与RNA-seq比较一致,说明lncRNA可能通过调控靶基因表达参与提高对水分胁迫的耐受性。gydF4y2Ba
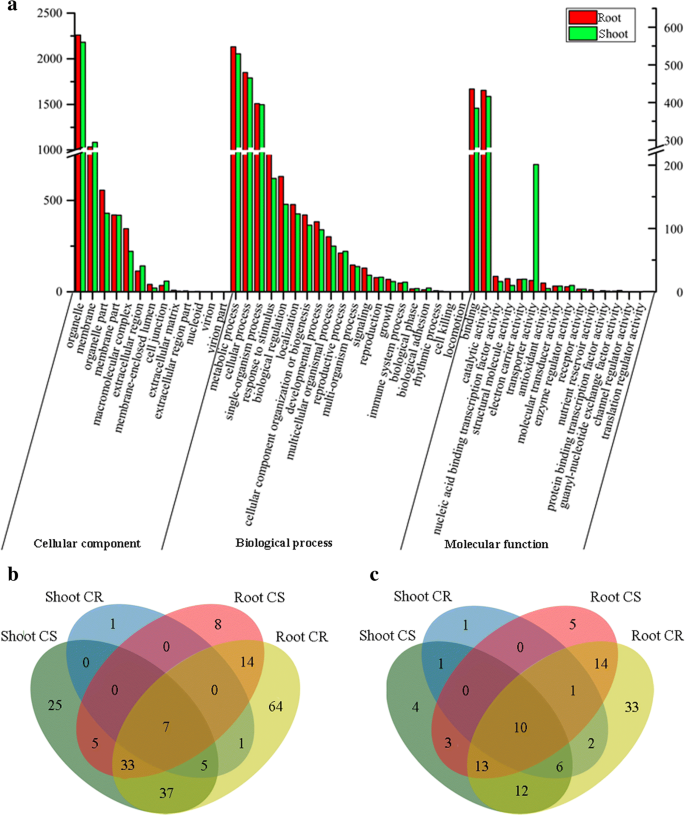
与枝条相比,根中DE-lncRNAs靶基因数量差异较大(根中5616个靶基因,枝条中1503个靶基因;额外的文件gydF4y2Ba10gydF4y2Ba).在两个器官中共发现731个共同靶基因,包括81个deg。为了破译受水分胁迫影响的主要生物过程,对两个器官进行了靶基因和DEGs的基因本体富集(GO)。GO分析显示,靶基因和DEGs主要富集于应激相关的类别,如刺激响应、暴食、生物调节、催化活性、代谢过程和细胞器(图。gydF4y2Ba4gydF4y2Ba和附加文件gydF4y2Ba10gydF4y2Ba).此外,DE-lncRNAs的靶基因中富集了生物粘附和生物相(生物过程)和营养库活性(分子功能)的类别,而胶原三聚体(细胞成分)在与lncRNAs无关的DEGs中显著富集(图)。gydF4y2Ba4gydF4y2Ba和附加文件gydF4y2Ba10gydF4y2Ba).在细胞成分分析中,细胞器和细胞膜富集DE-lncRNAs靶基因和与lncRNAs不相关的deg,而类核和胶原三聚体仅富集与lncRNAs不相关的deg。对刺激和代谢过程的反应也得到了丰富(图。gydF4y2Ba4gydF4y2Ba和附加文件gydF4y2Ba10gydF4y2Ba).gydF4y2Ba
de - lncrna在水分胁迫和恢复过程中的功能分析。gydF4y2Ba一个gydF4y2Ba与de - lncrna共表达的pc基因的基因本体富集左侧数据和右侧数据分别按照根和茎部DE-lncRNAs靶基因数量进行排序。gydF4y2Ba红酒吧gydF4y2BaDE-lncRNAs在根中的靶基因;gydF4y2Ba绿色的酒吧gydF4y2BaDE-lncRNAs在芽中的靶基因。显著富集GOs的维恩图。在不同的条件下,GO项被过度代表。gydF4y2BabgydF4y2Ba生物过程;gydF4y2BacgydF4y2Ba分子功能。gydF4y2BaCRgydF4y2Ba控制vs.恢复;gydF4y2BaCSgydF4y2Ba:控制vs.严重的水压力gydF4y2Ba
为了确定目标基因的功能类,主要涉及对水分胁迫和恢复处理的响应,进一步选取显著富集的GO项gydF4y2BaPgydF4y2Ba-value < 0.05。我们还分析了在比较中显著丰富和相同的GO术语的数量,以确定器官和条件之间的差异和相似之处。进行了两个比较,CK与SS (CS)和CK与R (CR)。GO显著富集的7个生物过程和10个分子功能在CS梢、CS根、CR梢和CR根中始终表现为过度表达(图2)。gydF4y2Ba4gydF4y2Bab, c和附加文件gydF4y2Ba11gydF4y2Ba).例如,GO术语被丰富用于生物过程(GO:0006468,蛋白质磷酸化;: 0006412,翻译;和GO:0044242,细胞脂质分解过程)和分子功能(GO:0005524, ATP结合;GO:0005525, GTP装订;GO:0004674,蛋白丝氨酸/苏氨酸激酶活性;GO:0003676,核酸结合)。gydF4y2Ba
与CS根系特定的生物学功能相比,CS幼苗对水分胁迫的GO项富集主要与多胺代谢过程(GO:0006595)、光合作用(如GO:0009768,光合作用,光系统I中的光收集)、信号转导(如GO:0016024, cdp -二酰基甘油生物合成过程和GO:0046341, cdp -二酰基甘油代谢过程)、气孔调节(GO:0010440:气孔谱系进展)和转运过程(如GO:0010496,细胞间转运;GO:0016482,细胞质转运;GO:0016192,囊泡介导转运;无花果。gydF4y2Ba4 bgydF4y2Ba).在特定的分子功能中,CS笋的特定GO术语包括许多酶活性(如GO:0016682,氧化还原酶活性,作用于二酚类及相关物质作为供体;GO:0045485,氧为受体,-6脂肪酸去饱和酶活性;GO:0052745,肌醇磷酸酶活性;和GO:0008466,糖原素糖基转移酶活性);同样,CS根的特定GO术语也包括许多酶活性(如GO:0004364,谷胱甘肽转移酶活性,氧化还原酶活性;GO:0016706,作用于配对捐赠者;GO:0016773,磷酸转移酶活性;无花果。gydF4y2Ba4摄氏度gydF4y2Ba).gydF4y2Ba
与CS笋的特异性分子功能和生物学功能相比,CR笋特异性GO项仅富集半胱氨酸型肽酶活性和酒精代谢过程。然而,大多数GO术语是针对茎和根的,并且CR根的转录反应比CS根涉及更多的功能。这些GO术语包括糖运输(例如,GO:0015770,蔗糖运输;GO:0015786, udp -葡萄糖转运;和GO:0015758,葡萄糖转运),组织发育(例如,GO:0010067,原形成层组织发生和GO:0010065,初级分生组织发育),信号传导(GO:0019932,第二信使介导的信号传导),营养库(GO:0045735,营养库活性),过氧化物酶体(例如,GO:0005053,过氧化物酶体基质靶向信号;GO:0000268,过氧化物酶体靶向序列结合;和GO:0004602,谷胱甘肽过氧化物酶活性),以及氧化还原酶活性(例如,GO:0052716,对苯二酚:氧氧化还原酶活性和GO:0016901,氧化还原酶活性;无花果。gydF4y2Ba4 bgydF4y2Ba而且gydF4y2BacgydF4y2Ba).这些结果表明,DE-lncRNAs在水分胁迫和恢复过程中调控pc基因,参与了几个重要的生物过程和分子功能。gydF4y2Ba
与水分胁迫和恢复有关的代谢途径gydF4y2Bac . songoricagydF4y2Ba
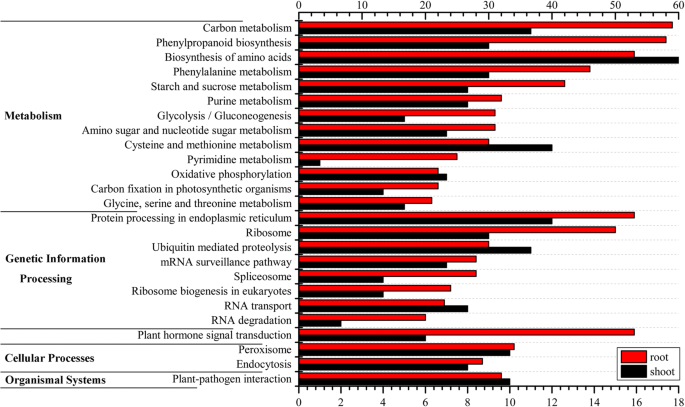
用KEGG通路定位了15784个DEGs和6388个DE-lncRNAs靶基因gydF4y2Bac . songoricagydF4y2Ba,强调了几种与干旱相关的途径的参与(图。gydF4y2Ba5gydF4y2Ba和附加文件gydF4y2Ba9gydF4y2Ba).在我们的研究中,发现了两个重要的苯丙类化合物通路,包括“苯丙类生物合成”和“苯丙氨酸代谢”,它们受到水胁迫和恢复过程的调节(图2)。gydF4y2Ba5gydF4y2Ba;额外的文件gydF4y2Ba12gydF4y2Ba).但根中DEGs含量高于笋中。“植物激素信号转导”在芽和根中分别由141个DEGs(6个DE-lncRNAs靶基因)和153个DEGs(53个DE-lncRNAs靶基因)组成。这些基因大多属于PYL和SnRK2蛋白家族。引人注目的是,根和芽之间最大的差异与“核糖体”有关。芽中核糖体的deg数量是根中的3倍(附加文件)gydF4y2Ba12gydF4y2Ba).核糖体翻译重编程被认为是茎部系统在水分胁迫下的最大响应之一;也可以被DE-lncRNAs调控gydF4y2Bac . songoricagydF4y2Ba.此外,DE-lncRNA靶基因和DEGs还参与了“淀粉和蔗糖代谢”、“抗坏血酸和醛酸代谢”、“谷胱甘肽代谢”、“精氨酸和脯氨酸代谢”和“脂肪酸生物合成”等途径,这些途径在植物抵抗非生物胁迫中发挥重要作用。gydF4y2Ba
植物水分胁迫和恢复过程中转录因子的鉴定gydF4y2Bac . songoricagydF4y2Ba
转录因子在提高植物对非生物胁迫的抗性方面发挥着重要作用。通过对这些遗传序列的挖掘,我们鉴定出1644个遗传序列,对应于来自49个遗传序列家族的839个高置信水稻同源体(附加文件)gydF4y2Ba13gydF4y2Ba).在839个水稻同源基因中,共鉴定出523个gydF4y2Bac . songoricagydF4y2Ba干旱胁迫下水稻中差异表达的DEGs (62%) [gydF4y2Ba36gydF4y2Ba].我们还分析了DE-lncRNA靶基因,以确定1664个tf中是否包含任何DE-lncRNA靶基因。总共189个tf对应163个gydF4y2Bac . songoricagydF4y2BaDE-lncRNAs(附加文件gydF4y2Ba13gydF4y2Ba).gydF4y2Ba
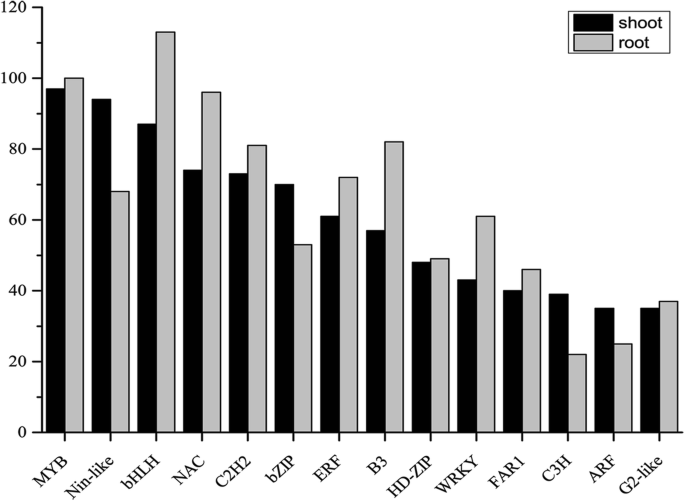
在gydF4y2Bac . songoricagydF4y2Ba其中,MYB、bHLH、NAC、C2H2和bZIP是最具代表性的转录因子家族,已被证实在植物中响应干旱胁迫。在鉴定的基因家族中,MYB家族是最大的基因家族(共144个),其中16个MYB基因作为DE-lncRNA的靶基因(图。gydF4y2Ba6gydF4y2Ba和附加文件gydF4y2Ba13gydF4y2Ba).的数量gydF4y2Bac . songoricagydF4y2Ba根和芽中的MYB家族基本相同。BHLH、NAC、B3和WRKY家族中表达较多的deggydF4y2Bac . songoricagydF4y2Ba根与芽的比较。BHLH家族包括148人gydF4y2Bac . songoricagydF4y2Ba82个水稻同源基因对应的DEGs。引人注目的是,50米同源gydF4y2Bac . songoricagydF4y2BaDEGs在水稻中也有差异表达。NAC家族基因来自gydF4y2Bac . songoricagydF4y2Ba与60个水稻NAC家族基因同源,包括gydF4y2BaOs03g60080 / SANC1gydF4y2Ba;gydF4y2BaOs01g66120 / SANC2 / OsNAC6gydF4y2Ba;gydF4y2BaOs11g03300 / OsNAC10gydF4y2Ba;gydF4y2BaOs08g06140gydF4y2Ba;gydF4y2BaOs05g34830gydF4y2Ba;而且gydF4y2BaOs03g04070 / ONAC022gydF4y2Ba.102个ERF, 17个AP2和5个RAV TF家族组成AP2- erebp超家族,介导非生物和生物胁迫。中ARF、bZIP和C3H族的数量gydF4y2Bac . songoricagydF4y2Ba茎部含量高于根部。90个bZIP基因中有11个是DE-lncRNA靶基因,5个bZIP基因与水稻同源gydF4y2BaLOC_Os08g36790gydF4y2Ba而且gydF4y2BaLOC_Os06g10880gydF4y2Ba(无花果。gydF4y2Ba6gydF4y2Ba和附加文件gydF4y2Ba13gydF4y2Ba).gydF4y2Ba
植物共调控基因表达网络的研究gydF4y2Bac . songoricagydF4y2Ba
我们比较了差异表达和非差异表达的分布gydF4y2Bac . songoricagydF4y2Ba具有15个干旱响应模块的基因最近被确定为水稻同源基因[gydF4y2Ba37gydF4y2Ba].假定的同类gydF4y2Bac . songoricagydF4y2BaDEGs进一步作为DE-lncRNAs靶基因分析。只有模组3和模组4在芽和根中均有过量表达(表3和4)gydF4y2Ba2gydF4y2Ba;额外的文件gydF4y2Ba14gydF4y2Ba).模块1在根中比在芽中更有代表性。模组2和模组5在中显示了较高数量的差异表达的假定正交词gydF4y2Bac . songoricagydF4y2Ba嫩枝与根比较。但是,模块7、9、12、13、14和15的功能没有报道。根据氧化石墨烯富集结果,模块15、13、12和10可能分别与“刺激反应”、“脂肪酸代谢过程”、“蛋白质磷酸化”和“翻译后蛋白质修饰”有关(表13)gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
鉴定了一组在水分胁迫和恢复过程中有差异调节的Poaceae核心基因gydF4y2Ba
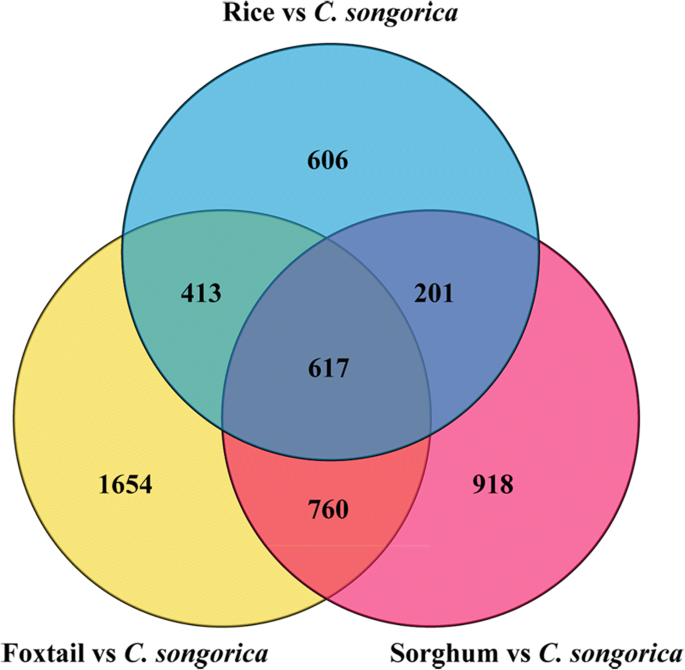
与水分胁迫相关的deg的共同子集gydF4y2Bac . songoricagydF4y2Ba鉴定出了狐尾草、高粱和水稻。总共有2496,3444和1837个假定的同源物分别从狐尾,高粱和水稻中鉴定出来。gydF4y2Ba7gydF4y2Ba;额外的文件gydF4y2Ba15gydF4y2Ba).在所有物种中共鉴定出617组推定的同源基因,构成了与干旱胁迫相关的进化保守基因核心。此外,保守的DEGs包括81个DE-lncRNAs靶基因和15个tf(附加文件gydF4y2Ba15gydF4y2Ba).这些基因和lncrna将被用来建立下一个网络。gydF4y2Ba
一些保守的基因参与了不同代谢物的生物合成,从激增到脂类和类黄酮。最有趣的gydF4y2Bac . songoricagydF4y2Ba与对照条件相比,水分胁迫下参与“淀粉和蔗糖代谢”的候选者被下调。“苯丙类生物合成”和“脂肪酸延伸”是这些保守的deg的第二个功能。其他一些保守的deg参与了“抗坏血酸和赤氨酸代谢”和“精氨酸和脯氨酸代谢”,这些已知参与了对非生物应激的反应。8个保守的参与“脯氨酸代谢”的DEGs在SS条件下均有差异表达,但在LS和R条件下大多无差异表达。与以往的研究一致,一定数量的膜转运蛋白是参与水分胁迫的保守的DEGs之一。我们发现22个保守的deg与ABC“转运体”有关。另有18个保守的deg参与了“植物激素信号转导”。其中含有来自pp2c(蛋白质磷酸酶2c)家族的蛋白质,这些蛋白质富集于“脱落酸激活信号通路”和“蛋白质磷酸化”。gydF4y2Ba
c . songoricagydF4y2Balncrna作为mirna的内源性目标模拟物gydF4y2Ba
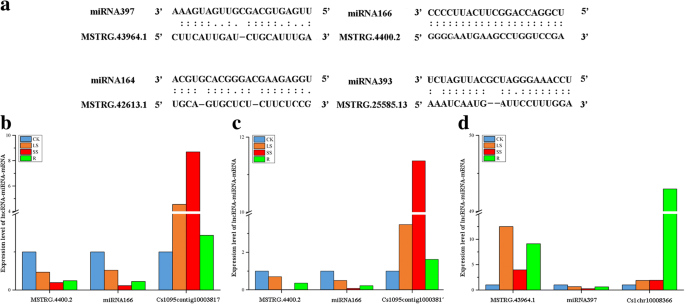
在植物中,lncrna的一个重要功能是目标拟态;这种miRNA-lncRNA关系是在gydF4y2Ba拟南芥gydF4y2Ba.总共有52个已鉴定的lncrna可能通过与已知的lncrna结合作为miRNA模拟物gydF4y2Bac . songoricagydF4y2Bamirna,包括miRNA166、miRNA164、miRNA393和miRNA397(附加文件)gydF4y2Ba16gydF4y2Ba).我们进一步构建了四种禾科植物的水胁迫响应型lncRNAs、miRNAs、保守型DEGs和tf共表达网络。结果表明,lncRNAs、miRNAs、保守的DEGs和tf在水分胁迫和恢复下,基于某种调控机制构成了一个复杂的转录调控网络(图2)。gydF4y2Ba8gydF4y2Ba).如图所示。gydF4y2Ba8gydF4y2Ba, miRNA397a和miRNA397b有7个靶基因,并与MSTRG.43964.1 lncRNA结合(图2)。gydF4y2Ba8gydF4y2Ba而且gydF4y2Ba9gydF4y2Ba).通过序列比对,发现干旱响应型lncRNA (MSTRG.4400.2)与miRNA166无错配,并在水分胁迫下协调miRNA166靶基因表达的增加(图2)。gydF4y2Ba8gydF4y2Ba而且gydF4y2Ba9gydF4y2Ba).MSTRG.42613.1也作为保守miRNA164的潜在靶模拟物,miRNA164调控三种NAC tf。gydF4y2Ba8gydF4y2Ba).gydF4y2Ba
功能预测gydF4y2Bac . songoricagydF4y2BalncRNA作为miRNA靶模拟。gydF4y2Ba一个gydF4y2Ba预测miRNA-lncRNA的碱基配对相互作用。gydF4y2BabgydF4y2Ba-gydF4y2BadgydF4y2Ba芽中lncRNA、miRNA和miRNA靶基因的相对转录丰度(gydF4y2BabgydF4y2Ba)和root (gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba)在水的压力和恢复。gydF4y2BaCsGAPDHgydF4y2Ba而且gydF4y2BaU6gydF4y2Ba被用作内参基因gydF4y2Ba
为了进一步了解miRNA目标模拟物与相关miRNA之间的关系,采用RT-qPCR分析了水胁迫和恢复过程中lncRNA及相应miRNA的表达。我们发现miRNA397与MSTRG.43964.1 lncRNA的表达模式相反(图2)。gydF4y2Ba9 dgydF4y2Ba).MSTRG.43964.1和miRNA397靶基因在水分胁迫和恢复条件下表达上调,而miRNA397表达下调。结果表明,MSTRG.43964.1在水分胁迫和恢复过程中,通过与miRNA竞争,下调miRNA的活性,从而上调miRNA397靶点的表达。miRNA166和MSTRG的表达模式明显不同。44002芽和根中lncRNA相同(图4)。gydF4y2Ba9gydF4y2Bab和c).我们认为miRNA166和MSTRG. 44002完全互补导致了MSTRG。44002 miRNA166靶基因的裂解和上调。gydF4y2Ba
讨论gydF4y2Ba
随着高通量测序工具的进步,在不同物种中发现了许多新的lncRNA转录物[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba].这些研究揭示了真核生物基因表达的复杂性,lncRNA在许多重要的生物学过程中发挥着重要作用。因此,了解lncRNA的调控机制将为植物抗性研究提供分子基础。然而,已知的和新型的lncrna在干旱胁迫下的基因组鉴定和表征仍然缺乏,特别是在干旱胁迫下gydF4y2Bac . songoricagydF4y2Ba.作为一种本土植物,gydF4y2Bac . songoricagydF4y2Ba在漫长的进化过程中适应了恶劣的环境。我们最近完成了gydF4y2Bac . songoricagydF4y2Ba全基因组测序。在这种植物中也发现了MiRNAs [gydF4y2Ba40gydF4y2Ba].在本研究中,我们构建了看台特异性文库来区分有义和反义lncrna。此外,大量的干净数据使得我们可以在研究中检测低表达水平的lncrna。为了提供有用的信息来预测假定的lncRNA靶点,我们还对控制和胁迫条件下的芽和根中的pc基因进行了测序和比较。gydF4y2Ba
共鉴定出3397个lncrnagydF4y2Bac . songoricagydF4y2Ba在这项研究中。lncrna的数量比在玉米和水稻中发现的要多[gydF4y2Ba17gydF4y2Ba,gydF4y2Ba41gydF4y2Ba],这可能是由于严格的标准或物种差异。与mrna相比,lncrna较短,内含外显子较少gydF4y2Bac . songoricagydF4y2Ba.此外,gydF4y2Bac . songoricagydF4y2Balncrna的转录水平低于mrna,且在不同物种中lncrna的保守性较低。这些结果与之前在其他物种中的结果一致[gydF4y2Ba38gydF4y2Ba,gydF4y2Ba42gydF4y2Ba].lncrna可以通过与目标意义rna杂交和阻断剪接体剪接位点的识别来调节选择性剪接。相比之下,48.1%的lncrna剪接在gydF4y2Ba衣藻reinhardtiigydF4y2Ba[gydF4y2Ba43gydF4y2Ba],占78.5%gydF4y2Bac . songoricagydF4y2Balncrna被剪接。此外,还鉴定出412个和87个lncrna,并分别在根和芽中差异表达。然而,不同器官中deg的数量大致相同。这表明lncrna表现出组织特异性的表达模式。gydF4y2Ba
尽管一些lncrna的功能已经得到了验证,但lncrna参与生物过程的分子机制在很大程度上仍然未知。例如,lncrna可以调节pc基因的转录、转录后和翻译后水平[gydF4y2Ba21gydF4y2Ba].总的来说,几种lncRNA机制已经出现,并被分类为信号、诱骗、引导和脚手架[gydF4y2Ba21gydF4y2Ba].此外,一些lncrna两者兼有gydF4y2Ba独联体gydF4y2Ba- - -gydF4y2Ba反式gydF4y2Ba-gydF4y2Ba代理gydF4y2Ba在调控靶基因中的作用。因为样本都大于5个gydF4y2Ba独联体gydF4y2Ba而且gydF4y2Ba反式gydF4y2Ba本研究鉴定了靶向基因。在根和芽中分别鉴定出4885个和722个特异性靶基因。为了了解de - lncrna在水胁迫和恢复过程中的功能,我们分析了与靶基因相关的GO术语和KEGG通路,主要富集了与胁迫相关的类别。例如,“苯丙烷途径”和“植物激素”在应对非生物胁迫中起着至关重要的作用,在水分胁迫和恢复过程中受到lncrna的调控gydF4y2Bac . songoricagydF4y2Ba[gydF4y2Ba44gydF4y2Ba,gydF4y2Ba45gydF4y2Ba].这说明lncRNAs在植物抗旱机制中发挥着重要作用gydF4y2Bac . songoricagydF4y2Ba.确定了水胁迫与恢复的异同点gydF4y2Bac . songoricagydF4y2Ba,比较了显著富集的GO术语,在不同处理和器官间发现了17个常见的GO术语。与恢复期间相比,在嫩枝中有更具体的GO术语来表示水分胁迫,但在根中则相反。这表明,根和梢对水分胁迫的反应存在差异。例如,CS笋参与光合作用、信号转导和运输过程。相比之下,CS根富含四氢叶酸的生物合成和代谢,对细胞外和外部刺激有反应。gydF4y2Ba
tf是影响许多生物过程的蛋白质,包括生长、发育、细胞分裂和细胞或生物体对环境刺激、应激源的反应[gydF4y2Ba46gydF4y2Ba].lncrna与tf之间也存在调控关系。例如,光敏色素相互作用因子3 (PIF3)编码(bHLH) tf家族的一个成员。LncRNA HID1 (HIDDEN TREASURE 1)被证明是通过调节PIF3表达在播种光形态建成中发挥重要作用[gydF4y2Ba47gydF4y2Ba].在本研究中,189个tf对应163个DE-lncRNAsgydF4y2Bac . songoricagydF4y2Ba;例如,预测bZIP基因为MSTRG.17203.1靶基因。此外,gydF4y2Bac . songoricagydF4y2Ba与水稻基因同源的基因包括gydF4y2BaOs03g60080gydF4y2Ba(gydF4y2BaSANC1gydF4y2Ba),gydF4y2BaOs01g66120gydF4y2Ba(gydF4y2BaSANC2gydF4y2Ba/gydF4y2BaOsNAC6gydF4y2Ba),gydF4y2BaOs11g03300gydF4y2Ba(gydF4y2BaOsNAC10gydF4y2Ba),gydF4y2BaOs08g06140gydF4y2Ba,gydF4y2BaOs05g34830gydF4y2Ba而且gydF4y2BaOs03g04070gydF4y2Ba(gydF4y2BaONAC022gydF4y2Ba),可提高转基因植物的抗旱能力[gydF4y2Ba48gydF4y2Ba,gydF4y2Ba49gydF4y2Ba,gydF4y2Ba50gydF4y2Ba,gydF4y2Ba51gydF4y2Ba,gydF4y2Ba52gydF4y2Ba,gydF4y2Ba53gydF4y2Ba].来自bZIP家族的五个基因是两个水稻基因的同源基因(gydF4y2BaLOC_Os08g36790gydF4y2Ba而且gydF4y2BaLOC_Os06g10880gydF4y2Ba),亦称为gydF4y2BaOsbZIP66gydF4y2Ba而且gydF4y2BaOsbZIP46gydF4y2Ba,已被证明可提高水稻的耐旱性[gydF4y2Ba54gydF4y2Ba,gydF4y2Ba55gydF4y2Ba].在水稻中,这些基因在模块10中起作用,并已被确定参与蛋白质翻译后修饰和蛋白质氨基酸磷酸化过程[gydF4y2Ba37gydF4y2Ba].在本研究中,这些假设gydF4y2Bac . songoricagydF4y2Ba在这个模块中,DEGs的同源物也主要参与磷酸化。gydF4y2Ba
在Poaceae家族中,同源基因组块中的同源基因的表达模式可能在不同物种间存在相关性。重要的是,在狐尾草、高粱、水稻和高粱之间共有617对同源基因gydF4y2Bac . songoricagydF4y2Ba[gydF4y2Ba37gydF4y2Ba,gydF4y2Ba56gydF4y2Ba,gydF4y2Ba57gydF4y2Ba].这些同源基因可能是与干旱胁迫相关的进化保守基因的核心群。这些保守基因包括81个DE-lncRNAs靶基因和15个tf。引人注目的是,5个保守基因属于同源结构域-亮氨酸拉链(HD-Zip) TF家族。HD-Zip I基因的表达受非生物胁迫和ABA、乙烯等激素的调控。gydF4y2BaOsHOX22gydF4y2Ba(gydF4y2BaLOC_Os04g45810gydF4y2Ba),gydF4y2BaOSHOX24gydF4y2Ba(gydF4y2BaLOC_Os02g43330gydF4y2Ba),属于HD-Zip I家族,在水稻非生物胁迫条件下差异表达[gydF4y2Ba58gydF4y2Ba].过度gydF4y2BaOSHOX24gydF4y2Ba增强转基因水稻对非生物胁迫的敏感性[gydF4y2Ba59gydF4y2Ba].转基因水稻过表达gydF4y2BaOSHOX22gydF4y2Ba对ABA敏感性增加,ABA含量增加,耐旱性和耐盐性降低[gydF4y2Ba60gydF4y2Ba].在本研究中,有两个保守基因是同源的gydF4y2BaOSHOX24gydF4y2Ba而且gydF4y2BaOSHOX22gydF4y2Ba.植物体内可溶性蛋白、可溶性糖、脯氨酸等渗透调节物质增加,可提高植物抗旱性[gydF4y2Ba61gydF4y2Ba].我们的结果表明,8个保守的DEGs参与了脯氨酸代谢。值得注意的是,这些DEGs在水分胁迫下上调。4个保守的DEGs作为DE-lncRNA的靶基因,参与淀粉和蔗糖代谢。ABA信号通路是植物干旱胁迫响应的核心。pp2c可视为ABA共受体[gydF4y2Ba62gydF4y2Ba].在植物激素信号转导通路中富集了3个DE-lncRNA靶基因(2个PP2C基因)。ABA的转运需要特定的摄取转运体。大多数atp结合盒(ABC)蛋白是完整的膜蛋白,并作为多种底物的atp驱动转运体,包括脂质和生长素。例如,ABCG40是一种质膜ABA摄取转运体gydF4y2Ba拟南芥gydF4y2Ba.气孔的gydF4y2Baabcg40gydF4y2Ba突变体对ABA的反应较慢,与野生植物相比,突变体表现出较低的耐旱性[gydF4y2Ba63gydF4y2Ba].在这些保守基因中,有18个保守的deg参与了ABA转运体通路。综上所述,这些结果表明,保守基因在水稻抗旱性中起着重要作用gydF4y2Bac . songoricagydF4y2Ba.ABA是参与植物对水分胁迫反应的主要激素。在这些重要的抗旱机制中,LncRNAs显著参与gydF4y2Bac . songoricagydF4y2Ba.gydF4y2Ba
miRNAs已被清楚地证明是基因表达的转录后调节因子[gydF4y2Ba64gydF4y2Ba].lncrna可以作为miRNA前体,也可以作为竞争性内源性RNA (ceRNA)或通过靶拟态(TM)与miRNA相互作用[gydF4y2Ba65gydF4y2Ba].在gydF4y2Ba拟南芥gydF4y2Ba, miRNA399被有效地调制gydF4y2BaIPS1gydF4y2Ba,可作为内源性海绵,隔离miRNA399 [gydF4y2Ba25gydF4y2Ba].利用生物信息学,我们预测52个lncrna可作为保守mirna的潜在目标模拟物gydF4y2Bac . songoricagydF4y2Ba.通过分析候选lncRNA和靶标miRNA的表达,预测其中一个与水胁迫相关的lncRNA (MSTRG.42613.1)是miRNA164的模拟靶标。已有研究表明,mirna164靶NAC基因的减少导致植物的耐旱性[gydF4y2Ba66gydF4y2Ba].本研究预测了3个miRNA164 NAC转录因子作为靶基因。在正常生长条件下和胁迫期间,生长素的感知和信号传递是由miRNAs调节的。TIR1(转运抑制剂response1)是一种生长素受体,可被miRNA393调控。在胁迫期间,上调的miRNA393通过促进低TIR1水平抑制生长素信号,导致胁迫下植物生长发育的减弱,并可能促进植物的抗逆性[gydF4y2Ba67gydF4y2Ba].在本研究中,lncRNA MSTRG.25585.13被预测为miRNA393靶模拟物。注释了2个miRNA393靶基因,包括tir1样蛋白。在非生物应激条件下,ROS大量积累,引起氧化损伤,最终导致细胞死亡[gydF4y2Ba68gydF4y2Ba].然而,最近的研究表明,ROS,特别是HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba它是调节植物发育的信号转导网络中重要的第二信使。漆酶(LACs)属于一大类被称为蓝铜蛋白的酶,包括抗坏血酸氧化酶和质体青苷。之前的一项研究表明gydF4y2BaOsLAC13gydF4y2Ba能产生HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba并受miRNA397调控[gydF4y2Ba69gydF4y2Ba].本研究鉴定了7个miRNA397a/b靶基因来自LAC家族,包括2个漆酶-13、2个漆酶-3、2个漆酶-10和1个漆酶-4。MSTRG.43964.1被预测为miRNA393a/b靶模拟物。众所周知,植物漆酶参与木质素的合成。在gydF4y2Ba拟南芥gydF4y2Ba,gydF4y2BaLAC4gydF4y2BaT-DNA插入突变体木质素水平低[gydF4y2Ba70gydF4y2Ba].综上所述,我们的结果表明gydF4y2Bac . songoricagydF4y2Ba实现不同的机制来调节其对水压力的反应。gydF4y2Ba
结论gydF4y2Ba
在这项研究中,鉴定出3397个lncrna,其中468个在水胁迫和恢复过程中差异表达gydF4y2Bac . songoricagydF4y2Ba.分析了这些lncrna和pc基因的基本基因组特征。lncRNAs可能通过调节pc基因gydF4y2Ba独联体gydF4y2Ba- - -gydF4y2Ba反式gydF4y2Ba-gydF4y2Ba代理gydF4y2Ba交互。我们分析了DE-lncRNA靶基因的GO富集和KEGG通路,发现基因主要富集与胁迫相关的类别。我们还发现,在水分胁迫和恢复过程中,特异性表达的lncrna可能作为保守mirna的内源性目标模拟物gydF4y2Bac . songoricagydF4y2Ba.在gydF4y2Bac . songoricagydF4y2Ba,鉴定出52个lncrna能够作为miRNAs的靶模拟物。MSTRG.43964.1和MSTRG.4400.2分别作为靶模拟物调控miRNA397和miRNA166在水分胁迫和恢复过程中的表达。这些发现扩展了目前lncrna作为无处不在的调控因子的观点gydF4y2Bac . songoricagydF4y2Ba在水压力和恢复条件下。gydF4y2Ba
方法gydF4y2Ba
植物材料和水分胁迫处理gydF4y2Ba
的种子gydF4y2Bac . songoricagydF4y2Ba都是从gydF4y2Bac . songoricagydF4y2Ba中国甘肃省民勤县兰州大学(北纬103°08,东经38°62)油田。漂白杀菌的种子gydF4y2Bac . songoricagydF4y2Ba在砂/蛭石中(1:1,gydF4y2BavgydF4y2Ba/v)生长室,昼夜温度控制在28/24℃,辐照度为150 μmol量子mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba, 16小时光-8小时暗循环,相对湿度65%。将四周大的幼苗移栽到塑料盆中,每盆一株。每盆中充砂/蛭石(1:1,v/v)混合液,每盆0.45 kg。每株每3天灌100ml霍格兰营养液。采用盆栽和人工治水法模拟干旱。生长28 d后,将36株盆栽幼苗随机分为对照组(CK)、轻水胁迫组(LS)、中度水胁迫组(MS)、重度水胁迫组(SS)、恢复4h组(R4h)和恢复48h组(R48h)。CK初始土壤含水量保持不变(土壤含水量为95-100%),LS、MS和SS停止浇水,直到土壤含水量下降到6-10%、3-6%和1-3%。整个过程耗时两周。土壤含水量每2天检测一次,补充不足量。R4h和R48h分别在SS处理4h和48h后进行复浇水。收集对照组和处理组的嫩枝和根,立即在液氮中冷冻,并保存在−80°C下,直到用于RNA提取。每个样品进行6个生物重复。gydF4y2Ba
链特异性RNA文库构建及RNA测序gydF4y2Ba
根据制造商的说明,使用TRIzol试剂(Invitrogen, USA)从每个独立样品中分离总RNA。首先,用Epicentre riboo -zero™rRNA去除试剂盒(Epicentre, USA)去除核糖体RNA,用乙醇沉淀清洗无rRNA残留。随后,根据制造商的建议,使用NEBNext®Ultra™Directional RNA Library Prep Kit for Illumina®(NEB, USA)使用rrna耗尽的RNA生成测序文库。最后,通过PCR富集构建合格的cDNA文库,测序在HiSeq2500上,测序reads长度为PE125。文库的制备和深度测序由诺沃金生物信息技术合作公司(北京,中国)完成。通过从原始读取中删除包含适配器的读取、包含poly-N的读取和低质量的读取,可以获得干净的读取。干净的读取被映射到gydF4y2Bac . songoricagydF4y2Ba基因组(数据未公布)使用HISAT2 (gydF4y2Bahttp://ccb.jhu.edu/software/hisat2/index.shtmlgydF4y2Ba)从BMK云服务器[gydF4y2Ba71gydF4y2Ba].gydF4y2Ba
LncRNA识别gydF4y2Ba
转录组使用StringTie v1.3.1进行组装(gydF4y2Bahttps://ccb.jhu.edu/software/stringtie/index.shtmlgydF4y2Ba)根据映射到参考基因组的干净读数[gydF4y2Ba72gydF4y2Ba].转录组组装完成后,使用gffcompare程序对组装好的转录本进行注释。根据lncRNA的特征,采用以下五个步骤进行鉴定[gydF4y2Ba73gydF4y2Ba,gydF4y2Ba74gydF4y2Ba]:(1)选择成绩单class_code为" i ", " x ", " u ", " o ",或" e "的成绩单;(2)去除长度≤200 bp、外显子数量≤2个的转录本;(3)选取FPKM≥0.1的转录本;(4) Pfam数据库中通过比对去除编码蛋白质的转录本和编码蛋白质的结构域(gydF4y2Bahttp://pfam.xfam.org/gydF4y2Ba);(5)使用编码潜能计算器(CPC)剔除未通过蛋白编码得分测试的转录本,gydF4y2Bahttp://cpc.cbi.pku.edu.cn/gydF4y2Ba)、编码-非编码索引(CNCI,gydF4y2Bahttp://www.ncbi.nlm.nih.gov/pubmed/23892401gydF4y2Ba)和编码潜能评估工具(CPAT,gydF4y2Bahttp://lilab.research.bcm.edu/cpat/gydF4y2Ba) [gydF4y2Ba75gydF4y2Ba,gydF4y2Ba76gydF4y2Ba,gydF4y2Ba77gydF4y2Ba,gydF4y2Ba78gydF4y2Ba].经Pfam、CNCI、CPC和CPAT筛选的转录本的交集被认为是得到的lncrna。通过袖口比对选择不同类型的lncrna,包括lincrna、内含子lncrna、反义lncrna和有义lncrna。为了评估序列守恒性,在gydF4y2Bac . songoricagydF4y2Ba被用作BLASTN搜索其他物种基因组的查询数据集,包括:gydF4y2Ba拟南芥gydF4y2Ba,gydF4y2Bao .漂白亚麻纤维卷gydF4y2Ba,gydF4y2BaBrachypodium distachyongydF4y2Ba而且gydF4y2BaMedicago truncatulagydF4y2Ba(摘自Phytozome 12.0;gydF4y2Bahttps://phytozome.jgi.doe.gov/pz/portal.htmlgydF4y2Ba#)。使用截止查询E≤10进行搜索gydF4y2Ba−5gydF4y2BaQcov值≥20。这项分析是使用BMK云服务器进行的,这是一个在线数据分析平台(gydF4y2Bahttp://www.biocloud.netgydF4y2Ba/)。gydF4y2Ba
de - lncrna和DEGs的鉴定gydF4y2Ba
使用StringTie(1.3.1)计算每个样本中lncrna和mrna的fpkm [gydF4y2Ba79gydF4y2Ba].差异表达分析采用DESeq R包(v1.10.1,负二项分布)。所得到的FDR(错误发现率)使用PPDE(成为DE的后验概率)进行调整。以FDR < 0.01 & |log2(FoldChange)|≥2作为显著差异表达的阈值。gydF4y2Ba
de - lncrna和DEGs功能分析gydF4y2Ba
为了分析de - lncrna的潜在功能,我们寻找距离lncrna上下游小于100 kb的蛋白编码基因,预测lncrna可能的靶基因,并使用lntar软件分析反义lncrna与mrna之间的互补碱基配对[gydF4y2Ba35gydF4y2Ba].gydF4y2Ba
利用GO seq R包对pc基因进行GO富集分析[gydF4y2Ba80gydF4y2Ba].GO术语被鉴定为a显著富集gydF4y2BaPgydF4y2Ba-value截断值为0.05。利用KOBAS软件检测KEGG通路中DE-lncRNAs靶基因和DEGs的统计富集情况[gydF4y2Ba81gydF4y2Ba].gydF4y2Ba
转录因子鉴定gydF4y2Ba
转录因子分析使用BMK云服务器进行,这是一个在线数据分析平台(gydF4y2Bahttp://www.biocloud.net/gydF4y2Ba).gydF4y2Ba
禾本科植物响应水分胁迫的保守基因鉴定gydF4y2Ba
目的:确定植物中常见的与水分胁迫相关的deg亚群gydF4y2Bac . songoricagydF4y2Ba,狐尾,高粱和大米,默认设置使用OrthoMCL软件V5 [gydF4y2Ba82gydF4y2Ba].gydF4y2Ba
预测lncrna作为miRNA靶模拟物gydF4y2Ba
通过提交所有已知的数据来预测目标gydF4y2Bac . songoricagydF4y2BamiRNA和所有lncrna到psRNATarget (gydF4y2Bahttp://plantgrn.noble.org/psRNATargetgydF4y2Ba),在lncRNA和miRNA配对区域内允许不超过3对错配和G/U对[gydF4y2Ba83gydF4y2Ba].成熟的gydF4y2Bac . songoricagydF4y2BamiRNAs序列来自我们之前的研究[gydF4y2Ba40gydF4y2Ba].共表达网络采用Cytoscape (gydF4y2Bahttp://cytoscapeweb.cytoscape.orggydF4y2Ba/),基于保守基因、mirna的靶基因、de - lncrna和de - lncrna的靶基因。gydF4y2Ba
实时定量PCR (RT)gydF4y2Ba
总RNA分别从gydF4y2Bac . songoricagydF4y2Ba用RNAiso regent (TaKaRa,大连,中国)进行qRT-PCR。qRT-PCR采用SYBR Premix Ex TaqTM (TaKaRa)进行。用PrimeScript®RT reagent Kit (TaKaRa)将约1 μg RNA反转录为第一段cDNA,并用特定引物将产物作为模板进行RT- qpcr(附加文件)gydF4y2Ba17gydF4y2Ba).的gydF4y2BaCsGAPDHgydF4y2Ba而且gydF4y2BaU6gydF4y2Ba均为内参基因。比较CT法计算相对表达量。所有反应均进行三次。gydF4y2Ba
缩写gydF4y2Ba
- 龙头:gydF4y2Ba
-
竞争性内源性rnagydF4y2Ba
- CNCI:gydF4y2Ba
-
Coding-Non-Coding指数gydF4y2Ba
- CPAT:gydF4y2Ba
-
编码潜力评估工具gydF4y2Ba
- 中国共产党:gydF4y2Ba
-
编码潜力计算器gydF4y2Ba
- etm:gydF4y2Ba
-
内生目标模拟gydF4y2Ba
- FPKM:gydF4y2Ba
-
每千碱基的片段数,每百万片段数gydF4y2Ba
- LncRNAs:gydF4y2Ba
-
长非编码rnagydF4y2Ba
- microrna的:gydF4y2Ba
-
微gydF4y2Ba
- PCgenes:gydF4y2Ba
-
蛋白编码基因gydF4y2Ba
- RT-qPCR:gydF4y2Ba
-
实时定量PCRgydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
Myers SS, Smith MR, Guth S, Golden CD, Vaitla B, Mueller ND, Dangour AD, Huybers P.气候变化与全球粮食体系:对粮食安全和营养不良的潜在影响。《公共卫生》,2017;38:259-77。gydF4y2Ba
- 2.gydF4y2Ba
Sillmann, Kharin, V, V Zwiers, f.w, Bronaugh, Zhang: CMIP5多模式集合中的气候极端指数:第2部分;未来气候预测。地球物理学报,2013,32(6):344 - 344。gydF4y2Ba
- 3.gydF4y2Ba
Munns R, Gilliham M.作物耐盐性的代价是什么?植物学报。2015;208(3):668-73。gydF4y2Ba
- 4.gydF4y2Ba
我。帕什:IPCC[政府间气候变化专门委员会]。2007年气候变化。在:物理科学基础。第一工作组对IPCC第四次评估报告的贡献。剑桥:英国剑桥大学出版社;2007.gydF4y2Ba
- 5.gydF4y2Ba
Dai A.在观测和模型中,全球变暖导致干旱增加。张国昌。2013;3(1):52-8。gydF4y2Ba
- 6.gydF4y2Ba
Bruce WB, Edmeades GO, Barker TC。玉米抗旱性改良的分子和生理方法。应用物理学报,2002;29(3):344 - 344。gydF4y2Ba
- 7.gydF4y2Ba
中岛K,伊藤Y, Yamaguchi-Shinozaki K.拟南芥和禾本科植物非生物胁迫下的转录调控网络。植物科学进展。2009;49(1):88-95。gydF4y2Ba
- 8.gydF4y2Ba
李志刚,李志刚,李志刚。非编码rna在胚胎发生中的调控作用。植物学报。2011;12(2):136-49。gydF4y2Ba
- 9.gydF4y2Ba
龙飞,张丽,李志强。莱茵衣藻的小沉默rna。密涅瓦生物技术。2010;22(1):29-37。gydF4y2Ba
- 10.gydF4y2Ba
Chekanova农协。长链非编码rna及其在植物中的功能。植物学报,2015;27:207-16。gydF4y2Ba
- 11.gydF4y2Ba
刘俊,荣昌,徐俊,王辉,邓晟,Bernad L, Arenas-Huertero C,蔡新华。全基因组分析揭示了拟南芥长基因间非编码rna的调控。植物科学进展。2012;24(11):433 - 45。gydF4y2Ba
- 12.gydF4y2Ba
山田K, Lim J, Dale JM,陈华,Shinn P, Palm CJ, Southwick AM,吴兴华,Kim C, Nguyen M,等。拟南芥基因组转录活性的实证分析。科学(纽约,纽约州)。2003, 302(5646): 842 - 6。gydF4y2Ba
- 13.gydF4y2Ba
王晓军,Gaasterland T,蔡新华。拟南芥顺天然反义转录本的全基因组预测与鉴定。中国生物医学工程学报,2005;6(4):R30。gydF4y2Ba
- 14.gydF4y2Ba
许俊杰,宋世峰。长内含子非编码RNA介导的春化介导表观遗传沉默。科学(纽约,纽约州)。2011, 331(6013): 76 - 9。gydF4y2Ba
- 15.gydF4y2Ba
Campalans A, Kondorosi A, Crespi M. Enod40是一种含有短开放阅读框的mRNA,诱导Medicago truncatula核RNA结合蛋白的细胞质定位。植物学报。2004;16(4):1047-59。gydF4y2Ba
- 16.gydF4y2Ba
拟南芥非编码RNA介导红光对光形态建成的控制。中国科学(d辑),2014,26(3):357 - 357。gydF4y2Ba
- 17.gydF4y2Ba
张玉春,廖建勇,李志勇,余宇,张建平,李庆峰,曲丽华,舒伟,陈永强。全基因组筛选和功能分析发现了大量参与水稻有性生殖的长链非编码rna。中国生物医学工程学报。2014;15(12):512。gydF4y2Ba
- 18.gydF4y2Ba
邓峰,张旭,王伟,袁锐,沈峰:gydF4y2Ba陆地棉gydF4y2Ba盐胁迫下的长链非编码rna (lncRNAs), 2018, 18(1):23。gydF4y2Ba
- 19.gydF4y2Ba
李松,于旭,雷宁,程震,赵鹏,何颖,王伟,彭敏。木薯低温和干旱响应lncrna的全基因组鉴定与功能预测。科学通报2017;7:45981。gydF4y2Ba
- 20.gydF4y2Ba
Kornienko AE, Guenzl PM, Barlow DP, Pauler FM。通过长链非编码RNA转录的基因调控。BMC生物学2013;11:59。gydF4y2Ba
- 21.gydF4y2Ba
彭婷,李志强,李志强。长链非编码rna的进化与功能。细胞。2009;136(4):629 - 41。gydF4y2Ba
- 22.gydF4y2Ba
Wierzbicki。长链非编码RNA在转录基因沉默中的作用。植物学报。2012;15(5):517-22。gydF4y2Ba
- 23.gydF4y2Ba
长非编码rna与染色质调控。植物学报。2011;14(2):168-73。gydF4y2Ba
- 24.gydF4y2Ba
刘芳,刘志刚,刘志刚,刘志刚。拟南芥Polycomb基因冷诱导的长反义转录本沉默。自然。2009;462(7274):799 - 802。gydF4y2Ba
- 25.gydF4y2Ba
Franco-Zorrilla JM, Valli A, Todesco M, Mateos I, Puga MI, Rubio-Somoza I, Leyva A, Weigel D, Garcia JA, Paz-Ares J.靶拟化提供了一种调控microRNA活性的新机制。植物学报。2007;39(8):1033-7。gydF4y2Ba
- 26.gydF4y2Ba
申慧,申慧,陈锐,李志强。在缺磷过程中,At4功能的缺失会影响根和芽之间的磷酸盐分配。植物学报,2006;45(5):712-26。gydF4y2Ba
- 27.gydF4y2Ba
Marker C, Zemann A, Terhorst T, Kiefmann M, Kastenmayer JP, Green P, Bachellerie JP, Brosius J, Huttenhofer A.拟南芥140个候选小非信使rna的实验RNomics研究目前生物学:CB。2002; 12(23): 2002 - 13所示。gydF4y2Ba
- 28.gydF4y2Ba
Paytuvi Gallart A, Hermoso Pulido A: GREENC:一个基于wiki的植物lncRNAs数据库。2016年,44 (D1): d1161 - 1166。gydF4y2Ba
- 29.gydF4y2Ba
杨娟。放牧制度对短花针茅草原重点植物种群繁殖特性的影响。干旱区资源与环境,2001。gydF4y2Ba
- 30.gydF4y2Ba
张洁,John UP,王勇,李霞,Gunawardana D, Polotnianka RM, Spangenberg GC,南哲。从EST资源中定向挖掘干旱胁迫响应基因。中国植物科学,2011;29(3):344 - 344。gydF4y2Ba
- 31.gydF4y2Ba
张娟,郑东,王玉林,安世杰,王玉良。转基因拟南芥中ALDH基因的胁迫诱导表达及其抗旱性的研究。植物组学。2014;7(6):438-44。gydF4y2Ba
- 32.gydF4y2Ba
段忠,张东,张娟,狄华,吴峰,胡霞,孟x,罗凯,张娟,王艳:共转化bar和CsALDH基因增强转基因苜蓿抗除草剂和抗旱耐盐能力(gydF4y2Ba紫花苜蓿gydF4y2Bal .)。植物科学学报,2015,6(6):344 - 344。gydF4y2Ba
- 33.gydF4y2Ba
张军,段忠,张东,张军,狄华,吴峰,王艳。共转化bar和CsLEA增强了转基因紫花苜蓿(Medicago sativa L.)的干旱和盐胁迫耐受性。生物化学学报。2016;472(1):75-82。gydF4y2Ba
- 34.gydF4y2Ba
张娟,孔磊,刘震,贾胡费兹,段震,霍勇,狄红,王艳。干旱荒漠草拟南芥中脱水蛋白LEA的胁迫诱导表达。植物组学。2015;8(6):485-92。gydF4y2Ba
- 35.gydF4y2Ba
李建伟,马伟,潘卓,王俊义,G斌,Y吉春,c清华。lntar:一种预测长链非编码RNA靶点的工具。生物信息学报。2015;16(5):806。gydF4y2Ba
- 36.gydF4y2Ba
Ray S, Dansana PK, Giri J, Deveshwar P, Arora R, Agarwal P, Khurana JP, Kapoor S, Tyagi AK。水稻水分亏缺胁迫下转录因子和代谢途径基因的调控。中国生物医学工程学报。2011;11(1):157-78。gydF4y2Ba
- 37.gydF4y2Ba
张玲,余松,左凯,罗玲,唐凯。水稻干旱响应相关基因模块的网络分析。公共科学学报,2012;7(5):e33748。gydF4y2Ba
- 38.gydF4y2Ba
王TZ,刘M,赵毫克,陈R,张WH。利用全基因组高通量测序鉴定和表征与渗透和盐胁迫有关的长链非编码rna。中国生物医学工程学报。2015;gydF4y2Ba
- 39.gydF4y2Ba
狄晨,袁杰,吴勇,李娟,林华,胡林,张涛,齐勇,Gerstein MB,郭勇,等。拟南芥胁迫响应型lncrna的表达、表观遗传和结构特征分析植物学报,2014;30(5):848-61。gydF4y2Ba
- 40.gydF4y2Ba
吴峰,张东,穆武义BP,闫强,张颖,闫珍,曹敏,王艳,张娟。二态植物小花的闭锁交配和裂花交配差异分析。科学通报2018;8(1):6287。gydF4y2Ba
- 41.gydF4y2Ba
李玲,艾希腾SR,清水R, Petsch K,叶CT,吴W, Chettoor AM, Givan SA, Cole RA, Fowler JE,等。玉米长链非编码rna的全基因组发现和表征。中国生物医学工程学报。2014;15(2):R40。gydF4y2Ba
- 42.gydF4y2Ba
王东,潘勇,赵霞,朱林,付波,李志。水稻干旱响应性基因时空表达谱分析。BMC Genomics, 2011; 12:49。gydF4y2Ba
- 43.gydF4y2Ba
李慧,王勇,陈明,肖鹏,胡超,曾铮,王超,王杰,胡铮。模式微生物莱茵衣藻全基因组长链非编码RNA的筛选、鉴定与鉴定。科学通报2016;6:34109。gydF4y2Ba
- 44.gydF4y2Ba
Dixon RA, Paiva NL。应激诱导的苯丙类代谢。植物科学进展。1995;7(7):1085-97。gydF4y2Ba
- 45.gydF4y2Ba
巴里R,琼斯JD。植物激素在植物防御反应中的作用。植物分子生物学杂志,2009;69(4):473-88。gydF4y2Ba
- 46.gydF4y2Ba
卡雷特罗-保莱特L,加尔斯特安A,罗伊-维拉诺瓦I, Martínez-García JF,毕尔巴鄂-卡斯特罗JR,罗伯逊DL。拟南芥、杨树、水稻、苔藓和藻类中bHLH转录因子家族的全基因组分类和进化分析。中国生物医学工程学报。2010;29(3):344 - 344。gydF4y2Ba
- 47.gydF4y2Ba
拟南芥非编码RNA介导红光对光形态建成的控制。中国科学院学报(自然科学版),2014;29(4):344 - 344。gydF4y2Ba
- 48.gydF4y2Ba
胡红,戴敏,姚军,肖斌,李霞,张强,熊玲。过表达一个NAM、ATAF和CUC (NAC)转录因子增强水稻抗旱性和耐盐性。中国科学院学报(自然科学版),2006;26(3):379 - 379。gydF4y2Ba
- 49.gydF4y2Ba
胡红,尤军,方勇,朱鑫,祁忠,熊玲。水稻耐寒耐盐转录因子基因SNAC2的鉴定。植物分子生物学杂志,2008;29(1):344 - 344。gydF4y2Ba
- 50.gydF4y2Ba
洪艳,张宏,黄玲,李东,宋峰。水稻耐盐耐旱基因ONAC022的过表达提高了水稻的耐旱性和耐盐性。前沿植物科学,2016;7:4。gydF4y2Ba
- 51.gydF4y2Ba
李dk,郑普杰,郑杰,张庚,方文文,郑海,金ys,河升,崔永德,金志强。水稻OsNAC6转录因子协调多种分子机制,包括根系结构适应和烟草胺生物合成的耐旱性。中国生物工程学报,2017;15(6):754-64。gydF4y2Ba
- 52.gydF4y2Ba
Nakashima K, Tran LS, Van Nguyen D, Fujita M, Maruyama K, Todaka D, Ito Y, Hayashi N, Shinozaki K, Yamaguchi-Shinozaki K.水稻非生物和生物胁迫响应基因表达中nac型转录因子OsNAC6的功能分析。植物学报,2007;26(4):344 - 344。gydF4y2Ba
- 53.gydF4y2Ba
郑杰,金ys,白赫,郑赫,河诗,都崔Y,金M, Reuzeau C,金JK。OsNAC10的根特异性表达提高了水稻在田间干旱条件下的耐旱性和产量。植物科学进展。2010;29(1):344 - 344。gydF4y2Ba
- 54.gydF4y2Ba
唐宁,马松,宗伟,杨宁,吕勇,闫超,郭震,李静,李霞,向勇,等。MODD介导OsbZIP46失活和降解,负调控ABA信号通路和水稻抗旱性。《植物细胞》,2016。gydF4y2Ba
- 55.gydF4y2Ba
尹硕,李德奎,俞ij,金玉生,崔永德,金金奎。过表达OsbZIP66转录因子可提高水稻植株的耐旱性。植物学报。2017;11(1):53-62。gydF4y2Ba
- 56.gydF4y2Ba
戚霞,谢松,刘勇,易峰,余娟。谷子对模拟干旱胁迫响应基因和非编码rna的深度测序。中国生物医学工程学报,2013;29(4):457 - 457。gydF4y2Ba
- 57.gydF4y2Ba
Dugas DV, Monaco MK, Olsen A, Klein RR, Kumari S, Ware D, Klein PE。高粱转录组对渗透胁迫和脱落酸反应的功能注释。BMC基因组学。2011;12:514。gydF4y2Ba
- 58.gydF4y2Ba
Jain M, Tyagi AK, Khurana JP。水稻同源盒基因的全基因组鉴定、分类、进化扩展及表达分析。中华医学杂志,2008;29(11):344 - 344。gydF4y2Ba
- 59.gydF4y2Ba
Bhattacharjee A, Sharma R, Jain M.过表达OsHOX24通过调节胁迫响应基因表达增强转基因水稻对非生物胁迫的敏感性。植物科学,2017;8:628。gydF4y2Ba
- 60.gydF4y2Ba
张s, Haider I, Kohlen W, Jiang L, Bouwmeester H, Meijer AH, Schluepmann H,刘cm, Ouwerkerk PB。HD-zip I基因Oshox22在aba介导的水稻耐旱耐盐中的作用植物化学学报,2012;40(6):571-85。gydF4y2Ba
- 61.gydF4y2Ba
渡边,小岛K,井出Y,佐佐木。生理盐水和渗透胁迫对胡杨脯氨酸和糖积累的影响。植物科学进展,2000;29(3):366 - 366。gydF4y2Ba
- 62.gydF4y2Ba
辛格D,拉克西米A:干旱响应的转录调控:一个曲折的转录因子网络。前沿植物科学,2015,6(895)。gydF4y2Ba
- 63.gydF4y2Ba
姜杰,黄菊,李敏,金YY, Assmann SM, Martinoia E, Lee Y. pdr型ABC转运蛋白介导植物激素脱落酸的细胞摄取。中国科学(d辑),2010,26(3):349 - 349。gydF4y2Ba
- 64.gydF4y2Ba
Axtell乔丹。植物小分子rna的分类与比较。植物学报。2013;34(4):529 - 529。gydF4y2Ba
- 65.gydF4y2Ba
李风扇C,郝Z,燕J, g .全基因组鉴定和功能分析lincRNAs充当microrna的目标或玉米的诱饵。BMC Genomics. 2015;16:793。gydF4y2Ba
- 66.gydF4y2Ba
方勇,谢坤,熊玲。mir164靶向NAC基因对水稻抗旱性的负向调控。中国机械工程学报,2014;26(4):516 - 516。gydF4y2Ba
- 67.gydF4y2Ba
Si-Ammour A, Vazquez F. miR393和次级sirna调控TIR1/AFB2生长素受体枝的表达和拟南芥叶片生长素相关的发育。中国生物医学工程学报。2011;29(2):344 - 344。gydF4y2Ba
- 68.gydF4y2Ba
Mittler R, Vanderauwera S, Gollery M, Van BF。植物活性氧基因网络。植物科学进展,2004;9(10):490-8。gydF4y2Ba
- 69.gydF4y2Ba
于勇,李庆峰,张建平,张峰,周永峰,冯永忠,陈永强,张永春。漆酶-13通过影响过氧化氢动态和线粒体完整性调控水稻结实率。中国植物科学,2017;8:1324。gydF4y2Ba
- 70.gydF4y2Ba
Berthet S, Demont-Caulet N, Pollet B, Bidzinski P, Cã©Zard L, Le BP, Borrega N, Hervã©J, Blondet E, Balzergue S: LACCASE4和17的破坏导致拟南芥茎木化的组织特异性改变。植物细胞学报,2011,23(3):1124-1137。gydF4y2Ba
- 71.gydF4y2Ba
王晓明,王晓明,王晓明,等。基于HISAT的快速拼接对齐算法研究[j] .计算机工程,2015,34(4):357 - 366。gydF4y2Ba
- 72.gydF4y2Ba
彭丽娟,陈晓明,张晓明,张晓明,等。基于RNA-seq转录组重构技术的研究进展[j] .中国生物医学工程学报,2015,34(3):379 - 379。gydF4y2Ba
- 73.gydF4y2Ba
吕健,黄忠,刘宏,刘宏,崔伟,李波,何辉,郭杰,刘强,张勇,等。与小鼠肝脏发育相关的长基因间非编码rna的鉴定和表征。Mol Genet基因组学:MGG。2014年,289(6):1225 - 35。gydF4y2Ba
- 74.gydF4y2Ba
Kelley D, Rinn J.转座元件揭示了干细胞特异性类长非编码rna。中国生物工程学报,2012;13(11):R107。gydF4y2Ba
- 75.gydF4y2Ba
王玲,朴海杰,李文文,王淑娟,李伟。基于无对齐逻辑回归模型的编码潜力评价方法。中国生物医学工程学报,2013;41(6):e74。gydF4y2Ba
- 76.gydF4y2Ba
孙玲,罗红,卜东,赵刚,于凯,张超,刘勇,陈锐,赵艳。利用序列本征组成对蛋白质编码和长非编码转录本进行分类。中国生物医学工程学报,2013;41(17):e166。gydF4y2Ba
- 77.gydF4y2Ba
孔玲,张颖,叶志强,刘小强,赵淑琴,魏玲,高光:CPC:利用序列特征和支持向量机评价转录本的蛋白质编码潜力。核酸研究,2007,35(Web Server issue): W345-349。gydF4y2Ba
- 78.gydF4y2Ba
Finn RD, Bateman A, Clements J, Coggill P, Eberhardt RY, Eddy SR, Heger A, Hetherington K, Holm L, Mistry J,等。Pfam:蛋白质家族数据库。中国生物医学工程学报,2014;42(D1): D222-30。gydF4y2Ba
- 79.gydF4y2Ba
王晓燕,王晓燕,王晓燕,王晓燕,等。RNA-seq转录水平的分析。中国生物医学工程学报,2016;11(9):1650-67。gydF4y2Ba
- 80.gydF4y2Ba
Young MD, Wakefield MJ, Smyth GK, Oshlack A. RNA-seq的基因本体分析:考虑选择偏差。中国生物医学工程学报。2010;11(2):R14。gydF4y2Ba
- 81.gydF4y2Ba
毛晓霞,蔡涛,李志刚,魏磊。基于KEGG Orthology (KO)的基因组自动注释和通路识别。生物信息学。2005;21(19):3787 - 93。gydF4y2Ba
- 82.gydF4y2Ba
Li L, Stoeckert CJ Jr, Roos DS。真核生物基因组正正交基的鉴定。基因组学报,2003;13(9):2178-89。gydF4y2Ba
- 83.gydF4y2Ba
戴鑫,庄志。赵px: psRNATarget:植物小RNA靶标分析服务器(2017年发布)。核酸决议2018。gydF4y2Ba
确认gydF4y2Ba
感谢BMKCloud (gydF4y2Bahttp://www.biocloud.netgydF4y2Ba/)提供数据分析平台。gydF4y2Ba
资金gydF4y2Ba
国家基础研究计划项目(973)(2014CB138704)、国家自然科学基金项目(31572453)、长江学者创新团队计划项目(IRT_17R50)、中央高校基本科研业务费专项资金项目(lzujbky-2016-10)、干旱气象开放计划项目(IAM201703)资助。所有这些资金都在研究的设计、收集、分析和撰写手稿中发挥作用。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
在目前的研究中产生和分析的数据集是不公开的,由于全基因组测序工作gydF4y2Bac . songoricagydF4y2Ba尚未发表,但可从通讯作者的合理要求。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
QY进行了生物信息学分析,并起草了手稿。QY和FW参与了研究的设计并对数据进行了分析。ZZY和JL参与RT-qPCR。张玉峰、TTM、赵玉峰实施软件,协助处理图形和表格。QY、JYZ和YRW构想了这项研究,并参与了研究的设计和协调,并帮助起草了手稿。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
c . songoricagydF4y2Ba在本研究中使用了一个品种。该品种是兰州大学畜牧农业科技学院通过驯化野生植物获得的。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
所有作者都宣称他们没有相互竞争的经济利益。gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
附加文件gydF4y2Ba
附加文件1:gydF4y2Ba
生理分析gydF4y2Bac . songoricagydF4y2Ba以应对水的压力和恢复。(docx210 kb)gydF4y2Ba
附加文件2:gydF4y2Ba
18个样本的RNA-seq数据。(xlsx10kb)gydF4y2Ba
附加文件3:gydF4y2Ba
不同条件下lncRNAs和mrna在根和茎中的表达量的箱线图。(docx930kb)gydF4y2Ba
附加文件4:gydF4y2Ba
保存的lncrna数量gydF4y2Bac . songoricagydF4y2Ba拟南芥,gydF4y2BaBrachypodium distachyongydF4y2Ba而且gydF4y2BaMedicago truncatulagydF4y2Ba和大米(gydF4y2Ba栽培稻gydF4y2Ba).(docx1598 kb)gydF4y2Ba
附加文件5:gydF4y2Ba
特异性表达基因和特异性表达lncrna (FPKM)的丰度。(docx360 kb)gydF4y2Ba
附加文件6:gydF4y2Ba
在至少一种胁迫处理中,DEGs (FDR≤0.01)在茎部和根部均有显著调节。(xlsx2110 kb)gydF4y2Ba
附加文件7:gydF4y2Ba
在至少一种胁迫处理中有显著的DE-lncRNAs (FDR≤0.01)及其在茎和根中的调控和靶基因。(xlsx1061 kb)gydF4y2Ba
附加文件8:gydF4y2Ba
所有lncrna和靶基因列表。(xlsx1554 kb)gydF4y2Ba
附加文件9:gydF4y2Ba
RT-qPCR分析lncRNA及其推测靶基因(DEG)。(docx338kb)gydF4y2Ba
附加文件10:gydF4y2Ba
水分胁迫与恢复下DEGs的功能分析。(docx755 kb)gydF4y2Ba
附加文件11:gydF4y2Ba
图中Venn图对应的器官/状况比较的不同组合中,过度代表显著丰富的GO术语的共同列表。gydF4y2Ba4 b, cgydF4y2Ba.(xlsx29 kb)gydF4y2Ba
附加文件12:gydF4y2Ba
DEGs在根和梢部的分布KEGG途径。(docx497 kb)gydF4y2Ba
附加文件13:gydF4y2Ba
中鉴定的差异表达tf的摘要gydF4y2Bac . songoricagydF4y2Ba缺水的转录组。(xlsx205kb)gydF4y2Ba
附加文件14:gydF4y2Ba
水稻芽根同源基因或水稻基因的假定列表gydF4y2Bac . songoricagydF4y2Ba.(xlsx113 kb)gydF4y2Ba
附加文件15:gydF4y2Ba
4种禾本科植物常见的干旱响应保守基因及其在植物中的表达模式gydF4y2Bac . songoricagydF4y2Ba.(xlsx291kb)gydF4y2Ba
附加文件16:gydF4y2Ba
在miRNA中lncrna的假定靶点和靶点模拟物gydF4y2Bac . songoricagydF4y2Ba.(xlsx29 kb)gydF4y2Ba
附加文件17:gydF4y2Ba
基因特异性引物引物列表。(xlsx11kb)gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文根据创作共用属性4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)除另有说明外,适用于本条所提供的资料。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
燕,Q.,吴,F,燕,Z。gydF4y2Baet al。gydF4y2Ba差异共表达网络长非编码rna和mrnagydF4y2BaCleistogenes songoricagydF4y2Ba在水压力下和恢复期间。gydF4y2BaBMC植物生物学gydF4y2Ba19日,gydF4y2Ba23(2019)。https://doi.org/10.1186/s12870-018-1626-5gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-018-1626-5gydF4y2Ba
关键字gydF4y2Ba
- LncRNAgydF4y2Ba
- 水的压力gydF4y2Ba
- Cleistogenes songoricagydF4y2Ba
- RNA-seqgydF4y2Ba
- 转录因子gydF4y2Ba
- 保守的干旱反应基因gydF4y2Ba
- 禾本科gydF4y2Ba
- 表达网络gydF4y2Ba