摘要
背景
葡萄糖-6-磷酸脱氢酶(G6PDH或G6PD)的功能是供应NADPH,这是植物对胁迫的防御反应所必需的。然而,G6PD是否在脱落酸(ABA)信号通路中发挥作用尚不清楚。在本研究中,我们研究了胞质G6PD5在ABA信号通路中的作用拟南芥.
结果
我们的特点是拟南芥单零变异g6pd5。表型分析表明,在种子萌发和根系生长期间,突变体对ABA更敏感,而G6PD5与野生型(WT)相比,过表达植物对ABA的敏感性较低。此外,ABA诱导突变体种子和幼苗中活性氧(ROS)的过度积累。G6PD5参与H的降低2O2到H2o在抗坏血酸 - 谷胱甘肽循环中。另外,我们发现了G6PD5抑制的表达脱落酸不敏感(ABI5), ABA在休眠控制中的主要信号成分。当G6PD5过表达,ABA信号通路失活。一致地,G6PD5负调制在分生组织和伸长区ABA嵌段的初生根的生长。值得注意的是,根伸长的由ABA的抑制是通过细胞周期的B型细胞周期蛋白触发CYCB1.
结论
本研究表明,G6PD5通过抑制aba介导的种子萌发和根系生长ABI5.
背景
氧化磷酸戊糖途径(OPPP)是NADPH的产生,其用于生物合成的主要途径[1,2,3.,4]及植物细胞内氧化还原平衡[5,6].OPPP的主要调节步骤是通过葡萄糖-6-磷酸脱氢酶(G6PDH或G6PD)催化。许多实验已经证明,G6PD.由不良生物和非生物胁迫引起的,包括盐度,干旱和ABA [7,8,9,10,11].G6PD活性增强与促进植物存活和耐受性有关[9,11,12].拟南芥基因组分析表明存在两种细胞溶质(Cy-G6PD)和四种塑性(PLA-G6PD)同种型的G6PD [13].Cy-G6PD包括G6PD5和G6PD6。根据氨基酸序列的差异,Pla-G6PD分为P1、P2和P0型:P1主要存在于叶绿体(G6PD1)中;P2主要存在于质体和一些非氧细胞中(G6PD2、G6PD3),而P0是一个非功能基因(G6PD4) [13].大量研究表明,胞质G6PD和塑质G6PD在植物存活和耐受性中发挥着不同的作用[9,11,12].例如,聚乳酸G6PD在调节重金属生化反应[关键14],而Cy-G6PD参与了高铝浓度下大豆的铝毒性[15].在拟南芥, G6PD6构成模式识别受体下游的免疫信号模块,将蛋白磷酸化级联反应与代谢调节联系起来[16].
许多压力导致水分缺乏和离子不平衡,从而导致必需酶的抑制、细胞膜的不稳定、营养供应的减少和活性氧(ROS)的过量产生[12,17].ROS用作信号分子,以调节许多生物过程,包括种子萌发和植物的根生长[12,17,18,19].已经记录了ROS通过植物中的酶和非酶反应产生[20.,21].在拟南芥,ROS直接来源于两种生成ROS的NADPH氧化酶AtrbohD和AtrbohF,破坏了应激对主根伸长的抑制[18,22].最近的研究表明,G6PD起着应激反应的基础性作用,有利于活性氧的清除功能[23].事实上,在干旱胁迫期间,植物细胞增加了减少能量的需求,以维持抗氧化防御系统,并对抗ROS积累和随之而来的损害[23,24].
ABA (ABA)的合成受到胁迫的显著诱导,ABA信号在种子成熟和休眠、气孔关闭、根系生长发育调控等非生物胁迫响应中发挥着重要作用[19,25].aba介导的基因调控通过基因启动子中保守的aba响应元件(ABREs)发生[26].ABREs包含ACGT作为核心核苷酸序列,作为bZIP转录因子的结合位点[2,26,27].在拟南芥,脱落Acid-Insensitive 5(ABI5),一个的bZIP转录因子,发挥种子成熟期间介导ABA信号至关重要的作用[28].aba增强的耐受性与诱导活性氧清除系统相关[29,30.,31,32].此外,最近的研究表明,ABA影响大麦质体G6PD的活性和表达[2].ABA介导干旱诱导的胞质G6PD活性增加,而增强的胞质G6PD活性通过调节大豆根系AsA-GSH循环维持细胞氧化还原稳态[11].
关于胞质异构体,拟南芥cyy - g6pd突变体产生的种子含油量较高,表明cyy - g6pd在种子发育过程中脂肪酸代谢中必不可少[11,13].有趣的是,当G6PD6对敲除植株的胁迫敏感性进行测试,发现在盐度条件下突变体种子的发芽率显著降低,根系生长受到NaCl胁迫的强烈影响[12].然而,人们对其表达和功能却知之甚少G6PD5.在这项工作中,我们使用遗传和分子方法来研究功能G6PD5.我们描述了的函数G6PD5在种子萌发和根的生长中。此外,我们的结果表明,G6PD5与ABI5拮抗,维持种子萌发和幼苗建立所必需的ABA信号水平。我们发现了ROS、ABA和G6PD5之间的一种新的相互作用。
方法
植物材料和生长条件
拟南芥Col-0为野生型。本文分别插入突变体g6pd5(CS804669)和g6pd6(SALK_016157C)从拟南芥生物资源中心(http://www.arabidopsis.org/).T-DNA在g6pd5突变体被插入编码区域At3g2300,并在g6pd6突变体,T-DNA插入编码区At5g40760.这G6PD5overexpressing植物(OE#1,OE#9.)是通过对G6PD5 -包含构造到Col-0。本研究还使用了以下突变体或转基因品系:aba2-1,aba2-3,abi4 - 102.NADPH氧化酶基因单突变ATRBOHD1(CS9555)和atrbohF1(CS9557)和双突变体atrbohD1 / F1均来自拟南芥生物资源中心。ABI5:格斯张祖桦通过他(中国院院士的科学版)是友好给出。种子abi3和ABI5-2从英高柳(山东农业大学,中国)的礼貌都提供。转基因线CYCB1; 1::格斯是由广勤郭(兰州大学,中国)提供的。所有这些都在Col-0背景中。将种子用1.5%NaClO灭菌15分钟,用无菌水洗涤三次,置于4℃,3d。冷处理的种子在含有1%蔗糖和0.8%琼脂的半级Murashige和Skoog(pH 5.8)上萌发在含有1%蔗糖和0.8%琼脂的23°C,在100-120μmol光子·m下的生长室中的0.8%琼脂−2·年代−1具有16 H / 8 H光/深光滤波器。
表型分析
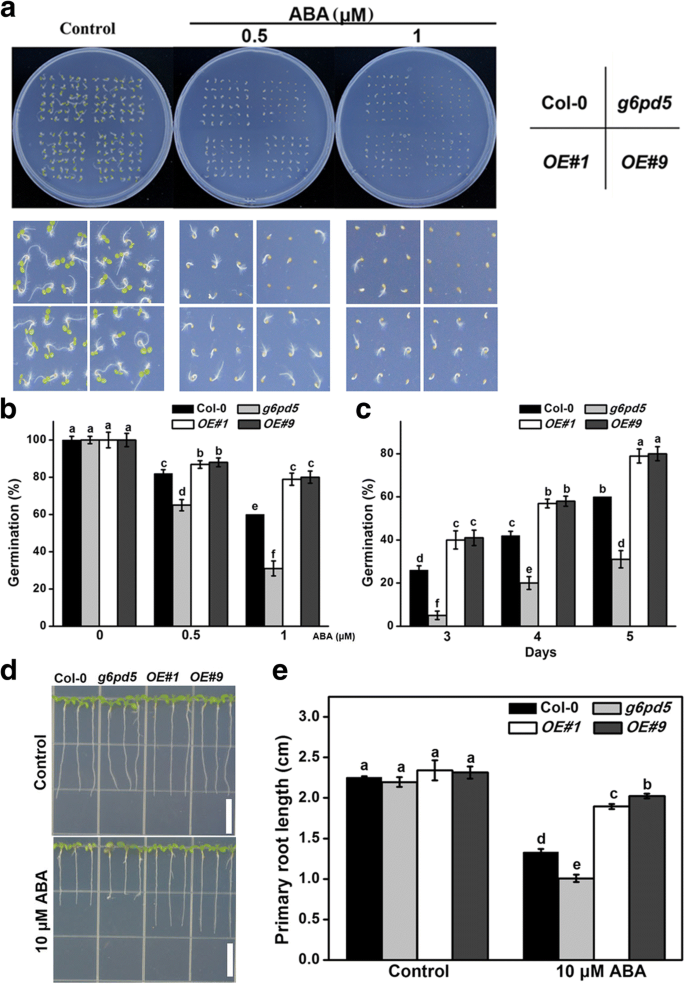
在发芽测定中,wt,g6pd5,OE#1,OE#9.种子(每个重复约50粒种子)进行表面消毒。播种于含或不含不同浓度ABA的1/ 2ms培养基上,23℃,16 h光照/8 h暗光周期培养。播种5 d后,记录播种和发芽的种子数。>的胚根出芽1 mm,表明种子萌发。每个处理使用三个重复板。
在根伸长率测量中,拟南芥如上所述,种子播种在1/2 ms培养基上,分层3d,然后在23℃下发芽5 d。对于根伸长率测量,每次重复使用15种幼苗,对每种处理进行三种重复。具有1-1.5厘米长的五天幼苗从1/2 ms琼脂平板转移到补充有不同浓度的ABA的新琼脂培养基上。在3 d治疗后测量根长度的增加[33,34].采用NIH Image软件(Image J, version 1.43)测量主根长度。在解剖显微镜下统计β-葡萄糖醛酸酶(GUS)染色位点。
不同基因型植物的世代
为了产生g6pd5植物窝藏CYCB1; 1::格斯(g6pd5/CYCB1; 1植物)或ABI5:格斯(g6pd5/ABI5植物),被阉割的花g6pd5植物与col0植物的花粉杂交CYCB1; 1::格斯(Col /CYCB1; 1植物)或ABI5:格斯(Col /ABI5植物)。由此产生的纯合子g6pd5/CYCB1; 1和g6pd5/ABI5利用PCR技术对植物进行鉴定G6PD5-特异性引物(左基因组引物,5΄-CACCATGGGTTCTGGTCAATGGC-3΄;右基因组引物5΄-CAATGTAGGAGGGATCTAAATGTAG-3΄)和T-DNA左缘引物LBb1。识别的CYCB1; 1::格斯和ABI5:格斯背景GUS染色;所有幼苗染成蓝色的细胞系用于实验。
共焦显微镜
为了分析碘化丙啶(PI)探针的荧光,根据Mei等人描述的方法,用PI (Molecular Probes, Eugene, OR, USA)对幼苗根进行染色。35].用10 μg/ml的PI在25°C黑暗中孵育5-10分钟,然后用ddH洗涤3次2O.在共聚焦显微镜下成像(Olympus FV 1000;激发488 nm,发射570-650 nm)。PI染色后,在共聚焦显微镜下测定WT和突变体幼苗根伸长区和分生组织区长度、表皮细胞大小和根伸长区细胞数量。
组织化学染色和活性氧的测定(ROS)
过氧化氢(H2O2)的积累用2,7-二氯二氢荧光素二乙酸酯(H2DCF,分子探针)测定。用20 μM H2DCF处理2日龄种子或5日龄幼苗根系10-15 min,在荧光显微镜(Olympus FV 1000,激发波长488 nm,发射波长500-550 nm)下监测荧光强度。测定H2O2或O2.-在根中,使用0.01%(进行在根尖组织化学染色w/v) 3,3-二氨基联苯胺(DAB, pH 5.0, for H2O2检测)或0.005% (w/v)硝基四唑蓝氯(NBT, pH 7.4,用于O2.-分别检测)。在所有情况下,染色材料使用数码相机(佳能,PC1146)拍摄。H2O2和O2.-根据Wang et al. [15].
抗氧化酶,NADPH氧化酶和葡萄糖-6-磷酸脱氢酶活性的测定
用10μmaba浸泡十天幼苗的溶液中12小时。处理后,根据Liu等人的方法评价抗氧化酶,NADPH氧化酶和G6PD的活性。[36Wang等人[37].
GUS染色
对于GUS染色,在GUS染色缓冲液中孵育幼苗(1mM 5-溴-4-氯-3-吲哚基-β-D-葡糖醛酸(X-Gluc),100mM磷酸钠(pH7.5),0.5mm k3.[Fe (CN)6, 0.5 mM K4[Fe (CN)6], 10 mM EDTA和0.1% Triton X-100),在37°C下6-18小时,并安装在显微镜分析的溶液中[38].如南等人所述进行定量GUS活性测定。[33].
实时荧光定量PCR分析
用Trizol (TaKaRa)提取幼苗总RNA。用无rnase - DNase I (Promega)在37℃下酶切45 min后,用PrimeScript II 1st Strand cDNA synthesis Kit (Takara)合成cDNA。将稀释后的cDNA用SYBR Premix Ex Taq™II (Takara)进行qRT-PCR分析。本研究使用的引物序列见附加文件1:表S1。循环阈值2(−ΔΔC (T))方法用于基因表达的相对定量分析。表达水平归一化为肌动蛋白2.
拟南芥本文所述基因的Genome Initiative位点标识如下:actin2.(AT3G18780),G6PD5(AT3G27300),G6PD6(AT5G40760),AtrbohD(AT5G47910),AtrbohF(AT1G64060),APX1.(At1G07890),GR2(At3G54660),NCED6(AT3G24220),NCED9(AT1G78390),CYP707A3(AT5G45340),CYP707A4(AT3G19270),ABI3(AT3G24650),ABI4(AT2G40220),ABI5(AT2G36270),CYCB1; 1(AT4G37490),PLT1(AT3G20840),PLT2(AT1G51190)。
g6pd5过表达(G6PD5-OE)品系的生成
完整的拟南芥G6PD5逆转录PCR获得cDNA,克隆到pENTR-TOPO克隆载体(Invitrogen)中并测序。在LR反应之后,G6PD5将cDNA插入pGWB2载体;这个结构被命名为pGWB2-G6PD5.在含州霉素的培养基上选择转化的植物。转化后第二代植物用于实验。空的PGWB5载体(CCDB基因被终端密码子取代)也转移到COL-0中并用作对照植物。
统计分析
每个实验至少重复三次。通过单向方差分析进行分析数据(ANOVA,P< 0.05),以平均值±SE表示。
结果
的响应能力g6pd突变体和G6PD5-过表达系在种子萌发和根系生长过程中对ABA处理的影响
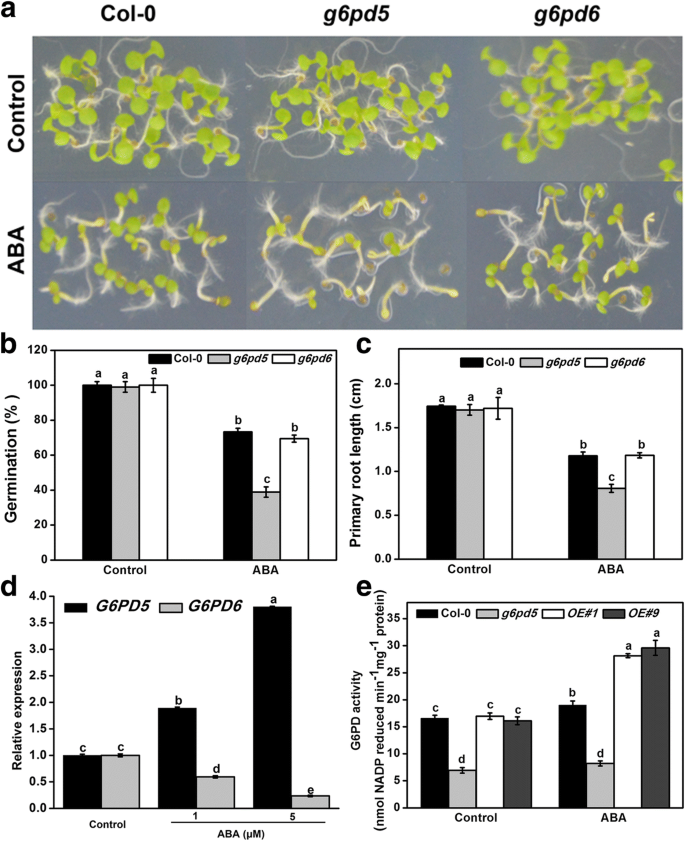
ABA被应力显着诱导,其信号传导具有非生物应激反应的重要功能。因此,我们测试了G6PD5是否参与了ABA信令的调节。研究G6PD5的潜在作用拟南芥,我们获得了来自拟南芥生物资源中心的T-DNA插入突变体。这g6pd5在正常生长条件下,与WT相比,突变体未在发芽和幼苗阶段显示任何可见表型(图。1a - c)。然而g6pd5与野生型相比,突变体的种子萌发率随着ABA浓度的增加而显著降低。1,2a - c)。此外,主根的生长g6pd5还显示出ABA敏感的表型(图。2d, e).相比之下,种子g6pd6与ABA处理的WT相比,突变体的种子萌发不明显(图。1a - c)。此外,表达G6PD5是由ABA处理诱导的,而G6PD6抑制(无花果。1).因此,我们主要集中在G6PD5在接下来的实验中。
野生型(WT)种子萌发和根系生长,g6pd5,g6pd6突变体对ABA的响应。一个和bSeeds were germinated on 1/2 MS agar plates with 1 μM ABA. Photographs were taken 4 d after treatment.c5-day-old seedlings were grown vertically on 1/2 MS agar plates supplemented with 10 μM ABA. Root growth was monitored and analyzed using ImageJ software.d相对转录水平G6PD5和G6PD6在野生型(Col-0)中具有不同浓度的ABA治疗。转录水平归一化为Actin2.eG6PD的活动拟南芥外源ABA处理下的WT和突变体。采用单向Duncan检验,不同小写字母表示差异有统计学意义(P< 0.05)。酒吧,1厘米。该实验得到相似的结果重复至少3次,并且从一个代表性实验的数据被呈现
在正常生长条件下,WT的发芽率和主根生长无显著差异G6PD5过表达(OE)线(图2).然而,通过ABA治疗,OE线的种子萌发率明显高于WT(图。2A,B)和OE植物的初生根的生长也hyposensitive到ABA处理(图2c, d).这些数据表明过度表达G6PD5增加ABA宽容拟南芥.
氧化损伤的G6PD5-overexpressing和g6pd5突变体植物
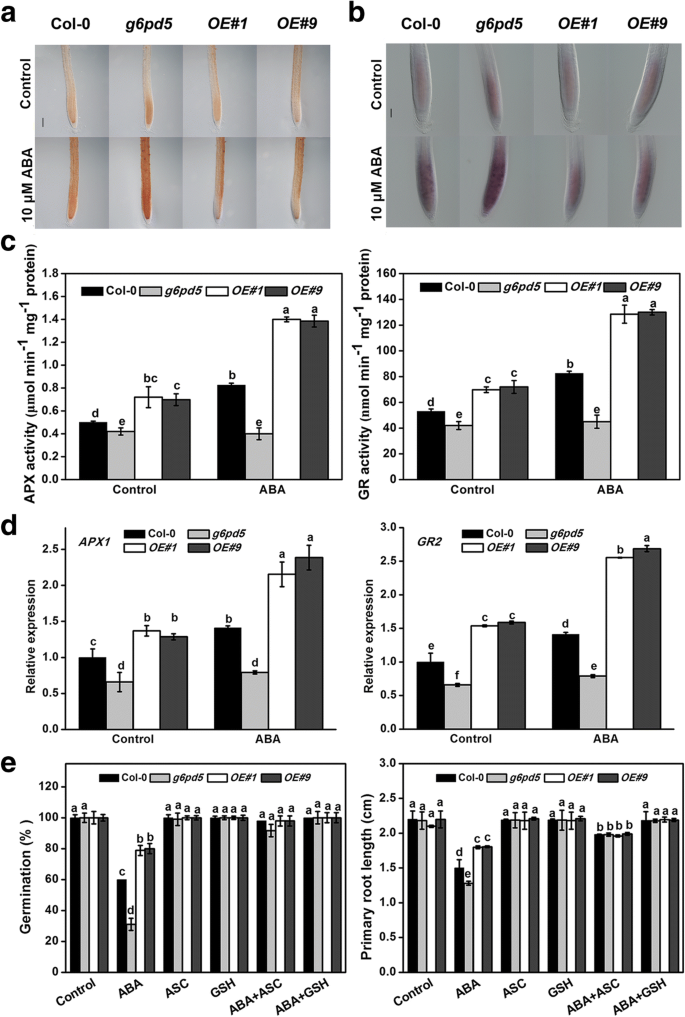
前期研究表明,ROS在非生物胁迫下的萌发过程中起着关键的调控作用[39,40].ROS可通过有利的条件下松动细胞壁[调制根伸长22,41].ABA引起氧化损伤和ROS的产生,因此我们评估了种子和幼苗中ROS的水平g6pd5和经ABA处理的g6pd5过表达(OE)系。H2O2在种子和幼苗的含量g6pd5突变体和WT增加对ABA处理的响应(图。3.一个,附加文件1:图S1,附加文件1:图S2A)。值得注意的是o2.-内容明显增强g6pd5突变体,但OE株系减弱(图。3.b,附加文件1:图开通)。为了进一步分析G6PD5参与ROS信号转导的作用,外源性H2O2被提供给媒体。这g6pd5突变体对氧化应激的敏感性增加,表现为相对于WT的发芽和根伸长延迟(数据未显示)。这些结果表明g6pd5比WT高。
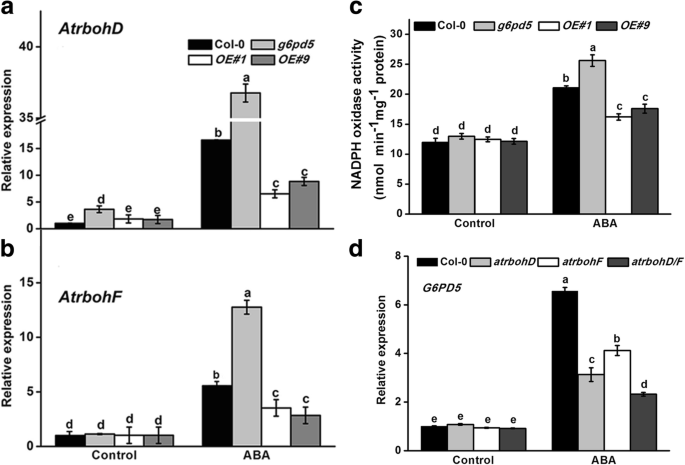
G6PD5影响NADPH氧化酶AtrbohD和AtrbohF
在拟南芥,RO可以通过过氧化物酶,氨基氧化酶和氧光度引发产生。然而,ROS生产的主要来源来自NADPH氧化酶ATRBOHD和ATRBOHF,其在压力抑制的原始根系生长中起重要作用[22].通过NADPH氧化酶信号传导途径确定G6PD5是否响应ABA的功能,我们分析了WT和WT中NADPH氧化酶基因的表达g6pd5有或没有aba治疗。如图1所示。4, NADPH氧化酶的表达AtrbohD和AtrbohF在所有材料中,ABA处理显著增加,尤其是在g6pd5突变体(图。4a, b).这些结果表明G6PD5影响NADPH氧化酶的表达。相反,NADPH氧化酶的活性较高g6pd5比ABA处理下的野生型(图4c).这些结果表明,在aba处理的幼苗中,cy-G6PD参与了rboh依赖的ROS生成。为了证明这一假设,我们使用了NADPH氧化酶单突变体,ATRBOHD1(CS9555)和atrbohF1(CS9557)和双突变体atrbohD1 / F1.在这些突变体中G6PD5低于WT植物(图。4d)。
G6PD5增强抗氧化酶的表达
抗氧化酶对压力作出反应,清除额外的ROS,以维持ROS产生和清除之间的平衡[19].为了研究G6PD5对抗氧化酶的转录和活性的影响,我们测定了抗氧化酶的活性和表达水平,包括APX型和GR..结果表明,aba诱导的活性和表达水平APX型和GR.(无花果。3.c)在g6pd5突变体明显低于野生型。相反,表达水平APX型和GR.OE株系中含量高于WT株系(图2)。3.这些结果表明G6PD5增强植物在ABA处理下清除过量ROS的能力,维持ROS产生与清除之间的平衡。增强的G6PD5活性为抗氧化系统提供更多的NADPH来清除多余的ROS。
进一步分析表明,外源施用抗坏血酸(ASC)或谷胱甘肽(GSH)可部分或完全挽救种子萌发和根系生长缺陷g6pd5突变体(图。3.E)。值得注意的是,GSH比ASC(图更有效。3.f).因此,G6PD5参与了H的降低2O2到H2Ø在谷胱甘肽过氧化物酶周期和抗坏血酸 - 谷胱甘肽循环两种。
G6PD5影响ABA生物合成和分解代谢的基因
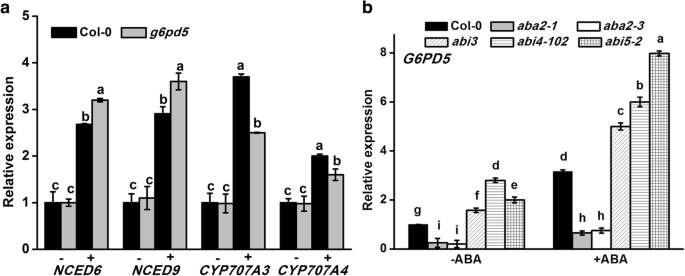
ABA作为一种胁迫激素,在许多胁迫反应中具有关键的调节功能[19,42].为了确定G6PD5在ABA代谢中的作用,我们分析了野生型和野生型ABA生物合成和分解代谢相关基因编码酶的表达g6pd5植物。qRT-PCR结果显示ABA生物合成基因(NCED6和NCED9)具有更高的表达水平g6pd5ABA处理下突变体比野生型突变体(图6a)相反,分解代谢基因CYP707A3和CYP707A4的表达水平明显较低g6pd5突变体比野生型(图。6一种)。该结果表明,G6PD5是参与基因的ABA代谢的表达调控。
G6PD5抑制aba信号通路
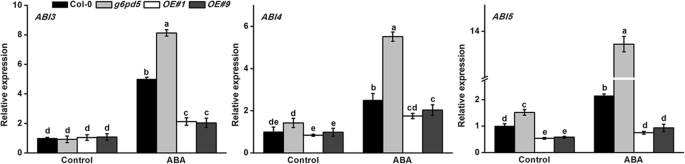
ABA信号转导基因参与调控种子萌发和根系生长[43].种子萌发缺陷g6pd5种子强烈表明ABA的参与。我们研究了ABA信号转导相关基因表达的差异是否与过敏性反应有关g6pd5阿坝(无花果。5).我们检测了ABA信号基因的表达ABI3,ABI4,ABI5.定量RT-PCR结果显示WT和之间观察到在这些ABA调节的基因的表达即显著差异g6pd5突变体植物(图。5).的转录水平ABI5在突变体植株中显著诱导(与WT相比增加了6倍),表明G6PD5可能作用于这些基因在ABA信号通路的上游。我们也检测了表达水平G6PD5在ABA缺失突变体(aba2-1,aba2-3)及aba反应突变体(abi3,abi4 - 102,ABI5-2).结果表明G6PD5aba缺陷突变体的表达水平(aba2-1,aba2-3)的表达水平明显低于野生型,而aba应答突变体的表达水平明显低于野生型G6PD5显著高于野生型(图。6b)。
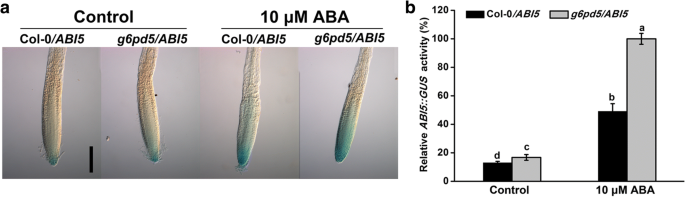
确认ABI5的表达水平g6pd5变种人,我们越过了g6pd5具有col0植株的突变体ABI5:格斯(Col /ABI5植物)。我们获得了纯合g6pd5植物窝藏ABI5:格斯(g6pd5/ABI5植物)和比较ABI5表达在坳/ABI5和g6pd5/ABI5苗(无花果。7).5天g6pd5/ABI5幼苗的根尖QC相对于Col/呈现强烈的蓝色ABI5添加或不添加ABA处理(图。7).这些结果证实了更高ABI5表达水平g6pd5幼苗,表明G6PD5可能参与ABA信号传导的调节。
G6PD5参与aba抑制根分生组织和伸长区细胞的伸长
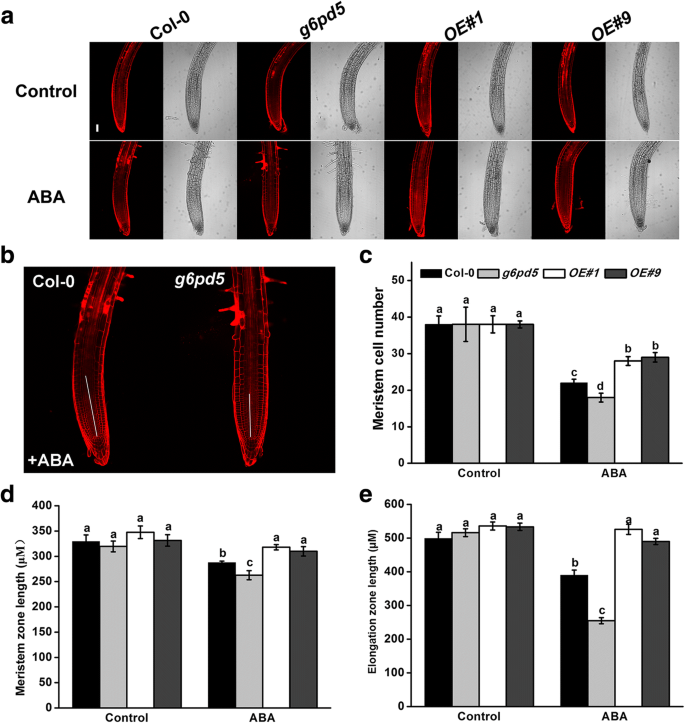
进一步探讨G6PD5在aba抑制根生长中的作用机制拟南芥,我们测量了WT和g6pd5在ABA提供的1/2 MS媒体上生长的突变体。在无ABA的培养基上类似于WT和突变体的根生长(图。8a).然而,当在含aba的培养基上生长12 h时,g6pd5与野生型相比,突变体植株的根伸长区显著缩短(图2)。8a, e).这些结果表明ABA抑制了细胞的伸长g6pd5根。除了伸长区中的细胞伸长外,根系分子区中的细胞分裂也有助于根生长。因此,我们检查了根顶部公司的大小。分子区的长度和细胞数g6pd在ABA存在的情况下,突变体植株比野生型植株少(图。8a-d),提示根分生组织的细胞分裂需要G6PD5。
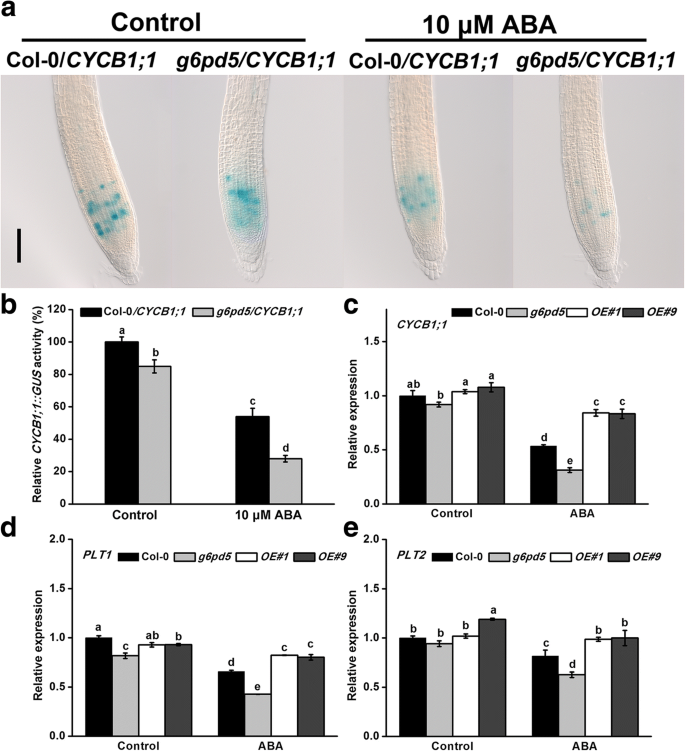
此外,我们发现细胞周期b型细胞周期蛋白CYCB1解释了在g6pd5ABA处理下突变体(图。9).为了进一步研究G6PD5在ABA条件下的保护机制,我们首先检测了G6PD5的表达CYCB1基因的g6pd5突变体和WTCYCB1ABA处理降低了幼苗生长,尤其是g6pd5突变体(图。9c).接下来,我们使用细胞周期标记线CYCB1; 1::格斯观察到这个纯合子g6pd5植物窝藏CYCB1; 1::格斯(g6pd5/CYCB1; 1植物)有较弱的蓝色着色比的Col-0 /CYCB1; 1在ABA处理下的根分生组织中(图2)。9a, b).基于以上结果,我们得出G6PD5参与了该基因的转录调控CYCB1在此过程中,G6PD5通过参与初生根ABA处理下CYCB的积累而发挥关键作用。
G6PD5参与ABA缺失或存在时的细胞分裂。一个表达式CYCB1; 1::格斯在Col-0 /CYCB1; 1和g6pd5/CYCB1; 1幼苗在添加或不添加ABA处理12 h的情况下生长5 d。比例尺,200 μm。bGUS活性的定量分析CYCB1; 1::格斯幼苗。Col-0/CYCB1; 1根调整为100%。C-ê相对转录水平CYCB1, PLT1和PLT2在WT (Col-0),g6pd5突变体和OE.有或没有ABA处理的株系植株。数据以三个独立实验的平均值±SD表示。采用单向Duncan检验,不同小写字母表示差异有统计学意义(P< 0.05)。该实验得到相似的结果重复至少3次,并且从一个代表性实验的数据被呈现
根分生组织的活动由根分生组织特异性基因调控,其中,PLETHORA (PLTs)基因是根发育的主要调控因子[44].PLT1和PLT2主要是QC中的局部化,并在根顶部分页(RAM)中冗余调节根茎茎细胞Niche [44].我们研究了野生型和野生型中ram相关基因的表达g6pd5.结果表明表达水平PLT1和PLT2在被降下g6pd5突变体与野生型相比,ABA处理(图。9d,e)。这些发现表明,G6PD5在ABA存在下对RAM维护至关重要。
讨论
到目前为止,已有多项研究报道G6PDs在植物发育过程中及在对压力作出反应时[11,37].Cy-G6PD作为OPPP调控步骤中的主要异构体,参与调控耐盐期细胞的氧化还原平衡[11,37].因此,Cy-G6PD在提高几种植物对环境胁迫的耐受性方面发挥了积极作用[23,45].在本研究中,我们研究了G6PD5参与的反应拟南芥在种子萌发和根系发育过程中ABA含量的变化。结果表明,在ABA处理下,G6PD5在种子萌发和幼苗发育中起重要作用。种子发芽率的变化g6pd5与WT相比,ABA处理下的突变体减少了约50%,暗示G6PD5在植物发育和ABA响应中具有关键功能(图。2a, b).相比之下,g6pd6与野生型相比,突变体种子在ABA处理下萌发不明显。1a - c)。这些结果表明G6PD5比扮演更重要的角色G6PD6在拟南芥种子发芽。这g6pd5与野生型相比,突变体的种子发芽率严重降低,主根缩短,ABA浓度增加G6PD5对ABA处理有反应?我们发现ABREs在启动子区G6PD5但不是在G6PD6(附加文件1:表S2)。
在有利条件下,ROS,如H2O2超氧阴离子和羟基自由基,是在低浓度下在质膜,叶绿体,线粒体和过氧化物酶体[制造46].ROS不仅是由于其物理化学毒性而一直存在的危险,而且是在许多应激条件下积累的重要信号分子[11,19].以前的报告显示h2O2在干旱诱导的G6PD总活性增加中发挥作用[11].因此,我们检验了H2O2在G6PD5ABA处理下。我们证实了在g6pd5活性氧来源于NADPH氧化酶AtrbohD和AtrbohF,在胁迫抑制的水稻主根生长中起重要作用拟南芥[22].进一步的研究表明,aba诱导H2O2NADPH氧化酶活性增强。为了巩固这一观察结果,我们检测了抗氧化酶的活性和转录水平g6pd5和WT植物(图。3.这些结果表明G6PD5增强以清除ABA治疗下的过度RO,以维持ROS生产和清除的平衡。结果还表明增强的G6PD5活性为抗氧化系统提供更多NADPH以除去过多的ROS。减少H.2O2到H2O可以通过谷胱甘肽过氧化物酶循环或抗坏血酸-谷胱甘肽循环来实现。
ABA在植物发育和适应多种胁迫反应中发挥着核心作用[19,47,48].ABI3已被认为是种子休眠和ABA种子萌发的主要调节因素[39,49].ABI5函数的下游ABI3并促进休眠协力ABI3[39,43,50].此外, ABI5通过激活活性氧来调节体内平衡过氧化氢酶1种子萌发过程中的转录[28].过氧化氢酶1是ABA信号的关键正调节因子,参与介导种子萌发和随后的主要根本建立[51].机械调查揭示了与ABI5相互作用的其他重要调节剂,以微调种子萌发[51].ABI4是否参与氧化还原调节和氧化挑战拟南芥叶子(39,43].有趣的是,成绩单水平ABI3,ABI4,ABI5增加了g6pd5突变体(图。5).这表明G6PD5可能在ABA信号通路中的这些基因的上游作用。这g6pd5与wt相比,突变体表现出对ABA的敏感性较小。我们的结果表明,我们的结果表明萌发缺陷g6pd5突变体是由阿比基因,特别是ABI5.
此外,ABA对主根生长的抑制是通过ABA诱导的调控CYCB1在G2 / M检查点处的表达[22,52].植物对主根生长的反应机制之一是调控细胞周期相关基因的表达。我们发现CYCB1ABA处理后g6pd5突变体苗(无花果。9).因此,我们建议G6PD5是参与的转录调控CYCB1ABA治疗下的基因。当然,通过调节表达水平,G6PD5对于ABA存在的RAM维护至关重要PLT1和PLT2(无花果。9d,e)。
结论
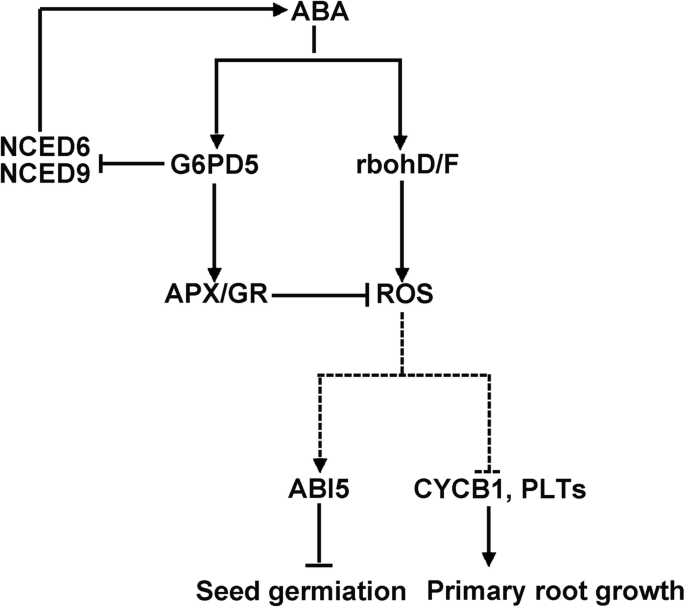
结果表明,ABA、H2O2aba诱导需要APX、GR和ABIG6PD5基因的功能。我们的发现指向了这种串音的一个不同的节点,它是由细胞质G6PD5的增加激活的,参与了休眠和发芽控制。基于这些结果,以及之前报道的结果,我们提出了一个假设模型,如图所示。10.在这个模型中,ABA诱导G6PD5,随后抑制H2O2通过激活种子和根系中的NADPH氧化酶产生ABA。增强的G6PD5通过NADPH参与ASC-GSH循环中关键酶(APX和GR)的调控。增强的抗氧化能力有助于维持H的稳定水平2O2从而避免活性氧对植物细胞的损伤。在ABA存在的情况下,G6PD5通过调节表达水平对RAM的维持至关重要CYCB1,PLT1和PLT2。此外,G6PD5在ABA治疗后,影响ABA生物合成和分解代谢的基因G6PD5可能是上游的行为阿比ABA信号通路中的基因。
缩写
- 阿坝:
-
脱落酸
- ABI:
-
脱落酸不敏感
- APX:
-
抗坏血酸盐过氧化物酶
- AsA:
-
抗坏血酸盐酸
- Cy-G6PD:
-
胞质glucose-6-phosphate脱氢酶
- CYP707A:
-
Aabscisic酸羟化酶8”
- 轻拍:
-
3,3'-二氨基苯甲酸
- G6PD:
-
Glucose-6-phosphate脱氢酶
- 格:
-
谷胱甘肽还原酶
- 谷胱甘肽:
-
谷胱甘肽
- H2DCF-DA:
-
Dichlorodihydrofluorescein二乙酸
- H2O2:
-
过氧化氢
- 电视台:
-
氮蓝四唑
- nc:
-
9-cis-epoxycarotenoid加双氧酶
- 购买力平价:
-
磷酸戊糖途径
- ROS:
-
反应性氧气
参考文献
- 1.
Bowsher C,Hucklesby D,emes M.亚硝酸盐降低和碳水化合物代谢在Pisum Sativum根系中纯化。Planta。1989; 177:359-66。
- 2.
Cardi M,Chibani K,Cafasso D,Rouhier N,Jacquot JP,Esposito S.脱离酸对大麦的活性和表达(Hordeum Vulgare.)质体葡萄糖-6-磷酸脱氢酶。中国生物医学工程学报。2011;62(11):4013-23。
- 3.
大麦根中谷氨酸的合成:可塑性葡萄糖-6-磷酸脱氢酶的作用。足底。2003;216(4):639 - 47岁。
- 4.
Hutchings D, rawthorne S, Emes MJ。油菜胚胎发育过程中脂肪酸合成及氧化戊糖磷酸途径(芸苔属植物。).[J] .中国生物医学工程学报。2005;56(412):577-85 .]
- 5.
磷酸戊糖氧化途径:结构与组织。植物学报。2003;6(3):236-46。
- 6.
沙伊贝R.马拉特阀平衡细胞能量供应。physiol植物。2004; 120:21-6。
- 7.
卡尔迪男,CASTIGLIA d,费拉拉男,Guerriero的G,Chiurazzi男,盐胁迫的原因基础代谢的大麦根导流Esposito的S的影响:可能不同的角色为葡萄糖-6-磷酸脱氢酶的同种型。植物生理学Bioch。2015; 86:44-54。
- 8.
刘俊,王X,胡Y,胡W,毕Y.葡萄糖-6-磷酸脱氢酶起着大豆根在容忍了举足轻重的作用对干旱胁迫。植物细胞报道2013; 32(3):415-29。
- 9.
刘旭,魏伟,朱伟,苏磊,熊铮,周明,郑勇,周大东。组蛋白去乙酰化酶AtSRT1调控拟南芥的代谢通量和应激反应。摩尔。2017;10(12):1510 - 22所示。
- 10.
拟南芥叶绿体葡萄糖-6-磷酸脱氢酶G6PD1与胞质中G6PD4的半胱氨酸依赖相互作用。植物j . 2011; 66(5): 745 - 58。
- 11.
王浩,杨玲,李勇,侯军,黄俊,梁伟。ABA-与H的关系2O2-依赖胞质葡萄糖-6-磷酸脱氢酶在维持干旱胁迫下大豆根系氧化还原稳态中的作用植物生理学报。2016;107:126-36。
- 12.
胁迫诱导的GSK3通过磷酸化葡萄糖-6-磷酸脱氢酶调控拟南芥的氧化还原胁迫反应。植物细胞,2012;24(8):3380 - 92。
- 13.
张志强,张志强,张志强,等。拟南芥葡萄糖-6-磷酸脱氢酶的全基因组分析。植物j . 2005; 41(2): 243 - 56。
- 14.
研究重金属对塑型葡萄糖-6-磷酸脱氢酶调控的作用机制。Sci众议员2018;8(1):13481。
- 15.
王华,侯军,李勇,张勇,黄俊,梁伟。高铝胁迫下大豆胞质葡萄糖-6-磷酸脱氢酶的研究进展。土壤植物。2017;416(1 - 2):一则。
- 16.
GSK3/ haggy-like激酶ASKa有助于模式触发免疫。植物杂志。2016;171(2):1366 - 77。
- 17.
长谷川P,Bressan的R,诸Ĵ,博纳特H.植物对高盐度细胞和分子的反应。Annu Rev植物植物植物Mol Biol。2000; 51:463-99。
- 18.
Kwak Jm,Nguyen v,Schroeder ji。反应性氧物种在激素反应中的作用。植物理性。2006; 141(2):323-9。
- 19.
Liu R, Liu Y, Ye N, Zhu G, Chen M, Jia L, Xia Y, Shi L, Jia W, Zhang J. AtDsPTP1在拟南芥种子萌发和幼苗建立过程中渗透胁迫信号的负调控作用。中国生物医学工程学报。2015;66(5):1339-53。
- 20。
活性氧:代谢、氧化应激和信号转导。植物学报2004;55:73 - 99。
- 21。
马丽丽,张辉,孙丽,张国栋,苗超,郝峰。NADPH氧化酶AtrbohD和AtrbohF在ros依赖性Na调控中的作用+/ K+盐胁迫下拟南芥的稳态。中国生物医学工程学报。2012;63(1):305-17。
- 22。
孙丽,王丽,张丽,刘波,李娜,苗超,郝芳。AtrbohD和AtrbohF对脱落酸抑制的主根生长的影响2+拟南芥根的信号转导和生长素反应。J Exp Bot. 2013;64(14): 4183-92。
- 23。
蓝底S,Nurcato R,德利洛A,伦蒂尼男,Grillo的S,埃斯波西托S.葡萄糖-6-磷酸脱氢酶发挥在番茄的响应中心作用(茄属植物lycopersicum)的植物短期和长期干旱。植物生理学报。2016;105:79-89。
- 24.
吉尔SS,Tuteja N.活性氧,并在作物抗逆抗氧化机制。植物生理学Bioch。2010; 48(12):909-30。
- 25.
Fujita Y, Fujita M, Shinozaki K, Yamaguchi-Shinozaki K. aba介导的植物渗透胁迫的转录调控。植物学报2011;124(4):509-25。
- 26.
含acgt的脱落酸反应元件的序列要求。植物生理学报。2002;43(1):136-40。
- 27.
Kashiwakura Y, Kobayashi D, Jikumaru Y, Takebayashi Y, Nambara E, Seo M, Kamiya Y, Kushiro T, Kawakami N.高耐发芽小麦籽粒表现出极端休眠和抗冷吸收的脱落酸积累。植物生理学杂志。2016;57(4):715-32。
- 28.
毕超,马勇,吴忠,余永涛,梁松,卢凯,王雪峰。拟南芥ABI5通过激活种子萌发过程中过氧化氢酶1的转录来调控ROS稳态。acta botanica sinica(云南植物学报),2017;47(1):1 - 4。
- 29.
关键词:拟南芥,低温诱导30 (LTI30),抗旱性,脱落酸敏感性,过氧化氢积累植物学报。2015;6:893。
- 30.
杨涛,张丽丽,郝华,张鹏,朱辉,程伟,王艳艳,王春华。拟南芥AtHSPR基因的核定位与抗氧化防御的关系。工厂j . 2015, 84(6): 1274 - 94。
- 31.
赵子,陈英克,张克。多粒子幼苗根尖中干旱诱导的脱落酸合成中反应性氧物质和一氧化氮的相互作用。AUST J植物理体。2001; 28(10):1055-61。
- 32.
夏志华,霍颖,魏勇,陈强,徐志华,张伟。拟南芥LYST互作蛋白5调控脱落酸信号通路和干旱响应。植物学报2016;7:758。
- 33.
南W,王X,杨升,胡Y,魏Y,梁X,毛L,碧Y.环GMP是拟南芥根系的生长和发育过程中参与生长素信号。J Exp Bot。2014; 65(6):1571至1583年。
- 34.
渗透胁迫下番茄ABA和乙烯介导的反应受TSS2和TOS1基因座调控。中国农业科学。2006;57(12):3327-35。
- 35.
梅y,jia wj,chu yj,xue hw。通过影响PIN蛋白的循环来调节极性养蛋白传输,拟南芥磷脂酰肌醇单磷酸三磷酸三酶2。细胞res。2012; 22(3):581-97。
- 36.
刘y,吴r,wan q,谢g,bi y.葡萄糖-6-磷酸脱氢酶在一氧化氮中对氧化胁迫下的氧化胁迫下的一氧化氮防御作用于氧化胁迫下的致态作用。植物细胞生理。2007; 48(3):511-22。
- 37.
王X,Ma Y,Huang C,WAN Q,Li N,Bi Y.葡萄糖-6-磷酸脱氢酶在调节盐胁迫下调节芦苇愈伤组织降低的谷胱甘肽水平方面发挥着重要作用。Planta。2008; 227(3):611-23。
- 38.
5 -羟色胺是一种在植物和动物中保存的由色氨酸衍生的信号,在拟南芥中可能作为一种天然生长素抑制剂调控根系结构。植物生理学杂志。2011;52(3):490-508。
- 39.
Chen C, Letnik I, Hacham Y, Dobrev P, bendaniel BH, Vankova R, Amir R, Miller G.抗坏血酸过氧化物酶6 (ASCORBATE PEROXIDASE6)保护拟南芥脱水和发芽种子免受胁迫,并介导活性氧、脱落酸和生长素之间的交互作用。植物杂志。2014;166(1):370 - 83。
- 40。
萨拉特·G,侯G,贝尔德LM,米切尔RB。活性氧,ABA和暖季型C4-草发芽一氧化氮的相互作用。Planta。2007; 226(3):697-708。
- 41。
李志强,李志强,李志强。活性氧中间体O的合成2.-, H2O2,.玉米根系对OH的影响及其在细胞壁松动和伸长生长中的作用。acta botanica yunica(云南植物研究),2004;36(2):114 - 23
- 42。
脱落酸:核心信号网络的出现。植物学报2010;61:651-79。
- 43。
Lopez-molina L,莫兰兰德S,Mclachlin dt,Chait Bt,Chua NH。ABI5在ABI3的下游起作用,在发芽期间执行ABA依赖的生长停滞。工厂J. 2002; 32(3):317-28。
- 44。
Galinha C,Hofhuis H,Luijten M,Willimsen V,Blilou I,Heidstra R,Scheres B.血清蛋白作为拟南芥根系的剂量依赖性校长。自然。2007; 449(7165):1053-7。
- 45。
葡萄糖-6-磷酸脱氢酶的同工酶替代提高了植物的抗逆性。中国科学(d辑:地球科学)2009;106(19):8061-6。
- 46。
周伟,周涛,李明明,赵春林,贾宁,王XX,孙永忠,李国良,徐敏,周荣刚,等。拟南芥的j蛋白AtDjB1通过保护细胞免受热诱导的氧化损伤来促进耐热性。新植醇。2012;194(2):364 - 78。
- 47。
植物的渗透信号:新出现的激酶家族介导的多种途径。植物杂志。2005;138(3):1185 - 94。
- 48.
钟C,徐H,叶S,汪S,李力,张S,王X.赤霉素刺激Arabidopsis6作为赤霉素,脱落酸,和葡萄糖信号在拟南芥种子萌发过程中的积分。植物理性。2015; 169(3):2288-303。
- 49.
Bentsink L,Koornneef M.种子休眠和发芽。拟南芥书。2008; 6:E0119。
- 50.
ab5与水稻原生质体中脱落酸信号效应子的相互作用。中国生物化学杂志。2002;277:1689-94。
- 51.
拟南芥VQ18和VQ26蛋白与ab5转录因子互作对ABA的负调控作用。植物j . 2018; 95(3): 529 - 44。
- 52.
拟南芥主根对盐胁迫响应的细胞周期调控。植物杂志。2004;135(2):1050 - 8。
确认
没有任何。
资金
国家自然科学基金(no . 31671595;甘肃省农业生物技术研究与应用发展计划项目(GNSW-2016-23)、中央高校基本科研业务费专项资金(lzujbky-2017-kb05)、兰州市科技计划项目(2015-3-53)、青海省科技厅项目(2016-ZJ-Y01)资助青海大学高原生态与农业国家重点实验室开放项目(201 -KF-05);资助机构在研究的设计、数据的收集、分析和解释以及手稿的撰写中没有发挥任何作用。
数据和材料的可用性
本研究中生成和分析的数据集可根据需要由通讯作者提供。
作者信息
隶属关系
贡献
构思和设计的实验:LY,YB,XW。所进行的实验:LY,SW,MR,LS,SL,RH,WZ和CL分析数据:LY写文章:LY。所有作者审查并同意最终的文本。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
额外的文件
额外的文件1:
表S1。引物序列。图S1。ROS水平g6pd5和OE.行。1日龄种子在添加10 μM ABA的1/2 MS琼脂平板上垂直生长6 h。H2DCF-DA荧光的拟南芥与ABA治疗的种子。图S2。H2O2和O2-水平g6pd5和OE.行。5日龄幼苗在添加10 μM ABA的1/2 MS琼脂平板上垂直生长6 h。表S2。Cis-acting的启动子区确定的调控元件G6PD5和G6PD6.在线搜索工具PlantCARE用于检测推定cis-acting监管要素。(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/).(医生610 kb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
杨磊,王绍平,孙磊。等等。植物种子萌发和根系生长过程中G6PD5对ABA的响应拟南芥.BMC植物杂志19,44(2019)。https://doi.org/10.1186/s12870-019-1647-8
收到了:
接受:
发表:
关键词
- 脱落酸
- 发芽
- Glucose-6-phosphate脱氢酶5
- NADPH氧化酶类
- 反应性氧气
- 根系统架构