抽象的
背景
葡萄叶片为浆果的发育提供了生化底物。因此,了解葡萄叶片代谢的调节可以帮助识别果实发育和浆果质量的基本过程。在此,我们监测了在充足灌溉和水分亏缺条件下生长的梅洛葡萄植株从veraison到收获期间叶片代谢的时间变化。
结果
藤本植物逐渐介导了水分胁迫,并涉及多种策略:渗透调节、转录代谢物改变和叶片脱落。初始气孔导度和叶片水势急剧下降,同时受到胁迫相关代谢的诱导,如脯氨酸、GABA代谢和胁迫相关糖的上调,以及发育过程的下调。随后,土壤逐渐干燥与Ca的贡献增加有关2+最后,在叶片脱落后的渐进胁迫条件下,在收获时,测量了叶片水势的增量变化,同时叶片代谢的扰动幅度减小。
结论
数据本证据表明,随着时间的推移葡萄驯化对水分胁迫多样化颞响应包围中心代谢和基因表达,渗透调节和减少在叶面积的改变。这些过程一起减轻叶片水分应力并有助于维持浆果熟程序。
背景
全球气候的变化预计将加剧全球干旱的发生[1那2].基于气候模型的预测表明,全球平均气温正在上升[3.那4.].季节性干旱和夏季高温已越来越多地影响着葡萄种植产业在全球范围,由于水资源短缺和葡萄生长,产量和质量[之间的负相关5.那6.那7.那8.那9.那10.].考虑到世界上三分之二的葡萄种植区年降雨量低于700毫米,即低于作物的充分蒸散量,这种趋势意味着严重后果[11.].小道消息(葡萄L.)被认为适合Mediterranean,如气候[12.].葡萄藤在应激条件下通过新陈代谢和细胞生理学的重新编程来调节其细胞内稳态[8.那10.那13.那14.那15.那16.那17.那18.那19.那20.那21.那22.,渗透调节[23.那24.]提高活性氧耐受性[25.那26.前人对全株水平胁迫反应的研究表明,水分胁迫诱导的叶片脱落在叶柄空化发生之前,茎空化发生[27.].在这方面,葡萄叶柄比茎更容易受到干旱引起的栓塞[28.],导致在切割压力条件下叶脱落。
尽管最近有许多关于葡萄藤对压力的反应的研究(由[29.那30.]),很少有人在田间探索叶片对胁迫的长期分子适应[31.那32.].据推测,生理适应的缓解水分亏缺的效果,并允许植物生产力[23.那33.].我们之前关于梅洛葡萄的报告显示,不充足的灌溉导致了浆果代谢的改变[34.].在这里,结合植物生理学、代谢组学和RNAseq分析,我们描述了梅洛葡萄植株叶片对季节性干旱的响应。
结果
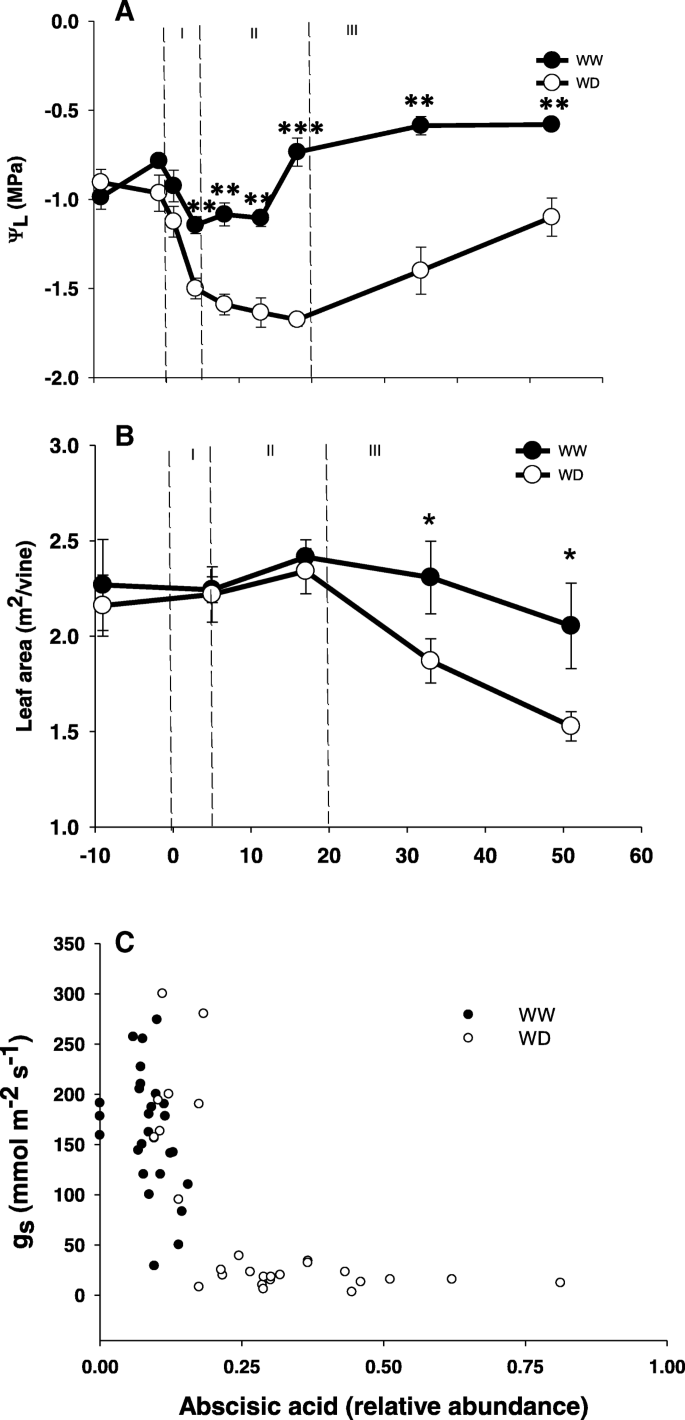
梅洛葡萄叶片代谢和生理反应在长期亏缺灌溉期间表现出不同的时间变化模式:(1)在第1天(即0 ~ 5 DAT),叶片的代谢和转录程序发生了迅速的变化,同时气孔导度和叶片水势也急剧下降(图2)。1一),(2)的瞬时沉降叶生理记录,即叶水势达到低稳态水平(即5-20 DAT);(3)在总叶面积(图的逐渐降低。1b)和导致叶片渗透调节的渗透渗流的增加的积累伴随着叶水潜力的变化变化的反向模式和代谢扰动的减少。该时期称为应力松弛期(SRP,从20个DATWAY)。下面详细描述了以下三个主要时间模式。
叶片液压和渗透调节
气孔导度显著降低(gS.)观察已经从内充分灌溉拼版4天(附加文件1:表S1)。与土壤含水量的减少相关[23.]水气孔电导胁迫葡萄藤最终达到第8天的最低点,然后留在此水平(15-20mmol H.2Ø米- 2年代- 1)(额外的文件1:表S1A)。g的减少S.在“严重”水分胁迫条件下,叶片脱落酸(ABA)含量相应增加(图2)。1c).叶片水势(ΨL.)exhibited three distinct temporal pattern of changes across the stress period: a progressive decline from − 0.9 MPa to − 1.6 MPa within the very first days of the experiment (Fig.1a),其次是在第20天( - 1.6最高-1.67MPa)的稳定低值( - 1.6至1.67MPa),最后在对收获反应的第三阶段逐渐增加至1.1MPa。
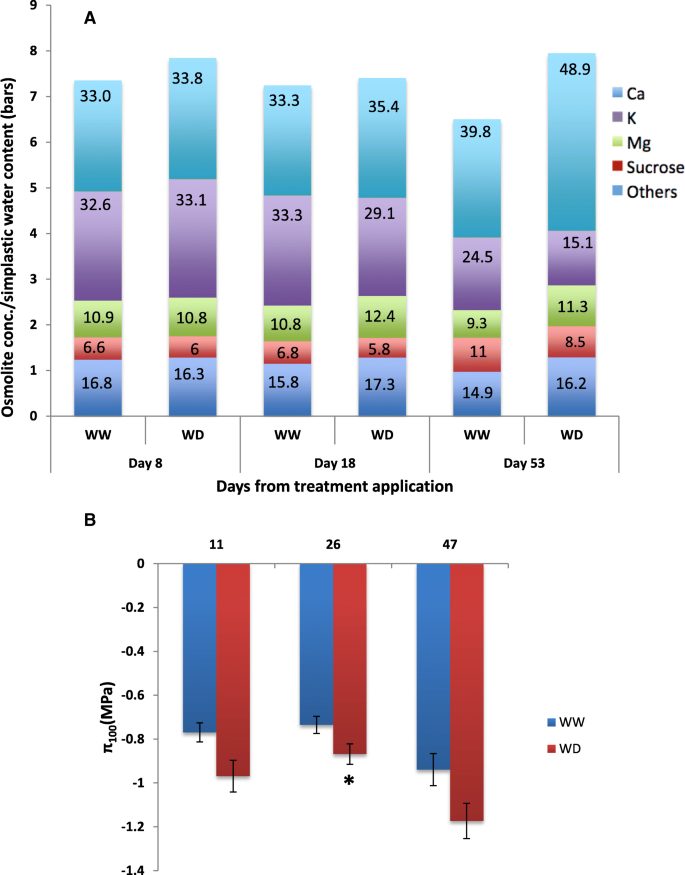
水分亏缺藤叶片在满膨压(−1.17 MPa)下的负渗透势大于对照植株(−0.94 MPa)(图2)。2b)中可能是由于溶质的浓度较高(图2一个)。随着压力的进展,k的作用+在渗透调节过程中,钙的贡献率由处理第8天的33.1%下降到处理第53天的15%2+和蔗糖从33.8%分别增加至48.9和5.9至8.9%,在上述天(图2a).实验结束时,矿物离子Ca2+K+和米格2+贡献48.9,15和11.3%,分别为WD叶中的Osmoregulation,然后是糖(8.6%)(图。2一个)。
降低叶片蒸腾和代谢重组:响应所述的第一个线,以充分灌溉
从亏缺灌溉开始的前20天,出现了较大的代谢紊乱。4 DAT时,叶片代谢受到显著干扰(附加文件)2:图S1),并在所测量的代谢物的40%含量的变化,后面是一个中间阶段,其中的变化在约25%相关联沉降到在叶生理学减少改变(如上所述)。
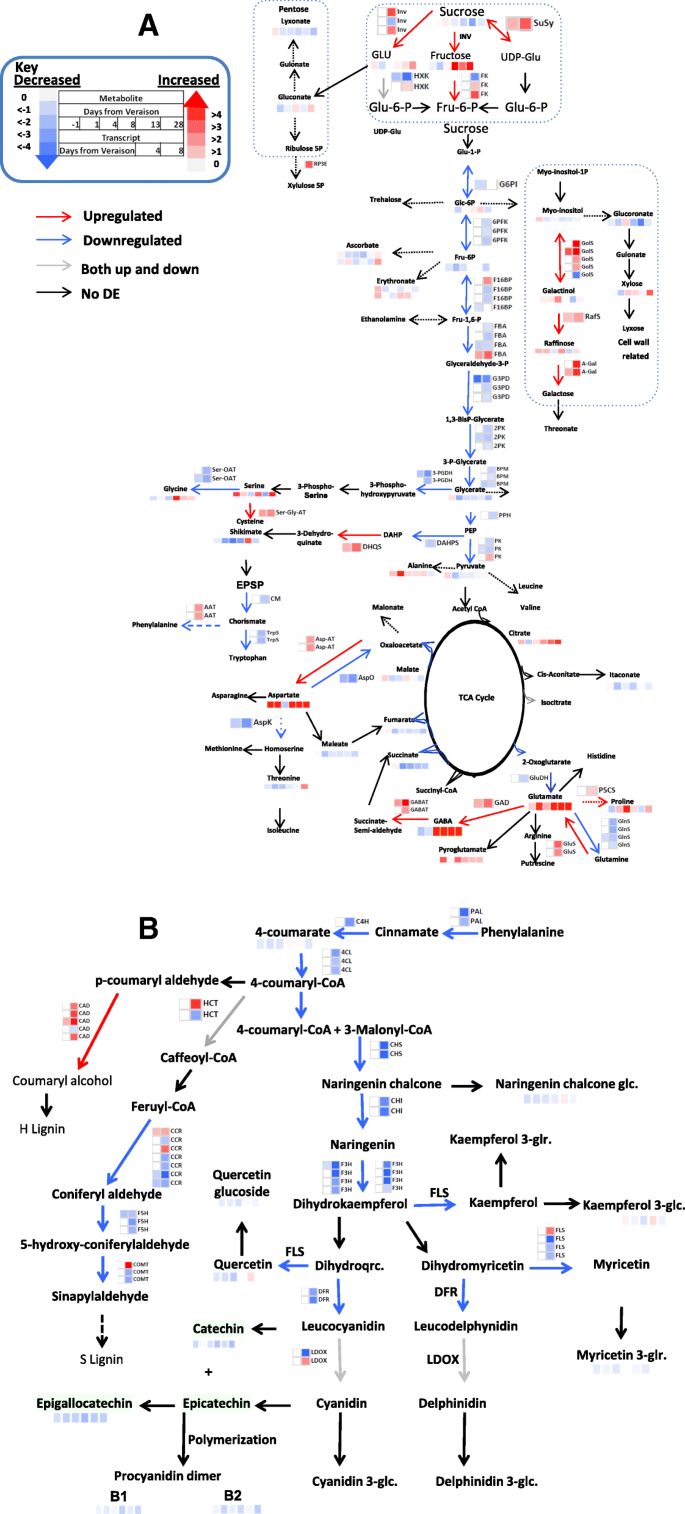
在水胁迫葡萄藤中,氨基酸显示出对应力的反应的重大变化,遵循不同的变化模式。首先,测量甘氨酸(1.23倍)和γ氨基丁酸(GABA)(GABA)(1.56倍)在应激(前4天)期间的降低。在中期期间,记录苏氨酸(2.2倍),谷氨酸(2倍),脯氨酸(+ CO 2)(3.5倍)和焦蛋白(1.8倍)的瞬时增加。延长的水胁迫条件(第20天后)引起了GABA(高达17倍),亮氨酸(2倍)和天冬氨酸(高达4.5倍)的强烈逐渐增加(图。3.一个)。
几乎所有的注释的糖类,除肌醇半乳糖苷和棉子糖的,显示期间响应于所述应力的第一阶段的显着降低特别是在4 DAT,这可能是由于减少了净光合的结果[34.].相反,在整个实验中累积的应力相关的低聚糖,半乳糖醇(高达1.5倍)和奖石(高达1.5倍)。The intermediate phase was characterized by a progressive decline in the level of sucrose (2-fold), but a reversed pattern of change of sucrose derived sugars, e.g., glucose (up to 1.4-fold) and fructose (up to 2-fold) which increased in relative content from 8 DAT onwards (Fig.3.一个)。在水中的渐进增加柠檬酸的水平(高达2倍)强调葡萄藤物时的应力的晚期初期,中期和还测量。与此相反,大多数的其它有机酸所表现出的中间(第8天和13)和应力(图的晚期阶段期间一般轻度减少。3.一个)。
在黄酮类化合物中,只有少数被胁迫改变。黄烷醇,如表儿茶素和表没食子儿茶素,以及莽草酸途径的中间体莽草酸,在实验期间持续下降(图)。3.A和B;附加文件1:表S2),但整体减少水平仍然温和。类似于在有机酸中观察到的模式,大多数羟基氨基甲酸酯化合物(肉桂酸酯(4-羟基),肉桂酸酯(3-羟基),肉桂籽(CIS),咖啡因(反式),Qualine(3-Caffeoyl CIS)),Kampferol(+ H2)磷酸在早期应力期间显示出明显的减少,然后在后来的压力阶段略有增加(附加文件1:表S3)。
应力松弛时间(20 DAT起)的特点是在葡萄树总叶面积的减少(由比对照葡萄藤28.6%)(图1b)在亏灌溉植物。因此,藤通过减小蒸发表面,使水电位的增加提高了其水平衡,重温代谢应激的迹象[34.那35.].
水分亏缺对叶片转录本的影响
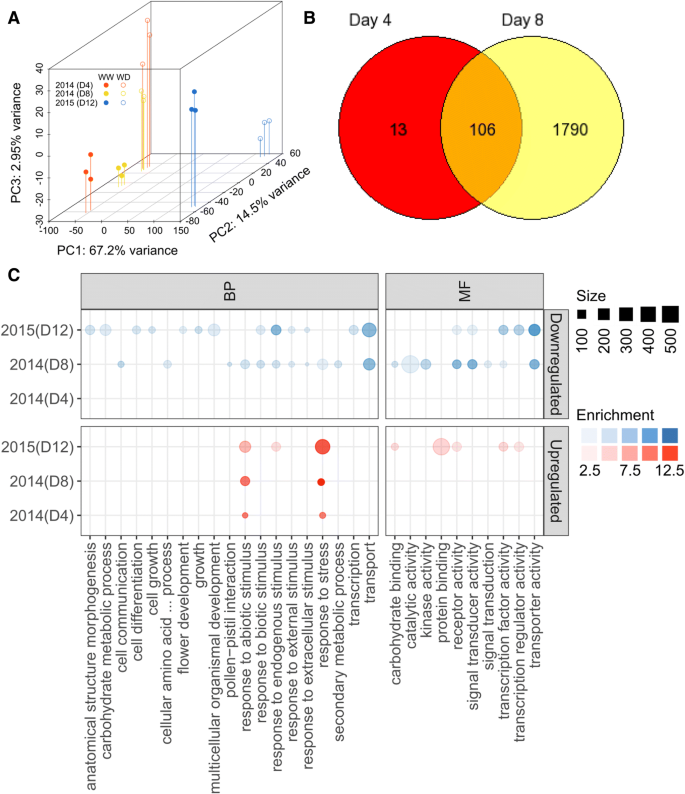
使用RNASEQ分析,平均为14.8和29.0百万单端读数分别在2014(4和8日)和2015(12个DAT)的测序样本中成功对齐并概述(附加档案1:表S4)。使用整个表达的转录本数据集生成的PCA图(附加文件1表S5)显示出第二主成分(PC2)中水分亏缺处理的明显分离(约15%的变异),尽管PC1的大部分变异(约67%)是由年份(2014 vs 2015)的差异造成的(图5)。4.一个)。这不是出乎意料的,因为葡萄园基因型X环境实验最近的转录组洞察面表明,发育阶段和复古条件是影响至少在浆果中的转录变异的两个关键变量[36.].这样,PC1中观察到的大变化可能是由于两葡萄园的高潮参数的差异。
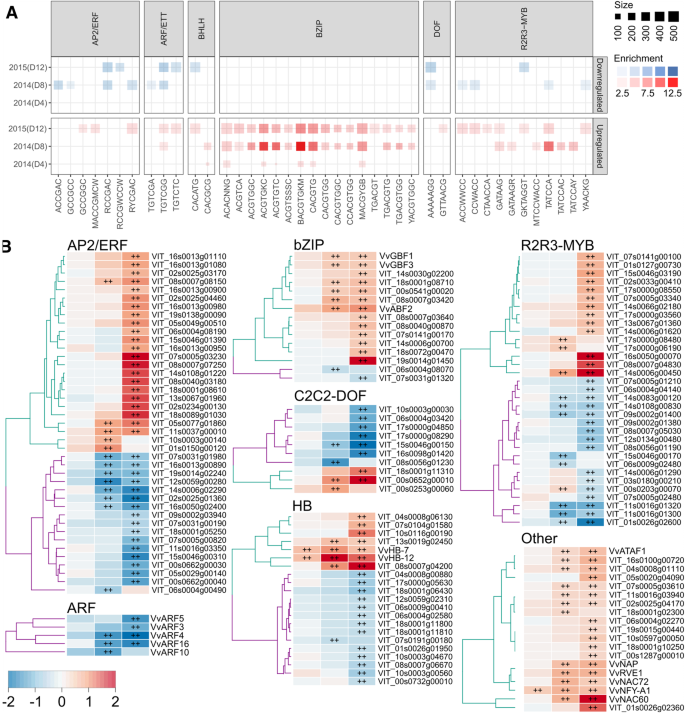
水分充足和水分亏缺条件下梅洛葡萄植株的叶片转录特征一种)实施赤字灌溉后第4天(D4)、第8天(D8)(2014)和第12天(D12)(2015)转录本变化的PCA。填充圆圈表示WW和开放圆圈WD治疗。B.)维恩图,代表第4天、第8天(2014)和第12天(2015)总DE (FDE < 5%, |log2Fc|≥1)基因中常见和唯一的基因。金色、红色和蓝色分别是第4天、第8天(2014)和第12天(2015)。C(2014)第4天、第8天(2014)和第12天(2015)与DE基因(FDE < 5%, |log2Fc|≥1)相关的苗条生物过程(BP)和分子功能(MF)项富集植物基因本论综述。每个圆的大小和不透明度分别表示每个富集类别的基因数量和富集得分(−log10(FDR))。大圈表示每个类别有更多的基因。蓝色(下调)和红色(上调)的不透明度越深,富集值越强,反之亦然
尽管如此,数据点的更大的分散时藤蔓暴露于较长的水分亏缺(图仍然观察到。4.a),反映基因差异表达程度(FDR < 0.05;> 2倍变化),即2014年第4天和第8天分别有119 1896个基因(附加文件1:表S6 - S8)。当比较每一列deg时,两种采样时间下共有106个DE基因转录本(图1)。3.b、 附加文件:表S9)。第4天和第8天DAT分别有13个和1790个特异性。在与早期应激反应(4 DAT)特异的13个基因中,VIT_11s0052g01650(信号通路)、VIT_16s0022g00890(细胞壁代谢)、VIT_06s0004g05020(乙醛酸和二羧酸代谢)、VIT_07s0031g00920(肌醇,磷酸盐代谢)VIT_04s0008g07110(天冬氨酸代谢)和VIT_15s0046g01560显示出WD的调节作用,而其他七个基因VIT_12s0028g02200(核黄素代谢)、VIT_06s0061g00100(淀粉和蔗糖代谢)、VIT_05s0049g00930(无机磷酸盐转运体)、VIT_08s0007g01940(甘油脂质代谢)、VIT_17s0053g00070(金属烟草胺转运体)、VIT_12s0059g01400(酪氨酸特异性蛋白磷酸酶)和VIT_03s0017g02110(花青素生物合成)因水分亏缺(WD)而下调4.C为不同代表类别的基因本体富集分析。早期应激期(第4天)主要导致刺激感知相关反应的激活。随着胁迫的进展,包括对非生物刺激的反应、对胁迫的反应、对内源刺激的反应、与细胞死亡相关的细胞过程和对生物刺激的反应等一系列应激相关转录本被强烈诱导。
在代谢基因中,参与蔗糖代谢的转录物在应激早期反应中表现出上调趋势(图。3.一个额外的文件1:表S6 - S8)。编码蔗糖转化为葡萄糖的基因转录本,转化酶(VIT_05s0077g00510 2倍,VIT_13s0074g00720)果糖(蔗糖酶)和udp -葡萄糖(VIT_07s0005g00750 1.7倍)在第1季的8 DAT和第2季的12 DAT的变化一致,同时糖酵解下游基因的减少。转录数据与观测到的收获过程中蔗糖水平的下降和次生糖的积累相匹配。值得注意的是,在试验的第4天,只有糖酵解途径的7个转录本受到水分胁迫的影响。
在PPP (penttose Phosphate Pathway)中,发现该通路不同步骤中涉及的三个转录本(VIT_01s0146g00060, VIT_14s0030g01900, VIT_15s0048g00370)在胁迫后期显著下调。磷酸核酮糖3-Epimerase (VIT_04s0043g00310),以其在缓解氧化应激中的作用而闻名[37.那38.],在另一方面,上调(2.5倍)下长时间水限制(第8天)(图3.一个额外的文件1:表S6 - S8)。TCA循环基因转录本在水分亏缺的前4 - 8天没有明显改变,与TCA中间体的总体轻微变化一致(图)。3.一个额外的文件1:表S6 - S8)。
除脱氢喹酸合成酶(DHQS)外,氨基酸代谢的变化主要表现在8 DAT。3.a).在shikimate途径中,chorismate synthase (CM)和tryptophan synthase (TrpS) 8 DAT的下调(1.6倍)与prephenate dehydratase (ADT/PDT)的上调(4.4倍)相结合,使prephenate的Phe分为两步(除了ADT/PDT - VIT_06s0061g01300)。
2014年,天冬氨酸转氨酶(AAT)转录本通常在8 DAT上调(图)。3.一个额外的文件1:表S3)。这与将Asp分解为草酰乙酸(OAA)的Asp氧化酶(AspO)和启动Met、Lys和Thr氨基酸生物合成的Asp激酶(AspK)的显著下调相结合,表明Asp水平的增加是由于其分解的减少。
谷胱甘肽相关转录物,谷氨酰胺合成酶(GLNS)(VIT_01S0011G02200,VIT_07S0104G00610,VIT_14S0006G00350,VIT_17S0000G01910)在8日下调节(2.1倍),而谷氨酸合成酶(GLUS)(VIT_16S0098G00290,VIT_15S0024G030)增加(2.4倍)(无花果。3.一个额外的文件1:表S6 - S8),在支持的Glu在2014年值得注意的是,谷氨酸脱羧酶(GAD,VIT_17s0000g00920)的积累,被上调(2.2倍)在8 DAT,与GABA水平的积累早一致如图4 DAT和GABA-T的诱导。
Glu衍生的应激氨基酸,与GABA一起积聚的脯氨酸,由酶Delta 1-吡咯啉-5-羧酸酯合成酶(VIT_13S0019G02360)合成,其伴随着下降 -调节的Pro降解在8日(图。3.一个额外的文件1:表S6 - S8)。
ABA生物合成的上调
水分胁迫下,ABA代谢的大量转录本在4和8 DAT均上调。例如,编码关键调节酶9-顺式环氧草酸二加氧酶(NCED, VIT_02s0087g00930和VIT_19s0093g00550)的三个转录本中的两个[39.]和ABAβ葡糖苷酶(VIT_17s0000g02680,水解共轭ABA葡萄糖至活性abscisate)(高达6倍)在4和8 DAT其中显著上调(附加文件:表S6,S7,S8),支撑所述在用水紧张的藤叶并发的更高水平的ABA(附加文件1:表S2)。另一方面,编码CYP707A的转录物,例如CYP707A。VIT_18S0001G10500和VIT_03S0063G00380(参与ABA分解代谢)在应力下显示了下调(2.3倍),表明其在水分胁迫下的较高积累可能是由于其诱导的生物合成和降低分解代谢。伴随地,对于三聚SNF1蛋白转录物编码激酶2-3 / AKIP / OST1(VIT_07s0197g00080),其参与控制气孔孔径干旱胁迫下[40那41.]在水分亏缺藤上表达上调5.7倍。
ROS代谢
在目前的研究中,我们观察到2014年在更长的水分压力期间差异表达的大量氧化应激相关基因(附加档案1:表S6 - S8)。甲基因转录物编码抗坏血酸过氧化物酶(VIT_08s0040g03150),酶参与H中2O.2去除,2014年8个DAT时上调,而另一个转录本(VIT_06s0004g03550)显示下调。此外,一个编码抗坏血酸脱氢十六烷酶的基因转录本(VIT_00s0317g00050和VIT_00s0317g00040),其催化二氢抗坏血酸返回抗坏血酸被上调。与此结果一致,随着水分胁迫时间的推移(8 DAT),相关抗坏血酸和脱氢抗坏血酸的积累是明显的(补充文件1:表S6 - S8)。我们发现了基因转录本(VIT_04s0008g06780和VIT_02s0025g03590 -谷胱甘肽过氧化物酶,VIT_07s0104g01400, VIT_07s0104g01420, VIT_14s0068g01570, VIT_14s0068g01570, VIT_18s0001g04600, VIT_10s0003g00390 - glutaredoxin, VIT_07s0130g00220, VIT_07s0130g00220, VIT_07s0130g00220,VIT_07s0130g00220 - Peroxidase_class_III)通常参与2014年应激后期上调的谷胱甘肽代谢(8dat)(附加文件1:表S6 - S8)。
水分胁迫下黄酮和木质素生物合成的变化
类黄酮途径的基因转录本和相关代谢物在WD下表现出普遍的轻微减少(图。3.b).苯丙氨酸解氨酶(PAL)编码基因中,VIT_06s0004g02620在胁迫后期下调(> 3倍)。花青素还原酶(ANR)的转录本(VIT_00s0361g00040)在8 DAT(> 4倍)高度下调,与苯丙素途径的代谢产物反应一致。vimybpa1 (VIT_15s0046g00170)是ANR和亮色花青素还原酶(LAR)的转录调节因子[15.],在8个DAT中显着下调(附加文件1:表S6 - S8)。在木质素生物合成中,编码羟基肉桂酰辅酶a莽草酸/奎宁酸羟基肉桂酰转移酶(hct)、肉桂酰辅酶a还原酶(CCR)和咖啡酸甲基转移酶(COMT)的转录本均被调节,呈现出混合模式的变化。与一般趋势相反,随着胁迫的进展,肉桂醇脱氢酶(木质素生物合成的倒数第二步)显著增加(图)。3.b、 附加文件1:表S6 - S8)。
丰富的顺式调控元件优先考虑干旱反应的转录调控因子
在植物中,aba依赖和aba独立的信号转导途径在很大程度上调节了对水分亏缺的转录反应[42.].在这项研究中,接近20%(437个基因)的所有预测葡萄藤转录因子[43.表示不同范围的TF族被显著调制(附加文件1:表S3 - S5)。我们观察到一致的富集响应所有主要的ABA(ABRE)和含ACGT元素,如ACGTGKC,BACGTGKM,MACGYGB和CACGTG,在缺水诱导基因的启动子(图5.一个额外的文件1:表S8)。在早期压力期(4个DAT)结束时已经观察到这些基序的富集,并且由于压力严重,在水缺陷诱导的基因启动子中富集更多的ABRE和相关元素。在许多干旱响应性Bzips中(例如GBF1,VIT_04S0023G01360; GBF3,VIT_15S0046G01440),当干旱严重时,高表达和一致地上调(> 4倍)的ABF2 /β1(VVABF2,VVABF2,VIT_18S0001G10450)的葡萄状同源物(图。5.一个额外的文件1:表S11)。脱水应答元件(DRE),用于调节干旱应答基因表达[另一个关键因素44.],在许多干旱下调基因中高度富集,但在上调基因中的程度较小。然而,在本研究中,ABA独立途径的主要调节器DREB1A / 2虽然观察到许多干旱响应AP2 / ERF的调节。与MYB的富集有关的结合位点也表现出类似的AP2 / ERF相关的CRES(图。5.一个额外的文件1:表S11)。然而,这些转录因子特别是ARFs的转录表达(例如ARF4, VIT_06s0004g03130;HBs(如HB-7, VIT_15s0048g02870, VIT_15s0048g02870, VIT_06s0004g02750, VIT_06s0004g02750;HB-12、VIT_02s0025g02590)在各应激期均上调(图2)。5.b、 附加文件1:表S11)。
讨论
工厂使用了几个协调的应对措施,以应付-了干旱胁迫[45].叶水势的衰落和气孔导度的后续下降和净光合[34.是众所周知的压力反应[9.那46],并因此用作葡萄水应力的灵敏的指标。目前的结果(图1一,表S1A)和我们以前的报道[34.将分子反应与这些生理指标联系起来。根据基于气孔的应力定义(中等50 < gS. < 150 or severe gS. < 50 mmol H2Ø米- 2年代- 1;[47])分子反应似乎主要发生在严重胁迫下,这在ABA水平上是显著的,只有当gS. < 50 mmol H2Ø米- 2年代- 1(无花果。1C)也在初级代谢修饰中,这在g时更为显著S.是最小的(附加文件2:图S1)。这些结果通过[48这种代谢损伤可能仅在严重的压力下进行,并且气孔闭合可以缓冲中等的水限制,而不会对葡萄葡萄的显着影响。
大多数分子反应只发生在gS.非常低,破坏了气孔闭合中分子信号的重要性。具体而言,它呼吁质疑ABA在G期间表现出稳定值的作用S.从300 mmol H降到100 mmol H2Ø米- 2年代- 1。两者都观察到相同的现象49] 和 [50支持水力信号关闭气孔而ABA是维持低g的重要因素的假设S.以下水势恢复。同样的假设也被最近的[的研究结果支持51结果表明,大部分气孔的下降调节可以用脱水过程中的膨压动态来解释。
其中一个有趣的结果在这项研究的是,叶子脱落介导的葡萄树的恢复处于生理和分子水平。例如,被标记的叶脱落事件之后,葡萄藤恢复叶水势和缓解代谢扰动的程度。作为一个可能的应力松弛器,这种机制将直接减少葡萄的蒸发表面,也可以在重定向同化物易位有助于从老叶到年轻的[52]渗透势与低叶水势和进行性叶片脱落相一致(图。2b)和溶质浓度(图。2a) 在胁迫后期表现出更为负值。众所周知,参与osmo调节的特定溶质种类因植物种类而异[53那54那55].有趣的是,我们发现钙是最重要的渗透石之一(约1/3的总渗透含量)。不同的,24.]据报道,钙离子占总渗透含量的比例不到10%,尽管他们发现在受胁迫的植物中,钙离子的含量增加了七倍。之前的研究表明,携带草酸钙离子的异胚细胞在植物体内积累葡萄属叶子(56]特别是在压力期间[57可能起到钙的储存/释放的作用,从而有助于叶片的渗透调节能力。在本研究中,较高的钙含量可以在很大程度上解释对照和水胁迫葡萄叶片渗透势的差异。钙离子在植物胁迫反应中发挥多种作用,如气孔关闭[58]、渗透调节、叶片膨压和细胞壁硬度[24.那59信号分子[60那61那62那63],提高植物的生物和非生物胁迫耐受性[64]和重金属的解毒[65].总体升高osmolite浓度特别的钙+这可能反映了它参与维持上述水分胁迫叶片的细胞过程。
压力期间代谢物水平的变化依赖于施加干旱的长度。转录和代谢组数据均表明Glu家族,GABA和脯氨酸的应力相关氨基酸的增加(图。3.一个)。第一个是GABA分流的一部分,一种将Glu连接到TCA周期的代谢途径[66]通过条目酶谷氨酸脱羧酶,其编码基因被提前时应力上调。第二参与抗氧化剂机械[67],作为渗透石[68].其积累在植物中的增量水赤字期间是常见的[51和其他葡萄品种[69]脯氨酸生物合成中的最终酶(P5CS:δ1-吡咯啉-5-羧酸合酶)介导1-吡咯-5-羧酸转化为脯氨酸的限速步骤。在P5CS中发现显著上调,而参与脯氨酸降解的酶在8 DAT时下调(图。2一个额外的文件1表S3),这支持Pro在受水胁迫的葡萄植株中总体积累较高,与之前的研究结果一致[8.].此外,在谷氨酸和天冬酸盐的改变和相关转录物的改变时,可能在干旱期间发生更高但逐渐发生的正常变化。实际上,叶片中的氨基酸代谢在很大程度上取决于氮素同化和脱诺氨基酸代谢,其从蛋白质降解中的释放[70]和流出到新生长的组织[71].
应对压力条件的代谢调整通常在很短的时间内发生,例如,GABA代谢可以在压力开始后几秒钟内作出反应[72]然而,在长时间的胁迫期间,蔗糖的逐渐减少可归因于整个植株光合作用速率的降低[34.因此,由于较早的细胞功能下调,例如运输,碳水化合物代谢过程和能量代谢。这种细胞过程的这种降低可能使植物能够以较低的速率维持关键生物过程,增强保护性代谢反应,并限制在生长组织中的压力相关损伤以及ROS的不利积累。例如,蔗糖降解到下游代谢过程。因此,蔗糖衍生的糖(例如,葡萄糖,果糖,木糖和棉糖)显示出反向变化的变化。这些低分子量碳水化合物(葡萄糖,果糖,半乳糖醇和棉糖)是已知的伴有[73]并且可能参与细胞渗透调节[74]由于与对照相比,它们的生物合成在很大程度上是在受胁迫的葡萄藤中诱导的,但也可以作为细胞结构的保护剂,防止干燥事件(例如,在种子干燥期间[66])及作为暂态碳储存[75].在能源生产TCA循环活性的一般下调,与TCA循环中间体温和减少一致响应于应力测定(图3.a) 值得一提的是,在目前的实验和以前的工作中,在水分胁迫的葡萄藤中,柠檬酸盐的含量逐渐增加[69].一旦在线粒体合成,柠檬酸要么输送至细胞溶胶,并存储在液泡或转化为异柠檬酸经由乌头酸酶[76那77].但是,在应力下,反应性氧(ROS)积聚[78],并能抑制乌头酸酶驱动的柠檬酸盐转化[79]导致观测到的积累。与这一假设一致的是,氧化应激相关基因的转录诱导可能在一定程度上解释了水分胁迫下柠檬酸盐的积累(附加文件)1:表S3)。
ABA的与应力信令和转导途径相关的植物反应中的作用在植物文献中充分描述的80那81那82].与早期的水分胁迫研究一致[8.那39.那83在水分胁迫开始8天后,ABA的积累和ABA相关转录产物的上调。巧合的是,干旱诱导了包括ARFs在内的大量转录因子。与发展相比,ARF在非生物应激反应中的作用仍然很大程度上未被探索。然而,累积的证据表明,arf可能涉及在环境响应中整合生长素和ABA的响应,特别是在干旱胁迫下[84].与之前的证据一致,这项研究表明ARFs可能参与了干旱的转录反应。
总的来说,转录组和代谢组学平行分析表明水分亏缺条件下叶片的代谢具有协同调节作用。前期水分亏缺和盐度对葡萄叶片影响的比较研究表明,主要胁迫效应与ROS和能量代谢、转录因子、ABA和渗透石浓度有关[8.].作者指出,胁迫相关代谢产物的积累与光合、糖异生和光呼吸途径的基因表达有较高的关联,并提示其在调节细胞渗透、ROS解毒和光抑制方面具有重要的功能意义。由[26.]还表明细胞代谢的全球重编程为适应水分亏缺。除了向葡萄响应于应力的以前的研究总体支撑,本季节长的研究表明,葡萄驯化包含整个植物生理学,叶面积动力学和叶代谢的时间不同的调制之间的多级协调。
结论
部分控制的现场病症下的一体化叶生理学,转录物和代谢物分析使我们能够检查对葡萄叶代谢的应力暂时效应。渐进水分应激引起了基因转录物 - 代谢物改变,渗透调节与叶片脱落和代谢松弛的顺序应力反应。随着赛季进展,逐步叶片脱落和蒸腾率的相应降低导致叶水潜力的增加。激活应激相关响应,例如应对响应。阿巴响应性转录因子,在早期阶段之后是应力相关的反应,例如渗透浓度增加,(例如,加利福尼亚州)2+离子)、ROS代谢和应激相关基因转录本及相应代谢物如GABA、脯氨酸、肌醇、半乳糖醇和棉子糖的上调。
方法
实验设计和植物生长条件
The experiment was conducted on 4-years old Merlot vines grafted onto SO4 rootstock at the Udine University experimental farm (North of Italy, 46° 02’ N, 13° 13′ E; 88 m a.s.l.) during 2014 and 2015 growing seasons exactly as describe in [23.那34.].为了模仿开放的场地条件,同时防止自然降水,藤蔓在4.5米高的隧道中从各个侧面开口,但如[中的塑料薄膜(EVA,乙烯 - 乙烯基 - 乙酸)覆盖,如[85].每个藤蔓在45升容器中生长在尺度(实验植物)上,以获得每日尿素率蒸散值(ETLYS, (86])。锅的侧面被铝箔覆盖,以避免过多的热量积聚。罐子被49.0%的沙子,31.5%的淤泥,19.5%的粘土补充20%的珍珠岩的混合物填充。葡萄藤被修剪成一个Guyot(0.8米高),每根有8到10个节点,并训练成垂直的茎定位。灌溉方法、矿质营养和杀菌剂处理的应用如[23.].
从veraison(颜色变化50%)-充分浇水(ET的120%)开始,施用2个灌溉处理LYS, WW)和水分亏缺(35%的ETLYSWW plant,WD),按照中所述,沿着花盆行随机应用四个重复[23.].在处理开始后的第3天,各处理间的土壤水分(θ)差异显著,第10天达到最小θ,然后在试验的其余时间保持相似(详细描述见[23.])。第一个赛季的结果细节时改变一贯在两个赛季存在中给出。季节性差异报告在补充结果。
叶面积测量
在实验期间,用一个与叶长(每次处理四种植物的所有叶片测量)和叶面积相关的线性模型对实验藤的叶面积进行了五次评估,如[23.].
叶生理测量
叶水势(ΨL.;MPA)在清澈的阳光灿烂的日子里,使用压力炸弹箱(土壤湿度有限公司,Santa Barbara,CA,USA)定期测量,如前所述[10.].在[中的协议之后进行压力体积(P-V)测量87],以了解渗透浓度。在恒定光强(1000 μmol.m)下,利用LI-6400气体交换系统(LICOR, Lincoln, NE)测量了暴露在阳光下和完全展开的叶片上的气体交换与水势平行- 2年代- 1)和公司2浓度(400μmol.mol.mol- 1)在环境湿度和叶片温度下。然后对用于气体交换测量的相同叶子进行采样以提取代谢物和转录物,如下所述。
叶采样和代谢物的提取
Samples for metabolic analysis were taken at nine time points in 2014 (− 1 (one day before deficit irrigation imposition), 1, 4, 8, 13, 18, 28, 35 and 53 days following deficit irrigation imposition) and six time points in 2015 (− 1, i.e.one day before deficit irrigation imposition 1, 3, 6, 12 and 26 days following deficit irrigation imposition). At each sampling time point, young, sun exposed and fully expanded leaf samples were taken, divided into two portions and used for metabolite and transcript analysis at the respective sampling stages. Each portion was immediately wrapped in aluminum foil and snap frozen with liquid nitrogen, and then kept at − 80 °C until further analysis. Sample preparation, tissue grinding and metabolite extraction for parallel GC-MS and LC-MS analysis were performed exactly as previously described [88.].以[的方法,处理用于GC-MS分析的样品89.那90.].所有化学药品均购自Sigma Aldrich公司。将30 mg组织冷冻粉末放入1 ml预冷甲醇/水/氯仿萃取混合物中(2.5/1/1)V./ v / v)。提取混合物含有内标利必醇(即水中0.2 mg/ml)、氨苄西林(水中1 mg/ml)和皮质酮(甲醇中1 mg/ml),使其浓度为0.86 mg ml- 1,5.6 mg ml- 1, 7.16 mg ml- 1,分别在最终注入的体积中。然后将样品提取混合物短暂地涡旋,以14,000rpm(微量离心5417r)离心2分钟,将上清液倾析成新管。将上清液与300ml氯仿和300mL UPLC级水混合,短暂地涡旋,然后以14,000rpm离心2分钟。对于GC-MS分析,将100μl从水/甲醇相的提取物在真空浓缩器(EPPendorf浓缩器加)中干燥以进行衍生化[89.].剩余的水/甲醇相转移到UPLC小瓶中进行LC-MS分析。
GC-MS衍生化和分析
用于GC-MS分析的样品完全按照前面所述进行衍生[88.].样本集还包括一个质量控制参考,包括拟南芥从大量提取的拟南芥Columbia-0植物和真实代谢物标准混合物(0.05 mg/ml)。体积为1 然后以不可拆分模式或50:1的拆分比将μl注入GC柱。根据Xcalibur®数据系统(版本2.0.7)中包含的国家标准与技术研究所(NIST,Gaithersburg,MA,USA)算法,根据保留指数(RI)进行光谱搜索图书馆可从德国戈尔姆的马克斯·普朗克植物生理学研究所下载[91.]使用加标法区分RI和光谱非常相似的代谢物(如鼠李糖和岩藻糖)。
LC-MS条件和数据处理
为进行LC-MS分析,将2 μl提取的样品注入配备ESI界面的UPLC-QTOF-MS系统(Waters Q-TOF XevoTM: Waters MS Technologies, Manchester, UK),在负离子和正离子模式下工作。色谱柱条件、溶剂组成和梯度程序完全按照[92.].所有分析均采用亮氨酸脑啡肽锁定质量校准,以确保准确性和重现性,浓度为0.4 ng L- 1,以乙腈的50/50/H表示20.1% v/v甲酸。MS条件的设置基本如[69].UPLC数据处理MassLynxTM软件(Waters)上4.1版本被用作系统控制UPLC和数据采集如[69].获取的原始数据使用Markerlynx Application Manager(Waters)基本上如先前所述处理[69].根据标准鉴定代谢物,在Chemspider代谢物数据库(http://www.chemspider.com/)并进一步确认以前的代谢物注释[93.那94.那95.那96.那97.那98.那99.].
RNA提取,RNA测序,顺式调控元件分析
Transcriptomics data was analyzed only for the early time points (i.e. 4 and 8 days after treatment; DAT) during the 2014 season, while one time point from the 2015 season (i.e. 12 DAT) was used as confirmatory data.
Frozen leaf was ground in liquid nitrogen and total RNA was extracted from 100 mg tissue using Sectrum™ plant total RNA kit (Sigma-Aldrich, STRN50). The quality and concentration of extracted RNA was determined using Bioanalyzer Chip RNA 7500 series II (Agilent, Santa Clara, CA) and a Nanodrop 2000 spectrophotometer (Thermo Scientific, Wilmington, DE). Following quality assessment, library construction was conducted using TruSeq RNA Sample Prep Kit v2.0 (Illumina). Sequencing was performed on an Illumina HiSeq 2000 sequencer (Illumina) at IGA Technology Services (Udine, Italy). Quality check, filtering, and trimming of raw sequence reads (50 nt, single-end) was performed using trimmomatic v0.36 [One hundred.]用下列参数;前置,avgqual和minlen参数值分别是20,20,20,和40。其他参数为默认。将得到的读数进行比对的参考葡萄基因组(12 x) (101使用bowtie2默认参数(v2.2.7) [102].使用带有默认设置的HTSeq-count (v0.6.1)执行阅读摘要[103使用12xV1]葡萄注释(GTF格式)文件。差异表达(DE)分析用DESeq2 [进行104].错误发现率(FDR) < 0.05和绝对萎缩log2倍变化> 1定义了每次比较中的差异表达基因。使用DESeq2计算基因表达丰度,表示为每Kilobase转录本Reads、每百万mapping Reads (RPKM)和方差稳定转化(VST)。转录组数据集的主要成分(29,970个基因)使用vst转化的转录本丰度进行分析。
对De基因的基因本体(GO)富集分析进行宾果作用[105]使用最新的12x V1功能注释提供的GO关联[106].植物瘦身类别被考虑。在FDR < 0.05时,类别显著富集,这是由FDR调整的Fisher精确检验确定的。浓缩为顺式元素(CRE)发起人(1 kb地区上游的5 ' UTR或DE基因的转录启动网站)测定用超几何检验调整错误发现率(罗斯福)与222年修正不尽介于6至8-mers据的过程107].严格的FDR临界值< 0.01表示CRE显著富集。
叶片无机离子浓度测定
在(8,18和53dAt)中使用20mg蒸馏水的叶样品从叶样品中提取无机离子,在100℃下在100℃下煮沸5分钟,在轨道振荡器保持约1分钟,并通过a过滤纤维素硝酸丝过滤器[24.].使用电感耦合等离子体发射光谱仪测定离子含量。如先前在[描述计算了不同的无机离子和可溶性糖以渗透调节的贡献24.].
统计分析
对于代谢物分析,对标准化数据集(组织干重和内标物)进行Student t检验,以比较每个采样数据点的处理。对测井曲线进行主成分分析(PCA)10.使用TMEV软件包转换数据[108].第一个赛季的结果进行了详细的给出时才被发现在两个季节变化的一个统一的模式。季节性差异报告补充说明的结果。
缩写
- 3-PGDH:
-
3 -磷酸甘油酸脱氢酶
- 4CL:
-
4-羟基肉桂酰辅酶A连接酶
- 6PFK:
-
6-磷酸果糖激酶
- α-半乳糖:
-
alpha-galactosidase
- Asp-AT:
-
天冬氨酸转氨酶
- aspk:
-
天冬氨酸激酶
- aspk:
-
天冬氨酸激酶
- aspo:
-
天冬氨酸氧化酶
- BPM:
-
bisphosphoglycerate变位酶
- C4H:
-
肉桂酸4-羟化酶
- 计算机辅助设计:
-
肉桂醇脱氢酶
- CCR:
-
cinnamoyl-CoA还原酶
- 气:
-
Chalcone异构酶
- CHS:
-
查耳酮合酶
- 厘米:
-
chorismate合酶
- COMT:
-
咖啡酸甲基
- DFR:
-
dihydroflavonol-4-reductase
- DHQS:
-
dehydroquinate合酶
- F16BP:
-
果糖-1,6-二磷酸
- F3H:
-
黄酮类化合物3'羟化酶
- F5H:
-
阿魏5羟化酶
- FBA:
-
果糖二磷酸醛缩酶
- FK:
-
低聚果糖激酶
- 读者:
-
黄酮醇合成酶
- G3PD:
-
甘油醛-3-磷酸脱氢酶
- G6PI:
-
葡萄糖-6-磷酸异构酶
- 加巴特:
-
γ-氨基丁酸转氨酶
- GAD:
-
谷氨酸脱羧酶
- glnS启动:
-
谷氨酰胺合成酶
- GluDH:
-
谷氨酸脱氢酶
- GluS:
-
谷氨酸合酶
- 高尔:
-
半乳醇合酶
- HCT:
-
羟基键酰COA
- HXK:
-
己糖激酶
- 发票:
-
转化
- 燕麦:
-
奥林辛转氨酶
- P5CS:
-
pyrroline-5-carboxylate还原酶
- 朋友:
-
苯丙氨酸氨裂解酶
- PK:
-
丙酮酸激酶
- PPH:
-
phosphopyruvate水合酶
- RAFS:
-
棉子糖合成酶
- RP3E:
-
丝带至磷磷酸3-截止酶
- Ser-Gly-AT:
-
丝氨酸/甘氨酸乙酰转移酶
- SER-OAT:
-
丝氨酸乙酰转移酶
- TrpS:
-
色氨酸合成酶
参考
- 1。
王志强,王志强,王志强,等。欧洲极端降水变化的区域气候模型。地球物理学报。2006;41 (D6): 1-22。
- 2。
SCHAR C,Jendritzky G.气候变化:从2003年夏天热性的新闻。2004; 432(7017):559。
- 3.
Cubasch U,Meehl G,Boer G,Stouffer R,Dix M,Noda A等。未来气候变化预测。2001年气候变化:WG1对IPCC第三次评估报告(TAR)的科学基础贡献:剑桥大学出版社;2001年。第525-582页。
- 4.
白麻,Diffenbaugh N,琼斯GV,帕尔Ĵ,Giorgi的F.极端高温在21世纪的减少和转移美国高档葡萄酒的生产。PROC NATL ACAD SCI。2006; 103(30):11217-22。
- 5.
Acevedo Opazo C,Ortega Farias S,Fuentes S.葡萄(Vitis vinifera L.)水分状况对耗水量、营养生长和葡萄品质的影响:实现调节赤字灌溉的灌溉计划应用。农业用水管理。2010;97(7):956–64.
- 6.
张志强,张志强,张志强,等。葡萄叶片和果实对水分胁迫和水分恢复的响应。植物学报,2012;3(09):1232。
- 7.
Bravdo B, Naor A, Zahavi T, Gal Y,编辑。水分胁迫在部分湿润区(PRD-partial rootzone drying)沿季节交替施加对葡萄酒品质、产量和水分关系的影响。第四届园艺作物灌溉国际研讨会664;2003.
- 8.
Cramer Gr,Ergüla,grimplet j,Tillett Rl,Tattersall ea,Bohlman Mc,等。葡萄树中的水和盐度应力:转录物和代谢物谱的早期和晚期变化。功能Integ基因组。2007; 7(2):111-34。
- 9。
刘志强,刘志强,刘志强,等。水分胁迫对夏敦埃和Airén葡萄叶面积发育、光合作用和产量的影响。中国科学(d辑:地球科学)2002;53(2):138-43。
- 10.
Hochberg U,Batushansky A,Degu A,Rachmilevitch S,FAIT A. Shiraz和Cabernet Sauvignon(葡萄球菌L.)的代谢和生理反应,在25和35℃的最佳温度下接近最佳温度。2015; 16(10):24276-94。
- 11.
Flexas J, Galmés J, Gallé A, Gulías J, Pou A, RIBAS-CARBO M,等。提高葡萄水分利用效率:生物技术改良的潜在生理目标。Aust J Grape Wine Res. 2010; 16:06 - 21。
- 12.
西班牙谷物、柑橘、葡萄和橄榄生产的气候风险比较。阿格利司系统。2009;101(2):91 - 100。
- 13。
Ablett E,西顿G,斯科特K,谢尔顿d,格雷厄姆MW,Baverstock P,等人。葡萄EST序列的分析:叶和浆果全球基因表达模式。植物SCI。2000; 159(1):87-95。
- 14。
BézierA,Lambert B,Baillieul F.葡萄牙叶片和浆果中的防御相关基因表达的研究。EUR J植物途径。2002; 108(2):111-20。
- 15.
Bogs J,JafféFW,Takos Am,Walker Ar,Robinson SP。葡萄转录因子VVMYBPA1在水果发育过程中调节原花青素合成。植物理性。2007; 143(3):1347-61。
- 16.
Degu A, ayennew B, Cramer GR, Fait A.葡萄果实对光照、温度、氧化应激、脱落酸和茉莉酸的多酚反应表现出特定的发育依赖程度的代谢抗扰能力。食品化学。2016;212:828-36。
- 17.
Robert N,Roche K,Lebeau Y,Breda C,Boulay M,Esnault R等。葡萄几丁质酶基因在受真菌或细菌病原体感染的浆果和叶片中的表达。植物科学。2002;162(3):389-400。
- 18.
Rossdeutsch L, Edwards E, Cookson SJ, Barrieu F, Gambetta GA, Delrot S,等。aba介导的水分亏缺反应通过其遗传背景区分葡萄基因型。植物学报。2016;16(1):91。
- 19。
王志强,王志强,王志强,等。转录组和代谢物分析揭示,长时间的干旱调节白葡萄中的苯丙素和萜类途径(葡萄L.)。BMC植物BIOL。2016; 16(1):67。
- 20.
王志强,王志强,王志强,等。多组学和综合网络分析揭示了在缺水葡萄果实(Vitis vinifera L.)发育过程中代谢产物、结构基因和转录调控因子之间的系统关系的新见解。植物学报2017;8:1124。
- 21.
Tattersall EA,Gremplet J,Deluc L,Wheatley MD,Vincent D,Osborne C,等。与渗透和盐度应力相比,转录性丰度曲线揭示了葡萄葡萄葡萄树的更大和更复杂的反应。功能综合基因组。2007; 7(4):317-33。
- 22
Vitulo N, Forcato C, Carpinelli EC, Telatin A, Campagna D, D’angelo M, et al.;通过对葡萄选择性剪接的深入研究,揭示了剪接机制与组织、胁迫条件和基因型有关的变化。植物学报。2014;14(1):99。
- 23
Hochberg U, Herrera JC, Degu A, Castellarin SD, Peterlunger E, Alberti G, et al.;蒸发需求决定了亏缺灌溉葡萄植株的相对蒸腾敏感性。Irrig Sci。2017;35(1):1 - 9。
- 24
(1)有机溶质和离子积累在干旱胁迫下葡萄藤渗透调节中的作用。植物科学。2002;163(2):361 - 7。
- 25.
Carvalho LC,Vidigal P,Am–ncio S.葡萄(Vitis vinifera L.)中的氧化应激稳态。环境前沿。科学。2015;3:20。
- 26.
Dal Santo S, Palliotti A, Zenoni S, Tornielli GB, Fasoli M, Paci P,等。等水和各向异性葡萄品种对水分限制的不同转录组反应。BMC基因组学。2016;17(1):815。
- 27.
李志刚,李志刚,李志刚,等。干旱对核桃叶片脱落的影响:脆弱性分割的证据。植物学报。1993;16(7):879-82。
- 28.
霍赫贝格U,阿尔伯克基C,Rachmilevitch S,Cochard H,大卫-施瓦茨R,CR BRODERSEN,等。葡萄叶柄比茎干旱诱导栓塞更敏感:从体内MRI证据和液压漏洞分割的microcomputed断层扫描观测。植物细胞环境。2016; 39(9):1886至1894年。
- 29。
利用组学和系统生物学方法研究葡萄(Vitis vinifera L.)对盐胁迫的响应:功能基因组学的一个展望。OENO。2014;48(3):189 - 200。
- 30.
Ferrandino A,Lovisolo C.《葡萄(Vitis vinifera L.)的非生物胁迫效应:关注脱落酸介导的对次生代谢和浆果质量的影响》。环境实验Bot.2014;103:138–47。
- 31.
中国农业科学,2018,37(4):553 - 558。植物生理学杂志,2017;
- 32.
陈志强,陈志强,陈志强,等。植物对盐胁迫的长期响应:渗透效应和离子毒性。中华医学杂志。2005;56(2):148-54。
- 33.
Flexas J,Bota J,Galmes J,Medrano H,Ribas-Carbóm.在不利条件下保持正碳平衡:光合作用和呼吸对水胁迫的反应。physiol植物。2006; 127(3):343-52。
- 34.
Herrera JC,Hochberg U,Degu A,Sabbatini P,Lazarovitch N,Castellarin SD等。对外法缺乏缺陷的葡萄代谢反应受到术前的气象变异性的影响。JAgric Food Chem。2017; 65(29):5868-78。
- 35.
Wolfe BT, Sperry JS, Kursar TA。在季节性干旱期间,叶子脱落能保护茎免受空化吗?液压引信假设的检验。新植醇。2016;212(4):1007 - 18。
- 36。
Dal Santo S,Zenoni S,Sandri M,De Lorenzis G,Magris G,De Paoli E等人。葡萄园田间实验揭示了基因型,环境的影响和它们相互作用(G×e)对浆果转录组的贡献。工厂J. 2018; 93(6):1143-59。
- 37。
Juhnke H,克雷姆斯B,科特P,Entian K-d。即显示出增加的敏感性的过氧化氢的突变体揭示的戊糖磷酸途径中针对氧化应激的保护酵母的重要作用。分子普通遗传学MGG。1996; 252(4):456-64。
- 38。
Slekar KH, Kosman DJ, Culotta VC。酵母铜/锌超氧化物歧化酶和戊糖磷酸途径在氧化应激保护中发挥重叠作用。[J] .中国生物医学工程杂志,1996;71(46):28831-6。
- 39.
井内S,小林男,塔吉T,Naramoto男,关男,加藤T,等人。由9顺式 - 环氧加氧酶的基因操作,在拟南芥脱落酸生物合成的关键酶的干旱耐受性的调节。植物杂志2001; 27(4):325-33。
- 40.
阿斯曼SM。在拟南芥保卫细胞中,OPEN STOMATA1为ABA信号通路打开了大门。植物科学进展。2003;8(4):151-3。
- 41.
拟南芥OST1蛋白激酶通过调节脱落酸调节气孔开度,并在活性氧产生的上游起作用。植物细胞。2002;14(12):3089 - 99。
- 42.
Yamaguchi-Shinozaki K,Shinozaki K.细胞反应的转录调控网络和脱水和冷应力的耐受性。Annu Rev植物Biol。2006; 57:781-803。
- 43.
Grimplet J, Cramer GR, Dickerson JA, Mathiason K, Van Hemert J, Fennell AY。VitisNet:通过葡萄藤分子网络的“组学”整合。《公共科学图书馆•综合》。2009;4 (12):e8365。
- 44.
Yamaguchi-Shinozaki K. Shinozaki K.拟南芥基因的新型CIS作用元件参与了干旱,低温或高盐胁迫的反应性。植物细胞。1994年; 6(2):251-64。
- 45.
布雷EA。植物对水分亏缺。趋势植物SCI。1997; 2(2):48-54。
- 46
引用本文:王志强,王志强,王志强,等。三种不同条件下葡萄叶片气体交换与水分关系的研究。Photosynthetica。2004;42(1):81 - 6。
- 47
罗维索罗,裴隆,卡拉,费兰迪诺,Flexas J, Medrano H,等。干旱诱导葡萄藤(Vitis spp.)器官发育和功能的变化及其在全株水平上的水力和非水力相互作用:生理和分子更新。植物生态学报。2010;37(2):98-116。
- 48
王志强,王志强,王志强,等。C3植物光合作用对干旱进程的响应:气孔导度作为参考参数。安机器人。2002;89(7):895 - 905。
- 49.
与抗氧化物葡萄葡萄栽培品种相比,Hochmilevitch S.在异常葡萄葡萄种类上显示出在干旱胁迫下的光合效率和光响应率近的情况下。physiol植物。2013; 147(4):443-52。
- 50。
Tombesi S、Nardini A、Froni T、Soccolini M、Zadra C、Farinelli D等。干旱胁迫下葡萄的气孔关闭由水力信号诱导,并由ABA维持。Sci Rep.2015;5:12449。
- 51。
Rodríguez-delfína,posadas a,león-velarde c,mares v,quiroz r,编辑。盐和水分胁迫对脯氨酸和总叶绿素含量的影响和营养物质对未土化培养的两种甘薯品种吸收。II无土文化和水培947国际研讨会;2011年。
- 52。
柳楼StützelH.生物量分配,比叶面积,并且响应于干旱胁迫蔬菜苋(苋属)的水分利用效率。SCI Hortic。2004; 102(1):15-27。
- 53。
Escobar-GutiérrezA,Zipperlin B,Carbonne F,Moing A,Gaudillere J.在桃幼苗中干旱胁迫期间的光合作用,碳分配和代谢物含量。Funct植物Biol。1998年; 25(2):197-205。
- 54.
王Z,Quebedeaux B,Stutte G.渗透调节:在树叶上的碳水化合物水分胁迫的影响,茎和苹果的根。功能植物生物学研究。1995; 22(5):747-54。
- 55.
王智,斯图特GW。水分胁迫下苹果碳水化合物在主动渗透调节中的作用。acta Hortic sinica, 1992;117(5): 816-23。
- 56.
马志强,马志强。葡萄(葡萄)中草酸钙的双生rapines:对晶体稳定性和功能的影响。acta botanica sinica(云南植物学报),2000;
- 57.
水分亏缺和UV-B辐射增强对葡萄光合能力和叶片解剖特性的影响。植物生理实验。2016;28(1):131-41。
- 58.
张志强,张志强,张志强,等。保卫细胞阴离子通道SLAC1受CDPK蛋白激酶调控,具有明显的Ca2+亲和力。中国科学院院刊。2010;107(17):8023-8。
- 59.
钙:植物生长和发育的中央调节器。植物细胞。2005;17(8):2142-55。
- 60
DeFalco TA, Bender KW, sneden WA。破解密码:植物信号传导中的Ca2+传感器。j . 2010, 425(1): 27-40。
- 61
Hetherington AM. McAinsh先生Ca2+信号系统的编码特异性。植物科学进展。1998;3(1):32-6。
- 62
Mcainsh Mr,Pittman JK。塑造钙签名。新植物。2009; 181(2):275-94。
- 63.
Vandelle E,Vannozzi A,Wong D,Danzi D,Digby A-M,Dal Santo S等人。钙调蛋白和钙调蛋白样基因在葡萄葡萄肠(葡萄肝血管素)中的鉴定,表征和表达分析揭示了应激反应中的可能作用。在:植物生理学和生物化学;2018年。
- 64.
Dayod M,Tyerman SD,Leigh Ra,Gilliham M.植物中的钙储存和对钙生物化的影响。原生质。2010; 247(3-4):215-31。
- 65.
烟草中LCT1过表达增强钙对镉毒害的保护作用。环境Pollut。2004;129(2):237 - 45。
- 66.
Fait A,HOFM H,Walter D,Galili G,Fernie AR。高速公路或步行者:GABA在植物中分流的代谢作用。趋势植物SCI。2008; 13(1):14-9。
- 67.
Ozden M,Demirel U,Kahraman A.脯氨酸对过氧化氢氧化胁迫下葡萄(Vitis vinifera L.)叶片抗氧化系统的影响。我是霍尔茨人。2009;119(2):163–8.
- 68.
Maevskaya S,Nikolaeva M.小麦幼苗抗氧化剂和OsMophotective系统对干旱和补液的反应。Russ J植物理体。2013; 60(3):343-50。
- 69.
Hochberg U、Degu A、Toubiana D、Gendler T、Nikoloski Z、Rachmilevitch S等。代谢物分析和网络分析揭示了葡萄水分胁迫反应的协调变化。植物生物学。2013;13(1):184.
- 70。
Araújowl,tohge t,Ishizaki K,Leaver CJ,Fernie AR。蛋白质降解 - 用于应激植物的替代呼吸基材。趋势植物SCI。2011; 16(9):489-98。
- 71。
Soudry E,Ulitzur S,Gepstein S.在脱落和附着的叶片衰老期间氨基酸的积累和重组:在重组发光细菌的植物疗法分析中的色氨酸水平。J Exp Bot。2004; 56(412):695-702。
- 72。
上午动态Kinnersley,Turano FJ。伽马氨基丁酸(GABA)和植物应激反应性的。CRIT Rev Plant Sci。2000; 19(6):479-509。
- 73。
Bohnert HJ, Nelson DE, Jensen RG。对环境压力的适应。植物细胞。1995;7(7):1099。
- 74。
Marcińska I, Czyczyło-Mysza I, Skrzypek E, Filek M, Grzesiak S, Grzesiak MT, et al.渗透胁迫对干旱敏感和抗旱小麦基因型生理生化特性的影响植物生理学报。2013;35(2):451-61。
- 75。
陈志强,王志强,王志强,等。拟南芥种子灌浆过程中贮藏和贮藏积累的研究进展。拟南芥的书。2008; 6: e0113。
- 76。
Bogin E,华莱士A.有机合成和积累酸甜柠檬水果:加州大学洛杉矶分校 - 植物。科学。1966年。
- 77。
GALVEZ S,Gadal P.在活的生物体中的NADP依赖性异柠檬酸脱氢酶同工酶的功能。植物SCI。1995; 105(1):1-14。
- 78.
Gechev Ts,van Breusegem F,Stone Jm,Denev I,Laloi C.反应性氧物种作为调节植物应力响应和编程细胞死亡的信号。生物。2006; 28(11):1091-101。
- 79.
过氧化氢对植物乌头酸酶的快速灭活作用。j . 1991; 276(3): 643 - 8。
- 80。
Gambetta GA, Matthews MA, Shaghasi TH, McElrone AJ, Castellarin SD。糖和脱落酸信号在葡萄成熟开始时被激活。足底。2010;232(1):219 - 34。
- 81。
ABA信号转导与种子发育的关系。植物学报2013;32(7):959-70。
- 82。
Wasilewska A, Vlad F, Sirichandra C, Redko Y, james F, Valon C, et al.;植物脱落酸信号转导的最新进展等。摩尔。2008;1(2):198 - 217。
- 83
Hopper DW,Ghan R,Schlauch KA,Cramer GR.叶片脱水反应的转录组学网络分析确定了三种不同耐旱葡萄品种中高度连接的ABA和乙烯信号枢纽。BMC Plant Biol.2016;16(1):118。
- 84
钱德勒JW。生长素响应因子。植物细胞环境。2016; 39(5):1014至1028年。
- 85
Herrera J,Bucchetti B,Sabbatini P,Comuzzo P,Zulini L,Vecchione A,等。水分亏缺和严重的枝条修剪对葡萄和葡萄酒成分的影响。Aust J《葡萄酒研究》2015;21(2):254-65。
- 86
López-Urrea R,Montoro A,Mañasf,lópez-fusterp,Fereres E.来自Lysimeter测量的evapotranspiration和作物系数的成熟'Tempranillo'wine葡萄。农业水管理。2012; 112:13-20。
- 87.
特纳数控。用压力室技术测量工厂的水状态。Irrig Sci。1988;9(4):289 - 308。
- 88.
Degu A,Hochberg U,Sikron N,Venturini L,Buson G,Ghan R等。在水果开发期间浆果皮肤的代谢物和成绩单剖析阐明了赤霞酚途径分支点的赤霞珠与石草品种之间的差异调节。BMC植物BIOL。2014; 14(1):188。
- 89.
李赛克Ĵ,绍尔N,科普卡Ĵ,Willmitzer L,弗尼AR。气相色谱 - 质谱植物分析为基础的代谢谱。NAT PROTOC。2006; 1(1):387。
- 90.
刘志强,刘志强,刘志强,等。代谢谱允许全面表型的遗传或环境改变的植物系统。植物细胞。2001;13(1):11-29。
- 91.
科普卡Ĵ,芬妮A,Weckwerth W,Gibon Y,斯蒂特M.代谢谱植物生物学:平台和目的地。基因组Biol。2004; 5(6):109。
- 92.
王志强,王志强,王志强,等。代谢物分析阐明红色和白色麝香草基因型多酚生物合成途径的共性和差异。植物生理生化。2015;86:24-33。
- 93.
Hanhineva K,罗高寿I,Kokko讲H,明茨-奥龙S,Venger I,KärenlampiS,等人。在草莓(草莓×ananassa)花空间代谢物组成的非靶向分析。植物化学。2008; 69(13):2463-81。
- 94。
引用本文:ijima Y, Nakamura Y, Ogata Y, Ki T, Sakurai N, Suda K, et al.基于质谱信息集成的代谢物注释。植物j . 2008; 54(5): 949 - 62。
- 95。
梁Z,吴B,风扇P,杨C,段W,郑X等。花青素组成及葡萄浆膜皮肤中的含量在肺炎种质中。食品化学。2008; 111(4):837-44。
- 96。
Moco S, Bino RJ, Vorst O, Verhoeven HA, de Groot J, van Beek TA,等。基于液相色谱-质谱的番茄代谢组数据库。植物杂志。2006;141(4):1205 - 18。
- 97。
莫纳加斯男,努涅斯V,BARTOLOME B,在格拉西亚诺,普兰尼洛戈麦斯 - CordovésC.花青素衍生的颜料和赤霞珠在西班牙生产的葡萄酒。Am j enol vitic。2003; 54(3):163-9。
- 98。
HPLC-DAD/ESI-MS同时测定红葡萄酒中非花青素酚类化合物。中华医学杂志。2005;56(2):139-47。
- 99。
Sánchez-Rabaneda F, Jauregui O, Lamuela-Raventós RM, Viladomat F, Bastida J, Codina C.苹果渣中酚类化合物的液相色谱-质谱串联模式定性分析。快速公共质谱。2004;18(5):553-63。
- 100。
Trimmomatic:用于Illumina序列数据的灵活微调器。生物信息学。2014;30(15):2114 - 20。
- 101。
雅永O,Aury J-男,诺尔B,Policriti A,Clepet C,卡萨格兰德A,等人。小道消息基因组序列表明,在各大被子植物类群祖先hexaploidization。自然。2007; 449(7161):463。
- 102。
Langmead B, Salzberg SL.快速间隙读对齐与领结2。Nat方法。2012;9(4):357。
- 103
用于处理高通量测序数据的Python框架。生物信息学,2015,31(2):166 - 9。
- 104
利用DESeq2对RNA-seq数据的折叠变化和离散度进行调节估计。基因组医学杂志。2014;15(12):550。
- 105
Maere S,Heymans K,Kuiper M.宾果:一种Cytoscape插件,用于评估生物网络中基因本体类别的超级陈述。生物信息学。2005; 21(16):3448-9。
- 106
Grimplet J, Van Hemert J, Carbonell-Bejerano P, Díaz-Riquelme J, Dickerson J, Fennell A, et al.;葡萄全基因组基因预测的比较分析,预测基因序列的功能注释、分类与整合。中国科学院院刊。2012;5(1):213。
- 107.
王志强,王志强,王志强,等。对葡萄R2R3-MYB转录因子家族的系统分析揭示了对二苯乙烯积累调控的新见解。DNA研究》2016;23(5):451 - 66。
- 108.
赛义德AI,Bhagabati NK,Braisted JC,梁W,沙罗夫V,豪EA等。[9] TM4微阵列软件套件。方法酶。2006; 411:134-93。
作者信息
从属关系
贡献
AD设计并执行了实验,对LCMS数据进行了分析,并用AF编写了论文正文;UH和JCH进行了生理和水力测量。GA, NL, EP, SDC,参与所有实验活动的协调,并帮助编辑稿件。DW在AD的协助下进行转录组分析和数据解释,并起草相关章节。AF构思并协调了这个项目。所有作者审查,编辑和批准的最终版本的手稿。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
附加文件
额外的文件1:
表S1。2014年和2015年的气孔导度测量值为平均值(N= 4)和标准误差。相应的时间点以应用治疗的天数表示。表S2。2014年和2015年试验过程中叶片次生代谢产物的Fold change(处理/对照)表S3。2014年和2015年试验过程中叶片中心代谢物褶皱变化(处理/对照)表S4。RNA测序分析方法综述。该表显示了被计数的12X葡萄藤参考基因组的过滤读和对齐读(过滤)的数量。表S5。在第4天、第8天(2014年)和第12天(2015年),所有29970个基因的转录本丰度,以每千碱基转录本的读数、每百万映射读数(RPKM)报告。表S6-S8。差异表达基因(FDR)概述 < 0.05,| log2 FC| > 1) 在葡萄树叶中,比较充分浇水和缺水处理。表S6、S7和S8分别列出了第4天、第8天(2014年)和第12天(2015年)处理的DESeq2统计结果。基因注释参考Vitisnet(https://www.sdstate.edu/agronomy-horticulture-and-plant-science/functional-genomics-bud-endodormancy-induction-grapevines-5)(Grimplet等人,2009)。表S9。葡萄树叶中的差异表达基因列表是在图2中描述的VENN图的每个交叉中的常见和独特的叶子。4.b。表S10。在第4天、第8天(2014年)和第12天(2015年),比较充分浇水和水分亏缺处理葡萄叶片中富集(FDR < 0.05)的GO瘦类植物。还报道了BiNGO (Maere et al. 2005)的其他统计输出。表S11。干旱调控基因启动子中FDR值< 0.01的顺式调控元件(CRE)在第4,8(2014)和第12(2015)天富集。对于每个处理组,包含CRE的基因数量、组大小、基因组中包含CRE的基因总数、启动子大小、富集程度P.-value, FDR,以及包含CRE的基因列表及其CRE沿基因启动子的位置。(XLSX 3596 kb)
额外的文件2:
图S1。利用GC-MS(初级代谢物)和LC-MS(次级代谢物)鉴定出水分胁迫下显著改变的代谢物数量。(PPTX 38 kb)
权利和权限
开放访问本文根据知识共享署名4.0国际许可的条款分发(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Degu,A.,Hochberg,U.,Wong,D.C.J.等Swift代谢物变化和叶片脱落是葡萄葡萄树在延长水分压力下的适应过程中的里程碑。BMC植物杂志19,69(2019)。https://doi.org/10.1186/s12870-019-1652-y
收到了:
公认:
发表:
关键词
- 葡萄藤
- 代谢改变
- 转录本更改
- 叶脱落
- 水胁迫
- 葡萄树适应环境