抽象的
背景
荔枝成熟(荔枝果皮色素和假种皮风味成分发生显著变化。其中,花青素的生物合成最为显著。前期研究表明,LcMYB1和LcbHLH转录因子参与调控荔枝花青素的生物合成。然而,其他MYB因素的作用仍不清楚。
结果
在本研究中,我们克隆并表征了其功能LcMYB5,一种从荔枝转录组中鉴定的新型R2R3-MYB。虽然LcMYB5在荔枝组织中组成表达,其表达与组织着色、过表达LcMYB5导致在烟草和喇叭花同时增强了花青素的生物合成,其内源性上调bHLHs这些结果表明,LcMYB5是一个R2R3转录因子,通过直接激活关键结构基因的表达来调节花青素的生物合成,如DFR或通过间接上调内源性表达bHLH监管机构。更有趣的是,转基因品系的花瓣和叶片的pH值显著低于未转化烟草和矮牵牛,表明LcMYB5也与pH调节有关。的表达式LcMYB5及其bHLH合作伙伴LcbHLH1与推测的组织酸化基因表达一致LcPH1和苹果酸的变化为LcMYB5和组织酸化之间的密切关系提供了进一步的证据。
结论
综上所述,我们的研究表明LcMYB5不仅参与花青素的生物合成,而且参与组织酸化。
背景
花青素是花朵和果实中红色、蓝色和紫色的主要次生代谢物。花青素生物合成途径的调控在植物中已经建立[1.,2.].三个转录因子家族包括参与花青素合成调节MYB,碱性螺旋 - 环 - 螺旋(bHLH)和WDR(WD40重复)已经被广泛表征[1.,3.].其中,R2R3 MYB转录因子被称为是关键调节器,并已在表征各种水果作物包括葡萄(葡萄) [4.),苹果家养苹果) [5.),月桂树的果实(杨梅) [6.),梨(Pyrus pyrifolia) [7.]、血橙(柑橘) [8.]和荔枝(荔枝) [9].
R2R3-MYB家族是最大的基因家族之一,控制着次生代谢的许多方面,以及植物细胞的身份和命运[10,11].R2R3-MYB蛋白通常聚集在功能保守的分支中。在进化支中拟南芥亚群6 MYBs主要调控多种植物花青素的生物合成[12].此外,葡萄(VvMYB5a和VvMYB5b)和矮牵牛(PH4)等其他亚群的成员也已被鉴定,并被认为通过控制花青素生物合成途径和/或液泡酸化的结构基因的转录来影响植物的着色[13,14,15].在结构上,MYB5s和PH4与强花青素诱导的MYB转录因子表现出显著差异,其中KPRPR[S/F]F基序(motif 6)缺失,C1基序(Lx3GIDPxTHKPL)和C3基序(DDxF[S/P]SFL[N/D]SLIN[E/D])存在。[10].在荔枝,53 R2R3-MYB转录因子基于RNA测序果皮鉴定[16].其中LcMYB1与LcbHLH1/3转录因子互作调控烟草和荔枝花青素积累[17].其他R2R3-MYBs在色素沉着和花青素生物合成中的作用仍有待鉴定。
除了花青素在液泡中的积累,一个组织的颜色部分取决于液泡腔的pH值,因为酸度影响花青素的吸收光谱。内膜室通常被液泡型电致H+-ATP水解酶(V-ATP酶)的质子泵,这是负责易位ħ+从细胞质进入腔内[18,19]先前的一项研究表明,亚组6 R2R3-MYB转录因子MdMYB1/10控制花青素的积累[20.,21],但最近的一项研究表明MdMYB1/10也部分通过调节液泡H参与调节细胞pH+- atp酶MdVHA-B1和MdVHA-B2在苹果果实中的作用[20.].在矮牵牛中,AN11-AN1-PH4复合物的靶标是一种名为PH3的WYKY转录因子,该复合物通过调控的表达调控矮牵牛液泡酸化PH5,一种编码Tonopopast H的基因+p3a-atpase [22,23].这些结果表明,R2R3 myb参与液泡酸化。液泡酸化与果实的色泽、风味和衰老密切相关。然而,在荔枝中液泡酸化的机制仍然缺乏文献记载。
在本研究中,我们描述了从荔枝中分离的R2R3-MYB转录调节因子LcMYB5的分子特征。的表达模式LcMYB5对果皮着色和假种皮发育过程进行了研究。利用酵母双杂交和BiFC方法检测LcMYB5与两个核定位LcbHLHs的相互作用。此外,LcMYB5在烟草和矮牵牛花中过度表达,以揭示其功能。我们提出LcMYB5-LcbHLH1复合物可能参与类黄酮的生物合成和液泡酸化。
结果
分离和序列分析LcMYB5
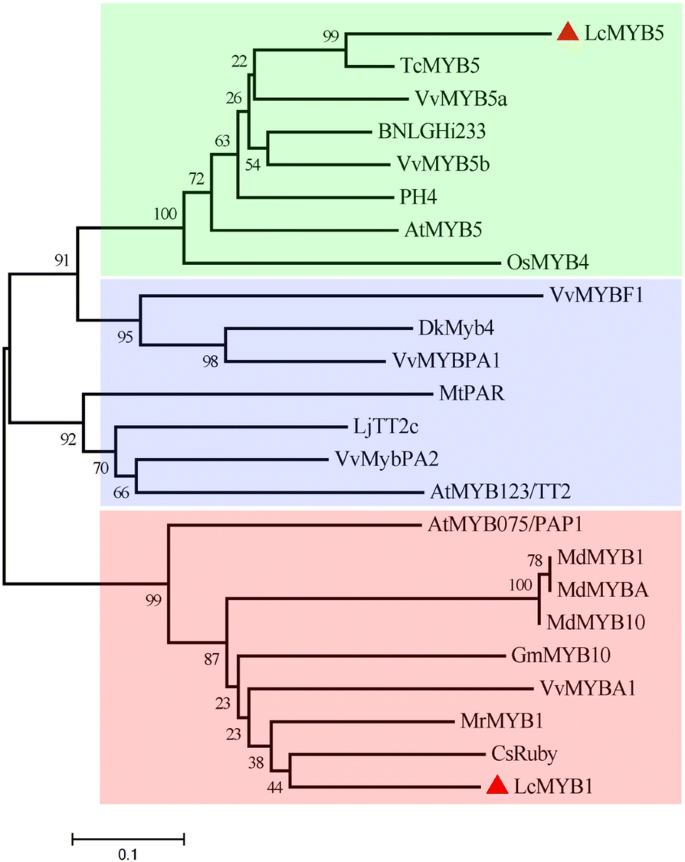
基于我们的荔枝转录组16],一个推定的R2R3-MYB转录因子(单基因0002103)表现出较高的相似性AtMYB5,VvMYB5a和VvMYB5b,因此被指定为LcMYB5。编码区LcMYB5 w ^全长1002 bp,编码333个氨基酸,含有典型的R2R3 MYB基序(图2)。1.).在R3域,LcMYB5表明一个综合[DE] Lx2的[RK] x3Lx6Lx3R基序可能相互作用bHLHs [24]。这表明与LcMYB1一致[17],LcMYB5也可能与特定bHLH蛋白相互作用。KPRPR[S/F]F基序(motif 6)在参与花青素生物合成的大多数MYB转录因子中较为保守[10,而LcMYB5不存在。而在MYB5s和PH4中发现了另外两个保守基序C1 motif (Lx3GIDPxTHKPL)和C3 motif (DDxF[S/P]SFL[N/D]SLIN[E/D]),这两个基序在CsRuby、MdMYBA、MdMYB10、MrMYB1和LcMYB1等强花青素诱导MYB转录因子中缺失。1.).利用MEGA5.0构建的系统发育树显示,LcMYB5与VvMYB5a、VvMYB5b和PH4聚类,而与LcMYB1不聚类(图5)。2.).与矮牵牛PH4、葡萄VvMYB5b和葡萄VvMYB5a的氨基酸同源性分别为37.1%、39.8%和40.0%。
其他植物LcMYB5、LcMYB1与R2R3-MYB转录因子的系统发育关系利用mega5、邻域-连接系统发育测试和1000个bootstrap重复构建了该树。这些蛋白(或翻译产物)在GenBank数据库中的登录号如下:MrMYB1, GQ340767;MdMYB1 ABK58136;MdMYB10 DQ267896;MdMYBA ABB84753.1;GmMYB10 ACM62751.1;CsRuby AFB73909;MrMYB1 GQ340767;VvMYBA1 BAD18977; LcMYB1, KY302802.1; AtMYB123/TT2, NP_198405.1; DkMyb4, AB503701.1; LjTT2c, AB300035.1; VvMybPA2, NM_001281024.1; VvMYBPA1, NM_001281231.1; MtPAR, HQ337434.1; VvMYBF1, FJ948477.2; AtMYB5, NP_187963.1; TcMYB5, XP_007030073.1; BNLGHi233, AAK19611.1; VvMYB5a, NP_001268108.1; OsMYB4, XP_015644524.1; VvMYB5b, NP_001267854.1; AtMYB075/PAP1, NP_176057.1
基因的亚细胞定位和表达模式LcMYB5
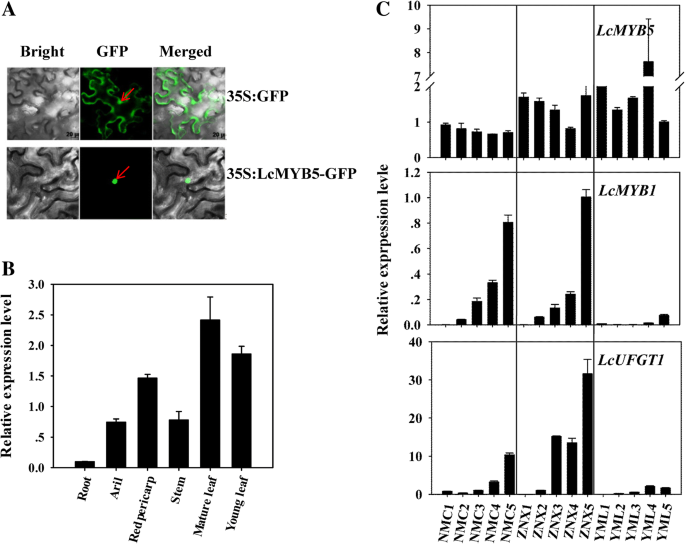
MYB转录因子通常作为反激活因子位于细胞核内。为了研究LcMYB5的亚细胞定位,将LcMYB5的编码序列在框架中融合绿色荧光蛋白基因。然后表达LCMYB5-GFP融合蛋白烟草benthamiana叶子。如图所示。3.a, LcMYB5的荧光只定位于细胞核,而35S: GFP控制的荧光均匀分布于细胞内。
本研究采用real-time PCR方法检测其表达模式LcMYB5在不同的组织和色素沉着果在期间果皮涉及LcMYB1和LcUFGT1,决定荔枝花青素积累的两个关键基因[9,17].不符合LcMYB1和LcUFGT1,其表达与色素沉着和花青素积累非常相似,LcMYB5在被测组织和果皮色素沉着过程中组成性表达(图。3.c)。非红色组织,如成熟叶片和' YML '果皮显示更高LcMYB5表现为嫩叶红,果皮红。这些结果暗示,LcMYB5可能没有一个转录因子参与花青素合成荔枝。然而,据报道其它MYB5基团如VvMYB5a,VvMYB5b和PH4参与组织的色素沉着[13,14,15].为了确认的功能LcMYB5在花青素生物合成中,建立了异源表达系统。
在表型发生改变LcMYB5表达烟草品系
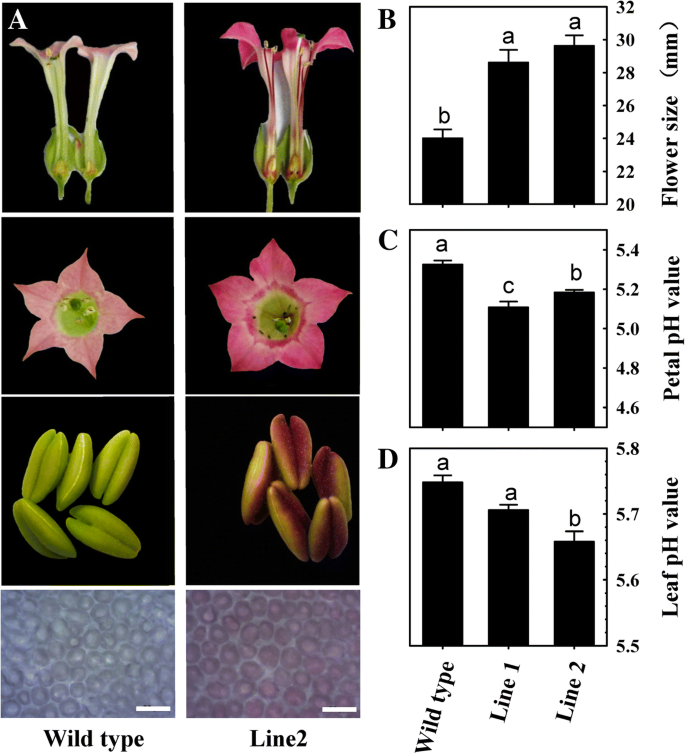
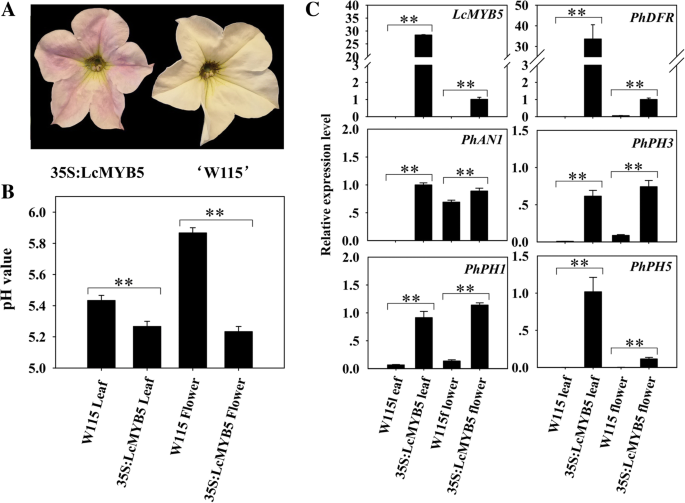
这个LcMYB5编码序列导入到CaMV 35S启动子后的二进制pBI121载体。后农杆菌-介导转化,获得2个转基因烟草株系,在花中观察到显著的表型变化(图。4.a)与野生型相比,花瓣颜色较深,花丝颜色较深,有子房和雄蕊。另一个明显的变化是花的大小。转基因烟草株系的花显著大于野生型。转基因株系的平均花冠直径约为29 mm,野生型的平均花冠直径约为24 mm。4.b).由于LcMYB5与PH4转录因子(一个参与矮牵牛液泡酸化的R2R3-MYB)聚类,我们测量了转基因品系和野生型的花瓣和叶子的pH值。与Quattrocchio等人一致[15],转基因株系的花瓣和叶片的pH值显著低于野生型(图。4.c - d)。
转基因烟草花青素含量及类黄酮生物合成基因表达
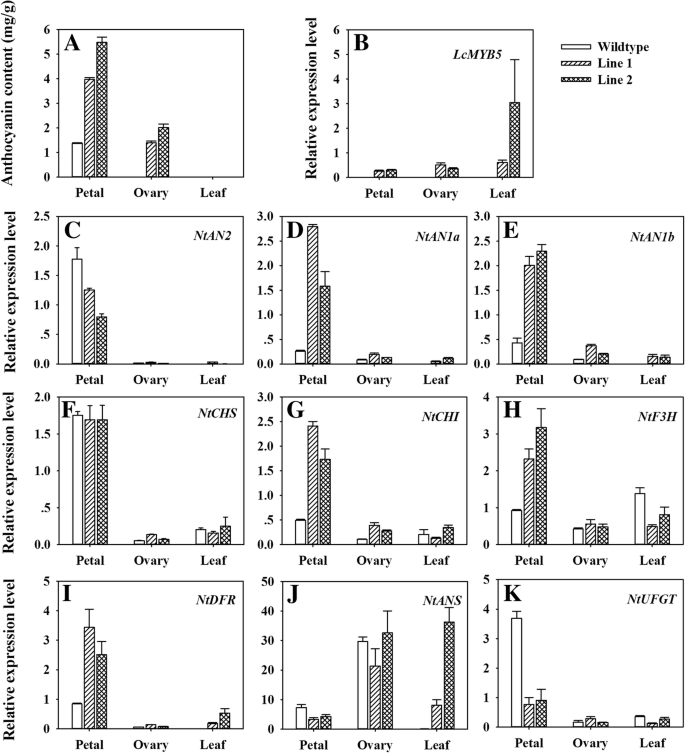
转基因株系花瓣花色苷含量(4.0 ~ 5.5 mg g .−1FW)比野生型(1.4 mg g)高约3-4倍−1FW)(图。5.一种)。花青素积累仅限于生殖器官LcMYB5过度表达的烟草线。在与非红色表型同时,在卵巢和野生型叶片中没有检测到花青素,而在转基因系的卵巢中检测到大量的花青素。
此外,花青素合成基因的表达水平包括LcMYB5三个源烟草花青素合成调节基因,和八个结构基因,进行了调查。如图1所示。5.的表达式LcMYB5在两个转基因株系的所有组织中都观察到,但没有表达LcMYB5在野生型植物中检测到LcMYB5.内源性MYB转录因子基因NtAn2被下调,而两个BHLH转录因子基因NtAn1a和NtAn1b在转基因烟草株系中显著上调,且在花瓣中的作用比在子房和叶片中更明显(图2)。5.一部)。的表达NtAn2是非常低或无法察觉的,而明显的表达NtAn1a和NtAn1b在卵巢中观察到,在转化的线条和野生型中。结构基因,NtCHI,NtF3H和NtDFR它们被上调,而NtANS和NtUFGT在转基因烟草花瓣中表达下调(图。5.F-K)。在卵巢,um-stamations如果说,NtCHI和NtDFR被注意到的反应LcMYB5.然而,在叶片中,显著上调NtDFR和NtANS被观察到。
过度表达LcMYB5诱导花冠花青素积累和组织酸化
描述…的作用LcMYB5在花青素生物合成和组织酸化过程中,35S:LcMYB5稳定转化矮牵牛W115 (an2-an4-).根据四脚乔的结果,当AN2或AN4在W115中过度表达,花冠变蓝LcMYB5过表达的矮牵牛W115系呈淡紫色粉红色(如图。6.一种)。这些结果表明LcMYB5能增强矮牵牛花青素的生物合成,但不如AN2和AN4,第6个MYB小组成员[25].与PH4一致,LcMYB5导致无论是在花和叶的pH值(图显著下跌。6.b)花青素生物合成关键基因PHDFR.与W115相比,W115植株的叶片和花冠表达上调(图2)。6.c) .在佩妮,幻影1编码bHLH转录因子和pH3编码其调节两个P-ATP酶基因中的WRKY转录因子,pH5和pH1[26].这些基因都是对过表达的反应LcMYB5(无花果。6.c) 。
LcMYB5与LcbHLH伴侣的相互作用
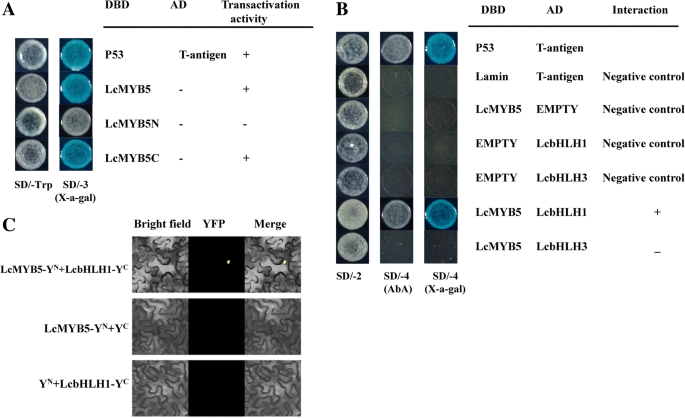
以前,我们确定了两个bHLH转录因子,LcbHLH1和LcbHLH3,这是核本地化,并在烟草参与花青素积累[17].在这项研究中,LcMYB5并且这两个LcbHLHs之间的交互使用酵母双杂交(Y2H)测定法进行了研究。用于与所述DNA结合域(DBD)融合的全长LcMYB5检测在酵母强反式激活活性。Specific primers were used to amplify the N terminal (1–414 bp) and C terminal (414–1002 bp) sequence ofLcMYB5,然后这两个序列被连接进质粒pGBKT7载体。LcMYB5的N末端具有在酵母中没有反式激活活性,如图。6.a.因此,我们利用LcMYB5的N端即LcMYB5N来研究LcMYB5与LcbHLHs之间的相互作用。
LcMYB5N序列连接到pGBKT7载体上LcbHLH1和LcbHLH3克隆到pGADT7载体中进行Y2H检测。酵母细胞共转化阳性对照(pGADT7-T + pGBKT7-53)LcMYB5N具有LcbHLH1在含有毒Aureobasidin A的SD/ -Leu / - Trp/ -His / - Ade培养基上生长,在含X-α-Gal的培养基上生长呈蓝色。6.b)。但是,酵母细胞窝藏LcMYB5N具有LcbHLH3和阴性对照无法SD / -Leu / -Trp / -His / -Ade培养基上生长。这些结果表明与LcbHLH1但与LcbHLH3该LcMYB5相互作用。
为确定LcMYB5和LcbHLH1之间的相互作用,进行了BiFC检测。LcMYB5融合n端片段(NYFP)LcbHLH1融合的C-末端片段(CYFP)瞬时共渗透到叶n benthamiana.浸润后两天,强YFP荧光注意到在表达LcMYB5-NYFP和LcbHLH1-CYFP融合蛋白表皮细胞的细胞核中,而没有YFP荧光既可以在细胞中表达LcMYB5-NYFP与CYFP或LcbHLH1-CYFP与NYFP检测(无花果。6.c) 。
的表达LcMYB5和LcbHLH1假种皮开发期间
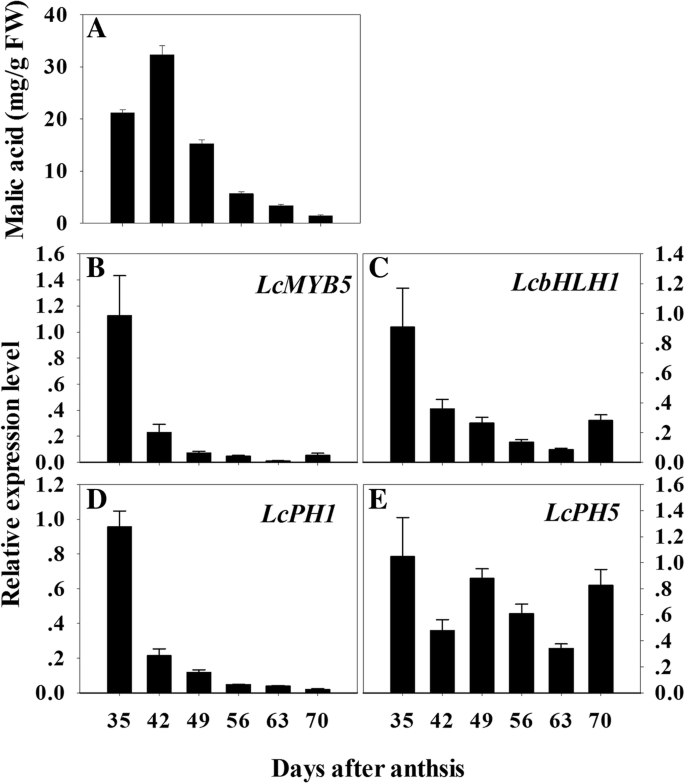
上述数据表明LcMYB5可诱导烟草和矮牵牛花和叶酸化,并可能与荔枝假种皮的酸化有关。使用HPLC测定苹果酸的含量,主要的酸在荔枝的假种皮。期间荔枝假种皮,增加和高浓度的苹果酸的早期发育中检测到,但转向减少与走向成熟的假种皮发展(图8.的表达LcMYB5和它的合作伙伴LcbHLH1在Aril开发的早期阶段高,随后与AriL发育急剧下降(图。8.c)。它们的表情模式通常与苹果酸的变化模式一致。这些结果暗示LCMYB5-LCBHLH1复合物可以参与荔枝ariL的酸化。PH1和PH5编码两个P-ATP酶作为PH4的靶点,负责矮牵牛花瓣细胞酸化[26].我们在荔枝基因组数据库中发现了矮牵牛花的两个同源基因PH1和PH5在荔枝假种皮中,LcPH1和LcPH5.这些基因的排列和系统发育树可在附加文件中找到1.:图S1和图S2。的类似表达模式LcPH1,LcMYB5和LcbHLH1被发现(图。8.当苹果酸下降时,它们的表达水平随着假种皮的成熟而降低。
讨论
在本研究中,一种新颖的R2R3-MYB转录因子,LcMYB5,通过搜索Litchi Pericarp转录组和基因组数据库获得。编码区LcMYB5 w ^全长1002 bp,编码333个氨基酸.与VvMYB5a类似,VvMYB5b和PH4,涉及葡萄和矮牵牛花颜色调节的基因[13,15,16], LcMYB5包含bHLH相互作用,C1和C3基序(图。1.).与LcMYB1和其他关键花青素MYB调控子相比,LcMYB5中没有Motif 6,但有C1和C3 Motif。结构上的差异表明这两个R2R3-MYB转录因子在功能上存在差异。
系统发育分析表明LcMYB5显然属于一个小的特殊簇(图2.),有报道称其在植物中具有多种功能,如颜色调节(VvMYB5a、VvMYB5b和PH4),植物细胞命运决定(AtMYB5)和耐寒性(OsMYB4) [11,27].
LcMYB1是决定荔枝花青素生物合成的关键转录因子[9].不像LcMYB1,这是专门为红色组织中表达,LcMYB5被发现在大多数组织/器官中表达,与内源性花青素水平无关(图。3.b).并且,的表达式LcMYB5果着色时果皮中花青素快速积累和LcMYB1和LcUFGT在两个红色荔枝品种“NMC”和“ZNX”中显著增加(图。3.c) 。这些数据表明,LcMYB5在荔枝中组成性表达,并且LcMYB5与果实颜色相关性不强。的表达模式LcMYB5通常与VvMYB5a和VvMYB5b在葡萄果中[28].在Deluc的研究中[13,14,却证明了这一点VvMYB5a和VvMYB5b调控原花青素和花青素的生物合成。这些结果表明,MYB5s与花青素积累表面上的非相关性并不一定意味着MYB5s不参与花青素的生物合成。
在本研究中,过度表达LcMYB5结果表明,烟草和矮牵牛花色素苷的生物合成增强,花瓣颜色显著增强,子房、花丝和雄蕊着色LcMYB5过表达的烟草品系(图4.a).转基因烟草株系的花瓣和子房花青素含量显著高于野生型(图2)。5.在矮牵牛花的测定中,观察到淡紫色的花瓣LcMYB5过度表达an2突变系W115与未转化系的白色花瓣相比(图。6.a).虽然没有PhAN2宽型(紫色蓝色)那么强烈,但着色的花瓣暗示了这一点LcMYB5增强花色素苷的生物合成,从而部分补充an2花瓣的变异。这些结果表明LcMYB5是一个参与花青素生物合成的R2R3转录因子基因。
花青素生物合成途径是目前研究最为深入的植物次生代谢途径,MYB转录因子和bHLH转录因子通过调控结构基因的转录来控制花青素的积累[29]先前的研究表明,花青素的积累依赖于晚期结构基因,而不是早期结构基因[6.,30.].LcMYB1由烟草叶中的调整对象花青素合成上调的表达水平NtDFR,NtANS和NtUFGT已故结构基因[9,17].在本研究中,花青素在花瓣中含量显著LcMYB5过表达线伴随显著上调NtCHI,NtF3H和NtDFR(无花果。5.b) 。矮牵牛花的一种明显的向上调节DFR基因也被发现在叶子和花瓣LcMYB5过表达系(图。6.b)。不像LcMYB1,在激活花青素修饰所需的基因方面起重要作用(LcUFGT) [9,17[LCMYB5通过激活负责花青素前体生物合成的基因的转录来增强花青素的合成。这些结果表明,多种MYB转录因子与花青素生物合成有关,尽管它们可能显示出不同的调节效率和靶结构基因。
与基因表达上调一致NtCHI,NtF3H和NtDFR(无花果。5.),在这两个叶片和花瓣总黄酮LcMYB5过表达烟草品系显著高于野生型烟草品系(其他文件)1.:图S3)。在拟南芥、AtMYB11、AtMYB111和AtMYB12已被表征为黄酮醇特异性调节剂,在黄酮醇生物合成中正向调节结构基因的表达[31].我们的结果表明,LcMYB5是一个转录因子,参与上调花青素前体(类黄酮)生物合成基因的表达,从而增强烟草和荔枝中花青素的积累和着色。
bHLH小亚家族转录因子作为花青素调控因子已被报道在各种植物中。MYB从苹果,中国杨梅和桃子中分离的基因不会在没有表达的情况下在烟草叶中瞬时表达时诱导花青素积累bHLH基因[32,33,34,35]1.加强监管NtAn1b(bHLH)回应LcMYB1似乎是烟草叶中花青素生物合成的关键[9].烟叶中花青素含量增加时,LcMYB1发生了LcbHLH1或LcbHLH3[17]这些结果表明,花青素生物合成的调节涉及多种BHLH。Y2H和BiFC分析均表明LcMYB5与LcHLH1相互作用,LcHLH1是一种参与花青素积累的转录因子(图。7.) [17].以往的双荧光素酶检测表明,启动子的活性LcCHS,LcCHI,LcDFR和LcANS当LcHLH1或LcHLH3与其他人共同转化LcMYB1与变换后的相比LcMYB1独自一人(17].在本研究中,烟草是内源性的bHLH转录因子,NtAn1a和NtAn1b,在所有被测试的组织中都显著上调,其影响在LcMYB5过表达系(图。5.b).矮牵牛内源性bHLH调节因子的表达,幻影1,也显著的叶子和花上调LcMYB5过表达W115线(图。5.c) 。LcMYB5对烟草和矮牵牛花色素苷合成的增强作用可能源于直接激活结构基因的表达水平,如气,F3H和DFR和/或间接上调内源性基因的表达bHLH监管机构。
花瓣颜色的增强可能是由于较高的花色苷和/或较低的pH值,因为花色苷在酸性条件下往往呈猩红。PH4,一个R2R3-MYB矮牵牛的基因,通过修改来代替花青素生物合成途径液泡酸化[调控花瓣颜色15].在本研究中,除了增强的花青素积累外,在转基因烟草和喇叭花的花瓣中观察到pH值的显着降低(图。4.罪犯,6.b).与未转化植株相比,转基因植株叶片的pH值也显著降低。在荔枝假种皮组织中LcMYB5与假种皮中主要有机酸苹果酸的含量基本一致(图。8.).这些结果暗示,LcMYB5不仅参与花青素生物合成,还参与细胞酸化。同样,VvMYB5a和VvMYB5b可以部分恢复喇叭花an2突变植物,也恢复矮牵牛花ph值4通过液泡[酸化的突变体28].
细胞酸化的调节是在细胞区室一个非常复杂的生物过程和pH值是用于蛋白质和囊泡的胞内运输和小分子的运输,包括激素重要[36].在矮牵牛花中,细胞酸化相关基因的表达pH5响应过度表达而上调LcMYB5在矮牵牛花的花瓣和叶子中(图。6.c).荔枝假种皮中LcMYB5合作伙伴,LcbHLH1和LcPH1,与…的表达平行LcMYB5(无花果。8.).这些结果提示LcMYB5可能与LcbHLH1互作,调控荔枝细胞酸性的关键基因。确切的作用LcMYB5对荔枝组织pH值的调节作用有待验证,其作用机理尚待揭示。在本研究中,在细胞酸化的同时,转基因株系的花瓣大小显著大于野生型(图。4.b).转基因株系中较大的花瓣大小是由于细胞酸度的变化还是其他代谢途径对过表达的反应LcMYB5需要进一步研究。
结论
LcMYB1是目前唯一报道的荔枝MYB参与类黄酮生物合成调节。在本研究中,我们克隆了一个新的荔枝R2R3-MYB转录因子,LcMYB5,在诱导烟草和矮牵牛花色素苷生物合成中表现出明显的作用LcMYB5通过直接激活关键结构基因的表达或间接上调内源基因的表达,参与花青素积累的调控bHLH监管机构。此外,我们的数据表明,其他方法如细胞酸素也可以通过该转录因子来控制。虽然其功能在异源系统中推断,但需要在荔枝中进一步确认,但我们的结果仍然提供了对洞中的新颖洞察力LcMYB5多种转录因子调控花青素的生物合成途径。
方法
植物材料
本研究选择了两个红色荔枝品种‘糯米慈’(‘NMC’)和‘紫娘溪’(‘ZNX’)以及一个非红色荔枝品种‘亚穆龙’(‘YML’),在海南省农业科学院(海口)的试验园中种植了品种‘ZNX’和‘YML’的树木在华南农业大学(中国广州)的实验果园中种植“NMC”树木。从品种“ZNX”中采集根、幼茎、假种皮、幼叶和成熟叶。在5天内采集每个品种的果皮盘5次 根据假种皮锤度酸比率反映的商业成熟前的天数间隔,按照成熟度顺序命名为样品1至5。所有样品立即在液氮中冷冻,然后储存在空气中− 80 摄氏度冷冻柜。
烟草(n .烟草)“K326”和佩妮(佩妮矮牵牛’W115’叶盘农杆菌-介导的稳定转变[37].的叶子n benthamiana进行亚细胞定位,并用浸润法进行BiFC分析[17].烟草、佩妮和n benthamiana植物在28°C的温室中生长。
花青素、苹果酸和pH值的测定
在前人研究的基础上,测定了荔枝和烟草组织中花青素的含量[38].Malic acid was extracted by grinding 1 g of aril tissue in 5 ml 0.2% (W/v)HPO3。将上清液通过高效液相色谱法(HPLC,安捷伦1200)进行分析。Detection of malic acid was performed at 210 nm using a diode array detector. A NUCLEODUR C18 column (250 mm × 4.6 mm) was used for separation at 35 °C with 0.2% (w/v) HPO3 at a flow rate of 1 ml min−1.花瓣和叶子提取物的pH值直接测量,用正常pH电极研磨样品在6ml蒸馏水中。
RNA提取、基因克隆及序列分析
使用臀部植物RNA套件(中国广州)的荔枝,烟草和喇叭花组织分离出总RNA(烟草和喇叭花)。然后用Turbo DNA酶(USA)消化来自总RNA的基因组DNA。根据制造商的总体积,根据制造商的方案,使用M-MLV(Invitrogen,USA)从2ng总RNA合成CDNA。使用LCMYB5_F:ATGAGGAACCCAACACTC和LCMYB5_R:TTATGCATGGTGACGATCCGTAG引物对(TTATGCATGGTGACGATCCGTAG引物对)用作LCMYB5的ORF(开放阅读框架)序列的PCR模板。然后将扩增的PCR产物克隆到克隆载体ptopo-ta(Aidlab,China)中并转化为JM109态性细胞。质粒DNA从阳性中分离大肠杆菌细胞和测序。使用MUSCLE和MEGA5进行多序列比对和系统发育树分析[39].
实时定量聚合酶链反应
利用ABI 7500实时荧光定量PCR仪(Applied Biosystems, USA),利用SYBR regent (TaKaRa, Japan)实时荧光定量PCR技术,计算荔枝、烟草和矮蓟花青素调控和生物合成途径基因的转录水平[9,23].用于基因表达分析的特异性引物列于附加文件1.:表S1。靶基因的相对表达水平标准化成管家基因的Cp值LcACTIN和LcGAPDH荔枝[40],NtACTIN对烟草和PhSAND对于矮牵牛花,基因的相对表达水平通过2-△△计算机断层扫描算法[41].以上所有的分析都具有三个生物学重复进行。
亚细胞定位分析
扩增LcMYB5(不含终止密码子)的序列编码,然后连接到pEAQ GFP载体,该载体通过限制性内切酶线性化年龄I,在用IN-FUSION HD克隆试剂盒(Clontech,美国)的GFP(绿色荧光蛋白)序列帧(引物对在其他文件中列出的1.:表S2) [42].将35S: LcMYB5-GFP融合构建物与对照35S: GFP载体转化农杆菌肿瘤术菌株GV3101,然后渗入n benthamiana用荧光显微镜(Axio Observer D1,蔡司)在渗透2天后观察GFP荧光信号。所有瞬时渗透实验至少重复三次。
酵母2台混合动力分析
酵母(酿酒酵母)根据制造商说明书(Clontech),使用基于Matchmaker gal4的双杂交系统进行双杂交检测。编码区LcMYB5,LcMYB5N终端(LcMYB5N, 1–417 (英国石油公司)和LcMYB5C终端(LcMYB5C, 418–1002 bp)连接到pGADT7载体中,与激活域(DNA-AD)融合(引物对在附加文件中列出)1.:表S2)。全长LcMYB5在酵母细胞中显示出自动转录激活活性LcMYB5(LcMYB5N)在LcMYB5(LcMYB5C)在酵母细胞显示经销商的转录激活活性。Specific bait and prey constructs combinations were then co-transformed into Gold Y2H yeast strain through a lithium acetate method and then yeast cells were plated selected on SD/−Leu/−Trp medium for 3 days. The transformed colonies were then plated on SD/−Leu/−Trp/–His/−Ade medium containing appropriate amount of Aureobasidin A and X-α-Gal at 30 °C for 3 days. The interactions between LcbHLH1/3 and LcMYB5 were determined according to the growth of the yeast cells and the activity of α-galactosidase.
BiFC化验
序列编码(无终止密码子),用于LcMYB5扩增(引物对在其他文件中列出的1.表S2),并亚克隆到pEAQ-NYFP中年龄我用In-Fusion方法制备LcMYB5-NYFP融合蛋白。pEAQ-LcbHLH1-CYFP和pEAQ-LcbHLH3-CYFP来自我们之前的出版物[17].然后将所有结构转换为农菌株GV3101,然后渗入n benthamiana树叶。观察到的荧光显微镜(Axio上观察D1,蔡司)下浸润后两天YFP荧光。基因的表达融合到NYFP或CYFP单独在叶片为阴性对照。所有的瞬态渗透实验至少重复三次。
缩写
- 答:
-
花青素合成酶
- 气:
-
查耳酮异构酶
- 社区卫生服务:
-
查耳酮合酶
- DFR:
-
Dihydroflavonol还原酶
- UFGT:
-
UDP-flavonoid葡糖基转移酶
- X-α-GAL:
-
5-溴-4-氯-3-吲哚氧基a-D-半乳糖苷
参考文献
- 1.
徐伟,王志强,王志强,等。MYB-bHLH-WDR配合物对黄酮类化合物合成的调控作用。植物科学进展。2015;20(3):176-85。
- 2.
黄酮类化合物生物合成途径的转录调控研究进展中国生物医学工程学报。2011;62(8):2465。
- 3.
黄志强。果实花色苷生物合成调控的新见解。植物学报,2013;18(9):477-83。
- 4.
巨峰葡萄myb相关基因的研究进展葡萄属labruscana)调控花青素的生物合成。足底。2002;215(6):924 - 33所示。
- 5.
潘基Y,本田C,初山Y,五十岚男,别所H,守口T.隔离和MYB转录因子基因是红颜色的苹果皮发展的关键调节器的功能分析。植物细胞生理。2007; 48(7):958。
- 6.
牛世生,徐建杰,张文生,张博,李旭,林旺科,Ferguson IB, Allan AC,陈克勤。杨梅花青素合成的协调调控(杨梅)通过R2R3 MYB转录因子表达的水果。植物。2010;231(4):887-99。
- 7.
冯绍峰,王颖,杨胜,徐勇,陈晓霞。梨花青素的合成受r2r2 - myb转录因子PyMYB10的调控。足底。2010;232(1):245 - 55。
- 8.
Butelli E,Licciardello C,张Y,刘俊,麦凯S,贝利P,Reforgiato-Recupero G,马丁C.反转录转座子控制果实特异性,在血橙花青素的冷依赖性积聚。植物细胞。2012; 24(3):1242至1255年。
- 9.
赖波,李晓军,胡波,秦玉华,黄晓明,王慧聪,胡国宝。LcMYB1是基因型、组织、发育阶段、ABA和光照条件下花青素积累差异的关键决定因素荔枝.Plos一个。2014; 9(1):E86293。
- 10.
R2R3-MYB基因家族拟南芥《植物生物学》2001;4(5):447-56。
- 11.
Vannini C, Locatelli F, Bracale M, Magnani E, Marsoni M, Osnato M, Mattana M, Baldoni E, Coraggio I.水稻的过度表达Osmyb4基因增加了令人不寒而栗和冰冷的耐受性拟南芥植物。植物杂志2004;37(1):115-27。
- 12.
杜博斯C, Stracke R, Grotewold E, Weisshaar B, Martin C, Lepiniec L. MYB转录因子拟南芥.植物学报,2010;15(10):573-81。
- 13.
转录因子VvMYB5b参与调控葡萄果实中花青素和原花青素的合成。植物杂志。2008;147(4):2041 - 53年。
- 14.
Barrieu F,Lauvergeat V,Carde JP。调节苯丙烷途径的葡萄藤R2R3-MYB转录因子的特性[J]。植物生理学。2006;140(2):499–511.
- 15.
矮牵牛花PH4是一个R2R3 MYB蛋白,通过与花青素途径的碱性-螺旋-环-螺旋转录因子相互作用激活液泡酸化。植物细胞。2006;18(5):1274 - 91。
- 16.
赖波,胡波,秦勇,赵军,王华,胡刚荔枝成熟过程中果皮的叶绿素降解和类黄酮的生物合成。BMC基因组学。2015;16(1):225。
- 17.
赖B,杜尔,刘R,胡b,苏,秦y,赵j,王h,胡g。两个lcbhlh转录因子与lcmyb1与调节花青素生物合成的后期结构基因相互作用烟草属和荔枝在花青素积累。前植物Sc. 2016;7(212):166。
- 18.
陈志强,陈志强。细胞内ph的传感器和调节因子的研究进展[j] .中国生物医学工程学报。2010;11(1):50-61。
- 19.
加西拉RA,Palmgren MG,舒马赫K.植物质子泵。费用。2007; 581(12):2204-14。
- 20.
胡DG,孙CH,马QJ,你CX,程L,郝YJ。MdMYB1花青素的调节作用和直接促进其运输到液泡苹果苹果酸积累。植物理性。2016; 170(3):1315至1330年。
- 21.
Takos AM,贾菲FW,SR雅各,沼泽Ĵ,罗宾逊SP,沃克AR。一个MYB基因的光诱导的表达调节中红苹果花青素的生物合成。植物理性。2006; 142(3):1216至1232年。
- 22。
VERWEIJ W,斯佩尔特CE,Bliek男,德弗里斯男,威特N,Faraco男,Koes R,Quattrocchio FM。功能类似WRKY蛋白调节矮牵牛和头发发展液泡酸化拟南芥.植物细胞。2016;28(3):786。
- 23。
Faraco M、Spelt C、Bliek M、Verweij W、Hoshino A、Espen L、Prinsi B、Jaarsma R、Tarhan E、de Boer AH等。液泡膜中两种不同P-ATP酶的联合作用导致的液泡过酸化决定了花的颜色。细胞代表2014;6(1):32-43。
- 24。
齐默尔曼IM,海姆MA,Weisshaar B,UHRIG JF。综合鉴定拟南芥MYB转录因子与R/B样BHLH蛋白相互作用。植物杂志2010;3(3):509。
- 25。
转基因和蛋白质定位:神话和传说。植物学报,2013;18(9):473-6。
- 26。
Li Y, Provenzano S, Bliek M, Spelt C, Appelhagen I, Machado De Faria L, Verweij W, Schubert A, Sagasser M, Seidel T, et al.;液泡酸化过程中液泡膜p - atp酶转运蛋白的进化。新植醇。2016;211(3):1092 - 107。
- 27。
李SF,桑蒂尼JM,NICOLAOU O,教区RW。从一种新的MYB相关基因拟南芥.2月。1996;379(2):117 - 21所示。
- 28。
Cavallini E, Zenoni S, Finezzo L, Guzzo F, Zamboni A, Avesani L, Tornielli GB。矮牵牛花青素调控突变体MYB5a和MYB5b调控类黄酮生物合成的功能多样化植物生理学报。2014;55(3):517-34。
- 29。
Petroni K,Tonelli C.最近关于生殖器官中的花青素合成的调控的进展。植物SCI。2011; 181(3):219-29。
- 30
刘雪峰,冯超,张敏,尹晓荣,徐建杰,陈克坤。杨梅MrWD40-1基因(杨梅)与MYB、bHLH相互作用,促进花青素积累。植物学报2013;31(6):1474-84。
- 31.
Pandey A、Misra P、Choudhary D、Yadav R、Goel R、Bhambhani S、Sanyal I、Trivedi R、Kumar TP。AtMYB12在番茄中的表达导致叶和果实组织中转录组和类黄酮含量的大规模差异调节。Sci Rep.2015;5:12412.
- 32.
Espley RV,Hellens RP,Putterill J,Stevenson DE,Kutty Amma S,Allan AC.苹果果实的红色是由于MYB转录因子MdMYB10的活性。植物杂志2007;49(3):414-27。
- 33.
刘XF,尹XR,Allan Ac,林王k,shi yn,黄yj,ferguson ib,xu cj,chen ks。MRBHLH1和MRMYB1在烟草和中国杨梅中调节花青素生物合成基因的作用(杨梅)在花青素生物合成中。植物细胞组织org。2013; 115(3):285-98。
- 34.
Hichri I,Heppel SC,Pillet J,Leon C,Czemmel S,Delrot S,Lauvergeat V,Bogs J.基本螺旋-环-螺旋转录因子MYC1参与葡萄中类黄酮生物合成途径的调节.摩尔植物.2010;3(3):509。
- 35.
拉希姆MA,Busatto N,桃果实花青素合成的Trainotti L.调控。Planta。2014; 240(5):913-29。
- 36.
Verweij W、拼写C、Sansebastiano GP、Vermeer J、Reale L、Ferranti F、Koes R、Quattrocchio F.和H+液泡膜上的p - atp酶决定液泡的pH值和花的颜色。细胞生物学杂志。2008;10(12):1456。
- 37.
一种简单而通用的基因转移到植物中的方法。科学。1985;227(4691):1229 - 31所示。
- 38.
魏永忠,胡福成,胡国宝,李晓军,黄学明,王慧聪。花青素生物合成基因的差异表达与花青素在果皮中的积累荔枝比如说。《公共科学图书馆•综合》。2011;6 (4):e19455。
- 39.
Tamura K,Peterson D,Peterson N,Stecher G,Nei M,Kumar S.MEGA5:使用最大似然法、进化距离法和最大简约法的分子进化遗传学分析.分子生物学进化.2011;28(10):2731。
- 40.
钟海云,陈建文,李春强,陈磊,吴建勇,陈建勇,卢文军,李建刚。利用实时荧光定量PCR技术筛选可靠的内参基因,研究荔枝在不同实验条件下的表达。植物学报2011;30(4):641-53。
- 41.
Livak KJ, Schmittgen TD。使用实时定量PCR和2(−Delta Delta C(T))方法分析相对基因表达数据。方法。2001;25(4):402 - 8。
- 42.
Sainsbury F, Thuenemann EC, Lomonossoff GP。pEAQ:植物中异种蛋白快速快速的通用表达载体。植物生态学报;2009;7(7):682-93。
致谢
作者赞赏George P. Lomonossoff博士(生物化学系,John Innes中心)提供PEAQ HT载体,教授Francesca M. Quattrocchioa和Ronald Koes(SWAMEMRIT生命科学研究所,阿姆斯特丹大学)为他们提供技术支持和宝贵意见。
资金
这项研究是由国家重点研究发展计划(2018YFD1000200),中国广州国家自然科学基金(项目编号31872066),广东省教育厅创新团队项目(2016KCXTD 011)和科学支持科技项目(201804020063)。
数据和材料的可用性
支持结果的数据可以在附加文件中找到,在当前研究中使用和/或分析的任何其他数据集可以从通信作者在合理的要求下获得。
作者信息
从属关系
贡献
H-CW和G-BH构思和设计的实验。BL进行的大部分实验,分析数据,并写文章的草稿。L-ND进行矮牵牛的转化。BH提取从荔枝组织中的总RNA,制备的cDNA。DW进行实时PCR分析,以检查的表达LcMYB5和LcbHLH1假种皮中发展。H-CW, X-MH和J-TZ帮助分析数据并撰写论文。所有作者阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
出版商说明
Springer Nature在公布的地图和机构附属机构的管辖权主张方面保持中立。
附加文件
额外的文件1:
图S1。的氨基酸序列的比对。(A)序列和PhPH1的LcPH1。PhPH5和LcPH5的(B)的序列。图S2。LcPH1和LcPH5与其他物种同源蛋白的系统发育关系(序列来自Li Y、Provenzano S、Bliek M等。液泡酸化中液泡膜P-ATP酶转运体的进化。新植物学家,2016,211(3):1092–1107。)图S3。野生型和LcMYB5超表达烟草品系叶片和花瓣的总黄酮含量。表S1。用于实时PCR的引物。表S2。用于蛋白质相互作用实验的引物。多克斯(1626 kb)
权利和权限
开放获取本文根据知识共享署名4.0国际许可的条款分发(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。创作共用公共领域贡献获豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
赖,B.,杜,LN.,胡,B。等一种新的荔枝R2R3-MYB转录因子的特性研究,该转录因子涉及花青素生物合成和组织酸化。BMC植物杂志19,62(2019)。https://doi.org/10.1186/s12870-019-1658-5
收到了:
认可的:
发表:
关键词
- 花青素
- 组织酸化
- MYB
- bHLH
- 荔枝
- 烟草
- 牵牛花