摘要
背景
不定根(AR)形成是一种复杂的遗传性状,由各种内源和环境提示控制。众所周知,植物蛋白在AR形成中发挥着核心作用;然而,这种作用的基础的机制尚不清楚。
结果
在这项研究中,我们证明了之前鉴定的生长素信号模块,营养响应因子(ARF)7 / ARF19-横向器官界限域(LBD)16 / LBD18经由AUXIN1(AUX1)/ LIKE-AUXIN3(LAX3)生长素涌入载体,其中起重要作用的侧根形成,参与AR形成在拟南芥。在aux1,LAX3.,arf7,ARF19,lbd16和lbd18单个突变体,我们观察到比野生类型的曲线减少。与相应的单个或双突变体分别相比,双突变体和三倍突变体表现出AR号的额外减少,以及AUX1 lax3 lbd16 lbd18四重突变体缺乏ARs。的表达LBD16或LBD18在他们自己的推动下lbd16或lbd18突变体将减少的ARs数量恢复到野生型水平。LBD16或LBD18与显性SRDX抑制因子融合抑制细胞周期基因的启动子活性,细胞周期蛋白依赖性激酶(CDK) A1; 1,在某种程度上。的表达LBD16或LBD18明显减少了arf7和ARF19期间AR形成在光依赖性突变体,但不是在arf6和arf8.启动子 - GUS报告者转基因系的GUS表达分析显示重叠表达模式LBD16,LBD18,ARF7,ARF19和LAX3在AR原基。
结论
这些结果表明ARF7 / ARF19-LBD16 / LBD18通过AUX1 / LAX3促进型流入载体的转录模块在拟南芥中的AR形成中起重要作用。
背景
高等植物的根系结构在系统和解剖水平上都是不同的,它对锚定在土壤和吸收水分和养分至关重要[1].一般来说,双子叶植物,如拟南芥,有主根分枝形成侧根(LRs)。在单子叶植物和双子叶植物中,主根可以从气生器官中自然生长出不定根(ARs),作为对环境变化的适应性反应,如洪水和暗光转换,或人为地通过伤害[2,3.,4,5].AR的形成是在农业精英基因型的无性繁殖关键和也是植物存活是重要的在各种生物和非生物应力的[4,5].植物局在LR和AR形成中发挥着核心作用[6].虽然生长素调控的初级和LR发育的信号和分子机制的特征相对较好,但我们对生长素如何调节AR形成的理解是初步的[1,7,8,9].
植物根的发育是通过生长素运输在原基顶端建立生长素最大值来调控的[10.,11.,12.,13.].在生长素运输,生长素行进通过等离子体膜定位生长素流出和流入的载体和触发器各种调节机构的联合作用内向顶部或basipetally长距离沿其路径[14.,15.,16.,17.].生长素外排载体,包括两种主要的跨膜蛋白,即PIN- formed (PIN - formed)和atp结合盒亚家族B (ABCB),被证明参与了不同植物物种的LR和AR的形成[10.,18.,19.,20.,21.,22.].用极性养蛋白转运抑制剂的研究,N-1-萘氨基酞酸,显示PIN1介导的植物素转运对于水稻植物的出现是必需的[23.].生长素与乙烯通过正向调控AR启动尼加斯加药(分析我国),其编码亲环素A型蛋白质(SlCYP)24.,25.].SlCYP1改变质膜上PIN流出载体的丰度以调节AR启动过程中生长素的极性运输[26.,27.,28.,29.].
生长素信号是由两个大的蛋白质家族调节:所述生长素应答因子(ARF)的蛋白质,其充当的生长素响应的DNA结合转录调节,和AUX / IAA蛋白,ARFs的负调节[30.].一些ARF.在拟南芥和水稻的AR形成中发挥作用。ARF6和ARF8已被证明是拟南芥下胚轴AR启动的正调控因子,而ARF17作为负调节者[31.,32.].这些ARF.S在转录和转录后水平上通过调节体内平衡来调节彼此的表达mir160.,哪个目标ARF17和mir167.,随后以两者为目标ARF6和ARF8[32.].这个复杂的转录因子网络调控着三种生长素诱导的表达格雷琴HAGEN3(GH3.)基因,编码酰酸 - 酰胺合成酶,其通过调节茉莉酸稳态拟南芥中的微调AR开始需要进行微调Ar开始[33.].有研究表明,参与LR形成的生长素信号模块也可能参与AR的形成。例如,ARF7和ARF19控制拟南芥LR的形成和AR的形成[34.,35.,36.,37.,38.].OsARF16,它是米的同源物ARF7和ARF19通过激活的表达控制水稻不定冠根原基的开始皇冠ROOTLESS1 /外源ROOTLESS1(CRL1 / ARL1),它编码一个横向器官边界域(LBD)蛋白[39.,40,41.].
在拟南芥中,几个的小黑裙基因,如LBD16,−18.,−29.和−33.,已被证明的生长素调节LR发展中发挥重要的独特作用[37.,42.,43.,44.,45.,46.,47.,48.,49.].已经表明养羊酸涌入载体AUXIN1(AUX1) 和LIKE-AUX1 3(LAX3)是生长素反应性表达所必需的LBD16和LBD18控制拟南芥LR发育的各个阶段[45.,50.,51.].在本研究中,我们发现AUX1 / LAX3-ARF7 / ARF19-LBD16 / LBD18信号传导模块对拟南芥中AR的形成也很重要,这为生长素信号传导过程中LR和AR形成的共同调控机制提供了证据。
结果
GUS基因表达谱分析proARF7:Gus.,proARF19:Gus.,proLAX3:Gus.,proLBD16:Gus.和proLBD18:Gus.在开发期间
以便深入了解LAX3-ARF7 / ARF19-LBD16 / LBD18在AR发育过程中,我们分析了GUS基因的表达proLBD16:Gus.,proLBD18:Gus.,proARF7:Gus.,proARF19:Gus.和proLAX3:Gus.在AR形成的早期阶段的转基因植物(图。1).GUS在3 d龄暗生长的子叶和下胚轴下部均有表达proLBD16:Gus.在时间t0的幼苗(图。1一个)。这些幼苗转移到光72小时后,在胚轴(图早期AR原基被清楚地检测到GUS表达。1b).光照6 d后,GUS在下胚轴和根中的表达普遍增加,在出现的AR附近的下胚轴中柱组织中检测到GUS的表达(图2)。1c)。关于proLBD18:Gus.中,仅检测在3-d龄黑暗生长的苗的下胚轴(图GUS表达。1d):光照72 h后,下胚轴AR原基中检测到GUS表达强烈(图)。1e)。在proARF7:Gus.,proARF19:Gus.和proLAX3:Gus.将3 d龄的暗生幼苗移栽光照72 h后,下胚轴中柱组织和AR原基中均检测到GUS的表达(图2)。1走)。这些重叠和独特的GUS表达模式在GUS报告转基因系的次髓基板组织和AR原始中表明LBD16和LBD18可能在早期的AR原始发展中发挥重叠作用LBD18可能在下游的后期发育阶段在AR原始中发挥着独特的作用ARF7 / ARF19-LAX3在基于“增大化现实”技术的发展。
胚乳中的GUS表达proLBD16:GUS,临LBD18:格斯,亲ARF7:GUS,临ARF19:格斯和proLAX3:Gus.转基因植物。A-C.GUS染色的表达proLBD16:格斯,d-fproLBD18:格斯,胃肠道proARF7:格斯,J-L.proARF19:格斯和m-oproLAX3:Gus.在黑暗中生长的幼苗3d(a,d,g,j和m),然后在光线下72h(b,e,h,k和n)或6 d(c,f,i,l)和o)。B,C,E,H,I,K和N中盒的区域的放大图像显示在B1,B2,C1,E1,E2,H1,H 2,I1,K1,K 2,N1和N 2中。箭头指向ARS或Primordia。A-O中的棒= 1cm,B1,B2,C1,E1,E2,H1,H 2,I1,K1,K 2,N1和N2中的50μm
AUX1,LAX3,LBD16和LBD18参与拟南芥下胚轴AR的形成
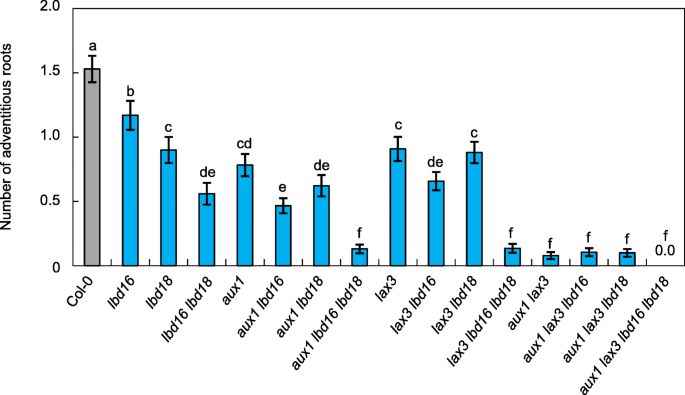
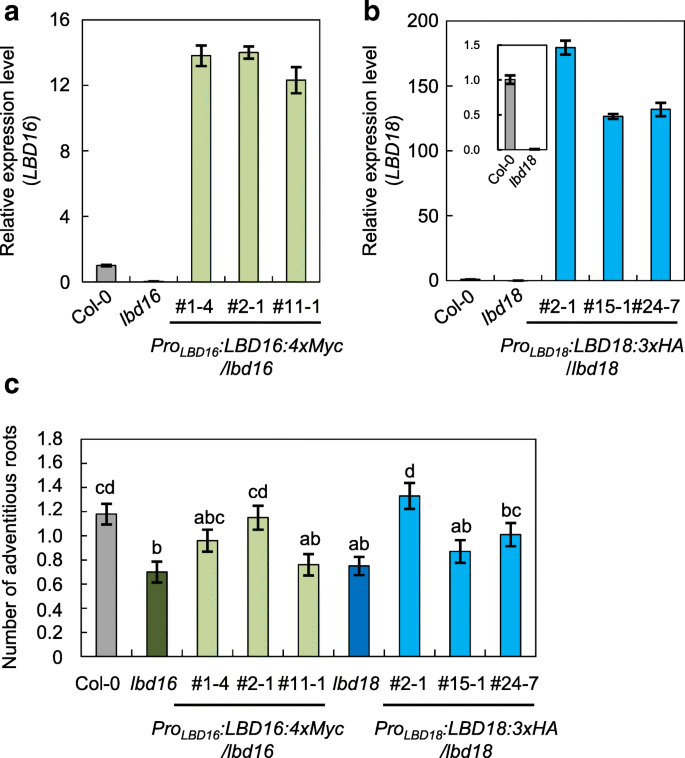
为了确定毒素中流量载体,AUX1和LAX3的作用,以及在AR形成中的两个临界LBD转录因子,LBD16和LBD18,我们在单一和多个突变体中测量了次突薄的AR号aux1,LAX3.,lbd16和lbd18(无花果。2).为了诱导下胚轴AR的形成,将萌发的种子垂直黄化3 d,在光照下生长7 d,计算AR [32.].的aux1,LAX3.,lbd16和lbd183 d龄暗苗转光照7 d后,单突变体的AR数量显著低于野生型(49.01、41.17、23.52和41.17%)aux1,LAX3.,lbd16和LBD18,分别)(图。2).双突变体中ARs的数量,lbd16 lbd18,aux1 lbd16,aux1 lbd18,lax3 lbd16,lax3 lbd18和aux1 lax3,与相应的单个突变体的相比,进一步减少(图。2).三重突变体的AR值,aux1 lbd16 lbd18和lax3 lbd16 lbd18,与野生型相比,进一步降低至~ 8%,而aux1 lax3双突变体,aux1 lax3 lbd16和aux1 lax3 lbd18三突变体的AR值为野生型的3.5-4%。2).在四重突变体中,AUX1 lax3 lbd16 lbd18,无法检测到AR形成。这些结果表明,植物素流入载体,例如AUX1和LAX3,对于AR形成至关重要AUX1,LAX3,LBD16和LBD18基因是AR的形成至关重要。为了进一步证实的作用LBD16和LBD18在AR形成过程中,我们获得了表达AR的转基因拟南芥植株LBD16: MYC(proLBD16:LBD16:MYC / LBD16)或LBD18:HA.(proLBD18: LBD18: HA / LBD18)lbd16或lbd18在自身启动子控制下的突变背景下,(图。3.A,B),并且这些互补线分析AR号码。选择AR分析这三种不同的互补株系救出引起AR发育缺陷lbd16或lbd18不同程度的突变(图3.c)。proLBD16:LBD16:MYC / LBD16(#2-1)和proLBD18: LBD18: HA / LBD18(# 2-1)转基因突变系显示出野生型的AR数量水平(图2-1)。3.c)。这些结果表明LBD16和LBD18在AR开发中发挥重要作用。
互补分析AR的形成lbd16和lbd18.一个表达分析LBD16在Col-0,lbd16和proLBD16:LBD16:MYC / LBD16植物.b表达分析LBD18在Col-0,lbd18和proLBD18:LBD18:3xha/lbd18植物.七级幼苗用于实时RT-PCR分析(A和B)。在归一化之后绘制相对折叠变化ACTIN7.相对折叠变化表示突变体或转基因植物中的比率相对于COL-0植物中的转录物水平。在三个技术重复中测定平均值±SE值。c人工鱼礁的数proLBD16:LBD16:MYC / LBD16和proLBD18: LBD18: HA / LBD18植物.线以上的数字表示转基因植物的行数。不定根的数量分析如图所示。2.数据以平均值±SE表示,由100棵幼苗测定。不同的字母表示显著差异,由单因素方差分析和Duncan事后检验(P< 0.05)
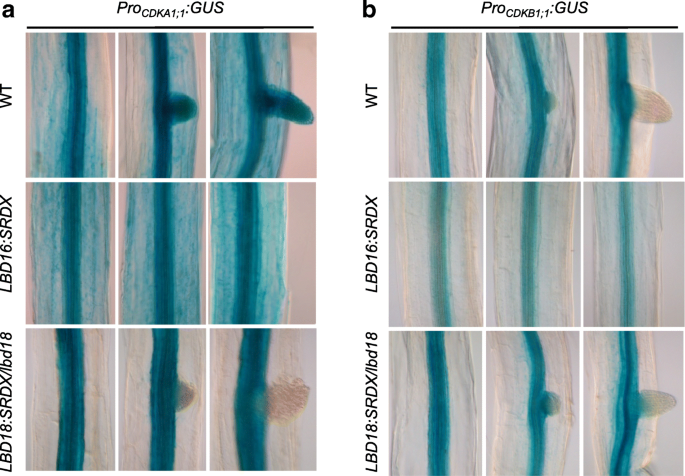
LBD16:SRDX和LBD18:SRDX均在诱导AR形成过程中抑制细胞周期基因启动子活性
以前的研究表明LBD16和LBD18在LR启动过程中调控某些细胞周期基因的表达[45.,48.].检查if.LBD16和LBD18可能参与在AR形成期间细胞周期基因的表达,我们使用了表达LBD16的转基因拟南芥:超人抑制域X(SRDX)或LBD18:SRDX在其自身的启动子和窝藏的控制下细胞周期蛋白依赖性激酶(CDK) A1; 1或CDKB1:1在col0或lbd18突变体[45.].我们发现LBD16:SRDX抑制了GUS基因在下胚轴脉管系统中的表达proCDKB1; 1:Gus.转基因植物,而LBD18:SRDX在幼杆子的原始和脉管系统中抑制了GUS表达procdka1; 1:Gus.转基因植物(无花果。4).抑制GUS基因在下胚轴维管系统中的表达proCDKB1; 1:Gus.通过LBD16:SRDX或在AR中procdka1; 1:Gus.由LBD18可知:SRDX与的优先表达有关LBD16或LBD18在胚轴组织碑或者仅在AR原基,分别。我们还注意到,LBD16:SRDX完全在光胚轴阻断AR形成,而LBD18:SRDX不阻断AR形成(图4).这些结果表明LBD16和LBD18可能参与了AR在不同发育阶段细胞周期基因的表达。然而,进一步的定量和功能分析是必要的,以澄清直接参与LBD16和LBD18在ar发育过程中调节细胞周期基因表达。
LBD16和LBD18下游行动ARF7和ARF19调节AR发展
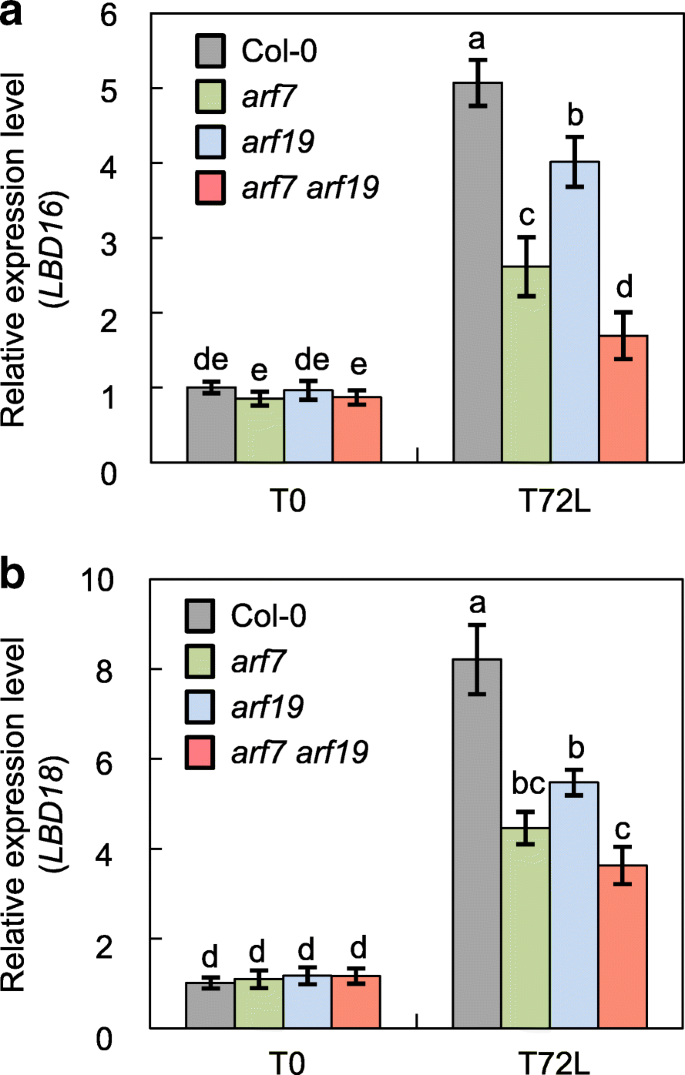
在LR开发期间,LBD16和LBD18是转录调控的下游吗ARF7和ARF19在助长信号通知期间[34.,37.,52.].因此,我们研究了在以轻依赖性的方式形成时相同的转录模块功能。为此,我们分析了表达LBD16和LBD18在幼杆子arf7和ARF19单突变体和arf7 arf19通过RT-qPCR分析AR形成早期不同时间点的双突变体(图。5).在T0,即幼苗黄化期(转阴前),表达LBD16和LBD18与野生型相比,所有三个突变体都没有变化(图。5).转光72h (T72L)后,表达LBD16和LBD18在野生型,以及在所有突变体植株明显增强。然而,光诱导的表达LBD16和LBD18明显减少了arf7(分别为48.5和45.6%,分别),ARF19与野生型相比,突变体(20.9和33.3%)(图20.9和33.3%)(图。5一个)。LBD16和LBD18表达进一步减少arf7 arf19双突变体(分别为66.6和55.9%),与此相比arf7和ARF19单突变体(无花果。5b),这表明ARF7和ARF19调节LBD16和LBD18暗光转换后AR发育过程中的表达。
表达分析LBD16和LBD18在Col-0的幼杆子中,arf7,ARF19和arf7 arf19突变体。的表达LBD16(一个) 和LBD18(b)的下胚轴转录本,arf7,ARF19和arf7 arf19.幼苗在黑暗中黄化,直到它们的下胚轴长6毫米(T0),然后转移到光72小时(T72L)。然后将幼苗收获用于RT-qPCR分析。的相对倍数变化表示在相对于在T0在Col-0中的转录水平突变体的转录水平的比例。Mean ± SE values were determined from three biological replicates (each biological replicate was estimated as the average of two technical RT-qPCR replicates). Different letters indicate a significant difference determined by one-way ANOVA followed by Duncan’s post hoc test (P< 0.05)
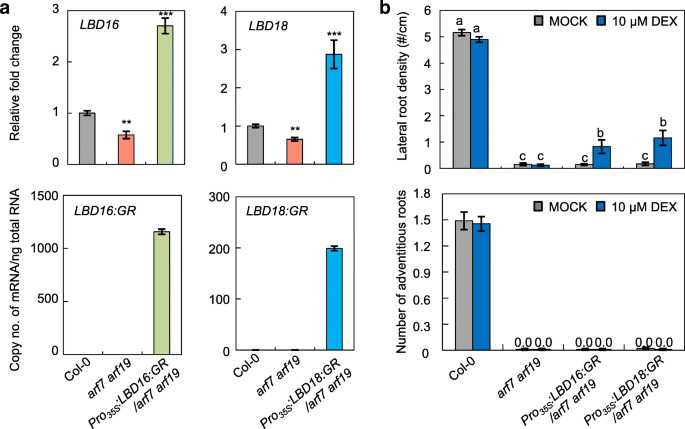
在之前的研究中,过度表达LBD16或LBD18在arf7 arf19的控制下,突变体花椰菜马赛克病毒(CaMV 35S)启动子在12 d内诱导显著的LR形成,表明LBD16和LBD18可以在下游独立运作ARF7和ARF19控制LR开发[37.,42.].据以前的研究报告说[37.,42.的LR表型arf7 arf19突变体被救出LBD16或LBD18过表达在一定程度上(图6B,上图)。我们接着检查是否过度表达LBD16或LBD18在arf7 arf19突变体可能导致ARS的异位引发,但即使在光的植物生长2周后,也无法检测到任何AR形成(图。6B,底部图片)。这一结果表明,不像LR开始,LBD16和LBD18需要ARF7和ARF19产生的额外因子来诱导AR启动。
LR的和AR形成分析arf7 arf19突变体表达LBD16: GR或LBD18:GR..一个表达分析LBD16和LBD16: GR在Col-0,arf7 arf19和pro35年代: LBD16: GR / arf7arf19(左面板)LBD18和LBD18:GR.在Col-0,arf7 arf19和pro35年代:LBD18:GR / ARF7ARF19植物(右面板).七级幼苗用于实时RT-PCR分析。在左侧面板中,归一化后绘制相对折叠变化ACTIN7.的相对倍数变化表示在突变体相对于在Col-0中的植物转录水平的转录水平的比例。在右侧面板中,成绩单复印件均每总RNA NG正常化后绘制ACTIN7RNA。在三个技术重复中测定平均值±SE值。bCOL-0的胚轴中的横向根密度和AR的数量,ARF7 ARF19,PRO35年代: LBD16: GR / arf7arf19和pro35年代:LBD18:GR / ARF7ARF19植物。在LR密度通过每单位初生根长度从2周垂直地生长和在顶部面板中示出的植物测定LR号(#)(厘米)作图。数据表示为平均值±SE从20个苗确定。不同的字母表示显著差异,由单因素方差分析和Duncan事后检验(P< 0.05)。在垂直平板上黑暗生长3 d,然后在有或无DEX的光周期16 h下生长2周,测量幼苗的ARs值,并绘制在底板上。数据以平均值±SE表示,由100个幼苗测定
以前的研究表明ARF6和ARF8作为AR形成的积极调节者[31.,32.].因此,我们测试了ifARF6和ARF8可以控制表达LBD16和LBD18对于AR形成。时间课程响应LBD16和LBD18表达式arf6和arf8RT-qPCR分析了生长素吲哚-3-乙酸处理后突变体的表达,但未见突变体的表达变化LBD16或LBD18在arf6和arf8观察突变体背景与野生型的比较(附加文件1:图S1),表明ARF6和ARF8通过一个独立的途径来调控AR的形成LBD16和LBD18,在生长素信号传导过程中。综上所述,这些结果表明LBD16和LBD18表达受下游的调控ARF7和ARF19但不是ARF6和ARF8,ar开发。
讨论
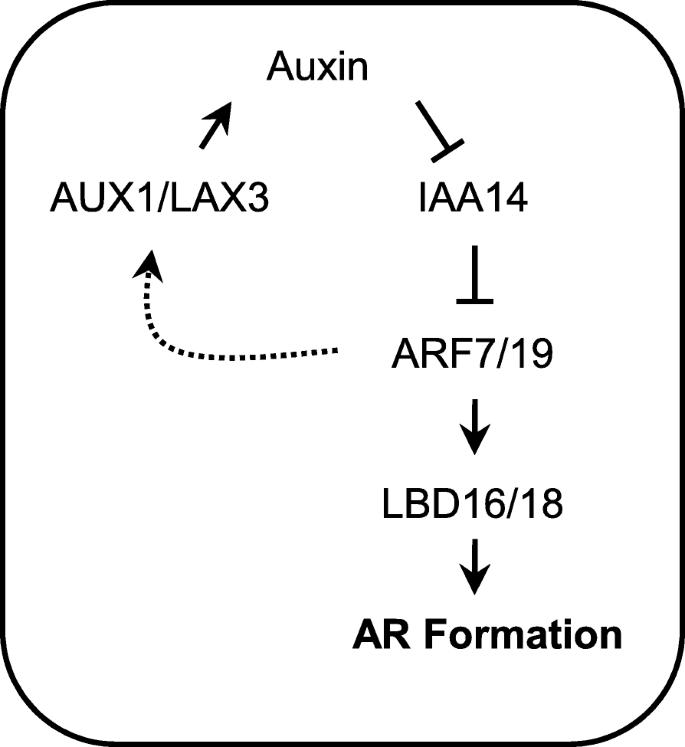
关于LR和AR形成的遗传方面和荷尔蒙反应的研究表明,LRS和ARS共享遗传和激素监管网络的关键要素,但具有不同的监管机制[1].而拟南芥LR发育过程中的遗传成分和分子信号通路已经被很好地描述了[9],那些参与AR的发展在很大程度上是未知。在这项工作中,我们发现,生长素响应ARF7/ARF19-LBD16/LBD18转录模块,经由AUX1 / LAX3转运,起着拟南芥胚轴在AR形成中起重要作用。
在拟南芥中,LRS的发育过程很好地定义,并且由血管细胞的灌注组成在原代根本的基础重新分析中,第一个抗癌性不对称细胞分裂(启动),有序的抗线和蠕虫细胞部门形成圆顶 -形状的LR原始,以及来自主要根的LR原始的出现[53.,54.].虽然在拟南芥中AR形成的发育阶段没有被很好地描述,但苹果切块中的AR形成也被类似地分为四个连续的阶段:细胞脱分化、细胞分裂开始的诱导、圆顶原基的生长和AR的出现[55.].在拟南芥中,ARS从次髓基杆邻近的木质杆附近的近周套细胞引发,类似于LRS发起的[56.].ARF蛋白,其参与LR起始,发现调节AR起始拟南芥[32.,33.],这表明尽管AR和LR来自不同器官的起源,类似分子机制可以调节AR引发。在水稻中,CRL1 / ARL1,这促进了冠根的发生,正调节基因277,并且这些当中,它正调节同源涉及LR形成拟南芥基因的许多基因[57.].
在本研究中,我们展示了信号模块AUX1 / LAX3-ARF7 ARF19-LBD16 / LBD18,已被证明可以调节LR形成[37.,42.,45.,48.],涉及AR的形成(图7),表明避免AR和LR形成的发育过程。但是,我们注意到LR和AR开发之间的每个信令组件的角色存在一些差异。我们以前发现十二次突变lbd16 lbd18 AUX1 lax3几乎废除了出现的LRS的形成,但几乎不会影响来自I至III的早期发育阶段的LR原始密度[45.].但是,我们无法检测到这种四片突变体中的任何Ar原始(图。2).这表明,AUX1/LAX3下游的LBD16/LBD18转录模块对AR的起始和发育都是必不可少的,而同一信号模块在LR起始过程中冗余地发挥作用,可能与其他信号模块共同作用的小黑裙基因。此外,我们发现过度表达LBD16或LBD18在里面arf7 arf19突变体不能挽救AR缺陷,而相同的方法显著刺激LR的形成arf7 arf19突变体(无花果。6)[34.,37.],表明LBD16和LBD18需要通过ARF7和ARF19产生的另外的组分来调节AR形成。此外,通过直接激活,LBD29在ARF7下游的LR形成中起重要作用LAX3对生长素反应的表达[47.,49.].LBD18表达受下游的调控LAX3[45.] 和LAX3参与ar形成(图。1).因此,很有可能LBD29也在AR形成中发挥作用。
我们注意到了互补线lbd16或lbd18表达产生的突变体LBD16或LBD18在自身启动子的控制下,每个转基因基因的表达量都比野生型高得多LBD16或LBD18,而互补株系的AR值与野生型Col-0的AR值具有可比性[图。3.].这一结果表明,单的小黑裙在ARF7下游调节的转录因子基因不足以过量产生转基因植物的ARS。
据此前报道,根尖部分argonaute1(ago1)突变体在AUXIN [中,突变体在AR形成中显示缺陷,但不在LR开发中[31.].AGO1是在后术后基因沉默的调节中发挥着关键作用的组件之一[58.].ARF17,是上调的ago1突变体通过抑制AR的形成负调控AR的形成GH3.的基因,由此扰乱生长素动态平衡在光依赖性方式[31.].这些结果表明,AR开发在拟南芥中具有LR开发的独特和共享组成部分。识别独特组成部分,在AR开发中起着关键作用,有助于发现AR和LR开发之间的独特发展过程。
结论
的ARF7/ARF19-LBD16/LBD18通过AUX1/LAX3生长素内流载体的转录模块在拟南芥下胚轴AR的形成中起重要作用,表明生长素信号转导过程中LR和AR的形成利用了一种共同的调控机制。
方法
植物生长和组织治疗
拟南芥按照前面描述的方法种植和处理幼苗[59.].对于生长素IAA处理,幼苗在23℃下在琼脂平板顶部的3mm Whatman滤纸上生长16小时。将装有幼苗的滤纸转移到20 μM的IAA培养皿中,在23℃的光照下轻轻摇晃培养一段时间。光强约为120 μmol m- 2年代- 1并由三个日光波长荧光灯泡(Kumho Electric Co.)提供。
植物材料
的拟南芥本研究采用生态型Columbia (Col-0)。我们使用纯合子T-DNA插入突变株lbd16,lbd18,lbd18, aux1 Lax3, Lax3 lbd16,lax3 lbd18,LAX3 LBD16 LBD18,aux1 lbd16,aux1 lbd18,aux1 lbd16 lbd18,aux1 lax3 lbd16,aux1 lax3 lbd18,Aux1 lax3 lbd16 lbd18, arf7,ARF19,arf7 arf19,是在以前的研究中发展起来的[37.,45.,51.,52.].我们确定了arf6-1(CS24606)和arf8-2(CS24608)从拟南芥生物资源中心(ABRC)的敲除T-DNA插入突变体。的proLBD16:Gus.和proLBD18:Gus.从以前的研究中获得的转基因植物[37.].proLAX3:Gus.马尔科姆·贝内特博士慷慨地提供了转基因种子[51.].proARF7:Gus.(CS24633)和proARF19:Gus.(CS24634)转基因种子取自ABRC。生成proLBD16:LBD16:4XMYC在里面lbd16突变体背景,启动子区LBD16,通过PCR使用PCR扩增 - 1309至-21bp相对于八月密码子进行扩增空斑形成单位DNA聚合酶与引物窝藏不是我(n-terminus)和ASC.I(C-末端)位点,并且被克隆到pENTR™/ SD / d-TOPO(Invitrogen)载体,以产PENTR™/ SD / D-TOPO:PROLBD16.的LBD16DNA片段被插入PENTR™/ SD / D-TOPO:PROLBD16与质粒ASC.在N-和c -端同时限制I位点,得到aPENTR™/ SD / D-TOPO:PROLBD16:LBD16.质粒。通过LR重组反应将该构建物亚克隆到目的载体pGWB516 (Nakagawa, Shimane University, Japan)中,然后转化为lbd16农杆菌介导的突变体,产生proLBD16:LBD16:4XMYC/lbd16拟南芥。proLBD18:LBD18:3xha/lbd18使用了以前研究中生成的拟南芥[60.].pro35年代: LBD16: GR/arf7 arf19和pro35年代: LBD18: GR/arf7 arf19通过交叉产生转基因突变体arf7-1 arf19-1(女性)与pro35年代: LBD16: GR(男性)或pro35年代: LBD18: GR(男)37.].按基因型分离纯合子系,缺乏侧根表型arf7-1 arf19-1并通过PCR检测基因组DNALBD16: GR或LBD18:GR.转基因。通过使用前通过基因分型确认所有突变体和转基因植物。本研究中使用的引物序列如附加文件所示2:表S1。
基于“增大化现实”技术的分析
下胚轴中ARs的诱导如前所述[32.].种子灭菌后,播种于平板上,4℃孵育2 d分层,转光照数小时诱导萌发。然后在黑暗中垂直放置3 d,直到下胚轴长约6mm,然后转移到光照下7 d,计数出现的ARs。
RNA分离及RT-qPCR分析
处理后,拟南芥植物立即在液氮中冷冻并储存在-80℃。对于逆转录定量聚合酶链反应(RT-QPCR)分析,使用RNEasy植物迷你试剂盒(QIAGEN)提取总RNA,并且使用Quantitect Sybr Greent-PCR套件进行实时RT-PCR(Qiagen)在CFX96™实时系统中,使用如前所述的C1000™热循环仪(BIO-RAD)[61].所有RT-qPCR的一式三份生物重复进行,并进行统计分析。如先前所述进行用于确定倍数变化相对基因表达数据的分析[60.,62].如先前所述进行用于确定转录物的拷贝数和用于测定反应特异性的数据分析61].RT-qPCR条件及引物序列见附加文件2:表S1。用于RT-QPCR的实验条件遵循MIQE(公布定量实时PCR实验的最小信息)要求如附加文件中所述3.:表S2。
显微镜和组织化学GUS检测
如前所述,对幼苗进行了全株可视化和GUS活性的组织化学分析[63].
统计分析
定量数据使用Student 's软件对每一对比较进行统计分析t-test(Windows版本20.0的预测分析软件)。
缩写
- ar:
-
不定根
- 东盟地区论坛:
-
生长素响应因子
- AUX / IAA:
-
蟾蜍蛋白/吲哚乙酸蛋白
- 格斯:
-
ß葡萄糖醛酸酶
- 小黑裙/美国手语:
-
横向器官边界域/不对称叶片2状
- RT-QPCR:
-
定量逆转录-PCR
参考
- 1。
2 .黄志强,李志强,李志强,等。不定根与侧根的异同。植物学报。2014;65:639-66。
- 2。
Hochholdinger女,沃尔K,绍尔男,的根形成在玉米Dembinsky D.遗传解剖(玉蜀黍)揭示了根型特定的发育程序。Ann Bot。2004; 93:359-68。
- 3.
Osmont KS, Sibout R, Hardtke CS。隐藏分支:根系统架构的发展。植物学报2007;58:93-113。
- 4.
Geiss G,Gutierrez L,Bellini C.不定根根组:新的见解和观点。:年度植物评论第37卷:根籍开发;2009年。
- 5。
李S-W,Xue L,Xu S,Feng H,An L.过氧化氢作为绿豆幼苗不定根形成中的信号分子。Environ Exp Bot。2009; 65:63-71。
- 6。
LavenusĴ,吴T,罗伯茨I,Guyomarc'h S,卢卡斯男,迪斯梅特I,Fukaki H,Beeckman T,贝内特男,Laplaze L.侧根发育拟南芥:生长素的50种色调。趋势植物SCI。2013; 18:450-8。
- 7.
基于AFB-Salehin男,巴格奇R,埃斯特尔M. SCFTIR1 /生长素感知:机制和在植物生长和发育的作用。植物细胞。2015; 27:9-19。
- 8.
对生长素激素的转录反应。植物生物学学报。2016;67:539-74。
- 9.
杜Y,Scheres B.侧根形成和养肝的多种作用。J Exp Bot。2018; 69:155-67。
- 10。
Benkova E,Michniewicz男,绍尔男,跳Teichmann T,Seifertova d,尤尔根斯G,Friml J.本地,流出依赖性生长素梯度作为植物器官形成一个公用模块。细胞。2003; 115:591-602。
- 11.
Geldner N,里希特S,Vieten A,马夸特S,托雷斯 - 鲁伊兹RA,迈耶U,尤尔根斯G.部分丧失功能基因揭示GNOM在拟南芥中的生长素运输相关,后期胚胎发育的作用。发展。2004; 131:389-400。
- 12.
Weijers d,Benkova E,雅格KE,Schlereth A,Hamann的T,Kientz男,Wilmoth JC,里德JW,通过ARF的对和AUX / IAA转录调节生长素应答的尤尔根斯G.发育特异性。EMBO J. 2005,24:1874年至1885年。
- 13。
veroux T, Brunoud G, Farcot E, Morin V, Van den Daele H, Legrand J, Oliva M, Das P, Larrieu A, Wells D,等。生长素信号网络在茎尖将动态输入转化为健壮的模式。摩尔系统生物学。2011;7:508。
- 14。
Fu X, Harberd NP。生长素通过调节赤霉素反应促进拟南芥根的生长。大自然。2003;421:740-3。
- 15.
Petrasek J,Friml J.植物林植物开发途径。发展。2009; 136:2675-88。
- 16。
王志强,王志强。植物生长素对植物生长发育的影响。细胞。2009;136:1005-16。
- 17.
盖斯勒男,王B,在根向地朱J.生长素运输:运输和技术。植物生物学(Stuttg)。2014; 16(增刊1):50-7。
- 18.
Laskowski M,Grieneisen Va,Hofhuis H,Hove Ca,Hogeweg P,Maree AF,Scheres B.从耦合细胞形状到助长传输的根系结构。Plos Biol。2008; 6:E307。
- 19.
Marhavy P,Vanstraelen M,De Rybel B,Zhaojun D,Bennett MJ,Beeckman T,Benkova E. endodermis和Furicycle之间的植物素回流促进了侧根引发。Embo J. 2013; 32:149-58。
- 20.
佩雷特B,米德尔顿AM,法语AP,拉里厄A,Bishopp A,NJO男,韦尔斯DM,波哥S,梅勒N,带LR,等人。生长素流出和流入载流子的序列诱导调节侧根的出现。MOL SYST BIOL。2013; 9:699。
- 21.
da Costa CT, de Almeida MR, Ruedell CM, Schwambach J, Maraschin FS, Fett-Neto AG。当逆境和发育同时发生时:扦插不定根的主要激素控制。植物科学学报2013;4:133。
- 22.
Sukumar P,Maloney GS,Muday GK。ATP结合盒B19的局部诱导B19 Auxin转运蛋白增强了拟南芥中的不定根形成。植物理性。2013; 162:1392-405。
- 23。
徐米,朱禄,寿何,吴P.一个Pin1家族基因,OSPin1,参与养阴依赖的不定根出现和分蘖。植物细胞生理。2005; 46:1674-81。
- 24。
淹水番茄不定根形成过程中激素的相互作用。植物j . 2010; 63:551 - 62。
- 25。
Lombardi-Crestana S, da Silva Azevedo M, e Silva GF, Pino LE, Appezzato-da-Gloria B, Figueira A, Nogueira FT, Peres LE。番茄(Solanum lycopersicum cv.)自然遗传变异Rg1和DELLA突变体procera控制形成不定根和芽的能力。J Exp Bot. 2012; 63:5689-703。
- 26。
OH K,Ivanchenko Mg,White TJ,Lomax TL。番茄的尼染蛋白基因编码了一种环托胺素:一种新型助长信号传导的球员。Planta。2006; 224:133-44。
- 27。
Ivanchenko mg,朱茹,王b,medvecka e,du y,azzarello e,mancuso s,megraw m,firichkin s,dubrovsky jg等。Cellophilin诊断毒物基因对根部和芽的植物素转运以控制侧根形成。发展。2015; 142:712-21。
- 28。
Retzer K,Luschnig C. DIAGEOTROPICA:从生长素沼泽消息。趋势植物SCI。2015; 20:328-9。
- 29。
Spiegelman Z,火腿BK,张Z,TOAL TW,BRADY SM,Zheng Y,Fei Z,Lucas WJ。WOLF S.番茄植物 - 流动蛋白通过在遥远的器官中介导植物蛋白反应来调节脱枝比。工厂J. 2015; 83:853-63。
- 30.
Mockaitis K,Estelle M.植物素受体和植物开发:一种新的信号范式。Annu Rev Cell Dev Biol。2008; 24:55-80。
- 31.
Sorin C, Bussell JD, Camus I, Ljung K, Kowalczyk M, Geiss G, McKhann H, Garcion C, Vaucheret H, Sandberg G, et al., et al., et al.等。拟南芥不定根的生长素和光控制需要ARGONAUTE1。植物细胞。2005;17:1343-59。
- 32.
Gutierrez L,Bussell JD,Pacurar di,Schwambach J,Pacurar M,Bellini C.拟南芥中偶然生根的表型可塑性受促进症响应因素转录物和MicroRNA丰富的复杂调节来控制。植物细胞。2009; 21:3119-32。
- 33.
Gutierrez L,Mongelard G,Flokova K,Pacurar di,Novak O,Staswick P,Kowalczyk M,Pacurar M,Demailly H,Geiss G,等人。植物蛋白通过调节茉莉酸性稳态来控制拟南芥不定目的根起因。植物细胞。2012; 24:2515-27。
- 34。
Okushima Y,Overvoorde PJ,Arima K,Alonso JM,Chan A,Chang C,Ecker Jr,Hughes B,Lui A,Nguyen D等人。拟南芥植物症响应因子基因家族成员的功能基因组分析:ARF7和ARF19的独特和重叠功能。植物细胞。2005; 17:444-63。
- 35。
Vanneste S,德Rybel B,的Beemster GT,Ljung的K,迪斯梅特I,范Isterdael G,Naudts男,饭田R,Gruissem W,田坂M等人。在中柱鞘细胞周期进程是不足以在拟南芥孤ROOT / IAA14介导的侧根开始。植物细胞。2005; 17:3035-50。
- 36。
Wilmoth JC, Wang S, Tiwari SB, Joshi AD, Hagen G, Guilfoyle TJ, Alonso JM, Ecker JR, Reed JW。NPH4/ARF7和ARF19促进叶片扩张和生长素诱导的侧根形成。植物j . 2005; 43:118-30。
- 37。
LBD18/ASL20与拟南芥ARF7和ARF19下游LBD16/ASL18联合调控侧根形成。植物杂志。2009;151:1377 - 89。
- 38。
De Smet I, Lau S, Voss U, Vanneste S, Benjamins R, Rademacher EH, Schlereth A, De Rybel B, Vassileva V, Grunewald W, et al.;双模生长素反应控制拟南芥的器官发生。美国国家科学院学报2010;107:2705-10。
- 39。
Inukai Y,Sakamoto T,Ueguchi-Tanaka M,Shibata Y,Gomi K,Umemura I,Haegawa Y,Ashikari M,Kitano H,Matsuoka M. Crown Root.1,这对于稻米氏蛋白根部形成至关重要,是一种目标助线信令中的助长响应因子。植物细胞。2005; 17:1387-96。
- 40.
Liu H, Wang S ., Yu X ., Yu J ., He X ., Zhang S ., Shou H ., Wu P. ARL1:水稻不定根形成所需的lob结构域蛋白。植物j . 2005; 43:47-56。
- 41.
王D,Pei K,Fu Y,Sun Z,Li S,Liu H,Tang K,Han B,Tao Y.稻瘟病响应因子(ARF)基因家族的基因组宽分析(Oryza Sativa)。基因。2007; 394:13-24。
- 42.
Okushima Y,Fukaki H,小野田男,Theologis A,田坂M. ARF7和ARF19调节通过在拟南芥LBD / ASL基因直接激活侧根形成。植物细胞。2007; 19:118-30。
- 43.
Lee HW,Kim MJ,Kim Ny,Lee Sh,Kim J.LBD18充当转录活化剂,直接与扩展蛋白14启动子结合,促进拟南芥的横向根出来。工厂J. 2013; 73:212-24。
- 44.
Lee HW,Kim Mj,Park My,Han Kh,Kim J.LBD18的LOB域中的保守脯氨酸残基对DNA结合和生物功能至关重要。莫尔植物。2013; 6:1722-5。
- 45.
Lee HW,Cho C,Kim J.横向器官界限Domain16和18在助胰1和类似的-Auxin3中下游作用,以控制拟南芥中的侧根发育。植物理性。2015; 168:1792-806。
- 46.
Berckmans B, Vassileva V, Schmid SP, Maes S, Parizot B, Naramoto S, Magyar Z, Alvim Kamei CL, Koncz C, Bogre L, et al.;侧边器官边界蛋白通过拟南芥E2Fa转录调控生长素依赖的细胞周期重新激活。植物细胞。2011;23:3671 - 83。
- 47。
冯志刚,孙旭,王刚,刘华,朱军。拟南芥侧根形成过程中LBD29对生长素响应的细胞周期进程调控。安机器人。2012;110:1-10。
- 48。
GOH T,JOI S,Mimura T,Fukaki H.拟南芥侧根创始细胞的不对称性的建立由LBD16 / ASL18和相关的LBD / ASL蛋白调节。发展。2012; 139:883-93。
- 49。
波哥S,拉里厄A,都Y,Gaudinier A,吴T,Swarup K,Swarup R,Kuempers B,Bishopp A,Lavenus J,等。在拟南芥侧根的出现依赖于生长素涌入载体LAX3的转录因子LBD29调节。发展。2016; 143:3340-9。
- 50。
Marchant的A,Bhalerao R,卡西米罗I,EklofĴ,卡西奥PJ,贝内特男,桑德伯格G. AUX1通过促进在拟南芥幼苗接收器和源的组织之间的吲哚-3-乙酸分布促进侧根形成。植物细胞。2002; 14:589-97。
- 51.
斯瓦卢普K,本科瓦E,斯瓦卢普R, Casimiro I, Peret B, Yang Y, Parry G, Nielsen E, De Smet I, Vanneste S,等。生长素流入载体LAX3促进侧根的出现。Nat Cell Biol. 2008; 10:946-54。
- 52.
ia1下游生长素响应转录组的全基因组分析及其表达分析揭示了生长素调控基因表达的多样性和复杂性。J Exp Bot. 2009; 60:3935-57。
- 53.
Malamy JE, Benfey PN。拟南芥侧根的组织和细胞分化。发展。1997;124:33-44。
- 54.
卡西米罗I,Beeckman T,格雷厄姆N,Bhalerao R,章H,卡西奥P,Sandberg的G,贝内特MJ。解剖拟南芥侧根发育。趋势植物SCI。2003; 8:165-71。
- 55.
de Klerk G-J, van der Krieken W, de Jong JC。回顾不定根的形成。新概念,新可能性。体外细胞发育生物学杂志1999;35:19 9 - 99。
- 56.
Boerjan W,Cervera Mt,Delarue M,Beeckman T,Dewitte W,Bellini C,Caboche M,Van OnCheLen H,Van Montagu M,Inze D.Superroot,拟南芥中的隐性突变,赋予养猪过度生产。植物细胞。1995年; 7:1405-19。
- 57.
Coudert Y,Le Va,Adam H,BES M,Vignols F,Jouannics,Guiderdoni E,Gantet P.冠Roolless1-调节基因鉴定水稻的鉴定揭示了后期的根系形成的特定和保守的元素。新植物。2015; 206:243-54。
- 58。
Vaucheret H,巴斯克斯男,克里特P,巴特尔DP。ARGONAUTE1在miRNA途径的行动,并通过miRNA途径及其调控是植物发展至关重要。基因开发。2004; 18:1187年至1197年。
- 59。
在类固醇调控诱导系统中,IAA1结构域II突变可产生不同的生长素相关表型,并抑制生长素激活的aux/IAA基因的表达。植物j . 2002; 32:669 - 83。
- 60.
LBD18利用正反馈回路的双模式调控拟南芥ARF的表达和转录活性。植物j . 2018; 95:233-51。
- 61.
全度Ĵ,金NY,金S,康NY,诺瓦克O,喾SJ,卓C,李DJ,李EJ,斯特尔纳德M等人。细胞分裂素双组分信号系统的一个子集起着在拟南芥冷温度应激反应的作用。J Biol Chem。2010; 285:23371-86。
- 62.
Livak KJ,Schmittgen TD。分析使用实时定量PCR和2(-Delta德尔塔C(T))方法相对基因表达数据。方法。2001; 25:402-8。
- 63.
关键词:冷胁迫,拟南芥,细胞分裂素应答因子2 (CRF2),侧根发育植物细胞。2016;28:1828-43。
致谢
不适用。
资金
本研究支持由下一代BioGreen 21项目(PJ013220),农村发展管理(RDA),韩国,中期研究项目(2016 r1a2b4015201)和基础研究实验室(2017 r1a4a1015620)通过韩国国家研究基金会(NRF),由教育部资助,给j·金的《韩国科学技术》RDA和NRF没有参与研究的设计、数据的收集、分析和解释,也没有参与手稿的撰写。
可用性数据和材料
支持我们的调查结果的所有数据都包含在稿件中。根据JK的要求提供构建和种子。
作者信息
从属关系
贡献
HWL,CC,SKP,YP和MJK设计并进行了实验并分析了数据。SKP准备了手稿草案。JK构思了该项目,设计了实验,分析了数据,并写了这篇文章。所有作者阅读并认可的终稿。
相应的作者
伦理宣言
伦理批准和同意参加
不适用。
同意出版物
不适用。
利益争夺
两位作者宣称他们没有相互竞争的利益。
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
权利和权限
开放访问本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
李,H.W.,CHO,C.,潘迪,S.K.et al。LBD16和LBD18代理的下游ARF7和ARF19参与拟南芥的不定根形成。BMC植物BIOL.19,46(2019)。https://doi.org/10.1186/s12870-019-1659-4
收到了:
接受:
发表:
关键字
- 拟南芥
- 不定根的形成
- 生长素响应因子
- 侧器官边界域
- LBD16
- LBD18