摘要
背景
赤霉素(GAs)及其调控因子DELLA参与植物生长发育的许多方面,目前关于赤霉素介导的GA信号的大部分知识都来自一年生物种的研究。为了了解多年生植物的GA-DELLA信号,我们培育了10株ga不敏感转基因葡萄,携带一个DELLA突变等位基因(Vvgai1)的背景葡萄并对其在茎、叶和根组织中的RNA表达谱进行了全面分析。
结果
转基因株系表现出不同程度的矮化和其他典型的DELLA突变表型,与基因水平密切相关Vvgai1表达式。在转基因株系的茎、叶和根组织中发现了大量差异表达基因,这些差异表达基因参与了不同的生物学过程;许多deg表现出很强的组织特异性,约30%的deg携带DELLA基序。我们进一步发现了几个关键的开花诱导基因出人意料的表达模式VvCO, VvCOL1而且VvTFL1.
结论
我们的研究结果不仅证实了以往在一年生植物中的许多DELLA研究发现,而且揭示了DELLA在葡萄中的新靶点和反应,包括同源结构域转录因子作为潜在的协同调控因子,在控制同时具有营养和生殖分生组织的葡萄的发育过程中发挥作用。一些关键开花诱导途径基因的不同响应为一年生和多年生植物GA-DELLA信号通路调控的差异提供了新的视角。
背景
赤霉素可以说在植物的整个生命周期中发挥着最广泛的作用。植物在不同发育阶段通过协调不同组织中GA的多个生物合成基因的激活和失活来严格调控GA的有效性[1].生物活性GA在各种组织中的流动速率和有效性水平受GA与其受体相互作用的不可抑制系统的调节Ga不敏感侏儒(GID1)与负调控因子DELLA合成三聚体GA:GID1:DELLA复合物[2].作为GA信号级联的关键组成部分,DELLA基因如Rht1从小麦和赤霉素不敏感(时至今日)拟南芥,已被广泛研究[3.].这些基因在其蛋白质序列中都携带一个保守的DELLA氨基酸结构域。DELLA结构域的关键功能获得突变阻止了与GA:GID1形成稳定的三聚体复合体,从而维持了GA信号的负调控[4].因此,缺乏ga的植物表现出许多异常发育特征,如叶片更小,颜色更深,节间长度缩短[5].除了DELLA蛋白基因在GA信号转导中的基本特征外[6],亦发现了许多控制模式种及一年生种多种性状发育的DELLA靶基因[7].相比之下,多年生木本植物DELLA调控的研究进展相对滞后,尽管从转基因杨树的研究中获得了一些关于DELLA调控的知识;转基因ga缺陷杨树的代谢和表型变化[8]被发现与他们的相似拟南芥突变体[9].类似于拟南芥丐帮携带不可降解DELLA基因的转基因杨树时至今日,一种变异的时至今日)为矮子,但对ga介导的野生型恢复不敏感[10,11].
小道消息(葡萄属)是多年生木本植物,具有重要的经济价值。DELLA介导的GA对葡萄生长发育的影响首次在葡萄品种L1分生组织层的一个体细胞变异中发现诉酿酒用葡萄莫尼耶皮诺[12].突变的葡萄植株携带野生型的每一个副本赤霉ACID-INSENSITIVE1(VvGAI1)和突变体(Vvgai1),并表现出节间长度缩短和植株高度缩短,这是DELLA突变体在许多物种中的标志性特征。突变葡萄还显示连续开花,在第一个花序出现后,大多数节点上都有花序。显然,GA和DELLA蛋白都参与了葡萄的花序形成、花诱导和浆果发育[13].
为了阐明della在葡萄发育中的作用,我们在一个鲜食葡萄品种的背景下创建了转基因品系,诉酿酒用葡萄“汤普森无籽”,携带葡萄突变DELLA基因,标记为Vvgai1[14].我们分析了非转基因和有代表性的转基因株系的茎、叶和根组织的RNA-Seq谱,并确认在葡萄中存在以della为中心的反馈机制,维持GA稳态[15]以及在一年生物种中发现的DELLAs与许多控制植物发育和生长的转录因子的复杂相互作用[16].我们进一步发现DELLA在葡萄卷须/花序发育的独特营养分生组织anlagen诱导中的可能作用[17],通过与分生组织调节器的协调。此外,我们还发现了包括葡萄在内的几个关键开花诱导基因的意想不到的表达模式君士坦斯(VvCO), CONSTANS 1(VvCO1),而且末梢花1 (VvTFL1或CENTRORADIALIS),这与一年生物种形成了鲜明的对比。这些发现为DELLA基因如何调节葡萄的发育和生长,特别是与开花有关的研究提供了见解,并填补了一年生和多年生物种之间这一重要研究领域的一些关键知识空白。
结果
转基因Vvgai1表达和表型
十个Vvgai1本研究生成了转基因葡萄,并选择了5个具有代表性的葡萄进行RNA-Seq分析,涵盖了一系列突变表型变异。4个转基因株系的节间长度均不同程度地显著短于NT,最严重的转基因株系G02节间长度约缩短了3倍(图2)。1a和b、表1).更严重的矮品系有更小的芽和更深的叶子,边缘卷曲。1c)与众不同诉酿酒用葡萄具有卷须的两个连续节点的芽型,后面跟着没有卷须的节点[18]在较短的矮品系中,卷须跳跃的频率较高。卷须在严重矮藤中也逐渐晚出现,G03的卷须晚到第10节,而NT的卷须晚到第5节。1d,表1).对于最严重的G02株系,即使在温室条件下生长1年后也未观察到卷须(数据未显示)。更严重的矮品系的根按比例增大且密度更大。1E, f)根系建立较差。
正如所料,Vvgai1数字qRT-PCR在5个转基因株系中均有表达,NT中无表达。在5个转基因株系中,最严重矮化株系G02在统计上表现最高Vvgai1在所有三种组织中的表达(表1,无花果。1a).这些结果表明,相对之间存在正对应关系Vvgai1表达水平(Vvgai1 / Vvgai1比率)和在转基因株系中观察到的表型变化的严重程度。
与转基因相关的差异表达基因Vvgai1表达式
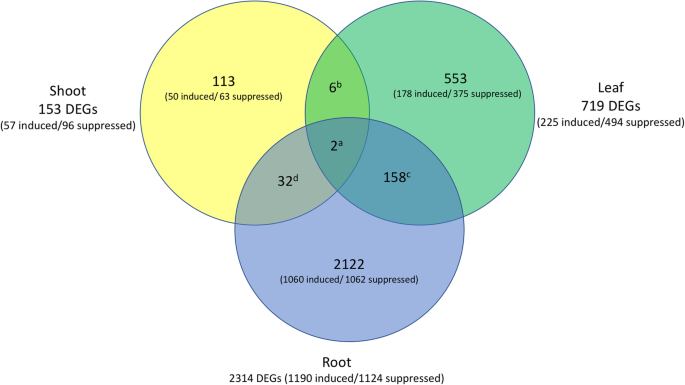
分别对5个转基因株系的叶、茎和根组织进行了差异基因表达分析。更严重的矮品系通常有更多的deg,尽管在根组织中没有观察到这种趋势。2,附加文件1:表S1)。捕获与之关联的deg的最大数目Vvgai1在假阳性最少的情况下,我们选择在最严重的转基因株系G02中仅保留这些deg(在FDR≤0.01时的1.5倍变化),并在其余四个转基因株系中至少有一个同时保留。我们还发现,在所有12个文库中,有25个基因最初被过滤掉,因为它们没有最低reads(即1CPM),但实际上它们只在转基因株系中表达,而在NT中被抑制,反之亦然(附加文件)2:表S2)。该修复系具有几个仅在转基因系叶片中诱导的细胞壁相关基因和一个关键的开花基因短营养期(VvSVP)在转基因株系的根部高度抑制。后续分析的最终deg数量分别为153、719和2314个,在三个样本组织中,总共有2986个基因至少有一次显著差异表达(图2)。2).
我们通过分析来自同一组织的30个与DELLA调控相关的显著基因的数字RT-PCR表达,验证了RNA-Seq数据。RT-PCR和RNA-Seq数据集的一般相关系数(r)在0.77到1.0之间,具有良好的一致性(附加文件)3.:表S3)。
基因本体(GO)分析
在茎部和叶片组织中标注的DEGs中,被抑制的DEGs(茎部96个,叶片494个)约为诱导的DEGs(茎部57个,叶片225个)的两倍,而根中也有相同数量的DEGs(被抑制1124个,诱导1190个)(图2)。2).丰富的GO术语在成员基因上有很大的重叠,语义聚类分析揭示了大约10个共同的相互依赖的生物学主题(表2).这并不奇怪,因为任意的聚类过程涉及大量具有广泛生物学作用的主生长调节剂,以协调植物的形态发生变化和对转录因子等刺激的反应南/ ATAF1, 2 / CUC2(南汽),WRKY,鳞状启动子结合蛋白样(SPL),TB1-CYC-PCF(TCP)而且THREE-AMINO-ACID-LOOP-EXTENSION(故事)一类同源蛋白。此外,还有大量生长素、细胞分裂素、油菜素内酯和乙烯等激素的生物合成和信号传递基因。
GA关键信号基因的表达谱
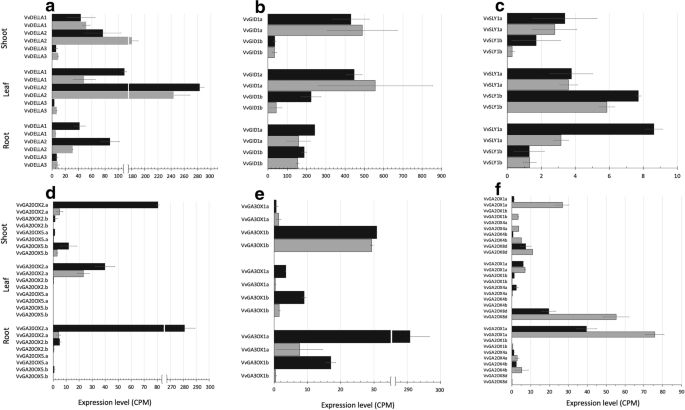
类似于当前接受的模型拟南芥[6],葡萄GA信号由三个DELLA同源体组成VvDELLA1,2而且3.,二GA受体GID1的VvGID1a而且VvGID1b.然而,葡萄藤有两个被提出的F-box SLY1基因,VvSLY1a而且VvSLY1b[19].VvDELLA1(同义VvGAI1)在茎部和叶部(~ 50 CPM)含量较高,约为根部(~ 10 CPM)的5倍。VvDELLA1然而,在转基因G02株系中,NT在叶片和根中表达的差异约为NT的两倍,但在茎中没有(图2)。3.一个)。VvDELLA2在3个NT组织中,根中表达量最高(30 ~ 240 CPM),在转基因G02株系中,根中表达量增加2倍以上,而在其他2个组织中表达量不增加。VvDELLA3在NT和转基因背景下,三种组织中均以低水平表达(~ 10 CPM)。的表达式配置文件VvDELLA1而且VvDELLA2经RT-PCR验证,相关系数高(r = ~ 0.95,附加文件3.:表S3)。内生VvDELLAs似乎对转基因生物有反应和诱导作用Vvgai1.
GA受体GID1的两个同源物在NT的所有组织中都有大量表达。VvGID1b显示在叶片中表达增加了5倍(~ 40 CPM到~ 220 CPM)(图。3.b).两个葡萄F-box基因,VvSLY1a而且VvSLY1b,在NT和转基因背景中均表现出低水平的表达(< 10 CPM)。3.c)。
GA生物合成基因的同源物赤霉素氧化酶(GA3ox)而且GA20氧化酶(GA20ox),另一组接受della控制反馈机制的人(比如GID1) [20.],在所有三个样本组织中都被诱导,但诱导水平不同,似乎保留了这个多基因家族的观察到的组织特异性[21].VvGA20ox2a芽、叶和根分别增加了15倍、2倍和50倍(图2)。3.d).同样地,VvGA3ox1a叶片折叠超过4次,根折叠超过10次(图2)。3.e).一致,GA失活GA2ox在转基因背景下,基因普遍被抑制。最大的抑制被观察到VvGA2ox1a,在茎部和根部分别减少了9倍(从28次CPM减少到3次CPM)和2倍(从76次CPM减少到40次CPM)。VvGA2ox8a也被抑制,叶片减少了约2.5倍(55到20 CPM)(图。3.f).这些结果肯定了DELLA促进的正反馈机制GID1以及生物合成基因GA20ox而且GA3ox[15].有趣的是,在本研究中,我们观察到这种反馈信号具有组织特异性,即不同GID1和GA在不同组织中诱导的生物合成同源物。
影响茎、叶和根发育的一些关键基因的表达谱
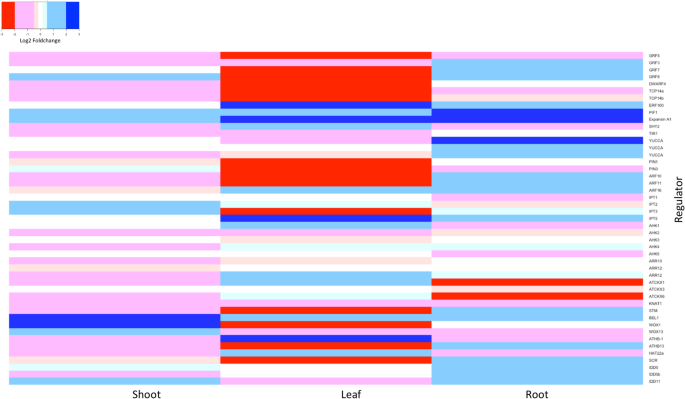
观察到的一些高度反应性的deg是发育过程的调节因子。在被高度压制的人群中有生长调节因子(GRF)基因家族,主要存在于花萼分生组织和叶原基中的重要调控因子[22].例如,同系物GRF5控制与叶片大小相关的细胞数量[23]在G02的叶片中被抑制了大约20次(图2)。4).油菜素内酯生物合成基因矮人4,另一个与生长素协同相关的关键基因[24]及通用规则[25],其功能丧失的突变体是短小的,叶柄较短,叶片为圆形和深绿色[26],在所有三种组织中均被抑制,但在G02系的叶片中尤其被抑制9倍(图2)。4).TCP转录因子是影响株高、叶片弯曲的主要调控因子[27]和葡萄藤的卷须分叶图案[28],在转基因G02株系的茎和叶中被抑制了4到9倍(图2)。4).
光介导的发育过程基因明显被诱导。ERF105,一种在强光和冰冻胁迫条件下活跃的基因[29,30.],分别在叶片和根上进行7次和3次折叠诱导光敏色素相互作用因子1,是一种主要基因,通过维持叶片中的细胞数量而参与叶绿体的产生[31],茎和叶增加了3倍,根增加了约8倍(图2)。4).细胞壁松动基因棒曲霉素A1在转基因背景下,茎部也被诱导了大约2倍,叶和根也被诱导了大约6倍(图2)。4).
生长素和细胞分裂素
生长素和细胞分裂素相关基因与GA-DELLA调控有广泛的交叉作用,是植物许多生长发育过程的主调控因子[32].生长素相关基因在所有转基因系中普遍活跃。短下胚轴2 (shy2 .),是生长素反应的负调节因子[33],为负相关Vvgai1在转基因株系G02中,茎和根的表达分别受到约2倍和4倍的抑制(图2)。4).相反,葡萄的同源基因转运抑制剂反应1(TIR1),是生长素的正向调节因子[34],只在茎部有轻微的诱导,但在根部增加了大约两倍.结合生长素生物合成基因的两个同源物丝兰在根部表现出较明显的诱导反应。另一方面,生长素相关转运蛋白和响应因子在样本组织中表现出不同的响应,反映了生长素的动态通量。葡萄的同源物PIN-FORMED3 (PIN3)是否被抑制,并与Vvgai1我们的qRT-PCR(附加文件)验证了这一点3.:表S3)。葡萄的同源物生长素反应因子11(ARF11),是细胞分裂素在根部过表达时拮抗的响应因子之一[35]被强烈诱导。有趣的是,在我们的转基因系中,细胞分裂素相关基因的活性似乎异常低。该生物合成基因同源ISOPENTENYLTRANSFERASE2(IPT2),IPT3在三个样本组织中均为低表达水平(10 CPM)。葡萄细胞分裂素氧化酶(CKX)细胞分裂素不可逆失活基因家族[36]在根中被抑制,尽管一些有趣的是在叶中被诱导。4).
同源域基因家族
许多同源结构域转录因子的表达普遍受到抑制,其中大量属于类故事,Wuschel相关homeobox(WOX),HOMEODOMAIN-LEUCINE拉链(HD-ZIP)(附加文件1:表S1)。这些同源结构域转录因子广泛参与分生组织维持和植物形态的调控[37],以及芽层结构明显中断[38].故事有两个亚科,KNOTTED1-like(诺克斯),有缘(贝尔).在诺克斯亚科,拟南芥的结状(KNAT1),拍摄MERISTEMLESS(扫描隧道显微镜)是在芽尖分生组织(SAM)中与细胞分裂素协同作用的同源对[39].我们观察到扫描隧道显微镜在转基因株系G02的茎和叶中均被抑制;KNAT1仅在茎部被抑制(图;4);而且KNAT1在叶片中不表达,这与它在叶原基起始中的负作用是一致的[40].BEL1(敲钟人加1),是BEL亚家族的一员,形成关键的KNOX-BEL异二聚体,以适当启动和维持顶端分生组织[41],在转基因株系G02的三个组织中均有诱导。WOX家族基因是胚胎发生和侧器官形成过程中发现的特化转录因子[42].在转基因系G02中,WOX1基因在茎部诱导,在叶部抑制WOX13在根部被抑制(图;4).此外,我们发现HD-ZIP家族成员基因在茎和根组织中普遍被抑制。HD-ZIP成员基因与器官和血管发育相关[43].
开花诱导途径
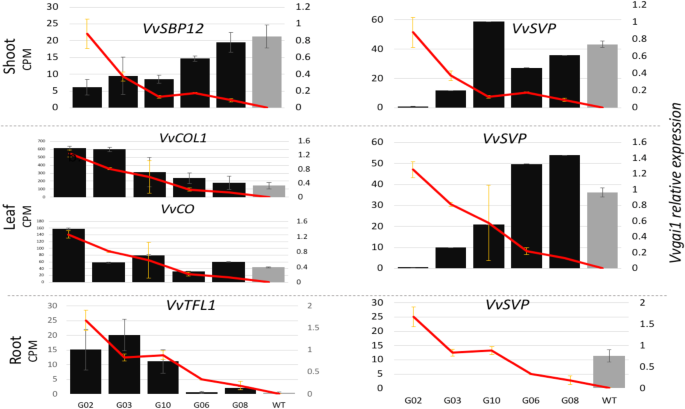
四个与开花相关的基因表现出显著的反应Vvgail本研究中的表达。VvSBP12是mir156靶向葡萄SPL基因的一员[44及其同系词in拟南芥,AtSPL3,被证明是DELLA抑制的靶点,也是miRNA156/−172相变调控的靶点[45].的VvSBP12在G02株系的所有三个组织中均被抑制,尤其是在茎部(图2)。5).有趣的是,一个与miRNA代谢相关的新基因家族的同源物之一HEN1 [46],在三个组织中表现出不同的反应模式,在茎和叶中被诱导,但在根中被强烈抑制(附加文件1:表S1)。另一方面,这两个君士坦斯葡萄藤的同源词,VvCOL1而且VvCO在三种组织中均有诱导(图;5),与拟南芥的在那里,他们被报告为DELLA镇压的目标[47].有趣的是,VvTFL1基因,分生组织身份的负调控因子[48],在嫩枝中明显被抑制,但在根中却被诱导。5、表3.,附加文件1:表S1)。qRT-PCR结果验证了这一有趣的表达谱(r = ~ 0.99)(附加文件3.:表S3)。此外,我们观察到mads结构域携带VvSVP基因在三种组织中均被高度抑制(图;5).从上述关键开花诱导基因的抑制状态预测,我们发现一些花分生组织特征基因没有被诱导。虽然花分生组织同一性基因开花位点t(英国《金融时报》)在NT和转基因株系中均未检测到转录本constans过表达抑制因子(SOC1)表达,但无显著差异表达。LFY仅在芽中表达,同样没有差异表达。在葡萄中,这些分生组织特征基因在休眠后的侧枝中表达[49].
5个转基因株系(黑条)开花相关关键基因在茎、叶、根组织中的平均表达量(CPM),按矮化程度和NT(灰条)排列;Vvgai1表达式表示为红线图(见表1)
转录因子基序富集
转录因子富集分析Vvgai1-相关的DEGs (r≥abs(0.70))显示共有17个显著过度代表的调控基序(附加文件4:表S4)。其中DELLA基元在所有三个组织中都是最高的:45%的抑制DEGs出现在茎部(110个中有49个),37%的抑制DEGs出现在叶片(725个中有269个),34%的诱导DEGs出现在根(371个中有126个)。总共有395个携带della的deg,约占2986个的13%Vvgai1相关的度。
为了评估DELLA与其他转录因子可能共同调控的程度,我们检测了这395个携带DELLA的deg的其他调控基序的丰度。基于PlantTFDB 4.0的计算基元预测[50]揭示了除了DELLA基序之外,前面讨论的16个基序中至少有两个存在于这些deg中的任何一个(表3.,附加文件5:表S5),强调了涉及della的转录网络之间相互依赖的复杂性质。与DELLA共定位的最常见的基元是TALE、TCP、INDETERMINDATE DOMAIN (IDD)、AP2/ERF和成髓细胞病(MYB)基因家族。TALE是与DELLA共定位频率最高的motif,在茎、叶和根中分别共享71%(35 / 49)、62%(167 / 269)和46%(59 / 126)富含DELLA的DEGs(附加文件)5:表S5)。其余基序频率较低,且倾向于组织特异性。例如,I类和II类TCP基序在约4-10%的della富集的DEGs中被发现,其中大部分位于叶片中。R2R3 MYB基序,由三个基因(Myb15, myb61, myb88)参与气孔运动及木质化[51,52,53在茎部富含DELLA的DEGs中,约4-60%、叶片中约4-15%、根中约2-15%与DELLA共定位。C2H2锌指基序由两个IDD基因(IDD5而且IDD11),并与DELLA基序在茎部4-8%、叶部5-8%和根部2-17%的DEGs中共享。
具有预测DELLA-TALE基序的DEGs包括显著的分生组织调节基因,与Vvgai1在各自的组织中。在拍摄中,他们包括了被抑制的FT-LIKE同源物VvTFL1(r =−0.73)和VvSBP12(r =−0.73), SPL13(r =−0.71)SPL9(r =−0.75)3.).在叶子中,它们包括被抑制的基因,比如蛋白质-蛋白质介导的钙蛋白,IQ-domain 5(r =−0.96),生长素反应因子11 (r =−0.93),开花调节剂短时间内早栓(r =−0.82),叶片形态发生调节剂YABBY1(r =−0.92)和同源域BLH4(r =−0.78)。在根中,它们包括诱导基因VvTFL1(r = 0.76),BEL1(r = 0.81),是一种保护膜调节剂KANADI 4(r = 0.84)IDD5(r = 0.93)3.).
讨论
以前报道过对della介导的调控的全球反应,但大多数是针对特定组织或特定发育阶段的年度模式物种[21,54,55].在本研究中,我们分析了5个转基因ga不敏感株系的茎、叶和根的RNA-Seq谱,这些株系的突变表型严重程度与转基因水平一致Vvgai1表达式。通过检查差异表达和相关性Vvgai1在三个组织中,我们能够剖析DELLA的整体和组织特异性调控,这是其典型的调控特征之一[56].我们的研究不仅证实了许多先前报道的GA-和DELLA相关基因和GO过程,而且还发现了新的DELLA靶点和作用模式,包括分生组织调节因子参与共同调控葡萄的发育,并鉴定了几个关键的开花诱导基因Vvgai1不同于一年生物种。
DELLA对GA信号基因表达的影响
与上次报告一致[19],我们发现VvDELLA2在NT的所有三个组织中都有大量表达,其次是VvDELLA1的表达VvDELLA3通常都很低。有趣的是,内源性VvDELLAS被显著诱导,但因组织而异,表明它们的调控相互依赖性和组织特异性作用[19,57].同样有趣的是观察到Vvgai1(突变DELLA)和诱导的内源性DELLA转录本在野生型背景下没有像预期的那样降解。这也与观察到的非常低的转录水平相一致VvSLY1a而且VvSLY1b(无花果。3.b),通过泛素化降解DELLA的两个F-box基因[58].低SLY1先前发现表达与异常高的积累有关VvDELLA而且VvGID1成绩单(59].我们还注意到假定的della驱动的反馈诱导VvGID1[15]是组织特异性的,仅为两者之一VvGID1同系物(VvGID1b)表现出正相关的变化Vvgai1在叶组织中尤为明显。另一方面,不同同源的GA生物合成组分(GA20氧化酶和GA3氧化酶)以与每年相同的方式诱导[12,21]和多年生物种[10].
葡萄的DELLA和共同调控网络
本研究鉴定的2986个deg表达了大量富集的GO分子,这些GO分子在三种组织中以不同程度和不同响应状态重叠,不仅反映了GA信号级联的广度[55]以及组织内部和组织之间生物功能的动态协调[1,60].例如,一个较大的氧化石墨烯生物学术语与分生组织调节和模式规范过程有关,并且在茎和叶中被抑制的DEGs中大量富集。GO术语中包括基因家族的关键分生组织调节因子,如GRFs, SPLs, SVPs和基因,如淡水螯虾,AS1, STM而且KNAT1.然而,在根中,相同的GO项在诱导的deg中被富集,包括生长素受体TIR1以及主要的根生长和模式调节因子,即GRAS短的根(Shr),稻草人(scr)还有转录因子IDD5.
在转基因葡萄中,与分生组织相关的发育过程的失调是显而易见的,因为样本组织中许多类同源结构域转录因子通常处于抑制状态,包括I类KNOX转录因子,它与GA途径基因相互作用以维持SAM [21,37,39].在拟南芥,类KNOX基因扫描隧道显微镜而且KNAT1通过适当定位细胞分裂素和GA来关键地协调适当的SAM生长[39,61,62].ga不敏感的转录组扫描拟南芥突变体似乎两者都有扫描隧道显微镜而且KNAT1在早期并没有特别表达出来[15,55,63]与成虫开花期一样多[54,64].我们在ga不敏感葡萄生长早期响应的DEGs中发现了大量关键的同源结构域转录因子,这突出了葡萄芽中独特的器官发育过程——同一根尖分生组织中有一个独立的营养和生殖分生组织(即anlagen)——以及它所需要的营养和生殖阶段转变的复杂调控。
这种复杂的调控也反映在17个大而多样的转录因子基序中,统计上在DEGs中过度代表。其中,DELLA的数量最多,约占总数的30%,其次是TALE、TCP、MYB和IDD等几个分生组织调控因子的基元,以及WRKY、NAC和bHLH等应激反应调控因子的基元。其中许多基序与DELLA基序在DEGs中共定位,为DELLA与其他转录因子相互作用共同调节多种生物过程提供了机会[7,65].事实上,在携带della基序的deg中,几种重要调控基序在三种组织中以不同的富集形式存在。根中,AP2/ERF、MYB和IDD的基序相对富集。IDD基序的富集是值得注意的,因为IDD5同源物最近被证明在竞争相互作用中充当转录支架可控硅而且德拉在调节根的生长时[66].另一方面,在茎和叶中抑制的della - DEGs中,TALE、TCP和MYB的基序更加丰富。TALE尤其引人注目,因为它是与DELLA共同出现的最常见的主题。推测的DELLA-TALE携带基因家族包括影响萌发(Nuclear Factors Y, IDDs)、生长(GATAs)、节间伸长(GRFs)、茎叶扩张(YABBY, BEL)以及花诱导相位变化(SPLs)的基因, VvTFL1)的途径。这些不同转录调控因子的发现以及它们的基序与DELLA在DEGs中的共同存在,为GA-DELLA信号传导如何影响植物生长发育的许多不同方面提供了一个潜在的解释。
DELLA与葡萄根生长
转基因葡萄的一个有趣的表型变化是根变大,生根能力差(数据未显示)。在转基因株系中,根组织与茎和叶组织相比,deg的数量最多。在诱导的deg中,DELLA基序在统计学上过高。在这些诱导的携带della基序的deg中月,可控硅而且SCL3,这是与根系维持和模式有关的GRAS基因[67].在转基因GA不敏感杨树的转录组分析中可控硅也是被发现诱发[68].然而,我们观察到许多细胞周期蛋白基因,特别是d型细胞周期蛋白,在我们转基因葡萄的叶和根中处于抑制状态,而它们在转基因杨树中被诱导。68].d型周期蛋白是SHR-SCR复合物的相互激活剂[69]和细胞分裂素[70]顶端分生组织中形成细胞分裂和侧部器官形成的调节网络[71].在本研究中,抑制这些细胞周期蛋白可能会破坏它们与shrr - scr复合物和细胞分裂素的相互作用,这可能解释了在我们的研究中观察到的较差的生根能力,而在转基因杨树中观察到的旺盛的根系。
我们推断,细胞分裂素在我们的转基因系中减少了,这是基于其生物合成的相对较低的转录水平(即。IPT2而且IPT3)、信号接收(例如:AHK4)和响应调节器(B型RR)组件。根系变大可能是过渡区细胞分裂素水平较低的表现,在过渡区细胞分裂素水平通常保持在相对高于生长素的水平,以促进细胞分化和根分生组织大小稳态的建立[72].相反,根尖通常保持高水平的生长素,有利于维持干细胞生态位所需的细胞分裂,这似乎是我们转基因葡萄的情况,由生长素生物合成的诱导状态(即。丝兰)、信号受体(即TIR1)、转运蛋白(即pin)和响应因子(即arf)。批判性地,我们观察到SHY2,生长素的关键负调控因子:细胞分裂素的串扰和平衡[73],被抑制,并呈负相关Vvgai1在嫩枝和根部。我们无法找到并确认是否SHY2同样在转基因GA不敏感杨树的微阵列研究中被抑制[68].然而,从上面讨论的表达谱来看,我们的转基因系似乎长期缺乏细胞分裂素和高生长素。转基因葡萄根的增大可能是由于低水平的细胞分裂素,从而降低了细胞分化水平,并适当控制了根分生组织的大小。与此同时,生长素:细胞分裂素之间的平衡被破坏可能导致生长素的更多积累,从而导致先前在研究中观察到的生根能力较差拟南芥[74].
DELLA和葡萄开花诱导
诱导反应VvCO而且VvCOL1来Vvgail这项研究的发现与之前的发现形成了鲜明的对比AtCO被DELLA压制在拟南芥[47].最近的研究表明,VvCO而且VvCOL1正调控葡萄侧芽诱导和休眠但是相比之下有限公司而且COL1在拟南芥的日振荡VvCO而且VvCOL1受连续光的影响较小,振幅较大,在黎明时达到峰值[75].由于低温有利于葡萄藤卷须而不是花序[76], GA信号呈日周期性拟南芥[77], GA和葡萄的光周期通路基因可能已经被适应性地修改,以感知更温暖的温度和光强,以及更少的日照时间作为花诱导的主要刺激[76].
类似于ga不敏感拟南芥[45],表达了几种VvSPL转基因株系的茎部和叶部基因均受到抑制。的GA-insensitive拟南芥是晚开花,因为DELLA隔离了SPL调节器,基本上延长了幼年期。然而,在葡萄中,幼体和成体之间的区别不那么明确,而且由于同一茎芽中同时存在营养分生组织和生殖分生组织而模糊了[78].最近对卷须和花序发育的转录组研究揭示了这一点VvSPLS在卷须和花序发育早期均有明显表达[79],表明在葡萄中,当胚根向卷须或花序的形成分化时,发生了等效的相变。至少有一个VvSPL年代,VvSBP12,据报道携带miRNA156/172调控基序[44],这就提出了miRNAs在葡萄芽结构和胚芽发育过程中发挥作用的可能性。VvSBP12的一年生模式植物中的同源体介导了许多相相关的发育过程,包括第一片真叶的开始拟南芥(AtSPL13[80]),颗粒增大(OsSPL16[81]),以及玉米穗颖的发育(TGA1[82])。压制VvSPL本研究中的基因可能解释了观察到的与高水平的无卷须淋巴结相关的渐进性严重程度Vvgai1表达式。我们注意到参与miRNA代谢的dicer样基因HEN1 [46]在芽和叶中诱导。然而,HEN1在根中被抑制,而另一个dicer同源物CARPEL FACTORY (CAF)则不相关Vvgai1表明DELLA、SPLs和miRNA之间存在复杂的相互作用。
我们发现基因VvSVP,一个MADS盒基因也参与了依赖于相转变的开花拟南芥[45,83],在叶和茎组织中显著抑制。被抑制的表达VvSVP而且VvSBP12在转基因植株中,与所观察到的卷须延迟出现和茎叶层序渐进式中断相一致。这也得到了事实的支持VvSVP被认为是葡萄花转化的正向调节因子[13,79,84],而不是消极的监管者拟南芥[83].
有趣的是,我们还发现了一种拮抗开花基因,VvTFL1在根中诱导,在芽中抑制,在叶中不表达。自VvTFL1手机是可移动的吗85,诱导的VvTFL1在根中可以迁移并作为分生组织同一基因的拮抗剂发挥作用LFY花卉积分器VvFT在葡萄藤上。这一发现可能表明根通过GA-DELLA信号级联参与了葡萄开花的整体调控。
结论
葡萄作为多年生植物具有与一年生植物相似的以della为中心的反馈机制,通过DELLAs与众多专门的转录因子的复杂相互作用来维持GA内稳态和控制植物的发育和生长。然而,这些相互作用的结果在多年生和一年生物种之间可能有很大的不同,本研究表明,某些开花诱导和发育途径基因在葡萄中的表达行为与一年生物种形成了鲜明的对比。有趣的是,观察到同源结构域转录因子似乎在协调葡萄营养和生殖的转变中起着重要作用,即营养分生组织和生殖分生组织同时存在于同一茎上。
方法
表达式盒和转换
一个二进制向量结构,命名为pVv::VvGAIL38H在这项研究中使用的是一种改良的5.1公斤长的葡萄碎片VvGAI克隆自诉酿酒用葡萄“黑比诺”。修改后的VvGAI基因组序列在ATG起始密码子上游有一个2171 bp的序列,在编码的GAI蛋白DELLA结构域第38位氨基酸上有一个组氨酸(H)取代了亮氨酸氨基酸(L),在编码的GAI蛋白的终止密码子下游有一个1157 bp的序列,并引入了一个1773 bp的点突变。关于该结构的其他详细信息之前已报道过[14].
加州大学戴维斯分校的Ralph M. Parsons工厂改造设施(https://ptf.ucdavis.edu/services)培育出转基因葡萄农杆菌属中的基于变换诉酿酒用葡萄这项研究的“汤普森无籽”背景。十个转基因Vvgai1在初步评估后,本研究选取了5个具有代表性的葡萄树(表1)1).一个非转基因诉酿酒用葡萄提供“Thompson Seedless”作为对照。
转基因葡萄的繁殖和表型
新鲜接收的转基因葡萄种植在4英寸的盆栽中。花盆使用Promix生物杀菌剂介质(Premiere Horticulture,加拿大)。从单个转基因系中提取的绿茎扦插用于后续实验的多个无性系。通过应用常规的葡萄树管理实践,在温室中1加仑的花盆中种植葡萄树。
在转基因株系和NT的5个生物重复中,观察了株高、节间长和卷须分布模式等表型性状。在叶片重量方面,每个生物重复测量5 ~ 10个混合叶片。同样,采用丙酮萃取法,从每棵葡萄的五个展开叶片的合池叶盘中评估总叶绿素含量[86].在温室中生长5个月后,从贮藏罐中评估根系特征。
RNA-Seq库准备和序列读取处理
用于RNA-Seq分析的所有组织均取自单个转基因系的5个月大的葡萄无性系。为每个转基因株系和非转基因对照收集至少两个无性系葡萄的重复样品。取了三种类型的组织。茎部组织样本包含1-3厘米的主枝茎尖,包括顶端区域和两个幼叶,展开。叶组织样本是从顶部开始的第5和第6个展开的叶片,根是从存放的植物中剪下的几根3厘米的标本。所有样品均新鲜采集,快速冷冻并在−80°C保存,直至进一步加工。
RNA提取和RNA- seq文库制备如前所述[87].在纽约州伊萨卡的康奈尔大学生物技术资源中心使用Illumina HiSeq 2000对RNA-Seq文库进行2 × 100 bp(根和茎组织样本)成对端或单端100 bp(叶组织样本)测序。
使用Trimmomatic (Illumina, San Diego, CA, USA)和FastQC对每个RNA-Seq库的序列读取进行预处理。然后将无工件的序列单独对齐到葡萄属参考基因组(12X诉酿酒用葡萄, Phytozome over。12)使用Tophat2,遵循拼接感知RNAseq对齐的工作流程(http://ccb.jhu.edu/software/tophat/manual.shtml).
数字RT-PCR验证
选择30个基因进行数字RT-PCR验证RNA-Seq基因表达。cdna是从RNA-Seq文库中处理的相同mrna合成的。采用Qiagen多重PCR +试剂盒进行第一轮单个基因150-200 bp片段扩增。对于每个组织样本,进行四次多重反应,以覆盖30个基因中的40个不同区域。第二轮PCR扩增采用Illumina Nextera双标引物系统对每个样品进行条形码标记,PCR反应用amprexp纯化,10 μl水洗脱。将来自不同文库的等量DNA汇集在一起进行Illumina HighSeq测序(2 × 150配对端)。
三个序列片段分别与等位基因特异性SNP被扩增,以自信地区分转基因时至今日等位基因(Vvgai1, (14])从非转基因植物(VvGAI1, gsvivg01011710001 [19])的“Thompson Seedless”背景。的比率Vvgai1/VvGAI1然后取三个区域的平均值,用平均值之比反映转基因的相对qRT-PCR表达量Vvgai1在纸巾里。进一步利用qRT-PCR数据的平均比值,对单个内源基因的RNA-Seq表达水平与的RNA-Seq表达水平进行相关性分析Vvgai1通过不同的转基因葡萄。
微分表达式分析
对于每个组织,我们构建并分析了12个RNA-Seq文库样本:5个转基因株系和1个非转基因Thompson Seedless株系,每个株系都有两个生物重复。对茎段库样本进行单端测序,对其他两个组织进行配对测序。
每个reads的丰度由HTseq [88],用EdgeR进行差异表达分析[89],按照我们之前工作中描述的分析工作流[28].研究那些最有可能受到Vvgai1,我们只纳入了最强转基因株系G02和至少一个其他转基因株系中与非转基因对照(NT)相比发现的差异表达基因(FDR≤0.01时变化为1.5倍)。我们使用计数每百万映射reads (CPM)作为归一化表达单位来评估基因的表达水平。
功能分析
基因本体论(GO)分析了与之相关的degVvgai1(r > = 0.50)在个体组织中使用Plant MetGenMAP [90].为了简化模式解释,使用REVIGO[将得到的丰富GO术语列表(FDR≤0.10)聚类为相似的函数[91].评价内源基因对转基因的相对反应Vvgai1的相对表达量,计算各DEG在转基因株系间的表达变化与DEG的相对表达量的两两相关性Vvgai1(比Vvgail1/VvGAI1)。以某一特定富集生物氧化石墨烯项中基因的平均相关指数作为关联的相对标尺Vvgai1.通过使用PlantTFDB 4.0和PlantRegMap促进转录因子富集和假定的成对调控因子-靶标相互作用[50].利用TAIR进行基因注释、交叉引用和序列同源性分析[92], Phytozome 12 [93]、PlantTFDB 4.0及PlantMetGenMap [90].只要有可能,我们就使用相关葡萄藤研究中报告的基因名称。除此之外,我们遵循基因镜12X中所示的命名法诉酿酒用葡萄基因组数据库(http://www.genoscope.cns.fr/externe/GenomeBrowser/Vitis/)与TAIR数据库(https://www.arabidopsis.org/)。为了提供进一步的清晰度和避免潜在的混淆,我们在适当的时候添加了一个前缀“Vv到附加文件中提供的正文中提到的基因名称1:表S1。
缩写
- 东盟地区论坛:
-
生长素反应因子
- 贝尔:
-
有缘
- CAF:
-
心皮厂
- CKX:
-
细胞分裂素氧化酶
- 有限公司:
-
君士坦斯
- CPM:
-
计数每百万读取对齐
- 英国《金融时报》:
-
开花位点1
- 遗传算法:
-
赤霉酸
- Ga20ox:
-
GA20氧化酶
- Ga3ox:
-
赤霉素氧化酶
- 盖:
-
赤霉acid-insensitive
- 叫:
-
GATA-binding
- GID1:
-
GA不敏感侏儒f1
- 走:
-
基因本体论
- 平:
-
生长调节因子
- HD-ZIP:
-
Homeodomain-leucine拉链
- 国际直拨电话:
-
不确定的领域
- IPT:
-
Isopentenyltransferase
- KNAT1:
-
Knotted-like从拟南芥1
- 诺克斯:
-
Knotted1-like
- MYB:
-
成髓细胞瘤
- 南京:
-
南/ ataf1, 2 / cuc2
- NT:
-
非转基因
- 销:
-
Pin-formed
- 山姆:
-
茎顶分生组织
- 可控硅:
-
稻草人
- 月:
-
短的根
- SHY2:
-
下胚轴短
- SOC1:
-
constans过表达抑制因子
- SPL:
-
鳞状突起启动子结合蛋白样
- STM:
-
拍摄meristemless
- 高级副总裁:
-
短营养期
- 故事:
-
Three-amino-acid-loop-extension
- TCP:
-
Tb1-Cyc-Pcf
- TFL1:
-
顶生花1或居中状
- TGA1:
-
大刍草颖粒结构
- TIR1:
-
运输抑制反应1
- Vvgai1:
-
对葡萄赤霉素不敏感
- WOX:
-
Wuschelrelated同源框
参考文献
Dayan J. Gibberellin运输。载:年度植物评论:赤霉素;2016.p . 95 - 120。https://doi.org/10.1002/9781119210436.ch4.
Murase K, Hirano Y, Sun TP, Hakoshima T.赤霉素诱导的DELLA识别赤霉素受体GID1。大自然。2008;456:459 - 63。https://doi.org/10.1038/nature07519.
绿色革命的基因。《趋势》,2003;19:5-9。https://doi.org/10.1016/s0168 - 9525 (02) 00009 - 4.
彭杰,Carol P, Richards DE, King KE, Cowling RJ, Murphy GP,等。拟南芥GAI基因定义了一个负向调控赤霉素反应的信号通路。基因开发,1997;11:3194-205。https://doi.org/10.1101/gad.11.23.3194.
Fleet CM, Sun TP。DELLAcate平衡:赤霉素在植物形态发生中的作用。植物学报,2005;8:77-85。https://doi.org/10.1016/j.pbi.2004.11.015.
赤霉素- gid1 - della:植物生长发育的关键调控模块。植物科学进展。2010;https://doi.org/10.1104/pp.110.161554.
Van De Velde K, Ruelens P, Geuten K, Rohde A, Van Der Straeten D.利用谷物中的DELLA信号。植物科学进展(英文版);https://doi.org/10.1016/j.tplants.2017.07.010.
Busov VB。调控树高的杨树赤霉素分解代谢显性基因(ga2 -氧化酶)的激活标记。植物科学学报,2003;https://doi.org/10.1104/pp.103.020354.
Schomburg FM, Bizzell CM, Lee DJ, Zeevaart AD, Amasino RM。一种新型赤霉素2氧化酶的过表达降低赤霉素水平并产生矮秆植物。植物学报。2003;15:151-63。https://doi.org/10.1105/tpc.005975.
Busov V, Meilan R, Pearce DW, Rood SB, Ma C, Tschaplinski TJ,等。转基因gai或rgl1会导致白杨矮化,改变赤霉素、根系生长和代谢物的分布。足底。2006;224:288 - 99。https://doi.org/10.1007/s00425-005-0213-9.
邓丽娟,孙春霞,王晓明。DELLA基序对于赤霉素诱导的RGA降解至关重要。自然科学进展,2001;https://doi.org/10.1073/pnas.251534098.
老板PK,托马斯先生矮化和花诱导与葡萄“绿色革命”突变的关联。大自然。2002;416:847-50。https://doi.org/10.1038/416847a.
葡萄花序原基形成的控制因素:其在潜伏芽结实性中的作用?复习一下。植物学。2016;94:147 - 63。https://doi.org/10.1139/cjb-2015-0108.
钟光光,杨阳。葡萄赤霉素不敏感突变等位基因在转基因拟南芥中的特性。转基因Res. 2012; 21:725-41。https://doi.org/10.1007/s11248-011-9565-z.
张志林,张志林,张志林,张志林,张志林,张志林,张志林,等。早期赤霉素信号转导中DELLA直接靶点的全球分析拟南芥.植物学报。2007;19:3037-57。https://doi.org/10.1105/tpc.107.054999.
Davière JM, Achard P. DELLAs在调节多种激素信号中的关键作用。《分子植物》2016;9:10-20。https://doi.org/10.1016/j.molp.2015.09.011.
斯里尼瓦桑C,马林斯MG。葡萄开花:卷须转化为花序和葡萄串。足底。1979;145:187 - 92。https://doi.org/10.1007/BF00388716.
杨晓东,李志刚,李志刚。野生葡萄的栽培研究进展。湛:施普林格国际出版;2015.https://doi.org/10.1007/978-3-319-24352-8.
胡杰,张志强,张志强,张志强,等。葡萄中赤霉素信号组分的功能表征和发育表达谱。中国科学(d辑),2015;https://doi.org/10.1093/jxb/eru504.
山口S, Kamiya Y.赤霉素的生物合成:内源性和环境信号的调控。植物物理学报。2000;41:21 1 - 7。https://doi.org/10.1093/pcp/41.3.251.
太阳TP。拟南芥赤霉素代谢、感知和信号通路。拟南芥书。2008;6:e0103。https://doi.org/10.1199/tab.0103.
马晓燕,李志强,李志强,等。植物生长调控因子家族的研究进展[j] . 2015。https://doi.org/10.1016/j.molp.2015.01.013.
Horiguchi G, Kim GT, Tsukaya H.转录因子AtGRF5和转录辅激活因子AN3调控拟南芥叶原基细胞增殖。植物学报(英文版);2005;https://doi.org/10.1111/j.1365-313X.2005.02429.x.
吉光Y,田中K,福田W,麻美T,吉田S,林林K,等。在拟南芥中,DWARF4的转录在生长素调控的根伸长和油菜素类固醇稳态中起着至关重要的作用。PLoS One, 2011;6:e23851。https://doi.org/10.1371/journal.pone.0023851.
高旭,张勇,何忠,付旭。赤霉素。In:植物激素代谢与信号通路;2017.107 - 60页。https://doi.org/10.1016/B978-0-12-811562-6.00004-9.
矮子4突变或油菜素类固醇生物合成抑制剂对油菜素类固醇生物合成的抑制挽救了拟南芥突变的非亲光性下胚轴4的嗜性反应缺陷。植物物理学报。2006;41:456 - 64。https://doi.org/10.1104/pp.105.076273.
尼古拉斯M,古巴P. TCP因素:信号块上的新孩子。植物学报,2016;33:33-41。https://doi.org/10.1016/j.pbi.2016.05.006.
杨宇,梁震,钟光宇,张志刚,张志刚。两个葡萄种群卷须叶状分离的转录组分析。Hortic Res. 2017;4:17032。https://doi.org/10.1038/hortres.2017.32.
摩尔M,沃格尔MO,迪茨KJ。拟南芥AP2/ERF转录因子网络上调表明,拟南芥对强光的适应反应在数秒内启动。植物学报。2014;9:1-4。https://doi.org/10.4161/15592324.2014.976479.
Bolt S, Zuther E, Zintl S, Hincha DK, Schmulling T. ERF105是拟南芥抗冻和冷驯化所需的转录因子基因。中国生物医学工程学报,2017;30(4):344 - 344。https://doi.org/10.1111/pce.12838.
王凯成,刘旭,陈春英,吴凯。光敏色素相互作用因子在光信号传递中的作用。1.中国生物化学杂志,2013;https://doi.org/10.4172/2329-9029.1000e114.
海登P, Sponsel V.一个世纪的赤霉素研究。中国植物学报。2015;34(4):344 - 344。https://doi.org/10.1007/s00344 - 015 - 9546 - 1。.
田强。拟南芥SHY2/IAA3抑制生长素调控基因表达。《植物科学》2002;14:31 - 19。https://doi.org/10.1007/s00344-015-9546-1.10.1105/tpc.010283.
Gray WM, Kepinski S, Rouse D, Leyser O, Estelle M.生长素调控AUX/IAA蛋白scftir1依赖性降解大自然。2001;414:271-6。https://doi.org/10.1038/35104500.
王艳,沈伟,陈志,吴艳。拟南芥内源性细胞分裂素过量分泌对ROS稳态调控及盐胁迫抗性的影响。前沿植物学报2015;6:1-69。https://doi.org/10.3389/fpls.2015.01004.
冯健,石勇,杨松,左娟。In:植物激素代谢与信号通路;2017.p . 77 - 106。https://doi.org/10.1016/B978-0-12-811562-6.00003-7.
Hay A, Craft J, Tsiantis M.植物激素和同源异构体:弥合差距?BioEssays。2004; 26:395 - 404。https://doi.org/10.1002/bies.20016.
伯恩我。拟南芥同源盒基因BELLRINGER决定了植物的叶序排列模式和干细胞的命运。发展。2003;130:3941-50。https://doi.org/10.1242/dev.00620.
贾辛斯基,Piazza P, Craft J, Hay A, Woolley L, Rieu I,等。KNOX在拟南芥中的作用是由细胞分裂素和赤霉素活性的协调调节介导的。《当代生物学》2005;15:1560-5。https://doi.org/10.1016/j.cub.2005.07.023.
Lincoln C, Long J, Yamaguchi J, Serikawa K, Hake S.拟南芥中一种类似knotted1的同源盒基因在营养分生组织中表达,在转基因植物中过表达后会显著改变叶片形态。植物细胞,1994;6:1859-76。https://doi.org/10.1105/tpc.6.12.1859.
Rutjens B, Bao D, van Eck-Stouten E, Brand M, Smeekens S, Proveniers M.拟南芥芽尖分生组织功能需要三种bel1样同源结构域蛋白的联合活性。植物J. 2009; 58:641-54。https://doi.org/10.1111/j.1365-313X.2009.03809.x.
植物初级分生组织:共享功能和调节机制。植物学报,2010;13:53-8。https://doi.org/10.1016/j.pbi.2009.09.008.
Ariel FD, Manavella PA, Dezar CA, Chan RL。HD-Zip家族的真实故事。植物科学进展,2007;12:419-26。https://doi.org/10.1016/j.tplants.2007.08.003.
Belli Kullan J, Lopes Paim Pinto D, Bertolini E, Fasoli M, Zenoni S, Tornielli GB等。miRVine:基于小RNA测序的葡萄microRNA表达图谱。BMC基因组学。2015;16:393。https://doi.org/10.1186/s12864-015-1610-5.
于生,Galvão VC,张永春c, Horrer D,张t - qt - q,郝艳海h,等。赤霉素通过mir156靶向SQUAMOSA PROMOTER BINDING-LIKE转录因子调控拟南芥花的转变。《植物科学》2012;24:32 - 32。https://doi.org/10.1105/tpc.112.101014.
李娟,宋r,陈晓霞,朴w,李娟。拟南芥microRNA代谢的新蛋白HEN1与CARPEL FACTORY。《生物学报》2002;12:1484-95。
徐峰,李涛,徐宝,李林,杜世山,连海龙,等。DELLA蛋白与CONSTANS蛋白发生物理相互作用,调控拟南芥长日照条件下的开花。FEBS Lett. 2016; 590:541-9。https://doi.org/10.1002/1873-3468.12076.
Boss PK, Sreekantan L, Thomas MR.在异种中过表达的葡萄TFL1同源物可以延迟开花并改变花的发育。植物功能生物学,2006;33:31。https://doi.org/10.1071/FP05191.
王晓明,王志刚,王志刚,王志刚。葡萄生殖发育的分子遗传学研究。中国机械工程学报,2008;26(4):349 - 349。https://doi.org/10.1093/jxb/ern160.
金J,田F,杨直流,孟Y-Q,香港L,罗J,等。PlantTFDB 4.0:朝着植物转录因子和调控相互作用的中心枢纽。核酸研究,2017;45:D1040-5。https://doi.org/10.1093/nar/gkw982.
王志强,王志强,王志强,等。植物MYB和bHLH转录因子的研究进展。植物J. 2011; 66:94-116。https://doi.org/10.1111/j.1365-313X.2010.04459.x.
黄东,王松,张波,上官凯,石勇,张东,等。赤霉素介导的DELLA-NAC信号级联调控水稻纤维素合成《植物科学》2015;27:1681-96。https://doi.org/10.1105/tpc.15.00015.
Chezem WR, Memon A, Li F-S,翁建科,Clay NK。拟南芥sg2型R2R3-MYB转录因子MYB15控制防御木质化和基础免疫《植物科学》2017;29:7 07 - 26。https://doi.org/10.1105/tpc.16.00954.
侯旭,胡伟伟,沈玲,李丽春,陶喆,韩建辉,等。拟南芥花发育过程中DELLA靶基因的全局鉴定。植物物理学报。2008;147:1126-42。https://doi.org/10.1104/pp.108.121301.
Claeys H, De Bodt S, Inzé D.赤霉素和DELLAs:生长调控网络的中心节点。植物科学进展(英文版);https://doi.org/10.1016/j.tplants.2013.10.001.
杨晓明,杨晓明,杨晓明,等。赤霉素在植物中的信号通路研究。发展。2013;140:1147-51。https://doi.org/10.1242/dev.087650.
格里姆雷特J,阿古德洛-罗梅罗P,特谢拉RT,马丁内斯-萨帕特JM,福特斯AM。葡萄GRAS基因家族的结构和功能分析表明,GRAS蛋白在葡萄发育和胁迫反应的控制中起着重要作用。7.前沿植物科学,2016;https://doi.org/10.3389/fpls.2016.00353.
胡军,孙廷平,张志刚,张志刚。拟南芥F-Box蛋白SLEEPY1针对赤霉素信号阻遏物进行赤霉素诱导的降解。《植物科学》2004;https://doi.org/10.1105/tpc.020958.
akacheampong,郑c, Halaly T, Giacomelli L, takbayashi Y, Jikumaru Y,等。赤霉素对无籽鲜食葡萄果实生长响应的内源异常抑制。植物科学进展(英文版);https://doi.org/10.3389/fpls.2017.00850.
沃斯U,主教A,法科特E,贝内特MJ。模拟激素反应和发育。植物科学进展(英文版);https://doi.org/10.1016/j.tplants.2014.02.004.
Hay A, Kaur H, Phillips A, Hedden P, Hake S, Tsiantis M.赤霉素通路介导不同体型植物knotted1型同源盒功能。《生物学报》2002;12:1557-65。https://doi.org/10.1016/s0960 - 9822 (02) 01125 - 9.
池崎M,小岛M,榊原H,小岛S,上野Y,町田C,等。拟南芥叶片发育中不对称LEAVES1 (AS1)和AS2调控的遗传网络:KNOX基因控制5个形态事件。植物J. 2010; 61:70-82。https://doi.org/10.1111/j.1365-313X.2009.04033.x.
Locascio A, Blázquez MA, Alabadí D. DELLA蛋白活性的基因组分析。中国生物医学工程学报,2013;https://doi.org/10.1093/pcp/pct082.
曹东,程红,吴伟,苏红梅,彭娟。赤霉素调控拟南芥种子萌发和花发育的转录组。植物物理学报。2006;142:509-25。https://doi.org/10.1104/pp.106.082289.
Davière J-M, de Lucas M, Prat S.转录因子相互作用:DELLA功能的核心步骤。Curr Opin Genet Dev. 2008; 18:295-303。https://doi.org/10.1016/j.gde.2008.05.004.
Yoshida H, Ueguchi-Tanaka M. DELLA和SCL3利用INDETERMINATE DOMAIN蛋白作为转录支架来平衡赤菌的反馈调控。植物信号学报。2014;9:e29726。https://doi.org/10.4161/psb.29726.
许志强,张坤,金伊亚,李敏华,李莎,宋世凯,等。拟南芥根中GRAS转录调控因子稻草人样3对赤霉素信号的漏斗作用。自然科学进展(英文版);2011;https://doi.org/10.1073/pnas.1012215108.
郭杰,蔡佳杰,方凯,陈勇,姜霞,等。赤霉素通过与生长素和其他激素的相互作用调节杨树侧根的形成。植物学报。2010;22:623-39。https://doi.org/10.1105/tpc.109.073239.
Sozzani R, Cui H, Moreno-Risueno MA, Busch W, Van Norman JM, Vernoux T,等。shorroot链接模式与生长对细胞周期基因的时空调控。大自然。2010;466:128-32。https://doi.org/10.1038/nature09143.
Riou-Khamlichi C.细胞分裂素激活拟南芥细胞分裂的研究。科学(80 -)。1999; 283:1541-4。https://doi.org/10.1126/science.283.5407.1541.
Dewitte W, Scofield S, Alcasabas AA, Maughan SC, Menges M, Braun N,等。拟南芥CYCD3 d型细胞周期蛋白连接细胞增殖和内周期,并限制细胞分裂素反应的速率。自然科学进展,2007;26(3):344 - 344。https://doi.org/10.1073/pnas.0704166104.
陈志强,陈志强,陈志强,等。在根分生组织中控制细胞分裂和分化的遗传框架。科学。2008;322:1380-4。https://doi.org/10.1126/science.1164147.
李文杰,李志强,李志强。细胞分裂素-生长素串扰。植物科学进展2009;14:557-62。https://doi.org/10.1016/j.tplants.2009.06.010.
植物激素对根生长的调控——生长素和赤霉素的作用。植物科学,2005;24:49 - 65。https://doi.org/10.1080/07352680500196108.
Almada R, Cabrera N, Casaretto JA, Ruiz-Lara S, González Villanueva E. VvCO和VvCOL1是两个CONSTANS同源基因,在葡萄花蕾诱导和休眠过程中受到调控。植物细胞学报2009;28:1193-203。https://doi.org/10.1007/s00299-009-0720-4.
斯里尼瓦桑C,马林斯MG。温度和生长调节剂对葡萄胚根、卷须和花序形成的影响。植物学报,1980;45:39 - 46。https://doi.org/10.1093/oxfordjournals.aob.a085842.
杨晓燕,王晓燕,王晓燕,等。拟南芥赤霉素信号通路的昼夜节律变化。自然科学进展(英文版);2011;https://doi.org/10.1073/pnas.1101050108.
老板PK, Buckeridge EJ, Poole A, Thomas MR.葡萄开花新见解。植物学报,2003;30:593。https://doi.org/10.1071/FP02112.
Díaz-Riquelme J, Grimplet J, Martínez-Zapater JM, Carmona MJ。葡萄(Vitis vinifera L.)芽发育过程中的转录组变异。BMC植物生物学2012;12:181。https://doi.org/10.1186/1471-2229-12-181.
Martin RC, Asahina M, Liu PP, Kristof JR, Coppersmith JL, Pluskota WE,等。拟南芥中microrna靶向鳞状芽胞启动子结合蛋白13对子叶到营养叶萌发后转变的调控。种子科学,2010;20:89-96。https://doi.org/10.1017/S0960258510000073.
王松,吴坤,袁强,刘旭,刘震,林霞,等。OsSPL16基因对水稻籽粒大小、形状和品质的控制。Nat Genet, 2012;44:95 - 4。https://doi.org/10.1038/ng.2327.
王华,Nussbaum-Wagler T,李波,赵强,Vigouroux Y, Faller M,等。裸露的玉米粒的起源。大自然。2005;436(7051):714 - 9。https://doi.org/10.1038/nature03863.
哈特曼U, Hohmann S, Nettesheim K, Wisman E, Saedler H, Huijser P.拟南芥花转化负调控因子SVP的分子克隆。植物J. 2000; 21:351-60。https://doi.org/10.1046/j.1365-313x.2000.00682.x.
Diaz-Riquelme J, Lijavetzky D, Martinez-Zapater JM, Carmona MJ。葡萄mikcc型MADS盒基因的全基因组分析植物学报。2009;49:354 - 69。https://doi.org/10.1104/pp.108.131052.
开花时间的远距离调控。中国科学(d辑),2011;https://doi.org/10.1093/jxb/err191.
Sudhakar P, Latha P, Reddy PV。植物色素。在:表型作物植物的生理和生化性状。爱思唯尔;2016.121 - 7页。https://doi.org/10.1016/B978-0-12-804073-7.00015-6.
杨勇,毛林,吉塔亚索恩,康勇,焦超,费震,等。嫁接葡萄接穗与砧木间信使RNA的交换。植物学报。2015;15:1-14。https://doi.org/10.1186/s12870-015-0626-y.
Anders S, Pyl PT, Huber W. HTSeq—用于处理高通量测序数据的Python框架。生物信息学。2015;31:166-9。https://doi.org/10.1093/bioinformatics/btu638.
Robinson MD, McCarthy DJ, Smyth GK。edgeR:用于数字基因表达数据差异表达分析的Bioconductor包。生物信息学。2010;26:139-40。https://doi.org/10.1093/bioinformatics/btp616.
郑俊杰,Corbett AM, Fellman SM, Tieman DM, Klee HJ, Giovannoni JJ,等。植物MetGenMAP:植物系统生物学综合分析系统。植物科学进展。2009;https://doi.org/10.1104/pp.109.145169.
Supek F, bosnjak M, Škunca N, Šmuc T. REVIGO总结和可视化的基因本体术语长列表。PLoS One, 2011; 6:1-9。https://doi.org/10.1371/journal.pone.0021800.
张志强,李志强,张志强,等。拟南芥信息资源:“金标准”注解参考植物基因组的制作与挖掘。《创世纪》。2015; 53:474 - 85。https://doi.org/10.1002/dvg.22877.
郭德华,陈志强,张志强,等。Phytozome:绿色植物基因组学的比较平台。核酸研究,2012;40:D1178-86。https://doi.org/10.1093/nar/gkr944.
致谢
我们要感谢加州大学戴维斯分校的拉尔夫·m·帕森斯植物转化设施为这项研究生产转基因葡萄。我们还要感谢美国农业部农业研究局葡萄遗传学研究部门的Debra Johnston和Della Cobb-Smith为维护温室内葡萄种群提供的帮助。Jie Arro是ORISE-ORAU教育和培训计划的参与者。所有作者均已阅读并同意此稿件。
资金
本项目由美国农业部农业研究服务局CRIS项目8060-21220-006-00D资助。
数据和材料的可用性
支持本文结果的数据集包含在本文及其附加文件中。
作者信息
从属关系
贡献
GYZ构思了这个项目。YY和JA分别进行了实验室工作和数据分析。JA、YY、QS、GZ撰写稿件。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
所有作者都同意发表这篇手稿。
相互竞争的利益
作者宣称他们之间没有利益冲突。
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
Arro, J., Yang, Y., Song, GQ。et al。RNA-Seq揭示了转基因ga不敏感葡萄的新的DELLA靶点和调控。BMC植物生物学19,80(2019)。https://doi.org/10.1186/s12870-019-1675-4
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-019-1675-4
关键字
- 君士坦斯
- 德拉
- 开花
- 小道消息
- HOMEODOMAIN
- 常年
- TFL1
- 转基因GA-insensitive