- 研究文章GydF4y2Ba
- 开放访问GydF4y2Ba
- 发布:GydF4y2Ba
田间和山地栽培人参根中萜类代谢的比较转录组分析GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba19.GydF4y2Ba文章编号:GydF4y2Ba82GydF4y2Ba(GydF4y2Ba2019GydF4y2Ba)GydF4y2Ba
摘要GydF4y2Ba
背景GydF4y2Ba
在田间和山地栽培之间存在形态特征和植物化学组成的差异GydF4y2Ba人参GydF4y2Ba(FCG和MCG),这可能与萜类代谢适应不同生长条件的变化有关。目前的工作旨在揭示这些变化。GydF4y2Ba
结果GydF4y2Ba
在26648个差异表达基因中,有496个基因分布在7个优势萜类途径中。二萜类和三萜类生物合成基因在FCG根中显著高表达。相反,在MCG根中,类胡萝卜素的生物合成明显更活跃。此外,主干萜类、单萜类、倍半萜类和萜类醌类生物合成均无明显倾向。结果表明,FCG根系中积累了较多的赤霉素和甾体,这可能是其快速营养生长的原因,而脱落酸、大叶孢素和原topanaxatriol型人参皂苷的富集可能是MCG根系抗逆性增强的主要原因。GydF4y2Ba
结论GydF4y2Ba
本研究首先综述了FCG和MCG根系中萜类物质的代谢,阐明了其不同形态和化学成分的内在机制。GydF4y2Ba
背景GydF4y2Ba
被用作超过5000年的重要传统草药后,人参GydF4y2Ba(人参GydF4y2Ba迈耶GydF4y2Ba)GydF4y2Ba在亚洲已被广泛接受[GydF4y2Ba1GydF4y2Ba]而且,由于其杂项健康益处,最近也已在美国药典中采用。已被证明人参有效治疗低流入性,厌食症,呼吸短促,心悸,失眠,阳痿,出血和糖尿病[GydF4y2Ba2GydF4y2Ba那GydF4y2Ba3.GydF4y2Ba].一方面,有效的药理学特性使人参带来相当大,崇拜的消费,但另一方面,过度消费导致野生人参的资源被濒临灭绝。为了满足不断增长的消费,自1600年前以来,两种人为栽培人参,现场和山地栽培人参,通过现代农业技术广泛发展。GydF4y2Ba
虽然这两种人参都是人工播种的,但它们的环境条件和日常管理有所不同。大田栽培人参(FCG)通常种植在花园或田地里,像蔬菜一样管理,每两年移植到一个新的肥沃的苗床上,以维持其根的生长。与此相反,山参在自然森林环境中模拟种植,生长期间不进行移栽、划痕、灌溉或施肥,因此与野生人参一样遭受严重的环境胁迫。因此,生长条件和日常管理的差异导致了两种人参根在形态和抗逆性方面的一些生理差异[GydF4y2Ba4.GydF4y2Ba].首先,FCG的主要根部比MCG更直的根,具有更长且分枝根的MCG(图。GydF4y2Ba1GydF4y2Ba).经验认为,人参根的形态特征与其人参皂苷含量密切相关,枝条越长的根,人参皂苷含量越高[GydF4y2Ba5.GydF4y2Ba[因此,MCG的价格估计高于FCG的10倍。其次,MCG的正常收获期(12-15岁),虽然比野生人参(20多年)短,但两倍于FCG(5-6岁),这对自以来的疾病非常容易受到影响第七年。换句话说,MCG在FCG上表现出对生物(致病和草药)和非生物胁迫的抗性的明显优势。GydF4y2Ba
萜类化合物作为最丰富、结构最多样化的一类天然产物,有超过40000个单独的化合物,在植物生长和发育的初级代谢调节剂(如赤霉素和脱落酸)、电子载体(如泛素和质体醌侧链)、或膜结构元素(如植物甾醇)和防御化合物(如挥发性化合物)对生物和非生物胁迫的反应[GydF4y2Ba6.GydF4y2Ba].人们普遍认为,萜类代谢在栽培植物和野生植物之间存在着明显的差异。例如,Nayyar等人[GydF4y2Ba7.GydF4y2Ba]报道,野生鹰嘴豆进化出了一种潜在的耐旱遗传机制,在水分胁迫下比栽培植物产生更高含量的脱落酸(一种倍半萜)。Besser等[GydF4y2Ba8.GydF4y2Ba]发现栽培番茄和野生番茄的毛状体显示出几乎相反的萜类特征:栽培植物以单萜类和低水平倍半萜为主,野生植物单萜类含量极低,倍半萜羧酸类杀虫剂含量丰富,增强了其对病原体和害虫的抗性。将话题带回两种类型的人参,推测其形态变异如图所示。GydF4y2Ba1GydF4y2Ba可能反映Terpenoids新陈代谢的变化。GydF4y2Ba
转录组分析已经深入应用于萜类代谢的研究[GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba10.GydF4y2Ba那GydF4y2Ba11.GydF4y2Ba],特别是在培养和野生植物之间发现萜类化合物生物合成的变化。Bleeker等。[GydF4y2Ba12.GydF4y2Ba]与野生的Sesquiterpenoids生物合成相比(GydF4y2Ba茄属植物habrochaitesGydF4y2Ba)与栽培的(GydF4y2Ba美国habrochaitesGydF4y2Ba)番茄物种通过焦磷酸化,并分别确定了七和六种特征性倍二萜合酶基因。Tao等人。[GydF4y2Ba13.GydF4y2Ba]疯狂测序(GydF4y2BaGossypium精华GydF4y2Ba)和有教养的(GydF4y2BaG. Arboreum.GydF4y2Ba通过Illumina Hiseq 2000 RNA-seq平台,发现萜类合成酶家族的表达下调GydF4y2Bag .精华GydF4y2Ba,导致野生种的腺形态发生延迟,棉酚含量较低。对于FCG和MCG,由于对两种人参萜类代谢的差异了解较少,因此急需进行比较转录组分析。GydF4y2Ba
人参皂苷是最有价值和最具特色的三萜,其在FCG和MCG中的积累已被广泛比较。Yong等人[GydF4y2Ba4.GydF4y2Ba]观察到丙二醇醇型人参皂苷的含量,包括RE,RF和RGGydF4y2Ba1GydF4y2Ba与含有较多原人参皂苷如RbGydF4y2Ba1GydF4y2Ba,RB.GydF4y2Ba2GydF4y2Ba,rc,rd。和RhGydF4y2Ba2GydF4y2Ba.但是,陈等人。[GydF4y2Ba14.GydF4y2Ba发现原碱碱型人参皂苷Rb的内容物GydF4y2Ba1GydF4y2Ba,RB.GydF4y2Ba2GydF4y2Ba,rc和rd。烯烃型人参皂甙RO在FCG根中较高,而RF和PROPOMANAXADIOL型人参皂苷RaGydF4y2Ba3.GydF4y2Ba丰富MCG的。与前两项研究不同的是,Xu et al. [GydF4y2Ba15.GydF4y2Ba]表现为Rf和RbGydF4y2Ba2GydF4y2Ba在FCG根中丰富,但RB的水平较高GydF4y2Ba1GydF4y2Ba, Rc, rd和RaGydF4y2Ba3.GydF4y2Ba,其他三种原丙醇型人参皂苷RaGydF4y2Ba2GydF4y2Ba,ra.GydF4y2Ba7.GydF4y2Ba和卢比GydF4y2Ba6.GydF4y2Ba,奎因诺苷R.GydF4y2Ba1GydF4y2Ba、三七皂苷铁、Re、Rg含量GydF4y2Ba1GydF4y2Ba在两种类型的人参根之间没有显着差异。因此,考虑到人参皂苷的生物合成是动态变化的,预期基于相关基因的实时表达的基于实时表达的进一步进行了争论。GydF4y2Ba
在目前的研究中,我们对FCG和MCG根进行了比较转录组分析,并测量了包括两种植物激素(赤霉素和脱钙酸),人参皂苷和其他几个关键萜烯的相应三萜酸的含量。我们的分析试图概述Terpenoids新陈代谢GydF4y2BaP.人参GydF4y2Ba这可能有助于阐明FCG和MCG根系之间生理多样性的潜在机制,也可以作为未来对其他物种的萜类化合物生物合成的未来调查的基础GydF4y2Ba人参GydF4y2Ba属。GydF4y2Ba
结果GydF4y2Ba
转录组简档和功能注释GydF4y2Ba
转录组简介GydF4y2Ba
为了实现FCG和MCG的根系中基因表达谱的全局概述,其cDNA文库由Illumina Hiseq4000平台构建和测序。通过参考人参基因组数据库修剪低质量读取和爆破,在我们的转录组中鉴定了56,233个基因,包括43,902个基因成功地映射到参考基因组中,并未取消映射的12,331个新基因,但预测其他三个数据库(6984个基因,4586带瑞士 - Prot和1362与PFAM)。有关质量控制和分配的详细信息显示在附加文件中GydF4y2Ba1GydF4y2Ba表S3和附加文件GydF4y2Ba2GydF4y2Ba:表S4。GydF4y2Ba
Go和Cog功能注释GydF4y2Ba
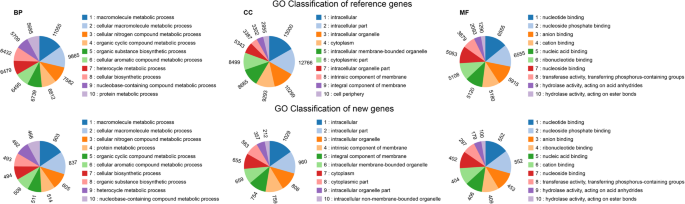
进行GO和COG功能注释,以分类56,233基因的功能。GO分析注释了33,144个基因,其中包括2990个新基因,可以分配到2464个术语。前10个富集的术语在参考和新基因的GO分类中基本一致(图。GydF4y2Ba2GydF4y2Ba).在“生物过程”这一主要类别中,大部分基因被归为“大分子代谢过程”(即GO分类中匹配了11,958个基因,包括参考基因和新基因;)、“细胞大分子代谢过程”(10,702)和“细胞氮化合物代谢过程”(8187)。在“细胞成分”这一主要范畴中,“胞内”(14029个基因匹配)、“胞内部分”(13726个基因匹配)和“胞内细胞器”(11107个基因匹配)是主导词。在第三大类“分子功能”中,占主导地位的术语是“核苷酸结合”(匹配7107个基因)、“核苷磷酸结合”(7107个)和“阴离子结合”(6368个)。值得一提的是,“次生代谢过程”和“次生代谢过程调控”分别注释了247个和22个可能与人参根中众多萜类化合物生物合成的次生代谢有关的基因。GydF4y2Ba
除了GO分析外,基于推测的翻译蛋白序列,COG分析还对参考基因和新基因的功能进行了注释。在我们的COG分析中,20953个基因包括672个新基因被分配到24个功能分类中(图2)。GydF4y2Ba3.GydF4y2Ba).在内参基因的分类中,“信号转导机制”(匹配的基因有2406个)最多,其次是“一般功能预测”(2360个)、“翻译后修饰、蛋白质转换、伴侣功能”(1767个)、“翻译、核糖体结构和生物发生”(1273个)、“碳水化合物运输和代谢”(1196)。对于新发现的基因,排名前五的分类分别是“翻译、核糖体结构和生物发生”(39)、“翻译后修饰、蛋白质转换、伴侣功能”(26)、“功能未知”(22)、“一般功能预测”(20)和“转录”(17)。值得注意的是,共有797个文献和新基因被归为“次生代谢产物生物合成、转运和分解代谢”类,这可能也与人参根的次生代谢特别是萜类化合物的代谢有关。参考基因组的43902个基因中,GO基因为30154个,COG基因为20281个,KEGG基因为22484个,共注释了36577个基因(83.3%),能够充分代表转录组。GydF4y2Ba
FCG和MCG根中萜类代谢相关基因的分析GydF4y2Ba
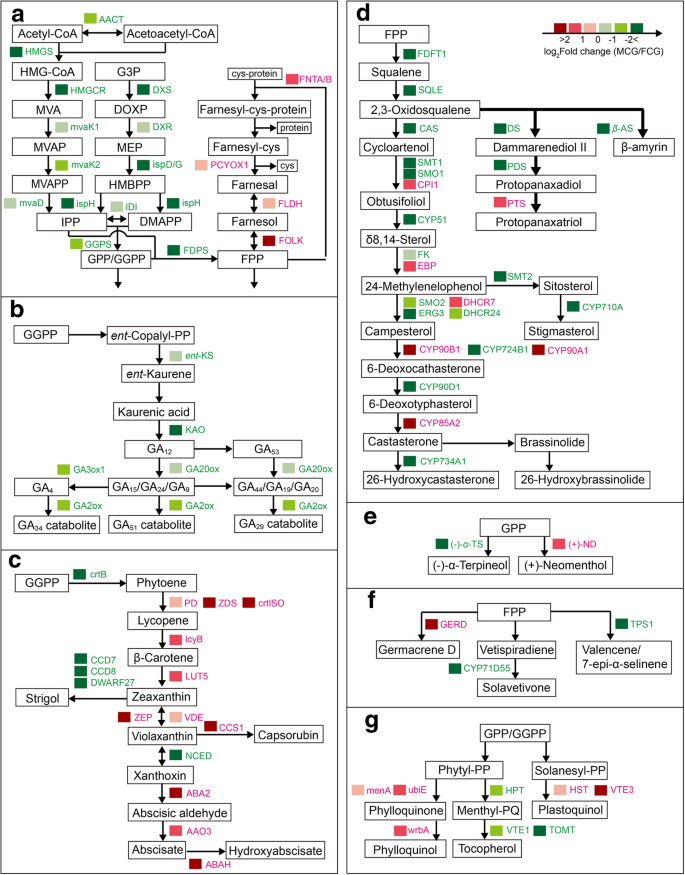
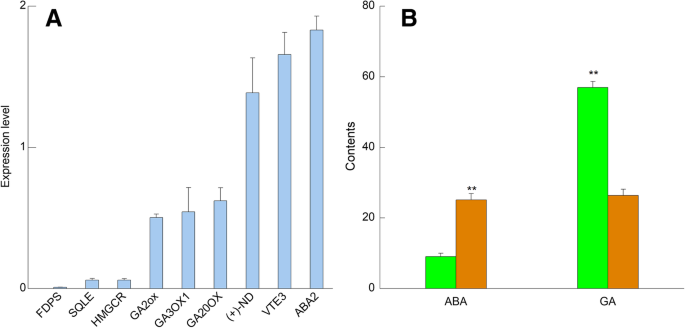
在56,233个基因中,分别在FCG和MCG根中显着高于表达了15,509和11,139个基因,其被认为是DEGS(|原木GydF4y2Ba2GydF4y2BaFC(FPKM.GydF4y2Ba麦格GydF4y2Ba/ FPKM.GydF4y2BaFCGGydF4y2Ba)| > 1 andP.GydF4y2Ba值<0.05)。为了公开FCG和MCG根部之间的Terpenoids代谢差异,我们进行了Kegg分析,发现496次参与了与萜类相关的途径。其中Terpenoids结构单位生物合成和所有直接相关的下游途径是我们的调查,如“萜类骨架生物合成(KO00900)”,“单萜类生物合成(KO00902)”,“二萜类生物合成(KO00904)”,“类胡萝卜素生物合成(KO00906)“,”Sesquiterpenoid和三萜类生物合成(KO00909)“,”类固醇生物合成(KO00100)“和”泛醌和其他三萜 - 醌生物合成(KO00130)“(图。GydF4y2Ba4.GydF4y2Ba).通过QRT-PCR进行这些萜类化合物生物合成途径中对应的键基因的验证,其中表达式符合我们的转录分析(图。GydF4y2Ba5.GydF4y2Ba一种)。GydF4y2Ba
两种人参根中不同萜类化合物的生物合成。图中右上角的色标分别用绿色和红色表示了催化相应生化反应的酶的首字母缩写,它们分别是由田间栽培人参(FCG)和山参(MCG)根中高表达基因编码的。GydF4y2Ba一种GydF4y2BaTerpenoid骨干生物合成:Act,乙酰-CoA C-乙酰转移酶;HMGS,羟甲基戊族CoA合酶;HMGCR hydroxymethylglutaryl-CoA还原酶;Mvak1,甲羟戊酸激酶;Mvak2,磷酮激酶;MVAD,二膦醇脱羧酸盐;DXS,1-脱氧-D-木糖-5-磷酸合成酶;DXR,1-脱氧-D-木糖-5-磷酸氧化酯酶;ISPD,2-C-甲基-D-赤藓糖醇4-磷酸胞苷细胞苷1酶;ispg,(GydF4y2BaE.GydF4y2Ba) 4-hydroxy-3-methylbut-2-enyl-diphosphate合成酶;4-羟基-3-甲基-2-烯-1-基二磷酸还原酶;伊迪,isopentenyl-diphosphate delta-isomerase;GGPS:香叶酰香叶酰二磷酸合酶;法尼基二磷酸合酶;FNTA / B、α/β蛋白治疗;PCYOX1 prenylcysteine氧化酶;FLDH,河畔GydF4y2Ba+GydF4y2Ba −dependent farnesol dehydrogenase; FOLK, farnesol kinase.B.GydF4y2Ba二萜生物合成:GydF4y2BaentGydF4y2Ba- 好吧,GydF4y2BaentGydF4y2Ba-kaurene合成酶;Kao,仁偕甲酸羟化酶;GA20ox,赤霉素20-oxidase;GA3ox1,赤霉素3-beta-dioxygenase;Ga2ox,吉布林素2-氧化酶。GydF4y2BaCGydF4y2Ba类胡萝卜素生物合成:crtB, 15-顺式-三烯/全反式-三烯合成酶;PD, 15-cis-phytoene desaturase;ZDS, zeta-carotene desaturase;crtISO prolycopene异构酶;番茄红素beta-cyclase lcyB;LUT5 beta-ring羟化酶;CCD7, 9-顺式- β -胡萝卜素9 ',10 ' -双加氧酶;CCD8 carlactone合成酶;DWARF27,β-胡萝卜素异构酶;齐柏林飞艇,玉米黄质环氧酶; VDE, violaxanthin de-epoxidase; CCS1, capsanthin/capsorubin synthase; NCED, 9-cis-epoxycarotenoid dioxygenase; ABA2, xanthoxin dehydrogenase; AAO3, abscisic-aldehyde oxidase; ABAH, (+)-abscisic acid 8′-hydroxylase.D.GydF4y2Ba三萜生物合成:FDFT1,法尼基-二磷酸法尼基转移酶;SQLE,角鲨烯单氧酶;中科院,cycloartenol合成酶;DS, dammarenediol-II合酶;GydF4y2BaβGydF4y2Ba——beta-amyrin合成酶;PDS,原人参二醇合成酶;分,protopanaxatriol合成酶;SMT1,甾醇24-C-methyltransferase;SMO1 4 4-dimethyl-9beta 19-cyclopropylsterol-4alpha-methyl氧化酶;CPI1, cycloeucalenol cycloisomerase;CYP51,甾醇14-demethylase;颗,delta14-sterol还原酶;EBP, cholestenol Delta-isomerase;SMO2 4-alpha-methyl-delta7-sterol-4alpha-methyl氧化酶; ERG3, delta 7-sterol-5-desaturase; SMT2, 24-methylenesterol C-methyltransferase; DHCR7, 7-dehydrocholesterol reductase; DHCR24, delta24-sterol reductase; CYP710A, steroid 22-desaturase; CYP90B1, steroid 22-alpha-hydroxylase; CYP724B1, cytochrome P450 family 724 subfamily B polypeptide 1; CYP90A1, cytochrome P450 family 90 subfamily A polypeptide 1; CYP90D1, cytochrome P450 family 90 subfamily D1; CYP85A2, cytochrome P450 family 85 subfamily A2; CYP734A1, PHYB activation tagged suppressor 1.E.GydF4y2Ba单调萜类生物合成:( - ) -GydF4y2BaαGydF4y2Ba-TS,( - ) - α-萜品醇合成酶;(+) - Nd,(+) - Neomenthol脱氢酶;MENA,1,4-二羟基-2-萘酸盐替代萘酸酯转移酶。GydF4y2BaFGydF4y2BaSesquiterpenoids生物合成:GERD,( - ) - 生殖器;CYP71D55,premnaspirodiene氧酶;TPS1,Valencene / 7-EPI-α-硒合成酶。GydF4y2BaGGydF4y2BaTerpenoid-quinone生物合成:MENA,1,4-二羟基-2-萘酸盐替代萘酸酯酶;Ubie,Demethylmena醌甲基转移酶;WRBA,NAD(P)H脱氢酶;HPT,同质化植物植物;VTE1,生育酚环缩;Tomt,生育酚O-甲基转移酶;HST,同源异酸盐溶那甲酯转移酶;VTE3,2-甲基-6-PHYTYL-1,4-氢醌甲基转移酶GydF4y2Ba
两种人参根转录组分析的验证。GydF4y2Ba一种GydF4y2Ba随机选取9个差异表达基因(DEGs),采用qRT-PCR检测其表达水平。通过2倍变化计算基因表达GydF4y2Ba- (Δctmcg-Δctfcg)GydF4y2Ba下面(左边六列)和上面(右边三列)1.0表明这些基因分别在田间和山参(FCG和MCG)根中显著高表达。法尼基二磷酸合酶;HMGCR hydroxymethylglutaryl-CoA还原酶;SQLE,角鲨烯单氧酶;GA20ox,赤霉素20-oxidase;GA3ox1,赤霉素3-beta-dioxygenase;GA2ox,赤霉素2-oxidase;VTE3 MPBQ / MSBQ甲基转移酶;ABA2黄氧素脱氢酶;(+)和(+)-neomenthol脱氢酶。GydF4y2BaB.GydF4y2BaABA和GA在两种类型的人参根中的内容。绿色和黄色的柱子分别代表FCG和MCG根。ABA和GA的内容表示为NG / G F.W.(GydF4y2BaNGydF4y2Ba= 3)。“**”表示差异极显著(GydF4y2BaP.GydF4y2Ba< 0.01)GydF4y2Ba
萜类骨干骨架的生物合成GydF4y2Ba
如图所示。GydF4y2Ba4.GydF4y2Baa,我们发现人参根中萜类主干生物合成涉及58个编码18种酶的DEGs,其中绿色的DEGs在FCG根中显著高表达,而红色的DEGs在MCG根中显著高表达。通常,萜类主干的生物合成会产生一个通用的结构块,即异戊烯基焦磷酸(IPP),它由两个分离的生物合成途径产生:胞质中的甲戊酸(MVA)途径和2-GydF4y2BaCGydF4y2Ba质体中的-甲基-d -赤藓糖醇4-磷酸/1-脱氧-d -木糖5-磷酸(MEP/DOXP)途径[GydF4y2Ba16.GydF4y2Ba].MVA通路(图左侧)。GydF4y2Ba4.GydF4y2Baa)、乙酰辅酶a经AACT、HMGS、HMGCR、mvaK1、mvaK2和mvaD依次作用生物合成IPP。在MEP/DOXP通路的情况下(Fig。GydF4y2Ba4.GydF4y2Baa)、甘油醛3-磷酸(G3P)在DXS、DXR和ispD/G/H酶的催化下,通过一系列反应生成IPP。随后IPP或其异构体二甲基烯丙基焦磷酸(DMAPP)进一步转化为香叶基二磷酸(GPP),香叶基香叶基二磷酸(GGPP)和法尼基二磷酸(FPP),这些酶是所有萜类生物合成途径的起源。根据他们FPKM值,这两个IPP生物合成途径相关基因,因此他们的两个下游酶,ggp FDPS,明显higher-expressed在MCG的FCG根比,表明从花色的萜类化合物骨干通过这两个途径可能更活跃在FCG微克。GydF4y2Ba
除了直接合成下游三萜件,我们在图1的右侧看到。GydF4y2Ba4.GydF4y2Baa,一些FPP参与了发生在细胞膜上的蛋白质异丙二烯酰化(Bhandari et al., 2010)。具体来说,FPP通过C-S键与蛋白质的半胱氨酸结合,并通过酶FNTA/B生成法尼基-半胱氨酸-蛋白质复合物。然后分离出法尼基半胱氨酸分子GydF4y2BaCGydF4y2Ba酶PCYOX1氧化为法纳醛,PCYOX1通过NAD脱氢为法纳醇GydF4y2Ba+GydF4y2Ba-依赖酶FLDH最终被FOLK酶磷酸化为FPP。值得注意的是,编码FNTA、PCYOX1、FLDH和FOLK四种关键酶的基因(Fig.右侧)。GydF4y2Ba4.GydF4y2Ba一个;在MCG根中,异丙基化蛋白的表达量显著高于FCG,表明MCG中异丙基化蛋白的活性高于FCG。GydF4y2Ba
二萜类生物合成:负责在最佳条件下FCG的快速生长GydF4y2Ba
在二萜类生物合成中发现21次编码的五种酶(图。GydF4y2Ba4.GydF4y2Bab).首先,通过酶的催化作用GydF4y2BaentGydF4y2Ba- 好吧,GydF4y2BaentGydF4y2Ba由GGPP衍生的-共聚聚丙烯(图。GydF4y2Ba4.GydF4y2Baa)转化为kaurenic acid生成GAGydF4y2Ba12.GydF4y2Ba通过花王酶。随后,遗传算法GydF4y2Ba12.GydF4y2Ba被酶Ga0ox催化,产生一系列GA同种型,包括GAGydF4y2Ba15.GydF4y2Ba,GaGydF4y2Ba24.GydF4y2Ba,GaGydF4y2Ba9.GydF4y2Ba,GaGydF4y2Ba53.GydF4y2Ba,GaGydF4y2Ba44.GydF4y2Ba,GaGydF4y2Ba19.GydF4y2Ba和gaGydF4y2Ba20.GydF4y2Ba.其中,遗传算法GydF4y2Ba9.GydF4y2Ba转化为遗传算法GydF4y2Ba4.GydF4y2Ba通过GA3ox1酶和GAGydF4y2Ba4.GydF4y2Ba,GaGydF4y2Ba9.GydF4y2Ba和gaGydF4y2Ba20.GydF4y2Ba都被GA2ox酶催化形成GAGydF4y2Ba34.GydF4y2Ba- ,GaGydF4y2Ba51.GydF4y2Ba- 和gaGydF4y2Ba29.GydF4y2Ba分别-catabolites。总的来说,这五种酶(GydF4y2BaentGydF4y2Ba-KS、KAO、GA20ox、GA3ox1和GA2ox)在FCG根中显著高表达,说明FCG根中二萜的生物合成活性较高,尤其是GAs。作为进一步的证明,FCG根的GAs含量(56.962 ng/g f.w.)大约是MCG根(26.351)的两倍(图。GydF4y2Ba5.GydF4y2Bab),这可能负责在最佳现场条件下FCG根的快速生长。GydF4y2Ba
类胡萝卜素生物合成:负责应对MCG面临的恶劣条件GydF4y2Ba
无花果。GydF4y2Ba4.GydF4y2Bac显示,在类胡萝卜素生物合成途径中发现了编码16种酶的34个DEGs。首先,五种酶crtB、PD、ZDS、crtISO和lcyB共同转化GGPP(图。GydF4y2Ba4.GydF4y2Baa)至β-胡萝卜素,主要在mcg根中高于fcg。其次,β-胡萝卜素倾斜以通过酶Lut5在MCG根中形成玉米蛋白,但通过三个步骤通过三个酶Dwarf27,CCD7和CCD8中的三个步骤在FCG根的较高表达可能表明新发现的生物合成的三个步骤中的三个步骤植物激素症状。第三,通过酶Zep和VDE通过酶CCS1或vertaxanth转化为辣椒素的胃果。在此,FCG根的Zep和VDE的表达比MCG在MCG中显着较高,但是,检测到MCG根中的CCS1的表达更高。最后,通过酶通过酶的酶转化为紫外线的毒素,通过酶ABA2和AOA3催化成脱落,并通过酶ABAH将其它羟基化至8'-羟基脱落酸。并且这三种酶在MCG根中也比在FCG中高。这些结果表明,ABA可能存在更高的积累,以应对MCG根面对的恶劣条件。为了验证该假设,确定了在FCG和MCG的根中的ABA(图。GydF4y2Ba5.GydF4y2Bab),发现ABA含量在MCG根(25.100ng / g f.)中比FCG(9.510ng / g f.W.)高2.6倍,与我们的扣除从上述转录组分析中推断出来。GydF4y2Ba
应提及MVA / MEP途径与其下游ABA生物合成之间的相关性的有趣发现。通常认识到,Ga和Aba Biosyntheses依赖于来自MVA / MEP途径的FPP [GydF4y2Ba17.GydF4y2Ba].但是,此概念并未完全由当前的工作验证。即使气体生物合成(图。GydF4y2Ba4.GydF4y2Bab;注意绿色的酶)确实显示出与MVA/MEP途径相似的趋势(Fig的左边和中间)。GydF4y2Ba4.GydF4y2Ba一个;如预测的那样,证明了GAs的生物合成与MVA/MEP途径,ABA的生物合成呈正相关(图。GydF4y2Ba4.GydF4y2BaC;注意那些红色的酶)显示与MVA / MEP途径的交谈趋势,但与蛋白质异戊二烯化相同的趋势(在图1的右侧。GydF4y2Ba4.GydF4y2Ba一个;注意那些红色的酶),其据报道是负调节的MVA / MEP途径[GydF4y2Ba17.GydF4y2Ba那GydF4y2Ba18.GydF4y2Ba],表明ABA生物合成可能与MVA / MEP途径多的蛋白质异戊二烯途径相关。即,推导出在MCG根系中更加剧烈的生物合成,可能来自于通过蛋白质异丙酚途径循环的FPP,这显然需要在进一步的研究中被证明。GydF4y2Ba
三萜类生物合成:覆盖人参根中甾体和人参皂苷的生物合成GydF4y2Ba
如图所示。GydF4y2Ba4.GydF4y2BaD,来自FPP的Squalene通过酶Sqle氧化成2,3-氧基喹啉,进一步转化为类固醇和人参皂苷。对于类固醇生物合成,2,3-氧基喹啉主要转化为环丁烯醇,随后转化为参与芸苔属生物合成(Br)的甾醇和炉灶。详细地,通过包括CYP90B1,CYP72B1,CYP90A1和CYP90D1的一系列酶转化为CAMPERTERONE,并最终通过酶CYP85A2到芸苔醇。如图所示。GydF4y2Ba4.GydF4y2Bad,除CPI1、EBP和DHCR7酶外,FCG根中大多数甘油三酯前的DEGs编码酶的表达显著高于MCG根;但从CYP90B1到CYP734A1的酶变化趋势不明确。GydF4y2Ba
In case of biosynthesis of ginsenosides, the DEGs encoding two saponin synthases, β-AS and DS, which produced β-amyrin and dammarenediol II in respective, were significantly higher-expressed in FCG root than in MCG’s, indicating that β-amyrin and dammarenediol II were more abundant in FCG root. Dammarenediol II was catalyzed by the oxidoreductases PDS and PTS into protopanaxadiol and protopanaxatriol in successive, which were further transformed into ginsenosides (PPD- and PPT-type). In our analyses, PDS gene was significantly higher-expressed in FCG root, but PTS gene showed a converse trend, revealing that biosynthetic activity of PPD-type ginsenosides might be higher in FCG root, meanwhile that of PPT-type ginsenosides were ambiguous, probably at a same level in the two types of ginseng root, or also at a higher level in MCG root than in FCG’s, due to the high level of PPD-type ginsenosides as the substrate. To verify this hypothesis, contents of ginsenosides were determined (Table1GydF4y2Ba).结果表明,MCG根中ppd型人参皂苷含量(134.558 mg/g f.w.)极显著低于FCG根(189.081),而ppt型人参皂苷含量在MCG根(162.596)和FCG根(160.941)之间无显著差异。因此,MCG根总皂苷(297.15)极显著低于FCG根总皂苷(350.02)。这些结果也与基因表达的测定结果一致。GydF4y2Ba4.GydF4y2Bad)。GydF4y2Ba
几种类型的其他三萜:与人参挥发性化合物相关GydF4y2Ba
除了形成植物激素和人参皂苷外,萜类主干还与“单萜类”、“倍半萜类”和“萜类-醌类”的生物合成有关。GydF4y2Ba4.GydF4y2Baeg)。单萜类化合物来源于GPP(图。GydF4y2Ba4.GydF4y2Baa)和(-)-α-松油醇和(+)-新薄荷醇,其合酶[图。GydF4y2Ba4.GydF4y2Bae;( - ) - α-TS和(+) - ND]分别在FCG和MCG根中高度表达。在生物合成的Sesquiterpenoids,FPP中(图。GydF4y2Ba4.GydF4y2BaA)直接生成倍半萜类化合物,包括germacrene, solavetivone和valencene/7-epi-α-selinene;其中编码valencene/7-epi-α-selinene和solavetivone的酶(分别为TPS1和CYP71D55)在FCG根中显著高表达,而编码germacrene D的酶(GERD)在MCG根中显著高表达(图2)。GydF4y2Ba4.GydF4y2BaF)。对于Terpenoid-Quinones,GPP的生物合成(图。GydF4y2Ba4.GydF4y2Baa)转化为phytyl-PP和solanesyl-PP,前者进一步转化为phylloquinol或生育酚,后者被催化为质体喹啉。叶皮酚和质体酚的生物合成在MCG根中更为活跃,合成酶menA、ubiE、wrbA、HST和VTE3的表达量较高,而生育酚合成酶HPT、VTE1和TOMT的表达量则显著高于MCG根(图)。GydF4y2Ba4.GydF4y2Bag)。GydF4y2Ba
为了支持我们的结论,用GC-MS分析了两种人参根中萜类化合物的含量。如表所示GydF4y2Ba2GydF4y2Ba,完全鉴定了33种化合物,并在附加文件中显示了它们的详细峰信息和总离子色谱GydF4y2Ba3.GydF4y2Ba:表S5和附加文件GydF4y2Ba4.GydF4y2Ba:图S2。总之,10个Sesqieterpenoids和15个三萜类化合物占大多数这些化合物,其分别在MCG和FCG根中显示出显着的积累。在哪种生殖酮D倾斜以在MCG根中积聚;α-氨霉素,γ-谷甾醇,环丁烯醇醋酸甲酯,Ergosterol(与obtusifoliol和8,14-甾醇相关),胆固醇氯甲酸酯(与24-甲基溶剂醇相关),4-分校 - 3-一(与炉子相关),和Stigmasterol衍生物(包括STIGMASTA-3,5-DIEN-7-ON,STIGMASTA-3,5-二烯,STIGMASTA-5,22-DIEN-3-OL,STIGMASTA-5,22-DIEN-3-OL,醋酸盐和高度检测到Stigmast-5-烯-3-醇,醋酸盐在FCG根中被高度检测到。此外,GydF4y2BaP.GydF4y2Ba单萜类生物合成中(+)-新薄荷醇的上游产物-menthane和萜醌类生物合成中phylloquinol的上游产物1,4-萘醌在MCG根中均表现出较高水平。相反,FCG根中生育酚含量较高。这些结果也与上述转录组分析结果一致。GydF4y2Ba
TFS注释GydF4y2Ba
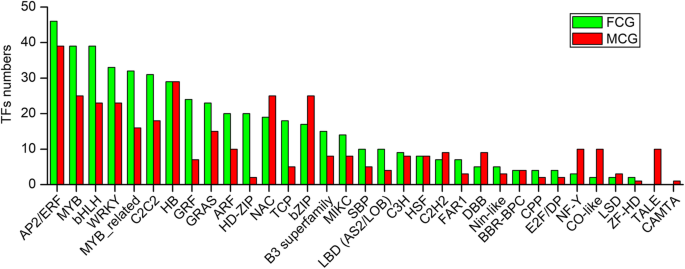
作为基因表达调控元件的主要组成部分,共注释了44个TF家族中3134个与TF相关的基因,其中最常见的是AP2/ERF,其次是MYB、bHLH和NAC(附加文件)GydF4y2Ba5.GydF4y2Ba:表S6)。差异表达的TFs(图。GydF4y2Ba6.GydF4y2Ba),来自33个TF家族的572和370个TF分别在FCG和MCG根显著高表达。其中285和233个转录因子被分为AP2/ERF、HB、MYB、NAC、bZIP、bHLH、WRKY和C2C2家族,超过一半的转录因子可能调控FCG和MCG的基因表达差异。此外,在MCG根中,两个家族的所有转录因子TALE和CAMTA均上调,表明这两个家族可能与MCG植物面临的逆境抗性有关。GydF4y2Ba
讨论GydF4y2Ba
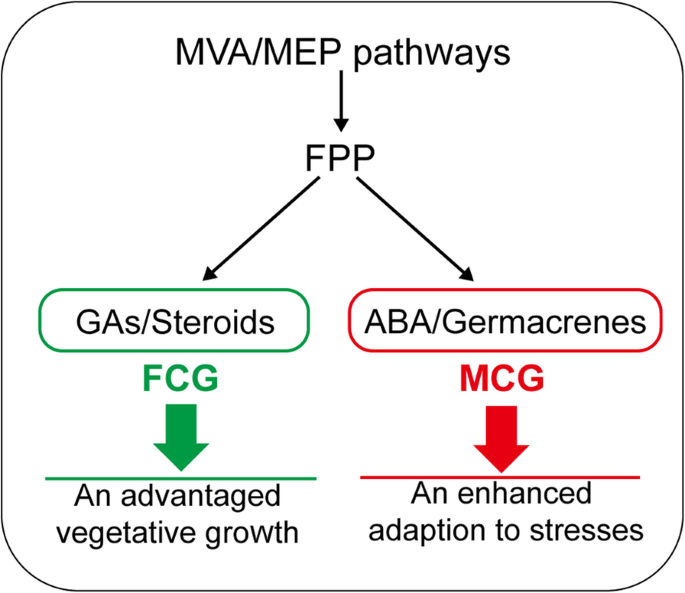
自从Kim等人。[GydF4y2Ba19.GydF4y2Ba[报道,来自人参叶的第一个转录组,比较转录组分析也已广泛进行,在不同人参根,如两种韩国人参品种的根(即,品种GydF4y2BaCheonryangGydF4y2Ba和GydF4y2BaYunpoongGydF4y2Ba)和美国人参(GydF4y2Bap . quinquefoliusGydF4y2Ba,凭证不。MPS002310) [GydF4y2Ba20.GydF4y2Ba],来自五个韩国人参品种的不定根(即,品种GydF4y2BaChunpoongGydF4y2Ba那GydF4y2Ba旗袍GydF4y2Ba那GydF4y2Ba桑海GydF4y2Ba那GydF4y2BaGoopongGydF4y2Ba, 和GydF4y2BaSununGydF4y2Ba)[GydF4y2Ba21.GydF4y2Ba或者或韩国人参品种的四个部分GydF4y2BaChunpoongGydF4y2Ba(即全根、主根体、根茎、侧根)[GydF4y2Ba22.GydF4y2Ba,为人参的初级和次级代谢提供了新的认识。针对FCG和MCG根的比较转录组分析,已经报道了萜类生物合成的几个关键基因。Sathiyamoorthy等人[GydF4y2Ba23.GydF4y2Ba首先报道了FCG和MCG的比较转录组分析,并初步讨论了基于6757年表达的序列标签的推定等序列标签,其中14岁的MCG和4岁FCG的毛状根和根部。zhen等人。[GydF4y2Ba24.GydF4y2Ba]构建了三种人参根(FCG、MCG和野生人参根)的根转录组,发现编码关键萜类生物合成酶HMGCR、MVK和SE的3个基因在野生人参根中的活性高于FCG。Wang等[GydF4y2Ba25.GydF4y2Ba从5-、12-、18-和25- MCG和4- FCG的根中鉴定出13种酶的78个基因,参与萜类主链和三萜类的生物合成。在目前的工作中,26648个DEGs中,496个基因分布在7个占优势的萜类途径。FCG根中二萜类和三萜类生物合成基因的表达显著高于MCG。相反,在MCG根中类胡萝卜素的生物合成活性明显高于FCG。此外,主干萜类、单萜类、倍半萜类和萜类醌类生物合成均无明显倾向。结合定量测定,我们最终推断出几种萜类化合物在FCG和MCG根中的倾向明显不同,取决于生长条件,从而导致生理表型性状的多样性(图)。GydF4y2Ba1GydF4y2Ba).在恶劣条件下,MCG的ABA和germacrene D及其几何异构体的积累显著增加。其中,ABA被认为介导了根系对干旱和盐胁迫的响应[GydF4y2Ba26.GydF4y2Ba].Germacrene D及其几何异构体,以前也在人参根中检测到[GydF4y2Ba27.GydF4y2Ba]被证明在寒冷的压力下是一种显着的浓缩[GydF4y2Ba28.GydF4y2Ba,也有助于适应不同的压力。此外,对压力的适应还体现在某些tf的分布上。例如,NAC、bZIP、NF-Y和CO-like的tf家族被广泛认为与抗逆性有关[GydF4y2Ba29.GydF4y2Ba那GydF4y2Ba30.GydF4y2Ba发现,被发现富含MCG(图。GydF4y2Ba6.GydF4y2Ba).特别是,TALE和CAMTA家族的表达仅在MCG中观察到。据报道,调节根生长的TALE家族[GydF4y2Ba31.GydF4y2Ba],在低温或高温胁迫下,橡胶和大豆中分别上调[GydF4y2Ba32.GydF4y2Ba那GydF4y2Ba33.GydF4y2Ba].同样,Camta系列的TFS被证明是在响应非生物压力的豆豆和草莓根上发挥作用[GydF4y2Ba34.GydF4y2Ba那GydF4y2Ba35.GydF4y2Ba].因此,可以得出结论,这些活跃的转录因子家族与MCG抗应激增强有关。在最佳人工培养条件下的FCG中,更多来自MVA/MEP途径的FPP可用于GAs和甾体的生物合成,如图所示。GydF4y2Ba7.GydF4y2Ba.由于GAs被广泛认为可以促进根的生长[GydF4y2Ba36.GydF4y2Ba[可以预期FCG中的较高水平的气体,可以推动用于增厚主要根根的生长。此外,类固醇样炉灶,刺激植物的空中部分的生长[GydF4y2Ba37.GydF4y2Ba和豆甾醇,影响细胞扩张和细胞分裂相关基因的表达[GydF4y2Ba38.GydF4y2Ba],富FCG(表GydF4y2Ba2GydF4y2Ba).这些可能都有助于其主根的有利营养生长,从而获得更高的生物量,从而具有更高的商业价值。为了证明这一假设,我们观察了FCG和MCG的形态。通过对其地上部分和地下部分的比较,可以看出,在茎、复叶、花茎和叶柄上,FCG确实明显优于MCG,但在侧根分枝上明显低于MCG(图2)。GydF4y2Ba1GydF4y2Ba;额外的文件GydF4y2Ba6.GydF4y2Ba表S7),两者都是由FCG根中比MCG根中更活跃的GAs和类固醇生物合成的影响造成的。GydF4y2Ba
几乎所有关于转录组的研究GydF4y2BaP.人参GydF4y2Ba已涉及人参皂苷的生物合成。Gao等人[GydF4y2Ba39.GydF4y2Ba在FCG中鉴定了248个人参皂苷生物合成相关基因和257个防御应答基因GydF4y2Ba柱孢属destructansGydF4y2Ba,发现前者39展示了与后者29的关系。在使用甲基己酸甲基甲基甲基甲酸的外来根系中。[GydF4y2Ba40GydF4y2Ba]不仅鉴定了749个人参皂苷生物合成基因,而且还鉴定了与人参皂苷输送有关的12个脂肪耐药性基因。刘等。[GydF4y2Ba41.GydF4y2Ba]进一步报道了这一点GydF4y2BaP. notoginseng.GydF4y2Ba砷胁迫下人参皂苷生物合成的下调。李及马吉[GydF4y2Ba42.GydF4y2Ba研究表明,水分不足可能导致西洋参中人参皂苷含量增加。这些发现揭示了人参皂苷的生物合成可能受到生物和非生物胁迫的双重影响,从而解释了为什么FCG和MCG的根中人参皂苷含量不同。根据这一论点,我们认为,有利于FCG培养的最佳生长条件可能会产生更多的dammarenediol II和ppd型人参皂苷,而严酷的生长环境可能会迫使MCG在自然条件下将更多的ppd型人参皂苷转化为ppd型人参皂苷(图)。GydF4y2Ba4.GydF4y2Bad)。因此,我们猜测它是对应力敏感的ppd型,并且当环境应力进一步突出时,PPT型人参皂苷酸型可能最近响应PPD型人参皂苷。这个猜想可以解释一种现象[GydF4y2Ba43.GydF4y2Ba结果表明,间歇低温(25°C 12 h和5°C 12 h)可增加PPD-型人参皂苷的生物合成,而连续低温(5°C 24 h)可增加PPD-和ppt -型人参皂苷的生物合成,表明PPD-型人参皂苷可能在应对低温胁迫时产生。而持续冷却则会导致多余的ppd型人参皂苷转化为ppt型人参皂苷。GydF4y2Ba
结论GydF4y2Ba
总体而言,本研究首先概述了FCG和MCG根系中的Terpenoids代谢。在此,二萜类化合物和三萜类化合物在FCG根中显着高于表达,并且相反,类胡萝卜素生物合成在MCG根系中更活跃,另外,Terpenoid主链的生物合成,单调萜类,癫痫萜烯酮和三萜醌不明显倾向于任何类型.具体而言,检测到,FCG根系中的气体和类固醇生物合成基因具有更高的气体和类固醇,这可能是其快速植物生长的原因,以及更高水平的ABA和生长醇类以及原醇醇型人参皂苷导致应力- 在mcg根中的形式。我们的研究结果可以大大促进阐明FCG和MCG根系之间不同形态外观和植物化学组合物的潜在机制,而且提供了理解其他栽培和野生物种中的Terpenoids生物合成的可参考观点。GydF4y2Ba
方法GydF4y2Ba
植物材料GydF4y2Ba
五岁的田间培养人参(FCG)和山地人参(MCG)(GydF4y2BaP.人参GydF4y2Ba简历。2016年9月下旬,在辽宁省宽甸县田间(125°2′32.14″E, 41°2′40.92″N)和桓仁县相邻山区(125°37′32.92″E, 41°2′39.85″N)采集到Ermaya。田间地块年平均气温和降雨量分别为7.13°C和1051.1 mm,山地地块年平均气温和降雨量分别为6.93°C和814.5 mm(详见附加文件)GydF4y2Ba7.GydF4y2Ba:表S1)。GydF4y2Ba
在收集时,用Vernier Capipers记录每种人参植物的茎,花茎,叶柄,龙头和侧壁以及横向根部的长度和宽度和宽度和宽度。清洁蒸馏水后,人参根在液氮中冷冻。GydF4y2Ba
RNA的分离、文库构建和测序GydF4y2Ba
根据制造商的协议,使用Trizol Reagent(Thermo Fisher Scientific Inc.,Waltham,Waltham,Waltham)的FCG和MCG的RNA总数。简而言之,水相用于具有相等体积的异丙醇的RNA沉淀。用1mL 75%乙醇洗涤RNA沉淀一次,然后在适当体积的不含RNase-水中重新溶解。对于两个样品中的每一个,收集至少三个单独的人参根用于RNA分离。为了避免蛋白质和多糖的干扰,使用ND-2000分光光度计(Thermo Fisher Scientific Inc.,Waltham,USA)和2100生物分析仪(Agilent Technologies Inc.,Santa Clara,USA)评估RNA浓度和质量。根据Truseq RNA样品制备指南(Illumina Inc.,San Diego,USA),所有这两个样品都应显示260nm的吸光度与280nm(GydF4y2BaR.GydF4y2Ba260/280GydF4y2Ba)在1.8-2.0,RNA完整性数量小于或等于8.0。GydF4y2Ba
用TruSeq RNA样品制备试剂盒对两种人参根样品各提取5 μg总RNA,构建文库。简单地说,保利(A)GydF4y2Ba+GydF4y2BamRNA通过磁性Oligo-dT珠(Thermo Fisher Scientific Inc., Waltham, USA)分离,并在碎片缓冲液中随机碎片到200 bp。构建的DNA模板经过15个周期的PCR扩增。扩增产物通过Bio-Rad Inc., Hercules, USA的认证低范围超琼脂糖凝胶电泳进行纯化。使用Truseq SBS Kit v3-HS 200 cycles Kits (Illumina Inc., San Diego, USA)在Illumina Hiseq4000测序仪(Illumina Inc., San Diego, USA)上进行高通量测序。Illumina rna测序原始reads可从NCBI Sequence Read Archive数据库(GydF4y2Bahttp://www.ncbi.nlm.nih.gov/sra.GydF4y2Ba),加入号为PRJNA419783。GydF4y2Ba
功能注释GydF4y2Ba
获得测序数据后,使用SeqPrep和Sickle 1.2软件去除适配器和低质量序列,对原始reads进行清理,产生792.51亿条干净reads,总长度为10.83 Gbp(占原始reads的95.08%)。然后,将获得的clean reads输入人参品种春风的基因组数据库(人参基因组数据库,GydF4y2Bahttp://ginsengdb.snu.ac.kr.GydF4y2Ba)[GydF4y2Ba44.GydF4y2Ba在Hisat2软件的帮助下[GydF4y2Ba45.GydF4y2Ba].基于该基因组,我们计算出目前转录组数据的测序深度为6G(约190X)。使用Diamond v0.8.37.99、Hmmer 3.1b2、Blast2GO 2.5.0和Kobas 2.1.1等软件对NR、Swissprot、Pfam、GO、COG和KEGG等数据库进行基因功能注释。基于PlantTFDB数据库,利用Hmmscan对转录因子(转录因子)进行注释和分类。GydF4y2Ba
差异表达基因分析GydF4y2Ba
通过每百万测序reads的每千碱基片段(FPKM)分析注释基因的表达情况,通过DEGseq 30.0(即if)比较差异表达基因(DEGs)的FPKM值来鉴定差异表达基因GydF4y2BaP.GydF4y2Ba < 0.05 and the false discovery rate < 0.05, then the result is considered statistically significant.). Subsequently, enrichment analysis of KEGG pathways was performed based on these DEGs using KOBAS software.
验证的存在GydF4y2Ba
对感兴趣的基因进行实时定量PCR (qRT- PCR)分析。在这些基因中,随机选择了9个基因,它们的表达差异很大,或者参与了萜类生物合成。的GydF4y2BaIF3G1GydF4y2Ba(KU215663.1)基因作为内参[GydF4y2Ba46.GydF4y2Ba].引物被列入附加文件GydF4y2Ba8.GydF4y2BaS2:表。使用Rayscript cDNA Synthesis Kit (GENEray Biotech Co., Ltd, Shanghai, China)对人参根样品中大约1.0 μg的总RNA进行了逆转录。随后,采用SYBR Green I法,从Power qPCR PreMix Kit (GENEray Biotech Co., Ltd, Beijing, China)中提取0.5 μl (10 μM)特异性引物、5 μl cDNA (750 ng/ μl)和4.5 μl PCR Enzyme Mix进行扩增。循环参数为95°C 5 min, 95°C 10 s, 60°C 34 s, 90°C 15 s,循环40次。进行了三个独立的生物学和技术重复。扩增特异性采用解离曲线分析,基因相对表达量采用2GydF4y2Ba——ΔΔctGydF4y2Ba方法 [GydF4y2Ba47.GydF4y2Ba].GydF4y2Ba
关键萜类化合物的测定GydF4y2Ba
分光光度法测定ABA和GAGydF4y2Ba
脱落酸(ABA)的提取方法:取新鲜人参根1.000 g,用液氮研碎,在3ml冷提取溶剂[丙酮:水:乙酸,80:19:1 (v:v:v)]中超声(昆山仪器有限公司KQ5200E超声仪)15 min。随后,混合物在4000 rpm和4°C下离心10分钟(Sigma, St. Louis, USA)。收集上清液,再将残渣提取两次。将三种上清液与萃取溶剂混合稀释至10 mL进行分析。ABA的测定采用酶联免疫吸附法(ELISA Kit, Coolaber Co., Ltd, Beijing, China),按照厂家说明进行。GydF4y2Ba
如下进行胃纤维素(气体)的提取:将0.500g新鲜人参根在5mL冷水中超声处理5分钟,然后以5000rpm和4℃离心10分钟。收集上清液,再将残渣提取两次。然后,将三个上清液合并并用水稀释至15ml。在用15%乙酸调节pH至2.8后,将水溶液与15mL乙醚分配,并将上部有机层收集并在室温下完全蒸发至干,最终重新悬浮在1ml 10%甲醇中。分析。气体由酶联免疫吸附试验(ELISA试剂盒,Cocaber Co.,Ltd。,北京,中国)测定。GydF4y2Ba
HPLC法测定人参皂苷含量GydF4y2Ba
人参皂苷的分离和测定根据以前的报道[GydF4y2Ba48.GydF4y2Ba]略有修改。粉碎1.000g的新鲜人参根并加入10ml 70%乙醇中。将混合物在冷水中超声处理40分钟,然后用0.22-μm过滤器(Keyilong仪器有限公司,天津,中国)过滤。收集滤液,残留物再萃取两次。最后,使用三种滤液并使用旋转蒸发器(Re52-A,中国的Yarong仪器有限公司),在40℃下在40℃下蒸发至干。将干燥的提取物溶于5ml甲醇中,并在HPLC分析之前通过0.22-μm注射器过滤器过滤。对于HPLC分析,Shimadzu HPLC系统(Shimadzu Corp.,Kyoto,Japan)配备了SPDM20A紫外线探测器,Diamonsil5μmcGydF4y2Ba18.GydF4y2Ba(ii)柱(250×4.6 mm列,Dikma Tech。Inc.,北京,中国)和由分析软件(LC Solution-Release 1.23SP1)控制的SIL-20 AC TH自动进样器。在下列条件下进行人参皂甙的测定:流动相为0.1%(GydF4y2BaV.GydF4y2Ba/ v)水(a)和乙腈(b)(a:b = 80:20)和梯度洗脱计划的磷酸为0-14分钟,21%b;14-30分钟,21-30%B;30-60分钟,30-32%b;60-75分钟,32-33%b;75-100分钟,33-35%B;100-110分钟,35-37%B;110-120分钟,37-60%B;120-130分钟,60-70%B;130-140分钟,70-80%b;140-150分钟,80-100%B.监测波长设定为203nm,1.0ml / min的流速,50℃,25°C的柱温液。 Ginsenosides standards were purchased from National Institutes for Food and Drug Control (Beijing, China), and stored at − 20 °C until analysis. A profile of standards (protopanaxadiol types: Rg1GydF4y2Ba1 mg/ml, Re 0.75 mg/ml, Rf 0.3 mg/ml, FGydF4y2Ba1GydF4y2Ba1.2 mg/ml, RgGydF4y2Ba2GydF4y2Ba0.2毫克/毫升;protopanaxatriol类型:RbGydF4y2Ba1GydF4y2Ba0.3 mg/ml, Rc 0.25 mg/ml, RbGydF4y2Ba2GydF4y2Ba0.25 mg / ml,RBGydF4y2Ba3.GydF4y2Ba0.2 mg/ml, Rd 0.3 mg/ml, RhGydF4y2Ba2GydF4y2Ba甲醇中的0.25mg / ml)显示在附加文件中GydF4y2Ba9.GydF4y2Ba:图S1。所有标准的校准曲线的相对系数高于0.998。GydF4y2Ba
通过GC-MS测量几个其他三萜骨的测量GydF4y2Ba
减少侵害侵犯的萜类化,超临界有限公司GydF4y2Ba2GydF4y2Ba进行提取(SFE)。约3g冻干样品以10厘米加入GydF4y2Ba3.GydF4y2Ba每次运行的船只。CO的流速GydF4y2Ba2GydF4y2Ba为1.5 L/h,以30 ml乙醇作为夹带剂。经过初步试验,确定提取时间为120 min,容器内温度和压力为45℃,400 bar。GydF4y2Ba
采用岛津GC-MS-QP2010 Plus(岛津,日本京都)和Rtx-5MS (30 m × 0.25 mm, 0.25 μm膜厚)色谱柱(日本京都岛津)对目标萜类化合物进行分离和定量。使用的气相色谱条件设置如下:程序升温从40°C到320°C, 5°C /min,然后在等温条件下10分钟。进样口和检测器设置在300℃。氦气以1.0 ml/min恒流作为载气。10 μl SFE样品以1:10的方式进样。MS条件:电离能为70 eV;离子源温度220℃;质量范围40-750 m/z。质谱参考数据库为NIST Special Database 14。GydF4y2Ba
统计分析GydF4y2Ba
所有测定都进行了3个重复的实验,结果以平均值±标准差(SD)表示。采用SPSS 19.0软件进行统计分析GydF4y2BaP.GydF4y2Ba值< 0.05认为有统计学意义。GydF4y2Ba
缩写GydF4y2Ba
- (−)-α- t:GydF4y2Ba
-
(−)-alpha-terpineol合成酶GydF4y2Ba
- (+) nd:GydF4y2Ba
-
(+) -neomenthol脱氢酶GydF4y2Ba
- AAO3:GydF4y2Ba
-
Abscisic-aldehyde氧化酶GydF4y2Ba
- 阿巴:GydF4y2Ba
-
脱落酸GydF4y2Ba
- ABA2:GydF4y2Ba
-
黄氧素脱氢酶GydF4y2Ba
- 阿巴:GydF4y2Ba
-
(+)脱落酸羟化酶8”GydF4y2Ba
- 行为:GydF4y2Ba
-
乙酰-CoA c-乙酰转移酶GydF4y2Ba
- CAS:GydF4y2Ba
-
Cycloartenol合酶GydF4y2Ba
- CCD7:GydF4y2Ba
-
9-CIS-BETA-CAROTENE 9',10'裂解二恶英酶GydF4y2Ba
- CCD8:GydF4y2Ba
-
carlactone合成酶GydF4y2Ba
- CCS1:GydF4y2Ba
-
Capsanthin / Capsorubin合成酶GydF4y2Ba
- CPI1:GydF4y2Ba
-
Cycloeucalenol cycloisomeraseGydF4y2Ba
- CRTB:GydF4y2Ba
-
15-CIS-植物/全转霉植物合酶GydF4y2Ba
- crtISO:GydF4y2Ba
-
Prolycopene异构酶GydF4y2Ba
- CYP51:GydF4y2Ba
-
甾醇14-脱甲基酶GydF4y2Ba
- CYP710A:GydF4y2Ba
-
类固醇22-desaturaseGydF4y2Ba
- CYP71D55:GydF4y2Ba
-
Premnaspirodiene加氧酶GydF4y2Ba
- CYP724B1:GydF4y2Ba
-
细胞色素P450家族724亚家族B多肽1GydF4y2Ba
- CYP734A1:GydF4y2Ba
-
PHYB激活标记抑制因子1GydF4y2Ba
- CYP85A2:GydF4y2Ba
-
细胞色素P450家庭85亚家族A2GydF4y2Ba
- CYP90A1:GydF4y2Ba
-
细胞色素p450家族90亚家族含有多肽1GydF4y2Ba
- CYP90B1:GydF4y2Ba
-
类固醇22-alpha-hydroxylaseGydF4y2Ba
- CYP90D1:GydF4y2Ba
-
细胞色素P450家族90亚家族D1GydF4y2Ba
- 度:GydF4y2Ba
-
差异表达基因GydF4y2Ba
- Det2:GydF4y2Ba
-
类固醇α还原GydF4y2Ba
- DHCR24:GydF4y2Ba
-
Delta24-sterol还原酶GydF4y2Ba
- DHCR7:GydF4y2Ba
-
7-dehydrocholesterol还原酶GydF4y2Ba
- DMAPP:GydF4y2Ba
-
Dimethylallyl焦磷酸GydF4y2Ba
- DS:GydF4y2Ba
-
Dammarenyiol-II合成酶GydF4y2Ba
- DWARF27:GydF4y2Ba
-
β-胡萝卜素异构酶GydF4y2Ba
- DXR:GydF4y2Ba
-
1-脱氧-D-木糖糖-5-磷酸氧化酯酶GydF4y2Ba
- dx:GydF4y2Ba
-
1-脱氧-D-木糖糖-5-磷酸合酶GydF4y2Ba
- EBP:GydF4y2Ba
-
胆烯醇三角洲异构酶GydF4y2Ba
- entGydF4y2Ba- 好:GydF4y2Ba
-
entGydF4y2Ba-kaurene合成酶GydF4y2Ba
- ERG3:GydF4y2Ba
-
三角洲7-sterol-5-desaturaseGydF4y2Ba
- FCG:GydF4y2Ba
-
Field-cultivated人参GydF4y2Ba
- FDFT1:GydF4y2Ba
-
Farnesyl-diphosphate批GydF4y2Ba
- FDPS:GydF4y2Ba
-
通过二磷酸合酶GydF4y2Ba
- 罗斯福:GydF4y2Ba
-
错误发现率GydF4y2Ba
- FK:GydF4y2Ba
-
Delta14-sterol还原酶GydF4y2Ba
- FLDH:GydF4y2Ba
-
河畔GydF4y2Ba+GydF4y2Ba −dependent farnesol dehydrogenase
- FNTA / B:GydF4y2Ba
-
α/β-蛋白法呢基转移酶GydF4y2Ba
- 民族:GydF4y2Ba
-
金合欢醇激酶GydF4y2Ba
- FPKM:GydF4y2Ba
-
每千碱基的片段每百万映射读取GydF4y2Ba
- FPP:GydF4y2Ba
-
通过二磷酸GydF4y2Ba
- G3P:GydF4y2Ba
-
甘油醛3 -磷酸GydF4y2Ba
- GA20ox:GydF4y2Ba
-
Gibberellin 20-氧化酶GydF4y2Ba
- GA2ox:GydF4y2Ba
-
赤霉素2-氧化酶GydF4y2Ba
- Ga3ox1:GydF4y2Ba
-
Gibberellin 3-Beta-DioxygenaseGydF4y2Ba
- 气体:GydF4y2Ba
-
赤霉素GydF4y2Ba
- GERD:GydF4y2Ba
-
Germacrene合酶GydF4y2Ba
- GGPP:GydF4y2Ba
-
Geranylgeranyl焦磷酸GydF4y2Ba
- ggp:GydF4y2Ba
-
天竺葵二磷酸二磷酸合成酶GydF4y2Ba
- GPP:GydF4y2Ba
-
小烷基二磷酸GydF4y2Ba
- HMGCR:GydF4y2Ba
-
羟甲基戊齐芳基因CoA还原酶GydF4y2Ba
- 邮政编码:GydF4y2Ba
-
Hydroxymethylglutaryl-CoA合酶GydF4y2Ba
- HPT:GydF4y2Ba
-
Homogentisate phytyltransferaseGydF4y2Ba
- HST:GydF4y2Ba
-
同型异盐溶那盐转移酶GydF4y2Ba
- 伊迪:GydF4y2Ba
-
Isopentenyl-diphosphate delta-isomeraseGydF4y2Ba
- ispD:GydF4y2Ba
-
2-C-甲基-D-赤藓糖醇4-磷酸胞嘧啶甲基转移酶GydF4y2Ba
- ispG:GydF4y2Ba
-
(GydF4y2BaE.GydF4y2Ba)-4-羟基-3-甲基丁基-2-烯基二磷酸合成酶GydF4y2Ba
- ispH:GydF4y2Ba
-
4-hydroxy-3-methylbut-2-en-1-yl二磷酸还原酶GydF4y2Ba
- kao:GydF4y2Ba
-
Ent-Kaureno酸羟化酶GydF4y2Ba
- lcyB:GydF4y2Ba
-
番茄红素β环酶GydF4y2Ba
- LUT5:GydF4y2Ba
-
Beta-ring羟化酶GydF4y2Ba
- MCG:GydF4y2Ba
-
Mountain-cultivated人参GydF4y2Ba
- 梅娜:GydF4y2Ba
-
1, 4-dihydroxy-2-naphthoate octaprenyltransferaseGydF4y2Ba
- 议员/ DOXP:GydF4y2Ba
-
2-GydF4y2BaCGydF4y2Ba- 甲基-D-赤藓糖醇4-磷酸/ 1-脱氧-D-木糖5-磷脂GydF4y2Ba
- MVA:GydF4y2Ba
-
甲戊酸酸GydF4y2Ba
- MVAD:GydF4y2Ba
-
二磷甲醛脱羧酶GydF4y2Ba
- MVAK1:GydF4y2Ba
-
甲羟戊酸激酶GydF4y2Ba
- MVAK2:GydF4y2Ba
-
磷酮激酶GydF4y2Ba
- nc:GydF4y2Ba
-
9-CIS-环氧丙酮蛋白二氧化酶GydF4y2Ba
- PCYOX1:GydF4y2Ba
-
戊基琥珀氧化酶GydF4y2Ba
- 帕金森病:GydF4y2Ba
-
15-CIS-植物去饱和酶GydF4y2Ba
- PDS:GydF4y2Ba
-
原人参二醇合成酶GydF4y2Ba
- 产后抑郁症:GydF4y2Ba
-
原人参二醇GydF4y2Ba
- PPT:GydF4y2Ba
-
ProtopanaxatriolGydF4y2Ba
- Prephytoene-pp:GydF4y2Ba
-
Prephytoene二磷酸GydF4y2Ba
- 分:GydF4y2Ba
-
protopanaxatriol合成酶GydF4y2Ba
- QRT-PCR:GydF4y2Ba
-
定量实时聚合酶链反应GydF4y2Ba
- SMO1:GydF4y2Ba
-
4、4-dimethyl-9beta 19-cyclopropylsterol-4alpha-methyl氧化酶GydF4y2Ba
- SMO2:GydF4y2Ba
-
4-alpha-methyl-delta7-sterol-4alpha-methyl氧化酶GydF4y2Ba
- SMT1:GydF4y2Ba
-
甾醇24-C-methyltransferaseGydF4y2Ba
- SMT2水平:GydF4y2Ba
-
24-methylenesterol C-methyltransferaseGydF4y2Ba
- SQLE:GydF4y2Ba
-
角鲨烯单氧酶GydF4y2Ba
- TOMT:GydF4y2Ba
-
生育酚O-甲基转移酶GydF4y2Ba
- TPS1:GydF4y2Ba
-
Valencene / 7-epi-alpha-selinene合酶GydF4y2Ba
- ubiE:GydF4y2Ba
-
Demethylmenaquinone甲基转移酶GydF4y2Ba
- VDE:GydF4y2Ba
-
黄质de-epoxidaseGydF4y2Ba
- VTE1:GydF4y2Ba
-
生育酚酸环化酶GydF4y2Ba
- VTE3:GydF4y2Ba
-
2-methyl-6-phytyl-1, 4-hydroquinone甲基转移酶GydF4y2Ba
- wrbA:GydF4y2Ba
-
NAD(P)H脱氢酶GydF4y2Ba
- ZDS:GydF4y2Ba
-
Zeta-carotene desaturaseGydF4y2Ba
- ZEP:GydF4y2Ba
-
Zeaxanthin环氧酶GydF4y2Ba
- βGydF4y2Ba-作为:GydF4y2Ba
-
β-氨纶合酶GydF4y2Ba
参考文献GydF4y2Ba
- 1。GydF4y2Ba
Yun tk。人参简介[J] .中国中医杂志2001;16:16-8。GydF4y2Ba
- 2。GydF4y2Ba
刘的ZQ。人参作为天然抗氧化剂资源的化学见解。化学启2012;112:3329-55。GydF4y2Ba
- 3.GydF4y2Ba
关键词:人参,人参皂苷,炎症反应,疾病人参人参精华2017;41:435-43。GydF4y2Ba
- 4.GydF4y2Ba
勇EC,勇SK, Myong JY, Wan GP, Jae SY, Seong RC,等。野山栽培人参根的生理化学特性。acta botanica botanica(云南植物研究). 2007;GydF4y2Ba
- 5。GydF4y2Ba
陈y,赵z,陈h,品牌e,yi t,qin m等。液相色谱 - 四极/飞行时间MS测定亚洲和美国人参中的吲哚糖苷:评估基于形态特征的变化。j ginseng res。2017; 41:10-22。GydF4y2Ba
- 6。GydF4y2Ba
Tholl D.植物萜类化生物合成和生物学功能。Adv Biochem Eng Biotechnol。2015; 148:63-106。GydF4y2Ba
- 7.GydF4y2Ba
水胁迫对鹰嘴豆生殖阶段的伤害:野生和栽培物种对脱落酸和多胺胁迫敏感性的评估。中国农业科学(英文版);2005;191:450-7GydF4y2Ba
- 8.GydF4y2Ba
李永强,李永强,李永强,等。野生和栽培番茄毛状体中萜类代谢的分化调控。植物杂志。2009;149:499 - 514。GydF4y2Ba
- 9.GydF4y2Ba
Garg A, Agrawal L, Misra RC, Sharma S, Ghosh S.穿心莲转录组为药用二萜的组织特异性积累提供了分子见解。BMC基因组学。2015;16:659。GydF4y2Ba
- 10.GydF4y2Ba
张晓霞,李超,王颖,姚强。龙胆转录组的重组和转录组特性研究。中华医学杂志。2015;16:11550-73。GydF4y2Ba
- 11.GydF4y2Ba
苏旭,李强,陈胜,董超,胡勇,尹林,等。的转录组分析GydF4y2BaIsodon得GydF4y2Ba和参与萜类生物合成的关键酶。Biotechnol Biotechnol装备。2016; 30:592-601。GydF4y2Ba
- 12.GydF4y2Ba
等。番茄茄和毛毛茄中倍半萜合成酶的RNA-seq发现、功能表征和比较。acta botanica sinica(云南植物学报),2011;37(6):733 - 736。GydF4y2Ba
- 13。GydF4y2Ba
Tao T,Zhao L,LV Y,Chen J,Hu Y,Zhang T等。种子萌发过程中Gossymium Autherale延迟腺体形态发生的转录组测序和差异基因表达分析。Plos一个。2013; 8:1-16。GydF4y2Ba
- 14。GydF4y2Ba
基于UHPLC-QTOF/MS/MS代谢组学方法的亚洲和美国人参化学鉴别与质量评价。Phytochem肛门。2015;26:145-60。GydF4y2Ba
- 15.GydF4y2Ba
徐晓峰,程晓丽,林庆华,李少森,贾志,韩涛,等。使用UPLC/oa-TOF MSE和多元统计样本分析策略鉴别山参和栽培人参。人参研究2016;40:344-50。GydF4y2Ba
- 16。GydF4y2Ba
Hemmerlin A,Harwood JL,Bach TJ。在植物异戊二烯生物合成的早期步骤中的两个不同途径的Raison d'être?Prog Lipid Res。2012; 51:95-148。GydF4y2Ba
- 17.GydF4y2Ba
Huchelmann A,Brahim MS,Gerber E,Tritsch D,Bach TJ,Hemmerlin A.法内酚介导的植物中蛋白酶戊烯化代谢起源的转变。生物chimie。2016; 127:95-102。GydF4y2Ba
- 18.GydF4y2Ba
法尼醇作为HMG-CoA还原酶降解的调节因子:法尼醇焦磷酸酶的特性和作用。生物化学学报1997;345:1-9。GydF4y2Ba
- 19.GydF4y2Ba
Kim MK, Lee B-S, In J-G, Sun H, Yoon J-H, Yang D-C。人参叶片表达序列标签(est)的比较分析。植物细胞代表2006;25:599-606。GydF4y2Ba
- 20.GydF4y2Ba
赵i - h, Lee S-H, Kim Y-C, Kim D-H, Kim H-S, Kim K-H,等。亚洲和西洋参根转录组组装和基因相关单核苷酸多态性标记的鉴定。基因组学。2015;290:1055-65。GydF4y2Ba
- 21.GydF4y2Ba
Lee YS, Park HS, Lee DK, Jayakodi M, Kim NH, Lee SC,等。5个人参品种不定根转录组和初级代谢产物的比较分析。人参精华2017;41:60-8。GydF4y2Ba
- 22.GydF4y2Ba
李世昌,李勇,朴h - s,金N-H,张伟,等。人参根转录组的综合分析。BMC Plant Biol. 2015;15:138。GydF4y2Ba
- 23.GydF4y2Ba
Sathiyamoorthy S, In JG, Gayathri S, Kim YJ, Yang DC。人参根表达序列标签(EST)的生成及基因本体分析。Mol Biol 2010; 37:3465-72。GydF4y2Ba
- 24.GydF4y2Ba
Zhen G,Zhang L,Du Yn,Yu RB,Liu XM,Cao Fr,等。从不同环境中的不同品种不同品种的根转录om Tego的组装和比较分析。不同环境中生长的迈耶。科学生中国生活SCI。2015; 58:1099-110。GydF4y2Ba
- 25.GydF4y2Ba
王克,姜,太阳,林y,尹r,王y等。人参的空间和时间转录组景观,Panax人参C. A. Meyer。SCI批准。2016; 5:18283。GydF4y2Ba
- 26.GydF4y2Ba
曹凤英,王志刚,王志刚。ABA在植物病原互作中的作用。植物学报2011;124:489-99。GydF4y2Ba
- 27.GydF4y2Ba
赵毅赫,李海杰,金泳三。人参属植物挥发性成分的差异。中国农业科学。2012;60:7616-22。GydF4y2Ba
- 28.GydF4y2Ba
Lianopoulou V,Bosabalidis Am,Patakas A,Lazari D,Panteris E.冷却胁迫对季节性二晶植物Teucrium polium(LamiCeae)的叶形形态,解剖学,超微结构,气体交换和精油的影响。acta physiol植物。2014; 36:2271-81。GydF4y2Ba
- 29。GydF4y2Ba
Swain S, Myers ZA, Siriwardana CL, Holt BF。核因子- y在拟南芥发育和胁迫反应中的多方面作用。生物物理学报。2017;186:636 - 44。GydF4y2Bahttps://doi.org/10.1016/j.bbagrm.2016.10.012GydF4y2Ba.GydF4y2Ba
- 30。GydF4y2Ba
彭旭,吴强,滕磊,唐芳,皮正,沈树生。低温胁迫对桑树转录的影响。中国生物医学工程学报。2015;15(1):-14。GydF4y2Bahttps://doi.org/10.1186/s12870-015-0489-2GydF4y2Ba.GydF4y2Ba
- 31。GydF4y2Ba
Sharma P,Lin T,Grandellis C,Yu M,Hannapel DJ。皮卡拉氏菌属的转录因子系列。J Exp Bot。2014; 65:709-23。GydF4y2Ba
- 32。GydF4y2Ba
龚XX,yan by,hu j,阳cp,李yj,liu jp等。橡胶树(HEVEA BRASILIENSIS)的转录组谱析出了冷应激反应的候选稳压器。基因和基因组学。2018; 40:1181-97。GydF4y2Bahttps://doi.org/10.1007/s13258-018-0681-5GydF4y2Ba.GydF4y2Ba
- 33.GydF4y2Ba
陶艳,陈敏,舒艳,朱艳,王胜,黄磊,等。大豆BEL1-LIKE同源盒转录因子GmBLH4的鉴定及功能分析。植物细胞组织器官邪教。2018;134:331-44。GydF4y2Bahttps://doi.org/10.1007/s11240-018-1419-4GydF4y2Ba.GydF4y2Ba
- 34.GydF4y2Ba
王刚,曾辉,胡昕,朱艳,陈勇,沈超,等。大豆钙调素结合转录激活因子基因的鉴定与表达分析。土壤植物。2014;386:205-21。GydF4y2Ba
- 35.GydF4y2Ba
赵敏,孙旭,王超,等。草莓(Fragaria × ananassa)钙调素结合转录因子的特性植物基因组。2015;8。GydF4y2Bahttps://doi.org/10.3835/plantgenome214.08.0039.GydF4y2Ba.GydF4y2Ba
- 36。GydF4y2Ba
Tanimoto E.由植物激素作用对植物素和赤霉素的根源调节。CRC Crit Rev植物SCI。2005; 24:249-65。GydF4y2Ba
- 37。GydF4y2Ba
Schaeffer A,Bronner R,Benveniste P,Schaller H.甾醇对拟南芥生长的比例由甾醇甲基转移酶2控制;一世。工厂J. 2001; 25:605-15。GydF4y2Ba
- 38。GydF4y2Ba
他j x。甾醇调节拟南芥的发育和基因表达。植物杂志。2003;131:1258 - 69。GydF4y2Bahttps://doi.org/10.1104/pp.014605GydF4y2Ba.GydF4y2Ba
- 39。GydF4y2Ba
高艳,何旭,吴斌,龙强,邵涛,王志,等。通过RNA-seq转录组分析,揭示了人参抗药基因。《公共科学图书馆•综合》。2016;11:1-18。GydF4y2Ba
- 40。GydF4y2Ba
Cao H,Nuruzzaman M,Xiu H,Huang J,Wu K,Chen X等。茉莉甲酸甲基甲基人参芳纶偶像根的转录组分析发现推定的人参皂苷生物合成和运输基因。int j mol sci。2015年。GydF4y2Ba
- 41。GydF4y2Ba
刘y,mi y,张俊,李q,陈L. illumina的转录组分析Panax Notoginseng响应砷胁迫。机器人螺柱。2016; 57。GydF4y2Ba
- 42。GydF4y2Ba
Lee J,Mudge Kw。水缺陷会影响植物和土壤水分状况,植物生长和美国人参的人参皂苷含量。Hortic Environ Biotechnol。2013; 54:475-83。GydF4y2Ba
- 43.GydF4y2Ba
江米,刘杰,泉X,吴氏,吴S.不同的冷却胁迫刺激了Panax人参细胞不同类型人参皂苷的积累。acta physiol植物。2016; 38:210。GydF4y2Bahttps://doi.org/10.1007/s11738-016-2210-yGydF4y2Ba.GydF4y2Ba
- 44.GydF4y2Ba
张伟等。人参基因组数据库:人参基因组学的开放获取平台。BMC Plant Biol. 2018; 18:1-7。GydF4y2Ba
- 45.GydF4y2Ba
HISAT:低内存要求的快速拼接对准器。Nat方法。2015;12:357-60。GydF4y2Ba
- 46.GydF4y2Ba
王敏,卢姝。人参基因表达定量分析中适宜内参基因的验证。1月6日;GydF4y2Ba
- 47.GydF4y2Ba
Livak KJ,Schmittgen TD。使用实时定量PCR和2-ΔΔCT方法分析相对基因表达数据。方法。2001; 25:402-8。GydF4y2Ba
- 48.GydF4y2Ba
王平,张彦波,杨晓伟,赵迪强,王艳萍。UPLC-DAD-QTOF-MS/MS快速测定人参根和根茎中人参皂苷的含量,HPLC-ESI-MS同时测定19种人参皂苷含量。人参研究2016;40:382-94。GydF4y2Ba
确认GydF4y2Ba
不适用。GydF4y2Ba
资金GydF4y2Ba
所有作品都得到了中国林业研究专项资助的支持(No. 201404718)。这些融资机构在实验设计,分析和解释中没有作用,以及稿件的准备。GydF4y2Ba
数据和材料的可用性GydF4y2Ba
本研究中产生或分析的数据包括在本发表的文章及其补充信息文件中。Illumina rna测序原始reads可从NCBI Sequence Read Archive数据库(GydF4y2Bahttp://www.ncbi.nlm.nih.gov/sra/GydF4y2Ba),加入号为PRJNA419783。GydF4y2Ba
作者信息GydF4y2Ba
从属关系GydF4y2Ba
贡献GydF4y2Ba
HF和YJL设计的实验;HF,KL,FY和LWS进行实验;YJL和HF写了稿件。YJL将在裁判和出版物的所有阶段处理对应,也发布发布。所有作者都已经阅读并赞成最终的手稿。GydF4y2Ba
相应的作者GydF4y2Ba
伦理宣言GydF4y2Ba
伦理批准和同意参与GydF4y2Ba
不适用。GydF4y2Ba
同意出版物GydF4y2Ba
不适用。GydF4y2Ba
利益争夺GydF4y2Ba
两位作者宣称他们没有相互竞争的利益。GydF4y2Ba
出版商的注意事项GydF4y2Ba
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。GydF4y2Ba
附加文件GydF4y2Ba
额外的文件1GydF4y2Ba
表S3。GydF4y2Ba测序质量控制。(DocX 14 KB)GydF4y2Ba
额外的文件2GydF4y2Ba
表S4。GydF4y2Ba映射到参考基因组的干净读取的分布。(多克斯13 kb)GydF4y2Ba
额外的文件3GydF4y2Ba
表S5。GydF4y2BaGC-MS暂定鉴定萜类化萜类化合物。(docx 17 kb)GydF4y2Ba
额外的文件4GydF4y2Ba
图S2。GydF4y2BaGC-MS全离子色谱法的MCG和FCG根。(TIF 31295 KB)GydF4y2Ba
额外的文件5GydF4y2Ba
表S6。GydF4y2BaTF家族注释转录因子的分布。(XLS 31 KB)GydF4y2Ba
额外的文件6GydF4y2Ba
表S7。GydF4y2Ba山地栽培人参的形态学特征。(DOCX 16 KB)GydF4y2Ba
额外的文件7GydF4y2Ba
表S1。GydF4y2Ba宽甸县月平均气温和降雨量。(多克斯15 kb)GydF4y2Ba
额外的文件8GydF4y2Ba
表S2。GydF4y2Ba萜类生物合成中9个关键基因的引物进行qPCR。(DocX 14 KB)GydF4y2Ba
额外的文件9GydF4y2Ba
图S1。GydF4y2Ba11种人参皂苷标准品的HPLC图谱。(JPG 91 kb)GydF4y2Ba
权利和权限GydF4y2Ba
开放访问GydF4y2Ba本文根据创意公约署署署的条款分发了4.0国际许可证(GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)除非另有说明,否则适用于本文中提供的数据。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
范海龙,李凯,姚飞。GydF4y2Baet al。GydF4y2Ba比较转录组分析现场和山地栽培人参根萜类代谢。GydF4y2BaBMC植物BIOL.GydF4y2Ba19,GydF4y2Ba82(2019)。https://doi.org/10.1186/s12870-019-1682-5GydF4y2Ba
已收到GydF4y2Ba:GydF4y2Ba
公认GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
迪伊GydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-019-1682-5GydF4y2Ba
关键字GydF4y2Ba
- Field-cultivated人参GydF4y2Ba
- Mountain-cultivated人参GydF4y2Ba
- 转录组分析GydF4y2Ba
- terpenoids生物合成基因GydF4y2Ba
- 人参皂苷GydF4y2Ba
- 萜类化合物激素GydF4y2Ba