摘要
背景
土壤传播的血管病原体黄萎病dahliae在许多植物中引起严重的枯萎病症状,包括草莓(Fragaria × ananassa)。增强我们对的影响的认识诉dahliae的成长与发展F. × ananassa,21的表达模式PR-10采用qPCR检测基因,LC-MS检测代谢物变化F. × ananassa植物受病原体感染。
结果
21种亚型的表达模式显示出广泛的反应范围。四个PR-10病原菌侵染后,叶片中基因高度诱导,根中有8个基因显著上调。在叶片和根中检测到同时诱导的表达PR-10基因。有趣的是,感染后在所有三个组织(叶、根和茎)中都表达了两种亚型,而其他两种成员未检测到诱导。抗真菌的儿茶素和表儿茶素在病原菌侵染的根和茎中积累,而咖啡酸和柠檬酸仅在侵染的根中积累。感染叶和茎的早期诱导产生脱落酸、水杨酸、茉莉酸(JA)、赤霉素酸和吲哚乙酸(IAA)。IAA和JA是晚期感染根中唯一确定的激素。
结论
几种归纳PR-10草莓植株侵染的基因诉dahliae建议扮演一个角色PR-10防御系统中的基因会对这种病原体做出反应。在感染的早期阶段产生的植物激素和在感染后期产生的抗真菌代谢产物被认为与这种反应有关。本研究结果为进一步完善该病原菌的防治措施提供了依据。
背景
该属的植物致病真菌轮枝菌属每年对全球农作物造成数十亿美元的损失[1].目前归入该属的十个种中研究最多的种轮枝菌属严格意义是黄萎病dahliae因为它造成了世界上许多地区农作物的巨大经济损失[2,3.,4].一种极易受到由土壤传播的致病真菌引起的严重疾病影响的植物种类诉dahliae是栽培的草莓(Fragaria × ananassa)工厂。诉dahliae最早描述自Dahlia sp. cv。盖泽尔氏菌作为一种病原体对存活的概率影响最大轮枝菌属枯萎菌对作物的产量大大降低和控制轮枝菌属威尔特很难对付,代价也很高[5,6,7].在没有合适的植物寄主的情况下,诉dahliae通过黑色的休眠结构(微菌核)在土壤中休眠数年,只在合适的寄主附近萌发[8].
植物病原真菌的生命周期包括三个营养阶段:休眠、寄生和腐生。在休眠期,富含氮和碳的根系渗出[9刺激微菌核的萌发,微菌核是一种持久的多细胞结构。这些结构使轮枝菌属孢子侵染易感植物,进入其寄生期。感染发生在侧根形成的部位或根尖[10].植物病原真菌渗入维管柱后开始形成分生孢子,分生孢子在木质部系统中传播[11,12].植物变得越来越殖民化,开始枯萎并发展成典型的坏死症状。真菌进入有限的腐生生长阶段,形成微菌核。微菌核释放到土壤中后可存活10-15年[8].单环病原体等诉dahliae每个生长季节只需经历一轮疾病和接种生产,在随后年份无需重复此循环[1,13].
植物对生物和非生物胁迫都有反应。发病相关(PR)蛋白,包括家族10蛋白(PR-10),在生物和非生物胁迫下被诱导,因此参与植物防御[14].pr蛋白在许多植物物种中表达,例如在真菌感染诱导抗性期间。在棉花中,PR-10的早期表达结合植物抗毒素的产生有助于轮枝菌属抗枯萎病能力[15].PR-10蛋白由多基因家族编码,在不同器官中构成性表达。这个蛋白质家族有许多功能[16].
尽管有几项研究和调查,但PR-10成员的具体作用仍不清楚。本工作旨在研究草莓离体植株与黄萎病之间的分子相互作用诉dahliae为了获得草莓对病原菌防御反应的分子证据,进行诱导鉴定PR-10对草莓病原菌感染的基因及激素反应的研究。目前研究的目的是为了有助于理解的功能PR-10亚型。
结果
疾病严重程度和真菌繁殖的视觉评估
F. × ananassa的E650分离物人工接种离体植株诉dahliae(附加文件1).在所有采样时间点,根据[17].该比例是根据患病叶面积的百分比确定的。疾病症状逐渐发展,并在20天后变得明显轮枝菌属接种。第2级(症状叶面积的10-25%)适用于感染后20 dpi的植物,第5级(症状叶面积的75-100%)适用于感染后30 dpi的植物。对于对照组和受感染的植物,在前20天内没有观察到任何症状,因此划分为0级(图2)。1).对冻干组织进行甲醇萃取后的颜色修饰,对样品进行评估(图2)。1).的比较轮枝菌属侵染根和对照在第1天的颜色为淡黄色,在30 dpi时,侵染根的颜色逐渐变为浅棕色,对照的颜色逐渐变为黄褐色。同样,在受感染的茎中,在1 dpi(荧光绿色)到30 dpi(荧光黄绿色)之间可见颜色变化,但在对照组织中没有,而在受感染的叶片中,唯一的颜色变化发生在20 dpi(深绿色)和30 dpi(浅绿色)之间(图2)。1).对照叶的颜色没有变化。
引物设计验证
BLAST分析发现21人PR-10基因组序列中的基因f . vesca([18];额外的文件2).因为21之间的序列相似性很高PR-10使用5 ' UTR和3 ' UTR区域设计了定量聚合链式反应(qPCR)的特异性引物(附加文件)3.).qPCR分析公关- 10.01 - 03使用所述的特定引物对进行[19].对于所有其他PR-10基因特异性引物使用5 ' UTR设计,除了公关- 10.09,公关- 10.14,PR-10-17而且公关- 10.20.为了在qPCR中高效扩增,本研究使用的引物产生的扩增子大小小于200 bp。的反底漆除外公关- 10.05,剩下的长度都是19个bpPR-10引物大小在20 ~ 27 bp之间。GC含量从32 ~ 65%不等。此外,除了底漆公关- 10.16,其熔融温度(Tm)为56°C, Tm为其余引物PR-10异构体在59°C到64°C之间。所设计引物的基因特异性通过BLAST (Basic Local Alignment Search Tool)分析21个引物的正向和反向序列来确认PR-10亚型。每个引物只与目标基因的序列完美匹配。尽管引物是设计在PR-10序列从f . vesca,它们也产生了各自的扩增子F. × ananassa。转录本分析后记录的熔解曲线显示单个明显的峰,表明所有的特异性较高PR-10亚型。
实时荧光定量PCR分析21PR-10基因对轮枝菌属感染
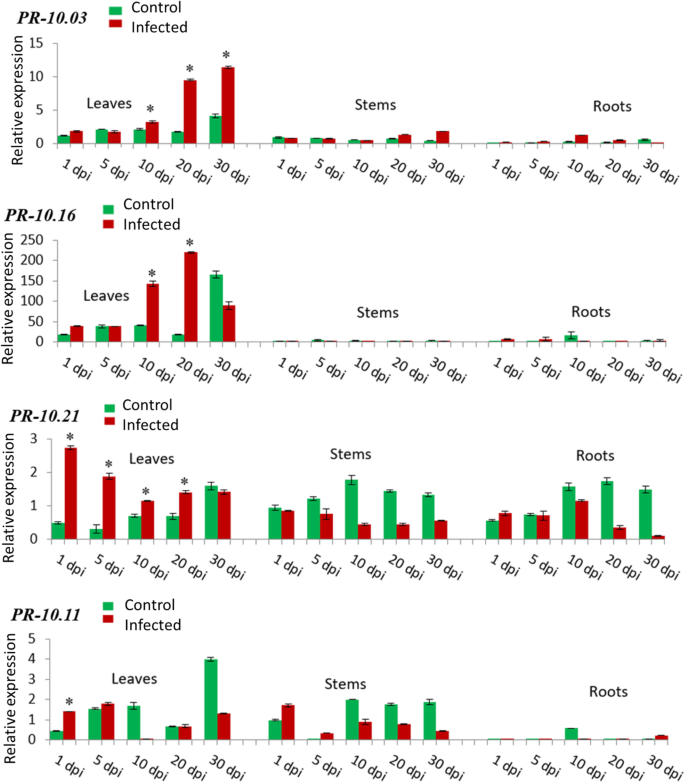
目的:观察病原菌感染对基因表达的影响PR-10基因,在离体培养的草莓植株中感染诉dahliae.在感染后(dpi)的规定时间间隔内采集样本。未受感染的植物作为对照。数值计算为每个样本相对于参考基因的倍数变化(FaRIB413).每个转录本(相对值)的折叠变化轮枝菌属计算并表示每种病毒的感染情况Fra 1基因。21的表达模式PR-10侵染后草莓植株不同组织(叶、茎、根)中的异构体诉dahliae表现出了广泛的反应。公关- 10.03(在30 dpi时相对表达量为11.4倍)和公关- 10.16(219.9倍的rel. exp,在20 dpi)在病原体感染后显著上调(图;2).这种诱导随着时间的推移而增加,并在感染20至30天后达到最大值。为公关- 10.21(1 dpi时的相对危险度为2.7倍),在感染1天后,叶片的诱导水平达到最高,随后稳定下降,直到第10天。为公关- 10.11在接种后第1天,叶片中也有显著的表达诱导(图2)。2).
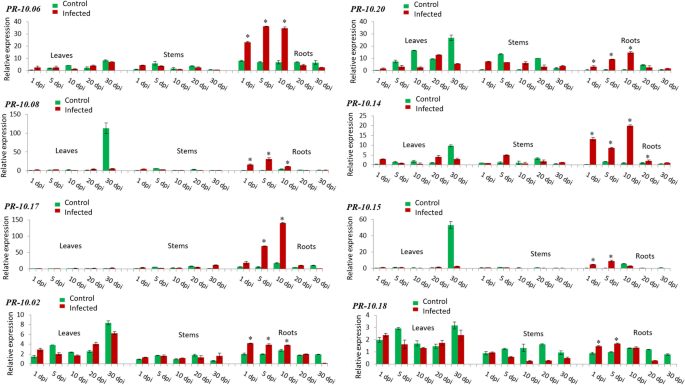
公关- 10.06,公关- 10.08而且公关- 10.17病原菌侵染后在根中大量表达(图;3.).有高达36.1倍的相对转录水平公关- 10.06, 31.3倍rel. exp公关- 10.08,为140倍可靠系数公关- 10.17在10 dpi。诱导在第5天更相关公关- 10.06而且公关- 10.08在第10天公关- 10.17。有趣的是,在根中也观察到快速而显著的上调公关- 10.02(4.2倍rel. Exp.)在1 dpi时,随着时间的推移略有下降。同样的,公关- 10.20(14.8倍rel. exp10 dpi)和公关- 10.14在10 dpi时,根茎高度诱导(19.8倍rel. exp),但最大峰值出现在第10 d。的表达模式公关- 10.15(9.0倍rel. expat 5 dpi)和公关- 10.18(1.7倍在5 dpi时的rel. exp)在根中相似,从第1天到第5天增加,然后下降到第30天(图2)。3.).
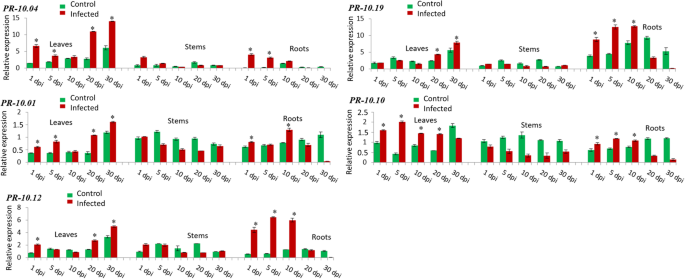
此外,公关- 10.04,公关- 10.01,公关公关- 10.12——10.19而且公关- 10.10叶和根同时强烈诱导(图;4).对于前3个基因,在20 dpi后的叶片中诱导更相关。在30 dpi时,有高达14.0倍的rel. exp公关- 10.04, 1.6倍rel. exp30 dpi公关- 10.01和5.0倍rel. exp也在30 dpi公关- 10.12在树叶。在根中,在第1天检测到一个上调公关- 10.04(4.1倍rel. Exp.)随后下降至第30天,而在感染根中观察到10天后强烈的表达诱导公关- 10.01(1.3倍寿命),5天公关- 10.12(6.4倍rel. Exp)。为公关- 10.19在叶片中,即接种后第20天(4.3倍危险期)和第30天(7.9倍危险期)均有较高的表达量,而在根系中,直到第10天(12.7倍危险期)均有渐进式的诱导,随后从第20天(3.4倍危险期)开始出现严重下降。公关- 10.10叶片在侵染前5天也有显著的上调(2倍rel. Exp.),但随着时间的推移,这种上调逐渐减弱。在根中,该基因从第1天(0.9倍rel. Exp.)开始诱导,直到第10天(1.0倍rel. Exp.),然后在第30天急剧下降(0.1倍rel. Exp.)(图2)。4).
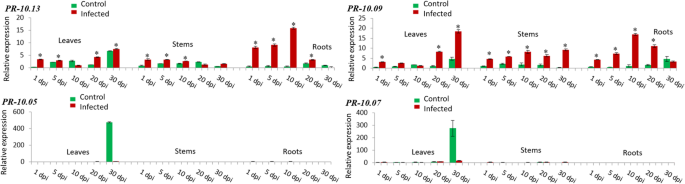
有趣的是,的表达公关- 10.13而且公关- 10.09同时在所有三个组织中诱导(图;5).在叶片中,这两种基因的表达模式非常相似。在接种后10 d内,其增殖速率逐渐下降,到接种第30 d时,其增殖速率又逐渐增加(约为接种后的7.5倍)公关- 10.1318.4倍rel. exp公关- 10.09).此外,这两种基因在根中诱导相同。直到感染第10天,均呈逐渐升高的趋势(相对比为15.8倍)公关- 10.1317倍可靠系数公关- 10.09),然后逐渐减少表达,直到第30天(0.2倍rel. Exp. for公关- 10.13为3.3倍可靠系数公关- 10.09).此外,公关- 10.13而且公关- 10.09是唯一两个在茎中诱导的基因。基因表达的稳定下降被检测到公关- 10.13从第1天(3.3倍实际试验)开始,一直到第30天公关- 10.09有两个表达峰,一个在第10天(8.2倍rel. Exp),另一个在第30天(9.2倍rel. Exp)。5).有趣的是,在感染组织中未检测到基因表达的诱导公关- 10.05而且公关- 10.07(无花果。5).
总之,在研究中观察到21种亚型的转录水平存在巨大差异F.×ananassa器官(叶、茎和根)。qPCR分析显示19种亚型在感染后明显上调轮枝菌属感染和不同的表达模式取决于分析的草莓组织。叶片(接种后20 ~ 30天)和根系(接种后10天)诱导水平最高。(额外的文件4).
液相色谱-质谱(LC-MS)分析
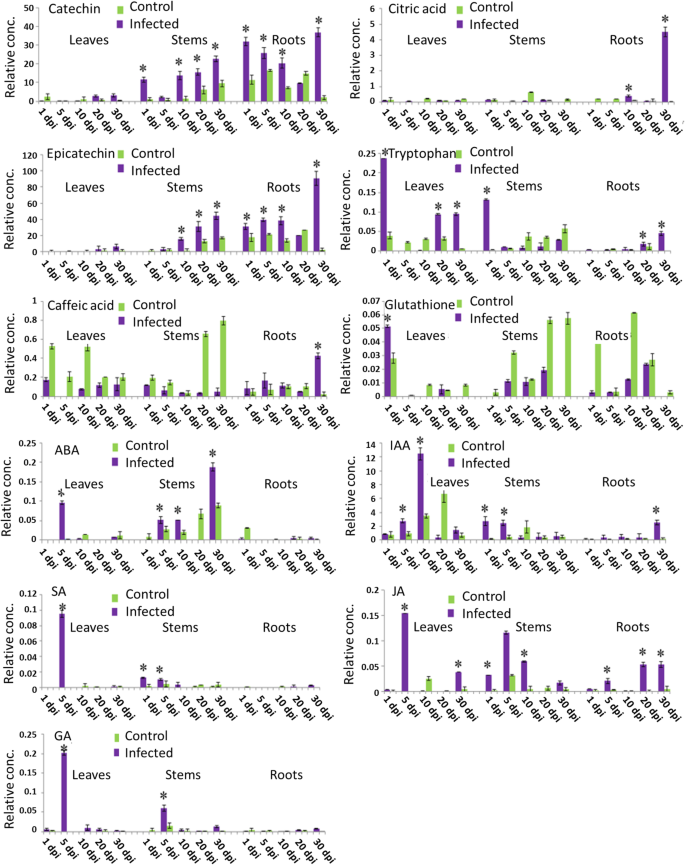
为了测试植物代谢产物是否参与防御反应轮枝菌属用LC-MS分析了用于qPCR的组织(图2)。6).随着时间的推移,儿茶素和表儿茶素等代谢物在受感染组织的茎和根中积累,大大超过对照植物的水平。30 dpi时,受感染的根中主要含有咖啡酸和柠檬酸。色氨酸在染病1 dpi和染病后期(20-30 dpi)分别在染病叶和茎中观察到。还原型谷胱甘肽(GSH)主要在对照茎和根中检测到,在感染叶中检测到1dpi。此外,还研究了一些植物激素对草莓防御的影响。LC-MS鉴定出5种植物激素。脱落酸(ABA)、水杨酸(SA)、茉莉酸(JA)和赤霉素酸(GA)在感染叶片5 dpi和10 dpi的吲哚-3-乙酸(IAA)中积累。在不同的时间点,SA、IAA和GA接种后5 dpi, JA接种后10 d,在感染茎中检测到5种激素。同样,ABA在感染茎的前10天被鉴定,在30 dpi达到峰值。 IAA and JA were the unique hormones to be discerned in infected roots at tardy stages (20 and 30 dpi) (Fig.6).
讨论
PR-10基因表达
本研究清楚地证明了各种表达PR-10基因是由轮枝菌属草莓植株的体外感染。公关- 10.03,公关公关- 10.11——10.16而且公关- 10.21在叶片中有显著的诱导作用(图;2).叶片20 ~ 30 dpi的基因表达量最高公关- 10.03而且公关- 10.16从1到5 dpi公关- 10.21而且公关- 10.11.侵染油菜叶片的异体蛋白质组分析诉longisporum揭示了PR-2 (β-1,3-葡聚糖酶)、PR-3(几丁质酶)和PR-4(几丁质酶)的上调[20.].在生菜中诉dahliae,PR-3而且PR-5(类thaumatin)基因仅在感染后3周收获的有症状叶中表达[21].因此,感染轮枝菌属导致叶片中多个PR基因的上调,包括PR-2,PR-3,PR-4[20.),PR-5[21),而PR-10(本研究)。
转录的Pr-10.02, pr-10.06, pr-10.08,Pr-10.14, pr-10.15, pr-10.17, pr-10.18而且公关- 10.20在根上强烈诱导轮枝菌属感染。值得注意的是,公关- 10.17只转录在21PR-10亚型(无花果。3.).上调主要出现在接种后10 d。尽管植物根系与多种土壤微生物密切接触,但它们之间的相互作用研究仍然很少[22,23].最近,拟南芥被用作主机模型的诉dahliae[24,25),诉longisporum[26],分析根与维管病原体的相互作用。在答:芥根感染诉longisporum,参与产生色氨酸衍生次级代谢产物的基因在8 dpi时的转录水平最高[27].同样,在我们的研究中,根中的表达峰值在10 dpi左右,这表明真菌正在随着时间的推移而扩散,直到在30 dpi时达到表达下降。这种下降可能是由于植物抗性反应,随后在30 dpi左右消除了真菌。受感染的植物的木质部导管中形成的果胶凝胶尖孢镰刀菌被认为是一种有效的防御系统,因为病原体在茎叶上部的定植被阻断。病原体停留在受感染的根部,不能扩散[28].因此,根据这项研究和所有引用的结果,根中某些PR-10蛋白的高水平可能是这种最受环境胁迫的植物器官的构成防御机制的一部分。
有趣的是,公关- 10.01,公关- 10.04,公关公关- 10.10——10.12而且公关- 10.19在根系(早期)和叶片(晚期)均有显著表达,因此与侵染的时间进程相关(图2)。4).这一发现也符合的归纳PR-10c在桦树的叶子和根中对氧化应激的反应[29].总体而言,上述17种蛋白的表达水平PR-10基因显示,叶和根在执行短暂防御反应方面有很大差异。
观察到一个惊人的表情公关- 10.13而且公关- 10.09,这三个组织(叶、根和茎)同时被诱导(图。5).一些研究表明,轮枝菌属物种进入根的木质部血管,在2至5 dpi后开始产孢,几天后在茎血管上定植[11,30.].在轮枝菌属-感染的啤酒花茎[31],真菌生物量随转录水平的增加而增加公关- 10.09在词干中同时表达公关- 10.13稳定下降直到30 dpi。也在番茄的茎中(茄属植物lycopersicum感染的诉dahliae,表达模式为二公关基因Ve1而且Ve2编码细胞外富含亮氨酸的重复受体样蛋白类抗病性蛋白的细胞表面受体蛋白表明,这两个基因在易感等值线中均表现出较高的转录水平10-12 dpi [32].在黄萎病-受感染的番茄,与寄主配伍(易感性)或不配伍(抗性)轮枝菌属似乎是由茎决定的[33,34].此外,在轮枝菌属在该组织定植中,真菌消除占主导地位,因为抗性品种植物能够更快地激活防御反应[30.,35]而在易感品种中,病原体逃脱了这种消除,并在植物的维管系统内传播[11,36].
在草莓中,抗性和耐受性都能增强不同基因型的整体性能诉dahliae但是在一个季节的过程中,耐受性可能不太稳定[37].与保护植物免受病原体攻击的植物抗病性相反,植物抗病性是一种特殊现象,包括与症状发展相关的基因下调[38].加州大学育种项目评估的41个草莓基因型中,大多数被确定为高度易感诉dahliae然而,十一草莓(F. × ananassa)基因型被指定为抗轮枝菌属威尔(37,39].草莓对多种病原体的抗性已被培育成商业品种,作为一种多基因性状,据报道可定量遗传[40].尽管有高浓度的诉dahliae接种可以降低全身感染的发生率,并减少病原体进入木质部后症状的表达。角色公关-基因诉dahliae耐药基因型尚未得到很好的研究。
在先工作,后工作轮枝菌属接种,对叶面症状的直观评估F. × ananassa进行了体外培养。用于疾病视觉评估的尺度是基于症状叶面积的百分比。草莓植株在前20 dpi(0级)期间似乎是“健康的”,因为没有观察到明显的叶片萎蔫症状。在20 dpi时,草莓叶片症状的扩散开始于2级,相当于症状叶面积的10 - 25%,仅在10天后,真菌就能够在几乎全部(75-100%)的叶表面定植,产生坏死的叶片,这些叶片有时发育不良。疾病严重程度超过36 dpi时相当严重,因为离体植物完全褪色,导致枯萎和植物死亡,这解释了为什么用于基因表达分析的植物材料在这个时间点后不能更多地恢复。同样,反应引起的感染诉dahliae在两个微繁殖F. × ananassa栽培品种在15 dpi后才变得明显,与我们的结果不同的是,在75 dpi时,' Filon '和' Teresa '的亚无性系获得了最高的完全褪绿微植物百分比[41].虽然我们的研究结果清楚地表明,在入侵的叶,根和茎的转录反应的启动轮枝菌属真菌占十九PR-10的基因,公关- 10.05而且公关- 10.07似乎逃脱了真菌的定植,因为在任何组织中都没有检测到两种基因的诱导。
研究防御基因表达需要采用合适的宿主-病原体模型系统和相应的培养条件。在草莓方面,许多研究人员应用体外筛选系统来获得对草莓抗性或耐受性的植株丝核菌fragariae而且葡萄孢菌[42),炭疽菌acutatum[43),尖孢镰刀菌[44),马铃薯疫霉,P. fragariae[45),诉dahliae[46].这项工作中使用的离体选择技术是一种有用的工具,可用于鉴定植物对病原体、低温和盐毒性等植物毒素产生的胁迫的抗性或耐受性[47].草莓品种和育种系对侵染的易感性研究诉dahliae在体外条件下,它们对感染的反应与在野外条件下相似[48].
组织LC-UV-ESI-MS分析
次生代谢产物
黄烷-3-醇如儿茶素和表儿茶素在感染的茎和根中积累,特别是在真菌感染后的晚期诉dahliae(无花果。6).这一结果表明,儿茶素和表儿茶素的产量增加轮枝菌属接种运动对抑制真菌感染有保护作用。(+)-儿茶素在草莓叶中已经存在,抑制链格孢属交替草莓叶片对这种真菌的抗性反应诱导了(+)-儿茶素的积累[49].儿茶素原花青素的积累是抑制其生长的基础葡萄孢菌在未成熟的草莓中[50].此外,黄斑矢车菊或斑矢车菊,(±)-儿茶素已被报道从其根部释放[51]显示出对土壤微生物活性的抑制作用[52].同样,Veluri等人。[53]报道了(+)-儿茶素对一些土壤菌株的抗菌和抗真菌作用(campestris黄单胞菌,农杆菌,Erwinia carotovora,而且欧文氏菌amylovora).儿茶素的(−)-对映体在某些土壤微生物分离株上没有检测到(+)-儿茶素的这种活性,而儿茶素的(−)-对映体被揭示为具有植物毒性[54].此外,有报道称表儿茶素能抑制脂氧合酶刺盘孢属、炭疽,使牛油果成熟过程中形成的抗真菌二烯(1-乙酰氧基-2-羟基-4-氧-heneicosa- 12,15 -二烯)失活[55].黄烷-3-醇在未成熟果实中高浓度存在,也可能通过抑制果胶酸裂解酶活性参与了鳄梨果实的抗性c、[56].黄烷-3-醇儿茶素和表儿茶素的抗氧化和自由基清除活性也超过了抗坏血酸、α-生育酚和其他酚类物质[57].
与咖啡酸含量相反,番茄根部咖啡酸含量显著降低丛枝菌根殖民(58,咖啡因酸的水平被诱导F. × ananassa在本研究中,感染根在30 dpi后尤其明显。咖啡酸在植物防御反应中起作用,在体外对多种真菌表现出很强的抗菌活性,包括诉dahliae.研究表明,这种抗氧化化合物在轮枝菌属-受感染的棉花[59]而在马铃薯的根和茎中也有不同的积累[60].在辣椒根中,真菌尖孢镰刀菌刺激咖啡酸的生物合成,启动绿原酸的生物合成[61].
同样,在感染根的后期(30 dpi)诱导柠檬酸的积累,支持这种酸影响植物宿主的生长和健康的假设。柑桔根系分泌柠檬酸增强黄瓜枯萎菌在这一过程中,柠檬酸起到了趋化剂的作用[62].番茄、黄瓜和甜椒的根分泌物中有机酸(柠檬酸)的总含量高于碳水化合物[63].根瘤菌菌群在施用生防菌株后会影响根系分泌物的组成荧光假单胞菌对番茄根造成琥珀酸水平降低,而柠檬酸浓度增加[64].
在本研究中,受感染组织中另一种草莓植物成分色氨酸的水平在叶片和茎中超过了1 dpi,在根中超过了20-30 dpi。草莓植物似乎已经进化出各种抵御生物胁迫的防御机制,包括产生初级和次级代谢产物,这些代谢产物起着防御化合物的作用。的叶子F. × ananassa用角斑菌接种,黄fragariae,产生大量色氨酸,色氨酸是芳香次级代谢产物的前体[65].色氨酸通路在机体对致病性感染的防御反应中也起着重要作用拟南芥根(27]以及大米[66].
在这项工作中,仅在真菌感染后1 dpi的感染叶片中观察到谷胱甘肽的还原形式的积累,显示出对真菌感染的快速反应轮枝菌属感染。谷胱甘肽可能在植物细胞对物理和生物应激的反应中发挥作用。谷胱甘肽是一种主要的细胞抗氧化剂,谷胱甘肽的代谢和水平都会影响细胞防御[67].在大多数植物组织中,谷胱甘肽主要以其还原形式(GSH)存在,但也可以检测到氧化二硫化物形式的谷胱甘肽(GSSG)。谷胱甘肽及其同源物被认为是植物细胞中必不可少的成分,通过硫醇-二硫化物氧化还原反应参与活性氧(ROS)的消除,并通过偶联反应参与各种异种生物的解毒[68,69].谷胱甘肽参与对真菌攻击后迅速积累的氧化应激和非生物应激的响应[70].谷胱甘肽参与抗氧化防御反应和解毒似乎是谷胱甘肽在植物组织中的主要作用,或通过直接与活性氧反应,或通过抗坏血酸-谷胱甘肽循环[70].此外,GSH和GSSG在大豆细胞悬浮培养中均能引起植物抗毒素反应,但在苜蓿中无作用[71].真菌病原体感染燕麦叶片谷胱甘肽含量下降Drechslera接种后约2天表明发病早期对活性氧解毒的需求增加[72].同样,除了在感染叶片中1 dpi的谷胱甘肽水平较高外,与对照相比,本研究在感染组织中检测到的谷胱甘肽水平较低。由此得出结论,受感染的叶片组织抗氧化应激和修复损伤的能力下降。在携带Cf基因的番茄叶片中,谷胱甘肽水平的变化也被量化-2或Cf9具有对真菌病原体的抗性枝孢属fulvum[73].诱导子注入叶片2 ~ 8小时后,总谷胱甘肽水平增加,87%的积累归因于GSSG形式。在不同的燕麦品系中也观察到叶片谷胱甘肽水平显著增加(燕麦属漂白亚麻纤维卷)感染后24小时B. graminis f. sp.燕麦[74]和抗性烟草(烟草。Xanthi-nc)感染烟草花叶病毒(TMV)的植物[75].
激素
ABA、SA、GA、IAA和JA等植物激素是植物胁迫响应过程中的主要信号分子,其水平在近年来已被研究轮枝菌属受感染的F. × ananassa试管植物。植物防御的一个关键步骤是感知压力,以便以快速有效的方式做出反应。感知非生物和生物应激条件启动信号级联,打开或关闭离子通道,激活或灭活激酶,产生活性氧(ROS),并导致植物激素的产生。
在本研究中,感染组织中ABA浓度在接种后5 dpi时超过对照,在接种后30 dpi时达到峰值,表明ABA在防御反应中起关键作用。这些结果表明,ABA信号通路是控制系统定植的候选诉dahliae在草莓。ABA在病原菌感染过程中起着突出的作用[76,77],或只参与感知环境压力,特别是渗透压力[78].过程中,甜菜叶片中ABA浓度增加尾孢属beticola在定植3至9 dpi时,检测到真菌感染和ABA浓度升高[79].ABA在抗病性中的作用是有争议的,因为它取决于许多因素,如攻击病原体的类型,它进入宿主的点和方式,防御反应的时间,以及被病原体攻击的植物组织。因此,ABA具有多种作用,取决于环境条件,其在植物病原体相互作用中的确切作用仍然存在争议。
植物产生的另一种主要激素是赤霉素(GA),也被认为主要参与非生物胁迫[80].在19世纪,GA被认为是水稻种子感染真菌病原体过度生长的原因藤仓赤霉在日本,直到最近才被认为与植物对病原体攻击的反应有关,并且已经研究了GA在植物免疫中的作用。水稻矮缩病毒(RDV)外衣壳蛋白P2与植物t-kaurene氧化酶相互作用,影响GA的产生,RDV感染水稻植株GA含量显著降低[81].这些发现与本研究一致,即与未感染的组织相比,叶片和茎在5 dpi处GA累积,在随后的所有感染天数内GA都在减少,而在感染的根中30天内未检测到明显的GA水平轮枝菌属感染。因此,GA是植物在病原体定植期间防御信号通路中使用的激素系统的一部分。赤霉素的生产由轮枝菌属利用矮突变苗的种玉米被调查[82].从114株轮枝菌属在马铃薯-胡萝卜葡萄糖培养基上生长15 - 25天,只有27个分离株产生“赤霉素”,其中12个被鉴定为赤霉素诉dahliae.此外,用赤霉素处理向日葵,可以防止接种的植株幼苗发育迟缓轮枝菌属,表明这可能是由于干扰正常的GA活动。GA促进DELLA蛋白的降解,而DELLA蛋白是生长的负调节因子,因此GA促进植物生长。此外,DELLA蛋白也作为GA信号通路的负调控因子拟南芥,调节SA和JA依赖的防御反应[83].一个拟南芥缺少四个的四倍della突变体德拉基因对生物营养性病原体Pto DC3000和Hyaloperonospora拟南芥[83,但很容易受到影响葡萄孢菌这是一种坏死性真菌。此外,GA是由坏死病原体合成的g . fujikuroi作为一种毒力因子来降解DELLA蛋白并赋予宿主易感性。在这种情况下,GA不仅干扰SA/ ja依赖的防御,而且通过干扰ROS平衡而导致死亡。因此,GA在应对病原体攻击中的作用机制仍然是一个争论的话题。
ABA和GA主要参与非生物胁迫,SA和JA更负责植物对生物胁迫的反应。在本研究中,与未感染的草莓植株相比,SA在5 dpi时只在叶片中积累,而JA在5和30 dpi时超过了同一感染组织中的水平。与未受感染的植株相比,JA在茎中积累在前10天轮枝菌属在受感染的根中,只有JA在后期(20-30 dpi)被发现。这些结果清楚地表明,SA和JA防御信号通路在草莓植株中都被激活轮枝菌属殖民。其中SA和JA的含量F. × ananassa简历。感染的Camarosa植株炭疽菌acutatum研究[84].5 dpi后,SA和JA浓度在气膜组织中也达到最高。一些已知的SA和ja依赖防御途径的组成部分,如FaPR1-1而且FaGST1(氧化应激反应防御基因)在与草莓互作过程中积累不显著c . acutatum。因此,在草莓植株中,只有SA和ja依赖的防御途径的特定分支受到这种病原体的影响,这支持了这种病原体使用分子策略来绕过植物防御的观点。植物有复杂的防御机制来抵御微生物和真菌病原体的攻击和超敏反应。抵抗病原体攻击最有力的方式是SA和某些PR蛋白的积累[85].下胚轴和根的木质部液芸苔属植物显著感染了诉longisporum含有高水平的SA,与病原体DNA的数量和发育迟缓程度相关[86].SA是一种重要的植物激素,参与保护植物免受生物营养和半生物营养病原体的侵害,并在建立系统性获得性抗性(SAR)中发挥作用[87].因此,SA也参与了植物组织的防御反应轮枝菌属毒素(88].相反,JA通常介导对食草昆虫和坏死性病原体的保护[89].轮枝菌属属半生物营养型植物病原真菌,在感染后期表现为坏死期。因此,本研究证实,植物SA防御信号通路在植物的第一个生物营养期被激活轮枝菌属叶片、茎和根的JA信号通路也在晚期被激活。简而言之,病原体感染和生长的成功取决于病原体逃脱植物防御的速度和植物适应防御反应的速度之间的平衡。此外,还应考虑病原体为自身利益而可能操纵宿主的激素状态。
因为有合适的突变体拟南芥,大多数植物激素的实验都是在该植物中进行的。SA信号的重要调控成分之一是PR基因1的非表达子(NPR1),它与TGA (TGACG基序结合蛋白家族)转录因子相互作用,TGA转录因子参与SA反应性PR基因的激活[90].在NPR1下游,多个WRKY转录因子(包含一个或两个WRKY蛋白结构域)在植物sa依赖防御反应的调控中发挥重要作用[91,92].
有趣的是,在接种后的前11 h, JA在叶片韧皮部分泌物中迅速积累,而SA则没有两JA生物合成基因表达水平的升高表明JA可以作为一种移动信号拟南芥病原体免疫[93].同样,其他研究人员证实,在病原体感染或组织损伤时,JA的浓度会增加,并诱导防御相关基因的表达[94,95].对JA反应的基因表达受到转录因子JA不敏感1/MYC2 (JIN1/MYC2)的调控[96], aptala2 /乙烯反应因子(AP2/ERF)家族成员[97], F-box冠状廷不敏感蛋白1 (COI1) [98],一种植物防御素蛋白1.2 (PDF 1.2) [99]和jasmonate - zimm - domain阻遏蛋白(JAZ) [One hundred.].在植物保护过程中调节植物保护的关键调节因子诉dahliae感染似乎是一种GbWRKY1转录因子,它激活了JAZ1在棉花中的表达[101].此外,SA和JA防御信号通路之间的相互作用是调节对各种病原体防御反应的重要机制。的拟南芥WRKY70(转录因子)[102,103], MPK4(丝裂原活化蛋白激酶4)[104]及GRX480 (glutaredoxin) [105]已被发现调节SA和ja介导的防御之间的拮抗相互作用。在本研究中,根系JA含量在后期升高,而SA含量在后期不显著。这一发现表明草莓中两种途径之间存在拮抗关系。此外,SA和JA防御途径之间的协同相互作用的证据已被报道。MeJA和SA在病原体接种后协同诱导转录因子WRKY62 [106]并激活了一些防御相关基因的表达[107].
除上述植物激素外,本文还对IAA进行了分析。在所有感染样本中均检测到显著水平的IAA。叶片中IAA浓度与未感染对照相比逐渐增加,在10 dpi时达到峰值,然后下降到30 dpi。与对照相比,茎秆中IAA在前5天内积累轮枝菌属30 dpi时只在根部感染。这些结果表明IAA在草莓的防御反应中也起着至关重要的作用Verticllium感染。Xcc和Xcc感染的植物叶片IAA积累也显著增加。拟南芥- - - - - -黄定pv。定)或Pto (两pv。番茄),最多在感染后3至4天出现[108].生长素响应GH3基因起着保护作用拟南芥和米饭。GH3.5在拟南芥,是病原体感染过程中的双功能调节因子,同时作用于SA和生长素信号通路[109].在大米中,过度表达GH3.8增强对病原体的抵抗力黄oryzae光伏oryzae(Xoo)在SA和JA独立通路中[110].GH3-8抑制了iaa诱导的膨胀素的产生,这可能是对iaa抗性的合理解释Xoo语.Xoo感染植物的机制之一是iaa刺激局部产生膨胀蛋白。此外,IAA和SA可拮抗相互作用,从而增强对生物营养性病原体的敏感性[111].有趣的是,转运抑制反应蛋白1 (transport inhibitor response protein 1, TIR1)是一种IAA受体,可与Aux/IAA蛋白相互作用[112,113].
这项工作是对草莓中激素影响的首次研究F. × ananassa作为对轮枝菌属感染。然而,这些化合物的基本分子机制和在草莓病原菌攻击中的作用还不完全清楚。植物激素信号传导的机制究竟有何不同轮枝菌属草莓中的菌株,植物如何调节植物激素水平以应对多种同时发生的病原体攻击,包括轮枝菌属以及哪种机制可能是对信号反应的适当控制的基础轮枝菌属感染,仍然是未来调查的挑战性问题。
结论
21的基因表达PR-10基因显示了转录水平的强烈变化和广泛的反应。19PR-10之后基因明显上调轮枝菌属感染。与植物定殖的时间点一致,根系和叶片的最高表达水平分别在早期和晚期。LC-MS分析表明,在5 dpi时,植物激素已经在叶、茎和根中积累F. × ananassa病原体感染后的植物,并提供了植物激素参与植物防御信号通路的证据。抗真菌代谢产物在后期积累轮枝菌属感染。这项工作很好地说明了草莓植物对真菌攻击的不同防御策略。
方法
植物离体繁殖
为了传播F. × ananassa简历。Elsanta在离体植物中使用改良的Murashige和Skoog (MS)培养基[114],蔗糖20 g/l,琼脂6.5 g/l。用HCl或KOH (1 M)调整pH值至5.8后,在121°C下蒸压20分钟。将琼脂冷却至45-50°C后,在培养基中加入50 mg/l的柠檬酸和抗坏血酸,最后在200 ml的罐子中分配(30 g)。琼脂凝固后,将离体植物转移到罐子中,草莓培养维持约6周。F. × ananassa离体植物在光周期为16小时的专用房间中生长。白天平均气温为23.8±1.4℃,夜间平均气温为22.0±1.5℃。
感染轮枝菌属
F. × ananassa用E650的分离物人工接种离体植株诉dahliae,由德累斯顿园艺作物育种研究所提供。这种隔离物造成了弱到中等的损伤F. × ananassa用于此工作的品种.诉dahliae用两层纱布在马铃薯葡萄糖琼脂上培养。培养皿在22°C的黑暗中保存3-4周(附加文件)1).一个月后,将纱布浸入10毫升无菌蒸馏水中旋转。滤除菌丝后,将分生孢子浓度调至106孢子/ml使用Thoma血细胞计。离体植物直接接种在琼脂培养基上,用移液管尖在5个不同的位置刺穿根部(106分生孢子/毫升)。
对照植物同样用无菌水接种。植物被保存在生长室中,以1,5,10,20和30 dpi的速度收获,并分离成叶、茎和根。每个时间点取5株感染株和5株对照。叶子、根和茎样本立即在液氮中冷冻,并在−80°C保存。在所有采样时间点,根据[9].
引物设计
使用不同的生物信息学工具(BioEdit/ Clustal 2.1/ Primer3/ OligoAnalyzer 3.1)设计并验证特定的引物。Primer3有许多不同的输入参数,这些参数可以被控制以定义允许软件设计适合qPCR分析的引物的特征。基于SYBR green的qPCR引物设计参数选择:引物长度为18-30个碱基对(bp),引物熔融温度(Tm)在58℃~ 64℃之间,鸟嘌呤-胞嘧啶(GC)含量为20-80%。其他标准是产物大小小于200bp和防止核苷酸序列重复以避免错引(例如ACACACACAC)。21的特定引物PR-10异构体在附加文件中列出3..为了检查基因特异性,并验证引物不与其他基因杂交,每一对引物都被硅质分析。这是通过使用BLAST选项将引物序列与已知基因数据库进行比较来完成的。对扩增产物进行熔融曲线分析,单峰表示特异性。
RNA提取
总RNA如所述分离[115使用CTAB方法。在1-2克冻干草莓材料中加入20毫升的预热萃取缓冲液。在65°C孵育混合物期间,Falcon管手动倒置3次。然后,加入等量的氯仿/异戊醇,再次用手轻轻翻转样品10分钟。在12000 rpm(4°C)离心后,将上清液转移到新的Falcon管中,并在反应中加入1/3体积的8 M LiCl。RNA沉淀在4℃下进行过夜。以12000 rpm离心,4℃离心30 min后,用500 μl 0.5% SDS轻溶。接着进行第二步离心,然后将上清液转移到装有两体积100%乙醇的新Eppendorf管中。反应在−20°C下进行2 h。沉淀的RNA离心后(30分钟,4°C, 13200 rpm),用70%和100%乙醇清洗颗粒。 Subsequently, the pellet was air-dried and then dissolved in 50 μl DEPC. The quality and quantity of RNA was determined using Nanodrop and 1% agarose gel.
cDNA的合成
用1 μl随机引物(10 μM)和1 μl 10 mM dNTP,在20 μl总体积中将1 μg dnase处理的RNA逆转录为cDNA。在65°C孵育5分钟后,将反应混合物放在冰上冷却1分钟。将第一链缓冲液和RNase OUT重组RNase抑制剂添加到无核酸酶微型离心管中。37℃孵育2 min后,加入1 μl M-MLV RT。在25°C孵育10分钟,然后在50°C合成cDNA 1小时。然后,将温度提高到70℃使逆转录酶失活,并将cDNA保存在−20℃。
实时定量PCR (qPCR)
定量实时PCR分析使用StepOne实时PCR仪器和软件(Applied Biosystems, Darmstadt, Germany)进行。用SYBR Green(应用生物系统公司)制备每次PCR的Master Mix。在总体积为20 μl的条件下进行扩增:10 μl Fast SYBR Green Master Mix, 10 μM正向引物,10 μM反向引物,2 μl模板(cDNA)。PCR扩增程序采用以下标准热程序优化为40个循环:95°C 10 min,然后95°C 15 s, 60°C 1 min(40个循环),然后95°C 15 s, 60°C 1 min, 95°C 15 s。扩增在96孔反应板(Applied Biosystems)中进行,所有样品在至少3个技术重复中进行扩增。目的基因的cDNA稀释为1/20,管家基因的cDNA稀释为1/8000,对基因定量研究足够敏感。每个的Ct值(阈值循环值)PR-10利用草莓的Ct值,将对照茎的基因归一化至1 dpiFaRIB413该基因对应于一个内部RNA间隔层(16S-23S)。基因表达的折叠变化2——ΔΔCt根据[116].
质分析
对于这种方法,制备了含有50 mg biochanin A和50 mg 4-methylumbelliferyl-ß-D-glucuronide的内标准,在250 ml甲醇中超声溶解10分钟。提取过程中,将染病草莓植株和未染病草莓植株冻干组织(叶、根、茎)50 mg与250 μl内标和250 μl甲醇混合。样品涡旋1分钟,超声10分钟,离心10分钟,转速13200转。将上清液放入新的Eppendorf管中,用500 μl甲醇再次提取颗粒。然后,将两种上清液混合,用Speed-Vac系统处理2-3小时,使甲醇蒸发。干燥后的颗粒再悬浮于35 μl LC-MS优质水中,以最大速度涡旋、超声、离心2次。最后,将清上清液装入带有微插片的LC-MS瓶中,进行LC-UV-ESI-MS分析。通过QuantAnalysis软件检测代谢物在感染和未感染离体植株叶、茎和根中的积累,并参考其保留时间和破碎模式。使用该工具进行定量,结果对照内标(biochanin A)进行归一化。以下所述代谢产物的积累量设计为相对浓度(Rel. conc.),用mg-equ表示。冷冻干燥草莓组织(叶、茎和根)中内部标准生物炭素A的干重/g。
脱落酸(ABA, 264.32 g/mol)、水杨酸(SA, 138.12 g/mol)、茉莉酸(JA, 210.27 g/mol)、赤霉素酸(GA, 346.47 g/mol)和吲哚乙酸(IAA, 175.19 g/mol)分别在37.9 min、35.5 min、39.1 min、30.8 min和33.3 min洗脱。保留时间由真实对照品分析确定。
统计分析
使用SAS (SAS Institute Inc., Cary, USA)统计程序进行统计分析。每接种日采用单因素方差分析(ANOVA), 21个基因相对表达量的平均值采用Tukey检验进行分析。显著性水平为p≤0.05。
写作指南
基因名称的符号以斜体表示(例如:公关- 10.06),而蛋白质名称的符号不斜体(例如PR-10.06)。
缩写
- 阿坝:
-
脱落酸
- 爆炸:
-
基本本地对齐搜索工具
- dpi:
-
感染后天数
- 遗传算法:
-
赤霉酸
- 谷胱甘肽:
-
谷胱甘肽
- GSSH:
-
氧化谷胱甘肽
- 国际宇航科学院:
-
吲哚乙酸
- 是:
-
茉莉酸
- 质:
-
液相色谱-质谱法
- PR-10:
-
致病相关蛋白家族
- qPCR:
-
定量聚合酶链反应
- RDV:
-
水稻矮缩病毒
- ROS:
-
活性氧
- 山:
-
水杨酸
- Tm:
-
熔化温度
参考文献
- 1.
佩吉GF,布雷迪BL.黄萎病。英国沃灵福德:CABI出版社;2002.
- 2.
Inderbitzin P, Bostock RM, Davis RM, Usami T, Platt HW, Subbarao KV。维管束萎蔫真菌致病菌黄萎病菌的系统发育与分类及五个新种的描述。科学通报。2011;6:e28341。
- 3.
Zare R, Gams W, Starink-Willemse M, Summerbell RC。Gibellulopsis是黑黄萎病属的适宜属,Musicillium是黑黄萎病属的新属。Nova Hedwigia. 2007; 85:463-89。
- 4.
霍克斯沃思DL,托尔博伊斯PW。黄萎病dahliae。中国病原真菌杂志,1970:255-9。
- 5.
Gams W, Zare R, Summerbell RC。建议保留属名Verticillium(变形子囊菌)的保守型。分类单元。2005;54:179。
- 6.
Klosterman SJ, Atallah ZK, Vallad GE, Subbarao KV。黄萎病种的多样性、致病性和管理。植物病理学杂志。2009;47:39-62。
- 7.
Subbarao KV, Kabir Z, Martin FN, Koike ST.利用蔬菜轮作管理草莓土壤传播疾病。植物科学学报,2007;
- 8.
植物根系对黄萎病微菌核萌发的影响。《植物病理学杂志》,1995;1(2):366 - 366。
- 9.
毕夏普CD,库柏RM。三种血管萎蔫病根系侵袭的超微结构研究。《植物病理学》1983;22:15-27。
- 10.
陈萍,李斌,罗杰。番茄对大丽叶黄萎病非寄主分离株的耐受性。植物病理学杂志,2004;64:283-91。
- 11.
黄志刚,李志刚,李志刚,黄氏菌侵染番茄的研究进展。植物病理学杂志,1998;52:385-96。
- 12.
黄萎病真菌在实验室和田间的寿命。植物病理学。1955;45:180-1。
- 13.
傅瑞金,傅志刚,彭志刚。大丽花和白纹黄萎病的生理和分子研究。Mol Plant Pathol 2006; 7:71-86。
- 14.
王志强,王志强,王志强,等。棉花叶片对黄萎病菌侵染的影响。植物病理学杂志2001;58:119-31。
- 15.
陈玲,孙娜,王娟,凌红,张玲,左坤。棉花枯萎菌诱导PR10-1基因的功能分析。植物科学学报,2013;04:417-26。
- 16.
Fernandes H, Michalska K, Sikorski M, Jaskolski M. PR-10蛋白的结构和功能研究。Febs j . 2013; 280:1169-99。
- 17.
李志强,李志强,李志强,等。葡萄枯萎病诊断的光学仪器评价。农业工程学报。2011;13:2。
- 18.
Shulaev V,萨金特DJ,克劳赫RN, Mockler TC, Folkerts O, Delcher,贾斯瓦尔P, Mockaitis K,斯通,鬃毛SP,伯恩斯P,戴维斯TM, Slovin JP,巴希尔N,赫楞RP,埃文斯C,哈金斯T, Kodira C, B Desany Crasta或者,詹森房车,艾伦AC,迈克尔•TP塞图巴尔JC, Celton JM,里斯DJ,威廉姆斯KP,霍尔特SH, Ruiz罗哈斯JJ, Chatterjee M,刘B,席尔瓦H, Meisel L, Adato, Filichkin SA Troggio M,中提琴R,清道夫TL,王H, Dharmawardhana P J,拉贾R,牧师高清,科比DW Jr,福克斯,Givan SA, Wilhelm LJ, Naithani S, Christoffels A, Salama DY, Carter J, Lopez Girona E, Zdepski A, Wang W, Kerstetter RA, Schwab W, Korban SS, davvik J, Monfort A, Denoyes-Rothan B, Arus P, Mittler R, Flinn B, Aharoni A, Bennetzen JL, Salzberg SL, Dickerman AW, Velasco R, Borodovsky M, Veilleux RE, Folta KM。林地草莓的基因组(草莓属vesca).Nat Genet. 2011; 43:109-18。
- 19.
Muñoz C, Hoffmann T, Escobar NM, Ludemann F, Botella MA, Valpuesta V, Schwab W.草莓果实Fra过敏原在类黄酮生物合成中的作用。植物学报。2010;3:113-24。
- 20.
王晓明,王晓明,王晓明,王晓明。油菜异体蛋白组防御反应的研究(甘蓝型油菜)抑制长孢黄萎病的生长,但对疾病症状没有影响。BMC植物生物学,2008;8:129。
- 21.
Klosterman SJ, Anchieta A, Garcia-Pedrajas MD, Maruthachalam K, Hayes RJ, Subbarao KV。SSH揭示了衰老相关蛋白酶和生菜黄萎病症状发展之间的联系。《植物病理学杂志》2011;76:48-58。
- 22.
Millet YA, Danna CH, Clay NK, Songnuan W, Simon MD, Werck-Reichhart D, Ausubel FM。拟南芥根中微生物相关分子模式激活的先天免疫反应。《植物科学》2010;22:973-90。
- 23.
奥原PA, Paulitz TC。真菌病原体的根防御反应:分子的角度。植物学报,2005;
- 24.
潘丽德斯,张志刚,张志刚。拟南芥被黄萎病菌(Verticillium dahliae)侵染时需要通过ETR1来感知乙烯。植物病理学杂志,2010;11:191-202。
- 25.
拟南芥生物防治剂K-165对大黄萎病抗性的诱导及致病相关蛋白基因表达植物与微生物相互作用,2005;18:555-61。
- 26.
Johansson A, Staal J, Dixelius C.拟南芥-长孢黄萎病病系统的早期反应依赖于NDR1, JA-和et相关信号通过细胞质NPR1和RFO1。植物与微生物相互作用。2006;19:958-69。
- 27.
Iven T, Stefanie König S, Singh S, brauss - stromeyer SA, Matthias Bischoff M, Tietze LF, Braus GH, Lipka V, Feussner I, Dröge-Laser W.拟南芥根中色氨酸衍生次级代谢产物的转录激活和产生有助于抵御真菌血管病原体Verticillium longisporum。植物学报。2012;5:1389-402。
- 28.
范文文,王志强,王志强,等。血管凝胶化:感染后的一般反应现象。植物病理学杂志。1977;11:95-100。
- 29.
Koistinen KM, Hassinen VH, Gynther PAM, Lehesranta SJ, Keinänen SI, Kokko HI, Oksanen EJ, Tervahauta AI, Seppo Auriola S, Kärenlampi SO。Birch PR-10c是由氧化应激因子诱导的,但似乎对这些因子不具有耐受性。新植物,2002;155:381-91。
- 30.
黄萎病1、2品系侵染克雷盖拉番茄后涂层反应的作用。《植物病理学杂志》,1995;29(4):344 - 344。
- 31.
Cregeen S, Radisek S, Mandelc S, Turk B, Stajner N, Jakse J, Javornik B.啤酒花抗性和易感品种对高侵袭性株系侵染的不同基因表达黄萎病albo-atrum.中国生物医学工程学报,2015;
- 32.
Fradin EF, Zhang Z, Ayala JCJ, Castroverde CDM, Nazar RN, Robb J, Liu CM, Thomma B.番茄Ve1介导黄萎病抗性的遗传解剖。植物科学学报。2009;30(3):344 - 344。
- 33.
Robb J, Powell DA, Street PFS。黄萎病番茄壁膜分泌的时间进程。植物病理学杂志,1987;31:17 - 26。
- 34.
斯特里特,罗柏J,埃利斯BE。白化黄萎病感染番茄木质部薄壁细胞分泌维管膜成分的研究。原生质。1986;132:1-11。
- 35.
罗柏J,李SW,莫汉R, Kolattukudy PE。番茄胁迫诱导维管膜的化学特性。植物学报。1991;97:528-36。
- 36.
van Esse HP, Fradin EF, de Groot PJ, de Wit PJ, Thomma BP。番茄对叶片和维管真菌病原体的转录反应是不同的。植物与微生物相互作用。2009;22:245-58。
- 37.
黄萎病抗性草莓(Fragaria × ananassa)抗黄萎病基因型与大黄萎病定殖程度的关系。植物病理学。2010;59:376-81。
- 38.
罗伯J,李B,纳扎尔RN。耐受番茄-血管病原体相互作用中的基因抑制。足底。2007;226:299 - 309。
- 39.
肖DV, Gubler WD, Larson KD, Hansen J.利用加州草莓的基因型和分离子代评估了大田大黄萎病抗性的遗传变异。自然科学进展,1996;21(2):344 - 344。
- 40.
Żebrowska J, hortyzyski J, Cholewa T, Honcz K.草莓品种对大黄萎病抗性的研究。农学通报,2006;71:1031-6。
- 41.
Żebrowska J.草莓(Fragaria x ananassa Duch.)组织对黄萎病抗性选择的效果。农业学报。2011;64:3-12。
- 42.
李志强,李志强,李志强,等。果胶酶对草莓植株抗真菌活性的影响。《植物科学》1997;16:272-6。
- 43.
戴亚诺C, Monticelli S, Frattarelli A, Nicolini S, Corazza L.草莓体细胞无性系变异与体外再生。植物学报。1997;447:87-94。
- 44.
丰田浩,山野勇,大内盛。草莓愈伤组织再生剂抗枯萎病抗性的筛选。植物科学。1991;10:167-70。
- 45.
马建林,钟林,李志强。草莓植株和根培养物抗疫霉和仙人掌病的体外筛选。植物学报。1993;448:496 - 9。
- 46.
Sowik I, Bielenin A, Michalczuk L.草莓对大黄萎病和辣椒疫霉抗性的体外试验。科学通报。2001;88:31-40。
- 47.
耆那教的SM。作物改良中的组织培养变异。Euphytica。2001;118:153 - 66。
- 48.
杨晓东,杨晓东,Wójcik D.草莓对黄萎病易感性的体外检测方法。植物学报,2008;16:11 - 21。
- 49.
Yamamoto M, Nakatsuka S, Otani H, Kohmoto K, Nishimura S.(+)-儿茶素在草莓叶中的感染抑制因子。植物病理学。2000;90:595 - 600。
- 50.
黄志刚,李志刚。草莓果实发育过程中儿茶素生物合成的个体发生变异及其与灰霉病的关系。中国植物病害防治杂志,2008;15(5):457 - 457。
- 51.
Blair AC, Hanson BD, Brunk GR, Marrs RA, Westra P, Nissen SJ, Hufbauer RA。一种与入侵成功有关的候选化感化学物质研究的新技术和发现。生态学报2005;8:1039-47。
- 52.
Inderjit KR, Kaur S, Callaway RM。(±)儿茶素对土壤微生物群落的影响《中华医学杂志》2009;2:127-9。
- 53.
Veluri R, Weir TL, Bais HP, Stermitz FR, Vivanco JM。儿茶素衍生物的植物毒性和抗菌活性。农业化学学报。2004;52:1077-82。
- 54.
Bais HP, Walker TS, Stermitz FR, Hufbauer RA, Vivanco JM。(±)-儿茶素对映体依赖性的植物毒性和抗菌活性。斑点矢车菊根分泌的外消旋混合物。植物学报。2002;128:1173-9。
- 55.
Prusky D, Kobiler I, Jacoby B, Sims JJ, Midland SL.鳄梨脂氧合酶抑制剂:它们与炭疽病菌潜伏期的可能关系。《植物病理学》1985;27:269-79。
- 56.
Wattad C, Dinoor A, Prusky D.炭疽炭疽菌(Colletotrichum gloeosporioides)果胶酸裂解酶的纯化及其表儿茶素的抑制作用:未成熟牛油果抗炭疽病的可能因素。植物与微生物相互作用,1994;7:293-7。
- 57.
黄烷-3-醇和原花青素在植物防御中的作用。见:植物生态学的原理与实践:化感化学相互作用。编辑Inderjit, Dakshini KMM, Foy CL。博卡拉顿:CRC出版社;1999.p . 307 - 338。
- 58.
Lopez-Raez农协。弗洛斯V, García JM,1和波佐MJ。AM共生改变番茄根部酚酸含量。植物生态学报,2010;
- 59.
威斯MV,德威JE。棉花生长调节剂变化与白化黄萎病引起的叶片脱落有关。植物物理学报。1970;45:04 - 9。
- 60.
El-Bebany ALR, Daayf .马铃薯酚类化合物的差异积累对弱和高侵袭性黄萎病菌株的反应。《植物病理学杂志》,2013;
- 61.
Veloso J, Alabouvette C, Olivain C, Flors V, Pastor V, Garcia T, Diaz J.保护菌株Fo47防治辣椒黄萎病的作用模式。植物病原学。2016;65:997-1007。
- 62.
刘艳,张楠,邱敏,冯辉,Vivanco JM,沈强,张荣。病原菌侵染增强解淀粉芽孢杆菌SQR9根际定殖。FEMS微生物学杂志2014;353:49-56。
- 63.
Kamilova F, Kravchenko LV, Shaposhnikov AI, Azarova T, Makarova N, Lugtenberg B.石棉上蔬菜分泌物中有机酸、糖和l -色氨酸及其对根际细菌活性的影响植物与微生物相互作用,2006;19:250-6。
- 64.
Kamilova F, Kravchenko LV, Shaposhnikov AI, Makarova N, Lugtenberg B.番茄病原体的影响尖孢镰刀菌f。Spradicis-lycopersici以及生物控制细菌荧光假单胞菌WCS365对番茄根分泌物中有机酸和糖组成的研究。植物与微生物相互作用。2006;19:1121-6。
- 65.
金敏敏,陈宗杰,郭永生,黄桂生。草莓(Fragaria X Ananassa)叶片对角斑菌(Xanthomonas Fragariae)的代谢反应。农业化学学报。2016;64:1889-98。
- 66.
Ishihara A, HashimotoY TC, Dubouzet JG, Nakao T, Matsuda F, Nishioka T, Miyagawa H, Wakasa K.色氨酸途径通过血清素的产生参与水稻对致病性感染的防御反应。植物J. 2008; 54:481-95。
- 67.
Ball L, Accotto GP, Bechtold U, Creissen G, Funck D, Jimenez A, Kular B, Leyland N, Mejia-Carranza J, Reynolds H, Karpinski S, Mullineaux PM。拟南芥谷胱甘肽生物合成与胁迫防御基因表达之间直接联系的证据。《植物科学》2004;16:2448-62。
- 68.
王志刚,王志刚,王志刚,等。不同谷胱甘肽s转移酶对小麦的诱导作用。植物科学进展。1993;
- 69.
郭志刚,李志刚,李志刚,李志刚。谷胱甘肽的合成、代谢及其与胁迫耐受性的关系。计算机应用技术学报,1998;49:623-47。
- 70.
温特伯恩CC, Metodiewa D.生物学上重要的硫醇化合物与超氧化物和过氧化氢的反应性。《游离自由基生物学杂志》1999;27:32 - 8。
- 71.
爱德华兹R,布朗特JW,狄克逊RA。在豆科植物细胞培养中谷胱甘肽和植物抗毒素反应的诱导。足底。1991;184:403-9。
- 72.
Gönner M. Schlösser E.氧化应激对燕麦的影响。植物病理学杂志。1993;42:21 21 - 34。
- 73.
May MJ, hamde - kosack KE, Jones J.活性氧、谷胱甘肽代谢和脂质过氧化在番茄子叶cf基因依赖的防御反应中的作用。植物科学学报,1996;
- 74.
Vanacker H, Foyer C, Carver TLW。白粉病侵袭诱导的燕麦非特异性抗性基因型抗氧化剂的变化。足底。1999;208:444-52。
- 75.
杨晓明,张晓明,张晓明,张晓明,等。抗氧化剂对烟草花叶病毒侵染和水杨酸的局部和全身免疫应答。(在系统性获得性耐药中的作用)。植物物理学报。1997;14:1443 - 51。
- 76.
Flors V, Ton J, van Doorn R, Jakab G, García Agustín P, mauh - mani B. JA、SA和ABA信号在对丁香假单胞菌和十字花型油菜链孢菌基础和诱导抗性过程中的相互作用。植物J. 2008; 54:81-92。
- 77.
唐志强,李志强,李志强,等。ABA在抗病性中的多重作用。植物科学进展;2009;14:310-7。
- 78.
刘志刚,刘志刚,刘志刚。植物非生物胁迫对植物生长的影响。BMC植物学报,2011;11:163-77。
- 79.
Schmidt K, Pflugmacher M, Klages S, Mäser A, Mock A, Stahl DJ。甜菜尾孢菌(Cercospora beticola)侵染部位激素脱落酸(ABA)的积累支持了ABA作为植物防御抑制因子的作用。植物病理学杂志,2008;9:661-73。
- 80.
Colebrook EH, Thomas SG, Phillips AL, Hedden P.赤霉素信号在植物对非生物胁迫反应中的作用。中国生物医学工程学报。2014;
- 81.
朱松,高峰,曹霞,陈明,叶刚,魏春,李艳。水稻矮缩病毒P2蛋白与t-kaurene氧化酶相互作用,导致赤霉素生物合成减少和水稻矮缩症状。植物科学学报。2005;39(3):339 - 344。
- 82.
Aubé C,萨克斯顿我们。黄萎病种的分布和流行与赤霉素类生物产生物质。《中华人民共和国学报》,2005;
- 83.
Navarro L, Bari R, Achard P, Lison P, Nemri A, Harberd NP, Jones JD。DELLAs通过调节茉莉酸和水杨酸信号的平衡来控制植物的免疫反应。《当代生物学》2008;18:650-5。
- 84.
Amil-Ruiz F, Garrido-Gala J, Gadea J, Blanco-Portales R, Muñoz-Mérida A, Trelles O, de Los SB, Arroyo FT, Aguado-Puig A, Romero F, Mercado JÁ, Pliego-Alfaro F, Muñoz-Blanco J, Caballero JL。炭疽菌相互作用对草莓SA-和ja -防御途径的部分激活。前沿植物科学,2016;7:1036。
- 85.
宋j, braden JM, Naess SK, Raasch JA, Wielgus SM, Haberlach GT, Liu J, Kuang H, Austin-Phillips S, Buell CR, Helgeson JP, Jiang J.从球castanum中克隆的基因RB对马铃薯晚疫病具有广谱抗性。生态环境科学学报,2003;21(2):366 - 366。
- 86.
杨晓明,李志刚,李志刚,李志刚。杨树木质部液中水杨酸和水杨酸苷的研究进展芸苔属植物显著感染了黄萎病longisporum.植物学报,2009;
- 87.
授予M,兰姆c全身免疫。植物学报2006;9:414-20。
- 88.
甄小红,李一智。大丽黄霉毒素和水杨酸处理后棉花抗性和敏感愈伤组织β -1,3-葡聚糖酶的超微结构变化及定位。中国植物科学,2004;21(1):1 - 7。
- 89.
对生物营养性和坏死性病原体防御机制的比较。植物学报。2005;43:205-27。
- 90.
董霞。NPR1,全面考虑。植物学报,2004;7:547-52。
- 91.
Eulgem T, Somssich IE。WRKY转录因子在防御信号中的网络。植物学报,2007;10:366-71。
- 92.
王东,董霞。植物系统性获得性抗性转录网络调控节点的基因组识别方法。PLoS Pathog. 2006;2:e123。
- 93.
杜鲁门W,班尼特MH,库比斯特尔蒂格I,特恩布尔C,格兰特RM。拟南芥系统免疫采用保守防御信号通路,由茉莉酸盐介导。自然科学进展,2007;26(3):349 - 349。
- 94.
罗伦佐O,索拉诺R.调控茉莉酸信号网络的分子玩家。植物学报,2005;8:532-40。
- 95.
茉莉酸类植物的生物合成、信号转导及其在植物胁迫反应、生长发育中的作用。杨晓明。2007;10:489 - 489。
- 96.
Lorenzo O, Chico JM, Sánchez-Serrano JJ, Solano R. JASMONATE- INSENSITIVE1编码MYC转录因子,对区分拟南芥不同茉莉酸调控的防御反应至关重要。《植物科学》2004;16:38 - 50。
- 97.
杨晓明,李志刚,杨晓明。AP2/ERF家族转录因子在植物非生物胁迫响应中的作用。生物化学学报,1819;2012:86-96。
- 98.
谢DX, Feys BF, James S, Nieto-Rostro M, Turner JG。COI1:拟南芥茉莉素调控防御和生育所需的基因。科学。1998;280:1091-4。
- 99.
Brown RL, Kazan K, McGrath KC, Maclean DJ, Manners JM。GCC-box在茉莉酸介导的拟南芥PDF1.2基因激活中的作用。植物物理学报。2003;132:1020-32
- One hundred.
Chini A, Fonseca S, Fernandez G, Adie B, Chico JM, Lorenzo O, García-Casado G, López-Vidriero I, Lozano FM, Ponce MR, Micol JL, Solano R.抑制因子JAZ家族是茉莉酸盐信号通路中缺失的一环。大自然。2007;448:666 - 71。
- 101.
李超,何霞,罗霞,徐玲,刘玲,闵玲,金玲,朱玲,张旭。棉花WRKY1通过激活茉莉酸- zimm - domain1的表达,介导棉花遭受黄萎病侵染过程中植株防御-发育的转变。植物学报。2014;166:2179-94。
- 102.
李娟,李志强,李志强等。WRKY70转录因子在植物防御中的作用。《植物科学》2004;16:19 - 31。
- 103.
李娟,李志强,李志强,等。WRKY70在植物防御中的信号通路选择调控作用。植物J. 2006;46:47 - 91。
- 104.
Brodersen P, Petersen M, Bjørn Nielsen H, Zhu S, Newman MA, Shokat KM, Rietz S, Parker J, Mundy J.拟南芥MAP激酶4通过EDS1和PAD4调节水杨酸和茉莉酸/乙烯依赖反应植物J. 2006; 47:532-46。
- 105.
Meyer Y, Siala W, Bashandy T, Riondet C, Vignols F, Reichheld JP。植物中的谷氧还蛋白和硫氧还蛋白。生物化学学报(英文版);2008:589-600。
- 106.
毛萍,段敏,魏春,李艳。WRKY62转录因子在胞质NPR1下游发挥作用,并负调控茉莉酸响应基因表达。植物物理学报。2007;48:833-42。
- 107.
Mur LAJ, Kenton P, Atzorn R, Miersch O, Wasternack C.水杨酸盐和茉莉酸盐信号通路之间浓度特异性相互作用的结果包括协同作用、拮抗作用和导致细胞死亡的氧化应激。植物物理学报。2006;140:249-62。
- 108.
O 'Donnell PJ, Schmelz EA, Moussatche P, Lund ST, Jones JB, Klee HJ。易感的不耐受-一系列激素作用在易感的拟南芥病原体反应。植物学报,2003;33:457 - 457。
- 109.
张震,李强,李震,Staswick PE,王敏,朱勇,何忠。GH3.5在拟南芥-丁香假单胞菌互作过程中水杨酸和生长素信号通路中的双重调控作用。植物物理学报。2007;145:450-64
- 110.
丁霞,曹颖,黄玲,赵娟,徐超,李霞,王松。水稻吲哚-3-乙酸-酰胺合成酶GH3-8的激活抑制膨胀素表达,促进水杨酸和茉莉酸独立的基础免疫。《植物细胞》2008;20:228-40。
- 111.
卡赞K,曼纳斯JM。连接发展与防御:植物-病原体相互作用中的生长素。植物科学进展2009;14:373-82。
- 112.
darmasiri N, Dharmasiri S, Estelle M. f盒蛋白TIR1是一种生长素受体。Nat。2005;435:441-5。
- 113.
Kepinski S, Leyser O.拟南芥F-box蛋白TIR1是一个生长素受体。大自然。2005;435:446-51。
- 114.
一种改进的烟草组织培养快速生长和生物测定的培养基。物理植物。1962;15:473-97。
- 115.
廖震,陈敏,郭玲,龚艳,唐峰,孙霞,唐凯。红豆杉和银杏中高质量总RNA的快速分离。生物化学,2004;34:209-14。
- 116.
Livak KJ, Schmittgen TD。使用实时定量PCR和2(−Delta Delta C (T))方法分析相关基因表达数据。方法。2001;25:402-8。
确认
我们感谢Hannelore Meckl帮助繁殖离体植物和Thomas Hoffmann在LC-MS分析方面的技术援助。
资金
这项工作得到了德国学术研究中心(DAAD)的支持。57076385到F.B.]。F.B.获得了DAAD的奖学金,在德国完成了博士学位。资助机构没有参与研究的设计、数据的收集、分析和解释,也没有参与手稿的撰写。
数据和材料的可用性
本研究中使用和/或分析的数据集可根据合理要求从通讯作者处获得。
作者信息
从属关系
贡献
F.B.设计并执行实验并撰写手稿,R.H.执行实验,W.S.计划实验,监督研究,并修改手稿。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用
发表同意书
不适用
相互竞争的利益
作者宣称他们之间没有利益冲突。
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
附加文件
附加文件1:
的文化黄萎病dahliae在马铃薯葡萄糖琼脂培养基中。培养皿的底部(右)和顶部(左)代表3-4周后的培养演变。(PPTX 548kb)
附加文件2:
PR-10命名法和基因号(PPTX 34 kb)
附加文件3:
21世纪入门PR-10用于qPCR分析的亚型。(PPTX 44 kb)
附加文件4:
的系统发育树PR-1021种基因及表达谱的总结PR-10离体培养的未经处理的叶、茎和根中的异构体F. × ananassa植物(绿条)和受感染的组织诉dahliae(红条)接种病原体后(天)的不同时间点。qPCR使用特定引物进行PR-10用基因和内参基因进行表达分析。(pptx238kb)
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
贝斯比斯,F.,哈贝格,R. &施瓦布,W.PR-10草莓植株的基因和代谢产物对黄萎病dahliae感染。BMC植物生物学19日,128(2019)。https://doi.org/10.1186/s12870-019-1718-x
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-019-1718-x
关键字
- Fragaria × ananassa
- 草莓
- 黄萎病dahliae
- PR-10
- 基因表达
- qPCR