- 研究文章GydF4y2Ba
- 开放访问GydF4y2Ba
- 发表:GydF4y2Ba
一氧化氮合酶介导的早期一氧化氮爆裂缓解了水分胁迫对供氨水稻根系的氧化损伤GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba19.GydF4y2Ba文章编号:GydF4y2Ba108.GydF4y2Ba(GydF4y2Ba2019GydF4y2Ba)GydF4y2Ba
抽象的GydF4y2Ba
背景GydF4y2Ba
营养与铵(NHGydF4y2Ba4.GydF4y2Ba+GydF4y2Ba与硝态氮处理相比,硝态氮处理能增强水稻幼苗的抗旱性GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba).然而,仍然有调查一氧化氮(NO)的不同的氮营养和水分管理的响应没有详细的研究。要研究内在机制支撑这一关系,依赖于时间的NO的产生和其保护作用在新罕布什尔州的抗氧化防御系统GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba——或者没有GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba对水稻幼苗进行了水分胁迫研究。GydF4y2Ba
结果GydF4y2Ba
An early NO burst was induced by 3 h of water stress in the roots of seedlings subjected to NH4.GydF4y2Ba+GydF4y2Ba但在NO处理下未观察到这种现象GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba治疗。由水胁迫诱导根的氧化性损伤是显著较高用于与NO治疗GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba比NHGydF4y2Ba4.GydF4y2Ba+GydF4y2Ba由于前者的反应性氧气(ROS)积累。通过申请3小时,不诱导没有生产GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba治疗缓解了氧化损伤,抑制早期NO通过将NO清除剂2-(4-羧基苯基)-4,4,5,5- tetramethylimidazoline -1-氧基-3-氧化物(c-PTIO)爆裂而增加的根的氧化在NH损坏GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba治疗。该一氧化氮合成酶(NOS)抑制剂N(G)的应用硝基 -GydF4y2BaL.GydF4y2Ba-Arginine甲酯(L-NAME)在NH后完全抑制了ROOTS 3 H中的合成GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba治疗和加重水应激诱导的氧化损伤。因此,通过L-NAME的氧化性损伤的加重可能导致从变化NOS介导早期NO爆裂。水应力也增加的根抗氧化酶的活性(过氧化氢酶,超氧化物歧化酶,和抗坏血酸过氧化物酶)。这些被进一步通过NO供体诱导的,但抑制由NO清除剂和NOS抑制剂在NHGydF4y2Ba4.GydF4y2Ba+GydF4y2Ba治疗的根源。GydF4y2Ba
结论GydF4y2Ba
这些结果表明,nos介导的早期NO爆发通过增强补充NH的根系的抗氧化防御能力,在缓解水分胁迫诱导的氧化损伤中发挥重要作用GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba.GydF4y2Ba
背景GydF4y2Ba
随着人口增长和全球气候变化的加剧,干旱胁迫正成为限制作物生长和产量的主要非生物因素。植物已经进化出几种应对水分胁迫的策略。这些包括形态、生理和分子的适应[GydF4y2Ba1GydF4y2Ba那GydF4y2Ba2GydF4y2Ba那GydF4y2Ba3.GydF4y2Ba].一氧化氮(NO)作为参与种子萌发、花器官转化、气孔运动、叶片衰老、产量发育等多种生理功能的重要信号分子,自20世纪80年代以来受到越来越多的关注[GydF4y2Ba4.GydF4y2Ba那GydF4y2Ba5.GydF4y2Ba那GydF4y2Ba6.GydF4y2Ba].植物对非生物胁迫的某些反应和适应也涉及到NO,而且有充分的数据表明NO介导植物对各种刺激的反应,包括干旱[GydF4y2Ba7.GydF4y2Ba)、盐(GydF4y2Ba8.GydF4y2Ba和金属毒性[GydF4y2Ba9.GydF4y2Ba,从而提高植物的抗逆性和存活率。GydF4y2Ba
水缺陷同时增加植物中的内源性NO和活性氧(ROS)生产[GydF4y2Ba7.GydF4y2Ba那GydF4y2Ba10.GydF4y2Ba].ROS在水分胁迫的植物中积累,破坏生化过程的功能,破坏细胞器,最终导致细胞死亡[GydF4y2Ba11.GydF4y2Ba].药理分析和转基因技术的结合已表明NO诱导抗氧化活性和以多种方式在植物中的缓解水分胁迫:(1)通过抑制ROS-生产者烟酰胺腺嘌呤二核苷酸磷酸氧化酶通过限制ROS积累和ROS诱导的细胞毒活性GydF4y2BaS.GydF4y2Ba亚硝基化作用[GydF4y2Ba12.GydF4y2Ba].(2)与ROS反应(如,O-GydF4y2Ba2GydF4y2Ba.-GydF4y2Ba),以产生瞬时ONOOGydF4y2Ba−GydF4y2Ba,然后立即被其他细胞过程清除[GydF4y2Ba13.GydF4y2Ba].(3)它诱导编码抗氧化酶的基因的表达,例如超氧化物歧化酶(SOD),抗坏血酸过氧化物酶(APX)和谷胱甘肽还原酶(GR),并且可以增加酶活性,从而减少水胁迫下的脂质过氧化[GydF4y2Ba14.GydF4y2Ba].(4)它有助于维持高血液活性溶质和氨基酸的高真空浓度[GydF4y2Ba15.GydF4y2Ba].(5)它充当下游脱落酸(ABA)信号分子,并参与“ABA-H”GydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba-NO-MAPK "信号转导过程,从而增加植物的抗氧化能力[GydF4y2Ba16.GydF4y2Ba].因此,内源性NO的产生可能增强植物的抗氧化能力,帮助植物细胞在各种胁迫下存活。GydF4y2Ba
然而,NO在植物上具有双相性质。其作用的双重性取决于压力持续时间和严重程度,以及细胞、组织和植物种类[GydF4y2Ba17.GydF4y2Ba].在低浓度或在非生物胁迫的早期阶段,在通过其在生理和应力相关的过程的参与高等植物重要功能NO参与(如上所述)。S.ome authors demonstrated that NO synthesis slightly increased in roots subjected to < 10 h water deficit, but was significantly up-regulated after prolonged drought (≥17 h) [18.GydF4y2Ba那GydF4y2Ba19.GydF4y2Ba].在严重或长期的胁迫下,植物体内NO的过量产生可以将细胞应激状态从氧化应激转变为严重的硝化应激,最终破坏蛋白质、核酸和细胞膜[GydF4y2Ba13.GydF4y2Ba那GydF4y2Ba20.GydF4y2Ba].蛋白质酪氨酸硝化被认为是评价各种非生物胁迫下亚硝化胁迫过程的一个很好的标记[GydF4y2Ba21.GydF4y2Ba].过量的NO也可与ROS协同作用,导致植物细胞内的硝基氧化应激并引发不良毒性效应[GydF4y2Ba7.GydF4y2Ba].Liao等。[GydF4y2Ba22.GydF4y2Ba],认为植物产生内源性或外源性NO以减轻氧化损伤的能力具有剂量依赖性。因此,测定干旱胁迫下植物瞬时NO含量并不能完全反映NO在抗旱性中的具体作用。GydF4y2Ba
在高等植物中,硝酸还原酶(NR)和一氧化氮合酶(NOS)是产生NO的两个关键酶[GydF4y2Ba4.GydF4y2Ba那GydF4y2Ba23.GydF4y2Ba].此外,NR依赖NO的产生响应于病原体感染时,发生GydF4y2Ba24.GydF4y2Ba)、铝(GydF4y2Ba25.GydF4y2Ba],冻结[GydF4y2Ba26.GydF4y2Ba],和干旱[GydF4y2Ba27.GydF4y2Ba].长期以来,尽管在植物中检测到NOS样活动,但在剩余的植物中编码NOS蛋白的基因仍有待确定[GydF4y2Ba28.GydF4y2Ba].最近,一些作者证明了哺乳动物NOS抑制剂抑制应对各种刺激植物[NO生产GydF4y2Ba22.GydF4y2Ba那GydF4y2Ba29.GydF4y2Ba,提示精氨酸依赖的一氧化氮合酶活性也可能在植物中发生。植物中大鼠神经元NO合酶的过表达增强了植物对干旱胁迫的耐受性,也证明了nos介导的NO生成在耐水分亏缺方面的重要性[GydF4y2Ba30.GydF4y2Ba].Arasimowicz-Jelonek等。[GydF4y2Ba18.GydF4y2Ba那GydF4y2Ba19.GydF4y2Ba应用一氧化氮供体硝普钠(SNP)和一氧化氮GydF4y2BaS.GydF4y2Ba-nitrosoglutathione(GSNO)到缺水的黄瓜和证明,NR和NOS都参加了抗旱性。尽管在NO介导的植物功能,NO起源增加知识和信令响应长期的压力及其在植物抗旱性调控仍然知之甚少。GydF4y2Ba
(NH铵GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba)和硝酸盐(NOGydF4y2Ba3.GydF4y2Ba−GydF4y2Ba)是植物的两个主要氮源。众所周知,NH能更有效地缓解干旱胁迫对植物发育的负面影响GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba比没有GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba营养,通过植物生长、生理特性和基因表达水平评价[GydF4y2Ba2GydF4y2Ba那GydF4y2Ba31.GydF4y2Ba那GydF4y2Ba32.GydF4y2Ba].NO在植物的驯化缺水了关键作用。尽管如此,对动态信息的NO产量变化及其干旱适应在没有提供植物的作用GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba或NH.GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba在缺水的早期阶段是稀缺的。在本研究中,我们监测了在水分胁迫下,这两种氮营养剂供应的根系内源NO产量的变化。采用药理学方法研究了内源性NO产生的具体作用和来源。本研究表明,一氧化氮早期释放通过增强NH根系的抗氧化防御能力,对缓解水分胁迫诱导的氧化损伤至关重要GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba提供植物。进一步的分析表明,这种早期的NO爆裂可能是由nos样酶引起的。GydF4y2Ba
结果GydF4y2Ba
植物生长和生理特性GydF4y2Ba
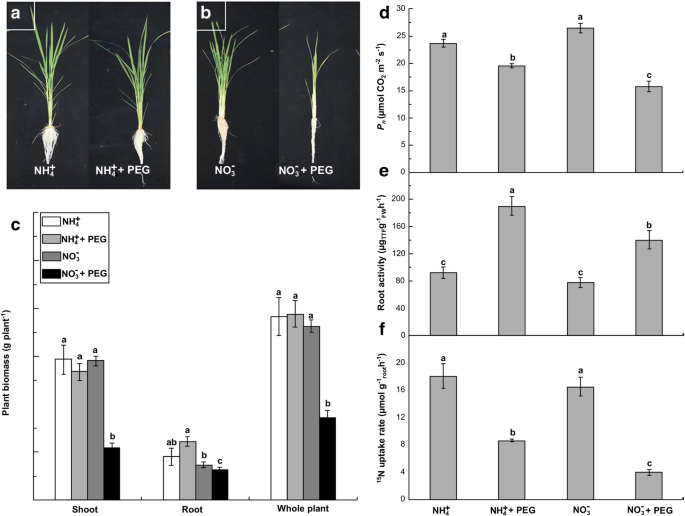
生长 - 和生理学相关的参数,如生物量,净光合速率(GydF4y2BaP.GydF4y2BaNGydF4y2Ba),以及在具有不同N源供给水稻幼苗根氮吸收率分别为负并通过不同的水分胁迫(图的影响。GydF4y2Ba1GydF4y2Baf)。水分胁迫21 d后,NO处理根系、地上部和总生物量分别显著降低14.1、62.1和52.4%GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba与无水胁迫处理(NOGydF4y2Ba3.GydF4y2Ba−GydF4y2Ba处理,作为对照处理)(图。GydF4y2Ba1GydF4y2Bab, c)。然而,这些值在NH中没有显著影响GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba用PEG治疗。水应力也减少叶(GydF4y2BaP.GydF4y2BaNGydF4y2Ba)和根GydF4y2Ba15.GydF4y2Ba氮素在NO中的吸收速率GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba-经处理的植物分别减少40.4%及76.1% (GydF4y2BaP.GydF4y2Ba< 0.05),而NH与非水胁迫处理植物的相关GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba-处理的植株分别减少了17.3%和52.2%。GydF4y2Ba1GydF4y2Bad,f)所示。与此相反,水分胁迫下根活动中的NO增加了106.2和79.6%GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba-treated和nh.GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba治疗过的植物,分别。因此,似乎NHGydF4y2Ba4.GydF4y2Ba+GydF4y2Ba-supplied水稻秧苗可以更有效地减轻PEG诱导的水分胁迫比NOGydF4y2Ba3.GydF4y2Ba−GydF4y2Ba-supplied水稻秧苗。GydF4y2Ba
(GydF4y2Ba一种GydF4y2Ba), (GydF4y2BaB.GydF4y2Ba) 和 (GydF4y2BaCGydF4y2Ba水稻农艺性状与生物量对NH的响应GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba- - -没有GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba施用10% PEG处理21 d后,对水稻进行水分胁迫处理。(GydF4y2BaD.GydF4y2Ba水分胁迫对NH叶片光合作用的影响GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba- - -没有GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba在21天之后。(GydF4y2BaE.GydF4y2Ba)在NH根活动水分胁迫GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba- - -没有GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba在21天之后。(GydF4y2BaFGydF4y2Ba)水分胁迫对根系的影响GydF4y2Ba15.GydF4y2BaN-标记的摄取NH率GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba- - -没有GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba在21天之后。稻叶光合作用,根活性和GydF4y2Ba15.GydF4y2Ba如在附加文件的描述测定氮的吸收率GydF4y2Ba4.GydF4y2Ba:方法S1。值代表平均值±标准误差(SE)(GydF4y2BaNGydF4y2Ba= 6)。不同的字母表示在GydF4y2BaP.GydF4y2Ba< 0.05。TTF:triphenylformazane;FW:鲜重GydF4y2Ba
根内源性NO的产生和氧化损伤的组织化学分析GydF4y2Ba
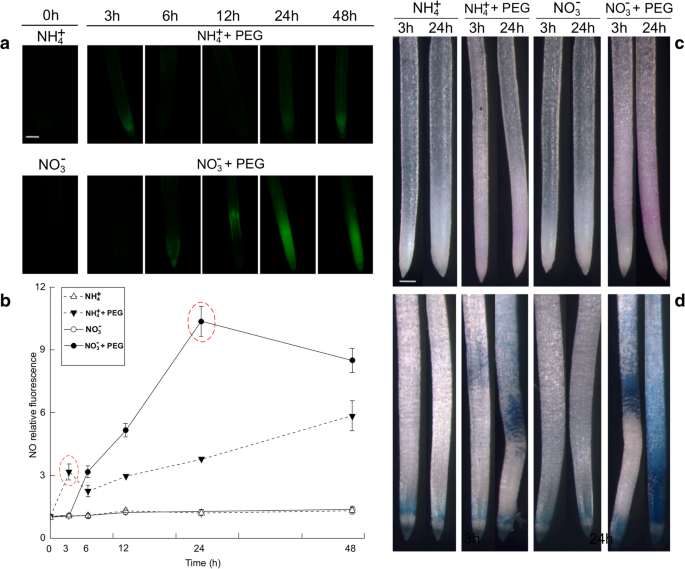
为了研究NO是否参与了水分胁迫驯化,研究人员使用NO特异性荧光探针二氨基荧光素- fm二乙酸酯(DAF-FM DA)监测根系内源性NO水平[GydF4y2Ba25.GydF4y2Ba].水分胁迫48 h后,根系的内源NO产量有显著差异(图2)。GydF4y2Ba2GydF4y2Baa).在NH中GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba或者没有GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba-处理植株的NO产量相对稳定,且在两种氮营养之间变化不大。GydF4y2Ba2GydF4y2Bab)。In contrast, water stress significantly induced endogenous NO production 3 h after the roots received NH4.GydF4y2Ba+GydF4y2Ba.而在NO处理中,内源性NO仅在6 h后才逐渐增加GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba治疗。相对荧光表明,在NH水分胁迫3 h时,NO有明显的提前爆发GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba与PEG治疗相对于NHGydF4y2Ba4.GydF4y2Ba+GydF4y2Ba治疗(Con)。NH处理的幼苗NO水平GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba比NO高2.92倍GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba治疗过的植物。然而,NO在NOGydF4y2Ba3.GydF4y2Ba−GydF4y2Ba-处理的幼苗比NH高2.72倍GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba-处理植株在24 h水分胁迫后(图。GydF4y2Ba2GydF4y2Bab)。GydF4y2Ba
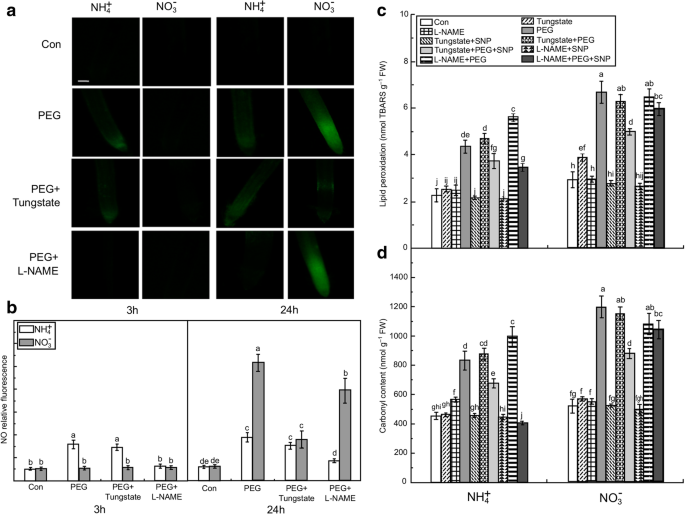
NH根尖内源性一氧化氮(NO)的产生和氧化损伤的组织化学检测GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba- - -没有GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba水分胁迫下的水稻幼苗。(GydF4y2Ba一种GydF4y2Ba)NO的检测使用DAF-FM DA染色和荧光显微镜荧光。NO产生是由绿色荧光指示。Bar = 300 μm。(GydF4y2BaB.GydF4y2BaNO的产生以相对荧光的形式表达。分别在0、3、6、12、24和48 h采集10% PEG处理下的幼苗根系,检测NO产生的时间过程。(GydF4y2BaCGydF4y2Ba) 和 (GydF4y2BaD.GydF4y2Ba水分胁迫下水稻幼苗根尖脂质过氧化和伊文思蓝吸收衍生醛的组织化学检测水稻幼苗分别接受3 h和24 h的水分胁迫。根用希夫试剂染色(GydF4y2BaCGydF4y2Ba)和伊文思蓝(GydF4y2BaD.GydF4y2Ba),然后立即在Leica S6E立体显微镜(莱卡,莲,德国)下拍摄。红色/紫色指示与希夫试剂检测出的脂质过氧化的存在。Bar = 1 mm. Endogenous NO concentrations and histochemical detection of oxidative damage in the root are given. In Fig.2GydF4y2Bab,红色圆点椭圆形表示NH内源NO产量高GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba- - -没有GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba- 分别为米饭。值代表平均值±标准误差(SE)(GydF4y2BaNGydF4y2Ba= 6)。不同的字母表示在GydF4y2BaP.GydF4y2Ba< 0.05。Con表明每个N营养的控制处理,即接受非水胁迫的植物GydF4y2Ba
通过席夫试剂和伊文思蓝染色的组织化学可视化表明,水分胁迫造成了严重的氧化性损伤,以接收所述植物的根质膜和细胞死亡NOGydF4y2Ba3.GydF4y2Ba−GydF4y2Ba,而损伤少得多中给出NH幼苗显GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba(图。GydF4y2Ba2GydF4y2Bac, d).以下对丙二醛(MDA)和羰基浓度的分析也证实了水分胁迫诱导NO根更严重的脂质过氧化GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba-处理比NH的根GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba处理幼苗(无花果。GydF4y2Ba3.GydF4y2Bac, d)。GydF4y2Ba
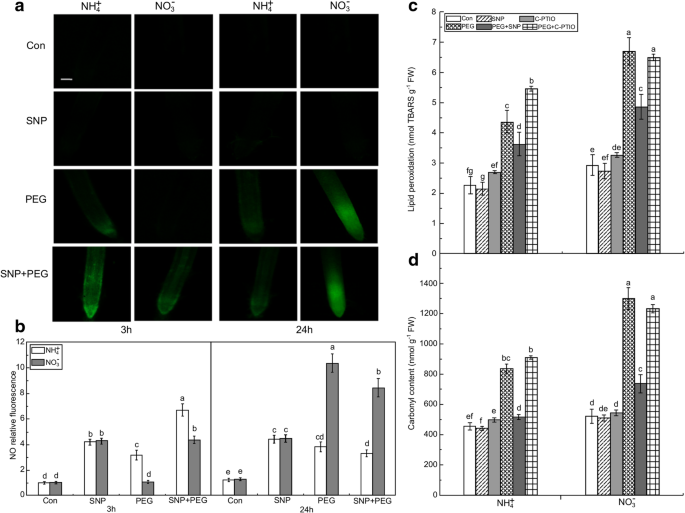
非水分胁迫(Con)和水分胁迫条件下根尖内源一氧化氮(NO)浓度和氧化损伤对NO供体(SNP)或NO清除剂(c-PTIO)的响应(GydF4y2Ba一种GydF4y2Ba) SNP处理后NO产生的照片。Bar = 300 μm。(GydF4y2BaB.GydF4y2Ba) NO的产生以相对荧光表达。在水胁迫下用SNP未经处理或治疗水稻幼苗。3小时和24小时后,用荧光显微镜20分钟加载10μmDAF-FM DA的根尖端,并且在20分钟后不会成像。展示内源性无根浓度。脂质过氧化(GydF4y2BaCGydF4y2Ba)及羰基浓度(GydF4y2BaD.GydF4y2Ba)在稻根表示的氧化性损伤。In the c-PTIO and PEG + c-PTIO treatments, the rice seedlings were pretreated with NO scavenger (c-PTIO) for 3 h followed by non-water stress or water stress. After 3 h, the contents of MDA representing lipid peroxidation and carbonyl group in rice seedling roots were determined. Values represent means ± standard error (SE) (NGydF4y2Ba= 6)。不同的字母表示在显著差异GydF4y2BaP.GydF4y2Ba< 0.05。Con表示对每种氮营养进行对照处理,即植株遭受非水分胁迫。弗兰克-威廉姆斯:鲜重;TBARS:硫氨酰氨酸反应物质GydF4y2Ba
NO供体对根系NO产生及氧化损伤的影响GydF4y2Ba
为了确定NO在耐水胁迫中的作用,我们用NO供体SNP来模拟NO的产生。采用不同浓度(0 ~ 100 μM)的SNP进行预实验,量化SNP对根氧化损伤的作用。如附加文件所示GydF4y2Ba1GydF4y2Ba图S1,≤20 μM SNP显著缓解了水分胁迫引起的根系氧化损伤。然而,SNP对根氧化损伤的修复作用在较高剂量(≥40 μM)时被逆转,说明SNP或NO含量高对根的生长有毒害作用。因此,本研究采用20 μM SNP进行NO供体实验。水分胁迫3 h后,SNP处理显著提高了两种氮营养的根系NO荧光强度。在3 h时,SNP + peg处理的NH幼苗根系中NO的产生水平分别提高了约2.05倍和3.85倍GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba和不GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba结果表明,peg处理的Con植株的根中,与peg处理的根中相比(图2)。GydF4y2Ba3.GydF4y2Baa, b).然而,在24 h的水分胁迫后,没有观察到这种现象。GydF4y2Ba
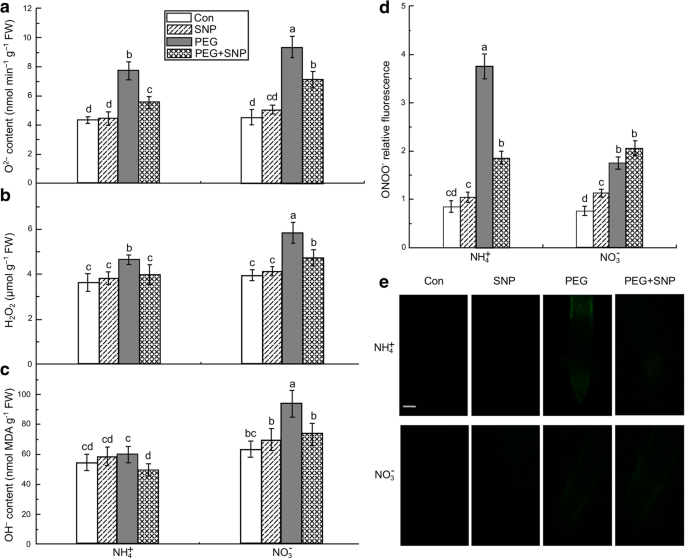
3小时后水分压力,ROS(oGydF4y2Ba2GydF4y2Ba.-GydF4y2BaHGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba,哦GydF4y2Ba−GydF4y2Ba)水平在两个NH的根增大GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba+ PEG-和NOGydF4y2Ba3.GydF4y2Ba−GydF4y2Ba + PEG-treated seedlings in relation to their Con seedlings. Under water stress, the O2GydF4y2Ba.-GydF4y2BaHGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba,哦GydF4y2Ba−GydF4y2Ba在根中给出NHGydF4y2Ba4.GydF4y2Ba+GydF4y2Ba和不GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba分别增加78.1和107.3%,28.3%和47.8%,分别为10.6和48.4%(图。GydF4y2Ba4.GydF4y2Baa - c)。根系丙二醛和羰基含量分别是NO处理的1.28倍和1.4倍GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba + PEG than in Con plants, respectively. In turn, MDA and carbonyl levels were significantly higher in NO3.GydF4y2Ba−GydF4y2Ba + PEG-treated plants than in plants given NH4.GydF4y2Ba+GydF4y2Ba+挂钩(无花果。GydF4y2Ba3.GydF4y2Bac, d).水分胁迫导致根系ONOO升高GydF4y2Ba−GydF4y2Ba在北半球GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba- 植物植物比没有GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba处理幼苗(无花果。GydF4y2Ba4.GydF4y2Bad),和外源性NO应用显著还原水应激诱导> ROS(OGydF4y2Ba2GydF4y2Ba.-GydF4y2Ba和HGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba)积累和氧化损伤(以MDA和羰基反映)。GydF4y2Ba3.GydF4y2Ba那GydF4y2Ba4.GydF4y2Ba).GydF4y2Ba
ROS和ONOOGydF4y2Ba−GydF4y2Ba积累在与NO供体(SNP)和处理过的任一接收非水胁迫(CON)或者使用PEG遭受水胁迫水稻幼苗的根顶点。After 3 h, O2GydF4y2Ba.-GydF4y2Ba(GydF4y2Ba一种GydF4y2Ba), HGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba(GydF4y2BaB.GydF4y2Ba),和OHGydF4y2Ba−GydF4y2Ba(GydF4y2BaCGydF4y2Ba),用分光光度法测定。ONOOGydF4y2Ba-GydF4y2Ba生产表达为相对荧光(GydF4y2BaD.GydF4y2Ba).ONOO的积累GydF4y2Ba-GydF4y2Ba用10μΜ氨基苯基荧光素检测到的(GydF4y2BaE.GydF4y2Ba), Bar = 300 μm。荧光图像和相对荧光强度分析如图所示。GydF4y2Ba2GydF4y2Ba对确定为NO。值代表平均值±标准误差(SE)(GydF4y2BaNGydF4y2Ba= 6)。不同的字母表示在显著差异GydF4y2BaP.GydF4y2Ba< 0.05。Con表示对每种氮营养进行对照处理,即植株遭受非水分胁迫。FW:鲜重GydF4y2Ba
确定水应激诱导的氧化性损伤由SNP缓解是否与NO产生时,NO清除剂的c-PTIO物施用于植物。After pretreatment with 100 μM c-PTIO for 3 h, the alleviation of root oxidative damage induced by SNP application under water stress was reversed (Fig.3.GydF4y2Bac, d). c- ptio清除内源性NO显著加剧了NH的根系氧化损伤GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba- 治疗植物,但对NO没有显着影响GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba-处理过的植物,与peg处理过的植物相比。因此,在NH中观察到水分胁迫引起的早期NO破裂GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba-处理的植物通过减少ROS,如OGydF4y2Ba2GydF4y2Ba.-GydF4y2Ba和HGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba.GydF4y2Ba
内源NO来源GydF4y2Ba
植物内源NO的产生主要是由NR和NOS活性驱动[GydF4y2Ba4.GydF4y2Ba].水分胁迫增加了NO的NR活性GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba-treated roots, and this activity was higher at 24 h than it was at 3 h of water stress (Additional file2GydF4y2Ba:图S2a)。NOS活性在水分胁迫3 h显著升高,NH显著升高GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba-处理比NOGydF4y2Ba3.GydF4y2Ba−GydF4y2Ba-treated根(附加文件GydF4y2Ba2GydF4y2Ba:图S2b中)。与此相反,水胁迫抑制NOS活性NOGydF4y2Ba3.GydF4y2Ba−GydF4y2Ba- 在24小时的生根。分别抑制NR和NOS活动的钨酸盐和L-NAME用于识别NH中未爆发的起源GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba治疗根(GydF4y2Ba25.GydF4y2Ba].L-NAME显著抑制NH内源NO的产生GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba-处理根系在3 h水分胁迫下,对no无显著影响GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba治疗的根源。在24 h时,钨酸盐和L-NAME的应用抑制NO的产生GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba,钨酸盐有较强的抑制作用。钨酸盐对nhh中no的生成无显著影响GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba治疗根(图。GydF4y2Ba5.GydF4y2Baa,b)。GydF4y2Ba
硝酸还原酶抑制剂(钨酸盐)和一氧化氮合酶抑制剂(L-NAME)对水稻幼苗根尖NO含量及氧化损伤的影响用NR抑制剂(100 μM钨酸盐)或NOS抑制剂(100 μM L-NAME)预处理水稻幼苗3 h,再进行水处理。(GydF4y2Ba一种GydF4y2Ba)没有荧光。Bar = 300 μm。(GydF4y2BaB.GydF4y2Ba) NO的产生以相对荧光表达。代表脂质过氧化的MDA含量(GydF4y2BaCGydF4y2Ba)和羰基(GydF4y2BaD.GydF4y2Ba钨酸盐和L-NAME预处理后,水处理3 h后,测定水稻幼苗根系的活性。值代表平均值±标准误差(SE) (GydF4y2BaNGydF4y2Ba= 6)。不同的字母表示在显著差异GydF4y2BaP.GydF4y2Ba< 0.05。Con表示对每种氮营养进行对照处理,即植株遭受非水分胁迫。弗兰克-威廉姆斯:鲜重;TBARS:硫氨酰氨酸反应物质GydF4y2Ba
在预处理3小时后,在预处理100μMC-PTIO的预处理后,SNP对缓解水胁迫诱导的根氧化损伤的影响。NoS抑制剂L-名称的应用显着加剧了水分胁迫诱导的NH中的氧化损伤GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba硝态氮处理的根系,SNP处理逆转了NOS抑制剂的作用,但没有逆转NR抑制剂的作用(图2)。GydF4y2Ba5.GydF4y2Bac, d)GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba- 处理的根,NR抑制剂或氧化氮合成酶抑制剂的应用对相对于水胁迫处理根氧化损伤无显著效果。GydF4y2Ba
抗氧化酶活性及硝酸盐/亚硝酸盐和精氨酸/瓜氨酸代谢GydF4y2Ba
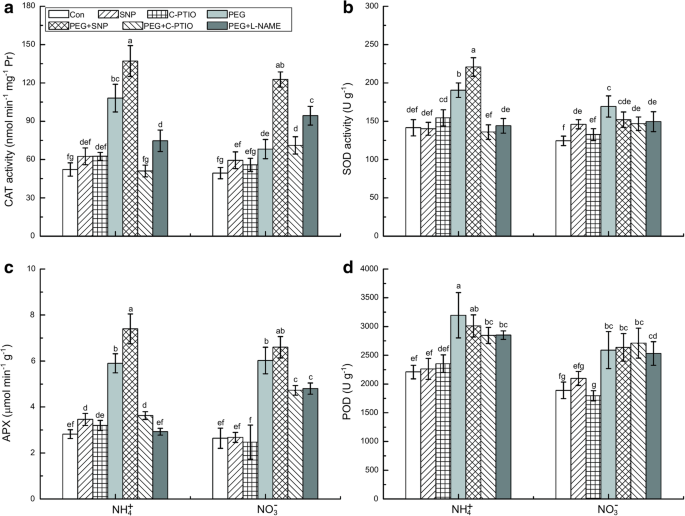
水胁迫significantly enhanced the activities of the root antioxidant enzymes catalase (CAT), superoxide dismutase (SOD), ascorbate peroxidase (APX), and peroxidase (POD) by ~ 107 and 38%, 52 and 36%, 152 and 128%, and 45 and 37% in the NH4.GydF4y2Ba+GydF4y2Ba-处理的根和NOGydF4y2Ba3.GydF4y2Ba−GydF4y2Ba- 与它们的锥体相比,分别的根系(图。GydF4y2Ba6.GydF4y2Ba).而SNP处理进一步提高了CAT、SOD和APX活性(图2)。GydF4y2Ba6.GydF4y2Ba在NH中,NO清除剂c-PTIO和NOS抑制剂L-NAME对这些抗氧化酶均有抑制作用GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba- 在水胁迫下的根源。GydF4y2Ba
不同治疗对水胁迫下水稻幼苗抗氧化酶变化的影响。收集根部以分析猫(GydF4y2Ba一种GydF4y2Ba)、SOD (GydF4y2BaB.GydF4y2Ba)、APX型(GydF4y2BaCGydF4y2Ba)和豆荚(GydF4y2BaD.GydF4y2Ba无水胁迫(Con)或水胁迫(water stress)处理3 h后。c-PTIO、PEG + c-PTIO和PEG + L-NAME处理分别用NO清除剂(c-PTIO)或NOS抑制剂(100 μM L-NAME)预处理水稻幼苗3 h,然后进行无水胁迫或水分胁迫。值代表平均值±标准误差(SE)(GydF4y2BaNGydF4y2Ba= 6)。不同的字母表示在显著差异GydF4y2BaP.GydF4y2Ba< 0.05。Con表明每个N营养的控制处理,即接受非水胁迫的植物GydF4y2Ba
随着NO中NR和NOS活性的增加GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba- 处理的根,水分胁迫降低在NR通路和在NOS途径中的精氨酸水平的硝酸盐水平(附加文件GydF4y2Ba3.GydF4y2Ba:图S3a中,b)中。同样,NR抑制剂和NOS抑制剂的应用增强的硝酸根和精氨酸含量分别。在NHGydF4y2Ba4.GydF4y2Ba+GydF4y2Ba-处理的根系,水分胁迫显著降低了精氨酸水平,说明精氨酸代谢相对较高。在此处理下,NR抑制剂对根精氨酸含量无显著影响。另一方面,NOS抑制剂抑制精氨酸代谢,从而抑制NHGydF4y2Ba4.GydF4y2Ba+GydF4y2Ba-处理根的精氨酸水平高于Con根(附加文件GydF4y2Ba3.GydF4y2Ba:图S3C)。这些结果也间接表明,NO早期生产中NH突发GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba-处理的根可能来源于NOS通路。GydF4y2Ba
讨论GydF4y2Ba
充足的实验证据表明,NO是参与植物非生物胁迫[GydF4y2Ba17.GydF4y2Ba].然而,据我们所知,没有详细的研究已进行评估在没有提供植物NO的干旱驯化中的作用GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba或NH.GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba.在本研究中,与非水分胁迫条件相比,水分胁迫21 d后,植物生物量、根氮吸收速率和叶片光合作用均降低(图2)。GydF4y2Ba1GydF4y2Ba).然而,这些减少是不太严重的,用于接收NH苗GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba,表明NHGydF4y2Ba4.GydF4y2Ba+GydF4y2Ba营养比NO更能有效提高水稻幼苗的抗旱性GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba营养[GydF4y2Ba2GydF4y2Ba那GydF4y2Ba33.GydF4y2Ba].O.ur study also demonstrated that, in the short term (48 h), endogenous NO production in response to water stress is time-dependent, varying according to water stress duration and N nutrition. This finding is consistent with those reported for other stressors [10.GydF4y2Ba那GydF4y2Ba25.GydF4y2Ba].Early NO bursts were induced at 3 h of water stress in the roots of NH4.GydF4y2Ba+GydF4y2Ba-处理的幼苗,但不含NOGydF4y2Ba3.GydF4y2Ba−GydF4y2Ba治疗过的苗。因此,有可能是NH之间显著差异GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba- - -没有GydF4y2Ba3.GydF4y2Ba−GydF4y2BaNO信号介导的抗旱性。此外,活性氧的积累,如OGydF4y2Ba2GydF4y2Ba.-GydF4y2Ba,哦GydF4y2Ba−GydF4y2Ba,和HGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba,根氧化损伤显著降低GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba-处理比NOGydF4y2Ba3.GydF4y2Ba−GydF4y2Ba-treated roots at 3 h of water stress (Fig.4.GydF4y2Ba).在不同的非生物胁迫下,ROS的过度积累会损伤细胞和细胞膜[GydF4y2Ba11.GydF4y2Ba].在NH中观察到的早期NO爆发是否是对水分胁迫的响应GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba-supplied苗起着植物抗氧化防御系统至关重要的作用需要进一步调查,但是。GydF4y2Ba
早期没有爆裂在NH的水胁迫耐受性中的作用GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba−/不GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba用NO供体和食腐动物证实。我们的研究表明NO供体诱导NO在NO中GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba在水分胁迫3 h,而在24 h时则没有。GydF4y2Ba3AGydF4y2Ba).施用NO供体后,水分胁迫下植物ROS积累、MDA和羰基水平显著降低(图2)。GydF4y2Ba3 c, dGydF4y2Ba).尽管如此,这些物质的水平在没有更高GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba-处理过的根比NH多GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba治疗的根源。因此,外源NO供体在3 h时增加NO的产生,可以缓解水胁迫诱导的NO氧化损伤GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba治疗的根源。另一方面,c-PTIO等NO清除剂对早期NO破裂的清除显著加剧了水应激诱导的氧化损伤(图2)。GydF4y2Ba3 c, dGydF4y2Ba).这些结果提供了直接的证据,说明早期NO爆发在NH的耐旱性中起着重要的作用GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba治疗的根源。因为北半球GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba-supplied根保持了较高的氮吸收率比NOGydF4y2Ba3.GydF4y2Ba−GydF4y2Ba水分胁迫下的根系(图GydF4y2Ba1FGydF4y2Ba),我们假设较高的NHGydF4y2Ba4.GydF4y2Ba+GydF4y2Ba摄取率是为早期NO突发有利的,因为参与根氮代谢NO生产[GydF4y2Ba13.GydF4y2Ba那GydF4y2Ba34.GydF4y2Ba].这种NO的爆发也可能是植物对非生物胁迫的积极适应机制,因为除了干旱胁迫外,有报道称它在受病原体挑战的植物中反复发生[GydF4y2Ba35.GydF4y2Ba、金属毒性[GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba25.GydF4y2Ba]和冷压力[GydF4y2Ba36.GydF4y2Ba].GydF4y2Ba
我们的研究进一步证实了早期NO爆裂通过增强根的抗氧化防御系统提高植物耐旱性。响应于水胁迫升高植物抗氧化酶活性和基因表达水平已被广泛证实[GydF4y2Ba12.GydF4y2Ba那GydF4y2Ba14.GydF4y2Ba那GydF4y2Ba18.GydF4y2Ba].在本研究中,否的提示GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba-处理的根系表现出更严重的水分胁迫诱导的氧化损伤(由于O的过量产生GydF4y2Ba2GydF4y2Ba.-GydF4y2Ba,哦GydF4y2Ba−GydF4y2Ba,和HGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba),而非NHGydF4y2Ba4.GydF4y2Ba+GydF4y2Ba治疗根(无花果。GydF4y2Ba2GydF4y2Ba-GydF4y2Ba4.GydF4y2Ba).相比之下,nhGydF4y2Ba4.GydF4y2Ba+GydF4y2Ba- 浮出的根部保持相对较高较高的抗氧化酶(猫,SOD和APX)活性水平以催化oGydF4y2Ba2GydF4y2Ba.-GydF4y2Ba和HGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba分解(图GydF4y2Ba6.GydF4y2Ba).植物体内NO和ROS之间存在明显的串扰。一氧化氮的抗氧化作用可通过其降低H的能力来解释GydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba和脂质过氧化,并诱导抗氧化基因表达和酶活性[GydF4y2Ba1GydF4y2Ba那GydF4y2Ba14.GydF4y2Ba].我们的研究结果表明,增强NO的水平和抗氧化酶活性(CAT和SOD)之后在NO NO供体应用进行了显著并且同时增加GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba-Treated根,从而降低ROS浓度和氧化损伤(图。GydF4y2Ba3.GydF4y2Ba那GydF4y2Ba6.GydF4y2Ba).在NH中观察到的早期NO爆发GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba治疗过的根可以增强抗氧化酶活性和活性氧的积累(OGydF4y2Ba2GydF4y2Ba.-GydF4y2Ba,哦GydF4y2Ba−GydF4y2Ba,和HGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba).这些结果在随后的实验中得到了证实,NO清除剂显著抑制了NH中的SOD和CATGydF4y2Ba4.GydF4y2Ba+GydF4y2Ba治疗的根源。因此,在NH耐旱GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba-处理的根可能与no诱导的抗氧化酶上调和ROS积累下调有关。GydF4y2Ba
一氧化氮也可以作为活性氮物种(RNS)的来源。非生物胁迫下RNS的过度积累会引起酪氨酸硝化和CAT、锰依赖(Mn-)SOD、GR等蛋白的失活,以及细胞色素的过氧化物活性GydF4y2BaCGydF4y2Ba[GydF4y2Ba37.GydF4y2Ba那GydF4y2Ba38.GydF4y2Ba].我们的研究结果表明,NOGydF4y2Ba3.GydF4y2Ba−GydF4y2Ba水分胁迫24 h后,植物的氧化损伤更严重,并积累了极高的NO水平。GydF4y2Ba3.GydF4y2Ba).This latent NO production can be partially alleviated by replenishing the early NO burst at 3 h with SNP. These results indicate that both ROS and RNS metabolism participate in the water stress response. High NO accumulation in the NO3.GydF4y2Ba−GydF4y2Ba- 治疗的根可能在24小时引起亚硝化胁迫,这也受损了根氧化还原平衡。在经受冷的植物中描述了类似的现象[GydF4y2Ba39.GydF4y2Ba],盐度[GydF4y2Ba40.GydF4y2Ba],和干旱[GydF4y2Ba7.GydF4y2Ba)压力。因为NO与氧气竞争细胞色素GydF4y2BaCGydF4y2Ba氧化酶结合(复杂IV),它会影响呼吸链和氧化磷酸化[GydF4y2Ba41.GydF4y2Ba那GydF4y2Ba42.GydF4y2Ba].因此,在水分胁迫下,NO产量较高GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba-处理过的根比NH多GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba处理后的根会加重呼吸抑制,引起更大的氧化损伤。GydF4y2Ba
我们的调查还表明,NO月初NH爆GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba-Treated根主要是由NoS在水分胁迫的早期阶段介导的。硝酸盐还原酶介导的未知在水资源赤字下会发生[GydF4y2Ba19.GydF4y2Ba那GydF4y2Ba43.GydF4y2Ba].还证明了植物中NOS样酶的干旱诱导,但由于物种,组织类型和植物生长条件,这无生产途径显着变化[GydF4y2Ba29.GydF4y2Ba那GydF4y2Ba30.GydF4y2Ba].在北半球GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba-处理的根系在水分胁迫3 h时NOS活性和NO产量同时增加,而施用NOS抑制剂则完全抑制了NO的合成。NOS抑制剂也加重了水分胁迫诱导的膜脂过氧化和氧化蛋白损伤,提示某些NOS相关蛋白可能在no介导的干旱保护反应中发挥重要作用[GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba23.GydF4y2Ba].相比之下,NR抑制剂没有显着影响没有生产或膜脂质过氧化。L-NAME的脂质过氧化的加剧可能是NOS介导早期没有爆裂的改变的结果。不,GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba处理24 h后,水分胁迫对NR活性的提高显著高于NOS活性的提高。然而,单独施用NR抑制剂和NOS抑制剂只能部分抑制NO的产生。因此,NR途径产生的NO可能在随后(24 h)的NO产生中发挥重要作用,这与之前的报道一致[GydF4y2Ba18.GydF4y2Ba那GydF4y2Ba19.GydF4y2Ba].虽然一些研究支持高等植物中精氨酸依赖的NO生产模式,但在这些植物中编码NOS的基因的鉴定仍存在争议[GydF4y2Ba28.GydF4y2Ba].因此,确定NR和NOS途径中硝酸盐/亚硝酸盐和精氨酸/瓜氨酸水平,分别测定。结果发现,水分应激显着增加了NOS活性,并加速了氮素中的精氨酸至瓜氨酸的转化。然而,与锥根根相关,在NH中,精氨酸含量明显增强GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba-处理后的根施用NOS抑制剂。这些结果提供了NH中早期NO爆发的额外证据GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba-处理的根主要由NOS介导(图。GydF4y2Ba7.GydF4y2Ba).GydF4y2Ba
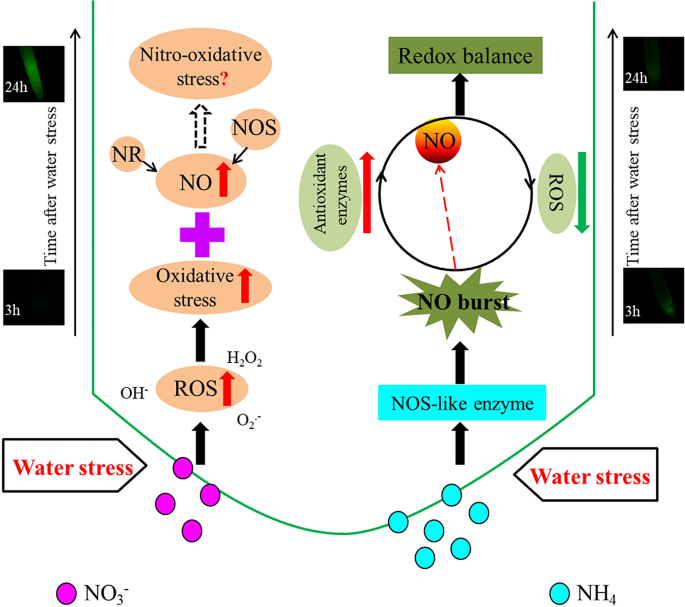
早期NO产生的不同反应及其对水稻水分胁迫防御反应的影响的模型示意图在NH的根中GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba-supplied rice, the NOS-mediated early NO burst (3 h) significantly enhanced plant antioxidant defense by reducing ROS accumulation and enhancing antioxidant enzyme activity; the relative lower NO production after 24 h of water stress in comparison to NO3.GydF4y2Ba−GydF4y2Ba水稻根系细胞的氧化还原平衡也得到维持,从而增强了其抗旱能力。在NO的根GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba水分胁迫3 h后,活性氧积累量和氧化损伤均显著高于NHGydF4y2Ba4.GydF4y2Ba+GydF4y2Ba提供大米。NO在NO中积累量高GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba水分胁迫24 h时,根系可能发生亚硝化胁迫。氧化胁迫和硝化胁迫的共同作用可能导致NO对水分胁迫的抵抗力较弱GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba提供大米。NR,硝酸还原酶。红色箭头表示增加;绿色箭头表示减小。黑色实心箭头表示已定义的路径,虚线箭头表示未定义的路径GydF4y2Ba
结论GydF4y2Ba
我们的研究表明,NH中早期的NO爆发GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba根系通过减少活性氧积累和提高抗氧化酶活性,显著增强植物抗氧化防御能力,从而提高植物对水分胁迫的适应能力。根系中nos类酶可能是响应水分胁迫而产生的早期NO爆发的导火索。我们的研究结果为no信号分子如何调节NH的耐旱性提供了新的见解GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba- 水稻植物。然而,在将来,遗传和分子技术提供的明确证据仍然需要开发出遗传和分子技术的途径,以实现在水缺陷下没有生物合成和信号通路的目标特异性编辑。GydF4y2Ba
方法GydF4y2Ba
植物材料和生长条件GydF4y2Ba
米 (GydF4y2Ba栽培稻GydF4y2BaL.'浙优1号混合GydF4y2BaindicGydF4y2Ba)苗,由中国水稻研究所获得的,在温室中的水培。种子在1%中灭菌(GydF4y2BaV.GydF4y2Ba/ v)的次氯酸钠溶液。After germination, seeds were transferred to a 0.5 mM CaCl2GydF4y2Ba溶液(pH 5.5)。三天后,将幼苗转移到1.5-L黑色塑料罐,含有以下组成的溶液:NHGydF4y2Ba4.GydF4y2Ba没有GydF4y2Ba3.GydF4y2Ba(0.5 mM), NaH2GydF4y2Ba阿宝GydF4y2Ba4.GydF4y2Bah·2GydF4y2Ba2GydF4y2BaO (0.18 mM), KCl (0.18 mM), CaClGydF4y2Ba2GydF4y2Ba(0.36 mM), MgSO4.GydF4y2Ba·7小时GydF4y2Ba2GydF4y2BaO(0.6毫米),MNCLGydF4y2Ba2GydF4y2Ba·4HGydF4y2Ba2GydF4y2BaO.(9. μM), Na2GydF4y2BaMoOGydF4y2Ba4.GydF4y2Ba·4HGydF4y2Ba2GydF4y2BaO.(0.1 μM), H3.GydF4y2Ba博GydF4y2Ba3.GydF4y2Ba(10 μM), ZnSO4.GydF4y2Ba·7小时GydF4y2Ba2GydF4y2BaO (0.7 μM), CuSOGydF4y2Ba4.GydF4y2Ba(0.3 μM), and FeSO4.GydF4y2Ba·7小时GydF4y2Ba2GydF4y2BaO-EDTA(乙二胺四乙酸)(20μm)。在以下条件下,在受控的生长室中进行所有实验:14/10H光/暗光周期,400μmol·mGydF4y2Ba− 2·秒GydF4y2Ba- 1GydF4y2Ba光照强度,白天和晚上分别为28/23°C,相对湿度为60%。用5 mM 2-(GydF4y2BaNGydF4y2Ba吗啉代)乙磺酸(MES)。该解决方案是每3天更换。GydF4y2Ba
After 6 days, seedlings of similar size were cultivated under the four following treatments: 1 mM NO3.GydF4y2Ba−GydF4y2Ba, 1 mMGydF4y2Ba3.GydF4y2Ba−GydF4y2Ba + 10% PEG (PEG-6000), 1 mM NH4.GydF4y2Ba+GydF4y2Ba和1毫米NHGydF4y2Ba4.GydF4y2Ba+GydF4y2Ba+ 10% PEG-6000. Water stress was induced by adding 10% PEG-6000. Eight treatments were performed in the NO donor (SNP) experiments: NH4.GydF4y2Ba+GydF4y2Ba,在北半球GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba+ SNP, NHGydF4y2Ba4.GydF4y2Ba+GydF4y2Ba+挂钩- 6000,NHGydF4y2Ba4.GydF4y2Ba+GydF4y2Ba+ peg-6000 + snp,不GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba,没有GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba+ SNP,没有GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba + PEG-6000, and NO3.GydF4y2Ba−GydF4y2Ba + PEG-6000 + SNP. The final SNP concentration was 20 μM. Each treatment had six replicates. For each N nutrition, plants cultivated under non-water stress condition were defined as the control (Con) relative to the water stress (PEG) condition.
To determine the role of NO in the plant antioxidant defense system under water stress, rice seedlings supplied with 1 mM NO3.GydF4y2Ba−GydF4y2Ba或1毫米NHGydF4y2Ba4.GydF4y2Ba+GydF4y2Basolution were pretreated with 100 μΜ c-PTIO (as NO scavenger) for 3 h, and then subjected to non-water stress (Con treatment) or water stress (PEG) for 24 h under the same condition as those described above. Each treatment had six replicates.
探讨在水胁迫下产生的内源性的起源,米幼苗提供1毫米的幼苗GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba或1毫米NHGydF4y2Ba4.GydF4y2Ba+GydF4y2Basolution were pretreated with the NR inhibitor (tungstate, 100 μΜ) or NOS inhibitor (L-NAME, 100 μΜ) for 3 h, and then subjected to non-water stress (Con) or water stress for 24 h under the same conditions as described above. There were eight treatments for each N nutrition: tungstate, L-NAME, tungstate + SNP, PEG-6000 + tungstate, PEG-6000 + tungstate + SNP, L-NAME + SNP, PEG-6000 + L-NAME, and PEG-6000 + L-NAME + SNP. Each treatment had six replicates.
NO和ONOO的测定GydF4y2Ba−GydF4y2Ba内容GydF4y2Ba
采用DAF-FM DA探针测定内源根NO水平[GydF4y2Ba25.GydF4y2Ba].根尖(1 cm)用10 μM DAF-FM DA在黑暗中孵育30分钟,用20 mM HEPES-KOH (pH 7.4)洗涤3次,去除多余的荧光,然后在尼康Eclipse 80i荧光显微镜下观察和拍照(尼康,东京,日本;激励滤波器460-500 nm,二色镜505 nm,屏障滤波器510-560)。使用Photoshop v. 7.0 (Adobe Systems, Mountain View, CA, USA)测量相对荧光强度。GydF4y2Ba
根内源性ONOOGydF4y2Ba−GydF4y2Ba采用氨基苯基荧光素(APF)探针法测定[GydF4y2Ba44.GydF4y2Ba].Root tips were incubated with 10 μM APF dissolved in 10 mM Tris–HCl (pH 7.4) in the dark for 60 min, and then washed three times with 10 mM Tris–HCl. Fluorescence images and relative fluorescence intensities were analyzed as described above for NO.
组织化学分析GydF4y2Ba
用希夫试剂和埃文斯蓝[组织化学检测脂质过氧化和根细胞死亡GydF4y2Ba45.GydF4y2Ba].Root tips were incubated in Schiff’s reagent for 20 min and washed by three consecutive immersions in 0.5% (W.GydF4y2Ba/GydF4y2BaV.GydF4y2Ba)KGydF4y2Ba2GydF4y2BaO.GydF4y2Ba3.GydF4y2Ba的解决。红色/紫色端点表示由脂质过氧化产生的醛的存在。Roots were also washed by performing three serial immersions in distilled water, then incubated in 0.25% (w/v) Evans blue for 15 min, and finally washed three times with distilled water. Roots stained with Schiff’s reagent and Evans blue were immediately photographed under a Leica S6E stereomicroscope (Leica, Solms, Germany).
用2,4-二硝基苯肼(DNPH)测定MDA和羰基的浓度,测定氧化损伤水平,特异性表达为膜脂过氧化和蛋白质氧化损伤[GydF4y2Ba46.GydF4y2Ba].GydF4y2Ba
活性氧含量测定GydF4y2Ba
根O.GydF4y2Ba2GydF4y2Ba.-GydF4y2Ba使用Liu等人描述的方法估计内容。[GydF4y2Ba47.GydF4y2Ba将大约0.15 g新鲜根与2 mL 65 mM磷酸盐缓冲盐水(PBS, pH为7.8)在预冷的砂浆中粉末状,并在5000℃离心GydF4y2BaGGydF4y2Ba和4°C 10分钟。然后将0.9 mL 65 mM PBS (pH 7.8)和0.1 mL 10 mM羟氯化铵加入到1 mL根提取物上清中,充分混合,静置反应25分钟。在此期间后,1ml 1% (GydF4y2BaW.GydF4y2Ba/GydF4y2BaV.GydF4y2Ba) 1 mL of 0.02% (w/v)GydF4y2BaNGydF4y2Ba-(1-萘基)-乙二胺二盐酸盐加入到1 mL根提取物溶液中反应30 min。在540 nm处测定吸光度。GydF4y2Ba
根H.GydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba用光比色法测定含量[GydF4y2Ba48.GydF4y2Ba]: ~ 0.15 g fresh root was powdered with 2 mL acetone in a pre-cooled mortar, and centrifuged at 5000 GGydF4y2Ba和4°C 10分钟。然后,0.1 mL的5% (w/v) tissoGydF4y2Ba4.GydF4y2Ba和0.1 mL pre-cooled ammonium hydroxide were added to 1 mL of the root extract supernatant, which was re-centrifuged at 5000 GGydF4y2Ba10分钟。丢弃上清液,将沉淀物用4 mL的2 M H重新溶解GydF4y2Ba2GydF4y2Ba所以GydF4y2Ba4.GydF4y2Ba.在415 nm处测定根提取物溶液的吸光度。GydF4y2Ba
OH根GydF4y2Ba−GydF4y2Ba含量是通过在先前的研究中所述的方法进行分析[GydF4y2Ba49.GydF4y2Ba]: ~ 0.1 g fresh root was powdered with 3 mL of 50 mM PBS (pH 7.0) in a mortar, and centrifuged at 10,000 GGydF4y2Ba和4°C 10分钟。Then, 1.0 mL of 25 mM PBS (pH 7.0) containing 5 mM 2-deoxy-D.GydF4y2Ba-核糖和0.2 mM NADH加入1 mL根提取物上清液中,完全混合,静置35°C黑暗反应60 min。孵育后,滤液中加入1 mL 1% (w/v)硫代巴比妥酸和1 mL冰醋酸。将混合物加热到100°C 30分钟,然后放在冰上20分钟。测定根提取物溶液在532 nm处的吸光度和OH值GydF4y2Ba−GydF4y2Ba从MDA的生产推断内容。GydF4y2Ba
酶活性测定GydF4y2Ba
新鲜大米根样品(0.5 g)均质于5 mL 10 mM磷酸盐缓冲液(pH 7.0)中,缓冲液中含有4% (w/v)聚乙烯吡罗烷酮和1 mM乙二胺四乙酸。上清液为粗酶溶液,12000离心收集GydF4y2BaGGydF4y2Ba4°C, 15分钟。利用Jiang和Zhang所述的光比色法测定SOD、CAT、APX和POD的活性[GydF4y2Ba11.GydF4y2Ba],和Sachadyn-Krol等。[GydF4y2Ba50.GydF4y2Ba].GydF4y2Ba
根系NR和NOS活性测定采用前人研究的方法[GydF4y2Ba25.GydF4y2Ba那GydF4y2Ba26.GydF4y2Ba,只做了一些修改。简单地说,用含有100 mM HEPES-KOH (pH 7.5)、1 mM EDTA、10% (GydF4y2BaV.GydF4y2Ba甘油、5 mM 1,4-二硫苏糖醇(DTT)、0.5 mM苯甲基磺酰氟、0.1% Triton X-100 (v/v)、1%聚乙烯吡咯烷酮(PVP)和20 μM黄素腺嘌呤二核苷酸。12,000离心收集上清GydF4y2BaGGydF4y2Ba和4°C处理20 min后,分别在520 nm和340 nm处测定NR和NOS活性。GydF4y2Ba
具体地,通过将250μl上清液与含有50mM Hepes-KOH(pH7.5),10mM MgCl(pH7.5)的250μl预热(25℃)测定缓冲液混合,立即测量NR的活性。GydF4y2Ba2GydF4y2Ba, 1毫米DTT, 2毫米KNOGydF4y2Ba3.GydF4y2Ba200 μM NADH。先加入缓冲液启动反应,30℃孵育30 min,再加入50 μL 0.5 M醋酸锌停止反应。将1 mL 1%磺胺加入3 M盐酸中,加1 mL 0.02%的磺胺,在540 nm处比色法测定产生的亚硝酸盐GydF4y2BaNGydF4y2Ba-(1-萘基)乙二胺,0.2 M HCl。在1 mL的反应混合物中检测NOS活性,其中包含100 mM磷酸盐缓冲液(pH 7.0)、1 mM lavo -arg (L-Arg)、2 mM MgClGydF4y2Ba2GydF4y2Ba那0.3 mM CaCl2GydF4y2Ba那4. μM BH4.GydF4y2Ba、1 μM FAD、1 μM黄素单核苷酸(FMN)、0.2 mM DTT、0.2 mM NADPH和200 μL蛋白提取物。在340 nm作用5 min,测定NADPH消耗导致的吸光度下降。利用NADPH的消光系数(ɛ= 6.22 mM)计算NOS活性GydF4y2Ba- 1GydF4y2Ba·厘米GydF4y2Ba- 1GydF4y2Ba).GydF4y2Ba
精氨酸和瓜氨酸的测定GydF4y2Ba
使用Salazar等人描述的方法估计精氨酸和瓜氨酸含量。[GydF4y2Ba51.GydF4y2Ba].简而言之,1.0g根样品在液体中冷冻GydF4y2Ba2GydF4y2Ba用4 mL 80% (v/v)甲醇提取,10000离心GydF4y2BaGGydF4y2Ba和4. °C for 5 min. The supernatant was then used in derivatization and reaction processes. Serial concentrations of amino acid standards were prepared as described above for the derivatizing reagent, and the derivatizing samples were used to determine the arginine and citrulline contents using liquid chromatography/electrospray ionization tandem mass spectroscopy (LC-ESI-MS).
统计分析GydF4y2Ba
本研究的所有实验至少有6个重复。所有数据以均数±标准误差(SE)表示,在SPSS v. 13.0 (IBM公司,Armonk, NY, USA)中进行处理。采用最小显著差异(LSD)检验确定各处理(GydF4y2BaP.GydF4y2Ba < 0.05). Figures were drawn in Origin v. 8.0 (OriginLab Corporation, Northampton, MA, USA).
缩写GydF4y2Ba
- 阿坝:GydF4y2Ba
-
脱盐酸GydF4y2Ba
- APF:GydF4y2Ba
-
AminophenylfluoresceinGydF4y2Ba
- APX:GydF4y2Ba
-
抗坏血酸盐过氧化物酶GydF4y2Ba
- 猫:GydF4y2Ba
-
催化剂GydF4y2Ba
- c-PTIO:GydF4y2Ba
-
2 - (4-carboxyphenyl) 4、4、5,5-tetramethylimidazoline-1-oxyl-3-oxideGydF4y2Ba
- DAF-FM DA:GydF4y2Ba
-
Diaminofluorescein-FM双乙酸钠GydF4y2Ba
- DNPH:GydF4y2Ba
-
2,4-二硝基苯GydF4y2Ba
- 德勤:GydF4y2Ba
-
1, 4-dithiothreitolGydF4y2Ba
- EDTA:GydF4y2Ba
-
乙二胺四乙酸GydF4y2Ba
- FAD:GydF4y2Ba
-
黄素腺嘌呤二核苷酸GydF4y2Ba
- FMN:GydF4y2Ba
-
黄素单核苷酸GydF4y2Ba
- 格:GydF4y2Ba
-
谷胱甘肽还原酶GydF4y2Ba
- GSNO:GydF4y2Ba
-
S.GydF4y2Ba-nitrosoglutathioneGydF4y2Ba
- L-Arg:GydF4y2Ba
-
Leavo-arghinine.GydF4y2Ba
- LC-ESI-MS:GydF4y2Ba
-
液相色谱/电喷雾串联质谱GydF4y2Ba
- L-NAME:GydF4y2Ba
-
n(g) - nitro-GydF4y2BaL.GydF4y2Ba精氨酸甲酯GydF4y2Ba
- MDA:GydF4y2Ba
-
丙二醛GydF4y2Ba
- MES:GydF4y2Ba
-
2 - (GydF4y2BaNGydF4y2Ba吗啉代)ethanesulfonic酸GydF4y2Ba
- NADPH:GydF4y2Ba
-
烟酰胺腺嘌呤二核苷酸磷酸GydF4y2Ba
- 不:GydF4y2Ba
-
一氧化氮GydF4y2Ba
- 号:GydF4y2Ba
-
一氧化氮合酶GydF4y2Ba
- NR:GydF4y2Ba
-
硝酸还原酶GydF4y2Ba
- ONOOGydF4y2Ba−GydF4y2Ba:GydF4y2Ba
-
过氧亚硝基GydF4y2Ba
- PBS:GydF4y2Ba
-
磷酸盐缓冲液GydF4y2Ba
- 挂钩:GydF4y2Ba
-
聚乙二醇GydF4y2Ba
- P.GydF4y2BaNGydF4y2Ba:GydF4y2Ba
-
净光合速率GydF4y2Ba
- 荚:GydF4y2Ba
-
过氧化物酶GydF4y2Ba
- PVP:GydF4y2Ba
-
聚乙烯吡咯烷酮GydF4y2Ba
- RNS:GydF4y2Ba
-
活性氮物种GydF4y2Ba
- ROS:GydF4y2Ba
-
活性氧GydF4y2Ba
- SNP:GydF4y2Ba
-
硝普钠GydF4y2Ba
- SOD:GydF4y2Ba
-
超氧化物歧化酶GydF4y2Ba
参考文献GydF4y2Ba
- 1。GydF4y2Ba
Bogeat-Triboulot MB, Brosche M, Renaut J, Jouve L, Le Thiec D, Fayyaz P,维诺科B, E喋喋不休,Laukens K,摄影师T,奥特曼,豪斯曼J, Polle, Kangasjarvi J,德雷尔大肠渐进的土壤水分消耗导致可逆变化的基因表达,蛋白质概况、生态生理学、生长性能GydF4y2BaPopuluseuphraticaGydF4y2Ba是一种生长在干旱地区的杨树。植物杂志。2007;143:876 - 92。GydF4y2Ba
- 2。GydF4y2Ba
郭S,周Y,沉Q,张F.铵盐营养对高等植物生长,光合作用,光素和水关系的影响。植物BIOL(斯图特)。2007; 9:21-9。GydF4y2Ba
- 3.GydF4y2Ba
草茎的非结构性碳水化合物分配:提高产量稳定性、耐受性和生物燃料生产的目标。J Exp Bot. 2012; 63:4647-70。GydF4y2Ba
- 4.GydF4y2Ba
尼尔SJ,Desikan R,汉考克JT。一氧化氮在植物中的信令。新植物。2003; 159:11-35。GydF4y2Ba
- 5。GydF4y2Ba
威尔逊ID,Neill SJ,Hancock JT。植物中的一氧化氮合成和信号传导。植物细胞ENVIRON。2007; 31:622-31。GydF4y2Ba
- 6.GydF4y2Ba
Simontacchi M,Galatro A,Ramos-Artuso F,Santa-MaríaGe。改变环境中的植物存活:一氧化氮在植物反应对非生物胁迫的作用。前植物SCI。2015; 6:977。GydF4y2Ba
- 7.GydF4y2Ba
西尼奥雷利S,科尔帕斯FJ,奥马BORSANI O,巴罗佐JB,蒙扎J.水分胁迫诱导根和叶的差分和空间分布的硝基 - 氧化应激反应GydF4y2BaLotus对虾GydF4y2Ba.植物SCI。2013; 201(202):137-46。GydF4y2Ba
- 8.GydF4y2Ba
赵敏,田Q,张W.一氧化氮合酶依赖的一氧化氮产量与耐盐相关GydF4y2Ba拟南芥GydF4y2Ba.植物杂志。2007;144:206-17。GydF4y2Ba
- 9。GydF4y2Ba
Gonzáleza,cabrera ml,henríquezmj,contreras ra,morales b,moenne a。钙,过氧化氢和一氧化氮中的交叉谈话和涉及钙调素和钙依赖性蛋白激酶的基因表达的激活GydF4y2Ba石莼压缩GydF4y2Ba暴露于过量的铜。植物理性。2012; 158:1451-62。GydF4y2Ba
- 10。GydF4y2Ba
Planchet E,Verdu I,Delahaie J,Cukier C,Girard C,Morère-LePaven M-C,Limami Am。在幼苗建立期间,在水缺陷应力下脱离酸诱导的一氧化氮和脯氨酸积累GydF4y2Bamedicagotruncatula.GydF4y2Ba.J Exp Bot。2014; 65:2161-70。GydF4y2Ba
- 11.GydF4y2Ba
姜呒,章J.水应激诱导的脱落酸积累触发增加的活性氧物种的和上调的玉米叶片抗氧化酶的活性。J Exp Bot。2002; 53:2401-10。GydF4y2Ba
- 12.GydF4y2Ba
范H,李T,关L,李Z,过嗯,柴Y,在抗氧化和DNA甲基化的外源性的一氧化氮的李Y.影响GydF4y2Ba霍山石斛GydF4y2Ba在干旱胁迫下生长。植物细胞组织器官邪教。2012;109:307-14。GydF4y2Ba
- 13。GydF4y2Ba
德尔里奥LA。ROS和RNS植物生理学:概述。J Exp Bot。2015; 66:2827-37。GydF4y2Ba
- 14。GydF4y2Ba
法鲁克男,巴士拉SMA,瓦希德A,拉赫曼H.外源施加一氧化氮增强了细晶粒芳香稻米的干旱耐受性(GydF4y2Ba栽培稻GydF4y2BaL.)。J Agron作物SCI。2009; 195:254-61。GydF4y2Ba
- 15.GydF4y2Ba
verdoy d,coba de lapeñat,redondo fj,lucas mm,pueyo jj。转基因GydF4y2Bamedicagotruncatula.GydF4y2Ba积聚具有增强渗透胁迫耐受性脯氨酸显示固氮活性的植物。植物细胞ENVIRON。2006; 29:1913年至1923年。GydF4y2Ba
- 16。GydF4y2Ba
张A,姜呒,张健,丁H,徐S,胡X,汤M.一氧化氮由过氧化氢诱导的介导在玉米叶参与抗氧化防御的促分裂原活化蛋白激酶级联的脱落酸诱导的活化。新植物。2007; 175:36-50。GydF4y2Ba
- 17.GydF4y2Ba
Santisree P, Bhatnagar-Mathur P, Sharma KK。NO对干旱-一氧化氮在植物干旱中的多功能作用:我们有所有的答案吗?植物科学。2015;239:44-55。GydF4y2Ba
- 18.GydF4y2Ba
李志强,李志强,李志强,等。外源一氧化氮对黄瓜根系水分胁迫响应的影响[J]。植物科学。2009;177:682 - 90。GydF4y2Ba
- 19.GydF4y2Ba
李志刚,李志刚,李志刚,等。干旱胁迫下黄瓜多胺和一氧化氮信号通路的相互作用[J]。acta botanica sinica, 2009; 29(4): 481 - 486。GydF4y2Ba
- 20.GydF4y2Ba
Großf,durner j,Gaupels f.一氧化氮,抗氧化剂和植物防御反应中的促氧化剂。前植物SCI。2013; 4:419。GydF4y2Ba
- 21.GydF4y2Ba
Corpas FJ, del Río LA, Barroso JB。植物亚硝化胁迫生物标志物的需求。植物科学进展。2007;12:436-8。GydF4y2Ba
- 22.GydF4y2Ba
廖伟,黄刚,于军,张明。一氧化氮和过氧化氢对万寿菊外植体干旱胁迫的缓解作用及其不定根的发育。植物生理与生物化学。2012;58:6-15。GydF4y2Ba
- 23.GydF4y2Ba
郭FQ,冈本男,克劳福德NM。参与激素信号植物型一氧化氮合酶基因的鉴定。科学。2003; 302:100-3。GydF4y2Ba
- 24.GydF4y2Ba
石峰,李勇。GydF4y2BaVerticilliumdahliaeGydF4y2Ba毒素诱导的一氧化氮的产生GydF4y2Ba拟南芥GydF4y2Ba是主要依赖于硝酸还原酶。BMB众议员2008; 41:79-85。GydF4y2Ba
- 25.GydF4y2Ba
Sun C,Lu L,Liu L,Liu W,Yu Y,Liu X,Jin C,Lin X.硝酸还原酶介导的早期一氧化氮突发通过提高小麦根中的抗氧化防御抗氧化防御诱导氧化损伤(GydF4y2BaTriticumaestivumGydF4y2Ba).新植醇。2014;201:1240-50。GydF4y2Ba
- 26.GydF4y2Ba
赵敏,陈蕾,张升,张W.硝酸还原酶依赖一氧化氮的产生涉及冷驯化和耐寒性在GydF4y2Ba拟南芥GydF4y2Ba.植物理性。2009; 151:755-67。GydF4y2Ba
- 27.GydF4y2Ba
Freschi L, Rodrigues MA, Domingues DS, Purgatto E, Van Sluys MA, Magalhaes JR, Kaiser WM, Mercier H.一氧化氮介导了凤梨幼苗中天红酸代谢表达的激素控制。植物杂志。2010;152:1971 - 85。GydF4y2Ba
- 28。GydF4y2Ba
Zemojtel T,弗勒利希A,Palmieri的MC,Kolanczyk男,Mikula I,Wyrwicz LS,Wanker EE,Mundlos S,Vingron男,Martasek P,Durner J.植物一氧化氮合酶:永无止境的故事?趋势植物SCI。2006; 11:524-5。GydF4y2Ba
- 29。GydF4y2Ba
科尔帕斯FJ,帕尔马JM,里奥LA,巴罗佐JB。证据支持L-精氨酸依赖一氧化氮合酶活性的存在于植物中。新植物。2009; 184:9-14。GydF4y2Ba
- 30.GydF4y2Ba
施H,叶T,诸JK,陈Z.构产生一氧化氮导致增强的干旱胁迫抗性和广泛的转录重编程的GydF4y2Ba拟南芥GydF4y2Ba.J Exp Bot。2014; 65:4119-31。GydF4y2Ba
- 31。GydF4y2Ba
杨旭,李勇,任波,丁玲,高超,沈强,郭胜。干旱诱导根系通气组织的形成对硝态氮供应水稻幼苗水分吸收的影响。植物细胞杂志GydF4y2Ba.GydF4y2Ba2012; 53:495-504。GydF4y2Ba
- 32。GydF4y2Ba
丁L,Gao C,Li Y,Li Y,Zhu Y,Xu G,Shen Q,Kaldenhoff R,Kai L,Guo S.铵下水稻植物的增强耐旱性与Aquaporin(AQP)有关。植物SCI。2015; 234:14-21。GydF4y2Ba
- 33。GydF4y2Ba
Li Y, Ren B, Yang X ., Xu G ., Shen Q ., Guo S. effects of nacl胁迫下水稻叶绿体超微结构的变化GydF4y2Ba栽培稻GydF4y2BaL.)干旱条件下。植物细胞生理。2012; 53:892-900。GydF4y2Ba
- 34。GydF4y2Ba
Corpas FJ, Chaki M, Fernández-Ocaña A, Valderrama R, Palma JM, Carreras A, Begara-Morales JC, Airaki M, Del Río LA, Barroso JB。非生物胁迫条件下豌豆活性氮的代谢acta botanica yunnanica(云南植物研究). 2008;49(4):417 - 418。GydF4y2Ba
- 35。GydF4y2Ba
Floryszak-维乔雷克Ĵ,Arasimowicz男,Milczarek G,耶伦H,Jackowiak H.只有一个早期一氧化氮突发和仲的一氧化氮产生增强的死体营养病原体的天竺葵属有效的防御响应的以下波。新植物。2007; 175:718-30。GydF4y2Ba
- 36。GydF4y2Ba
Cantrel C,Vazquez T,Puyaubert J,Rezén,Lesch M,Kaiser WM,Dutilleul C,Guillas I,Zachowski A,Baudouin E.一氧化氮参与冷敏磷酸磷脂的形成和基因表达GydF4y2Ba拟南芥蒂利亚纳GydF4y2Ba.新植物。2011; 189:415-27。GydF4y2Ba
- 37。GydF4y2Ba
Clark D, Durner J, Navarre DA, Klessig DF。一氧化氮对烟草过氧化氢酶和抗坏血酸过氧化物酶的抑制作用。植物与微生物的相互作用。2000;13:1380-4。GydF4y2Ba
- 38。GydF4y2Ba
Batthyány C, Souza JM, Durán R, Cassina A, Cerveñansky C, Radi R细胞色素的时间历程和地点GydF4y2BaCGydF4y2Ba由过氧亚硝基酪氨酸硝化。生物化学。2005; 44:8038-46。GydF4y2Ba
- 39。GydF4y2Ba
Airaki M, Leterrier M, Mateos RM, Valderrama R, Chaki M, Barroso JB, Del Río LA, Palma JM, Corpas FJ。辣椒活性氧和活性氮的代谢(GydF4y2Ba甜椒GydF4y2Ba低温胁迫下的植物。Plant Cell Environ. 2012; 35:31 - 95。GydF4y2Ba
- 40。GydF4y2Ba
基于氧化和亚硝化的信号转导和相关的翻译后修饰协调了柑橘植物对盐胁迫的适应。植物j . 2012; 72:585 - 99。GydF4y2Ba
- 41.GydF4y2Ba
米勒AH,日DA。一氧化氮抑制细胞色素氧化酶而不是植物线粒体的交替氧化酶。费用。1996; 398:155-8。GydF4y2Ba
- 42.GydF4y2Ba
Yamasaki H,Shimoji H,Ohshiro Y,Sakihama Y.一氧化氮对植物线粒体氧化磷酸化的抑制作用。一氧化氮。2001; 5:261-70。GydF4y2Ba
- 43.GydF4y2Ba
余敏,拉玛蒂娜L,斯波尔SH, Loake GJ。植物生物学中的一氧化氮功能:反褶积中的氧化还原线索。新植醇。2014;202:1142-56。GydF4y2Ba
- 44.GydF4y2Ba
烟草BY-2细胞防御反应中过氧亚硝酸盐的生成和酪氨酸硝化的研究。植物生理学报2006;47:689-97。GydF4y2Ba
- 45.GydF4y2Ba
山本Y,小林Y,松本H.脂质过氧化是一种早期症状由铝触发,而不是伸长抑制在豌豆根的首要原因。植物理性。2001; 125:199-208。GydF4y2Ba
- 46.GydF4y2Ba
Velikova V,Yordanov我,Edreva A.氧化应激和酸雨处理豆类植物的一些抗氧化系统:外源性多胺的保护作用。植物SCI。2000; 151:59-66。GydF4y2Ba
- 47.GydF4y2Ba
刘Y,吴R,皖Q,谢G,碧Y.葡萄糖-6-磷酸脱氢酶起着红芸豆的根在对抗氧化应激一氧化氮参与防守了举足轻重的作用盐胁迫下。植物细胞生理。2007; 48:511-22。GydF4y2Ba
- 48.GydF4y2Ba
王华,黄建军,毕玉英。硝酸还原酶依赖的一氧化氮生成与红芸豆根耐铝性的关系。植物科学。2010;179:281-8。GydF4y2Ba
- 49.GydF4y2Ba
赵志军,刘永强,江华,安林。一氧化氮合酶样活性依赖的一氧化氮生成对低温诱导的氧化损伤的保护作用GydF4y2BaChorisporabungeanaGydF4y2Ba悬浮培养细胞。植物理性生物化学。2010; 48:936-44。GydF4y2Ba
- 50.GydF4y2Ba
Sachadyn-Król M, Materska M, Chilczuk B, Karás M, Jakubczyk A, Perucka I, Jackowska I.臭氧对辣椒果实贮藏过程中生物活性化合物含量和酶活性的影响。食品化学。2016;211:59 - 67。GydF4y2Ba
- 51.GydF4y2Ba
Salazar的C,Armenta JM,Shulaev V的UPLC-ESI-MS / MS法测定血浆使用6- aminoquinolyl-GydF4y2BaNGydF4y2Ba-hydroxysuccinimidyl氨基甲酸酯衍生为靶向的氨基酸分析:应用程序的筛选GydF4y2Ba拟南芥蒂利亚纳GydF4y2Ba突变体。代谢物。2012;2:398-28。GydF4y2Ba
确认GydF4y2Ba
感谢Editage (GydF4y2Bahttp://www.editage.cnGydF4y2Ba)英语语言编辑。GydF4y2Ba
资金GydF4y2Ba
这项工作得到了浙江自然科学基金的支持(授予第18C130005);以及中国的国家重点研发方案(授予NO。2017YFD0300100,2016YFD0101801)。支持者在本研究和相关数据的设计,分析或解释中没有发挥任何作用。GydF4y2Ba
数据和材料的可用性GydF4y2Ba
在这项研究中产生的或分析所有的数据都包括在此发表的文章(和它的补充资料文件)英寸GydF4y2Ba
作者信息GydF4y2Ba
从属关系GydF4y2Ba
贡献GydF4y2Ba
XCC、QXM、QYJ对实验进行了构思和设计。XCC、CQZ和CZ进行了实验。XCC、LHW和JHZ对数据进行了分析。论文由XCC、QXM、CQZ撰写。所有作者阅读并批准了最终的手稿。GydF4y2Ba
相应的作者GydF4y2Ba
伦理宣言GydF4y2Ba
伦理批准和同意参与GydF4y2Ba
不适用。GydF4y2Ba
同意出版GydF4y2Ba
不适用。GydF4y2Ba
相互竞争的利益GydF4y2Ba
作者宣布没有存在竞争利益。GydF4y2Ba
出版商的注意GydF4y2Ba
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。GydF4y2Ba
附加文件GydF4y2Ba
附加文件1:GydF4y2Ba
图S1。GydF4y2Ba外源NO供体(SNP)对水分胁迫下根系氧化损伤的影响对水稻根系进行了混合氮(NH)处理GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba+ No.GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba)Nutrient solution containing 0 μM, 5 μM, 10 μM, 20 μM, 40 μM, 80 μM, or 100 μM SNP either with or without 10% PEG for 48 h. The contents of MDA representing lipid peroxidation (a) and carbonyl group (b) in rice seedling roots were determined. Values represent means ± SE (NGydF4y2Ba= 6)。不同的字母表示在显著差异GydF4y2BaP.GydF4y2Ba< 0.05。Con表示对每种氮营养进行对照处理,即植株遭受非水分胁迫。弗兰克-威廉姆斯:鲜重;TBARS:硫代巴比妥酸活性物质。(TIF 71 kb)GydF4y2Ba
额外的文件2:GydF4y2Ba
图S2。GydF4y2Ba水分胁迫对根系NR (a)和NOS (b)的影响分别在水分胁迫3 h和24 h后采集根系进行NR和NOS测定。值代表平均值±SE(GydF4y2BaNGydF4y2Ba= 6)。不同的字母表示在显著差异GydF4y2BaP.GydF4y2Ba< 0.05。Con表示对每种氮营养进行对照处理,即植株遭受非水分胁迫。(TIF 41 KB)GydF4y2Ba
额外的文件3:GydF4y2Ba
图S3。GydF4y2Ba外源性NR抑制剂(钨酸盐)和NOS抑制剂(L-NAME)对NR介导和NOS介导NO通路中相关化合物的影响(a) NO中的硝酸盐和亚硝酸盐水平GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba治疗的根源。(b) NO中精氨酸和瓜氨酸水平GydF4y2Ba3.GydF4y2Ba−GydF4y2Ba治疗的根源。(c) NH中精氨酸和瓜氨酸水平GydF4y2Ba4.GydF4y2Ba+GydF4y2Ba治疗的根源。PEG +钨酸盐和PEG + L-NAME处理分别用NR抑制剂(100 μM钨酸盐)和NOS抑制剂(100 μM L-NAME)预处理水稻幼苗3 h,然后再进行无水胁迫(Con)或水分胁迫处理。值代表平均值±SE(GydF4y2BaNGydF4y2Ba= 6)。不同的字母表示在显著差异GydF4y2BaP.GydF4y2Ba< 0.05。(TIF 69 KB)GydF4y2Ba
额外的文件4:GydF4y2Ba
方法S1。GydF4y2BaD.E.termination of leaf photosynthesis, root N uptake rate, and root nitrate and nitrite contents in rice seedlings after 21 days of non-water stress (Con) or water stress (PEG) treatment. (DOCX 14 kb)
权利和权限GydF4y2Ba
开放访问GydF4y2Ba本文根据创意公约署署署的条款分发了4.0国际许可证(GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)除非另有说明,否则适用于本文中提供的数据。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
Cao,X.,朱,C.,Zhong,C.GydF4y2Ba等等。GydF4y2Ba一氧化氮合酶介导的早期一氧化氮爆裂缓解了水分胁迫对供氨水稻根系的氧化损伤。GydF4y2BaBMC植物BIOL.GydF4y2Ba19,GydF4y2Ba108(2019)。https://doi.org/10.1186/s12870-019-1721-2GydF4y2Ba
已收到GydF4y2Ba:GydF4y2Ba
公认GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
迪伊GydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-019-1721-2GydF4y2Ba
关键词GydF4y2Ba
- 铵GydF4y2Ba
- 一氧化氮GydF4y2Ba
- 一氧化氮合酶GydF4y2Ba
- 氧化损伤GydF4y2Ba
- 抗氧化酶GydF4y2Ba
- 水胁迫GydF4y2Ba