- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
成熟叶在花诱导过程中广泛的核重编程和核内重复gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba19gydF4y2Ba,文章号:gydF4y2Ba135gydF4y2Ba(gydF4y2Ba2019gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
花的转变是一个复杂的发育过程,它受到各种环境和内源性因素的调节,以确保后代的成功繁殖。叶片是感知花的诱导信号的关键器官,如光照状态的变化,以及产生可移动的致花素。gydF4y2Ba君士坦斯gydF4y2Ba而且gydF4y2Ba开花位点tgydF4y2Ba是叶片响应光周期的主要参与者。花转变过程中的形态和分子事件已经在茎尖分生组织中得到了深入的研究。为了更好地理解叶片中较少描述的伴随过程,我们研究了完全发育的叶片在花转变过程中的核变化。gydF4y2Ba
结果gydF4y2Ba
我们强调了新的假定的叶片开花调控候选者。我们观察到与细胞、激素和代谢作用相关的基因的差异表达谱,以及编码长非编码rna和新的自然反义转录本的基因gydF4y2Ba.gydF4y2Ba此外,我们发现在花的转变过程中,倍性水平显著增加,这表明了核内重复。gydF4y2Ba
结论gydF4y2Ba
我们的数据表明,分化成熟的叶片具有生理可塑性,并在花的转变过程中进行广泛的核重编程gydF4y2Ba.gydF4y2Ba动态事件指向功能相关的转录因子网络和新的调控基序,但也复杂的激素和代谢变化。gydF4y2Ba
背景gydF4y2Ba
向开花的过渡是植物生命周期中决定繁殖成功的决定性发育事件。总的理解强调了一个涉及环境和内生线索之间复杂相互作用的微调过程。根据植物的生活方式,信号被感知和解码,并导致分生组织水平的一系列巨大形态变化,从而产生花器官[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba].gydF4y2Ba
光周期是控制植物向开花过渡的主要参数,具有复杂的向光效应,并与生物钟有关。在叶片中感知到的光信号,触发代谢产物和调控因子的积累,例如保存良好的开花位点T (FT)蛋白,其表达受参与光周期通路的锌指转录因子CONSTANS (CO)的控制[gydF4y2Ba3.gydF4y2Ba].它们的输出,作为系统致花素信号,通过脉管系统传递到远端茎尖分生组织(SAM),激活花的同源异型基因[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba].拟南芥被描述为定量长昼(LD)种,利用其光周期特性,通过暴露于单个LD或单个位移短昼(SD)诱导同步开花,提供了一个方便的实验诱导系统[gydF4y2Ba7gydF4y2Ba].除光周期外,其他调控途径也参与了植物-生殖转换控制[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba].gydF4y2Ba
从转录和基于染色质的机制,到选择性剪接和翻译后调控,许多调控水平参与了花转化的控制[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba]及其主要参与者,这些参与者已收集于花卉互动数据库(flo - id) [gydF4y2Ba16gydF4y2Ba].除了参与发育转变的蛋白质调控因子外,越来越多的研究强调了长链非编码rna (long non-coding RNAs, lncRNAs)的调控功能[gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba].在春化反应中,lncRNAsgydF4y2BaCOLDAIRgydF4y2Ba,gydF4y2BaCOLDWRAPgydF4y2Ba,gydF4y2BaCOOLAIRgydF4y2Ba,gydF4y2Ba反义长gydF4y2Ba参与关键MADS-box花抑制因子的精细调控gydF4y2Ba开花位点c (flc)gydF4y2Ba通过修改gydF4y2Ba方法gydF4y2Ba染色质环境[gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba].最近,gydF4y2Ba凝花gydF4y2Ba的自然反义转录(NAT)gydF4y2Ba循环自由度因子5gydF4y2Ba(gydF4y2BaCDF5gydF4y2Ba)正调控开花时间,抑制开花时间gydF4y2Ba提供gydF4y2BaTFs (gydF4y2BaCDF1gydF4y2Ba,gydF4y2BaCDF3gydF4y2Ba,gydF4y2BaCDF5gydF4y2Ba),并随之增加gydF4y2Ba英国《金融时报》gydF4y2Ba表达式[gydF4y2Ba24gydF4y2Ba].lncrna是参与转录基因调控的多功能调控因子gydF4y2Ba,gydF4y2Ba在参与染色质组织和基因调控,甚至转录后调控机制的引导或支撑蛋白复合物中[gydF4y2Ba25gydF4y2Ba].由于它们的数量很大,估计有几千个,而且它们的多样性(基因间ncrna,内含子ncrna,反义rna,gydF4y2Ba独联体gydF4y2Ba或gydF4y2Ba反式gydF4y2BaNATs(…)gydF4y2Ba19gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba],它们的功能注释和在发展阶段转变中的作用仍然很少被探索。gydF4y2Ba
在整个植物的尺度上,向开花的过渡是一个综合的过程。很少有研究在基因组水平上分析花转化过程中分生组织和根组织的转录行为[gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba].早期研究发现很少有CO靶标在叶片开花期间差异表达,其中gydF4y2Ba英国《金融时报》gydF4y2Ba[gydF4y2Ba33gydF4y2Ba]被认为是参与SD到LD转换反应的主要CO目标[gydF4y2Ba34gydF4y2Ba].gydF4y2Ba英国《金融时报》gydF4y2Ba称为开花积分器与gydF4y2Baft的孪生姐妹gydF4y2Ba(gydF4y2BaTSFgydF4y2Ba) [gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba].随后的研究增加了参与开花期间叶片反应的相关基因的数量(见flo - id概述和其中的参考文献)。然而,尽管叶片作为诱导光周期信号的受体和致花分子的产生者具有重要的功能,但叶片中全基因组转录组在花转变过程中的动态尚未见报道。在这里,通过利用对长日(LD)移位的感应响应[gydF4y2Ba7gydF4y2Ba],并将叶片生长或发育反应与花诱导反应分离,我们进行了大规模的转录组分析,并确定了涉及成熟叶片开花的新位点和调控元件。转录组数据集使我们能够突出分子事件,为伴随花转变的叶片转录重编程提供了新的见解。对核内重复事件的观察支持转录组数据,并提示其在开花过程中的新功能。gydF4y2Ba
结果gydF4y2Ba
成熟叶的开花和器官生长gydF4y2Ba
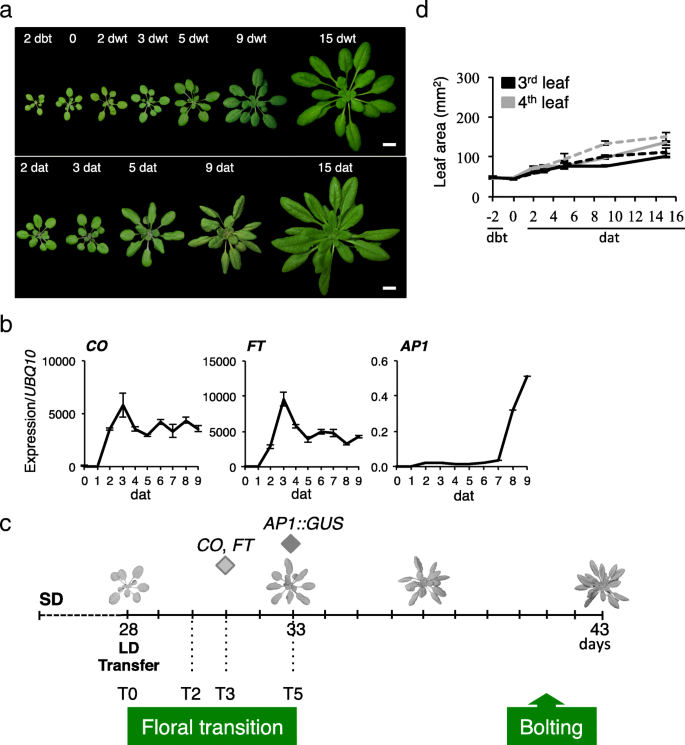
我们的实验系统是基于从SD到LD的光周期变化,这诱导了一个同步开花,适合于分析花的转变(图。gydF4y2Ba1gydF4y2Baa,附加文件gydF4y2Ba1gydF4y2Ba:图S1a)。花的过渡窗口是由基因表达的开始决定的gydF4y2Ba有限公司gydF4y2Ba而且gydF4y2Ba英国《金融时报》,gydF4y2Ba开花和开花的两个早期标志gydF4y2BaAPETALA 1gydF4y2Ba(gydF4y2BaAP1),gydF4y2Ba花分生组织特征的早期标记(图。gydF4y2Ba1gydF4y2Bab, c)。gydF4y2Ba有限公司gydF4y2Ba而且gydF4y2Ba英国《金融时报》gydF4y2Ba在LD中,转移后表达迅速升高,在转移后第3天(dat)达到最大值,在转移后的时间略有延迟gydF4y2Ba英国《金融时报》gydF4y2Ba与的主要激活作用一致gydF4y2Ba有限公司gydF4y2Ba(无花果。gydF4y2Ba1gydF4y2Bab)。虽然gydF4y2BaAP1 mRNAgydF4y2Ba7时检测到转录本,gydF4y2BaAP1gydF4y2Ba在分生组织细胞中,当使用an时,表达稍早(5d)gydF4y2BaAP1:格斯gydF4y2Ba这表明在那个时候花的转变已经完成。gydF4y2Ba1gydF4y2Bab, c,附加文件gydF4y2Ba1gydF4y2Ba:图S1b)。gydF4y2Ba
由SD-LD开关引起的花转变gydF4y2Ba答:芥gydF4y2Ba.gydF4y2Ba一个gydF4y2BaCol-0植株在SD条件下生长4周,在SD条件下(上行)或在LD条件下(下行)转移。转让前一天(dbt),不转让的一天(dwt),转让后一天(dat)。比例尺,1厘米。gydF4y2BabgydF4y2Ba关键开花时间基因的表达。实验值为平均值±SEM。gydF4y2BacgydF4y2Ba发展事件的图式。的gydF4y2Ba有限公司gydF4y2Ba而且gydF4y2Ba英国《金融时报》gydF4y2Ba表示表达峰值,而gydF4y2BaAP1gydF4y2Ba表达起始被认为是花转化(钻石)的上限。T0, LD的转让日。gydF4y2BadgydF4y2Ba第三和第四个莲座叶面积的测量。SD条件下(连续线),在LD中转移(虚线)。实验值为平均值±SEMgydF4y2Ba
为了完成我们的描述,我们监测了伴随光周期变化的器官生长。在连续SD和SD- ld条件下,在0-5天窗口内,莲座叶的大小没有显著差异,而前6个莲座叶表现出不同的行为(图5)。gydF4y2Ba1gydF4y2Bad、附加文件gydF4y2Ba2gydF4y2Ba:图S2)。前两个叶片的大小在转移(dbt)前2天已经确定,与光周期条件无关。0 ~ 5d, SD和SD- ld条件下3 ~ 4叶生长速率无显著差异。叶5 ~ 6在15 d内生长速率较高且持续。因此,在花转变的5天窗口期,发育和生长过程在叶片3-4中被抑制,这使得这对成熟叶片成为研究花转变相关早期分子事件的合适材料,独立于其他发育或信号事件。gydF4y2Ba
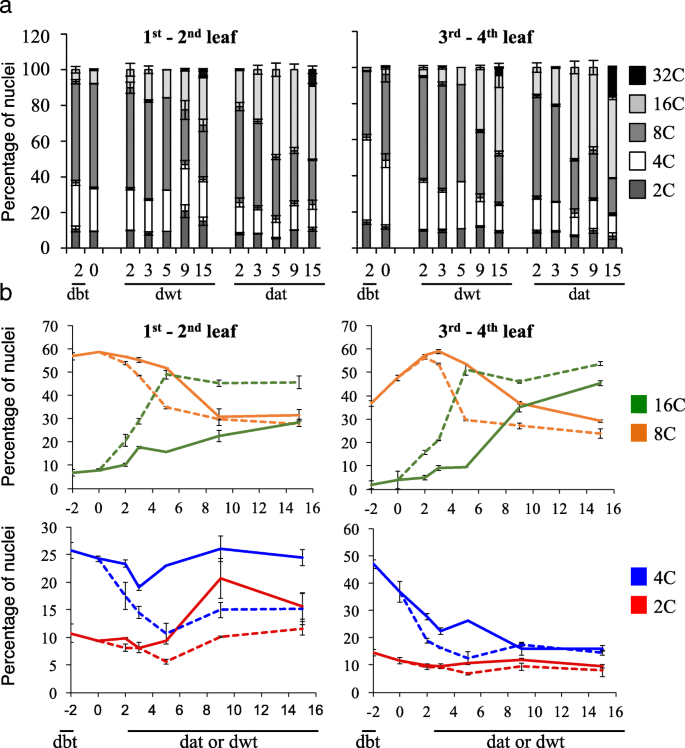
倍性水平在花过渡窗口期间发生变化gydF4y2Ba
由于植物的发育伴随着核内重复,我们分析了叶片1 ~ 4的倍性分布。与叶片位置、年龄和生长条件无关,2C倍体核的百分比相对稳定。gydF4y2Ba2gydF4y2Ba),表明细胞分裂率较低,与生长分析一致。随着时间的推移,倍性水平从4摄氏度进化到32摄氏度。这种动态取决于叶片位置和生长条件。两种条件下叶片3-4倍体水平表明,核内重复事件(8C和16C核)响应LD移位。15天后检测到32C核群,SD- ld组明显比SD组大。3 ~ 4叶的核内重复指数从1.95±0.01 (15 dwt)到2.35±0.03 (15 dat),而1 ~ 2叶的核内重复指数基本不变(15 dwt时为2.08±0.02,15 dat时为2.04±0.09)。因此,光周期SD- ld开关显示成熟叶片的核内重复显著增加,发生在花转变的3-5天窗口,比SD(15天)更早。gydF4y2Ba
诱导转移期间转录谱的主要变化gydF4y2Ba
为了描述花转变过程中的分子事件,我们检测了叶片3-4在不同时间点(T0, T2, T3和T5)的RNA谱(图5)。gydF4y2Ba1gydF4y2Bac、附加文件gydF4y2Ba3.gydF4y2Ba:图S3)。我们鉴定出至少在四个时间点中的一个时间点表达的20284个基因,在最大的转变(T0/T2)处有超过6000个差异表达基因(deg),在主要的T0/T2、T2/T3和T3/T5转变处有特定的基因集。通过基于TAIR注释和已发表的数据集组装14621个长非编码转录单元(lnctu)的非冗余数据集,我们还确定了531个差异表达lnctu (de - lnctu)(附加文件)gydF4y2Ba4gydF4y2Ba:图S4,附加文件gydF4y2Ba5gydF4y2Ba).这些数据证实了成熟叶片在响应SD-LD开关时具有高度动态的转录活性。gydF4y2Ba
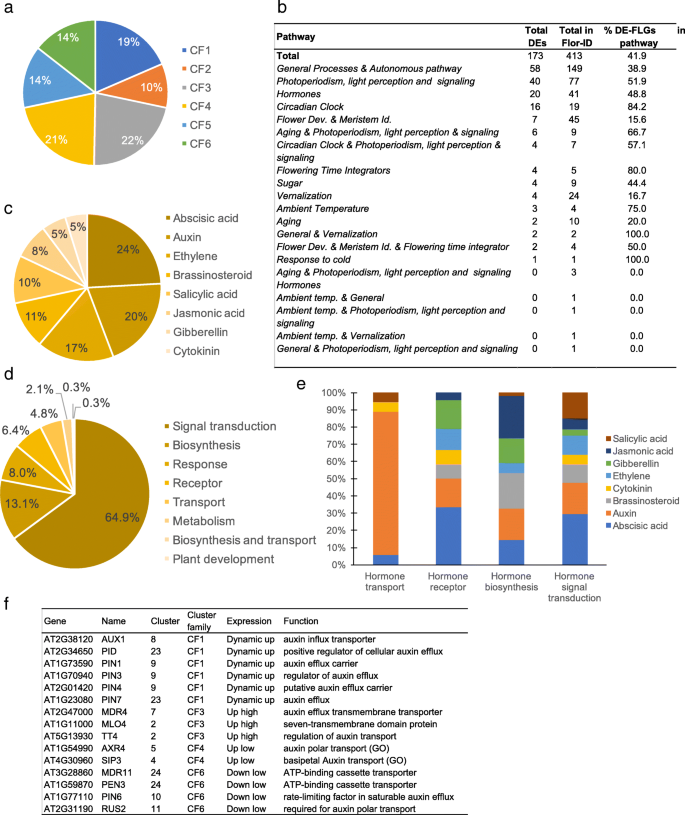
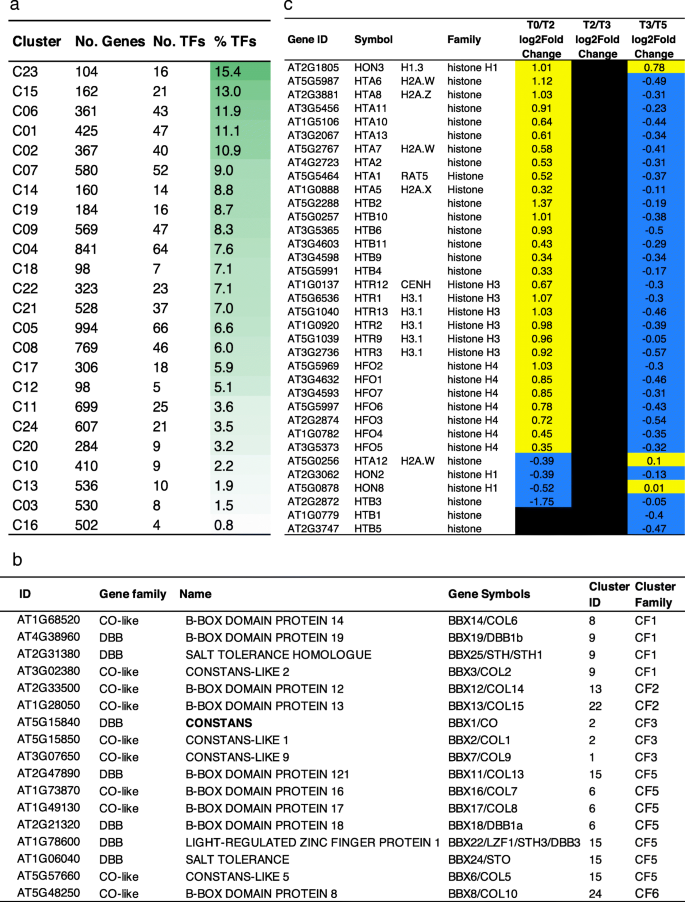
为了描述转录组的特征,我们使用不同的聚类方法和转换函数(R package coseq)进行了聚类分析。由基因和lnctu组成的24个簇(附加文件gydF4y2Ba6gydF4y2Ba),并根据表达趋势分为6个聚类家族(CF1 ~ CF6)。gydF4y2Ba3.gydF4y2Baa, b):瞬时上升(CF1)或下降(CF2),高位稳定(CF3)或下降(CF5),低位稳定(CF4)或下降(CF6)。gydF4y2Ba
这24个聚类具有特定的GO术语富集特征,甚至在聚类家族中,如7个聚类(C20、C23、C16、C18、C19、C15、C4、C3)具有强特征,从而支持聚类分析(图2)。gydF4y2Ba3.gydF4y2Bac, d,附加文件gydF4y2Ba7gydF4y2Ba).这一分类揭示了成熟叶片在SD-LD响应过程中的不同过程。例如,C3、C15、C17和C24富集在参与光合作用叶绿素生物合成过程、光收集或质体组织的下调基因中,这表明光合机制发生了重编程。CF5中的C12和C15以及CF3中的大多数簇中都富含应激相关的词语,如防御反应、对刺激的反应、对伤害的反应,突出了应激与光周期、光和生物钟扰动的变化的关联。相应地,我们在C19、C2和C14中注意到,“child”GO术语分别与茉莉酸、水杨酸或油菜素类固醇相关。次生代谢产物,如黄酮类化合物(C18)和与防御相关的硫代葡萄糖苷(C4),以及碳代谢(GO术语,如“葡聚糖分解代谢过程”,C17中的“细胞多糖分解代谢过程”)也进行了修饰。我们观察到与细胞壁相关的氧化石墨烯术语的富集,如C14中的“细胞壁组织”和“木葡聚糖代谢过程”或C20中的“植物型次生细胞壁生物发生”和“纤维素代谢过程”。例如,gydF4y2Ba木葡聚糖内转葡萄糖酶/水解酶9 (xth9gydF4y2Ba)参与细胞壁松动在C14中表达上调(log2比值1.85,FDR在T0/T2时为1.28E-3)。这些数据表明,成熟叶片的SD-LD开关伴随着细胞壁的重塑和细胞壁的一定可塑性,以响应环境变化。据报道,根系中的细胞壁改变是对无机磷酸盐饥饿的响应,下胚轴中的细胞壁改变是对光信号的响应[gydF4y2Ba37gydF4y2Ba].这种与环境信号有关的细胞壁重塑的例子仍然很少报道,特别是在叶片中。我们还在C14中注意到一个GO术语“对环戊烯酮的反应”,这是一种具有信号活性的脂肪酸衍生物。C16簇属于CF2,具有短暂性下调特征,与翻译、RNA加工和代谢相关的富集项最高,这表明细胞水平上蛋白质代谢的强烈修饰可能护送着整个植物向生殖期转变期间发生的代谢状态的转变。在拟南芥原生质体的细胞去分化和再分化过程中,也观察到这种短暂的翻译和相关过程的改变[gydF4y2Ba38gydF4y2Ba].最后,C20富集了与细胞周期过程相关的氧化石墨烯。的表达式的修改gydF4y2BaLGO / SMR1gydF4y2Ba,gydF4y2BaKRP2gydF4y2Ba而且gydF4y2BaKRP6gydF4y2Ba细胞周期抑制基因参与核内重复[gydF4y2Ba39gydF4y2Ba),gydF4y2BaCYCA2; 3gydF4y2Ba,是细胞周期的主要标记物内环的抑制因子,gydF4y2BaCDKB2.1gydF4y2Ba,gydF4y2BaCYCA1; 1gydF4y2Ba,gydF4y2BaWEE1,gydF4y2BaM相入口的负调节器[gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba]与观察到的内循环的开始一致(附加文件gydF4y2Ba8gydF4y2Ba:图S5)。综上所述,在花转变过程中,叶片转录组在许多过程中发生了重大变化,如碳代谢和次生代谢、信号事件和核内重复。gydF4y2Ba
在花诱导过程中,成熟叶片中开花和激素相关基因的表达存在差异gydF4y2Ba
flo - id核心数据库记录了与开花时间和花发育的不同调控途径相关的基因[gydF4y2Ba16gydF4y2Ba].为了更好地描述这些分子事件,我们分析了这些基因在花转变过程中成熟叶片中的表达。我们从413个flg中鉴定出173个de - flg。这些基因相当均匀地分布在不同的簇和调控途径(图。gydF4y2Ba4gydF4y2Baa, b,附加文件gydF4y2Ba9gydF4y2Ba).正如预期的那样,主要的花整合因子上调了,比如gydF4y2BaFt是Ft的孪生姐妹gydF4y2Ba(gydF4y2BaTSFgydF4y2Ba),gydF4y2Baft的兄弟gydF4y2Ba(gydF4y2BaBFTgydF4y2Ba),gydF4y2Ba有限公司gydF4y2Ba而且gydF4y2BaCOL1gydF4y2Ba.173个基因集还包括花分生组织特征和花发育(FMI-FD)基因,如gydF4y2BaAP2gydF4y2Ba,gydF4y2Ba花瓣损失gydF4y2Ba而且gydF4y2BaSEPALLATA 4gydF4y2Ba.与基于光周期偏移的实验设计一致,大多数被归类为与生物钟相关的flo - id基因差异表达(84.2%)。成熟叶片flo - id中大量的deg显示了花转化调控基因网络的复杂性和广泛性。gydF4y2Ba
在拟南芥激素数据库(AHD) [gydF4y2Ba42gydF4y2Ba],我们确定了331个参与激素调节的deg,从生物合成、代谢、感知和运输到激素反应。C23是这些基因富集程度最高的簇(附加文件)gydF4y2Ba10gydF4y2Ba;额外的文件gydF4y2Ba11gydF4y2Ba:图S6)。我们注意到脱落酸(ABA)和生长素相关基因在deg中是最具代表性的(图2)。gydF4y2Ba4gydF4y2Bac). ABA生物合成相关基因下调,与ABA对开花的抑制作用一致[gydF4y2Ba43gydF4y2Ba].然而,这种开关也在很大程度上影响了与激素信号转导相关的基因,如生长素运输(图2)。gydF4y2Ba4gydF4y2Bad, e)。在参与生长素激素转运的deg中,大多数基因在转换过程中至少是短暂上调的,如几个PIN成员(图。gydF4y2Ba4gydF4y2BaF),质疑生长素转运蛋白在花期控制中的作用。参与赤霉素(GA)生物合成的基因主要被下调,参与赤霉素代谢的甲基转移酶GAMT2以及赤霉素反应的负调控因子被激活(gydF4y2BaRGA-LIKE1-2gydF4y2Ba)(附加文件gydF4y2Ba11gydF4y2Ba:图S6b)。事实上,参与细胞分裂素(CK)生物合成的基因gydF4y2Ba呜咽五像1,2gydF4y2Ba基因(gydF4y2BaSOFL1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba),参与调节CK水平[gydF4y2Ba44gydF4y2Ba],而参与CK分解代谢的基因(gydF4y2BaCKK4gydF4y2Ba,gydF4y2BaCKK6gydF4y2Ba)被下调了。b型拟南芥响应调节因子10 (ARR10) TF是CK信号通路中光响应和芽启动的关键因子[gydF4y2Ba45gydF4y2Ba],在T0/T5之间表达上调。除了参与一种激素途径的DEGs外,还有36个DEGs参与激素串扰,其中ABA参与了大多数的串扰(附加文件)gydF4y2Ba12gydF4y2Ba).虽然GA被认为可以促进花的转变,并与ABA有拮抗作用,但我们的数据表明,在SD-LD转换过程中,GA、ABA以及油菜素内酯及其衍生物、IAA和CKs等新参与者之间存在复杂的激素相互作用。gydF4y2Ba
涉及SD-LD开关的新调控角色gydF4y2Ba
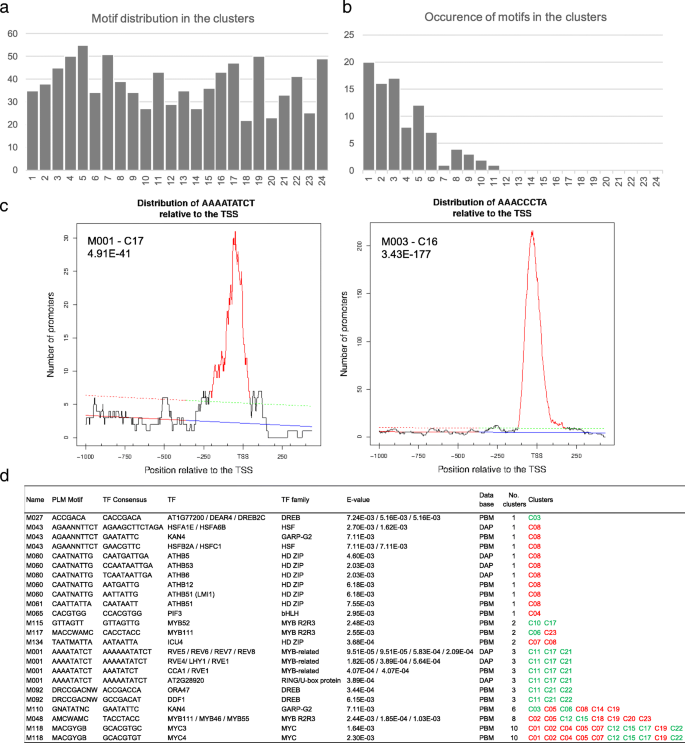
为了确定与成熟叶片开花相关的调控元素,我们进行了一项研究gydF4y2Ba从头开始gydF4y2Ba使用优先定位motifs (PLM)检测器算法在每个簇中共调控基因的启动子中搜索motif [gydF4y2Ba46gydF4y2Ba].我们鉴定出192个4 - 11个碱基的显著基序,分布在24个簇中(M001 - M192,gydF4y2BapgydF4y2Ba-value < 0.05)。gydF4y2Ba5gydF4y2Ba,附加文件gydF4y2Ba13gydF4y2Ba).然后我们将我们的分析限制在7个节拍或更长的母题(91个母题)。它们的出现从11个不同簇中的一个独特基序(M055)到仅一个簇中的20个基序不等。我们使用Tomtom Motif比较工具对这些Motif是否与之前发现的转录因子绑定位点(TFBSs)相对应进行了研究[gydF4y2Ba47gydF4y2Ba]和两个由蛋白质结合微阵列(PBMdb)识别的功能基序数据库[gydF4y2Ba48gydF4y2Ba],并通过DAP-seq (DAPdb) [gydF4y2Ba49gydF4y2Ba].我们只保留显著基序(e值< 0.01;对于DAP图案,重叠值大于75%)。其中13个motif与这些数据库中32个tf所针对的已知motif相似(图2)。gydF4y2Ba5gydF4y2Ba),其余基序对应假定的新调控元件,其功能有待进一步研究。gydF4y2Ba
32个TF组在GO术语中富集,与“regulation of metabolic process”相关(GO:0019222;gydF4y2BapgydF4y2Ba-value 5.65E-29, FDR 1.11E-26), " response to hormone stimulus " (GO:0009725;gydF4y2BapgydF4y2Ba-value 3.86E-12, FDR 3.53E-10)和“昼夜节律”(GO:0007623;gydF4y2BapgydF4y2Ba-value 8.68E-10, FDR 6.43E-08) (PlantGSEA工具包)。M001基序(AAAATATCT)与CCA1、LHY1、RVE1和RVE5-8 tf识别的TFBS以及“Evening Element”相匹配,参与昼夜节律调控基因的控制[gydF4y2Ba50gydF4y2Ba],并被鉴定为,例如,在下调的基因,如gydF4y2Ba植物时钟1号高级副总裁gydF4y2Ba(gydF4y2BaPCL1gydF4y2Ba),gydF4y2Ba长营养阶段1gydF4y2Ba(gydF4y2BaLOV1gydF4y2Ba).M118 (MACGYGB)与MYC3和MYC4的TFBS相似,这两个TFBS都参与了开花[gydF4y2Ba51gydF4y2Ba].有趣的是,没有TF可以与M003 (AAACCCTA)和M004 (AAACCCTAA)相关联,这两个密切相关的基序具有最好的PLMgydF4y2BapgydF4y2Ba-values(分别为3.43E-177, 5.39E-104)。值得注意的是,M003与LHP1结合基序(A/G/T)AACCCTA(A/G)高度相似gydF4y2BatelogydF4y2Ba-box motif (AAACCCTA)和重复结合蛋白1 (TRB1)识别[gydF4y2Ba52gydF4y2Ba],并且在较小程度上与TOE1的三级基序(AACCTTAA)有关,该TF属于AP2/EREBP超家族(PBMdb的e值为0.54)。已知LHP1和TOE1都抑制开花,LHP1是PRC1复合体的组成部分[gydF4y2Ba53gydF4y2Ba,gydF4y2Ba54gydF4y2Ba]和TOE1抑制CO活性gydF4y2Ba英国《金融时报》gydF4y2Ba激活(gydF4y2Ba55gydF4y2Ba].这32个tf中的大多数(56%)在这一过程中受到差异调控,这意味着所识别的基序的功能偏好。gydF4y2Ba
因此,我们利用PlantTFDB进一步分析了tf的表达[gydF4y2Ba56gydF4y2Ba],并鉴定出648种差异表达TF,属于51个TF家族(附加文件gydF4y2Ba14gydF4y2Ba).gydF4y2Ba英国《金融时报》,TSFgydF4y2Ba而且gydF4y2BaBFTgydF4y2Ba与其他7种tf共同监管(其中,gydF4y2BaNAC3gydF4y2Ba,gydF4y2BaNLP3gydF4y2Ba,gydF4y2BaWOX2gydF4y2BaASG4) (C18)和gydF4y2Ba有限公司gydF4y2Ba而且gydF4y2BaCOL1gydF4y2Ba与其他38个tf (C02),扩大监管网络。来自CF1的短暂上升的C23簇在其DEGs中具有最高的tf百分比,与T0/T2发生的最大转录开关一致(图2)。gydF4y2Ba6gydF4y2Baa).对于某些TF家族,很大比例的成员存在差异表达,这表明这些家族在响应SD-LD转移中发挥了重要作用。其中一个家族是BBX蛋白家族,包括DBB(双B-box (BBX)锌指蛋白亚家族和co样亚家族[gydF4y2Ba57gydF4y2Ba,gydF4y2Ba58gydF4y2Ba](主要下调;17个deg中的10个)(图。gydF4y2Ba6gydF4y2Bab). BBX家族包括参与生物钟、光形态建成、开花时间、花发育或应激反应的调控因子,如开花激活因子COL5 [gydF4y2Ba59gydF4y2Ba], BBX2/COL1是生物钟调节器[gydF4y2Ba57gydF4y2Ba]或开花抑制因子COL9 [gydF4y2Ba60gydF4y2Ba].这些数据表明BXX家族中SD-LD开关可能具有协同作用和拮抗作用。C2中另有39个转录因子,其中5个未知转录因子可能是成熟叶开花时间控制的新候选因子。NF-Y(核因子Y)家族的表达也发生了很大的变化。保守的NF-Y复合物由NF-YA、NF-YB和NF-YC亚基组成,参与发育、胁迫反应和开花[gydF4y2Ba61gydF4y2Ba,gydF4y2Ba62gydF4y2Ba,gydF4y2Ba63gydF4y2Ba,gydF4y2Ba64gydF4y2Ba].其中,与其他亚基(2个NF-YB、4个NF-YC)相比,NF-YA亚基主要是上调的(CF3和CF4中9个NF-YA中有8个,即向上-高和向上-低簇族),部分亚基是共上调的(如CF3中的NF-YA4/NF-YB2/NF-YC2, CF4中的NF-YA8/NF-YA9/NF-YB3),表明NF-Y配合物的组成具有特异性和动态性。单链DNA结合蛋白小WHIRLY (WHY)家族的三个成员也主要下调(C10, C13)。WHIRLY1被认为参与基因调控和叶绿体到核的逆行信号,以响应光适应过程中发生的氧化还原过程[gydF4y2Ba65gydF4y2Ba,gydF4y2Ba66gydF4y2Ba].WHIRLY1具有叶绿体/核的双重定位,WHY2和WHY3分别靶向线粒体和叶绿体。这些数据表明在花期控制中存在一种新的叶绿体-核信号。gydF4y2Ba
flo - id是64个tf的功能相关子集,对应于数据库中差异表达的tf(143个中的64个)(附加文件gydF4y2Ba15gydF4y2Ba)使用TF2Network工具进行分析[gydF4y2Ba67gydF4y2Ba来破译成熟叶片中的基因调控网络。通过与flo - id tf对应的子集进行比较,我们确定了66个特定的候选调控因子,这些调控因子没有差异表达(数据未显示)。排名最好的监管机构是HYH, ABF1, TCP21, ABI5, MYC2和HY5(附加文件gydF4y2Ba16gydF4y2Ba:图S7),提示成熟叶片花转变的候选调控因子。ABI5和ABF1是参与ABA响应的转录因子,它们作为候选调控因子的鉴定与成熟叶片中ABA相关基因在花转化过程中高比例的差异表达一致(图5)。gydF4y2Ba4gydF4y2Bac)。gydF4y2Ba
最后,由于染色质是一个关键的转录调节水平,我们寻找了与开花有关的关键染色质相关基因(CAGs)。我们鉴定出90个de - cag, 91%在T0/T2位点差异表达,偏向上调基因(附加文件)gydF4y2Ba17gydF4y2Ba而且gydF4y2Ba18gydF4y2Ba).我们注意到很大比例(39%)的de - cag编码组蛋白变体,例如gydF4y2BaH1.3gydF4y2Ba4 .与应激反应相关的变异(HON3)gydF4y2BaH3.1gydF4y2Ba变体,以复制依赖的方式合并,与核内重复事件或10一致gydF4y2BaH2AgydF4y2Ba变异(无花果。gydF4y2Ba6gydF4y2Bac).在组蛋白翻译后修饰的基因中,如编码SDG4/ASH1-RELATED 3和SDG13/SUVR1组蛋白甲基转移酶的基因表达上调,而组蛋白去乙酰酶只有弱差异表达,除HDA2下调,首次与花转化相关外。与伴随早期花转化事件的DNA甲基化修饰一致,我们观察到的表达变化gydF4y2BaMET1gydF4y2Ba,gydF4y2BaCMT3gydF4y2Ba同时也是gydF4y2BaDEMETER-LIKE2gydF4y2Ba(gydF4y2BaDML2gydF4y2Ba),在成熟叶片中编码一种参与DNA去甲基化的DNA糖基化酶。因此,这些结果表明表观基因组的快速修改伴随着TF谱的改变,这进一步支持了叶基因组的戏剧性重编程,使人联想到另一个发育开关[gydF4y2Ba38gydF4y2Ba].gydF4y2Ba
一组lnctu在花的转变过程中受到差异调控gydF4y2Ba
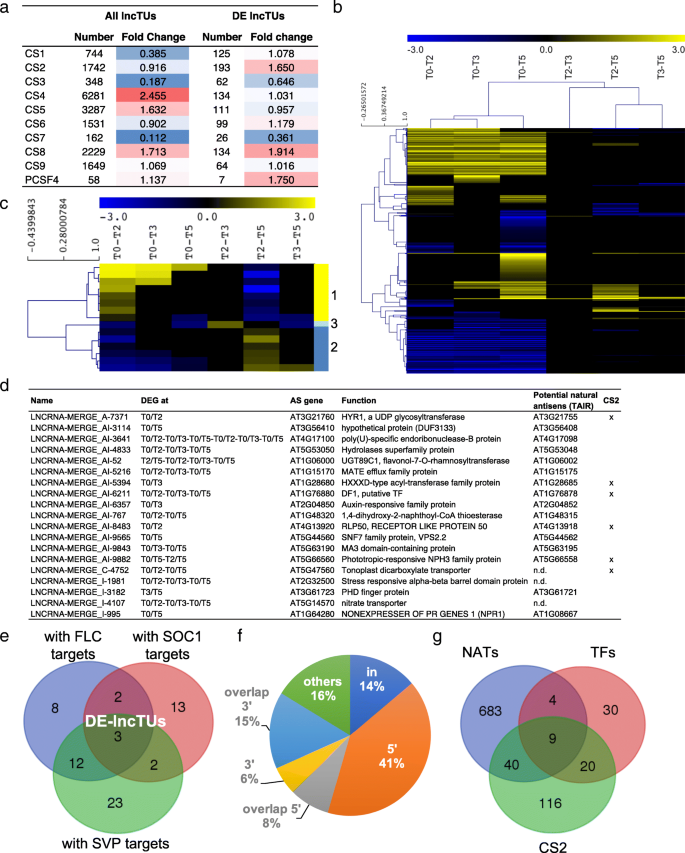
为了识别具有假定调节功能的lnctu,我们首先质疑了我们数据集中的14621个lnctu区域和531个de - lnctu区域是否与特定的基因组地形特征相关,特别是9种染色质状态(CS) [gydF4y2Ba68gydF4y2Ba(图。gydF4y2Ba7gydF4y2Baa). lncTUs始终优先与CS4相关,CS4主要对应于远端启动子区和非编码基因间区。CS4具有高水平的H3K27me3和活性组蛋白标记水平降低。在较小程度上,但仍然显著地,lncTUs在CS5中普遍存在,polycomb调控的CS也富含高H3K27me3水平,在CS8中富含at异染色质,但不含本构异染色质(CS9)。尽管在CS8中lncTUs和DE-lncTUs的折叠变化非常相似,但在二价染色质状态CS2中观察到两组之间存在很大差异。我们观察到,在PCF11-SIMILAR PROTEIN 4 (PCFS4)靶向的区域中,DE-lncTUs数量较少,PCFS4是影响开花时间的关键因素gydF4y2Ba葬礼gydF4y2Ba可供选择的处理方法[gydF4y2Ba69gydF4y2Ba(图。gydF4y2Ba7gydF4y2Baa).这些结果表明存在与特定染色质状态和花转变过程中特定调控活动相关的lnctu集,如193个de - lnctu中的CS2子集或PCSF4子集。gydF4y2Ba
光周期感应开关过程中lncrna的分析。gydF4y2Ba一个gydF4y2BalncTU在9种染色质状态和PCFS4靶区分布的热图。根据观察到的lncrna与随机分布的lncrna的比值计算折叠变化。gydF4y2BabgydF4y2Bade - lntu的层次聚类。gydF4y2BacgydF4y2Ba动态de - lnctu的层次聚类。gydF4y2BadgydF4y2BaDE-lncTUs在NAT定向中,基因在同一时间点有差异表达,相应的潜在NAT,如TAIR所注释。gydF4y2BaegydF4y2Ba不同de - lntu组与FLC、SOC1或SVP附近结合位点之间的维恩图。gydF4y2BafgydF4y2BaFLC, SOC1或SVP的TFBSs分布在(内),在5 '或3 '端,在lnctu的3 '或5 '端重叠。gydF4y2BaggydF4y2BaCS2中的de - lnctu、邻近具有SVP、FLC或SOC1结合位点(tf)的de - lnctu与形成NAT偶的de - lnctu之间的维恩图gydF4y2Ba
分层聚类分析显示,531个DE-lncTUs中大多数是上调或下调的,而只有15个DE-lncTUs是动态变化的(图2)。gydF4y2Ba7gydF4y2Bab, c).这说明de - lnctu的大部分特异位点主要针对营养期或生殖期,少数特异位点仅涉及过渡期事件。gydF4y2Ba
研究lncTUs是否能改变基因的表达gydF4y2Ba独联体gydF4y2Ba我们检测了lnctu及其邻近基因的表达。在基因组水平上没有检测到表达与结构之间的相关性。然后,我们通过分析具有重叠基因的lnctu来研究lnctu是否可能具有假定的NAT调节功能。的gydF4y2Ba凝花gydF4y2Ba例如,NAT具有抑制作用gydF4y2BaCDF5gydF4y2Ba位于反义,但也gydF4y2BaCDF1gydF4y2Ba而且gydF4y2BaCDF3gydF4y2Ba位于其他染色体上,参与开花时间控制[gydF4y2Ba24gydF4y2Ba].而gydF4y2BaCDF2gydF4y2Ba差异,gydF4y2BaCDF3gydF4y2Ba而且gydF4y2BaCDF5gydF4y2Ba在我们的数据中被下调了。推定的lntu,我们可以在gydF4y2BaCDF2gydF4y2Ba,gydF4y2BaCDF3,gydF4y2Ba而且gydF4y2BaCDF5gydF4y2Ba在我们的实验设计中没有差异表达,这表明其他调节机制控制gydF4y2Ba提供gydF4y2Ba表达式。或者,相应的lnccu表达的瞬时变化无法检测到。在我们的数据集中,我们发现655个lnctu与一个侧壁基因重叠,并以反义方式转录(假定为NAT lnctu)。其中,19个NAT lncTUs在6个比较中至少有一个显示出与重叠基因相反的转录活性(图2)。gydF4y2Ba7gydF4y2Bad、附加文件gydF4y2Ba19gydF4y2Ba).然而,该基因及其NAT lntu的表达动态可能更复杂,两个伙伴可能没有同步表达。例如,一个lncTU与gydF4y2BaMAF5 (gydF4y2Balncrna - merge_c - 9859,命名gydF4y2BaMAF5_NATgydF4y2Ba),编码的花抑制因子gydF4y2Ba方法gydF4y2Ba进化枝。gydF4y2BaMAF5gydF4y2Ba在花的转变和gydF4y2BaMAF5_NATgydF4y2Ba在MAF5上调之前被强烈下调(附加文件gydF4y2Ba20.gydF4y2Ba:图S8)。这不同于反义调控ncrna的短暂上调,后者抑制gydF4y2Ba方法gydF4y2Ba从而说明了开花调控机制的复杂性。gydF4y2Ba
最后,对于每个DE-lncTU,我们在一个4 kb窗口(上游3 kb -下游1 kb)中检测了SVP、FLC和SOC1开花调控因子的TFBSs的存在[gydF4y2Ba70gydF4y2Ba,gydF4y2Ba71gydF4y2Ba,gydF4y2Ba72gydF4y2Ba,gydF4y2Ba73gydF4y2Ba,gydF4y2Ba74gydF4y2Ba].我们在63个de -lncTU附近鉴定出123个TFBSs,其中1 - 7个结合位点主要存在于5 '区域,这表明这些TFBSs在de -lncTU的表达方面具有一定的功能,以及这些TFBSs在lncTU调控中的推测作用(图5 ')。gydF4y2Ba7gydF4y2Bae, f,附加文件gydF4y2Ba21gydF4y2Ba).此外,一些带有TFBSs的de - lnctu位于CS2和/或参与NAT偶联。基于这些标准(表达谱,TFBS的存在,在特定染色质状态的位置,NAT偶),确定的DE-lncTUs代表了有趣的候选,其在开花中的调节功能有待进一步研究。gydF4y2Ba
讨论gydF4y2Ba
成熟叶片花转化过程中的复杂分子过程gydF4y2Ba
在感知花的诱导刺激时,叶片产生致花素信号,将SAM从营养期切换到生殖期。参与产生致花素的关键基因已经被确定,但在花的转变过程中叶片中的整体分子事件仍然很少被描述。本研究以发育完成的成熟莲座丛叶为研究对象,完成了该器官花转化的分子过程分析。基于差异基因表达谱,我们发现SD-LD开关诱导的花性转变伴随着光合能力重组、蛋白质合成、细胞代谢、激素作用、应激反应和细胞周期调节,并在光照状态、生物钟和花性转变之间存在复杂的相互作用。我们的数据强调了成熟叶片在花的转变中的复杂作用。gydF4y2Ba
LD作为致花信号的一部分,刺激叶片蔗糖水平的升高[gydF4y2Ba75gydF4y2Ba,gydF4y2Ba76gydF4y2Ba,gydF4y2Ba77gydF4y2Ba].然而,其他代谢物也参与了花的转变:碳、磷、氮或硫会影响这一过程[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba78gydF4y2Ba].与黄酮类化合物和硫代葡萄糖苷含量相关的基因在光周期转换期间受到差异调控,而这些次生代谢产物通常与应激反应有关[gydF4y2Ba79gydF4y2Ba].这些数据支持了最近的一项研究,即开花调节因子gydF4y2Ba方法gydF4y2Ba在芸苔科物种中存在与硫代葡萄糖苷含量相关的QTL区间,gydF4y2BaAethionema arabicumgydF4y2Ba[gydF4y2Ba80gydF4y2Ba].在SAM中发生的开关似乎需要在叶片中进行大量的代谢和生理重编程事件来进一步探索。gydF4y2Ba
开花控制的新调控候选重点gydF4y2Ba
基因的转录谱和lncrna的转录谱都发生了动态变化,突出了其中一些基因在花转变中的潜在调节功能。我们的lnctu图谱,基于它们在二价染色质状态或与蛋白质编码基因反义的位置,具有推测的调节功能,为花转化过程中基因组调控的新角色提供了有前景的资源。gydF4y2Ba
基因簇的分析允许提取特定的假定的调控基序。其中一些DNA元件与差异表达的tf的结合位点相对应,提示其在花转化的转录调节中具有功能。与此同时,研究人员发现了大量参与不同过程的差异表达tf,与GO分析突出显示的分子过程一致。一组FMI-FD基因在分生组织中起着至关重要的作用,其转录的变化表明在花的转变过程中有其他水平的基因调控。gydF4y2Ba
通过重点研究flo - id转录因子,我们重点研究了小基因调控网络,以及在叶片花转化过程中可能出现的新参与者,如ABI5、ABF1或TCP21。TCP21参与生物钟的调节和控制gydF4y2BaCCA1gydF4y2Ba表达式[gydF4y2Ba81gydF4y2Ba].TCP21作为候选调控因子的鉴定与SD-LD切换期间差异表达的大量生物钟相关基因(84.2%)一致(图2)。gydF4y2Ba4gydF4y2Bab). ABI5被报道为一种花抑制因子[gydF4y2Ba82gydF4y2Ba],这与此处SD-LD切换期间的下调及其与下游解除管制的tf的假定相互作用相一致。ABA参与花期的控制,并根据环境条件产生相反的作用[gydF4y2Ba83gydF4y2Ba,gydF4y2Ba84gydF4y2Ba,gydF4y2Ba85gydF4y2Ba].例如,ABA被证明以一种依赖于ld的方式促进开花时间,并通过调节来响应水资源的可用性gydF4y2BaGIGANTEAgydF4y2Ba(gydF4y2Ba胃肠道gydF4y2Ba)活动gydF4y2Ba英国《金融时报》gydF4y2Ba而且gydF4y2BaTSFgydF4y2Ba[gydF4y2Ba84gydF4y2Ba,gydF4y2Ba85gydF4y2Ba].然而,下调了gydF4y2Ba胃肠道gydF4y2Ba这表明aba依赖的开花促进可能不参与SD-LD的转变,但ABI5介导的抑制可能会丢失。ga依赖性促进途径的激素作用[gydF4y2Ba10gydF4y2Ba]也可能起作用。大多数激素通路在转换过程中受到影响,尽管程度不同,但使用激素剂量可能有助于解开它们对开花时间的贡献。gydF4y2Ba
叶花转化过程中伴随的核内再复制事件gydF4y2Ba
在花的转变过程中,SAM细胞分裂加速gydF4y2Ba答:芥gydF4y2Ba[gydF4y2Ba29gydF4y2Ba,gydF4y2Ba86gydF4y2Ba].在这里,我们报道了内环护送花的转变在叶子。因此,花的诱导伴随着叶片和分生组织的细胞周期的调节,但细胞周期的退出分别根据器官、内循环或有丝分裂而不同。我们的结果得到了关键细胞周期阶段标记物表达变化的支持,如gydF4y2BaCYCA2; 3gydF4y2Ba,还有组蛋白变异和内环相关基因。与刺激内环功能的丧失一致[gydF4y2Ba87gydF4y2Ba],gydF4y2BaCYCD3gydF4y2Ba在我们的实验中,基因被下调。纺锤体组装检查点(SAC)基因也被证明影响花的转变和内循环开始的时间[gydF4y2Ba88gydF4y2Ba].在本研究中,SAC家族中只有BUBR1/MAD3基因被轻度下调,但其在拟南芥有丝分裂检查点控制中的作用仍鲜有文献记载。gydF4y2Ba
激素信号通路参与有丝分裂到内环转变的控制:高生长素含量诱导内环抑制[gydF4y2Ba39gydF4y2Ba,gydF4y2Ba89gydF4y2Ba].一致地,我们观察到生长素通路在光周期感应开关期间的改变。SUMO E3连接酶HPY2,被认为是一种内环抑制因子,可能连接生长素信号通路和细胞周期程序[gydF4y2Ba89gydF4y2Ba,gydF4y2Ba90gydF4y2Ba],以及其他两种内环负调控因子在T0/T2转变时均被上调,表明成熟叶片进入内环程序可能是由于不同调控途径之间的适当剂量所致。gydF4y2Ba
先前的研究表明,光强度的增加[gydF4y2Ba91gydF4y2Ba]及UV-B辐射[gydF4y2Ba92gydF4y2Ba]与倍性水平的变化有关。一种假说认为,倍性动力学可能是对太阳辐射可能引起的损伤的适应性反应。最后,我们还可以推测,在花转化过程中,成熟叶片倍性水平的提高可能有助于发育开关所需能量的增加,代谢产物和内源性信号分子的增加,或转录阈值的调节。gydF4y2Ba
结论gydF4y2Ba
我们的详细研究提供了一个新的分子框架,以进一步质疑新的假定的调节因子在花的转变过程中在叶子中的作用,例如新的假定的lncrna,其多聚腺苷酸化状态还需要进一步确认。此外,它还指出了开花与核内再复制之间的关系以及几种植物激素之间复杂的相互作用,为研究开辟了新的视角。gydF4y2Ba
方法gydF4y2Ba
植物材料和生长条件gydF4y2Ba
所有gydF4y2Ba拟南芥gydF4y2Ba线在col0背景中。种子gydF4y2BapAP1:格斯gydF4y2Ba转基因系由G. Angenent教授提供(未发表材料)。的gydF4y2BaAP1gydF4y2Ba启动子片段融合成agydF4y2BaGUS-GFPgydF4y2Ba盒式录音带,载于[gydF4y2Ba93gydF4y2Ba],使用来自VIB的二进制pBGWFS7向量[gydF4y2Ba94gydF4y2Ba].在SD (8 h光照/16 h暗)或LD (16 h光照/8 h暗)条件下生长。使用了白色荧光灯。光合光子通量密度为120 μmol mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba在SD和LD中,光照时温度为21℃,暗时温度为18℃,湿度(65%)保持不变。在LD中,温度(21℃)和湿度(70%)保持不变,分别为21℃和70%。植株在单个花盆的土壤中培养3、4或5周。在SD光照结束时,在LD暗期之前进行转移。花期指标的记录如上文所述[gydF4y2Ba53gydF4y2Ba)(附加文件gydF4y2Ba1gydF4y2Ba:图S1a)。茎生叶相对于总叶数的百分比(CL%)量化了抽苔和花转变事件之间的关系[gydF4y2Ba95gydF4y2Ba].对于在SD中生长3,4和5周并在LD中转移的植物,其CL%与连续LD中的CL%相近(17.6%),而高于连续SD中的CL% (11.9%) [gydF4y2Ba96gydF4y2Ba].这一初步试验表明SD-LD开关模拟了LD的生长条件。为了在时间和材料数量之间取得良好的折衷,然后对SD中生长4周的植物进行分析。gydF4y2Ba
对于RNA提取,在SD的授时因子时间7 (ZT7)和LD的ZT15采集植物,ZT0标志着从黑暗到光明的转变。为了进行叶片生长分析,在不同的时间点采集单个叶片,在白纸上压平,然后进行数字扫描。利用ImageJ软件(gydF4y2Bahttp://rsb.info.nih.gov/ij/gydF4y2Ba).对10 ~ 15株植物的叶片进行了分析。gydF4y2Ba
倍性分析gydF4y2Ba
收获叶片1 ~ 4,用刀片在Galbraith缓冲液800 μl中切碎,过滤过30 μm网,加入碘化丙啶溶液150 μl (100 μg/ml) [gydF4y2Ba97gydF4y2Ba].核DNA含量的定量是使用FloMax®软件(Sysmex Partec,法国)在CyFlow®细胞仪上进行的,如所述[gydF4y2Ba98gydF4y2Ba].核内重复指数计算公式为:EI = 0x(2C %) + 1x(4C %) + 2x(8C %) + 3x(16C %) + 4x(32C %)。gydF4y2Ba
表达分析gydF4y2Ba
总rna由莲座状材料制备,经处理并逆转录,如前所述[gydF4y2Ba99gydF4y2Ba].定量实时PCR在BioRad CFX96仪器上进行,使用SYBR绿色Master Mix (BioRad),按照制造商的说明进行。gydF4y2BaUBIQUITIN10gydF4y2Ba作为内参基因。引物在附加文件中列出gydF4y2Ba22gydF4y2Ba.GUS组织化学染色时,将植物收集在染色液(1 mM X-Gluc(5-溴-4-氯-3-吲哚基-ß-D-glucuronide), 0.1 M磷酸钠缓冲液,pH 7.0, 2 mM亚铁氰化钾,2 mM铁氰化钾,0.5% Triton X-100)中,真空浸润3次,每次5分钟,37℃孵育过夜。然后在70%乙醇中清洗样品,并在光学显微镜下观察。gydF4y2Ba
RNA提取,文库制备和测序gydF4y2Ba
总RNA用Plant RNeasy Mini kit (QIAGEN)提取。10 μg RNA用TURBO DNA-free kit (Ambion Ref. AM1907)处理,酶解反应用RNeasy MinElute Cleanup kit (QIAGEN Ref. 74204)清除,按照生产说明进行。RNA完整性和浓度用Agilent 2100 Bioanalyzer和Agilent RNA 6000 Nano Kit (Ref. 5067-1511)进行分析。在一个重复中,从20株植物中分离出3-4片叶子,并将其聚集在一起。每个时间点分别进行3个独立重复。利用Illumina truu - seq链RNA样品制备v2试剂盒从polyA RNA中制备链特异性测序文库。4个文库在每个通道上进行多路复用,并在Illumina HiSeq 2000上进行配对端(PE)测序。每个样品产生超过4000万个150 bp的读数。实验的所有步骤,从生长条件到生物信息学分析,都记录在CATdb数据库中[gydF4y2BaOne hundred.gydF4y2Ba) (gydF4y2Bahttp://tools.ips2.u-psud.fr/CATdb/gydF4y2Ba项目编号NGS2015_01_Transition根据国际标准MINSEQE最少信息进行一次高通量测序实验。gydF4y2Ba
RNA-Seq数据分析gydF4y2Ba
RNA-Seq样本使用以下管道处理:读预处理标准包括修剪库适配器和使用FastQC执行质量控制检查。使用FastX工具包(Phred Quality Score > 20, read length > 30 base)对原始数据(fastq)进行修剪。领结2绘图器[gydF4y2Ba101gydF4y2Ba,用于将读取与gydF4y2Ba答:芥gydF4y2Batair10转录组。平均而言,99%的基因通过了质量筛选,并被唯一地映射到TAIR 10参考基因组中。我们从TAIR10版本数据库中提取了33,602个基因[gydF4y2Ba102gydF4y2Ba],每个基因一个亚型对应于TAIR10给出的代表性基因模型(最长编码序列)。每个基因的丰度是由一个本地脚本计算的,该脚本解析SAM文件,只计算成对的末端读取,其中两个读取都清楚地映射一个基因,并删除多次命中。根据这些规则,大约96%的PE读取与基因相关,2%的PE读取未映射,2%的PE读取多次命中被删除。gydF4y2Ba
对于差异表达分析,我们在至少一半的样本中丢弃了在百万计数(CPM)归一化后没有至少1个read的基因。库大小使用TMM方法归一化。计数分布采用负二项广义线性模型(GLM),其中考虑了收获日期。离散度由edgeR方法估计[gydF4y2Ba103gydF4y2Ba在统计软件“R”(R核心团队,2015)。的gydF4y2BapgydF4y2Ba-值通过Benjamini-Hochberg程序调整以控制FDR。当基因调整后的p值低于0.05时,即为差异表达。gydF4y2Ba
lncrna分析gydF4y2Ba
我们从已发表的lncRNA数据集中收集了14,621个假定lncRNA序列的非冗余数据集(ijpb_lncrdb) [gydF4y2Ba26gydF4y2Ba,gydF4y2Ba104gydF4y2Ba,gydF4y2Ba105gydF4y2Ba,gydF4y2Ba106gydF4y2Ba].多余的信息被删除。数据集根据链信息分为三个子集(+,−,Not Available (NA))。对于每个子集,我们将重叠或“书尾”的lncRNA合并到单个转录单位(lncTU)中。建立了3个lnctu的FASTA文件:一个正链上有5055个TUs,另一个负链上有4851个假定的TUs,最后一个有4715个TUs,没有链信息。所有读取都使用Bowtie 2映射器映射ijpb_lndb [gydF4y2Ba107gydF4y2Ba]使用相同的计数标准。尽管96%的配对末端reads如预期的那样映射到TAIR10基因组,但映射到lncRNA数据集的平均百分比为0.78%。为了建立差异表达的lnctu,我们使用了edgeR的GLM,不带或带Bonferroni或Benjamini-Hochberg (BH)测试校正的过滤器。Bonferroni检验鉴定的差异表达lnctu均出现在BH检验鉴定的DE lnctu列表中。我们进一步分析了BH DE lncTUs。DE-lncRNAs在两条链上的分布没有观察到偏倚。gydF4y2Ba
为了确定lncRNA和注释染色质状态之间的重叠,我们使用了在线BEDTools套件。我们建立了所有lncrna、DE lncrna和相同大小的随机重组区域的交叉,以计算观察到的和随机分布的lncrna之间的折叠变化。采用Multiexperiment Viewer工具(MeV 4_8),结合平均连锁法、基因叶序优化和Pearson相关进行层次聚类分析。gydF4y2Ba
共表达分析模型gydF4y2Ba
使用R包coseq对差异表达的转录本和lncrna进行共表达分析[gydF4y2Ba108gydF4y2Ba) (gydF4y2Bahttps://bioconductor.org/packages/devel/bioc/vignettes/coseq/inst/doc/coseq.htmlgydF4y2Ba).我们运行了两个聚类方法(gydF4y2BaKgydF4y2Ba-means算法和高斯混合模型)用于两种不同的计数数据转换函数(中心对数比(CLR)和logCLRgydF4y2BaKgydF4y2Ba则;Logit和arcsin对于高斯混合模型)。为防止初始化问题,每个方法/转换组合执行10个技术重复。我们计算了30个模型gydF4y2BaKgydF4y2Ba= 10到gydF4y2BaKgydF4y2Ba= 40 (gydF4y2BaKgydF4y2Ba=集群数)。每种方法都是最好的gydF4y2BaKgydF4y2Ba是通过斜率启发式方法选择的gydF4y2BaKgydF4y2Ba-means方法或通过集成完成似然(ICL)准则的高斯混合模型。转换函数,它最小化了簇内的可变性(对于gydF4y2BaKgydF4y2Ba-means算法)或ICL准则(高斯混合模型)被保留。自gydF4y2BaKgydF4y2Ba-means算法似乎对极端表达式数据更敏感,我们最终保留了带arcsin变换函数的高斯混合模型方法,K = 24。这种方法为每个簇提供了更均匀的转录本数量。gydF4y2Ba
对于每个聚类,GO项的奇异富集分析(SEA) (AgriGO v2.0) [gydF4y2Ba109gydF4y2Ba]进行(Fisher检验,FDR截断值为0.01,最小映射条目数为10),使用时间过程实验中对应表达基因的自定义参考。使用secompare程序(AgriGO v2.0)获得了比较单个集群SEA结果的热图。gydF4y2Ba
生物信息学分析gydF4y2Ba
我们从flo - id中提取了413个基因[gydF4y2Ba16gydF4y2Ba],包括306个花期核心基因、花分生组织特征和花发育相关基因(FMI-FD)和有待注释的花期基因。对于tf的分析,我们使用PlantTFDB 4.0 (gydF4y2Bahttp://planttfdb.cbi.pku.edu.cn/gydF4y2Ba).染色质相关基因在[gydF4y2Ba38gydF4y2Ba].采用多重实验观察器工具(MeV)进行分层聚类,以Pearson相关度量和平均连锁聚类为连锁方法[gydF4y2Ba110gydF4y2Ba].类执行了函数注释和分类gydF4y2Ba”gydF4y2BaAgriGOgydF4y2Ba”gydF4y2Ba基因本体工具[gydF4y2Ba109gydF4y2Ba]和BAR的Classification SuperViewer工具[gydF4y2Ba111gydF4y2Ba].对于每个聚类,我们提取了具有最佳FDR和最佳专业化和丰富的“子”GO术语的生物过程(BP) GO术语(附加文件)gydF4y2Ba23gydF4y2Ba).维恩图是使用T. Hulsen (gydF4y2Bahttp://bioinformatics.psb.ugent.be/webtools/Venn/gydF4y2Ba).gydF4y2Ba
主题检测gydF4y2Ba
“优先定位Motifs”算法基于转录起始位点(TSS)周围的motif的过度表示,从TSS到5'UTR的区域- 300,与TSS之前在−1000到−300(学习区域)的分布相比[gydF4y2Ba46gydF4y2Ba].我们还研究了一份由PLACE [gydF4y2Ba112gydF4y2Ba]及AGRIS (gydF4y2Bahttp://agris-knowledgebase.org/AtcisDB/bindingsites.htmlgydF4y2Ba)以充实(gydF4y2BapgydF4y2Ba-value < 0.05)与所有拟南芥基因组相比(附加文件gydF4y2Ba23gydF4y2Ba).gydF4y2Ba
加入数量gydF4y2Ba
进入国际GEO存储库的登录号是GSE116123。gydF4y2Ba
缩写gydF4y2Ba
- 度:gydF4y2Ba
-
差异表达基因gydF4y2Ba
- 英国《金融时报》:gydF4y2Ba
-
转录因子gydF4y2Ba
- 走:gydF4y2Ba
-
基因本体论gydF4y2Ba
- LD:gydF4y2Ba
-
长时间gydF4y2Ba
- 信号:gydF4y2Ba
-
长非编码gydF4y2Ba
- SD:gydF4y2Ba
-
短几天gydF4y2Ba
- 图:gydF4y2Ba
-
转录单位gydF4y2Ba
- ZT型:gydF4y2Ba
-
授时因子gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
hehepworth J, Dean C.开花位点C的教训:保守染色质开关支持发育时间和适应。中国生物医学工程学报,2015;29(4):344 - 344。gydF4y2Ba
- 2.gydF4y2Ba
Pajoro A, Biewers S, Dougali E, Leal Valentim F, Mendes MA, Porri A, Coupland G, Van de Peer Y, Van Dijk AD, Colombo L,等。(r)控制拟南芥植物繁殖的基因调控网络的进化:二十年的历史。中国机械工程学报,2014;26(3):344 - 344。gydF4y2Ba
- 3.gydF4y2Ba
李志刚,李志刚,李志刚gydF4y2Ba君士坦斯gydF4y2Ba基因的gydF4y2Ba拟南芥gydF4y2Ba促进开花并编码一种与锌指转录因子相似的蛋白质。细胞。1995;80:847-57。gydF4y2Ba
- 4.gydF4y2Ba
花期调控的遗传学研究进展。植物学报,2005;3(1):3 - 16。gydF4y2Ba
- 5.gydF4y2Ba
宋永红,沈宗杰,金月-舒尔茨,田秀文。叶片光周期开花的时间测量机制。植物学报,2015;gydF4y2Ba
- 6.gydF4y2Ba
Corbesier L, Vincent C, Jang S, Fornara F, Fan Q, Searle I, Giakountis A, Farrona S, Gissot L, Turnbull C,等。FT蛋白运动参与拟南芥花诱导的长距离信号传递。科学。2007;316(5827):1030 - 3。gydF4y2Ba
- 7.gydF4y2Ba
Corbesier L, Gadisseur I, Silvestre G, Jacqmard A, Bernier G.拟南芥花诱导同步系统的设计。植物学报,1996;9(6):947-52。gydF4y2Ba
- 8.gydF4y2Ba
麦克朗CR,卢P,赫尔曼德V,金智。环境温度对生长和开花诱导的重要性。植物科学进展,2016;7:1266。gydF4y2Ba
- 9.gydF4y2Ba
季节性开花调控中的分子记忆:从有能力到停止。中国生物医学工程学报。2015;gydF4y2Ba
- 10.gydF4y2Ba
激素控制花的转变:一个人能全部抓住它们吗?中国生物医学工程学报。2017;30(2):288-301。gydF4y2Ba
- 11.gydF4y2Ba
Mahrez W, Shin J, Munoz-Viana R, Figueiredo DD, Trejo-Arellano MS, Exner V, Siretskiy A, Gruissem W, Kohler C, Hennig L. BRR2a通过FLC剪接影响开花时间。PLoS Genet, 2016;12(4):e1005924。gydF4y2Ba
- 12.gydF4y2Ba
郭杰,孙gh,宋俊杰,徐hs。开花位点C的翻译后修饰可调节其活性。中国生物医学工程学报,2017;32(3):383-9。gydF4y2Ba
- 13.gydF4y2Ba
FLC位点:表观遗传学和适应性发现的平台。细胞发育生物学,2017;33:55 - 75。gydF4y2Ba
- 14.gydF4y2Ba
段慧慧,魏丽华,张超,王艳,陈琳,陆铮,陈柏荣,何超,贾刚。ALKBH10B是影响拟南芥花转化的RNA N(6)-甲基腺苷去甲基酶。植物学报。2017;29(12):2995-3011。gydF4y2Ba
- 15.gydF4y2Ba
环境知觉和表观遗传记忆:通过FLC的机械洞察力。中国植物学报,2015;29(1):344 - 344。gydF4y2Ba
- 16.gydF4y2Ba
布什F, Lobet G, Tocquin P, persorleux C. flo - id:拟南芥开花时间基因网络的交互式数据库。核酸研究,2016;44(D1): D1167-71。gydF4y2Ba
- 17.gydF4y2Ba
植物长基因间非编码(linc) rna的功能。中国植物学报,2017;30(1):67-73。gydF4y2Ba
- 18.gydF4y2Ba
Krzyczmonik K, Wroblewska-Swiniarska A, Swiezewski S.拟南芥发育转变受双向转录基因产生的反义rna调控。RNA生物学,2017;14(7):838-42。gydF4y2Ba
- 19.gydF4y2Ba
金德华,奚燕,宋山。长链非编码RNA的模块功能,COLDAIR在春化反应中的作用。PLoS Genet, 2017;13(7):e1006939。gydF4y2Ba
- 20.gydF4y2Ba
许俊杰,宋世峰。长内含子非编码RNA介导的春化介导表观遗传沉默。科学。2011;331(6013):76 - 9。gydF4y2Ba
- 21.gydF4y2Ba
刘芳,刘志刚,刘志刚,刘志刚。拟南芥Polycomb基因冷诱导的长反义转录本沉默。自然。2009;462(7274):799 - 802。gydF4y2Ba
- 22.gydF4y2Ba
刘飞,Marquardt S, Lister C, Swiezewski S, Dean C.反义转录本靶向3 '处理引发拟南芥FLC染色质沉默。科学。2010;327(5961):94 - 7。gydF4y2Ba
- 23.gydF4y2Ba
Shin JH, Chekanova JA。拟南芥RRP6L1和RRP6L2通过调控反义RNA合成在开花位点C沉默中的作用。公共科学图书馆。2014;10(9):e1004612。gydF4y2Ba
- 24.gydF4y2Ba
恩里克斯R,王华,刘杰,Boix M,黄丽芬,蔡新华。由CDF5及其反义RNA FLORE组成的反相调节模块将生物钟与光周期开花联系起来。植物学报,2017;21(3):854-67。gydF4y2Ba
- 25.gydF4y2Ba
王kc,常海海。长链非编码rna的分子机制。生物化学学报,2011;43(6):904-14。gydF4y2Ba
- 26.gydF4y2Ba
狄晨,袁杰,吴勇,李娟,林华,胡林,张涛,齐勇,Gerstein MB,郭勇,等。拟南芥胁迫响应型lncrna的表达、表观遗传和结构特征分析植物学报,2014;30(5):848-61。gydF4y2Ba
- 27.gydF4y2Ba
袁超,王娟,孙文杰,陈敏,陈东,陈敏。拟南芥天然反义转录本的全基因组研究。DNA res 2015;22(3): 233-43。gydF4y2Ba
- 28.gydF4y2Ba
拟南芥开花时间基因的全植物网络整合研究。科学通报2016;6:29042。gydF4y2Ba
- 29.gydF4y2Ba
Klepikova AV, Logacheva MD, Dmitriev SE, Penin AA。拟南芥顶端分生组织时间序列的RNA-seq分析揭示了花起始的临界点。BMC Genomics. 2015;16:466。gydF4y2Ba
- 30.gydF4y2Ba
Torti S, Fornara F, Vincent C, Andres F, Nordstrom K, Gobel U, Knoll D, Schoof H, Coupland G.花转化过程中拟南芥芽分生组织转录组的分析确定了不同的调节模式和促进开花的富含亮氨酸的重复蛋白。植物学报。2012;24(2):444-62。gydF4y2Ba
- 31.gydF4y2Ba
Schmid M, Uhlenhaut NH, Godard F, Demar M, Bressan R, Weigel D, Lohmann JU。用全局表达分析解剖花诱导途径。发展。2003;130(24):6001 - 12所示。gydF4y2Ba
- 32.gydF4y2Ba
You Y, Sawikowska A, Neumann M, Pose D, Capovilla G, Langenecker T, Neher RA, Krajewski P, Schmid M.拟南芥开花期间芽分生组织基因表达和组蛋白标记的时间动态。Nat Commun. 2017;8:15120。gydF4y2Ba
- 33.gydF4y2Ba
Samach A, Onouchi H, Gold SE, Ditta GS, Schwarz-Sommer Z, Yanofsky MF, Coupland G. CONSTANS靶基因在拟南芥生殖发育中的作用科学。2000;288(5471):1613 - 6。gydF4y2Ba
- 34.gydF4y2Ba
王晓明,王晓明,王晓明,王晓明,王晓明。拟南芥花诱导过程的时空信息整合。科学。2005;309(5737):1056 - 9。gydF4y2Ba
- 35.gydF4y2Ba
Michaels SD, Himelblau E, Kim SY, Schomburg FM, Amasino RM。冬生拟南芥开花信号的整合。植物科学进展。2005;37(1):1 - 5。gydF4y2Ba
- 36.gydF4y2Ba
杨晓明,王晓明,王晓明,王晓明,等。TSF基因的克隆与表达。中国生物医学工程学报,2005;29(4):379 - 379。gydF4y2Ba
- 37.gydF4y2Ba
拟南芥根发育的细胞壁异质性研究。前沿植物科学,2016;7:1242。gydF4y2Ba
- 38.gydF4y2Ba
朱培恩,李志刚,李志刚,李志刚。拟南芥原生质体液体培养全能性研究进展。植物学报。2013;25(7):2444-63。gydF4y2Ba
- 39.gydF4y2Ba
王志刚,王志刚。植物叶片发育的细胞形态学研究。植物科学进展(英文版);gydF4y2Ba
- 40.gydF4y2Ba
Dewitte W, Riou-Khamlichi C, Scofield S, Healy JM, Jacqmard A, Kilby NJ, Murray JA。d型细胞周期蛋白CYCD3改变拟南芥细胞周期分布、增殖和抑制分化。植物学报。2003;15(1):79-92。gydF4y2Ba
- 41.gydF4y2Ba
Imai KK, Ohashi Y, Tsuge T, Yoshizumi T, Matsui M, Oka A,青山T. A型细胞周期蛋白CYCA2;3是拟南芥核内再复制倍性水平的关键调控因子。植物学报。2006;18(2):382-96。gydF4y2Ba
- 42.gydF4y2Ba
蒋震,刘旭,彭震,万勇,季勇,何伟,万伟,罗娟,郭慧。植物系统研究拟南芥激素数据库AHD2.0更新版。核酸决议2011;39(数据库issue): D1123-9。gydF4y2Ba
- 43.gydF4y2Ba
舒凯,陈强,吴勇,刘瑞,张慧,王松,唐松,杨伟,谢强。脱落酸不敏感4通过直接促进拟南芥开花位点C的转录负调控开花。中国科学(d辑),2016;26(1):1 - 5。gydF4y2Ba
- 44.gydF4y2Ba
张娟,陈晓明,张晓明,陈晓明,陈晓明,陈晓明。拟南芥AtSOFL1和AtSOFL2基因在拟南芥细胞分裂素表达中的冗余正向调控作用。科学通报。2009;4(12):e8236。gydF4y2Ba
- 45.gydF4y2Ba
Argyros RD, Mathews DE, Chiang YH, Palmer CM, Thibault DM, Etheridge N, Argyros DA, Mason MG, Kieber JJ, Schaller GE。拟南芥B型反应调控因子在细胞分裂素信号通路和植物发育中起着重要作用。植物学报。2008;20(8):2102-16。gydF4y2Ba
- 46.gydF4y2Ba
Bernard V, Brunaud V, Lecharny a .植物基因中TATA-box预期位置的tc -motif:一类参与转录调控的新motif。BMC基因组学。2010;11:166。gydF4y2Ba
- 47.gydF4y2Ba
李志强,李志强,李志强。量化主题之间的相似性。中国生物工程学报。2007;8(2):R24。gydF4y2Ba
- 48.gydF4y2Ba
Franco-Zorrilla JM, Lopez-Vidriero I, Carrasco JL, Godoy M, Vera P, Solano R.植物转录因子的dna结合特异性及其定义靶基因的潜力。中国科学(d辑),2014;26(6):357 - 357。gydF4y2Ba
- 49.gydF4y2Ba
O'Malley RC, Huang SC, Song L, Lewsey MG, Bartlett A, Nery JR, Galli M, Gallavotti A, Ecker JR. Cistrome和Epicistrome特征塑造了调控DNA景观。细胞。2016;165(5):1280 - 92。gydF4y2Ba
- 50.gydF4y2Ba
杨晓明,李晓明,李晓明,等。拟南芥中不同阶段的生物钟调控因子。植物科学进展。2002;30(2):627 - 638。gydF4y2Ba
- 51.gydF4y2Ba
王红,李艳,潘杰,娄东,胡艳,于东。茉莉酸介导的拟南芥开花抑制需要bHLH转录因子MYC2、MYC3和MYC4。植物学报,2017;10(11):1461-4。gydF4y2Ba
- 52.gydF4y2Ba
Molitor A, Latrasse D, Zytnicki M, Andrey P, Houba-Herin N, Hachet M, Battail C, Del Prete S, Alberti A, Quesneville H,等。拟南芥hnRNP-Q蛋白LIF2和PRC1亚基LHP1共同调节胁迫响应基因的转录。植物细胞,2016;28:2197-211。gydF4y2Ba
- 53.gydF4y2Ba
Gaudin V, Libault M, Pouteau S, Juul T, Zhao G, Lefebvre D, Grandjean O.拟南芥LIKE异染色质蛋白1突变对开花时间和植物结构的影响。Devevlopment。2001;128:4847-58。gydF4y2Ba
- 54.gydF4y2Ba
张欣,Germann S, Blus BJ, Khorasanizadeh S, Gaudin V, Jacobsen SE。拟南芥LHP1蛋白与组蛋白H3 Lys27三甲基化共定位。分子生物学。2007;14(9):869-71。gydF4y2Ba
- 55.gydF4y2Ba
张波,王磊,曾玲,张超,马华。拟南芥TOE蛋白表达光周期信号,拮抗CONSTANS调控开花时间。基因开发,2015;29(9):975-87。gydF4y2Ba
- 56.gydF4y2Ba
金J,田F,杨,孟YQ,香港L,罗J,高g . PlantTFDB 4.0:对中央在植物转录因子和监管中心交互。核酸研究,2017;45(D1): D1040-5。gydF4y2Ba
- 57.gydF4y2Ba
Gangappa SN, Botto JF。植物转录因子的BBX家族。植物科学进展,2014;19(7):460-70。gydF4y2Ba
- 58.gydF4y2Ba
Khanna R, Kronmiller B, Maszle DR, Coupland G, Holm M, Mizuno T, Wu SH.拟南芥B-box锌指家族。植物学报。2009;21(11):3416-20。gydF4y2Ba
- 59.gydF4y2Ba
程晓峰,王志智。COL9是一种类似constans的基因,过表达通过降低CO和FT的表达来延迟开花。植物学报,2005;43(5):758-68。gydF4y2Ba
- 60.gydF4y2Ba
哈西丁M,哈里尔Y,雅基尔E,克朗I,格林RM。过表达CONSTANS-LIKE 5可诱导短日生长拟南芥开花。足底。2009;230(3):481 - 91。gydF4y2Ba
- 61.gydF4y2Ba
赵H,吴D, F,香港林K,张H,李·g·Y转录因子的拟南芥核因素。前沿植物科学,2016;7:2045。gydF4y2Ba
- 62.gydF4y2Ba
Swain S, Myers ZA, Siriwardana CL, Holt BF 3。核因子- y在拟南芥发育和胁迫响应中的多重作用。生物化学学报,2017;1860(5):636-44。gydF4y2Ba
- 63.gydF4y2Ba
Kumimoto RW, Zhang Y, Siefers N, Holt BF 3。在拟南芥中,NF-YC3, NF-YC4和NF-YC9是constans介导的光周期依赖开花所必需的。植物学报,2010;30(3):379-91。gydF4y2Ba
- 64.gydF4y2Ba
Kumimoto RW, Adam L, Hymus GJ, Repetti PP, Reuber TL, Marion CM, Hempel FD, Ratcliffe OJ。核因子Y亚基NF-YB2和NF-YB3在拟南芥中通过诱导长日光周期来促进开花发挥加性作用。足底。2008;228(5):709 - 23所示。gydF4y2Ba
- 65.gydF4y2Ba
傅海燕,王晓明,王晓明,等。植物转录因子1与转录因子1在植物交叉耐受性应答中的作用。中国生物医学工程学报(自然科学版);2014;gydF4y2Ba
- 66.gydF4y2Ba
蔡强,郭磊,沈志荣,王元元,张强,Sodmergen。利用WHIRLY2提高花粉线粒体DNA拷贝数:改变拟南芥呼吸和花粉管生长。中国生物医学工程学报,2015;29(1):366 - 366。gydF4y2Ba
- 67.gydF4y2Ba
Kulkarni SR, Vaneechoutte D, Vande Velde J, Vandepoele K. TF2Network:利用公开的结合位点信息预测拟南芥转录因子调控因子和基因调控网络。中国生物医学工程学报,2018;46(6):e31。gydF4y2Ba
- 68.gydF4y2Ba
Sequeira-Mendes J, algerez I, Peiro R, Mendez-Giraldez R, Zhang X, Jacobsen SE, Bastolla U, Gutierrez C.拟南芥基因组的功能地形是在染色质状态的线性基序中组织的。植物科学进展。2014;26(6):2351-66。gydF4y2Ba
- 69.gydF4y2Ba
邢东,王勇,徐瑞,叶霞,杨东,李qq。Pcf11-similar-4 (PCFS4)通过与靶位点的全基因组物理相互作用在拟南芥发育中的调控作用。BMC Genomics. 2013;14:598。gydF4y2Ba
- 70.gydF4y2Ba
Gregis V, Andres F, Sessa A, Guerra RF, Simonini S, Mateos JL, Torti S, Zambelli F, Prazzoli GM, Bjerkan KN,等。拟南芥营养发育和生殖发育过程中由短营养期直接调控的途径的鉴定。中国生物医学工程学报。2013;14(6):R56。gydF4y2Ba
- 71.gydF4y2Ba
Immink RG, Pose D, Ferrario S, Ott F, Kaufmann K, Valentim FL, de Folter S, van der Wal F, van Dijk AD, Schmid M,等。通过识别SOC1的上游和下游调控因子来描述SOC1在开花过程中的核心作用。中国生物医学工程学报,2012;26(1):439 - 448。gydF4y2Ba
- 72.gydF4y2Ba
Mateos JL, Madrigal P, Tsuda K, Rawat V, Richter R, Romera-Branchat M, Fornara F, Schneeberger K, Krajewski P, Coupland G.拟南芥短营养期和开花位点C的组合活性确定了不同的开花调控模式。中国生物工程学报。2015;16:31。gydF4y2Ba
- 73.gydF4y2Ba
邓伟,H颖,Helliwell CA, Taylor JM, Peacock WJ, Dennis ES。开花位点C (FLC)调控拟南芥整个生命周期的发育途径。中国科学:自然科学(英文版),2011;29(3):366 - 366。gydF4y2Ba
- 74.gydF4y2Ba
陶喆,沈玲,刘超,刘玲,闫艳,余华。拟南芥花转化过程中SOC1和SVP靶点的全基因组鉴定。植物学报,2012;40(4):549 - 561。gydF4y2Ba
- 75.gydF4y2Ba
李志刚,李志刚,李志刚。碳水化合物在拟南芥开花诱导中的作用:野生型和无淀粉突变体的比较。足底。1998;206(1):131 - 7。gydF4y2Ba
- 76.gydF4y2Ba
王,王晓明,王晓明,王晓明。拟南芥花信号的研究进展。光合作用和远红光响应通过增加开花位点T (FT)的表达独立调控开花。中国机械工程学报,2008;29(4):529 - 529。gydF4y2Ba
- 77.gydF4y2Ba
ortizo - marchena MI, Romero JM, Valverde F.花转化过程中糖释放的光周期控制:糖在成花信号中的作用?植物信号行为研究。2015;10(5):e1017168。gydF4y2Ba
- 78.gydF4y2Ba
李文杰,李文杰,李文杰,李文杰。诱导开花的生理信号。植物学报。1993;5(10):1147-55。gydF4y2Ba
- 79.gydF4y2Ba
桑德比IE, Geu-Flores F, Halkier BA。硫代葡萄糖苷的生物合成——基因发现及超越。植物科学进展,2010;15(5):283-90。gydF4y2Ba
- 80.gydF4y2Ba
李志强,李志强,李志强,李志强。开花位点C (FLC)是油菜Aethionema arabicum(芸苔科)发育阶段硫代葡萄糖苷含量的潜在主要调节因子。植物科学进展,2017;gydF4y2Ba
- 81.gydF4y2Ba
普鲁内达-帕兹JL,布雷顿G, Para A,凯SA。一种功能基因组学方法揭示了CHE是拟南芥生物钟的组成部分。科学。2009;323(5920):1481 - 5。gydF4y2Ba
- 82.gydF4y2Ba
王艳,李玲,叶涛,陆勇,陈霞,吴艳。ABA对拟南芥花转化的抑制作用是由ABI5介导的。中国科学(d辑:自然科学),2013;gydF4y2Ba
- 83.gydF4y2Ba
舒凯,罗旭,杨伟。脱落酸在花转化中的分子机制研究。中国生物医学工程学报,2018;29(2):344 - 344。gydF4y2Ba
- 84.gydF4y2Ba
Riboni M, Galbiati M, Tonelli C, Conti L.巨茶通过脱落酸依赖的花原激活和CONSTANS过表达的抑制因子来实现干旱逃避反应。中国生物医学工程学报,2013;29(3):366 - 366。gydF4y2Ba
- 85.gydF4y2Ba
Riboni M, Robustelli Test A, Galbiati M, Tonelli C, Conti L. aba依赖的GIGANTEA信号调控使拟南芥通过上调开花位点T逃脱干旱。中国生物医学工程学报,2016;29(3):339 - 344。gydF4y2Ba
- 86.gydF4y2Ba
Jacqmard A, Gadisseur I, Bernier G.拟南芥花转化过程中茎尖的细胞分裂和形态变化。学报学报。2003;91(5):571-6。gydF4y2Ba
- 87.gydF4y2Ba
Dewitte W, Scofield S, Alcasabas AA, Maughan SC, Menges M, Braun N, Collins C, Nieuwland J, Prinsen E, Sundaresan V,等。拟南芥CYCD3 d型细胞周期蛋白连接细胞增殖和内周期,并限制细胞分裂素反应的速率。中国科学院学报(自然科学版),2007;26(3):344 - 344。gydF4y2Ba
- 88.gydF4y2Ba
鲍忠,杨华,华杰。细胞周期调控的扰动通过激活抗病基因引发植物免疫应答。中国科学(d辑),2013;26(6):357 - 357。gydF4y2Ba
- 89.gydF4y2Ba
Ishida T, Adachi S, Yoshimura M, Shimizu K, Umeda M, Sugimoto K.生长素调节拟南芥有丝分裂周期到内循环的转变。发展。2010;137(1):63 - 71。gydF4y2Ba
- 90.gydF4y2Ba
Ishida T, Fujiwara S, Miura K, Stacey N, Yoshimura M, Schneider K, Adachi S, Minamisawa K, Umeda M, Sugimoto K. SUMO E3连接酶HIGH PLOIDY2调控拟南芥内循环启动和分生组织维持植物学报。2009;21(8):2284-97。gydF4y2Ba
- 91.gydF4y2Ba
杨晓明,杨晓明,陈晓明,等。拟南芥细胞和叶片尺寸可塑性的研究进展?植物细胞环境。2006;29(7):1273-83。gydF4y2Ba
- 92.gydF4y2Ba
Gegas VC, Wargent JJ, Pesquet E, Granqvist E, Paul ND, Doonan JH。拟南芥叶片大小变异对UV-B响应的内多倍体是一种潜在的替代适应策略。中国机械工程学报,2014;26(3):457 - 457。gydF4y2Ba
- 93.gydF4y2Ba
菲尔斯M,胡根布姆J,布鲁纳齐A,温尼克斯T,安杰南特GC,伊明克RGH。一种基于植物的化学基因组学筛选,用于鉴定开花诱导物。植物学报。2017;13:78。gydF4y2Ba
- 94.gydF4y2Ba
王志强,王志强,王志强,等。农杆菌介导植物转化的GATEWAY载体研究。植物科学进展,2002;7(5):193-5。gydF4y2Ba
- 95.gydF4y2Ba
李志刚,李志刚。拟南芥抽苔和花转变在生殖阶段变化中的意义。中国机械工程学报。2009;26(12):366 - 366。gydF4y2Ba
- 96.gydF4y2Ba
Latrasse D, Germann S, Houba-Herin N, Dubois E, Bui-Prodhomme D, Hourcade D, Juul-Jensen T, Le Roux C, Majira A, Simoncello N,等。由LIF2控制开花和细胞命运,LIF2是多梳复合体成分LHP1的RNA结合伙伴。公共科学学报,2011;6(1):e16592。gydF4y2Ba
- 97.gydF4y2Ba
高志刚,李志刚,李志刚。高等植物核DNA含量及倍性分析。Curr Protoc Cytom, 2001;第七章:7.6单元。gydF4y2Ba
- 98.gydF4y2Ba
Thevenin J, Dubos C, Xu W, Le Gourrierec J, Kelemen Z, Charlot F, Nogue F, Lepiniec L, Dubreucq B.一种快速定量分析植物异种基因表达的新系统。生态学报,2012;29(2):344 - 344。gydF4y2Ba
- 99.gydF4y2Ba
Le Roux C, Del Prete S, Boutet-Mercey S, Perreau F, Balague C, Roby D, Fagard M, Gaudin V. hnRNP-Q蛋白LIF2参与植物免疫应答。公共科学图书馆,2014;9(6):e99343。gydF4y2Ba
- One hundred.gydF4y2Ba
Gagnot S, Tamby JP, Martin-Magniette ML, Bitton F, Taconnat L, Balzergue S, Aubourg S, Renou JP, Lecharny A, Brunaud V. CATdb:来自URGV-CATMA平台的拟南芥转录组数据的公开访问。核酸研究,2008;36:D986-90。gydF4y2Ba
- 101.gydF4y2Ba
朗米德B,萨尔茨堡SL.快速间隙阅读对齐领结2。光子学报。2012;9(4):357-9。gydF4y2Ba
- 102.gydF4y2Ba
Lamesch P, Berardini TZ, Li D, Swarbreck D, Wilks C, Sasidharan R, Muller R, Dreher K, Alexander DL, Garcia-Hernandez M,等。拟南芥信息资源:改进的基因注释和新工具。核酸决议2012;40(数据库issue): D1202-10。gydF4y2Ba
- 103.gydF4y2Ba
麦卡锡DJ,陈勇,史密斯GK。生物变异方面的多因素RNA-Seq实验差异表达分析。中国生物医学工程学报,2012;40(10):4288-97。gydF4y2Ba
- 104.gydF4y2Ba
Derozier S, Samson F, Tamby JP, Guichard C, Brunaud V, Grevet P, Gagnot S, Label P, Leple JC, Lecharny A,等。在flagdb++环境中探索植物基因组。植物科学。2011;7:8。gydF4y2Ba
- 105.gydF4y2Ba
刘俊,荣昌,徐俊,王辉,邓晟,Bernad L, Arenas-Huertero C,蔡新华。全基因组分析揭示了拟南芥长基因间非编码rna的调控。植物科学进展。2012;24(11):433 - 45。gydF4y2Ba
- 106.gydF4y2Ba
谢超,袁娟,李慧,李敏,赵刚,卜东,朱伟,吴伟,陈锐,赵艳。NONCODEv4:探索长链非编码RNA基因世界。Nucleic Acids Res. 2014;42(数据库issue): D98-103。gydF4y2Ba
- 107.gydF4y2Ba
Langmead B, Trapnell C, Pop M, Salzberg SL.人类基因组短DNA序列的超快和内存高效对齐。中国生物医学工程学报。2009;10(3):R25。gydF4y2Ba
- 108.gydF4y2Ba
Rau A, Maugis-Rabusseau C. RNA-seq共表达分析的转换和模型选择。短暂的bioinform。2017; 19(3): 425 - 36。gydF4y2Ba
- 109.gydF4y2Ba
田涛,刘勇,闫红,尤强,易鑫,杜震,徐伟,苏哲。agriGO v2.0:农业社区GO分析工具包,2017年更新。核酸工程学报,2017;45(W1): W122-W129。gydF4y2Ba
- 110.gydF4y2Ba
Saeed AI, Sharov V, White J, Li J, Liang W, Bhagabati N, Braisted J, Klapa M, Currier T, Thiagarajan M,等。TM4:免费的、开源的微阵列数据管理和分析系统。生物学技术。2003;34(2):374 - 8。gydF4y2Ba
- 111.gydF4y2Ba
王晓霞,陈伟,韩波,张海生,朱涛。拟南芥低温敏感性的基因表达表型。植物科学进展。2003;32(2):893-906。gydF4y2Ba
- 112.gydF4y2Ba
黄志刚,黄志刚,黄志刚。植物顺式作用调控DNA元件(PLACE)数据库:1999。核酸工程学报,1999;27(1):297-300。gydF4y2Ba
确认gydF4y2Ba
我们感谢Bruno Letarnec和Hervé Ferry在温室里的植物护理。我们感谢Gerco Angenent教授和Suraj Jamge博士为gydF4y2BaAPI:格斯gydF4y2Ba转基因系(未发表的材料)在ITN项目的框架内。我们非常感谢Ortrun Mittelsten Scheid博士和VBCF平台进行初步测序测试。我们感谢IJPB植物天文台的Johanne Thevenin和植物细胞学和成像平台(PCIV)对流式细胞仪的技术支持。我们非常感谢梁博士的仔细阅读和意见。我们非常感谢Ronald E. Koes教授(阿姆斯特丹大学)为SDP提供阿姆斯特丹大学的博士短期奖学金。对SDP的资助表示感谢。gydF4y2Ba
资金gydF4y2Ba
SDP得到了由欧盟委员会第七框架- people -2012- itn项目EpiTRAITS (no-316965)提供的博士奖学金、INRA短期资助和阿姆斯特丹大学Swammerdam生命科学研究所的博士短期奖学金的支持。测序平台(POPS-IPS2)和IJPB受益于LabEx Saclay Plant Sciences-SPS (ANR-10-LABX-0040-SPS)的支持。资助机构在研究设计、数据收集、分析和解释以及撰写手稿方面没有发挥任何作用。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
本研究中使用和分析的数据集可根据合理要求从通讯作者处获得。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
SDP进行了实验和分析。LST执行库和测序。AM、DC、NB、CG、VB和FG进行生物信息学分析。VG分析数据并协调分析。SDP, PF和VG撰写了手稿。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
本研究中对植物进行的实验研究符合机构、国家和国际准则。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们之间没有利益冲突。gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
附加文件gydF4y2Ba
附加文件1:gydF4y2Ba
图S1。gydF4y2BaSD-LD开关的特性。(a)开花时间按SD周数计算。当第一朵花出现时,植物上就有莲座叶和茎生叶的记录。当茎距播种高度为0.5 cm时,定量测定抽苔时间。3个生物重复,每个重复12株。(b)表达gydF4y2BaAP1:格斯gydF4y2Ba在SD条件下生长4周后,将报告基因转移到LD条件下。转移后1天(dat)。(PDF 772 kb)gydF4y2Ba
附加文件2:gydF4y2Ba
图S2。gydF4y2Ba莲座叶的生长响应SD或SD- ld开关。(a)测量玫瑰丛总叶面积。(b)前六片叶子的面积测量。将Col-0植株在SD中培养4周,然后在SD(连续线)中保存或在LD(虚线)中转移。每组10株,进行2个生物重复。实验值为平均值±SEM。(PDF 70kb)gydF4y2Ba
附加文件3:gydF4y2Ba
图S3。gydF4y2BaRNA-Seq实验和表达基因分布。(a)生物复制库的大小。(b)读取不同时间点和生物重复的映射。(c)表达基因在基因组中的分布。(d)差异表达基因(DEGs)和维恩图与三种主要比较。(e)表达基因在主要基因类中的分布。(PDF 194kb)gydF4y2Ba
附加文件4:gydF4y2Ba
图S4。gydF4y2Balncrna分析。(a)用于构造lncTU数据集的资源。(b)使用Benjamini-Hochberg (BH)检验对每个比较进行差异表达的lnctu。(PDF 51kb)gydF4y2Ba
附加文件5:gydF4y2Ba
lnctu列表。(xlsx639kb)gydF4y2Ba
附加文件6:gydF4y2Ba
每个簇的基因列表。(xlsx188kb)gydF4y2Ba
附加文件7:gydF4y2Ba
24个簇的最佳富集生物过程(BP) GO术语。从每个SEA分析中提取最佳BP GO项及其FDR。(xlsx11kb)gydF4y2Ba
附加文件8:gydF4y2Ba
图S5。gydF4y2Ba从ThaleMine数据库中提取的差异表达的内复制相关基因。报告Log2 (Fold-Change)。黑色表示无统计学意义的折叠变化值。(PDF 44kb)gydF4y2Ba
附加文件9:gydF4y2Ba
flo - id数据库差异表达基因在聚类中的分布。(xlsx28 kb)gydF4y2Ba
附加文件10:gydF4y2Ba
由基因证据支持的激素相关基因群集。(xlsx22 kb)gydF4y2Ba
附加文件11:gydF4y2Ba
图S6。gydF4y2Ba花的转变和激素途径。(a) AHD基因簇分布。(b)与赤霉素代谢和反应相关的基因。(PDF 56kb)gydF4y2Ba
附加文件12:gydF4y2Ba
激素相关基因参与了集群中的几种激素通路。(xlsx10kb)gydF4y2Ba
附加文件13:gydF4y2Ba
用PLM算法识别的图案。(xlsx87 kb)gydF4y2Ba
附加文件14:gydF4y2Ba
tf在集群中的分布。(xlsx38kb)gydF4y2Ba
附加文件15:gydF4y2Ba
来自flo - id的tf。(xlsx12kb)gydF4y2Ba
附加文件16:gydF4y2Ba
图S7。gydF4y2Ba使用64个不同监管的tf并属于flo - id的TF2network用户界面的截图。三个Cytoscape面板显示了前5个排名最好的调控因子(蓝色菱形)的基因调控网络。根据TF2Network接口注释,绿色菱形代表tf基因,绿色圆圈代表非tf基因。虚线箭头表示对应调节器的PWM图案。蓝线表示蛋白质之间的相互作用。(PDF 524kb)gydF4y2Ba
附加文件17:gydF4y2Ba
与染色质生物学相关的差异表达基因。(xlsx19 kb)gydF4y2Ba
附加文件18:gydF4y2Ba
与染色质生物学相关的差异表达基因的分布。CR:染色质重塑。(xlsx9kb)gydF4y2Ba
附加文件19:gydF4y2Ba
lntu及其NATs的表达。(xlsx25kb)gydF4y2Ba
附加文件20:gydF4y2Ba
图S8。gydF4y2BaMAF5及其反义lntu的表达位于3 '端gydF4y2BaMAF5gydF4y2BaT0, T2和T3的区域。(a)褶皱变化。(b)显示表达式概要的浏览器快照。BR1: 1号生物复制。(PDF 77 kb)gydF4y2Ba
附加文件21:gydF4y2Ba
TFBFs在lnctu区域的分布。(xlsx21 kb)gydF4y2Ba
附加文件22:gydF4y2Ba
寡核苷酸列表。(xlsx8kb)gydF4y2Ba
附加文件23:gydF4y2Ba
在PLACE和AGRIS数据库中关于已识别图案的信息。(xlsx38kb)gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文根据创作共用属性4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)除另有说明外,适用于本条所提供的资料。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
德尔普雷特,S,莫里托,A,查里夫,D。gydF4y2Baet al。gydF4y2Ba成熟叶在花诱导过程中广泛的核重编程和核内重复。gydF4y2BaBMC植物生物学gydF4y2Ba19,gydF4y2Ba135(2019)。https://doi.org/10.1186/s12870-019-1738-6gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-019-1738-6gydF4y2Ba
关键字gydF4y2Ba
- 植物的过渡gydF4y2Ba
- 叶gydF4y2Ba
- 拟南芥gydF4y2Ba
- 转录gydF4y2Ba
- 非编码RNAgydF4y2Ba
- 转录因子gydF4y2Ba
- DNA的主题gydF4y2Ba
- 核内复制gydF4y2Ba