抽象的
背景
白粉病(PM)是一种广泛存在于温带气候的植物真菌病害,给农业环境造成重大经济损失。的特殊同源物枣疯病基因家族是PM敏感因素,因为它们的功能丧失导致耐用的PM电阻(枣疯病几种植物种类中的抵抗力。角色枣疯病植物 - 病原体相互作用中的易感性基因仍然难以捉摸,但是已知在PM感染后强烈上调它们。
结果
在这项研究中,我们调查了414个推定推杆区域(PPRS)的结构枣疯病基因和突出的主题和调节元素模式与同源物种和系统发育距离之间的基因组关系相关。发现TC盒状图案和胸腺嘧啶的富泳图案被认为是超越的枣疯病基因在用PM真菌感染时转录上调。作为概念证明,我们表明甜瓜的表达(Cucumis Melo.L.)在用PM真菌感染后,强烈地上调了上述上述基因的基因podosphaera xanthii..
结论
在识别候选人时枣疯病甜瓜的易感基因,本研究提供了对转录控制的见解枣疯病基因并表示有助于识别的诊断功能枣疯病易感基因跨物种影响PM疾病。
背景
白粉病(PM)是由Erysiphales子囊菌属真菌引起的,可严重影响温带地区栽培的几种农业品种的产量和品质,包括甜瓜(Cucumis Melo.l .)。PM的化学控制通常是昂贵的,并提出了重要的环境问题。因此,了解基因型抗性的分子机制对农业遗传育种具有重要意义。
的特殊同源物Mildew Locus O.(枣疯病)植物特异性基因家族是PM敏感性因素,因为它们的函数丧失导致耐用和广谱形式的抵抗力,称为枣疯病反抗 [1].最初在大麦中发现,枣疯病抗性后来显示在几种其他物种中发生,即拟南芥,番茄,豌豆,胡椒,烟草和小麦[2那3.那4.那5.那6.那7.那8.那9.那10.[证明是否对果实和内生症PM物种有效[10.那11.].因此,若干作者提出了基于鉴定和灭活的植物育种策略的机会枣疯病易感性基因[1那7.].
到目前为止没有公知,枣疯病易感基因属于两个系统发育型切片,分别称为Clade IV和V,其特异性是单焦和销售的[12.那13.那14.那15.那16.].但是,并非所有的思工IV和Clade V枣疯病基因是PM的易感性因素。例如,当番茄基因沉默时slmlo1.结果是枣疯病抗白粉病病原体粉孢子neolycopersici,沉默了其他V型进化支的基因SLMLO3.那SLMLO5.和SLMLO8.仍然与敏感的表型相关[17.].先前的调查显示枣疯病同源物在PM易感性中发挥着重要作用,包括大麦HvMLO, 番茄slmlo1.和胡椒Camlo2.,用PM真菌感染后几个小时转录上调[2那11.那18.].
转录是在几个阶段调节的非常重要的生物过程。了解基因规则如何策划是表征复杂事件,如植物病原体相互作用的重要挑战[19.那20.].被称为转录因子(TFS)的蛋白质以特定方式调节基因表达,通过其与DNA调节元件的结合[21].因此,基因表达分析的关键目标是鉴定转录因子和DNA调节元件。在过去十年中,经验数据积累了表明调节因素的突变可能是表型分歧的主要原因[22那23].
术语“启动子”用于指定位于基因上游的基因组序列,其倾向于含有顺式作用调节元件(CRES)。基于从转录开始点(TSS)的距离,也使用“近端启动子”(TSS上游的几百个核苷酸)和“远端启动子”(千分比和更多核苷酸的TSS上游)的术语。大多数CRE由5-20个核苷酸组成,并且在近端启动子中局部化[24].通常认为具有相似表达模式的基因在其启动子区域中含有共同的基序[25].
全基因组数据和下一代测序技术的可用性开辟了新的途径,用于分析基因调控和表达。在植物中的特殊数据库的发展[26]以及生物信息学工具的发展,以发现DNA序列中的特定主题[27大大方便了促进剂的硅分析。多种方法可以帮助识别调控基序,包括基于缺失的功能分析、比较基因组学、其共同表达基因的分析,以及ChIP-Chip或ChIP-Seq [28那29那30.]超人级主题的共同表达基因[31那32].
在这项研究之前,一个独特的CRE与拟南芥易感基因的启动子区域相关ATMLO2.和共同表达的基因,被发现响应衰老,轻应力,伤害和PM接种[33].我们的研究目的是在推定的推动者地区(PPRS)中的矿山主题和监管要素枣疯病基因,并确定推测的调控序列特定于支V同源物或枣疯病已知在PM感染时易于上调基因。通过生物信息学分析绘制的结论是通过转录表征证实的枣疯病我们最近在甜瓜基因组中描述的基因[13.].
结果与讨论
识别和分配枣疯病viridiplantae的克里斯
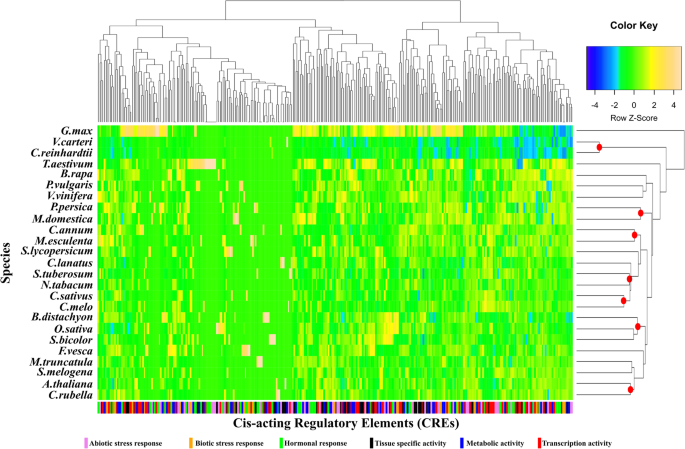
对应于预测TSS上游的2kBP序列的推定的推动者区(PPRS)成功提取447以下的414枣疯病前面在25种植物基因组中描述的基因[13.].识别借鉴参与转录调控的CREMLO-表达式,对地点数据库执行搜索。检测到以可变数量和顺序分布的三百十六个非冗余CRE(附加文件1:表S1)。总共有186,060个元素在我们的414的PPR中注释了枣疯病检测到基因数据集,检测到每位同源物的正向和反向补充取向的平均449个CRES(表1).Capsicum annum.和拟南芥基因组具有最高的(476)次枣疯病同源物,而Broachypodium distachyon.基因组的数量最低(346).最丰富的CRE是DOFCOREZM(PLACE-ID:S000265),CACTFTPPCA1(ID:S000449)和CAATBOX1(ID:S000028),它们分别在整个数据集中记录10,983,10,431和8533次(附加文件1:表S1)。DOFCOREZM是DOF (dna结合One zinc Finger)蛋白结合所需的核心位点,DOF蛋白是高等植物中参与许多生物过程的转录因子家族[34].存在于CactFTPPCA1元件中的四核苷酸腺,是C4植物中叶肉瘤表达的关键组分[35那36].
通常,开花植物就元素数量和全球密度分布而表现出家用的图案(图。1).实际上,观察到葫芦科(Cucumis Melo.和Cucumis sativus),蔷薇科(Malus Domestica.和碧桃),Poaceae(Broachypodium distachyon.那奥雅萨苜蓿和高粱二色的),solanaceae(Solanum lycopersicum和尼科尼亚塔哈瓦姆)和十字花科(拟南芥和Capsella风疹).在其他情况下,枣疯病-CRE配置文件似乎是家庭独立的,如在情况Brassica Rapa.和甘氨酸最大.这可能是由于缺少一些关于一些人的信息枣疯病家庭成员,或发生真实物种的特定模式。对个体CRE的分析表明,九克雷斯特异性存在于单焦点或eDICOTS中。正如预期的那样,枣疯病藻类的CRE剖面(Volvox Carteri.和Chlamydomonar Reinhardtii.)显然与开花植物中的一个不同(图。1),共包含147个在绿色植物进化过程中可能与保守特征相关的元素,并参与了绿色植物的转录枣疯病同源染色体。
的分布枣疯病在系统发育型切片中的克里斯
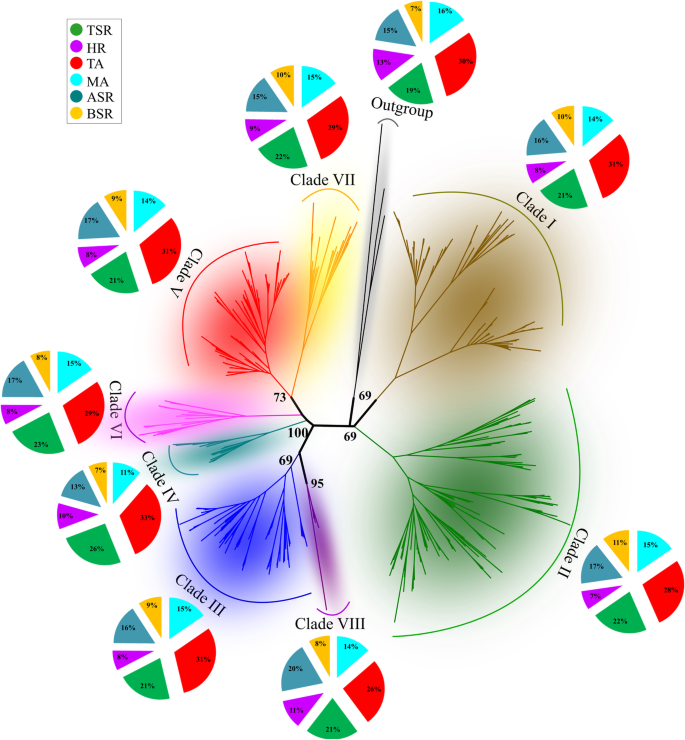
经鉴定的cre可细分为6个功能类别:代谢活性(MA)(63)、转录活性(TA)(74)、组织比活性(TSA)(45)、激素反应(HR)(60)、生物应激反应(BSR)(24)和非生物应激反应(ASR)(50)。通过归一化,得到了一个系统进化分支特有的CRE剖面,每个分支的每个CRE类在属于同一类的CRE总数上的丰度[不尽进化枝类/ Cres.类](附加文件1:表S2)。总的来说,在所研究的8个系统发育支系中,纲的分布没有显著差异(图。2).MA、HR和BSR类在所有进化支系中分布均匀。与TA相关的CREs的百分比较高枣疯病-PRAD I,III和V(31%)和IV(33%)。在Clades IV(26%)和VIII(20%)中观察到与TSA和ASR相关的CRE中的最高百分比(图20%)(图。2).在八分水切割的所有监管型材中,119的核心(〜40%)CRE元素高度保守。这个子集可以有助于解释协调的上调枣疯病来自不同曲面的同源物响应于相同的生物或非生物胁迫[37].可能是PPRS的核心监管结构枣疯病属于不同的植物的S促进对环境提示的基本基因激活。在病原体响应或CLADE V中没有发现特异性CRE枣疯病基因(表格2).
为了鉴定富含特异性系统发育的CRES,进行基序富集分析。五个片状(I,II,III,IV和V)显着富集了CRES(E-CRES)(附加档案1:表S3)。总共确定了43个过度的CRE,其中约40%被分组到TA-Class中(附加档案1:表S3)。枣疯病支I和支II的PPRs聚类显示了特异性转录因子结合位点的富集(支I的MYCATRD22;进化支III有5个e-CREs (POLASIG1、POLASIG2、GT1GMSCAM4、TATABOX5和MARTBOX)。与应激信号响应因子(ER和pr蛋白)相关的元件AGCBOXNPGLB是唯一在进化支IV中显著富集的CRE。有趣的是,在43个鉴定的e-CREs中,超过50%(24个)的e-CREs主要与TA类相关,与PPRs相关枣疯病进化枝V中的同源物聚类(调整后)P.-Value <0.01)。
病原体应答中假定的调控基序的重新鉴定mlos.
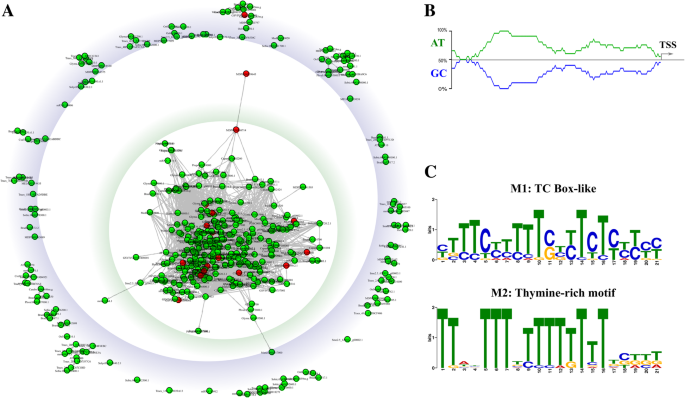
转录响应性PPRS的额外调节基序枣疯病-Homologs公开了。根据PPR-DataSet的第一个全局对准,在预测TSS上游的前200BP中观察到最高序列标识。限制该区域的相似性矩阵突出显示含有约65%的PPR的大型集群,包括17个(18个)枣疯病已知在PM感染时上调的基因(表2和无花果。3.一种)。相同区域的多次对准显示PPR的序列同一性(33%)和含量(70%)枣疯病与其他数据集相比,PM感染后同源基因表达上调(分别为27和64%)(图。3.有趣的是,PPRs的表达与at含量之间的显著关联此前已被报道为不同的基因mlos.[38].
采用模因d -模态分析方法,鉴定了大鼠PPR中富集的基序枣疯病基因在与PM真菌的相互作用期间上调或包括在CLADE V中(表2).值得注意的是,发现了两种超人的主题(M1和M2)枣疯病PM感染后基因上调(附加文件1:表S4)。除了ATMLO3.,这些图案存在于预测的TSS上游的0.4kbp序列内。三个保守的主题(M3,M4和M5)在CLADE V同源物中过于代表(附加文件1:表S4)。M1的一致序列(图。3.c)类似于TC元素序列。以前的研究表明,TC元素可以构成参与特定条件表达的植物基因表达复杂调节的新型调节序列[39].高度保守的(〜70%的同一性)M2基序的特征在于高含量的胸腺嘧啶残基。富含胸腺嘧啶的基序作为转录效率的基本要素,因为它可以增加下游促进剂序列的可达性进行额外的蛋白质因子[40那41].PPR-DataSet中剩余的M3,M4和M5序列的高可变性使其预测其推定作用的预测使其复杂化。
基于基因组本体(Genome Ontology, GO)关联分析,预测M1 ~ M5基序与跨膜转运(GO:0005886和GO:0006813)、转录正向调控(GO:0016563)和转录因子活性(GO:0045449、GO:0003700和GO:0045941)相关。母题M2与GO:0001950相关联酿酒酵母富含质膜蛋白蛋白质的基因的启动子区域。总体而言,这些结果符合MLO蛋白质的跨膜定位及其在跨膜运输中的作用[14.].
414的PPRs枣疯病还通过桅杆分析基因,以验证以前特征的CRE主题的发生。(2010)[33在拟南芥易感基因中ATMLO2.和中的基因。值得注意的是,大约96%(408)的人发现了这种母题枣疯病启动子。通过该基序驱动的β-葡萄糖醛酸糖苷酶(GUS)报告基因的表达模式的实验突出了几个器官中的强信号,并且不仅是PM接种,还呈衰老,轻应力和伤害[33].综上所述,这些结果表明该motif可能代表了枣疯病基因,调节表达响应内稳态扰动。
生物信息学结果的转录验证
在Silico分析中,突出了两个推定的PPR监管元素的超额陈述,即TC盒状和富含胸腺的主题,枣疯病在PM感染时上调同源物。作为概念证明,我们分析了先前在甜瓜基因组中发现的三种Clade V基因的转录响应[13.)(Melo3C005044:CMMLO3那Melo3C012438:CMMLO5.和Melo3C025761:CMMLO12.).其中,Melo3C012438显示最佳组合匹配(组合P.-Value <1E-5)对于PPR区域的过度代表的基序。随着PM真菌的人工接种后podosphaera xanthii.,强烈上调Melo3C012438在接种后5和9小时观察到。相比之下,没有检测到显着差异Melo3C005044, 和Melo3C025761.(无花果。4.).作为eudicot.枣疯病易感性基因属于CLADE V,并在PM挑战时上调[2那11.那18.我们的结果表明Melo3C012438是甜瓜的PM敏感因素。
结论
的表达控制机制枣疯病同源物不清楚。在这里,我们报告了表征枣疯病从25种植物和藻类中提取的大型数据集中的PPRS。推定的分布模式枣疯病调节元素根据种类相关性和同源物种之间的系统和系统发育距离而变化。在CLADE V的PPRS中,两个图案,称为M1和M2,在CLADE V的PPR中持续枣疯病在PM感染时上调的基因,已知为PM易感基因充当PM易感基因。按照这一发现,我们展示了,在甜瓜,v枣疯病富含M1和M2的基因在用甜瓜PM真菌攻击后上调podosphaera xanthii..总体而言,这项研究提供了对PPR的见解枣疯病基因家族,报告候选人的特征枣疯病并突出PPR的诊断特征,可用于鉴别枣疯病栽培物种间的易感基因。这一信息对于繁殖目的是极有价值的,如失活枣疯病易感基因,例如靶向沉默和基因组编辑,可能导致PM抗性基因型的鉴定。
方法
推定推动者区数据集
447.枣疯病来自二十五种不同基因组的基因(Volvox Carteri.那衣藻reinhardtii那拟南芥那Brassica Rapa.那Capsella风疹那Citrullus lanatus.那Cucumis Melo.那cucumis。缎点那Manihot Esculenta.那甘氨酸最大那Medicago Truncatula.那phoudolusulus vulgaris.那Broachypodium distachyon.那奥雅萨苜蓿那高粱二色的那小麦那草莓属vesca那Malus Domestica.那碧桃那Solanum lycopersicum那尼科尼亚塔哈瓦姆那Capsicum Annuum.那茄属植物melongena那Solanum Tuberosum.和葡萄),被认为是初始数据集。利用BEDTools v2.17.0提取推定启动子区域(PPRs)(在基因注释中报道的预测TSS上游2 Kbp) (http://samtools.sourceforge.net.进一步使用414pprs(447个),进一步使用PPR长度> 1kbp。
viridiplantae中Cres的检测和分布枣疯病同源染色体
PPR序列被扫描,转向和反向补充取向,以搜索植物CIS作用调节DNA元素(PLACE)数据库中存在的顺式作用调节元素(CRE)(https://sogo.dna.affrc.go.jp/cgi-bin/sogo.cgi?lang=en& pj=640&ack = page&page=newplace)[26].使用最严格的识别标准(完全匹配)。通过消除由“相同序列”定义的重复的图案,使用了针别手-Wunsch算法(默认设置)来生成非冗余数据集。为了获得Viridiplantae的Cre图枣疯病同源物,进行了注释CRE的分层聚类分析。使用“GPLOTS”R软件包从CRE-丰度矩阵开始产生热图[41].
对系统发育型切口和转录反应的特征
根据文献中报告的每个元素的调控功能,将鉴定出的crs(316)手工划分为6个不同的功能类别(类):
代谢活动(ma):涉及初级和次生代谢物的生物合成;
转录活动(TA):通过转录因子认可;
组织特异性活动(TSA):与特定组织有关;
激素的反应(HR):由植物激素诱导;
生物应激反应(BSR):由生物胁迫引起;
非生物应激反应(ASR):由非生物应激诱导。
对每个枝,每个CRE类在属于同一类的CRE总数上的丰度进行归一化,得到一个特定枝的CRE剖面[不尽进化枝类/不尽类].为了识别特定进化支中过多的CREs,使用MEME套件中可用的Analysis of Motif Enrichment (AME)工具和默认的截止值,将与每个进化支相关的PPRs与其余数据集的PPRs进行比较[42].使用Ranksum测试评估了基序的富集意义,也称为Mann-Whitney U测试,随后应用于所获得的多个测试校正P.值(调整P.-Value <0.05)。还进行了基质富集和单个CRE注释的分析,以比较在PM感染期间上调的同源物的PPR,或者包括其他人枣疯病同源染色体。
PPR相似度网络
使用MAFFT版本v6.814b对齐PPRs的前200 bp,并使用EINS-i算法生成相似矩阵[43].使用“WGCNA”R软件包进行加权相关网络分析[44].
de novo注释和功能预测枣疯病-motifs.
用于主题诱导的多个EM(MEME)算法[27用来鉴定在PPRS中特别富集的基序枣疯病包括在进化支V中的基因或先前显示的在PM激发下上调的基因(表2).使用默认的截止值以统计置信度进行判别 - 模式(D-Mode)进行分析。
使用MEME分析标识的富集基序的最佳组合匹配是使用MOME分析和搜索工具(MAST)(默认截止:P值1E-4和E-VALUE <10)进行检测到(默认截止:P值1E-4)[27].桅杆也用于确认先前由Humphry等人描述的图案的存在。(2010)[33]在PPR数据集中,使用两个不同的设置(p值<1e-4和p值<1e-3)。使用基因本体进行富集的主题(GOMO,http://meme-suite.org.) 工具 [29]确定是否有任何基因与与一种或多种基因组织(GO)术语相关的基因显着相关[45].
甜瓜的转录特性枣疯病基因
植物的Cucumis Melo.(CV。用PM真菌接种肌腱verde ts258)Podosphaera Xantii.通过刷在田地中收集的重感染叶子。用健康叶子刷的植物被用作实验对照。接种后在5,9和24小时收集叶样品(每次治疗的三种生物重复和三种技术重复)。RNA分离,cDNA制备和QRT-PCR的方案与Iovieno等人报告的相同。(2015)[7.].三种Clade V甜瓜基因的相对转录性丰度Melo3C005044那Melo3C012438和Melo3C025761.使用2评估-ΔΔct方法(46],使用β-肌动蛋白基因作为靶基因标准化的内务监工[47].使用Student的t检验来检验无效假设。用于基因表达分析的引物对均在附加文件中列出1:表S5。对于每个引物对,进行解离动力学分析以确保通过产生具有五个连续10倍稀释液的标准曲线来评估扩增产物和扩增效率的特异性。
缩写
- ame:
-
基序富集分析
- ASR:
-
非生物应激反应
- BSR:
-
生物应激反应
- CRE:
-
CIS作用监管要素
- e-CREs:
-
Enriched-CRE
- 去:
-
基因本体论
- GOMo:
-
基因本体论主题
- 人力资源:
-
荷尔蒙反应
- 马:
-
代谢活动
- 桅杆:
-
主题对齐和搜索工具
- MEME D-MODE:
-
基序诱导判别模式的多重EM
- MLO:
-
Mildew Locus O.
- 的地方:
-
植物顺式作用调控DNA元素
- 下午:
-
白粉病
- PPR:
-
推定推动者区
- TA:
-
转录活动
- TSA:
-
组织特异性活动
- TSS:
-
转录开始网站
参考
- 1。
黄志强,王志强,王志强,等。一种新的广谱耐药育种策略。摩尔品种。2010;25:1-12。https://doi.org/10.1007/S11032-009-9323-6.
- 2.
白勇,郑志刚,郑志刚,Reinstädler A, Lotti C,等。在中美洲一个番茄品种中,自然发生的广谱白粉病抗性是由mlo功能丧失引起的。植物与微生物互动学报2008;21:30-9。https://doi.org/10.1094/MPMI-21-1-0030.
- 3.
Büschgesr,hollricher k,Panstruga R,Simons G,Wolter M,Frijters A等人。大麦MLO基因:一种新型植物病原体抗性控制元素。细胞。1997年; 88:695-705。https://doi.org/10.1016/s0092 - 8674 (00) 81912 - 1.
- 4.
辅音C, Humphry ME, Hartmann HA, Livaja M, Westphal L, Vogel J,等。白粉病发病过程中对植物宿主细胞蛋白的保守需求。Nat麝猫。2006;38:716-20。https://doi.org/10.1038/ng1806.
- 5.
Fujimura T, Sato S, Tajima T, Arai M.日本国产烟草品种Kokubu的白粉病抗性与MLO同源物的异常剪接有关。植物病理学研究。2016;(8):1358 - 65。https://doi.org/10.1111/ppa.12498.
- 6.
沉没我,Reinstaedler A,Ivanov S,Bisseling T,Panstruga R.豌豆ER1植物耐用的广谱粉状抗性耐药性通过PSMLO1中的功能突变的自然丧失赋予。莫尔植物途径。2011; 12:866-78。https://doi.org/10.1111/j.1364-3703.2011.00718.x.
- 7.
Iovieno P,Andolfo G,Schiavulli A,Catalano D,Ricciardi L. Frusciante等。三种栽培葫芦科在霉菌基因座O(MLO)基因家族的结构,演化和功能推断。BMC基因组学。2015; 16:1-13。https://doi.org/10.1186/s12864-015-2325-3。
- 8。
Pavan S, Schiavulli A, Appiano M, Marcotrigiano AR, Cillo F, Visser RGF,等。豌豆白粉病er1抗性与MLO同源位点的功能缺失突变相关。Theor Appl Genet. 2011; 123:1425-31。https://doi.org/10.1007/S00122-011-1677-6.
- 9。
王Y,Cheng X,Shan Q,Zhang Y,Liu J,Gao C等人。同时编辑六倍倍醇面包小麦中的三个同种型伴侣赋予含有含粉状霉菌的萎缩性。NAT BIOTECHNOL。2014; 32:947-51。https://doi.org/10.1038/nbt.2969..
- 10。
Zheng Z,Nonomura T,Appiano M,Pavan S,Matsuda Y,Toyoda H,等。MLO Orthologs中的功能丧失降低了辣椒和番茄的易感性,并由Leveillula Taurica引起的粉状霉菌疾病。Plos一个。2013; 8:E70723。https://doi.org/10.1371/journal.pone.0070723.
- 11.
郑志强,郑志强,郑志强,等。番茄(Solanum lycopersicum)及其野生近缘植物抗白粉病的遗传和分子机制植物病理学杂志。2014;138:641-65。https://doi.org/10.1007/s10658-013-0314-4.
- 12.
Appiano M,Catalano D,SantillánMartínezm,Lotti C,Zheng Z,Visser RGF。尽管类特异性分子特征的演变,单子叶和二手MLO粉末状霉菌敏感因子在功能挽救中。BMC植物BIOL。2015; 15:257。https://doi.org/10.1186/s12870-015-0639..
- 13.
李志刚,李志刚,李志刚,等。绿草属植物mlo家族的鉴定与功能推断。植物病理学杂志。2016;98:587-94。https://doi.org/10.4454/jpp.v98i3.027.
- 14.
KUSCH S,PESCH L,Panstruga R.综合系统发育分析揭示了MLO系列整体膜蛋白的多样性和起源。基因组Biol Evol。2016; 8:878-95。https://doi.org/10.1093/gbe/evw036..
- 15.
基于同源比较的植物多蛋白家族保守肽结构域的发现。acta botanica sinica(云南植物学报),2005;https://doi.org/10.1007/S11103-0055-0353-0..
- 16.
RisaPail N,Rubiales D.基因组鉴定和豆类MLO基因家族的比较。SCI REP。2016; 6:32673。https://doi.org/10.1038/srep32673.
- 17.
郑Z,Appiano M,Pavan S,Bracuto V,Ricciardi L,Visser RGF等。番茄SLMLO基因家族的基因组研究及其在粉末状霉菌卵泡Neolycopersici中的函数表征。前植物SCI。2016; 7:380。https://doi.org/10.3389/fpls.2016.00380.
- 18。
Piffanelli P,周FS,Casais C,Orme J,Jarosch B,Schaffrath U,Collins NC等。Barley MLO的防御和细胞死亡调节剂对生物和非生物胁迫刺激的反应性。植物理性。2002; 129:1076-85。https://doi.org/10.1104/pp.010954.
- 19。
Andolfo G,Ercolano Mr。植物先天免疫多组分模型。前植物SCI。2015; 6:987。https://doi.org/10.3389/fpls.2015.00987.
- 20。
Sanseverino W,Ercolano Mr。在硅方法中预测候选R蛋白并定义其域架构。BMC RES笔记。2012; 5(1): - 11。https://doi.org/10.1186/1756-0500-5-678..
- 21。
Lenhard B,Sandelin A,Carninci P.监管元素美唑烷调色剂:新兴特征和洞察转录调控。NAT Rev Genet。2012; 13:233-45。https://doi.org/10.1038/nrg3163.
- 22。
Dulyk M.转录因子结合位点位置的计算预测。基因组Biol。2003; 5:201-11。https://doi.org/10.1186/gb-2003-5-1-201.
- 23。
朱Z,Shendure J,Church Gm。发现人细胞周期中的功能转录因子组合。Genome Res。2005; 15:848-55。https://doi.org/10.1101/gr.3394405.
- 24。
Rombauts S,Florquin K,Lescot M,Marchal K,RouzéP,van de Peer Y.鉴定植物基因组中的启动子和CIS调节元件的计算方法。植物理性。2013; 132:1162-76。https://doi.org/10.1104/pp.102.017715.
- 25.
Vilo J,Brazma A,Jonassen I,Robinson A,Ukkonen E.使用基因表达数据进行酵母基因组中推定的调节元素的挖掘。Proc Int Conv Intel Syst Mol Biol。2000; 8:384-94。
- 26.
Higo K,Ugawa Y,Iwamoto M,Korenaga T.植物顺式作用调节DNA元素(Place)数据库:1999。核酸RES。1999年; 27:297-300。https://doi.org/10.1093/nar/27.1.297.
- 27.
Bailey TL,Boden M,Buske Fa,Frith M,Grant Ce,Clementi L. Meme Suite:主题发现和搜索的工具。核酸RES。2009; 37:W202-8。https://doi.org/10.1093/nar/gkp335.
- 28.
吉H,江H,MA W,Johnson DS,Myers RM,Wong WH。用于分析芯片芯片和芯片SEQ数据的集成软件系统。NAT BIOTECHNOL。2008; 26:1293-300。https://doi.org/10.1038/nbt.1505.
- 29.
Tompa M,Li N,Bailey TL,Church Gm,De Moor B,Eskin E,喜欢AV等。评估用于发现转录因子结合位点的计算工具。NAT BIOTECHNOL。2005; 23:137-44。https://doi.org/10.1038/nbt1053.
- 30.
谢晓霞,卢建军,Kulbokas EJ, Golub TR, motha V, lindblak - toh K,等。通过几种哺乳动物的比较,系统地发现人类启动子和utr中的调控基序。大自然。2005;434:338-45。https://doi.org/10.1038/nature03441.
- 31.
Maclean D, Jerome CA, Brown AP, Gray JC。烟草和拟南芥幼苗发育过程中编码质体核糖体蛋白的核基因的光和质体信号的协同调控。植物学报。2008;66:475-90。https://doi.org/10.1007/S11103-007-9279-z..EPUB 2008年1月10日。
- 32。
Vandepoele K,Quimbaya M,Casneuf T,De Veylder L,Van de Peer Y.使用CIS-Charmatory元素和共表表达网络解开拟南芥中的转录控制。植物理性。2009; 150:535-46。https://doi.org/10.1104/pp.109.136028.
- 33。
在单子叶和双子叶植物中保守的一个调控因子定义了抗真菌植物免疫的功能模块。美国国立科学院科学技术研究所2010;107:21896-901。https://doi.org/10.1073/pnas.1003619107.
- 34。
引用本文:王志刚,王志刚,王志刚。dna结合一锌指(DOF)转录因子家族在植物中的作用。植物科学。2013;209:32-45。https://doi.org/10.1016/j.plantsci.2013.03.016.
- 35。
Akyildiz M,Gowik U,Engelmann S,Koczor M,Streubel M,Westhoff P. C4 Dicot Flaveria Trinervia中培养基特异性基因表达的顺式调节模块的演化和功能。植物细胞。2007; 19:3391-402。https://doi.org/10.1105/tpc.107.053322.
- 36。
王志强,王志强,王志强,等。C4植物黄酮中叶肉特异基因表达的顺式调控元件,C4磷酸烯醇丙酮酸羧化酶基因的启动子。植物细胞。2004;16:1077 - 90。https://doi.org/10.1105/TPC.019729.
- 37.
Nguyen VNT, Vo KTX, Park H, Jeon JS, Jung K-H。水稻MLO家族在水稻形态发育、昼夜反应、光信号通路和各种胁迫反应等方面发挥着重要作用。植物学报2016;7:1413。https://doi.org/10.3389/fpls.2016.01413.
- 38.
Kravatskaya Gi,车臣VR,Kravatsky YV,Tumanyan VG。超铜敏敏感基因启动子区核苷酸序列的结构属性:如何将微阵列表达数据与基因组序列相关。基因组学。2013; 101:1-11。https://doi.org/10.1016/j.ygeno.2012.10.003.
- 39.
Bernard V,Brunaud V,Lecharny A. TATA-Box的TC-Motif在植物基因中的预期位置:一类小型的转录法案中涉及的主题。BMC基因组学。2010; 11:166。https://doi.org/10.1186/1471-2164-11-166.
- 40.
Lascaris rf,groot e,hoen pb,mager wh,planta rj。酵母RPS28A基因的核心组织中ABF1P和富富型启动子元素的不同作用。核酸RES。2000; 28:1390-6。https://doi.org/10.1093/nar/28.6.1390.
- 41.
Warnes Gr,Bolker B,Bonebakker L,Gentleman R,Huber W等人。包装'gplots`。2012年,http://cran.r%2Dproject.org.
- 42.
Motif富集分析:一个统一的框架和对ChIP数据的评价。BMC生物信息学。2010;11:165。https://doi.org/10.1186/1471-2105-11-165.
- 43.
Katoh K,Misawa K,Kuma K,Miyata T. Mafft:一种基于快速傅里叶变换的快速多序列对齐的新方法。核酸RES。2002; 30:3059-66。https://doi.org/10.1093/nar/gkf436.
- 44。
Langfelder P,Horvath S.WGCNA:用于加权关联网络分析的R包。BMC生物信息学。2008; 9(1): - 13。https://doi.org/10.1186/1471-2105-9-559..
- 45。
Ashburner M, Ball CA, Blake JA, Botstein D, Butler H, Cherry JM,等。基因本体论:生物学统一的工具。Nat麝猫。2000;25:25-9。https://doi.org/10.1038/75556.
- 46。
Livak KJ,Schmittgen TD。使用实时定量PCR分析相对基因表达数据和2-∆∆CT方法。方法。2001; 25:402-8。https://doi.org/10.1006/meth.2001.1262.
- 47。
kong q,元j,牛p,谢j,姜w,黄y等。筛选冬瓜逆转录定量实时PCR分析中的合适参考基因。Plos一个。2014; 9:E87197。https://doi.org/10.1371/journal.pone.008719。
- 48。
陈Z,哈特曼,吴米,弗里德曼e,陈j,滑轮m等。编码植物特异性七跨膜域蛋白的AtmlO基因族的表达分析。植物mol biol。2006; 60:583-97。https://doi.org/10.1007/S11103-005-5082-X..
- 49.
Feechan A, Jermakow AM, Dry IB.对白粉病致病性有要求的葡萄藤MLO候选人?植物信号行为。2009;4:522-3。https://doi.org/10.4161/psb.4.6.8575.
- 50.
Pessina S,Pavan S,Catalano D,Gallotta A,Visser Rg,Bai Y等。表征枣疯病蔷薇科基因家族及其基因表达分析Malus Domestica..BMC基因组学。2014;15:618。https://doi.org/10.1186/1471-2164-15-618.
- 51.
Schouten H,Krauskopf J,Visser R,Bai Y.鉴定黄瓜粉状或柔软霉菌敏感所需的候选基因。Euphytica。2014; 200:475-86。https://doi.org/10.1007/s10681-014-1216-z.
确认
我们感谢Luigi Frusciante教授进行了有关进行分析的宝贵讨论。
资金
意大利大学和研究部(Genhort项目)提供了对这项工作的财政支持。
可用性数据和材料
所有支持数据都包含在文章中。补充材料(附加文件1:表S1, S2, S3, S4和S5)可在网上找到本文的资料:(https://figshare.com/s/6adb5ce53cd02838ffbd).用户只能以对我们的确认并将本文引用数据下载和使用数据以进行研究目的,并将本文引用为数据。
作者信息
隶属关系
贡献
GA提出了研究的想法,主要涉及生物信息分析、植物接种、结果解释和手稿撰写。PI参与了数据分析、植物接种和qRT-PCR实验。LR和CL对手稿进行了严格的修改。EF提供了对手稿的批判性阅读。SP参与实验规划、结果解释和手稿撰写。MRE协调了这个项目,并对结果的解释和手稿的撰写做出了贡献。所有的作者阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。这份手稿不报告或涉及任何动物或人类数据或组织的使用。
同意出版物
不适用。
利益争夺
作者声明了该研究在没有任何商业或财务关系的情况下进行的,这可能被解释为潜在的利益冲突。
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
附加文件
附加文件1:
表S1。MLO的推定推动者区域中的316个候选人CRE清单,其特征在于Iovieno等,(2016)。表S2。CRES的功能注释枣疯病-PPRS。分类基于含有CrES的基因的分子功能和生物学过程。表S3。每个系统发育分支的富集cres列表。表S4。在推定启动子区域(PPRs)中确定的富集基序列表枣疯病基因在与PM真菌的相互作用期间上调和/或属于系统发育的CLADE V.表S5。本研究使用的基因特异性引物进行基因表达分析及其扩增效率。(XLSX 31 kb)
权利和权限
开放获取本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
安道尔福,艾维耶诺,P.里恰尔迪,L。等等。进化的保护枣疯病基因启动子签名。BMC植物杂志19,150(2019)。https://doi.org/10.1186/s12870-019-1749-3
已收到:
公认:
发表:
关键词
- CIS作用监管要素
- 主题
- 枣疯病
- 粉状霉菌抵抗力
- 转录