抽象的
背景
在非洲骄傲(AP)Atemoya的正常季节成熟的果实裂缝是采后储存的主要问题。我们目前对果实裂纹的分子机制的理解有限。本研究的目的是在通过转录组分析中收获后果实成熟和裂缝中的作用淀粉降解和细胞壁多糖代谢。
结果
对乙烯处理和对照裂解果实的AP气叶果皮进行转录组分析。KEGG通路分析显示,淀粉和蔗糖代谢通路显著富集,约有39个DEGs可被功能注释,包括淀粉、纤维素、果胶等糖代谢相关基因。对乙烯处理后不同裂解阶段及对照的淀粉、原胶和可溶性果胶含量进行了监测。结果表明,与对照相比,乙烯加速了淀粉的降解,抑制了原果胶的合成,提高了可溶性果胶的含量,这与乙烯诱导果实开裂的表型相一致。利用RT-qPCR分析了淀粉、果胶和纤维素降解的关键基因。结果显示α -淀粉酶1 (AMY1),α-淀粉酶3(AMY3)、β -淀粉酶1 (BAM1)、-淀粉酶3 (BAM3)、β -淀粉酶9 (BAM9)支链淀粉酶(普尔)和糖原脱枝酶(glgx.),是参与淀粉降解的主要基因。AMY1,BAM3,BAM9,pul, 和glgx.与对照相比,所有均上调并具有更高的表达水平,乙烯处理具有乙烯处理,表明乙烯处理可能负责加速淀粉降解。α-1,4-半乳糖酰基转移酶的表达谱(ga)和颗粒结合的淀粉合酶(gbs)与原胶含量变化相一致,可能与原胶合成有关。果胶酯酶(体育)、聚半乳糖醛酸酶(PG)和果胶酸裂解酶(PEL.)所有参与果胶退化;体育被乙烯显著上调,是果胶降解的关键酶。
结论
DEG和物质含量分析的Kegg途径富集分析证实,淀粉分解成可溶性糖和细胞壁多糖代谢与AP Atemoya的熟化和开裂密切相关。通过RT-QPCR分析建立了在Atemoya果实的不同裂解阶段和其表达式影响淀粉和果胶内容物之间的基因升高或下调的联系。
背景
非洲骄傲(AP)属于Atemoya(番荔枝磨×答:squamosaL.),在各个国家消耗的半落叶,异国情调的亚热带水果[1].它容易软化和开裂,从而降低市场产量和质量,并反过来促进疾病[2].在气叶成熟过程中,果裂首先在果梗周围发育,然后从果基部向外辐射。它可以发生在收获前后,数量随品种而异。导致水果开裂的刺激因素因物种而异。已经观察到果实开裂敏感性与特定的果实性状(如形状)之间的相关性[3.], 尺寸 [4,坚定5],水果皮肤的气孔[6],有咬合性质[7]、渗透浓度及其他因素[8].青果果裂多发生在采后贮藏期。采用低温贮藏、1-甲基环丙烯(1-MCP)处理等延缓裂化措施[9]、壳聚糖及柠檬酸处理[10],以及水杨酸治疗[11].然而,这些不能有效地防止水果裂缝,我们目前对果实裂纹的分子机制的理解有限。
Atemoya是一种典型的更年期成熟水果,研究表明,随着乙烯产量的增加,水果在呼吸高峰期开始开裂[2,12,13,14].通常,Atemoya软化伴随着裂化。糖代谢是Atemoya果实成熟中最重要的材料转化过程,包括淀粉降解,转化和细胞多糖代谢。据报道,水果软化通常伴随着各种细胞壁多糖的解聚和溶解,例如果胶和半纤维素,并通过与细胞壁降解相关的基因,蛋白质和酶活性的表达水平升高[15,16].然而,我们目前对果实裂纹的分子机制的理解有限。
到目前为止,对气门果裂解分子机理的研究还很少。一些细胞壁相关基因、细胞壁松弛因子和角质层相关基因已被鉴定,包括聚半乳糖醛酸酶(PG),果酸酯酶(体育),β牛乳糖(β-GAL.),扩展蛋白(经验值),木瓜葡聚糖内酯直糖基酶(xet.),AP2 / EREBP型转录因子(Pawinb.),蜡合成酶(WS.)和β-酮酰基-CoA合酶(Pakcs6.)[8,17,18,19,20.,21,22,23],与水果软化和裂缝有关。Atemoya的全基因组测序尚未进行到目日期,目前只有少数遗传资源。本研究的目的是鉴定乙烯处理后亚yea果实的裂化相关的代谢途径和基因,并通过转录组测序建立固体基础,利用高通量测序和表达数据分析为未来的分子研究建立坚实的基础。
结果
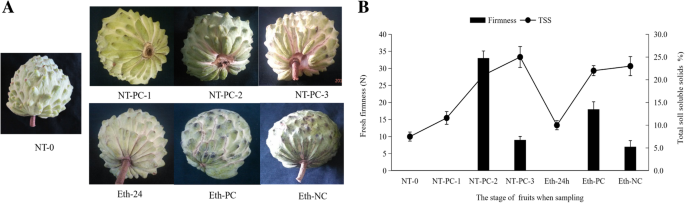
乙烯治疗后的Atemoya水果的外观,坚定和TSS变化
AP夏季水果通常准备在水果收获后约3天或4天(80%成熟)。当肤色从深绿色变为浅绿色时[14,24],水果的表面是乳膏的片段之间的颜色,并且单独的水果状片的表面变得平滑[2],水果是收获的。然而,除了上述两个条件外,80%成熟的定义还包括10%可溶性固体含量[24].在中国湛江市的夏季,在室温下,果实在收获后2天开始在花梗与中轴之间开始分离,如图NT-PC-1所示。1a.我们用渗透试验来评价气叶的软化,发现果实的硬度值过高,无法确定,但第2天的TSS水平(11.6%)高于第0天的TSS水平(9.5%)。第3天,开裂从果实基部辐射出来,如图NT-PC-2所示。1A,果实开始软化,允许我们测量坚定性。TSS水平继续增加到21%。在第4天,开裂更深,从花序梗到一些水果中辐射到果皮上,从而完全暴露于图2中的NT-PC-3所示的花梗。1a.果实的硬度迅速下降,TSS值最高(25%)。
在乙烯处理(Eth-24h)的24小时后,观察到在0 / NT-0日内的Atemoya果实之间的外观没有差异,尽管TSS含量略高于第0天/ NT-0时。在第2天,果皮开始表现出裂缝的迹象,果皮周围的区域软化。在第三天,水果显示出更广泛且更深的裂缝,包括如图1中所示的花梗。1一种。果实的坚定性迅速下降,观察到最高的TSS值(图。1b).但部分乙烯处理的果实没有开裂的迹象,但硬度和TSS含量的变化与图中Eth-NC所示的开裂果实相似。1.
转录组测序,装配和注释
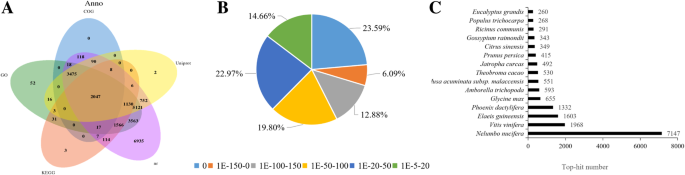
为了获得用于裂解Atemoya果实的参考转录组,使用来自Pericarp的RNA构建RNA-SEQ文库,并且在室温下从未处理的果实产生了7个文库(NT-0,NT-PC-1,NT-PC-2在不同的裂化相时,NT-PC-3)和NT-PC-3)和乙烯处理的水果(Eth-24h,Eth-PC和Eth-NC)。使用Illumina Hiseq™2500平台进行测序这些库。桌子1表明,我们共产生38 GB核苷酸,Q30百分比为95%,未分配的“N”碱基的百分比几乎为0.七个图书馆的读数分布为5090万(13.34%)(NT-0),对于NT-PC-2,NT-PC-2,50.0(13.10%)的NT-PC-1,49.4百万(12.95%),69.58亿(14.97%)(14.97%)(14.97%)(14.97%))对于Eth-24h,47.4(18.23%)的Eth-PC,38.2(12.42%)的Eth-NC。在清洁和进行质量检查之后,三位一体包装用于执行64,069个unigenes的De Novo组装,平均大小为670bp。这些unigenes的大小分布在附加文件中显示1.在使用BLASTX针对NR,UNIPROT,GO,KEGG和COG数据库搜索同源序列之后,总共可以将39.14%(25,074 / 64,069)的未成年人分配给所有五个数据库的同源物(图。2一种)。Undigenes的约38.97%(24,967 / 64,069)可以使用NCBI NR数据库通过Blastx(E-Value <1E-5)注释。基于电子值分布,我们发现大约42.56%的unigenes显示出非常强大的同源性(E值<1E-100)到可用的植物序列(图。2b)。数字2C显示大约有12705个unigenes被注释到五个热门物种,包括Nelumbo Nucifera,vitis Vinifera,Elaeis guineensis, 和大豆.
大约17039个unigenes可以被分为三个GO类别,即细胞成分、生物过程和分子功能(Additional file)2).此外,分别根据UniProt和Cog(附加文件)注释12,650和5780个未进剂3.).约4932个unigenes被定位到203个KEGG通路上(附加文件)4).unigenes表达量最高的图谱包括代谢途径(map01100)和核糖体途径(ko03010),其次是不同环境下的微生物代谢途径(map01120)、核糖体(map03010)、植物激素信号转导(map04075)、植物与病原体相互作用(map04626)、剪接体(map03040)、RNA转运(map03013)、内质网蛋白加工(map04141),泛素介导的蛋白水解(map04120),淀粉和蔗糖代谢(map00500)(附加文件4).
差异表达基因(DEGs)的筛选及KEGG途径富集分析
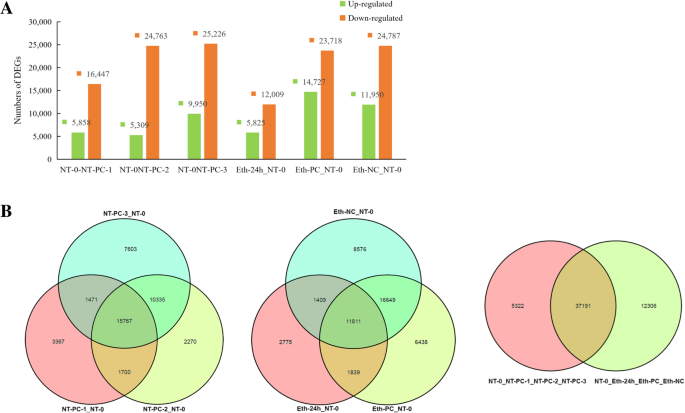
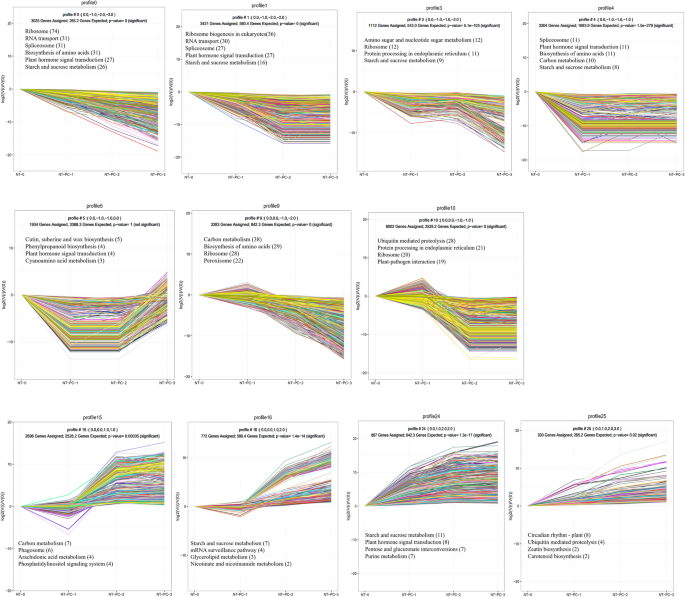
我们根据使用RPKM值的七个库的获得唯一读取的Unigene表达水平(附加文件5),然后使用FDR≤0.05和| LOG2RATIO的组合标准筛选出次 ≥ 1. The library generated from the pooled NT-0 samples was used to normalize the DEGs in the other six libraries, which was then followed by pairwise comparisons. Changes in gene expression were determined by comparing NT-PC-1/NT-0, NT-PC-2/NT-0, NT-PC-3/NT-0, Eth-24 h/NT-0, Eth-PC/NT-0, and Eth-NC/NT-0, respectively. NT-PC-1/NT-0, NT-PC-2/NT-0, and NT-PC-3/NT-0 were defined as the first group, and Eth-24 h/NT-0, Eth-PC/NT-0, and Eth-NC/NT-0 were designated as the second group. In these pairwise comparisons, we detected both unique and overlapping sets of DEGs. Figure3.A在果实软化开裂过程中,表达下调的基因相对于表达上调的基因富集。NT-PC-1/NT-0、NT-PC-2/NT-0和NT-PC-3/NT-0分别检测到22 305、30 072和35 176个DEGs。在正常的采后贮藏过程中,共富集了42,513个DEGs,其中重叠基因15,767个。在乙烯处理下,Eth-24 h/NT-0、Eth-PC/NT-0和Eth-NC/NT-0共富集49,497个DEGs,其中包括11,811个重叠基因。通过比较第一组和第二组,共得到54819个deg,其中第一组有5322个唯一基因,第二组有12306个唯一基因,37191个重叠基因(图1)。3.b)。
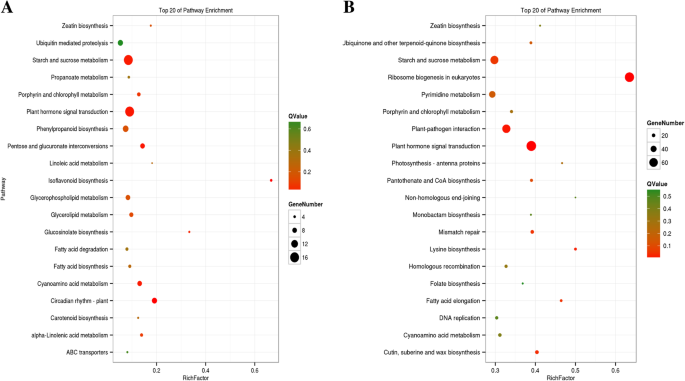
选择并使用包括NT-0,NT-PC-1,NT-PC-2和NT-PC-3,包括NT-0,NT-PC-1,NT-PC-3,这些文库在果实成熟期间没有接受治疗并表现出裂缝。通过配对的四种文库的配对比较来确定上调的次数的数量,然后是Kegg途径富集分析。图2中示出了具有最多的上调和下调的Degs数量最多的顶部20kegg途径。4.淀粉和蔗糖代谢(ko00500)、植物激素信号转导(ko04075)、戊糖和葡萄糖醛酸的相互转化(ko00040)和氰胺氨基酸代谢(ko00460)途径显著富集,DEGs上调,Q值降低。植物激素信号转导(ko04075)、淀粉和蔗糖代谢(ko00500)、植物与病原菌相互作用(ko04626)和真核生物核糖体生物发生(ko03008)的KEGG通路中都富集了下调的DEGs。在DEGs上调和下调富集的前20个KEGG通路中,淀粉和蔗糖代谢(ko00500)和植物激素信号转导(ko04075)的DEGs数量最高,q值最低,说明这两个通路在atemoya软化和裂解过程中发挥了重要作用。
通过对NT-PC-1/NT-0、NT-PC-2/NT-0、NT-PC-3/NT-0、NT-PC-1/NT-PC-2、NT-PC-2/NT-PC-3的两两比较,共获得44 697个DEG,利用STEM技术分析DEG表达谱。为了进一步了解水果裂解过程中的生物过程,我们将这些基因分为25个簇,其中11个簇代表不同的表达模式。数字5图11是包含26,177°的11个簇,具有显着的差异表达(P-value < 0.05),包括7个下调模式(Profiles 0、1、2、3、4、9和10)和4个上调模式(Profiles 15、16、24和25)。每个概要文件中的deg数量显示在附加文件中6.在图1中示出了使用Kegg途径富集的每种类似调节的转录物中富集的生物途径的全局描述。5.簇0和1中的基因,包括对“核糖体”,“RNA转运”,“抗体组”,“氨基酸生物合成”负责的广泛基因,以及“植物激素信号转导”的NT-0显着下调到NT-PC-3。来自这两种谱的基因主要涉及基础代谢途径中材料的降解,这反映了水果成熟状态。簇3,4和5含有最初下调的基因,然后随后上调。这些发现表明,这些基因在储存的后期阶段(NT-PC-2和NT-PC-3)中发挥作用。这些基因主要属于氨基糖和核苷酸糖“代谢”的类别,“核糖体”,“内质网”,“淀粉和蔗糖代谢”,“脾脏”和“植物激素信号转导”中的“蛋白质加工”。在储存的早期阶段(NT-0和NT-PC-1)中诱导的基因随后将下调分为簇9和10.这些基因主要参与“碳代谢”,“泛素介导的蛋白水解”,“核糖体”和“过氧化物体”途径,并且可能负责在早期阶段的材料降解。在整个存储阶段期间上调的簇15,16,24和25个基因。这些基因涉及“淀粉和蔗糖代谢”,“碳代谢”,“植物激素信号转导”,“戊糖和葡糖醛酸酯互联网”,和“泛素介导的蛋白水解”。 The genes involved in “Starch and sucrose metabolism”, “Carbon metabolism”, and “Pentose and glucuronate interconversions” are all involved in sugar transformation, thereby confirming that sugar transformation plays an important role in atemoya fruit ripening and cracking, including the conversion of starch into soluble sugars and the degradation of soluble sugars into other forms to generate energy.
实时荧光定量PCR对DEGs进行验证
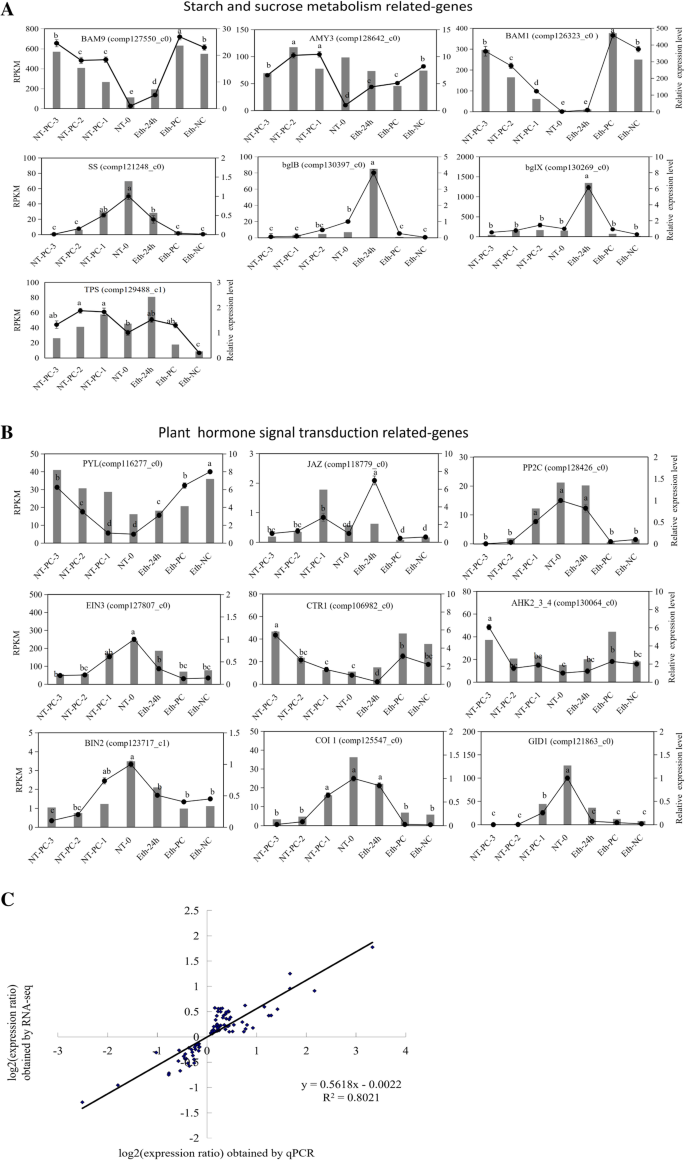
为了进一步验证我们的RNA-SEQ结果,我们选择了16个unigenes进行定量实时PCR(RT-QPCR)分析。在Kegg富集途径中,淀粉和蔗糖代谢途径和植物激素信号转导途径排名更高。Atemoya是淀粉储存类型的果实[25]淀粉和其他糖的降解是在熟化过程中重要的代谢过程,其与果实涡轮压力变化密切相关[8].在本研究中,一些裂解相关基因属于细胞壁多糖,属于淀粉和蔗糖代谢途径。此外,植物激素信号转导也与一些水果的果裂有关,例如荔枝[26].因此,我们从这两个代谢途径中选择了16个基因。
以乙烯处理后的气叶果皮和常温对照的RNA为模板。这些单基因参与淀粉和蔗糖代谢,包括淀粉、纤维素、蔗糖和海藻糖,以及植物激素信号转导途径,包括乙烯、细胞分裂素、赤霉素、油菜甾体素、脱落酸和茉莉酸。在七个采样阶段,候选基因的表达谱与测序结果相符(图。6a和b)和RNA-seq分析(Pearson相关系数R2 = 0.8021;无花果。6C),从而验证我们的转录组分析。
RT-qPCR与RNA-seq的fold-change数据的候选基因表达水平验证和系数分析。一个从rna测序中筛选出7个属于淀粉和蔗糖代谢途径的基因,其转录水平和RT-qPCR结果。brna测序中筛选出9个属于植物激素代谢途径的基因,其转录水平和RT-qPCR结果。16个unigenes是BAM9,AMY3,BAM1,SS.,BLGB.,BLGX.,COI1.,TPS.,GID1,塔,JAZ,PP2C,EIN3.,CTR1,ahk2-3-4, 和BIN2.,它们的全名在“缩写”部分中显示。左Y轴显示通过QPCR(黑线)分析的相对基因表达水平。右y轴表示RNA-SEQ(灰度直方图)的相应表达数据。X轴表示采样时间。每个基因的CT值是三种技术复制的平均值,标准误差指示。在图形上报告了Duncan测试估计的不同采样时间中相对表达值的显着差异(p值< 0.05)。用相同字母标注的意思没有显著差异。c通过RNA-SEQ(Y轴)和RT-QPCR(X轴)的LOM2表达比产生散点片
淀粉和蔗糖新陈代谢途径相关的次数参与果实成熟和裂缝
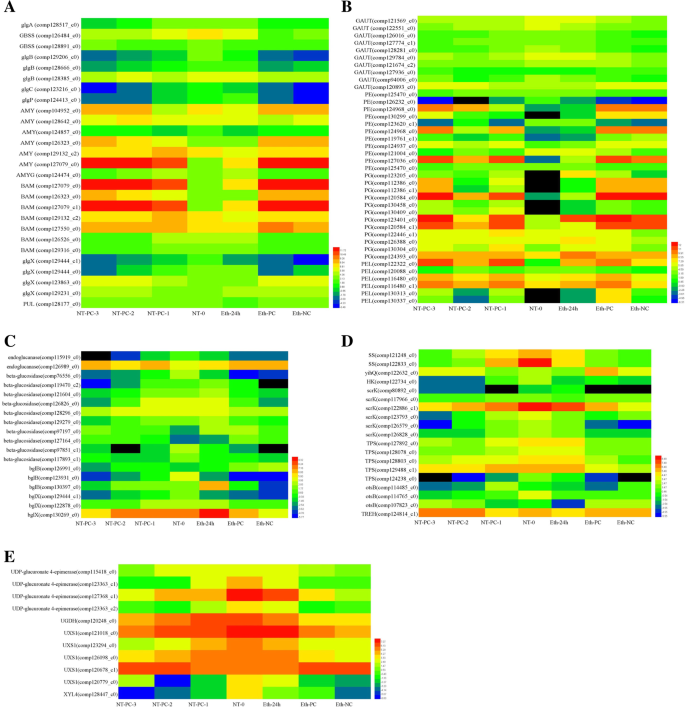
Kegg途径对每个表达谱的富集分析确定在大多数簇中显着富集淀粉和蔗糖代谢途径(图。5).桌子2显示从NT-0到NT-PC-3中涉及淀粉和蔗糖代谢途径的11种差异表达簇的次数。在淀粉和蔗糖新陈代谢途径中共注释了39次,包括淀粉,纤维素,果胶,蔗糖,海藻糖,麦芽糖,葡萄糖,果糖等。选择大约114个unigenes并用于热图分析(图。7).淀粉和蔗糖新陈代谢途径部件在附加文件中显示8.
KEGG分析淀粉和蔗糖代谢途径中注释的DEGs表达模式的热图。一个淀粉新陈代谢相关基因。b果胶新陈代谢相关基因。c纤维素新陈代谢相关基因。d海藻糖,蔗糖,果糖和葡萄糖新陈代谢相关基因。e淀粉和蔗糖代谢途径中的其他代谢相关基因。表中列出了热图中所有基因的简写和全名2.将基因表达水平数据归一化。每一列代表一个实验样本(如NT-0、NT-PC-1、NT-PC-2、NT-PC-3、Eth-24 h、Eth-PC、Eth-NC),每一行代表一个基因。右边的颜色刻度表示对数变换后的RPKM值,不同颜色表示表达差异。红色表示高表达,绿色表示低表达
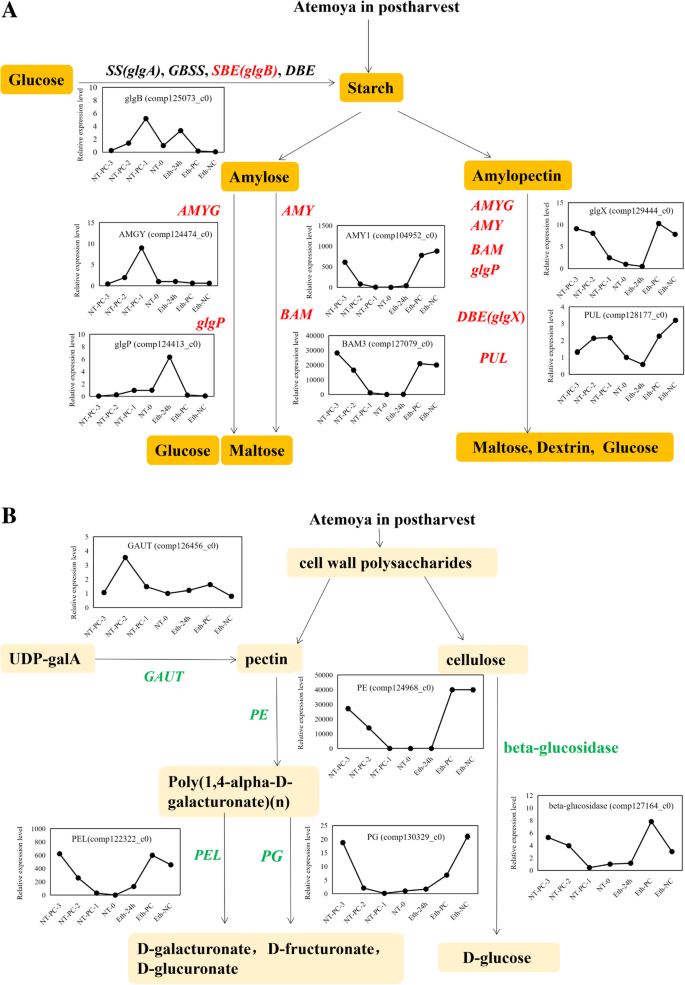
在淀粉代谢途径中,有四种与淀粉合成相关的DEGs分别编码GLGA.(淀粉合成酶),GLGB.(1,4-α-葡聚糖分支酶),glgc.(glucose-1-phosphate adenylyltransferase),gbs(granule-bound淀粉合酶)。一个GLGA.,3GLGB.,1glgc.和2gbs在整个贮藏期,乙烯处理后NT-0和NT-PC-3均下调,而gbs与对照相比,乙烯抑制(Comp126484_C0)抑制(图。7一种)。在淀粉降解相关的未成年人中,分别编码三种类型的未成熟AMYG(葡糖淀粉酶),pul(淀粉酶),和glgp.(Pyg淀粉磷酸化酶)用单一基因富集(表2).表达水平AMYG和glgp.NT-PC-1和Eth-24 h略有升高,然后在整个存储期间下降,而NT-PC-1和Eth-24 h略有升高pul在正常储存条件下和乙烯处理后都上调(图。7一种)。编码α-淀粉酶(amy)和β-淀粉酶(Bam)的两种主要类型的淀粉降解酶分别分别富含六至七个unigenes(图。7一个和表格2).有四个上调和两个下调艾米unigenes,其表现出具有正常储存条件和乙烯处理后的类似表达模式。艾米(comp127079_c0)显示了最高的表达水平,和艾米(comp104952_c0)是六个中的第二个艾米在整个储存期间仍有上调的unigenes,这表明这些可能在淀粉退化中发挥重要作用。七BAM富利原烯烯浓缩,其中五个被上调,两者以正常的储存条件和乙烯处理后下调(图。7一个和表格2).BAM(comp127079_c0)和BAM(comp127079_c1)表达水平非常高,高于艾米(comp127079_c0)(图。7a),而这两个ungenes属于相同基因的不同片段,如爆炸所示。相比艾米,BAM可能是淀粉降解的主要酶。四个egs编码glgx.(糖原 - 脱氮酶),其包括在正常储存条件下和乙烯处理之后的两个下调和两个上调基因。GlgX(Comp129231_C0)与对照相比,诱导乙烯表达更高的表达。在淀粉代谢途径中,所有合成酶基因在果实裂解过程中下调,而大多数有关的有关基因,包括艾米,BAM,pul, 和glgx.调节。这些发现表明,淀粉在果实成熟和开裂过程中被广泛降解。
Pericarp直接参与水果裂纹,果皮的组分与开裂抗性的发展密切相关。大多数细胞壁组分是多糖,例如纤维素和果胶。富集的纤维素相关基因主要编码纤维素降解的酶,包括两种基因,即内切葡聚糖酶和β-葡糖苷酶。富含两个内切葡聚糖酶基因和16个β-葡糖苷酶基因,其中1个内切葡聚糖酶和2β-葡糖苷酶基因被上调,1个内葡聚糖酶和14β-葡糖苷酶在正常储存条件下和乙烯处理后下调(图。7C和表格2).在14个下调的unigenes中,5个beta-葡萄糖苷酶基因(包括comp119470_c2、comp121604_c0、comp129279_c0、comp130397_c0和comp130269_c0)的表达被不同程度的诱导,而在正常贮藏条件下,这些基因从NT-0持续下调至NT-PC-3(图1)。7c)。
还观察到果胶与果胶相关的未成年人的富集,除了ga(参与果胶合成的(alpha-1,4-半曲乳糖基转移酶)以及体育(果胶酯酶),PG(polygalacturonase),和PEL.(果胶酶),参与果胶降解。十个unigenes编码ga差异表达,其中三种呈现的上调型材,其余部分在正常储存条件下和乙烯处理后下调。有11个体育,12PG和6.PEL.分别富集的未来,其中8,12和5在正常储存条件下和乙烯处理后上调(图。7B和表格2).两个体育unigenes(comp124968_c0和comp127036_c0),三个PGunigenes(comp120584_c0,comp123401_c0和comp120584_c1)和两个PEL.unigenes (comp122322_c0和comp116480_c1)在正常贮藏条件下和乙烯处理后的表达量均高于其他果胶降解酶基因,但对照与乙烯处理之间无明显差异(图1)。7b)。还观察到果胶降解酶的富集,并且这些中的大部分是上调的,这表明果胶降解与果实成熟和裂化密切相关。几个unigenes编码TPS.(海藻糖6-磷酸合酶/磷酸酶),malQ(4-alpha-glucanotransferase),scrK(Fructokinase),SS.(蔗糖合成酶),1,3-β-葡聚糖合成酶,UXS1(UDP-葡糖醛酸脱羧酶)和其他糖代谢相关基因涉及海藻糖,麦芽糖,蔗糖,果糖和葡萄糖代谢途径,其负责将各种多糖转化为单糖。不同种类糖对渗透压的贡献变化,单糖具有提供最大贡献,多糖转化率为单糖的速率可以影响渗透压。因此,对糖相关基因的富集分析可以鉴定在阿米苏菌果实中代谢的主要糖及其对果实裂化过程中渗透压变化的影响。根据富含糖相关基因,海藻糖,蔗糖,果糖,葡萄糖和麦芽糖是果实成熟期间糖代谢中的主要可溶性糖。其中大部分是在整个储存期间下调;然而,其中一些在NT-0,NT-PC-1和Eth-24h中具有高表达水平,例如,SS.(comp122833_c0),scrK(comp122886_c1),treh.(α,α-皮质酶)(Comp124814_C1),UDP-葡糖醛酸4-eBimerase(Comp127368_C1),和UXS1(comp121018_c0)(图。7d和e)。上述结果仅初步确定了主要类型的糖,并且下一步是量化每个阶段的主要糖的内容物,以确定糖的转化率及其对渗透压的影响。
淀粉和果胶含量的变化及其新陈代谢相关基因表达谱
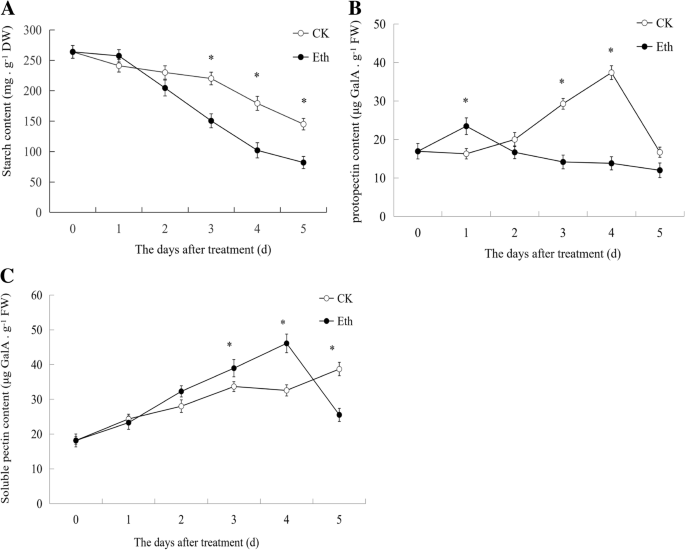
数字8据表明,果实储存期间淀粉含量降低,乙烯处理加速淀粉降解。在没有治疗的情况下,PericaRP中的原始素含量增加至第4天,而在第1天后,在第1天后减少了乙烯处理(图。8b)表示乙烯抑制了原蛋白的合成。数字8C显示果实储存过程中可溶性果胶含量增加,与无处理相比,乙烯处理增强可溶性果胶含量,这表明乙烯处理加速果胶降解。
为了阐明在果实裂解过程中淀粉和细胞壁多糖代谢途径中发挥重要作用的基因,分析了12个unigenes的表达谱。在这其中,AMY3(comp128642_c0),BAM1(comp126323_c0),和BAM9(comp127550_c0)通过RT-QPCR验证(图。6一种)。九个淀粉降解酶,即AMY1(comp104952_c0),AMYG(comp124474_c0),BAM3(comp127079_c0),pul(comp128177_c0),glgx.(comp129444_c0),glgp.(comp124413_c0),AMY3,BAM1,BAM9和一个淀粉合成基因GLGB.(Comp125073_C0)被选中(图。9一种)。其中,除了glgp.和AMYG,显着上调其他有降解的酶基因的表达,而合成基因的表达在乙烯处理后和对照中的果实裂化过程中降低。AMY1,BAM3,BAM9,pul, 和glgx.与未处理相比,乙烯处理后均表达上调,表达水平升高,这可能是乙烯处理后加速淀粉降解的原因。用乙烯处理和对照组,AMY1和BAM3表明这两个基因是淀粉降解的关键基因。
简化多糖代谢途径方案。(A)淀粉代谢途径;被检测的基因用红色斜体加粗字母表示,其中包括GLGB.,AMY1,BAM3,AMYG,glgp.,glgx., 和pul(B)果胶和纤维素代谢途径。被检测的基因用绿色斜体加粗的字母表示,其中包括GATU.,体育,PG,PEL., 和beta-glucosidase.基因的全名如表所示2和“缩写”部分的一部分
ga关键果胶合成酶[27].大量ga(Comp126456_C0)在前三个阶段累积,在与乙烯处理相比,对具有对照和乙烯处理的第四阶段的第四阶段和乙烯处理的表达水平较高,而其表达谱与原霉素含量的变化相吻合,这可能涉及原霉素果实裂化和软化过程中的合成(图。9b)。体育(comp124968_c0),PG(comp130329_c0),和PEL.(COMP12232222222_C0)有或没有乙烯处理上调,表明这三种基因在果胶降解中起重要作用。在这其中,体育通过乙烯显着上调,因此可能是果胶降解中的关键基因(图。9b)。β-葡萄糖苷酶(comp127164_c0)被乙烯上调,说明它可能是一种主要的纤维素降解酶(图。9b)。
讨论
有几个因素影响果实裂缝,包括遗传学,形态学,生理学,环境条件(例如,温度,风和光)和果园管理(例如,灌溉和营养)。此外,水果裂缝是由几个基因控制的定量性状[8].为了产生分子证据并阐明果实裂缝的潜在机制,本研究试图在采后储存期间识别阿米苏省的果实裂化基因。为了避免阿米尤参考基因组的不可用,我们利用在参考转录组的DE Novo组装中的RNA-SEQ裂解Atemoya果实的Pericarp。我们的大会总共包含64,069个unigenes,平均大小为670 bp。大约25,074个unigenes注释给公共蛋白质数据库。我们在NT-0和Eth-24h,Eth-PC和Eth-PC和Eth-PC和Eth-PC之间进行了成对比较并鉴定了NT-0和NT-PC-1,NT-PC-2和NT-PC-3和49,497°之间的49,497°。eth-nc。Kegg途径浓缩分析每种不同表达模式的所有Degs和Degs表明,淀粉和蔗糖代谢途径显着富集。
目前的研究确定,在亚牛约岛,碳水化合物主要以淀粉的形式储存[28].AP Atemoya的扫描电子显微镜(SEM)分析表明了水果组织中的许多淀粉颗粒[29].因此,气叶果的细胞不仅储存淀粉,而且用它来维持细胞充盈[30.].Mo等人。[11表明番荔枝果实的硬度随着成熟而急剧下降,可能是由于淀粉转化为可溶性糖。威尔斯等人[31[表明,裂化的启动与果实中淀粉水平的大约五分之一的下降吻合。paull [14研究表明,气叶破裂通常发生在采后,因为在成熟过程中,渗透性和随之而来的充盈发生了变化,这与中性糖的产生有关,中性糖的产生导致水分从皮肤和容器流向果肉。已有研究表明,淀粉降解引起果实膨松变化,与果实软化开裂密切相关;然而,这些主要是在生理水平上观察。在本研究中,转录组测序显示,水果开裂与多个淀粉代谢基因的显著富集密切相关,其中包括7个淀粉合酶基因和17个淀粉降解酶。在转录水平上,淀粉向可溶性糖的转化可能是果实软化开裂过程中最重要的过程之一。编码淀粉合酶的基因均下调,而淀粉降解基因大多上调。例如,AMY1(comp104952_c0)和BAM3(COMP127079_C0)在果实裂解期间显着诱导和高度表达,这表明这些是淀粉降解的关键,同时显示淀粉在去氨乙醇期间通过淀粉酶快速分解。我们还表明,淀粉降解与果实裂缝有关,其与先前研究生理代谢的结果一致。
可溶性糖含量影响果实膨胀,从而导致果实开裂。前人对甜樱桃、腊苹果、荔枝、葡萄等水果的研究证实,裂解的果实比未裂解的果实可溶性糖含量高,渗透势低[20.,32,33,34],这表明水,可溶性糖和渗透潜力与果实裂缝密切相关。鲁和林[20.据报道,裂化果实中的TSS含量和总滴定酸水平比在蜡苹果的非破裂的果实中均高出20%。此外,当其Turgor压力较高60%时,观察到在果实成熟过程中的TSS含量和总滴定酸水平的增加,这又导致组织渗透势的降低。Considine和Kriedemann [32为果实可溶性固体的重要性提供了直接证据,其中在渗透在低渗透潜力的溶液中时发生葡萄的开裂。Atemoya水果是淀粉储存类型[25[后,接受淀粉降解的速率和能力与可溶性糖含量直接相关,这又直接影响水果Turgor [8].因此,影响淀粉降解速率(如温度和乙烯)的因素也可能影响果实裂化程度。在低温下,Cherimoya果实的TSS含量慢慢增加,而未观察到pH值的可检测变化[35,36,说明番荔枝经低温处理后,淀粉水解速率和单糖浓度降低,这些结果与我们对番荔枝的研究结果一致[37].Gutiérrez等。[28]的超微结构分析结果表明,在4℃下贮藏6 d后,淀粉粒不分解,细胞壁保持完整。我们前期研究表明,除低温外,乙烯能显著加速气叶的开裂和成熟,2 g/kg乙烯利处理后,果皮先开裂,这与对照处理不同[22].本研究发现,与对照相比,乙烯加速了淀粉的降解,提高了可溶性果胶的含量,说明乙烯加速了果实的开裂和成熟。转录组分析表明,淀粉、果胶和纤维素的降解与蛋白的上调有很强的相关性AMY1(comp104952_c0),BAM3(comp127079_c0),BAM9(comp127550_c0),pul(comp128177_c0),glgx.(comp129444_c0),体育(comp124968_c0)和beta-glucosidase(comp127164_c0)。此外,乙烯处理不仅促进了果胶可溶性的增加,而且抑制了果胶的合成,这可以解释为什么乙烯处理后果皮先开裂。在转录水平上,ga(comp126456_c0)主要参与果胶的合成。以上研究表明,外源环境温度和乙烯处理可通过调节淀粉和细胞壁多糖的代谢,直接与果实开裂的时间和程度有关。
以往的研究发现,淀粉可以转化为各种可溶性糖,如双糖(如蔗糖)和单糖(如果糖和葡萄糖)。paul等人[38[据报道,在Soursop中,成熟度增加了四倍的蔗糖含量,并且在收获后3天观察到最高浓度,随后降至40%。果糖和葡萄糖含量随后慢慢增加直至收获后5天。蔗糖,葡萄糖和果糖在可食用阶段的比例为4.3:3.0:3.2 [39].但是,在亚丁夫(番荔枝轧机。简历。’Fino de Jete’),淀粉主要在等摩尔浓度下转化为葡萄糖和果糖,蔗糖的积累很少,而且是短暂的[28,40].在我们的研究中,富集了一些参与蔗糖,果糖和葡萄糖的基因,例如蔗糖代谢酶,SS.和α-葡糖苷酶(yihq.)和果糖新陈代谢相关酶,scrK,和六酮酶(香港)、葡萄糖代谢基因和葡聚糖1,3- β -葡萄糖苷酶。此外,海藻糖代谢相关基因,包括8个海藻糖6-磷酸合酶(TPS.)基因,三个海藻糖6-磷酸磷酸酶(otsb.)基因,一个treh.基因和三种麦芽糖相关的基因malQ,被丰富了。淀粉的降解产生麦芽糖,而先前的研究表明,海藻糖很少参与Annona果实的淀粉转化。最近的研究已经观察到,植物海藻糖也参与代谢和基因表达调控,并影响植物生长,发育和对外部环境变化的反应[41.,42.].海藻糖是一种典型的应力代谢和保护物质,当生物体受到压力时,它可以迅速积累海藻糖[43.,44.].海藻糖在果实采后贮藏过程中的作用有待进一步研究。
研究人员发现一些与细胞壁相关的基因,包括经验值,xet.,PG, 和体育,还在水果裂缝中发挥作用[8,21].Shen等人。[19]建议在田间果实的开裂和成熟过程中,表达Asexp1.和ASExp3.比较高,而那个ASExp2.相对较弱。Wang等人。[17据报道,LCEXP1和LCEXP2在荔枝Pericarp中的差异表达与果实生长和抗裂形成抗性有关。我们以前的研究[22比较了甘油果抗裂品种和抗裂品种在采后贮藏过程中的表现,发现EXP1与果实成熟和软化的关系更大。EXP2,EXP3, 和体育更接近于水果裂解,然而XET1,XET2, 和XET3可能与水果软化有关,并且是水果裂缝的关键基因不太可能[22].鲁和林[20.与非破裂的蜡苹果果实相比,报道了裂纹果实中PG活性增加了131%。在本研究中,转录组测序分析发现除12外PG11.体育,另一种果胶有关相关基因,6PEL.已富集,表明果胶分解也是Atemoya果实裂缝中的重要多糖代谢过程。在生理水平,将部分基因表达证据与我们的RNA-SEQ结果相结合,增强了我们的理论,即阿米托果裂纹是由淀粉转化为可溶性糖的转化,从而增加了橡胶压力,从而导致破裂细胞和组织,以及细胞壁多糖如果胶和纤维素的降解,最终降低细胞壁韧性,其被表现为果皮和肉体的开裂。
RT-qPCR分析表明,该菌株富集了大量淀粉、果胶和纤维素代谢相关基因,主要为AMY1(comp104952_c0),BAM3(comp127079_c0),pul(comp128177_c0),glgx.(comp129444_c0),体育(comp124968_c0),PG(comp130329_c0),PEL.(comp122322_c0),和beta-glucosidase(comp127164_c0)。由于本研究被设计为初步验证,因此需要探讨这些基因和果实裂缝之间的关系的额外研究。此外,水果裂解是一种复杂的生理现象,因为没有单一基因直接控制该过程。然而,转录组测序提供了分子证据,即淀粉和细胞壁多糖可以参与果实裂缝,以及用于筛选额外的果实裂解相关基因的有用遗传资源。
除了淀粉和蔗糖代谢途径在阿米苏果裂纹中的重要作用外,研究表明,植物激素信号转导途径也参与果实裂纹。在樱桃,石榴和荔枝上喷洒不同浓度的嗜酸杆菌素可以降低果实裂缝率[45.,46.,47.].荔枝和石榴果裂后果皮中ABA含量高于健康果[48.,49.],喷施ABA可提高荔枝果实的开裂率[11].这些研究人员表明,喷涂GA可以降低水果裂缝,但喷洒ABA可以增加一些水果裂缝。李等人。[26[对非裂纹和裂解荔枝果实进行了比较转录组分析,发现植物激素信号转导途径相关基因已富集,包括GA和ABA。他们认为,佩西加斯的GA水平和高度的ABA水平导致果皮的压力膨胀较慢,因此AriN细胞产生更多的涡轮螺杆,从而导致果实裂缝。在我们的结果中,富集的植物激素信号转导途径的富集数量排名第四,包括总共154次,包括嗜酸盐素,脱落酸和细胞内胰岛(另外4),而我们没有专注于本研究中的植物激素相关基因,因此它们在果实裂缝中的作用需要进一步调查。
结论
总之,通过Illumina测序产生了七组包含64,069个未成熟的转录组数据。Degs和材料含量分析的Kegg途径富集分析证实,淀粉分解成可溶性糖和细胞壁多糖代谢与AP Atemoya的熟化和开裂密切相关。RT-PCR分析表明,在阿米苏果果实不同裂解阶段期间基因的差异表达影响淀粉和果胶含量。此外,植物激素信号转导途径相关基因显着富集,表明其在果实成熟和裂缝中的作用。本研究可作为未来Atemoya基因组研究的宝贵资源,也可能受益于涉及其他密切相关的农业物种的调查。DEG DataSet还可以提供有用的候选基因,用于阐明果实裂纹的机制和其他水果中的果实裂化的机制。
方法
植物材料和实验设计
在本研究中,AP Atemoya果实在中国热带农作物研究所的热带农作物,中国热带农作物,湛江,中国广东省广东省湛江。果园位于21°12'n,110°4'e。材料收集按照本地立法进行,无需其他组织的许可。我们遵守了濒危野生动物群和植物群的贸易公约。10月份收获了水果,当水果肤色从较浅的绿色变化时,可以是绿色的黄色,并且收集那些没有瑕疵和机械损伤的人[14].
水果的第一种单点用于转录组测序。阿米苏岛果实摘为成熟约80%。在室温下保持二十个水果,没有治疗,最近采摘的水果定义为第0天或NT-0。大多数没有任何治疗的果实在第2天开始在Pepicel上裂开并且被命名为NT-PC-1,而分裂在第3天(NT-PC-2)和第4天(NT-PC-2)增加和加深长期储存时间。选择以下四个阶段用于转录体测序:最近采摘的水果(NT-0),在花梗(NT-PC-1)处开裂,在Peedel(NT-PC-2)处适度的裂缝,以及在Peedel处的严重裂缝(NT-PC-3)。将另外20个果实浸入2g / kg乙醇中2分钟,转移到封闭的塑料盒中,盖子在24小时后打开。在ethephon治疗24小时后没有表现出裂缝的水果被指定为Eth-24 h。大多数果实最初在第2天的Pericarp中展示了裂缝,并命名为Eth-PC。 On day 3, the fruits showed more extensive and deeper cracking, including the pericarp and the peduncle. However, not all of the fruits after ethephon treatment appeared cracking, and no-cracking fruits were defined as Eth-NC on day 4 after ethephon treatment. Samples were collected from three stages for transcriptome sequencing, including fruits 24 h after ethephon treatment (Eth-24 h), fruits with pericarp cracking after ethephon treatment (Eth-PC), and no fruit cracking after ethephon treatment (Eth-NC).
在每个阶段的相同治疗中收集显示出类似的TSS含量,固定值和裂缝度的三种终端果皮样品被收集,立即在液氮中冷冻,然后在-80℃下储存直至进一步加工。为每个生物样品制备三个复制样品。候选样品的Pericarps,包括NT-0,NT-PC-1,NT-PC-2,NT-PC-3,Eth-24h,Eth-PC和Eth-Nc,进行转录组测序和表达分析。
水果的第二个单价用于淀粉和果胶含量测定。将十五个果实在室温下储存,没有治疗,并且如前所述,用乙烯治疗另外15个果实。在第0,1,3和5天收集样品。收集每个阶段的三个终端果皮样品,立即在液氮中冷冻,然后在-80℃下储存直至进一步加工。
总可溶性固体(TSS),固定值,淀粉和果胶测定
如前所述测量TSS含量和坚定性[22].80%CA的解决方案(没有3.)2用于从乙醇不溶性残余物中提取淀粉,使用根据CaO等人的方法,测定反应产物在620nm波长下的吸收值。[50.].用95%乙醇溶液在沸水浴中提取果胶。用上清液测定可溶性果胶,用硫酸水解乙醇不溶残渣测定原果胶含量,方法参照Cao等[50.].果胶由咔唑测定,并通过半乳糖醛酸的质量表明果胶的含量。
转录组分析的RNA提取和illumina测序
RNA- Seq设计了7个文库(NT-0, NT-PC-1, NT-PC-2, NT-PC-3, Eth-24 h, Eth-PC和Eth-NC),以获得果实成熟和开裂的气叶果皮转录组的总体概况。使用快速RNA分离试剂盒从果皮组织中提取总RNA,按照制造商的说明(华岳阳,中国)。RNA样品用DNase I酶切去除可能污染的基因组DNA,用RNase-free柱纯化。RNA质量使用2100 Bioanalyzer RNA Nanochip (Agilent, Santa Clara, CA, USA)进行验证,RNA完整性通过含1.5%甲醛的电泳(w/v)琼脂糖凝胶。然后,使用Nanodrop Nd-1000分光光度计(纳米滴,威尔明顿,美国)定量RNA。通过在每个阶段的RNA-SEQ中使用的三种生物学重复的相等数量来汇集三种高质量的RNA。使用100bp配对结束协议在Illumina Hiseq 2500系统中测序每个图书馆。所有原始转录组数据都被沉积到Genbank短读取存档(登录号SRP114346)。
DE NOVO集装和功能注释
将得到的RNA测序数据进行纯化,包括除去适配器和低质量读数。清洁读数是使用Trinity计划组装的De Novo [51.].然后将所得序列称为unigenes。要注释unigenes,我们使用了Blastx程序(http://www.ncbi.nlm.nih.gov/BLAST/)NCBI具有1E-5的E值阈值,到NCBI非冗余蛋白(NR)数据库(http://www.ncbi.nlm.nih.gov.),通用蛋白质资源(Uniprot)数据库(http://www.uniprot.org/),基因和基因组(Kegg)数据库的京都百科全书(http://www.genome.jp/kegg.),基因本体(GO)数据库(http://geneontology.org/)和蛋白质同源组聚类(COG)数据库(http://www.ncbi.nlm.nih.gov/COG).通过计算每kb /百万reads (RPKM)将Unigene表达水平标准化[52.].根据Anders和Huber所描述的Degseq [53.王等人。[54.].当假发现率(FDR)≤0.05时,鉴定治疗和对照样品之间的DEGs≤0.05,log2ratio | ≥ 1, andP- value <0.05。从NT-0汇集样品中制备的库被用作校准剂,以使其他六个文库(NT-PC-1,NT-PC-2,NT-PC-3,ETH-24 H,Eth-PC中的校准化和eth-nc)。通过短时间序列表达矿工软件(Stew)聚集了Degs [55.].具有p值≤0.05的聚类配置文件被认为是显着的表达的。然后使用Blast所有软件对抗Kegg数据库进行DEGS对Kegg途径注释进行。具有Q值≤0.05的Kegg途径被显着富含DEG。使用OMICSHARE工具构建资深泡沫图,是一个免费的网络分析的免费在线平台(www.omicshare.com/tools).为了了解果实裂缝期间DEG的基因表达模式,我们对群集软件进行了表达式模式的分层集群分析[56.]和java treeview [57.].
RT-QPCR验证
RT-qPCR检测基因表达模式。使用PrimeScript™RT试剂盒和gDNA Eraser (TaKaRa,日本)从7个果皮样品中分离出1 μg总RNA,生成第一链cDNA。采用Primer Premier 5.0软件(Premier, Canada)设计RT-qPCR引物,由生工生物技术(上海,中国)有限公司合成。选择atemoya同源肌动蛋白(GenBank登录号MF893339)作为参考。候选单基因的所有引物见附加文件7.每种反应(最终体积:10μl)含有5μl2×SYBR绿色Mastermix(Thermo Fisher),每一个正向和反向引物(0.25mm),cDNA模板的1μl,2μlRNase- 免费水。使用以下条件,在LiveCycler 480系统(Roche,USA)中进行RT-QPCR:95℃,5分钟,其次为30℃,55℃,30s,72°C为72℃。在96孔光学反应板中有30秒。每个RT-QPCR分析一式三份进行。通过CT值测定测试的参考基因的表达水平并使用2计算-△△Ct[58.].
统计分析
所有测量都会重复三次。根据使用SPSS软件(SPSS,Inc.,Chicago,IL,USA)的完全随机设计的模型对所有数据进行ANOVA。评估的两个样本之间的差异t在RT-QPCR分析中的0.05水平下,Duncan的试验评估了在淀粉和果胶测定中的0.05水平的测定和差异,在RT-QPCR分析中的0.05水平中评估。
缩写
- 1-MCP:
-
1-甲基环丙烯
- 艾米:
-
阿尔法
- Amyg:
-
葡糖淀粉酶
- BAM:
-
β-淀粉酶
- BGLB:
-
β-葡萄糖苷酶
- BGLX:
-
β-葡萄糖苷酶
- COI1:
-
冠状含量不敏感蛋白1
- CTR1:
-
丝氨酸/苏氨酸 - 蛋白激酶
- DBE:
-
淀粉脱支酶
- 可见:
-
差异表达基因
- EIN2:
-
Ethylene-insensitive蛋白2
- EIN3:
-
Ethylene-insensitive蛋白3
- 经验值:
-
突出
- GBSS:
-
颗粒状淀粉合酶
- GID1:
-
赤霉素受体GID1
- GLGA:
-
淀粉合成酶
- glgC:
-
Glucose-1-phosphate adenylyltransferase
- GLGP:
-
淀粉磷酸化酶
- glgx:
-
糖原脱支酶
- 香港:
-
六酮酶
- 杰兹:
-
含有ZIM结构域的茉莉酸蛋白
- 马克:
-
4-alpha-glucanotransferase基因
- otsb:
-
海藻糖6-phosphate磷酸酶
- pe:
-
果胶酯酶
- 图像的基本单位:
-
Pectate Lyase.
- PG:
-
polygalacturonase.
- PP2C:
-
蛋白质磷酸酶2C.
- 普尔:
-
Prululanase.
- pyl:
-
脱落酸受体PYR/PYL家族
- RT-QPCR:
-
逆转录定量实时PCR
- sbe:
-
淀粉分支酶
- SCRK:
-
果糖激酶
- SS:
-
淀粉合成酶
- TPS:
-
海藻糖6-phosphate合酶/磷酸酶
- tree:
-
α,α-海藻酶
- XET:
-
Xyloglucan endotransglycosylase
- YihQ:
-
α-葡糖苷酶
- ahk2_3_4:
-
拟南芥组氨酸激酶2/3/4
- GAUT:
-
α-1,4-半曲乳糖基转移酶
- glgB:
-
1,4-α-葡聚糖分支酶
参考
- 1.
Yamashita F,Migilioranza LHDS,Miranda LDA,Souza Cmdae。包装与温度对阿米塔采后的影响。Rev Bras Marutic。2002; 24:658-60。
- 2.
Pareek S,Yahia Em,Pareep Op,Kaushik Ra。加拿尼水果的采后生理和技术。食物res int。2011; 44:1741-51。
- 3.
Beyer M,Hahn R,Peschel S,Harz M,Knoche M.分析甜樱桃的果实形状(普鲁尼乌斯唉L.)。SCI Hortic。2002; 96:139-50。
- 4.
Sekse L,Bjerke Kl,Vangdal E.甜樱桃的水果裂缝 - 一种综合方法。Acta Hortic。2005; 667:471-4。
- 5。
Simon G.关于雨诱导甜樱桃果实裂缝的评论(普鲁尼乌斯唉),其原因和预防的可能性。中华医学会园艺科学分会。2006;12(3):27-35。
- 6。
霍夫兰k,sekse l.通过甜樱桃的水吸收(普鲁尼乌斯唉L.)水果花纹:果实水位的影响和完整的果皮。Acta Agric Scand Sect B土壤植物SCI。2004; 54:91-6。
- 7。
陈述J.果实增长的物理方面:与水果术说的有粘性骨折和骨折模式vitis Vinifera.j hortic sci。1982; 57:79-91。
- 8。
Khadivi-Khub。影响果实开裂的生理和肠蠕动因素。植物学报。2015;37:1718。
- 9。
李春荣,沈文斌,卢文杰,姜亚明,谢建华,陈建勇. 1-MCP延缓软化及对番荔枝果实XET和EXP基因表达的影响。采后生物技术。2009;52:254-9。
- 10.
采后柠檬酸和壳聚糖包衣处理对番荔枝成熟特性及细胞壁相关基因表达的影响番荔枝磨坊。)水果。SCI Hortic。2016; 198:1-11。
- 11.
莫yw,龚dq,梁gb,汉朗,谢俊,李威。收获后储存过程中水杨酸治疗增强了糖苹果果实的保存效果。j sci食物agr。2008; 88:693-2699。
- 12.
Brown Bi,Wong Ls,George Ap,Nissen RJ。不同种类水果采后生理学的比较研究安诺纳(番荔枝)。j hortic sci。1988; 63:521-8。
- 13.
morea J, De La Plaza JL。番荔枝冷藏时的呼吸强度:更年期水果的一个特例?Acta Hortic。1993;138:179 - 86。
- 14。
Paull Re。在成熟期间,在成熟期间的Postharvest Atemoya果子分裂。Postharvest Biol Tech。1996年; 8:329-34。
- 15.
acta physica sinica, 2010, 34 (6): 689 - 694 . acta physica sinica, 2010, 34 (6): 689 - 694 . acta physica sinica, 2010, 34(6): 689 - 694。植物杂志。2000;123:1583 - 92。
- 16。
Giovannoni JJ。果实成熟和成熟的分子生物学。植物生理学报2001;52:725-49。
- 17。
王Y,Lu WJ,刘JG,江烨。两种扩张基因在裂解抗性荔枝栽培品种果实中的两种扩张基因的差异表达。J AM Soc Hortic SCI。2006; 131:118-21。
- 18。
Kasai S,Hayama H,Kashimura Y,Kudo S,Osanai Y.果实开裂与扩展基因表达的关系Mdexpa3.在'fuji'苹果(马吕斯有明显borkh。)。SCI Hortic。2008; 116:194-8。
- 19。
沉WB,李克,陈杰,谢杰,卢WJ。在果实成熟和软化过程中,牛仔羊果中的扩展蛋白基因表达与肉体固定性相关。j hortic sci biotechnol。2009; 84:333-9。
- 20。
陆路,林驰。蜡苹果果实裂缝的生理学(气味清香samarangense).Botanica Orientalis J植物SCI。2011; 8:70-6。
- 21.
李米,张扬,张玉,吉兮,张r,liu dl等。过敏乙烯信号和ZMdPG1表达导致果实软化和裂开。Plos一个。2013; 8:E58745。
- 22.
陈俊,段yj,莫yw,hu yl,hu hg,xie jh。蛋白苹果品种易患果实裂缝的果皮细胞壁代谢与细胞壁代谢相关的基因表达分析。J Fruit Sci。2015; 32:769-76。
- 23.
Balbontín C, Ayala H, Rubilar J, Cote J, Figueroa CR.两个耐裂性不同的甜樱桃品种果实发育过程中细胞壁和表皮相关基因的转录分析。acta Agr Res. 2014; 74:162-9。
- 24.
张FP,陈WH,林DX。收获后处理技术规范番荔枝属atemoya.广东江苏省。2003; 3:43-5。
- 25.
李伟,陈文祥。番荔枝果实采后生理及保鲜方法研究进展。热带亚热带植物学报。2004;12(3):280-4。
- 26。
李WC,吴继文,张恒,施系统,刘立,舒B等。德诺维荔枝鳖菌果壳的果皮转录组组装及鉴别鉴别基因鉴定。int j mol sci。2014; 15(10):17667-85。
- 27。
孔永忠,周国康,尹永彬,徐勇,柏翠斯,韩明国。一个家族的分子分析拟南芥半乳糖醛酸转移酶相关基因。植物杂志。2011;155(4):1791 - 805。
- 28。
Gutiérrezm,sola mm,pascual l,vargas am。在冷冻受伤的Cherimoya中的糖浓度的采后变化(番荔枝磨。)。J植物理性。1994年; 143:27-32。
- 29。
Gutiérrezm,sola mm,pascual l,rodriguez-garcia mi,vargas am。冷却果实的超微结构变化。食品结构。1992; 11:323-32。
- 30。
Goñio,muñozm,ruiz-cabello j,escribano mi,Merodio C.成熟过程中牛仔咖啡果实水状况的变化。Postharvest Biol Tech。2007; 45:147-50。
- 31。
将遗嘱,Poi A,Greenfield H,Righey CJ。贮藏期间Annona Atemoya的果实组成的波脱变化及储存温度对成熟的影响。Hortscience。1984; 19:96-7。
- 32。
想想JA, Kriedemann PE。葡萄分果:临界膨压的测定。澳大利亚农业研究2000;23:7-24。
- 33.
甜樱桃品种抗裂性的测定方法。果实Var Hortic Dig. 1957; 12:3-4。
- 34.
黄小明,李景刚,王慧聪,高芳芳。荔枝果裂与果皮钙含量的关系。Acta Hortic。2001;558:209-15。
- 35.
Gutiérrezm,拉赫州杰姆,Sola M,Pascual L,Vargas Am。储存在寒冷和非冷淡温度下储存的结牛皮果的总可溶性固体和组织pH的前氨基乙醇。Hortic SCI。1994年; 69:459-63。
- 36.
Jomngam P,Chen Ky,Chumpookam J,Shiesh CC。熟化与储存温度对阿米苏省质量的影响(番荔枝轧机。×答:squamosaL.)水果。Acta Hortic。2017; 1166:161-6。
- 37.
李文敏,陈建军,段玉军,胡海根,庞志超,谢建华。不同温度调节和乙烯处理对非洲骄傲冬季果实成熟软化过程中多糖代谢的影响热带作物学报,2018;39(3):275-80。
- 38。
陈南娇,陈南娇。酸草果果实成熟过程中有机酸、糖和顶空挥发物的变化Annona Muricata.L.)。J AM Soc Hortic SCI。1983; 108:931-4。
- 39。
Paull Re。糖酸组成的采后变异(Annona Muricata.L.)与呼吸和乙烯生产相关的果实。J AM Soc Hortic SCI。1982; 107:582-5。
- 40.
Sola MDM,Gutiérrezm,vargas上午。己酮磷酸循环的调节决定了牛米酱中的葡萄糖和果糖积累(番荔枝磨坊。)在成熟期间。J植物理性。1994年; 144:569-75。
- 41。
海藻糖介导的拟南芥幼苗生长抑制是由于海藻糖-6-磷酸盐的积累。植物杂志。2004;135:879 - 90。
- 42。
Dijken Aj,Schluepmann H,Smeekens SC。Arabidopsis海藻糖-6-磷酸合酶1对于正常营养生长和过渡到开花至关重要。植物理性。2004; 135:969-77。
- 43。
Devirgilio C, Hottiger T, Dominguez J, Boller T, Wiemken a .海藻糖合成在酵母中获得耐热性的作用I遗传证据表明海藻糖是一种热保护剂。acta Biochem. 1994; 19:179 - 86。
- 44。
Mackenzie Kf,Singh Kk,Brown广告。酵母水胁迫镀膜超敏反应:海藻糖在酿酒酵母中的作用。J Gen Microbiol。1988; 134:1661-6。
- 45.
Hoda A,Khalil Sha。石榴的开裂和果实品质(菲尼卡·腊饭在收获前喷施一些生长调节剂和矿质营养物质的影响。acta botanica yunnanica(云南植物研究). 2013;5:71-6。
- 46.
Cline Ja,受试M.甘草酸对果冻和山姆甜樱桃的果实裂缝和品质的影响。可以j植物sci。2007; 1:545-52。
- 47.
Munish A,Kahlon PS,Mahajan BVC。生长调节剂外源应用对荔枝水果滴,开裂和质量的影响(荔枝中华人员索恩。)cv。Dehradun。农业SCI消化。2003; 23:191-4。
- 48.
Yilmaz C, Ozguven AI。石榴采前保鲜的激素生理研究(菲尼卡·腊饭).Acta Hortic。2003; 5:716-27。
- 49.
Sharma SB,Dhillon BS。荔枝果实裂缝的内源性水平(荔枝中华人员索恩。)。J Res Punjab Agric Univ。1986; 23:432-4。
- 50。
曹家杰,姜文斌,赵永明。果蔬采后生理生化实验指导。北京:中国轻工业出版社;2007.
- 51。
Grabherr Mg,Haas Bj,Yassour M,Levin Jz,Thompson Da,Amit I等。来自RNA-SEQ数据的全长转录组件没有参考基因组。NAT BIOTECHNOL。2011; 29:644-52。
- 52。
Mortazavi A,Williams Ba,McCue K,Schaeffer L,Wold B.用RNA-SEQ进行测绘和量化哺乳动物转录om。NAT方法。2008; 5:621-8。
- 53。
Anders S,Huber W.序列计数数据的差异表达分析。基因组Biol。2010; 11:R106。
- 54。
王LK,冯泽,王X,王XW,张XG。DEGSEQ:用于识别来自RNA-SEQ数据的差异表达基因的R包。生物信息学。2010; 26:136-8。
- 55。
STEM:用于分析短时间序列基因表达数据的工具。BMC生物信息学。2006;7:191。
- 56。
de Hoon MJL, Imoto S, Nolan J, Miyano S.开源集群软件。生物信息学。2004;20:1453-4。
- 57.
Saldanha AJ。Java TreeView-微阵列数据的可扩展可视化。生物信息学。2004; 20:3246-8。
- 58.
Livak KJ,Schmittgen TD。分析对实时定量PCR和2的相对基因表达分析-△△Ct方法。方法。2001; 25:402-8。
致谢
我们感谢Letpub(www.letpub.com.),以提供语言上的协助。
资金
该项目得到了中国热带农业科学院中央公有利益科学机构基础研究基金(1630062016003)。支持者在研究设计,数据收集,数据分析,数据解释中没有作用,编写稿件或决定发布。
可用性数据和材料
支持该发现的所有数据包含在稿件及其补充文件中,除了RNA-SEQ数据。我们在序列读取档案中存入了我们的RNA-SEQ数据(SRA)(http://www.ncbi.nlm.nih.gov/sra/),我们提交的加入是SRP114346。DGE分析的原始数据也在登录号SRX3170370(NT-0),SRX3170369(NT-PC-1),SRX3170368(NT-PC-2)SRX3170367(NT-PC-3)下沉积在NCBI序列读取归档中。(NT-PC-3),SRX3170372(ETH-PC),SRX3170373(ETH-24H)和SRX3170371(ETH-NC)(http://www.ncbi.nlm.nih.gov/sra/).
作者信息
从属关系
贡献
CJJ进行了大部分实验和数据分析。DYJ和HUL进行了部分材料收集,RNA提取和生理学参数测定。LWM进行了生物信息学分析和数据解释。SDQ参与编写稿件。HHG和XJH构思,设计和协调了研究。所有作者都已经阅读并赞成最终的手稿。
相应的作者
道德声明
作者的信息
所有作者在中国热带农作物研究所,中国热带农作物研究所,湛江,524091,中国的南亚热带作物研究所。
伦理批准和同意参与
不适用。
同意出版物
不适用
利益争夺
提交人声明他们没有竞争利益。
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
附加文件
附加文件1:
图S1。参考库中unigenes的大小分布。(DOC 21 kb)
附加文件2:
图S2。对参考库中所有unigenes的GO赋值。(医生195 kb)
附加文件3:
图S3。COG分配参考文库中的所有未成年人。(Doc 55 KB)
附加文件4:
表S1。途径注释unigenes和裂解Atemoya Pericarp的途径数。(XLSX 162 KB)
附加文件5:
表S2。结果表明,所有单基因的RPKM均与核桃果皮开裂有关。(XLS 11116 kb)
附加文件6:
图S4。根据概要订购P- 预期分配数量的值。括号之间的数字表示分配的DEG的数量。(Doc 2023 KB)
附加文件7:
表S3。内参基因和候选基因的引物序列用于RT-qPCR分析。(XLS 64 kb)
附加文件8:
图S5。富含淀粉和蔗糖新陈代谢途径。用红色矩形标记的组件被认为是差异的表达。(Doc 32 KB)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
陈,J.,Duan,Y.,Hu,Y.et al。Atemoya Pericarp的转录组分析阐明了多糖代谢在收获后果实成熟和裂缝中的作用。BMC植物BIOL.19,219(2019)。https://doi.org/10.1186/s12870-019-1756-4
已收到:
接受:
发表: