抽象的
背景
被子植物性染色体一般是最近进化而来的。从常染色体开始性染色体发育的关键步骤是在非重组区域内建立一个决定性别的位点。为了更好地理解早期性染色体的进化,确定在性决定基因周围的重组被抑制的过程是很重要的。我们用异株被子植物猕猴桃Actinidia chinensis.var..对,具有活跃的性染色体系统,研究性遗址周围的重组率,以更好地了解性染色体的发展中的关键事件。
结果
我们已经确定了性别决定区(SDR)A. Chinensis.var。对利用高密度遗传作图和荧光原位杂交(FISH)将细菌人工染色体(BACs)与粗线期染色体上的性标记连接起来。SDR是靠近核仁组织区(NOR)的亚端粒非重组区。在雄性和雌性图谱中都有一个约6 Mbp大小的限制性重组区域,覆盖了约1 / 3的25号染色体。
结论
由于重组在X染色体之间和X染色体与Y染色体之间的一个相似区域被抑制,我们提出重组在该区域被抑制是因为NOR和着丝粒的邻近,NOR和着丝粒都抑制重组。这比由于X和Y染色体的差异而被抑制的重组要早。如果一个决定性别的位点在那里发展或易位到这个区域,基因组中这些被抑制的重组区域就为性染色体的进化提供了机会。
背景
性染色体在许多植物中独立进化[1,2].它们是从常染色体进化而来的通过非重组区域的性别决定位点的发展或在性别决定区域周围的非重组区域的发展[3.,它阻止性染色体之间的遗传物质交换,使它们开始彼此分离[4].每种性别的不同选择压力的组合和缺乏重组导致一系列进化过程,包括穆勒的棘轮,背景选择和遗传搭便车[5,6].
被子植物性染色体比哺乳动物性染色体年轻得多,据估计哺乳动物性染色体大约在1.67亿年前进化(Mya) [7].与X染色体相比,哺乳动物的Y染色体通常退化严重,包含的基因很少。这被认为是在男性特异性区域X和Y染色体之间缺乏重组的结果。被子植物的祖先是雌雄同体140-200 Mya,雌雄异株和性染色体在不同的被子植物科中独立进化[3.].性染色体SILON LATIFOLIA.估计已经进化了5-10 Mya [8]并且还认为番木瓜中的那些在最近发生了大约7.0和1.9 mya的两种染色体逆转[9].植物性染色体的研究可以在一般来说,对性染色体的演变提供重要的见解,特别是早期阶段[10,11].在含有多于一种性别测定基因的生物体中形成性染色体的关键事件是围绕这些基因抑制重组,这允许多个基因作为单个单元遗传,使得仅生产雄性和雌性后代。问题仍然是如何发生的[12,13].需要研究进化早期阶段的性染色体,例如在脱型高管植物中发现的那些,以回答这些问题。
属猕猴桃(猕猴桃)含有超过50种长寿的多年生植物[14].众所周知猕猴桃物种在功能性脱节,在不同植物上的男性和女性花[15].猕猴桃基本染色体数x = 29,许多物种是多倍体,从二倍体到八倍体,包括A. Chinensis.var。中国人,其中有二倍体和四倍体种族[16].雌性植物开花,看起来完整;然而,它们只产生空花粉粒,而雄花产生可育花粉,但在花柱伸长或胚珠发生前雌蕊生长受到抑制。性别决定的猕猴桃在所有倍性水平上似乎都是单因素的,因为雄性和雌性植株通常以1:1的比例出现[17].然而,存在患有Y染色体的遗传的群体在后代不是1:1,例如在雄性父母产生未更新的配子的群体中[18].同样,在春天的二倍体雄性倍增A. Chinensis.var。对为了产生一个四倍体雄性(XXYY),雄性和雌性后代以5:1的比例产生(Wu,未发表)。罕见的‘无常’二倍体雄性A. Chinensis.var。熟食店偶尔会产生果实的植物;这些果实在自行的时候在3:1的比例中产生男性和女性后代[19].这表明了猕猴桃有活跃的Y系统的性表达严格控制,其中二倍体具有统计雌性(XX)和杂种雄性(XY)。虽然没有明显的二态性染色体猕猴桃,有人建议在A. Chinensis.var。中国人,含有核仁组织区(NOR)的染色体是性染色体[20.].该建议是基于染色体染色体在噬菌体期间的观察结果,其中含含含染色体的卫星区域在雌性植物中配对,但在雄性植物中不配对。二倍体的遗传映射A. Chinensis.var。对还表明,性测定区域(SDR)位于单染色体对的亚细胞计量区域中,连杆组17 [21],对应于25号染色体的亚端粒区[22].目前还不知道有多少基因与性别决定有关猕猴桃。
所有现存的猕猴桃物种是巨型的,无论倍率或物种如何,他们的常见祖先都很可能是雌雄同体和含有性染色体。actinideae的最古老的化石建议是89 mya [23]和化石记录猕猴桃中国延伸至早中新世或20-26米亚[24];的主干系统发育的年代猕猴桃建议发生了初始分离的林c。26.9 mya [25].actinideae中的另外两个现存的属性是秋豪岛和Clematoclethra..秋豪岛能雌雄同株或功能上的雌雄异株吗Clematoclethra.是单一的[26]理论上,从理论上延伸祖先性染色体年龄的上限猕猴桃进入白垩纪,虽然它们可能已经比这更能发展得多。与哺乳动物中的性染色体相比,性染色体猕猴桃处于其进化的早期阶段。
目的提高二倍体SDR的鉴定和特征A. Chinensis.var。中国人,我们使用了高密度遗传映射,微卫星(SSR)映射和基因组序列数据来研究性别测定基因座周围的重组速率。我们还鉴定了我们发现与SDR相关联的细菌人工染色体(BAC)探针的杂交态染色体上。
结果
假染色体25的重组率
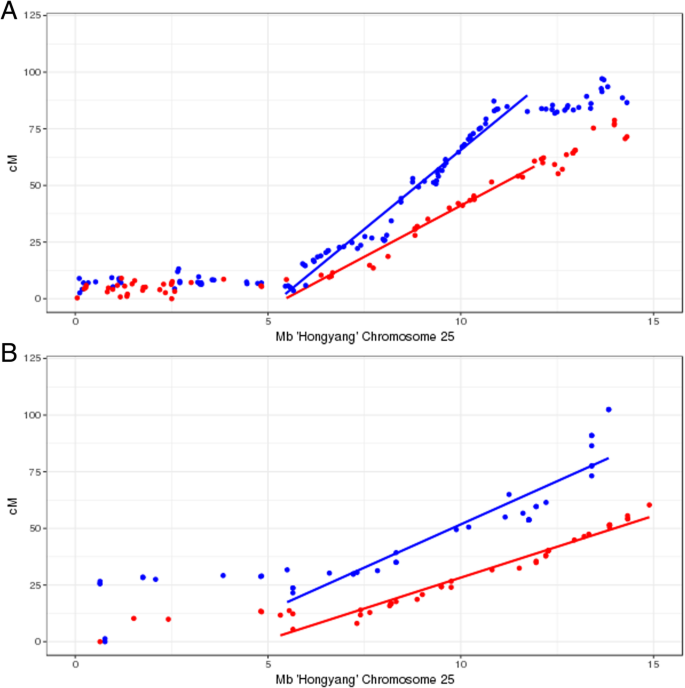
重组率沿外猕猴桃由重组映射测定的性染色体(染色体25)如图2所示。1.基于种间F1杂交的高密度遗传图谱猕猴桃温泉'mt570001'和A. Chinensis.var。对'桂海诺4'(映射人口i)含有210个标记染色体25 [22[沿着前5-6 MB的染色体25兼容,表现出抑制重组25A. Chinensis.var。对(父系)图谱,表明该区域X染色体和Y染色体极少或没有重组。的答:温泉(母系)图谱还显示25号染色体末端5 ~ 6m的重组受到抑制,表明该区域X染色体之间很少或没有重组。母性和父性也是如此A. Chinensis.var。对从‘Hort16A’× P1(作图群体II)中绘制的遗传图谱中,25号染色体的5 ~ 6m末端观察到抑制重组。两个作图家族的父本假常染色体区总重组率均较高(‘贵海4号’16.7 cM/Mb;P1为14.21 cM/Mb,高于雌性(MT57001, 10.4 cM/Mb;Hort16A 7.52厘米/ Mb)。
微卫星地图
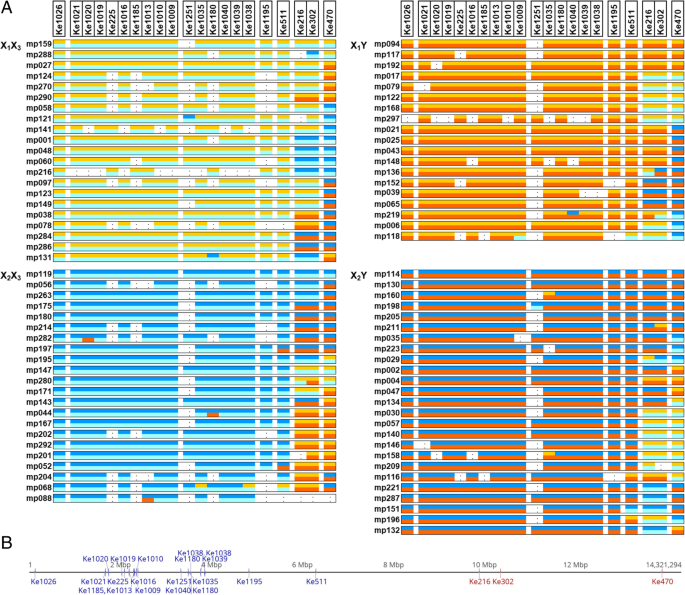
基于染色体25末端6 MB内微卫星标记等位基因的遗传,映射群III后代(一种内脏二倍体)A. Chinensis.var。对从母本X间杂交的F1定位家族1X2和父本X3.Y1)可以被分为四组:雌性后代或X1X3.或者X2X3.男性后代或者X1Y1或者X2Y1.根据标记在“红阳”基因组中的位置进行排序,其后代微卫星等位基因含量如图所示。2.对于21个标记中的18个,所获得的几乎所有微卫星等位基因都是预期的,对于没有重组的父母,该地区的遗传预期。但是,如图所示。2,有一些例外,例如MP121具有来自染色体X1251的B等位基因2而不是来自X染色体的a等位基因1正如周围标记所预料的那样。同样,MP118标记Ke1009也有一个来自X染色体的b等位基因3.从周围标记的预期,而不是来自Y染色体的C等位基因。
一个微卫星标记由它们的位置排序Actinidia chinensis.var。对'Hongyang'染色体25.用于映射群III的87个成员(CK51_05 x CK15_02)[20.,则显示每个等位基因起源的染色体(X1(黄色),X2(深蓝色),x3.(浅蓝色)或y1(红色)或未确定(。),这些是通过染色体配对分组的。这是利用信息性微卫星标记的结果,例如完全信息性标记Ke511的亲本等位基因为a(217)b(205)和c(215)d(219),雌性后代为a(217)c(215)和b(205)c(215),雄性后代为a(217)d(219)和b(205)d(215)。在毛细管电泳中,这四个等位基因被检测为扩增片段碱基对的长度差异b“红阳”基因组25号染色体上的标记位置显示,非分离标记为蓝色,分离标记为红色
伪染色体25的注释分布和遗传变异
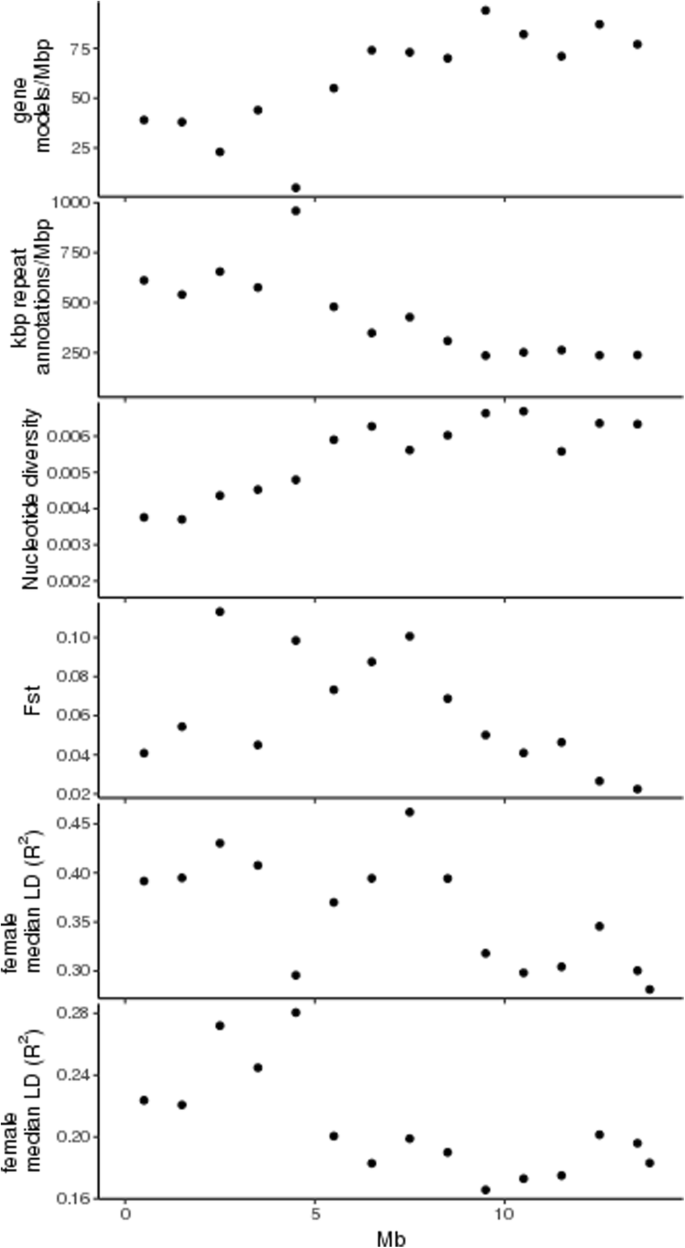
对基因模型分布和重复注释的检测表明,与25号染色体其余部分相比,0 ~ 6 Mb末端区域的基因密度较低,重复密度较高。在4.5-5 Mb处发现了一个基因非常贫乏、重复丰富的区域(图2)。3.).基因组序列数据可用于14A. Chinensis.基因型是用来计算核苷酸多样性的。核苷酸多样性在0-5 Mb区域被发现比在染色体的其余部分更低。雌雄异株的窗固定指数(Fst)在3 ~ 8mb区域出现峰值。
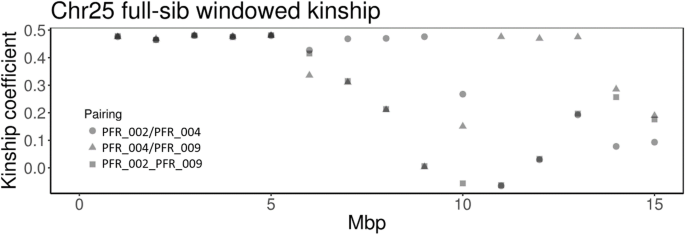
为进一步评估细胞减数分裂重组A. Chinensis.var。对性染色体,我们利用全基因组序列数据计算了3个全同胞雄性之间1-Mb窗口的成对亲属关系。这3个全同胞雄性分别从父本和母本获得了相同的Y染色体非重组区单倍型和两个可能的X单倍型中的一个。在所有三个全同胞对全同胞的配对中,假染色体的前5mb的亲缘关系在0.46到0.48之间,表明在所有三个全同胞的雄性中,该区域的相同基因型高度相似(图)。4).继承相同的本地区的X和Y单显示,他们继承了相同的X单体型孕产妇父(偶然,因为每个理论上可以收到两个单)和Y单体型从他们的父亲的父母通过整个pseudochromosome 5 Mb。在减数分裂期间,这一区域的两个X染色体或X和Y染色体之间没有重组,从而导致了这三个全同胞雄性的产生。对于其余的染色体,窗口亲缘系数从零或更少(没有共享的单倍型)到0.47(所有共享的单倍型),这与整个染色体其余部分发生的重组一致。
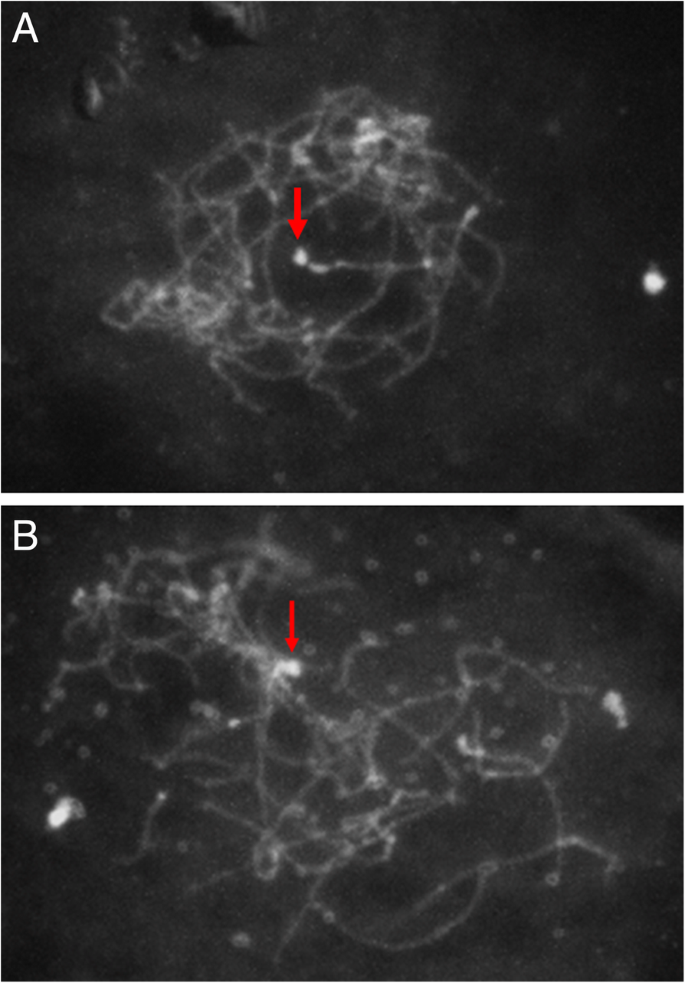
荧光原位杂交
从母本SDR中提取的三种BAC探针所观察到的杂交模式相似。在女性A. Chinensis.var。对, CK51_05,在染色体对的末端观察到强烈的杂交信号,在着丝粒处也观察到一些信号(图。5).主要杂交位点与次要收缩相关,确定为NOR。NOR占总染色体长度的5%A. Chinensis.var。对[20.].
讨论
在我们的研究中,我们采用了几种方法来表征SDR的重组景观A. Chinensis.var。对以前映射了遗传[21,22].使用特异性SDR的探针的体外荧光杂交表明,涉及单个染色体对,此外,沿染色体的重组率分析表明抑制重组在X和Y变体上的染色体25的变体的位置和程度。
在SDR染色体所在的25号染色体末端,X染色体和Y染色体之间的重组率非常低。在研究的三个双亲本遗传作图家族的父本中,X染色体和Y染色体的前5 ~ 6m均受到抑制。此外,对3个全同胞雄性的亲缘关系分析表明,他们都从父本遗传了相同的单倍型的前5 Mb的Y染色体。这是符合一个active-Y类型系统,性别决定被认为是由至少两个Y染色体性别决定基因紧密相连,和任何男性性别决定基因(XY)之间的复合植物会产生无性重组或雌雄同体的后代,而不是观察到的雌雄同体的后代猕猴桃.
X染色体和Y染色体之间被抑制的重组被认为是性染色体形成的第一步[27].两个X染色体之间的重组率A. Chinensis.var。对“Hort16A”和那些答:温泉'MT570001'抑制了前5-6 MB。这与假设一致,同时是微卫星标记的遗传模式,其中源自相同X单倍型的等位基因在端子6 MB上被继承。三种全SIB雄性的亲属性分析表明,每个母体母体的相同单倍型作为前5 MB的X染色体,进一步抑制该区域重组的证据。两x染色体和X和Y染色体之间的重组抑制程度的相似性表明该区域中的重组抑制不是由于X和Y染色体之间的逆转等差异。
X染色体和Y染色体的重组模式相似A. Chinensis.var。对其中30-35%是性测定基因所在的末端非重组区域,而剩余的65-70%经历正常重组,表明了性染色体的演变的机制A. Chinensis.var。对来自仿血剂。在基因组中,重组率不均匀,重组和抑制重组区域的热点[28].这种抑制性测定基因周围的重组是性染色体的关键特征,允许一对染色体分开演变。解决最初建立性染色体的关键问题是“如何重组最初被抑制?”[29,30.,31].在A. Chinensis.var。对,由于NOR和着丝粒的邻近,SDR似乎在一个抑制重组的区域进化。NOR和着丝粒与性别决定基因的接近很可能创造了一个抑制重组的区域,允许性别决定基因之间的重组受到限制,并允许性染色体进化。在A. Chinensis.var。对认为至少有两个性别决定基因[32]这些将包括负责抑制卵巢发育的基因(SUF.,根据Westergaard M [33]),以及负责花粉成熟的基因(米)[3.].Y编码基因负责抑制卵巢形成猕猴桃最近鉴定为男性特异性型cytokinin反应调节剂[34].性染色体的进化不仅需要这些基因的等位基因的进化,而且需要它们位于一个被抑制的重组区域,以便只产生单性的雄性和雌性后代[35].
着丝粒周围重组率的降低已经在几种动物、植物和真菌中得到证实[36].抑制Centromere周围的重组对于减数分裂期间均匀的染色体的均匀性是重要的。它是通过的CTF19/CCANKinetochore Complex。已经提示,复合物以两种方式抑制重组:抑制在靠近符号的区域中的双链断裂的形成,并募集到脑大分子区域的内聚力,这促进了乳腺间染色体修复而不是同源间修复[37].也有证据表明NOR中核糖体DNA (rDNA)周围的重组率降低。在细胞中观察到含nor染色体的减数分裂重组率降低拟南芥[38]而在酵母中,在rDNA基因周围抑制非姐妹染色体之间的减数分裂重组[39.],虽然姐妹染色单体之间有丝分裂和减数分裂重组经常发生[39.].特别提款权的重组率低A. Chinensis.var。对可能是由于NOR和着丝粒都接近SDR。例如,nor也存在于其他生物体的性染色体上果蝇[40.,如苔类植物[41.]和菠菜[42.这些NORs也可能在抑制性别决定基因的重组中发挥了作用,允许在这些生物体中建立性染色体。
性关联的BAC探针的杂交模式表明,主要杂交位点位于染色体对的末端区域,其含有二次收缩。杂交信号跨越终端区域,包括次级收缩和符号(图。5),建议SDR跨越该地区,并且性测定基因位于这两个特征之间。因为这是观察到的唯一次要收缩A. Chinensis.var。对在染色体上,很可能是NOR。bac中出现的DNA重复出现在性染色体和一些常染色体上,这可能是对其他染色体上观察到的杂交信号的解释。从其他植物的性染色体中分离出来的DNA重复已被证明存在于常染色体上[43.].FISH杂交的结果支持他和同事的[20.]断言,含含染色体是性染色体(染色体25),并且端粒位置与遗传绘图结果一致,表明性别测定基因座在与染色体相对应的连杆组的末端附近[21,22].
虽然在SDR中重组被抑制,但X染色体之间和X染色体与Y染色体之间的遗传交换水平仍然很低。在对SDR的SSR遗传分析中,当一些标记显示存在根据周围标记没有预料到的等位基因时,就可以观察到这一点。两种主要的可能会导致这种遗传模式:双交叉事件或基因转换。由于受抑制的重组,该区域不太可能发生双交叉,这种模式与非交叉基因转换是一致的。非交叉基因转换是短DNA片段在同源物之间的非互反转移。在特别提款权区域A. Chinensis.var。对有证据表明X-X,X-Y和Y-X型基因转换。例如,存在在MP131中的KE1180的X-X基因转化的证据,在MP118的KE1009中看到X-Y基因转化率的证据,并且在MP088的KE1013中看到Y-X基因转化率的证据。Overall, when considering the segregation of the markers within the terminal 5 Mb of chromosome 25, i.e. all markers apart from Ke511, Ke216, Ke302 and Ke470, there was evidence for four X1-X2 gene conversions (four unexpected alleles out of 559), three X2-X1 gene conversions (three unexpected alleles out of 495), two X3-Y gene conversions (two unexpected alleles out of 695) and three Y-X3 gene conversions (three unexpected alleles out of 638). Non-crossover gene conversions affect a short region of the DNA. The tracts have been estimated to span 50–1000 bp [44.,而基因转换是植物基因组同源物之间较为频繁的基因交换之一[45.].在其他生物的性染色体中鉴定了染色体基因转化,包括人类,灵长类动物,鸟类和苔藓[46.,47.,48.,49.].缺乏重组和基因转换的发生的组合将占我们的重组映射,亲属分析和SSR继承的结果。
结论
性染色体进化理论认为性染色体曾经是一对常染色体,由于失去了重组的能力而进化出不同的形态和基因内容[50.].围绕SDR的重组抑制是该过程的关键步骤。我们已经证实在性染色体中A. Chinensis.var。对,在X和Y以及X和X染色体之间的SDR周围,重组受到抑制,这表明该区域的重组抑制不是特定于X和Y染色体之间的差异。我们认为NOR和着丝粒靠近这一区域创造了一个被抑制的重组区域,这与男性不育和女性不育突变的进化一起,使性染色体得以进化猕猴桃.
方法
植物材料和DNA分离
三个双重父母映射群体猕猴桃用于研究染色体25的重组率。绘制人口我是一个三角形的双父母测绘家庭答:温泉×A. Chinensis.var。对(A, ' MT570001 ' × '贵海4号')[22].映射人口II是一种有条理的二倍体A. Chinensis.var。对家庭从'Hort16a'和男性父母p1之间的横跨发展。映射人口III也是一种有条理的二倍体A. Chinensis.var。对来自来自河南省的种子的女性的家庭,来自中国广西的种子加入的男性父母[21].
对定位群体II进行组培,筛选出236个个体进行基因分型。幼嫩的膨大叶片组织,重约100毫克,被收获并在−80°C下通过液氮快速冷冻保存。采用CTAB法提取基因组DNA [51.].使用Qubit™荧光分析进行DNA定量。
基因分型(GBS)、变异呼叫和单核苷酸多态性(SNP)标记的选择
发展GBS人口II型文库的方法遵循[52.,通过使用而改变Bam嗨限制消化步骤。通过在测序之前通过琼脂糖凝胶电泳进行分析,通过分析琼脂糖凝胶电泳进行单独扩增和成功制备。在测序之前通过琼脂糖凝胶电泳进行分析[53.].使用Illumina HiSeq2000在单端模式下对236个基因型的文库进行测序,每个文库产生超过2亿单端100 bp的reads。2个文库板(192个基因型)在2个车道上进行测序,1个车道上对44个基因型进行测序。在Red5(版本PS1.1.68.5)上使用参考引导的TASSEL管道执行SNP调用[54.,是已发表的基因组的早期版本[55.])和“红羊”参考基因组[56.].在所有基因型的覆盖范围内过滤SNP,在所有基因型中覆盖,从每个基因组产生〜44-50k个SNP位点,横跨29个伪体瘤组,在连锁基CH13中的未分配支架。使用以下父母对SNP标记进行脱络合物标准。首先,选择SNP标记物,其在另一个母体中的一个父母和纯合(AA)中的杂合(AB),反之亦然。这产生了一组标记,其理论上将分离为1:1
遗传图谱构建
利用' Hort16A '和P1 SNP标记构建遗传图谱,使用Joinmap3®(www.kyazma.nl.).使用“CP”格式为群体结构的“CP”格式处理SNP标记数据。使用默认设置进行连接组,用于使用修改分组,包括:a)OPEDS(LOD)的独立对数(基极10)的阈值范围从10到20的LOD得分开始使用回归映射算法.
迄今为止染色体的重组率
将分离SNP标记在遗传图谱上的物理位置与伪分子上的物理SNP位点用R 3.3.0 (https://www.r-project.org.)在两个种群中是种间的猕猴桃温泉×A. Chinensis.var。对(‘MT570001’ב贵海4号’)定位居群I和种内A. Chinensis.var。对(' Hort16A ' × P1)定位种群
SDR内微卫星等位基因的分离
SSR内部SSR标记的遗产模式在内部内部进行了调查A. Chinensis.var。对映射先前描述的人口[20.].选择21个微卫星标记进行分析;其中18个从25号染色体的末端6mb内放大,其余3个从远端部分放大。该作图群体的亲本和87个后代用这些标记进行筛查,方法与前面描述的相同[57.].这些引物的顺序和退火温度在附加文件中给出1:表S1。基于从完全信息性,女性信息性和男性信息标志物的等位基因分离的模式,根据它们起源于它们的染色体,将等位质分为四组中的一种,其中1组1来自染色体x1,第2组起源于染色体x2(继承自女性父母),第3组起源于x3.,来自Y的第4组1(遗传自父亲)。
全基因组序列比对、变异呼叫及亲缘关系分析
使用fastq-mcf (fastx toolkit, version 0.0.13)筛选和剪切短插入Illumina全基因组序列的适配器和低质量或不确定序列[58.].大约30倍覆盖的配对读数被映射到“宏阳”基因组[56.]使用bwa-mem 0.7.15 [59.].使用Freebayes 1.1.0执行变体调用[60.,在1 mb的窗口中。变体调用格式(VCF)文件使用没有丢失数据的双等位变体过滤,使用以下vcflib (https://github.com/vcflib/vcflib)管道:
vcfbiallelic |VCFFILTER -F'NS = 14&QUAL> 30&SAR> 3&配对> 0.8和SAF> 3。
VCF文件使用Beagle 4.0和默认值进行分期[61.].FST,使用VCFTOOLS 0.1.14对伪粒组合体25的每个1-MB窗口产生Tajimas PI和血缘关系系数。62.和使用vcftools relatedness2选项确定的亲属关系[63.].使用poplddecay(https://github.com/bgi-shenzhen/poplddecay.).每个窗口内的LD衰减总结为中位数R2在1 kB-10 KB子间隔中。
染色体制备
二倍体的女性基因型A. Chinensis.var。对用于本研究,CK51_05,是映射群III的女性父母以前用于构建遗传图谱A. Chinensis.var。对[21].收集各阶段的幼芽,立即置于3:1乙醇:醋酸中,4℃保存至少1天。如果芽被储存超过两周,它们被转移到70%v/乙醇并在-20℃下储存直至需要。
通过在FLP(Formo:Lacto:Propiono)orcein和观察减数分裂阶段,通过挤压每粒子阶段含有嗜孢子阶段的Meiocytes的花蕾。一旦鉴定了嗜孢子的芽,染色体制剂遵循Andras SC,Hartman TP,Marshall JA,Marchant R,Power JB,Cocking EC和Davey Mr [64.,利用每个芽中剩余的花药,并加以修饰,以花药而不是根尖。花药在1 M HCl中37°C水解15-20 min,然后在以下酶混合物中消化80 min: 4% (w/v)Onozuka R10纤维素酶(Merck 102,321),4%(w / v)纤维素酶(sigma c-9442),2%(w / v)植物含量(sigma p-3026)和1%(w / v)细胞素酶(sigma c-8274)溶解在0.01μm柠檬酸盐缓冲液pH 4.5中。Felsenstein J的落水技术[65.和Henegariu O, Heerema NA, Lowe Wright L, Bray-Ward P, Ward DC and Vance GH [66.]随后被用来制备染色体扩散。
BAC文库的构建与筛选
基因组DNA Bac库A. Chinensis.var。对CK51_05由加拿大魁北克的Bio S&T公司制备,并以4 × 4打印配置在23个尼龙过滤器上打印。的基因ndha.(NADH-dehydrogenase亚基的) 和cox2(细胞色素c氧化酶)用于分别估计来自叶绿体和线粒体的污染。只有0.6%的BAC文库含有细胞细胞DNA。从309个BAC克隆的样品,我们确定平均插入尺寸为71.32±46.15 kB,30%的采样BAC克隆包含80-260 kB的大插入物。
从衍生自患有性别联系SMX标记的非多态标记产生的聚合酶链反应(PCR)探针[67.]和两个遗传标记侧翼侧翼(Ke225和Udkac096)[21]被用来识别母本的SDR。将纯化的PCR探针用地高辛-11- dutp(罗氏诊断)进行非放射性标记,在65°C下杂交过夜,并按规定检测[68.].分离相应的BAC克隆,并选择三个标记中最小的克隆,通过nicko -translation(罗氏诊断)对其进行生物素标记。这3个克隆分别是包含Ke225 (59.7 kb)的47F17 -、包含SmX (49.3 kb)的180D13 -和包含udkac096 (85.2 kb)的156B2 -。
荧光原位杂交(鱼)
鱼类程序遵循先前发表的方法[64.],有一些修改。简而言之,将探针(50-100ng)溶解在2×SSCP(0.3M NaCl,0.03M柠檬酸钠,0.04M磷酸钠,pH6.5)中,50%甲酰胺和10%硫酸葡聚糖,并在85℃下变性分钟。向每个载玻片中加入30μl的杂交混合物,用塑料盖滑动覆盖载玻片。在70%乙醇中,在0.15m NaOH中为5分钟的制剂在0.15m NaOH中,然后通过冰冷的乙醇系列(70,85和96%,每次3分钟)脱水。在42℃下在2×SSC(0.3M NaCl,0.03M柠檬酸钠)中洗涤24小时,在42℃下温育24小时,然后在42°C下每次0.2×SSC的两个严格洗涤15分钟(严格〜68%),并在室温下检测缓冲液(0.1M Tris,0.15M NaCl,pH 7.5)中的最终洗涤5分钟。使用50ng /μlcy3-串吖素缀合物(Sigma)检测探针,5%(w/v)牛血清白蛋白(Sigma)在37℃检测缓冲液中60分钟。载玻片在含0.05% (v/ v)TWEEN®20持续15分钟,染色体制剂在1mm 4',6-二脒基-2-苯基吲哚,二羟氯晶(DAPI)(DAPI)(DAPI)(DAPI)(DAPI)中以1X PH 7.4进行逆染色,并安装在40中 μL of mounting solution (0.2% (v/v) 1, 4-diazabicyclo-[2.2.2]octane (DABCO) (Sigma), 50% (v/v) glycerol in 1X PBS pH 7.4). Following storage at 4 °C for 2–3 days before observation, chromosome spreads were observed with an Olympus Vanox AHT3 light microscope using epi-fluorescence, and images were captured with an RS Photometrics CoolSNAP digital camera. Two images were captured per cell, at excitation wavelengths of 358 nm and 550 nm. Entire images were then manipulated using Adobe® Photoshop Version 6.0. Chromosome measurements were made using the computer application MicroMeasure version 3.3 [69.].
参考文献
- 1.
Charlesworth B.性染色体的演变。科学。1991; 251:1030-3。
- 2.
Fridolfsson A-K,Cheng H,Copeland Ng,Jenkins Na,Liu H-C,Raudsepp T,木制T,Chowdhary B,Halverson J,Ellegren H.来自祖先对母染症的禽类性染色体的演变。PROC NATL ACAD SCI。1998年; 95:8147-52。
- 3.
植物性别决定与性染色体。遗传。2002;88:94 - 101。
- 4.
Welch DM,Meselson M.没有性繁殖或遗传交换的BDelloid Rotifers演变的证据。科学。2000; 288:1211-5。
- 5。
Y染色体退化过程的时间动力学。遗传学。2008;179:1513-25。
- 6。
穆勒HJ。重组与突变进展的关系。Mutat杂志1964;106:2-9。
- 7。
Warren WC, Hillier LW, Graves JAM, Birney E, Ponting CP, Grützner F, Belov K, Miller W, Clarke L, Chinwalla AT。鸭嘴兽的基因组分析揭示了进化的独特特征。大自然。2008;453:175。
- 8。
Nicolas M,Marais G,Hykelova V,Janousek B,Laporte V,Vyskot B,Mouchiroud D,Negrutiu I,Charlesworth D,Moneger F.在脱衣植物中性染色体的进化历史中重组限制的逐步过程。Plos Biol。2005; 3:E4。
- 9。
吴米,摩尔·瑞典。Carica Papaya中性染色体降解的进化节奏。J Mol Evol。2015; 80:265-77。
- 10。
Kejnovsky E,Hobza R,Cermak T,Kubat Z,Vyskot B.重复DNA在植物中性染色体结构和演变的作用。遗传。2009; 102:533-41。
- 11.
Taravella AM, Sayres MAW。对性染色体的大量分析揭示了X-treme遗传多样性。基因组医学杂志。2016;17:244。
- 12.
性染色体限制性重组的进化。生态学报2009;24:94-102。
- 13.
Charlesworth D.植物对我们对性染色体演变的理解的贡献。新植物。2015; 208:52-65。
- 14。
李杰克,李XW,Soejarto DD。修订属猕猴桃来自中国。国际园艺科学学会(ISHS),鲁汶,比利时;2007: 41-44。
- 15.
Ferguson A. Kiwifruit(Actinidia)。温带水果遗传资源及螺母作物290 1991:603-656。
- 16。
黄洪。猕猴桃遗传资源的驯化与育种。Hortic启33:1 2007;121年。
- 17。
Testolin R,Cipriani G,Messina R. Actinidia的性对照是单术,仍然是多倍体。牛津:BIOS Scientific Publishers Ltd;1999年。
- 18。
Seal AG,Ferguson Ar,De Silva Hn,张JL。2N配子对猕猴桃性别比例的影响。性植物团体。2012; 25:197-203。
- 19。
Testolin R,Cipriani G,Costa G.性别分离率和Aftinidia属的性别表达。性植物团体。1995年; 8:129-32。
- 20.
何震,黄华,钟宇。二倍体的细胞遗传学研究Actinidia chinensis.-核型、初生分化期性染色体形态及进化意义。在。国际园艺科学学会,鲁汶,比利时;2003: 379 - 385。
- 21。
弗雷泽LG,曾钰成,Datson PM,De Silva HN,Harvey CF,Gill GP,Crowhurst RN,McNeilage MA。富型物种猕猴桃(Kiwifruit)中的富含基因的联系地图揭示了推定的X / Y性别测定染色体。BMC基因组学。2009; 10:102。
- 22。
张Q,刘迪,刘毅,瑞恩·r,姚Xh,钟查,黄鹤。Kiwifruit的高密度间隙遗传图谱和性特异性标记的鉴定。DNA Res。2015; 22:367-75。
- 23。
Knobloch E, Mai DH。Früchte和Samen的专著,在der Kreide von Mitteleuropa。Rozpravy ústredního ústavu geologickénho 1986。
- 24.
崔志,黄洪,肖欣。中国猕猴桃属植物。中国农业科学技术出版社;2002.
- 25.
刘勇,李东,张强,宋超,钟超,张欣,王勇,姚昕,王铮,曾胜,等。两种猕猴桃杂交种及其亲本的快速辐射揭示了物种多样化的两层模式。新植物学家。2017; 215:877 - 90。
- 26。
他Z-C,李杰Q,蔡Q,王Q. Actinidia,Saurauia和Clematoclethra(Actinidiaceae)的细胞学。Bot J Linn Soc。2005; 147:369-74。
- 27。
穆勒HJ。遗传变异,双杂交和常杂交,在平衡致死因素的情况下。遗传学。1918;3:422 - 99。
- 28。
周鹏,周鹏飞,周鹏,王志强,王志强。短梗紫花苜蓿基因组重组的研究进展。生物科学进展。2012;4:726-37。
- 29。
植物性染色体进化。J Exp Bot. 2013; 64:405-20。
- 30.
陈某,张克,邵c,黄q,刘g,张p,歌曲w,n,chalopin d,volff j-n。扁平鱼的全基因组序列为ZW性染色体的演变和适应底栖生活方式提供了深入的洞察。NAT Genet。2014; 46:253-60。
- 31.
Wright Ae,Dean R,Zimmer F,Mank Je。如何制作性染色体。自然通信。2016; 7:12087。
- 32.
弗雷泽Lg,McNeilage Ma。生殖生物学。在:Testolin R,Huang H-W,Ferguson AR,编辑。Kiwifruit基因组。Cham:Springer International Publishing;2016. p。65-84。
- 33。
Westergaard M. Diocious开花植物中性别测定机制。adv genet。1958; 9:217-81。
- 34。
Akagi T,Henry Im,Ohtani H,Morimoto T,Beppu K,KATAOKA I,TAO R.通过在Kiwifruit中的细胞蛋白响应调节剂的谱系特异性重复进行了一系列的女性化抑制作用。植物细胞。2018; 30:780-95。
- 35。
Tanurdzic M, Banks JA。陆生植物的性别决定机制。植物细胞。2004;16 (5):s61 - 71。
- 36.
着丝粒转换但不交叉。公共科学图书馆杂志。2010;8:e1000326。
- 37.
vincent N, Kuhl LM, Lam I, Oke A, Kerr AR, Hochwagen A, Fung J, Keeney S, Vader G, Marston AL.着丝粒阻止减数分裂中着丝粒近端交叉重组。Elife。2015;4。https://doi.org/10.7554/前辈.10850.
- 38。
拟南芥四分体的基因组重组和着丝粒功能分析。美国国家科学学院学报1998;95:247-52。
- 39。
Pan J,Sasaki M,Kniewel R,Murakami H,Blitzblau Hg,Tischfield Se,Zischfield Se,Zhu X,Neals MJ,Jasin M,Socci Nd等,et al。分层组合的因素塑造了酵母减数重组引发的基因组地形。细胞。2011; 144:719-31。
- 40。
果蝇rDNA的序列分析。细胞。1977;10:213-4。
- 41。
Nakayama S,Fujishita M,Sone T,Ohyama K. rDNA序列的其他基因座,特异于Liverwort的X染色体,Markantia多晶型。染色体res。2001; 9:469-73。
- 42.
兰涛,张珊珊,刘波,李昕,陈锐,宋伟。利用FISH技术对菠菜雌雄异株性染色体的鉴别。细胞遗传学和基因组研究。2006; 114:175。
- 43.
Hobza R,Lengerova M,Svoboda J,Kubekova H,Kejnovsky E,Vyskot B.在性染色体进化的早期阶段在Silene Latifolia的Y染色体上积累串联DNA。染色体瘤。2006; 115:376-82。
- 44.
人类减数分裂交叉热点的强烈和高度定位的基因转换活性。Nat麝猫。2004;36:151-6。
- 45。
杨松,袁勇,王磊,李军,王伟,刘辉,陈建强,Hurst LD,田东。拟南芥重组事件中绝大多数是基因转化事件。中国科学院院刊2012;109:20992-7。
- 46。
McDaniel SF, Neubig KM, Payton AC, Quatrano RS, Cove DJ。苔藓紫角角龙紫外性染色体的最新基因捕获。进化;国际有机进化杂志。2013; 67:2811-22。
- 47。
Hirai H, Hirai Y, Takahata N.灵长类动物X和Y同源染色体区域之间的频繁基因转换事件。BMC Evol Biol. 2010;10:225。
- 48.
Wright AE,哈里森PW,蒙哥马利SH,指针马,人类JE。禽类性染色体上的独立层形成揭示了染色体间基因转化率和纯化W染色体的纯化选择。进化。2014; 68:3281-95。
- 49.
Trombetta B,D'Atanasio E,Cruciani F.在人Y染色体的阳性特异性区域上染色体间基因转化的模式。前群体。2017; 8:54。
- 50。
D. Y染色体的退化。《英国皇家学会哲学汇刊B:生物科学》2000;355:1563-72。
- 51。
多伊尔·j·植物的DNA协议。见:Hewitt GM, Johnston AWB, JPW Y,编辑。分类学中的分子技术。柏林,海德堡:施普林格柏林海德堡;1991.p . 283 - 93。
- 52。
Elshire RJ,Glaubitz JC,Sun Q,Poland Ja,Kawamoto K,Buckler Es,Mitchell SE。一种高分辨率物种的鲁棒,简单的基因分序列(GBS)方法。Plos一个。2011; 6:E19379。
- 53。
hillary E, Barron L, Deng CH, Datson PM, De Silva N, Davy MW, Storey RD.随机标记测序(rtGBS)基因分型,一种在目标基因组中定位限制性内切酶位点的无偏性方法。《公共科学图书馆•综合》。2015;10:e0143193。
- 54.
Crhurst R,Pilkington S,McCallum J. Kiwifruit Genome组装Red5版PS1.68.5(版本PS 1.68.5)。https://doi.org/10.5281/zenodo.1297304.2018.
- 55.
Pilkington SM, Crowhurst R, hillary E, Nardozza S, Fraser L, Peng Y, Gunaseelan K, Simpson R, Tahir J, Deroles SC,等。人工注释的猕猴桃(猕猴桃)基因组突出了与草图基因组和植物基因预测相关的挑战。BMC基因组学。2018;19:257。
- 56.
黄胜,丁建军,邓东,唐伟,孙洪涛,张磊,牛旭,张旭,等。猕猴桃猕猴桃基因组草案。Nat Commun。2013;4:2640。
- 57。
弗雷泽Lg,麦克尼拉雷马,曾荫权湾麦克拉省,麦格拉·埃省。使用Est-rolived MicroTaTellites作为Kiwifruit在遗传图的开发中的标记。在。国际园艺科学学会,鲁汶,比利时;2007年:169-176。
- 58。
Aronesty E. Ea-utils:用于处理生物测序数据的命令行工具。表达分析,达勒姆,NC 2011。
- 59。
李洪波,王志强。基于盲轮变换的长读快速定位。生物信息学。2010;26:589 - 95。
- 60.
基于单倍型的短读测序变异检测。预印arXiv:12073907 2012。
- 61.
布朗宁BL,褐变SR。基因型归纳和单倍型相相推断的统一方法,对三种三种数据集和无关个体。我是j嗡嗡声的遗传。2009; 84:210-23。
- 62。
DaneCek P,Auton A,Abecasis G,Albers Ca,Banks E,Depisto Ma,Handsaker Re,Lunter G,Marth Gt,Sherry St.变体呼叫格式和vcftools。生物信息学。2011; 27:2156-8。
- 63。
Manichaikul A,Mychaleckyj JC,Rich SS,Daly K,Sale M,Chen W-M。基因组关联研究中的鲁棒关系推断。生物信息学。2010; 26:2867-73。
- 64。
Andras SC, Hartman TP, Marshall JA, Marchant R, Power JB, Cocking EC, Davey MR. A drop-spreading technique to produce cytoplasfree mitotic preparation from plants with small染色体Chromosom杂志1999;7:641-7。
- 65。
Felsenstein J.重组的进化优势。遗传学。1974年; 78:737-56。
- 66.
Henegariu O,Heerema Na,Lowe Wright L,Bray-Ward P,Ward DC,Vance GH。细胞遗传学载玻片制剂的改善:控制染色体展开,化学老化和逐渐变性。细胞测定法。2001; 43:101-9。
- 67.
吉尔GP,哈维CF,加德纳RC,弗雷泽LG。猕猴桃性别鉴定的性别连锁PCR标记的开发。Theor Appl Genet. 1998; 97:439-45。
- 68.
杂交与检测技术综述。在:希拉里奥E,麦凯J,编辑。非放射性探针核酸分析方案。Totowa, NJ: Humana出版社;2007.27-38页。
- 69。
Reeves A,撕裂J. Micromeasure for Windows,版本3.3。2000.来自互联网的作者分发的免费计划https://sites.biology.colostate.edu/micromeasure/.
致谢
我们感谢Conseagues Maren Wellenreuther和Gail Timmerman-Vaughan关于手稿草案。
资金
本研究的设计、样本采集、基因组测序、数据解释和手稿撰写得到了AGMARDT项目P16001和国家自然科学基金(批准号:31772268)的资助。
数据和材料的可用性
本研究期间生成或分析的所有数据都包含在此已发布的文章中及其附加文件中。
作者信息
从属关系
贡献
所有作者都对手稿中所包含的实验设计做出了贡献。SMP和PD在QZ, JT, EH, AC, JM的输入下撰写了手稿。手稿由QZ、SEG、DC、LGF和MAM编辑。专家数据分析由LJ、CD和RNC完成。所有作者阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用
同意出版
不适用
相互竞争的利益
提交人声明他们没有竞争利益。
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
额外的文件
附加文件1:
表S1.微卫星分析的底漆序列。(XLSX 16 KB)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
皮尔金顿,塔希尔,希拉里奥,E。et al。遗传和细胞学分析揭示了猕猴桃部分分化植物性染色体的重组景观。BMC植物BIOL.19,172(2019)。https://doi.org/10.1186/s12870-019-1766-2
收到了:
接受:
发表:
关键字
- 性染色体
- 进化
- 性别决定
- 猕猴桃
- 猕猴桃
- 重组抑制