摘要
背景
抗油菜素氮(BZR)家族基因编码参与油菜素内酯信号转导的植物特异性转录因子(TFs)。BZR TFs在植物生长中具有重要作用,包括细胞伸长。然而,我们对此所知甚少BZR甜菜中的基因(甜菜属l .)。
结果
因此,我们进行了全基因组调查Bvbzr.甜菜的基因。通过对BES1_N保守领域的分析,六Bvbzr.在糖甜菜基因组中鉴定基因家族成员,其根据系统发育分析聚集成三个亚组。每个疏水板被保守的图案很好地定义,这意味着可以在每个亚家族的成员之间识别紧密的遗传关系。根据染色体分布映射,分别位于染色体1,4,5,6和8上的2,1,1,1,1和1基因。这独联体与主根生长相关的作用元件随机分布在启动子序列中Bvbzr.基因。组织特异性表达分析表明所有Bvbzr.基因在根、茎和叶三种主要组织类型中均有表达,其中叶的表达量显著高于根、茎和叶。亚细胞定位分析显示Bv1_fxre和Bv6_nyuw定位于细胞核内,与Wolf PSORT的预测一致。
结论
这些发现为预测其功能提供了基础BZR为进一步研究甜菜的生物学功能奠定了基础BZR甜菜的基因。
背景
油菜素内酯(Brassinosteroids, BRs)是一种植物特异性激素,在植物生命周期中参与广泛的发育过程[1].随着生物化学和分子生物学技术的发展,利用不同类型突变体进行BR信号转导的研究取得了很大进展[2那3.那4.].与直接靶向核受体的动物类固醇激素不同,BRs结合到BRASSINOSTEROID-INSENSITIVE 1 (BRI1) [5.,然后以抗油菜素氮(BZR)转录因子(TFs)为靶点[6.,进而调节br反应基因[7.那8.那9.].
BZR TFs是BR信号转导的关键元件。在拟南芥蒂利亚纳, 这BZR基因家族包括抗油菜素氮1 (BZR1),Bri-EMS-Suppressor1(BZR2 / BES1), 和BZR1 / 2.同源物1-4(Beh1.-Beh4.),显示高序列同一性BZR1 / 2.[10那11].BZR1和BZR2 / BES1分别作为转录抑制因子和激活因子[10那12那13那14].例如,BZR1与的启动子结合CPD.和DWF4.通过鉴定序列CGTG(T / C)G,最终抑制转录[12那15那16].相比之下,BES1通过识别基本螺旋环 - 螺旋蛋白,BIM1 [10].BZR1和BZR2.表现出蛋白质序列相似度高达88%[10那17].染色质免疫抑制定量PCR实验表明BZR1和BZR2 / BES1与br抑制基因结合DWF4.和BR-induced基因SAUR-AC1[18].而且,BZR2 / BES1结合到19个BZR1结合位点中的18个。研究表明BZR转录因子可能通过调节其他转录因子参与植物的生长发育[11那19].因此,识别新的BZR来自不同植物物种的基因是一种可靠的方法,以获得新的见解BZR基因家庭。
提高作物产量和改善作物质量是农业生产的两个主要目标。在极其重要的植物类固醇激素中,BRs参与广泛的细胞反应,包括细胞伸长、对环境胁迫的耐受性和对病原体的抗性,通过这些它们也可以增加产量[20.].此外,BRs的有用农业应用已被确认,包括提高几种主要作物的产量和抗逆性。例如,在叶或根快速生长期,以及贮藏糖期,BRs可以增加甜菜spad基叶绿素含量(甜菜属L.)提高叶片净光合速率和叶子气孔电导,最终改善生产。
甜菜根是甜菜的一个重要器官,甜菜是一种产糖作物,占全球蔗糖产量的30% [21].虽然人们对甜菜的转录因子进行了大量的研究,但对甜菜BZR家族的研究却很少,尤其是对其发育功能的研究。
因此,我们进行了比较基因组分析Bvbzr.对甜菜中该基因家族进行全面分析。首先,Bvbzr.根据已发表的转录组分析鉴定基因。系统发育分析和保守域序列搜索将该家族聚类为3类。接下来,Bvbzr.在使用定量实时逆转录(QRT)-PCR期间,在生长期期间分析了三种主要组织类型(根,茎和叶子)和响应于植物激素的表达模式。此外,我们调查了效果Bvbzr.甜菜根发育的基因。这些研究结果为进一步研究其结构和功能奠定了基础Bvbzr.基因,以及识别和表征BZR其他物种的基因。此外,本研究为进一步研究甜菜根生长的分子机制提供了理论依据。
结果
鉴定Bvbzr.基因
BES1_N域的隐藏马尔可夫模型配置文件用于识别BZR甜菜基因组中的六个基因Bvbzr.确定基因。随后,对各基因的蛋白质氨基酸序列进行智能分析,并与先前的发现一致。因为没有任何报告BZR甜菜的基因家庭成员,Bvbzr.根据甜菜数据库初步命名基因如下:bv5_cuzi.那Bv_epwr那bv1_fxre.那Bv6_nyuw那bv1_qnjn., 和bv_yfzt..
BvBZR家族的保守基序及其系统发育分析
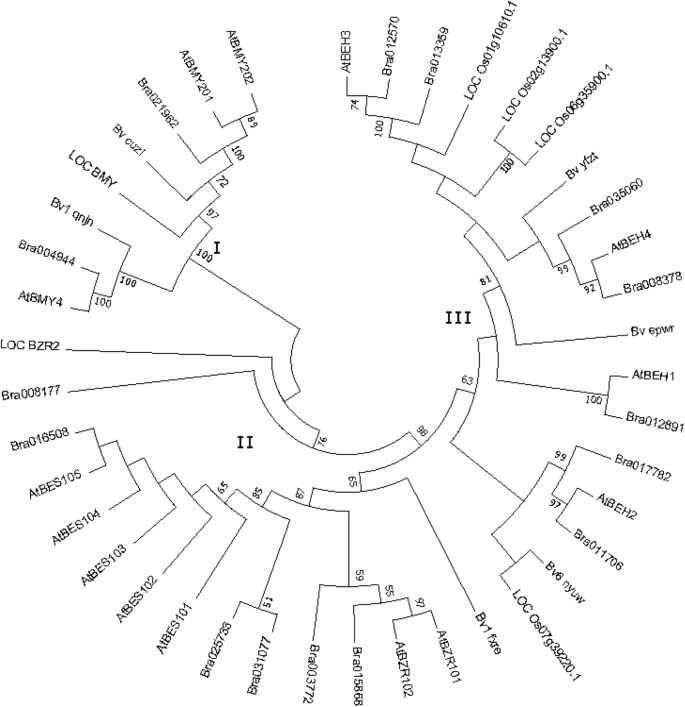
为了阐明BZR家族的进化关系,我们基于来自甜菜41个BZR家族成员的氨基酸序列构建了系统发育树,答:芥米饭和大白菜(图。1).BZR TFs分为3组,分别为8、15和18个成员。每个BvBZR亚基与它们可能的同源物聚在一起答:芥.例如,CLADE II包含ATBZR1和ATBZR2 / BES1,以及bv1_fxre.,表明与AtBZR1/2同源性最高。Bv6_nyuw与AtBEH2的同源性最高。尽管存在这些关联,AtBEH4和AtBEH2的功能尚未确定[10].
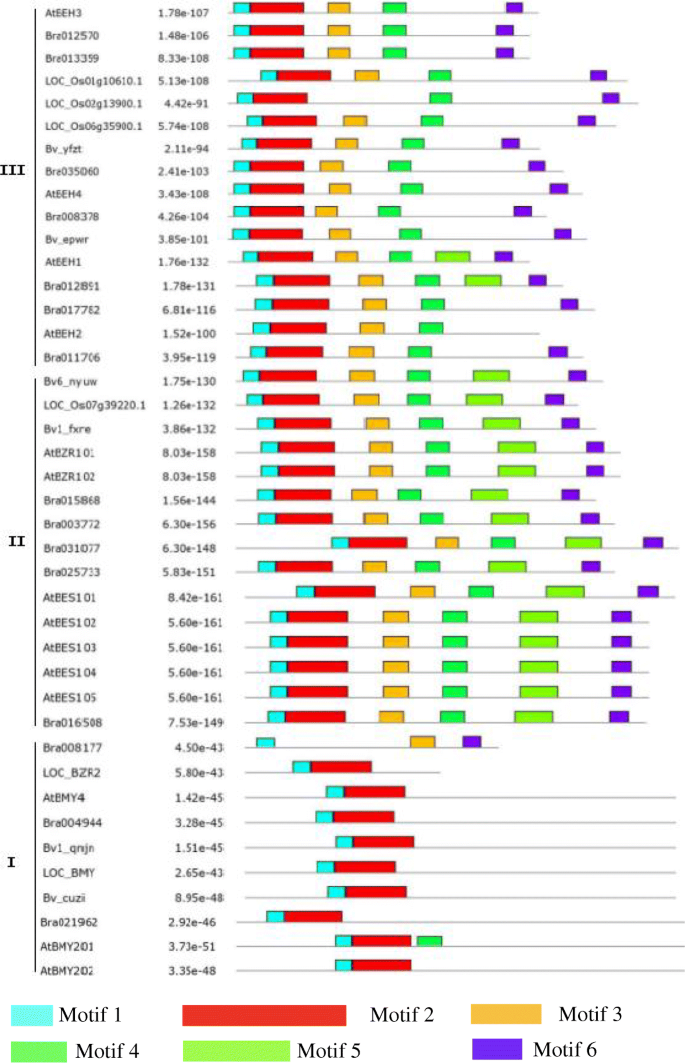
为了解BZR蛋白结构的多样性,采用模因分析方法预测甜菜BZR家族的保守基序,答:芥米饭和大白菜,鉴定了六个保守的主题。BZR成员聚集成三个亚基(Clades I,II和III)(附加文件1;无花果。2).每种思工共享类似的主题:Clade III包含保守的主题1,2,3,4和6;Clade II含有图案1,2,3,4,5和6;和Clade I包含的主题1和2。尽管重叠,但每个人都有特定的主题;例如,只有Clade II包含的图案5,而在除了CLADE I之外的所有曲线中都发现了图案3,4和6的图案3,4和6。虽然Bv_epwr,Bv6_nyuw和Bv1_fxre分布到不同的亚基中,在这些蛋白质中鉴定了相同的基序,表明它们具有类似的功能。为BV1_QNJN和BV5_CUZI观察了类似的关联。
染色体分布和基因结构Bvbzr.基因
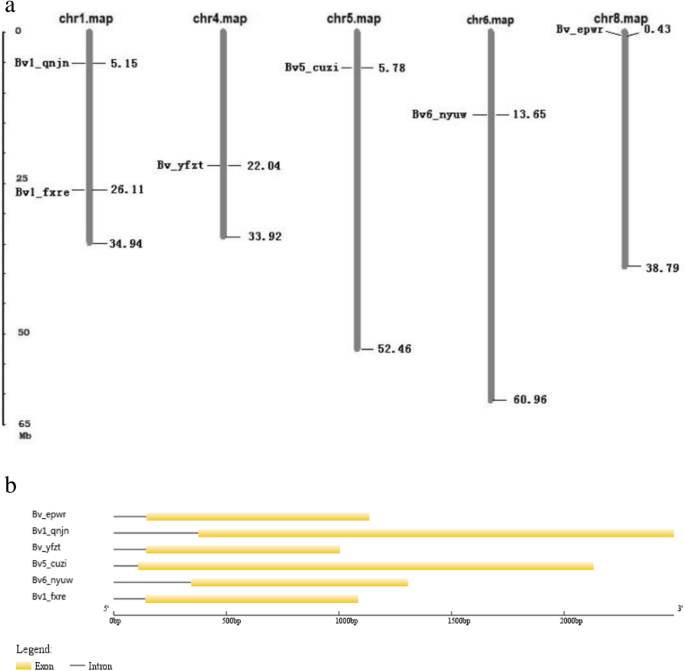
六个了Bvbzr.基因映射到五种糖束染色体上(图。3.一两)。Bvbzr.基因(bv1_qnjn.和bv1_fxre.)分布在第1号染色体上,其余4个分布在第4、5、6和8号染色体上。分析Bvbzr.基因结构显示,所有成员都只包含一个内含子(图。3.b)。
分析独联体表演的元素Bvbzr.基因推广者
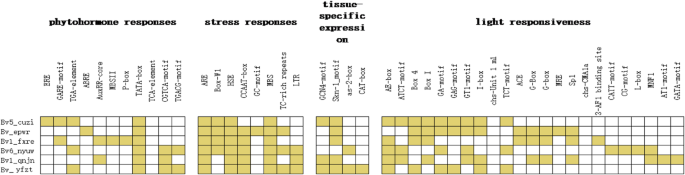
调查独联体的启动子区域的作用元素Bvbzr.使用PlantCare分析基因,在翻译引发位点上游的序列约1500bp。总计63独联体发现的元素,其与植物激素,胁迫和光反应有关,以及不同的启动子组织特异性表达Bvbzr.基因(图。4.).全部Bvbzr.上游序列包含一个假定的TATA盒。光响应元件的数量最多独联体- 结合元素,接着是应力响应元件,以及最终植物激素响应性和组织特异性表达元素,其中几种基因仅具有一个元素。不同的基因不仅包括不同数量的植物激素响应元件,包括bv1_fxre.(四个元素)与bv1_qnjn.(两个元素),还有因素响应不同类型的植物激素的元素。例如,bv1_fxre.含有生长素和赤霉素响应元件,Bv_epwr只含有脱落酸反应元件。这些发现表明不同Bvbzr.基因在主根生长过程中通过响应不同的植物激素信号而发挥不同的调控作用。
进一步分析发现的植物激素响应元件的类型Bvbzr.发现了4种基因启动子:赤霉素、脱落酸、生长素和茉莉酸甲酯。赤霉素和生长素反应元件促进生长,而其他的促进成熟。因此,bv1_fxre.,其中含有赤霉素响应元件,更有可能促进甜菜生长,而Bv_epwr,其仅包含脱离酸响应性元素,可能促进成熟。
Bvbzr.基因表达模式在营养生长期间
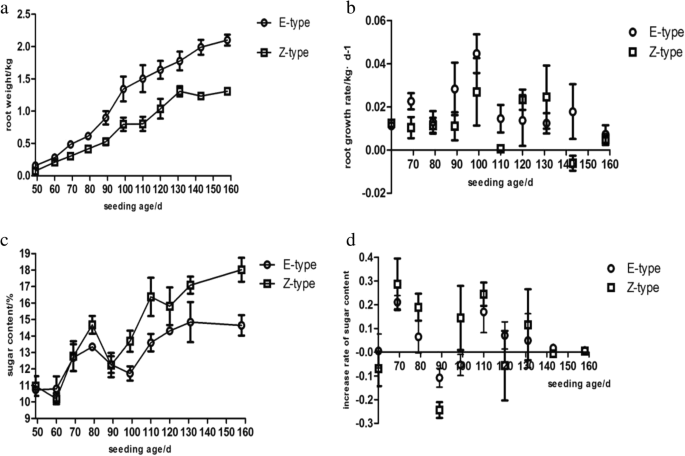
数字5.说明了甜菜根的生长特性。在整个营养期,ertrage型品种的根重均大于zucker型品种。两个品种的根系生长速率在99 d时达到最大值。在营养过程中,z型的糖含量高于e型,但两个品种的糖积累速率均在69 d时达到最大值。
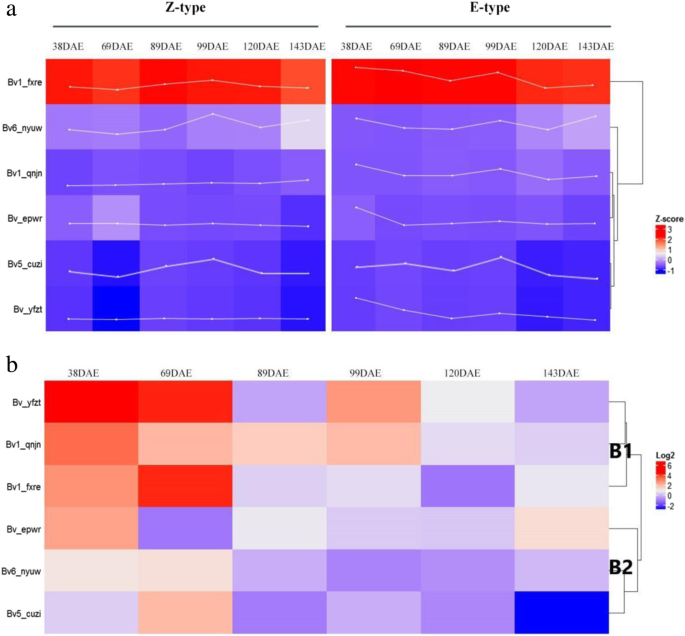
基因表达模式通常与基因功能相关。因此,我们根据甜菜生长特征相关的四个时期创建了一张热图(附加文件)2和3.;无花果。6.).所有的表达水平Bvbzr.当根生长速率在两种品种达到最大值时,基因在99天幼苗的幼苗中占据上调。特别是,bv5_cuzi.表达在第99天达到顶峰。然而,除了bv1_qnjn.,其他五个Bvbzr.在69天老化的Z型幼苗中表现出表达水平降低。而且,bv1_fxre.表达明显高于所有其他Bvbzr.(图5)6.a).为了更深入地了解它们的潜在功能,进行相关分析Bvbzr.进行了甜菜根生长速率和糖积聚速率的基因表达。观察到阳性相关性bv5_cuzi.那bv1_fxre., 和bv_yfzt.生长(表1).然而,其他基因表现出与根生长的负相关,特别是bv1_qnjn.,这表现出显着的负相关。有趣的是,bv1_qnjn.与糖积累率呈正相关,而其他基因,特别是bv5_cuzi.,显示出负相关。
来研究Bvbzr.进行两种调查的品种之间的基因,进行了聚类分析,将其分开Bvbzr.基因分为两组(图。6.b)。在38岁和69天的幼苗中,B1亚组基因的表达水平在E型中高于Z型。在99天老年龄幼苗的峰根生长速率下,两种品种表现出基因表达的显着差异,B2亚组基因表达在E型中低于Z型。在120天的幼苗中,当根生长速率低时,E型植物表现出较低的表达Bvbzr.而不是z型,除了bv_yfzt.,两种品种之间没有差异。
Bvbzr.甜菜组织中的基因表达模式
进入更大的洞察潜在功能Bvbzr.基因,我们分析了表达模式Bvbzr.e型和z型品种根、茎和叶组织中根、茎和叶生长速率最快的基因(苗龄99 d)4.).在所有三种组织类型中表达所有六种基因,尽管具有不同的表达模式,但是几种组织中某些基因的转录性丰度非常低(图。7.).几乎所有的Bvbzr.与其他组织相比,叶片中基因的表达量最高。而且,bv1_fxre.表达含量高于茎中,表明它可能对甜菜的根生长中具有重要作用。
Bvbzr.基因表达模式响应植物激素
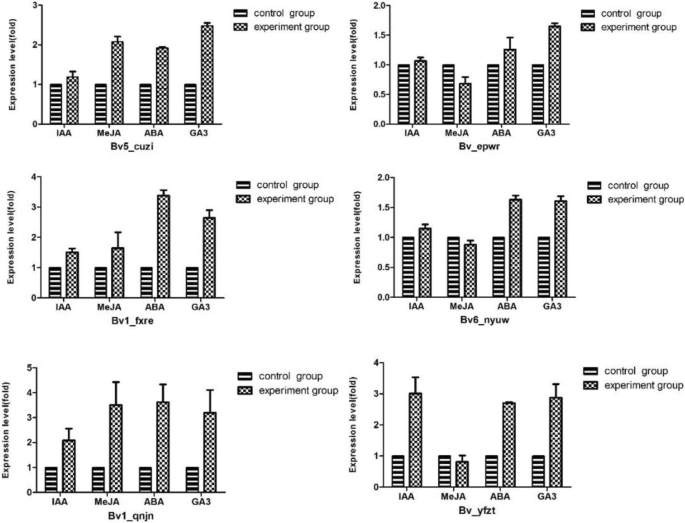
来研究Bvbzr.在甜菜根喷施吲哚乙酸(IAA)、脱落酸(ABA)、茉莉酸甲酯(MeJA)和赤霉素(GA)等外源激素后,外源激素对基因的表达有一定的调控作用3.).如图1所示。8.的表达水平bv_yfzt.用IAA喷洒后增加三倍,而Bv_epwr响应ABA表达出更高的表达。而且,Bv6_nyuw对GA的回应是上调的3.,这与的分析是一致的独联体表演的元素Bvbzr.基因的催化剂。表达水平Bv_epwr的表达水平受到抑制,而bv1_qnjn.增加,这表明Bv_epwr和bv1_qnjn.响应Meja,扮演不同的角色。
BvBZR::sGFP融合蛋白的亚细胞定位
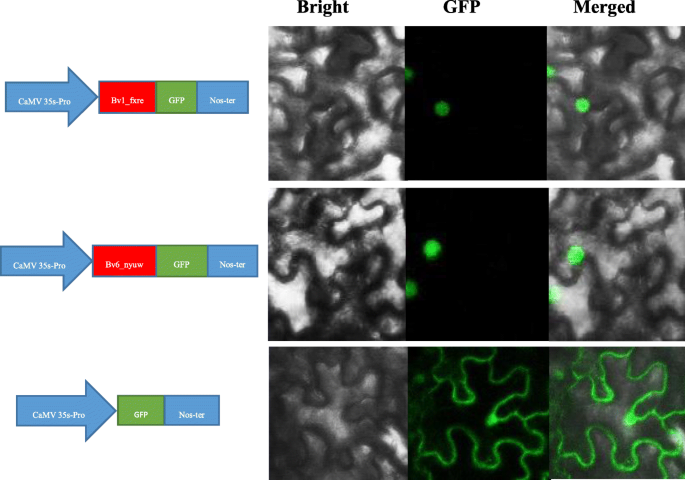
阐明亚细胞定位Bvbzr.基因,使用了狼Psort软件,这预测了大多数Bvbzr.基因是核心的本地化(附加文件5.).为了验证这一结果,将bv1_fxre.和Bv6_nyuw融合到GFP双载体中,然后在尼古利亚娜·宾夕法尼亚州叶子。细胞核内可见强烈的荧光信号(图)。9.).然而,GFP信号与35S::GFP蛋白分布于整个细胞。结果与Wolf PSORT的预测结果一致。
讨论
BZR家族是植物中重要的TF家族,在植物生长中具有各种作用。基于完成的全基因组序列,14,15和52BZR基因已被识别答:芥[12],大白菜[22和豆类[23),分别。相比之下,甜菜BZR基因家族包含的基因要少得多。为了研究BZR家族成员在物种间的进化关系,我们从植物中提取了BZR蛋白答:芥稻米和大白菜在保守的基序和系统发育分析中。本研究中的系统发育树类似于大白菜的研究中[22].系统发育分析分裂Bvbzr.基因分为三个亚组,其中Clade I包含bv5_cuzi.和bv1_qnjn.,包括进化枝IIbv1_fxre.而进化支II则包含了所有其他基因。保守基序鉴定得到了相同的结果,除了Bv6_nyuw,它被聚集在思工中。系统发育分析暗示BZR基因来源于共同的祖先。在第二进化枝中,bv1_qnjn.位于一个单独的亚洲atbzr1 / 2.那locbzr1 / 2., 和Brabzr1 / 2..我在进化枝,bv1_qnjn.被聚集到与BRA004944和AtBMY4.这些结果表明BZR基因在决定动物的特性和功能方面具有独特的作用答:芥,大米,大白菜和甜菜。
评估潜在的功能BZR甜菜根发育中的基因,评估了模型植物中同源基因的功能。由41bzR蛋白构建的系统发育树揭示了蛋白质bv1_fxre与之密切相关答:芥同源染色体(无花果。1).此外,分析独联体- 启动子中的元素证明BV1_FXRE可能在促进生长方面具有作用。组成型活性形式的BZR1的细胞类型表达证实,伸长区中的正常细胞行为需要高水平的BZR1 [24].减少BES1和BZR1导致Semidwarf表型,BES1和BZR1中的显性突变导致在光线下生长的植物中的明显表型[10那21那25].最后,另一项研究表明,BZR1与吉伯塞林协同促进细胞伸长率[14那26那27那28].
在99天的幼苗中,Z型和E型品种表现出显着差异bv_yfzt.表达(图。6.b).此外,两者之间存在正相关关系bv_yfzt.表达量和根系生长速率1),建议BV_YFZT在甜菜根生长中具有作用。在69天老年的幼苗中,Bv_epwr在z型品种中表达量较高(图。6.b),与糖积聚速率一致(图。5.d),表明Bv_epwr可能在甜菜根内的糖积累中起作用。
结论
在本研究中,我们进行了全基因组的鉴定和表征,系统发育关系、基因结构、染色体定位和启动子序列分析BZR甜菜的基因。表达分析显示,所有六种Bvbzr.成员在叶中比在根中表达得更多。此外,研究结果表明bv1_fxre.和bv_yfzt.在Taproot开发中有角色,而Bv_epwr在主根的糖积累中起作用。这是第一份需要确认的报告BZR为进一步研究甜菜BZR家族的生物学功能奠定了基础。
方法
植物材料和生长条件
本试验选用2个甜菜品种:由Strube (Söllingen, Germany)提供的e型SD13829和本实验室选育的z型BS02。种子在内蒙古农业大学农场(内蒙古呼和浩特;40°52 54”N, 111°43”53 E)。从出苗后第38天开始,每10 d同时采集根、茎和叶。在组织采集过程中,每个品种包括3个生物重复。所有样品立即在液氮中冷冻,并保存在−80°C,直到进一步分析。
鉴定Bvbzr.甜菜基因组中的基因
我们使用了一个隐马尔可夫模型概要[29],使用BES1_N(PF05687)保守域序列从PFAM数据库下载(http://pfam.xfam.org)作为查询,识别所有Bvbzr.糖甜菜数据库refbeet-1.1和refbeet-1.2的序列(http://bvseq.molgen.mpg.de/Genome/Download/index.shtml)使用BLASTP程序。此外,14次报告答:芥来自拟南芥信息资源的BZR蛋白序列(https://www.arabidopsis.org/)也用作查询序列。使用1.0×10的电子值截止施用BLASTN程序−5识别所有Bvbzr.糖甜菜基因组中的基因。确保所识别的有效性Bvbzr.基因,使用简单的模块化建筑研究工具检查各种蛋白质的氨基酸序列(智能;http://smart.embl-heidelberg.de.).
BZR蛋白的保守基序鉴定及系统发育分析
使用MEME测试BVBZR蛋白全长氨基酸序列中的保守基序[2];motif的数量被设置为6,并且默认设置被应用到所有其他参数。
甜菜BvBZR结构域答:芥使用cluster - x2.0对水稻、大白菜进行比较。利用MEGA7.0软件构建系统发育树。利用成对删除选项,应用邻居连接方法构建不同的BZR TF树。为获得每个分支的支持值,执行了1000次引导。
的染色体位置和基因结构Bvbzr.基因
有关的信息Bvbzr.从甜菜数据库中获得基因,包括染色体位置和DNA和cDNA序列。MapInspect用于映射分布Bvbzr.基因。使用基因结构显示服务器工具构建外显子/内含子基因结构[15].
亚细胞定位分析
这bv1_fxre.和Bv6_nyuw利用特异性引物扩增除终止密码子外的开放阅读框。扩增的Bv1_fxre和Bv6_nyuw DNA用酶切酶切BAM你好/萨尔我和Kpn一世/-Xba我分别限制酶,然后插入BAM你好/萨尔我和Kpn我/Xba我分别酶切pCAMBIA1300-35S-GFP载体,产生pCAMBIA1300-35S-FXRE::GFP和pCAMBIA1300-35S-NYUW::GFP。两种重组质粒均转化为根癌土壤杆菌应变GV3101。瞬态的转变N. Benthamiana.如前所述进行具有携带融合构建体的GV3101的表皮细胞。使用气体扫描共焦激光扫描显微镜(Zeiss LSM 880,Carl Zeiss,Jena,Germany)观察GFP荧光。
启动子序列分析Bvbzr.基因
从起始密码子(ATG)上游约1500 bp的序列Bvbzr.从甜菜数据库中确定基因为调控启动子区域。随后,利用PlantCARE数据库(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/).
测量外源植物激素对外源性植物的反应
BS02植株在土壤中生长76 d后喷施赤霉素3.(80 mg / L),ABA(10mg / L),IAA(0.5 mg / L),Meja(200μmol/ L)或甜菜根的水3小时。从三个生物重复收集根。所有样品立即在液氮中冷冻,并保存在−80°C,直到进一步分析。
QRT-PCR.
在韩晓敏博士指导下,使用TRIzol提取各样本总RNA。cDNA稀释16倍后作为模板。采用CFX96实时PCR系统(Bio-Rad, Hercules, CA, USA)进行qRT-PCR,反应时间为20 μL,包含10 μL iTaq Universal SYBR Green Supermix (Bio-Rad)、0.5 μL每个引物(10 μM)、2 μL cDNA模板、7 μL双馏H2O. PCR程序如下:95℃,2分钟,其次为40℃,10s,55℃,10s,72℃,30秒。每次反应后,都进行熔化曲线分析以确认只有一个产品被扩增并检测到。引物序列列于附加文件中2S1:表。周期阈值(CT.)值用于计算表达式的折叠变化差异。使用2确定相对表达水平-△△CT.方法 [30.].所有qRT-PCR实验包括3个生物学重复,每个重复3个技术重复。然后用相对表达量进行分析Bvbzr.在主根生长过程中的表达模式,并使用Heatmap Illustrator (ver。1.0.1;https://hemi.biocuckoo.org/).使用SPSS(VER.18.0)进行对甜菜根生长速率和糖积累的根,茎和叶基因表达水平的相关分析。
缩写
- 阿巴:
-
脱落酸
- BRI1:
-
芸苔类固醇不敏感1
- br:
-
Brassinosteroids
- BZR:
-
BRASSINAZOLE-RESISTANT
- BZR2 / BES1:
-
BRI-EMS-SUPPRESSOR1
- 大街:
-
出现后的日子
- e-type:
-
Ertrag-type
- 遗传算法3.:
-
吉布林素
- 国际宇航科学院:
-
吲哚乙酸
- Meja:
-
甲基jasmonate
- QRT-PCR:
-
实时定量逆转录PCR
- TFS:
-
转录因素
- Z型:
-
Zucker-type
参考
- 1。
李建军,李建军。油菜素内酯信号转导中富含亮氨酸重复受体激酶的研究。细胞。1997。https://doi.org/10.1016/s0092 - 8674 (00) 80357 - 8.
- 2.
Clouse SD。分子遗传学研究证实油菜素内酯在植物生长发育中的作用。植物j . 1996。https://doi.org/10.1046/j.1965-313x.1996.10010001.x..
- 3.
Kim MH, Kim Y, Kim JW, Lee HS, Lee WS, Kim SK,等。拟南芥bak1相关受体样激酶1 (BARK1)的鉴定及其基因表达和油菜素甾醇调控的根表型特征。植物生理学报。2013。https://doi.org/10.1093/pcp/pct106.
- 4.
罗XM,林夫,朱谟,朱耶,孙y,风扇xy等。通过拟南芥的GATA转录因子整合光和芸苔和芸苔类化途径。DEV细胞。2010年。https://doi.org/10.1016/j.devcel.2010.10.023.
- 5.
brassinosteroids - insensitive-1是一个广泛表达的富含亮氨酸重复受体丝氨酸/苏氨酸激酶。植物杂志。2000。https://doi.org/10.1104/pp.123.4.1247.
- 6.
Kim Tw,Guan S,Sun Y,Deng Z,Tang W,Shang JX等。芸苔类固醇信号转导从细胞表面受体激酶转导到核转录因子。NAT细胞BIOL。2009年。https://doi.org/10.1038/ncb1970.
- 7.
Tang WQ,Yuan M,Wang R,Yang Yh,Wang Cm,Kim Tw等。PP2A通过去磷酸化BZR1激活芸苔甾体系重基因表达和植物生长。NAT细胞BIOL。2011年。https://doi.org/10.1038/ncb2151.
- 8.
王志勇,王启明,冲科,王福荣,王磊,白明明,等。油菜素内酯信号转导途径。细胞研究》2006。https://doi.org/10.1038/sj.cr.7310054.
- 9.
于晓峰,李丽,李丽,郭明,乔杰,尹永华。拟南芥中含有jumonji结构域的ELF6和REF6蛋白对油菜素内酯调控的基因表达的调控。《美国国家科学院学报》上。2008.https://doi.org/10.1073/pnas.0802254105.
- 10。
尹永红,王海峰,陶玉华,张志强,张志强。拟南芥的一个新分类。细胞。2005。https://doi.org/10.1016/j.cell.2004.11.044.
- 11.
yu x,li l,zola j,aluru m,ye h,foudree a等。拟南芥中BES1靶基因的基因组鉴定揭示了一种芸苔类化合物转录网络。工厂J1111。https://doi.org/10.1111/j.1365-313x.2010.04449.x.
- 12.
他JX,Gendron JM,Sun Y,Gampala S1,Gendron N,Sun CQ等。BZR1是一种转录压缩机,具有双重作用的芸苔类固态性稳态和生长反应。科学。2005年。https://doi.org/10.1126/science.1107580.
- 13.
他JX,Gendron JM,杨YL,李杰,王泽。GSK3样激酶Bin2磷酸化和BZR1,拟南芥中芸苔类固醇信号通路的正调节剂。《美国国家科学院学报》上。2002年。https://doi.org/10.1073/pnas.152342599.
- 14.
Oh E,朱继勇,Ryu H, Hwang I, Wang ZY。TOPLESS通过与BZR1相互作用介导油菜素类固醇诱导的转录抑制。Nat Commun》2014。https://doi.org/10.1038/ncomms5140.
- 15.
胡斌,金军,郭爱华,张华,罗军,高国刚。gss2.0:一种改进的基因特征可视化服务器。生物信息学》2015。https://doi.org/10.1093/bioinformatics/btu817.
- 16.
王厘米,尚jx,陈qx,prieto jao,bai my,yang yh等。通过串联亲和力纯化鉴定BZR1 - 相互作用蛋白作为拟南芥中芸苔类固醇信号通路的潜在组分。Mol细胞蛋白质组学。2013年。https://doi.org/10.1074/mcp.m113.029256.
- 17.
尹永红,王志勇,Garcia SM,李建明,Yoshida S, Asami T,等。BES1在细胞核中积累,响应油菜素内酯调控基因表达,促进茎伸长。细胞。2002。https://doi.org/10.1016/s0092-8674(02)00721-3.
- 18.
Ryu H ., Kim K ., zhao H ., huang I., BSU1和BIN2在油菜素内酯信号转导中的主导作用。摩尔细胞。2010。https://doi.org/10.1007/s10059-010-0034-y.
- 19.
Ryu H,Kim K,Cho H,Park J,Choe S,Hwang I. BZR1介导的BZR1核细胞麦克风在拟南芥芸苔类固醇信号中必需。植物细胞。2007年。https://doi.org/10.1105/tpc.107.053728.
- 20。
Oh E,朱建勇,白美,Arenhart RA,孙勇,王志勇。在拟南芥的下胚轴中,细胞伸长是通过一个相互作用的转录因子的中心回路来调控的。eLife。2014.https://doi.org/10.7554/前辈.03031.
- 21。
张艳芳,李国良,王雪峰,孙宇强,张淑英。甜菜(Beta vulgaris L.)不同发育阶段主根生长和蔗糖积累的转录组分析《公共科学图书馆•综合》。2017。https://doi.org/10.1371/journal.pone.0175454..
- 22。
吴p,宋xm,王z,段wk,胡r,王wl。大白菜中BES1转录因子家庭的基因组分析。植物生长调节。2016年。https://doi.org/10.1007/S10725-016-0166-Y..
- 23。
李媛媛,何丽丽,李娟,陈建辉,刘灿。豆科植物BZR转录因子基因家族的全基因组鉴定、特性和表达谱分析。植物学报。2018。https://doi.org/10.3389/fpls.2018.01332.
- 24.
蔡万农,王志勇。拟南芥中油菜素内酯的时空信号转导及其与生长素模式干细胞动态的拮抗作用。咕咕叫医学杂志》2015。https://doi.org/10.1016/j.cub.2015.02.046.
- 25.
王志勇,中野涛,金德龙,何建新,陈敏,Vafeados D,等。核定位BZR1介导油菜素内酯诱导的生长和反馈抑制油菜素内酯生物合成。Dev细胞。2002。https://doi.org/10.1016/s1534-5807(02)00153-3.
- 26.
Bailey TL,Boden M,Buske Fa,Frith M,Grant Ce,Clementi L等。MEME SUITE:主题发现和搜索的工具。核酸RES。2009年。https://doi.org/10.1093/nar/gkp335.
- 27.
李qf,王厘米,姜l,李某,孙某,他jx。BZR1和戴尔斯之间的相互作用在拟南芥中介导铜豆荚和胃纤维素之间的直接信号交叉谈。SCI信号。2012年。https://doi.org/10.1126/scisignal.2002908.
- 28.
李庆芳,何建新。油菜素内酯和赤霉素之间的信号串扰机制。植物信号行为,2013。https://doi.org/10.4161/psb.24686.
- 29.
Finn Rd,Clended J,Arndt W,Miller Bl,Wheeler TJ,Schrei派F等人。HMMER Web服务器:2015更新。核酸RES。2015年。https://doi.org/10.1093/nar/gkv397.
- 30。
Livak KJ, Schmittgen TD。使用实时定量PCR和2(−Delta Delta C(T))方法分析相对基因表达数据。方法。2001。https://doi.org/10.1006/meth.2001.1262ce.
确认
感谢内蒙古大学王迎春教授和马斌杰博士提供airscan共聚焦激光扫描显微镜,以明确亚细胞定位。
资金
这项工作得到了以下补助金:中国国家自然科学基金(31760416)和中国农业研究系统(CARS-170201)。资助者在研究设计,数据收集和分析中没有规则,决定发布或准备手稿。
数据和材料的可用性
本研究中产生或分析的所有数据均包含在本文及其补充信息文件中。本研究中使用和分析的数据集可在合理要求下由通讯作者提供。
作者信息
隶属关系
贡献
SYZ构思并指导了这项研究。SYZ, YQS和GLL设计实验。WW进行了实验,分析和解释了数据。SYZ, GLL和YQS参与了讨论,并提供了宝贵的意见和实际贡献。WW写的手稿。所有作者审查,编辑和批准的最终稿件。
通讯作者
道德声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
两位作者宣称他们没有相互竞争的利益。
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
附加信息
这份文件中的英文经过了至少两名专业编辑的审核,他们都是以英语为母语的。有关证书,请参阅:http://www.textcheck.com/certificate/nlw0cd.
权利和权限
开放获取本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
王伟,孙玉强。、李、GL。et al。基因组鉴定,表征和甜菜中BZR转录因子家族的表达模式(甜菜属l .)。BMC植物杂志19,191(2019)。https://doi.org/10.1186/s12870-019-1783.1.
已收到:
公认:
发表:
关键字
- BZR转录因子
- 表达式模式
- 全基因组分析
- 甜菜
- Taproot开发