摘要
背景
根寄生杂草是世界范围内作物生产的主要制约因素,每年造成产量和经济价值的重大损失。这些寄生虫通过附着在宿主身上的一种独特的器官,即吸器,来获得完成生命周期所需的营养物质(糖、氨基酸等),从而导致自身的毁灭。寄生杂草的营养需求和寄主依赖程度不同,糖转运体的差异表达可能是寄生后存活的关键因素。
结果
我们确定编码的单糖转运体(MSTS)基因家族,蔗糖转运(SUTs)和糖果(糖最终将出口转运)三根寄生杂草在主机的依赖性不同:Triphysaria杂色的(兼hemiparasite),Phelipanche aegyptiaca(全寄生物),Striga hermonthica(预留hemiparasite)。通过对这些基因在寄生虫发育过程中的系统发育关系和差异表达谱的研究,揭示了不同寄主依赖水平的寄生虫之间存在的差异。在三种寄生虫之间发现了估计基因数量的差异,不同糖转运蛋白基因家族的同源基因要么在寄生虫发育过程中的表达谱中保持保守,要么在发育时的表达中显示出寄生虫特有的差异。例如,pGLT分支中的MST基因在与宿主连接之前表达最高斯特和Triphysaria但不是菲律宾人而MST ERD6-like分支的基因在连接后生长阶段高度表达菲律宾人但在萌发和繁殖阶段中最高Striga。这种差异是否反映了由不同的主机依赖级别引起的变化尚不清楚。
结论
虽然推测MST、SUT和SWEET基因家族成员的估计基因数量和表达谱的差异是诱人的菲律宾人那斯特和Triphysaria为了反映寄生虫对宿主的依赖程度,需要额外的证据来证明转运体基因表达的改变是因果关系。我们的发现确定了定向调控的潜在靶点,这将有助于更好地理解营养物质的运输过程,也可能是控制这些寄生虫对作物产量破坏性影响的手段。
介绍
属根寄生杂草列当科是在全球范围内生产生产的主要制约因素1那2那3.],导致作物产量和经济价值的损失估计将超过数十亿美元每年[2那3.].这些寄生虫的主机中是世界上最重要的食物和饲料草(玉米,高粱,小米和大米)和谷物豆类(豇豆,花生),其在整个范围内的地区最小到100%4.那5.那6.].目前,限制这些寄生虫的影响和传播的措施并不有效。使这些控制困难更加复杂的是各种种子的事实列当科可以在土壤中存活多年[7.难以消除困难。
现在有充分的证据表明,寄生虫生命周期的进展依赖于一系列宿主衍生的化学线索,这些线索导致了宿主-寄生虫相互作用过程中的关键发育变化。例如,寄生物种子只有在土壤中经过一段时间的后熟和预处理后,以及在根际存在寄主来源的化学刺激物(如独角珠内酯)时才会萌发[8.那9.].在萌发后,伸长的寄生胚根会转变为吸器,这是依附宿主的独特器官,这是对第二组宿主衍生的化学线索的反应,被称为吸器启动因子(hif) [10那11].吸器一旦形成,就会附着在宿主根上,形成侵入性组织,横过宿主根皮层,最终与宿主血管系统建立连接。与此同时,特化细胞和组织的发展使寄生虫获得和利用宿主来源的营养[10].大多数对寄主植物的损害发生在寄主生长的前期,寄主生长和活力的下降就是证据[1].随着寄生虫从土壤中萌芽,它生长到生殖成熟,开花并结出种子,从而完成其生命周期[9.那10].
尽管它们对许多作物构成了巨大的威胁,但直到最近,人们才对寄主-寄生杂草相互作用的分子方面进行了研究,这方面的研究相对于其他已经得到充分研究的致病因子。大多数早期对寄生性植物的分子研究列当科家庭专注于塑性基因组进化[12那13]、多样性分析[14那15那16那17那18,以及系统发育关系[19那20.那21]在家庭成员中。随后,出现了报告,其中调查人员试图了解宿主和寄生虫的基因表达,响应于使用CDNA文库分析和来自宿主和寄生虫的表达的序列标签(EST)的表达序列标签(EST)测序的差异基因表达分析攻击[22那23那24那25那26].
三种寄生性植物的比较转录组学列当科(例如,Triphysaria杂色的那Phelipanche aegyptiaca,Striga hermonthica)和几个相关的非寄生虫进行了研究,以检查在这组寄生虫的进化过程中发生的全球变化,并潜在地确定寄生虫生活方式所需的变化[27那28那29].通过寄生植物基因组计划(PPGP;http://ppgp.huck.psu.edu/).Wickett等人分析这些数据集的第一种方法[30.而非光合作用的寄生植物p . aegyptiaca叶绿素生物合成的基因被保留、转录并受到净化选择,这表明叶绿素的功能与光合活性无关。随后,Yang等人[31]分析了来自p . aegyptiaca那美国hermonthica,t .杂色的通过基因表达的差异表达和基因表达聚类分析,以鉴定具有促进寄生与寄主植物相互作用作用的候选寄生性基因。这些研究人员表明,表达变化,无论是否基因复制,是大多数与寄生有关的基因进化的常见机制,他们认为适应性进化或放松选择限制可能在吸器基因的进化中是重要的。基于表达数据,Yang等人[31,进一步表明根和花发育相关基因的共选择在吸器的进化中起关键作用。Honaas等人利用激光捕获解剖制备的宿主-寄生虫界面组织样本生成的转录组数据[32表明,寄生植物的基因表达模式会随着宿主受到攻击的性质而改变。此外,在界面上差异表达的基因中有各种糖转运体,这表明在宿主-寄生虫相互作用中可能起着至关重要的作用。
糖转运体大致分为三种主要类型:单糖转运体(MSTs),蔗糖转运体(SUTs)和糖类(糖类最终将被出口转运体)。MSTs和SUTs在糖内流中起作用[33],而SWEETs(也被称为Medicago Truncatula.结瘤素3(MtN3)/唾液[34)在韧皮部运输中起重要作用[35]它们主要在蔗糖流出和双向糖转运中起作用[35那36那37].
MSTS是Sugar_tr域(PF00083),包含主要促进者超级家族(MFS)类运输商的成员。在结构上,MFS转运仪通常含有12个跨膜(TM)域[37那38那39].七MST进化枝已在植物中定义:(i)所述早期反应脱水6样(ERD6样)进化枝[40](有时缩写为ESL);(ii)含有含有SGB1的塑性葡萄糖涂布器(PGLT)的疏水剂(G蛋白β1的抑制剂)亚洲分支[37];(iii)肌醇转运体(INT)和(iv)紧张性单糖转运体(TMT)分支[41,两者的成员都位于液泡膜和质膜上[41那42那43],并参与液泡单糖转运[37那44];(v)多元醇/单糖转运蛋白(PMT)的疏水板,其在Lalonde和Frommer中称为PLT [41];(vi)液泡型葡萄糖转运体(VGT)分支;及(vii)糖转运蛋白(STP)分支[38那41],其成员发挥多种作用,包括与共生真菌和致病真菌的相互作用[37]、花粉发育及根系发育[45].
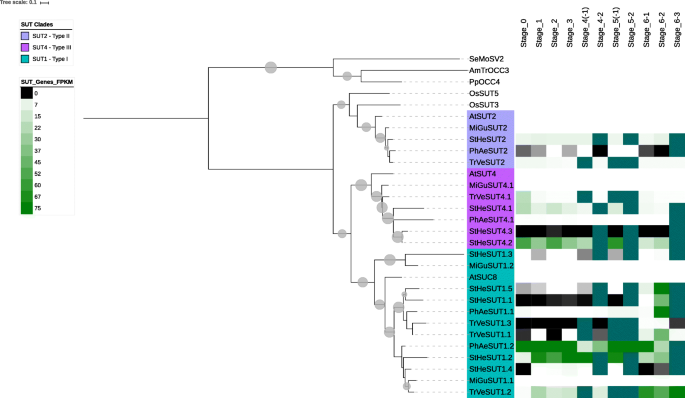
SUTs,像MSTS,是MFS的Sugar_tr结构域(PF00083)超家族成员[38,但他们的组织却不那么清晰。sut最初被分为五个分支,包括SUT1-SUT5 [41那46].SUT1是双子叶特殊分支,其成员在伴细胞和筛分子中表达[37],并建议从伴细胞通过内质网(ER)筛分元素[46那47].SUT1蛋白在韧皮部装载中起作用[48那49]及卸货[50],以及与共生真菌和致病真菌的细胞相互作用(载于[37])。SUT2分支的成员在单子叶和双子叶中都有发现[46],并在库细胞中表达,在较小程度上,在源叶中表达[51].与Sut1疏浚成员一样,Sut2疏水板构件可以有助于Phloem载荷和蔗糖的运输到各种水槽细胞中[52].SUT4分支也在单子叶和双子叶中表达[46,并在表达式中进行本地化,以筛选元素[53]和源叶[54].它们参与了几个过程,包括脱水反应和光合作用[54]和昼夜节律[55],使结节发育[56].SUT基因表达已被证明在与源-库蔗糖运输相关的不同生理条件下发生变化[57].彭等人[58将SUTs分为两个亚科:古群1 (AG1)和古群2 (AG2)。在AG1中有两个分支,双子叶植物特有的“类型I”分支和单子叶植物和双子叶植物都有的“类型III”分支。在AG2中也有两个分支,在单子叶和双子叶中都发现的“II型”和单子叶特有的“IIB型”。根据彭等人[58, Kuhn & Grof报道的SUT1组[46]和SUT4组报道拉隆德&Frommer [41]分别属于I型和III型演化枝。Peng等人的II型进化枝[58]包含来自Lalonde & Frommer的SUT2 [41]和类型IIB组包含SUT3和SUT5从库恩&格罗夫[46].
糖是糖转运体,像SUTs和MSTs一样,在不同的生理条件下基因表达发生变化,这种变化与调控源-库蔗糖运输有关[57].与MSTS和SUTS相反,甜食是含有七个TM域的转运蛋白的超家族的成员[36那37那59].糖果的特征是MtN3/唾液域[60],包含一对重复序列,它们跨越两个TM螺旋,由一个环路连接[61].有四组糖果是植物独有的,编号为I到IV。
先前的研究已经确定糖的运输在植物的基本生长和发育、根和茎的伸长、分生组织的生长以及与共生和致病微生物的相互作用中起着至关重要的作用[33那37那45那62].MSTs和SUTs的成员都参与了宿主植物和病原真菌之间的相互作用[37那63,而SWEETs被证明是被病原体利用的,比如黄oryzae[64].除了对蔗糖转运体的分析Phelipanche ramosa[65目前对寄生杂草中糖转运基因家族的结构和组织以及它们在宿主-寄生虫相互作用中的作用知之甚少。
有充分的文献记载,寄生植物的寄主依赖程度不同,从兼性半寄生形式(例如,Tryphysaria.能在不与寄主接触的情况下进行光合作用并完成其生命周期的寄生性植物,到完全不进行光合作用的全寄生性植物,包括寄生性植物菲律宾人(syn。奥诺坎普)属那这完全取决于他们的主人。其他,就像迫使血珠一样Striga,有能力光合作用,但依赖于他们的早期生长阶段,仍然是尚未明确的原因,仍然是发展的[27那28那29].鉴于这些差异和营养交换从宿主到寄生虫的重要性在整个生命周期中,我们假设寄生血液中发育时间和表达水平的差异可能存在不同的宿主依赖性,并且这些差异可能是重要的寄生虫生存。为了解决这个问题,我们表征了三种寄生植物的糖转运曲目,Phelipanche aegyptiaca那Striga hermonthica,Triphysaria杂色的在寄主依赖程度的不同,并检查了寄主附着之前和之后以及在寄主生长的早期和后期/生殖阶段的不同家族成员在寄主幼苗中的表达模式。此外,我们利用正群分析来确定一个分支中表达的任何变化是否可以用在同一个糖转运子分支中可能存在的多个正群来解释。我们鉴定了MST、SUT和SWEET基因家族的成员,这些基因家族既有一般表达,也有发育阶段特异性表达,并推测这些基因/基因家族在控制宿主相互作用中的潜在作用。
结果
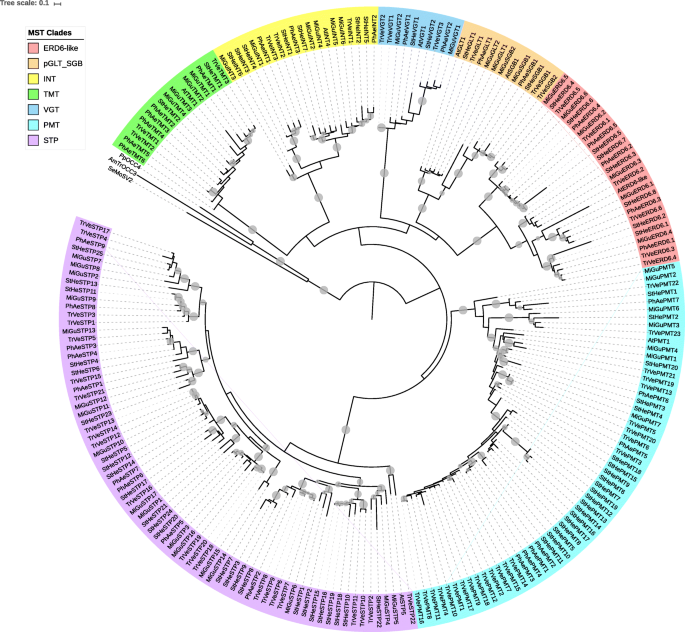
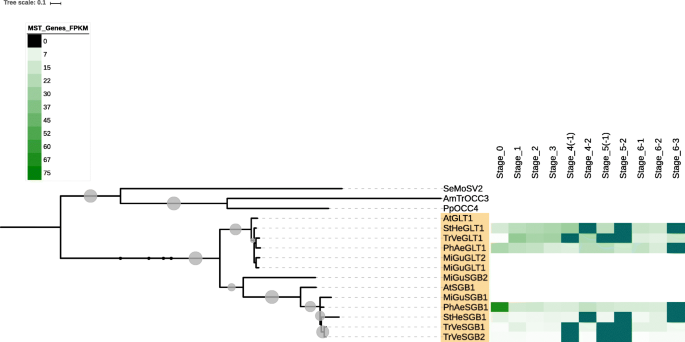
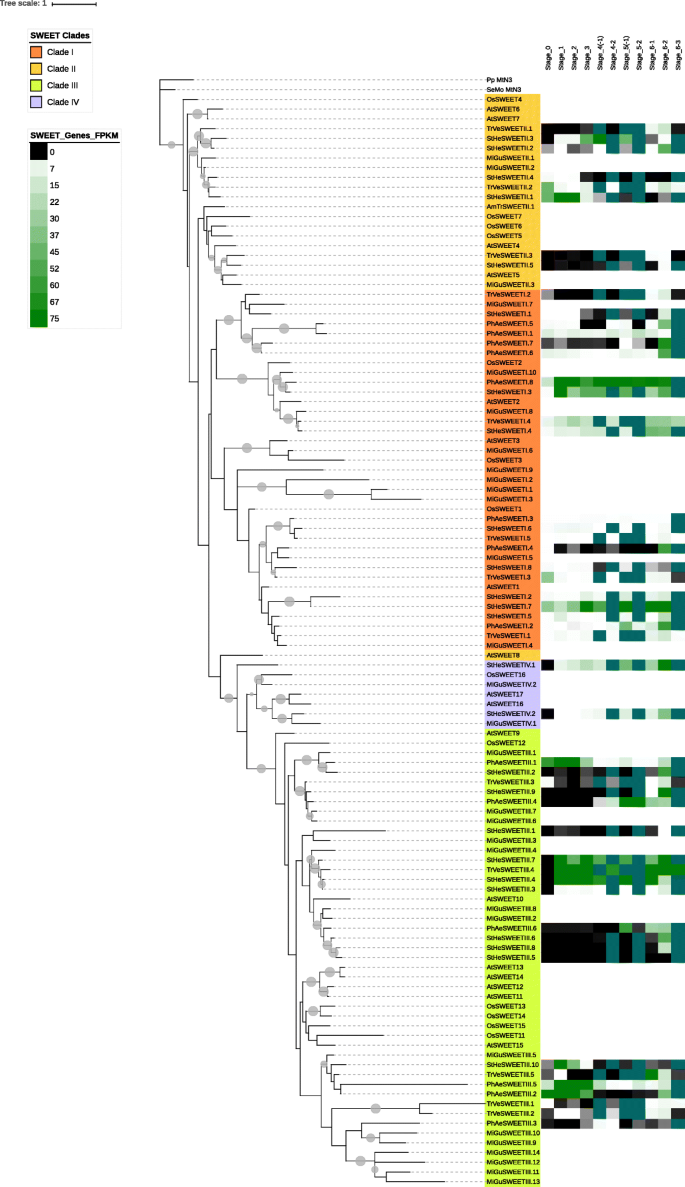
我们已在三个寄生植物中确定了MST,SUT和甜糖转运蛋白基因家族的成员,该祖英植物是兼性血珠Triphysaria杂色的, holoparasiticPhelipanche aegyptiaca和专性半寄生虫Striga hermonthica和非寄生虫Mimulus guttatus (syn。Erythranthe guttata)传统骨科的成员(现在彭霉菌)[66]那使用一种新的基因发现渠道。这个发现管道(见材料和方法)使用一套基于域结构的严格规则来定义基因家族成员。确定SUT家族的成员并适应库恩和格洛夫以前的系统发育组织[46]和Lalonde & Frommer [41].在本研究中,我们使用了来自米Sut3和Sut5的代表序列和拟南芥Sut1,Sut2和Sut4片,以查询寄生虫数据集。Clades Sut1 - Sut5在呈现的附图中给出,以及与Peng等人的先前研究的一致性。[58我们认为SUT1分支与Type I分支同义,SUT2分支与Type II分支同义,SUT4分支与Type III分支同义,SUT3和SUT5分支与Type IIB分支同义。为了寻找寄生植物的SWEET序列,我们使用了33个水稻SWEET基因序列的保守的SWEET域(21个来自于水稻粳稻亚种和12个indic亚种)和17个序列答:芥.表格1显示了基于三种寄生性植物转录组的MST, SUT和SWEET基因家族的估计大小m . guttatus基因组。这些是具有代表性的基因,其中多种异构体被排除在外。的预留hemiparasite美国hermonthica具有最多的表达MST代表性基因,略大于兼产寄生虫中的表达t .杂色的.这几乎是在全寄生虫中发现的两倍p . aegyptiaca.美国hermonthica也有表示SUTs和糖果的数量最多。这m . guttatus其中MST基因46个,SUT基因4个,SWEET基因29个1).相比之下,共有53个mst [45]及9个SUTs [58)在拟南芥基因组,而水稻基因组有65米,而[67]和5个SUTs [58].袁&王[68研究发现,在水稻基因组中有21个糖类,在水稻基因组中有17个糖类答:芥基因组。有两点值得注意这里。首先,由于转录从头组件的零碎的性质,我们对寄生虫种类的拷贝数是指估计的数字,因为准确的拷贝数也只能确定在全基因组组装和成熟的注释变为可用。Second, the sequence set at the nucleotide and amino acid level was examined for possible isoforms using the following criteria: sequences with attributes such as high similarity to other sequences, similar domain structure, and short (< 0.01) distances on a neighbor joining phylogram. These criteria were used to remove possible isoforms. However, the expression values from isoform-rich and single-isoform filtered datasets were studied.
糖转运蛋白基因家族的系统发育分析
接下来检查寄生物种内外MST,SUT和甜基因家族的各种成员的系统发育关系,以确定特定的植物中的相似性和差异是否占估计基因数的观察到的变化。在三种寄生物种中观察到MST系列结构的显着差异(图。1那2那3.那4.和5., 桌子1额外的文件1那2那3.那4.和5.).例如,PMT和STP进化支是最大的,其包括在所有三个寄生虫MST家族的进化枝,在成员ERD6样进化枝也正在家庭总大小的显著比例(表1).菲律宾人拥有最多的TMT基因,而斯特拥有最多的ERD6,int和STP基因。TriphysariaPMT和VGT基因最多,而MimuluspGLT/SGB基因数量最多。
一般来说,这三种寄生虫在这些物种的SUT科(即SUT1, SUT2和SUT4)的三个分支中有相当数量的成员。唯一的例外是SUT1和SUT4基因在美国hermonthica相对于它的同类(图。4., 桌子1).美国hermonthica在三种寄生虫中具有最多的SWEET基因(图。5., 桌子1),几乎是甜基因总数的两倍t .杂色的和p . aegyptiaca.扩张美国hermonthica似乎主要是在SWEET进化支II和III中。总的来说,与它们的非寄生亲戚相比m . guttatus,这三种寄生植物在枝II中代表过多,而在枝III SWEETS中代表不足。在寄生虫中,SWEETSs的数量和分布美国hermonthica和的最相似吗m . guttatus.仅有的斯特和Mimulus进化支IV中有SWEET基因(表1,无花果。5.).
三种寄生植物中糖转运体的表达
为了揭示不同寄主依赖水平的寄生虫之间可能存在的糖转运基因表达差异,我们首先检测了不同MST、SUT和SWEET家族成员在不同发育阶段的表达水平(基于FPKM数据)。我们特别注意了寄主接触前后表达水平的显著差异。下面讨论每个转运蛋白家族的分析结果。寄生虫生命周期的每个阶段的描述可以在材料和方法中找到。在本分析中,为了避免低估各种糖转运体的表达水平,我们首先考虑的是基因水平的表达,而不是每个亚型的表达(如图所示)。2那3.那4.和5.和额外的文件1那2那3.那4.和5.).然而,由于可能性是存在的不同同工型中的生命周期,我们还研究了基因水平和同种型的表达水平都分别的不同阶段表达。这些值在其他文件中给出7.那8.和9..
MST基因家族
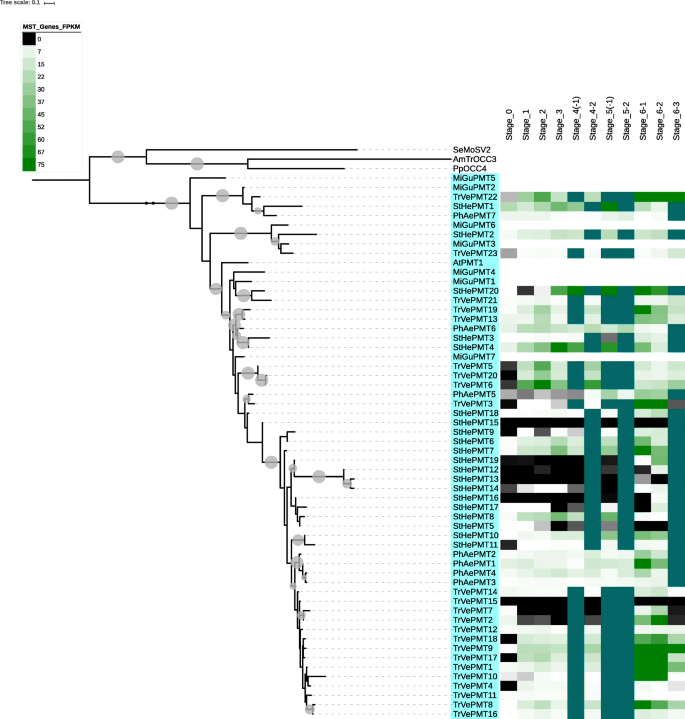
总的来说,各种寄生植物中MSTs的表达量从萌发到附着前根生长(第1和第2阶段)增加,在吸器连接阶段降低,然后在出苗前和出苗后的生长发育、开花和繁殖过程中再次增加(fig . 1和fig . 2)。2那3.那4.和5.和额外的文件1那2那3.那4.和5.).在MSTS中,在PMT和STP的地图中,增加的表达式最明显(附加文件6.).但是,急剧增加MST表达在出苗后的生长和繁殖阶段明显,在斯特和Triphysaria没有出现在菲律宾人(附加文件6.).在Triphysaria在萌发和附着根生长前(第1和第2阶段),MST的表达量也较高。
在这三种寄生植物中,ERD6-like分支的基因表达谱差异最大1和6.).例如,在菲律宾人, ERD6-like基因在附着后根生长(5-1期)和茎叶生长(6-1期)中大量表达斯特,大多数erd6样基因在萌发和生殖阶段强烈表达1和6.).
MSTS的pGLT进化枝的成员类似地示出了寄生虫生命周期(图中的差异表达。2额外的文件6.).在菲律宾人, pGLT成员在萌发期表达最多。在斯特,同源pGLT成员表达于吸器连接时间(第4-1阶段)和生殖芽发育(第6-2阶段),以及在Triphysaria, pGLT分支的序列在吸器前根生长过程中表达最强烈。在Triphysaria, INT分支中基因在叶和茎生长中表达较高(6-1)。在斯特, INT基因似乎在吸器前根生长(阶段1)和繁殖(阶段6-2)中更高表达(附加文件2和6.).研究植物,MimulusINT注释基因的比例最高,而Triphysaria, 最低的。
TMT分支中代表性基因的表达量在生长发育的前、后阶段最高菲律宾人,以及后新兴增长阶段斯特和Triphysaria(附加文件3.和6.).在这三种寄生虫中,大多数pts在生长后表达最强烈(附加文件)6.).然而,在Triphysaria, pts在吸器前根生长中也表达强烈(图。3.和附加文件6.).在斯特和Triphysaria,发现VGT分支成员在生长后的组织生长和繁殖过程中更高的表达(附加文件6.).然而,在菲律宾人,的VGT的表达吸器连接和芽后根生长期间最大(附加文件4.和6.).在这三种寄生植物中,STP分支的成员在生长和繁殖后表达最强烈。在Triphysaria,STP表达式在预计的增长中也强大(附加文件5.和6.),和斯特, STP在生长前表达最强。
SUT基因家族
SUT家族成员的表达似乎在三种寄生虫生命周期的后生长阶段最高(图。4.额外的文件6.).这一点在斯特和Triphysaria.然而,在种子萌发和吸器前生长过程中可以观察到显著水平的SUT表达斯特和Triphysaria(无花果。4.额外的文件6.).
SUT1分支的成员在萌发后的生长阶段表现出高表达,最高表达水平出现在植物进入生殖阶段(6-2阶段)。在菲律宾人例如,SUT1基因在6-1和6-2阶段(分别在地上茎和叶生长和繁殖)表达最强烈,而在6-1和6-2阶段斯特和Triphysaria,大多数SUT1基因在生殖阶段(6-2阶段)强表达(图6-2阶段)。4.额外的文件6.).SUT2分支成员在整个生命周期的各个阶段都有表达(图。4.额外的文件6.),对任何一个发展时间点没有强烈偏好。在吸器前根生长第3阶段和吸器连接第4-2阶段,SUT4分支的成员有较大程度的表达菲律宾人.在Triphysaria,Sut4表达在发芽期间最强(第0阶段)。
甜蜜的基因家族
的SWEET家族成员的表达谱显示在图。5..在一般情况下,我们观察到,从三个相关的寄生虫SWEET基因家族的成员往往有表达类似的模式在整个寄生虫生命周期与Triphysaria和斯特SWEET家庭成员最相似(图。5.额外的文件6.).总体而言,SWEET家族成员在寄生虫发育的生殖和花芽发育(6.2阶段)中表达最多(图)。5.额外的文件6.).在斯特和Triphysaria,也有一些SWEET基因在萌发和附着前根生长过程中表达更强烈(图。5.额外的文件6.).
保守基序和正交群分析
我们接下来检查了使用MEME分析定义了这些各种糖转运镜的成员的保守基板的性质(附加文件7.那8.那9.那10那11那12和13),与每个基序和每个基序的序列最常关联的正交群,发现在MST, SUT和SWEET基因家族。这样做是为了确定MST、SUT或SWEET的每个分支中的变异是否与这些分支中的表达差异相关,以及基于同源性搜索的基因家族定义与正群定义之间是否存在一对一的对应关系。与某些进化支、植物和阶段相关的主题的统计数据显示在附加文件中10那11和12;这些数据汇总在附加文件中13.总的来说,在糖转运子的每个分支中,存在着大量的母基,这些母基要么是专属于MST家族的某些分支,要么是强烈代表性的。
orthogroup analysis in OrthoFinder [69(附加文件14那15那16和17)usegalaxy.org[70揭示了许多正群是一个分支所特有的,但某些分支有不止一个正群。这里需要注意的是,虽然MST和SUT家族中的正群都包含一个Sugar_tr PFAM域,而SWEET正群都有一个MtN3_slv域,但不同分支的成员(以及正群)具有不同的保守MEME域架构(额外文件)10那11和12).
在MST家庭中,ERD6样,PGLT,INT和PMT的分支每个都有两个Orthogroups,它们是独一无二的。STP思工有五个Orthogroups。在SUT家族中,OrthoGroup 1431包含了Sut1和Sut4的所有成员,而Sut2 Clade仅包含Orthogroup 3807.在甜蜜的家庭中,Clade我几乎完全由三个Orthogroup表示(有一个Mimulus支II成员均属于支769,支III成员均属于支429,支IV成员均属于支2089。
在一些情况下,同一分支中的不同orthogroups被发现在不同的发展阶段有其表达的最高水平。其中这可以看作一个例子是STP进化枝的五个orthogroups(附加文件17).这可能是因为不同的STP分支成员对不同单糖有不同的亲和力[45].
讨论
寄生杂草在不同程度上依赖于寄主的营养需求,因此在其生命周期中,营养转运体的组织和表达可能需要在发育和时间上发生变化。我们的研究结果表明列当科,虽然有共同的糖转运基因,可能调整这些基因的表达,以回应他们的生活方式。p . aegyptiaca是holoparasite和美国hermonthica是一种专性hemiparasite [27].因为全寄生虫已经失去了与光合作用有关的解剖和分子特征[27那30.那70那71,预计与光合作用相关的糖转运体将会丢失菲律宾人.在曲目大小上的差异菲律宾人和斯特(例如,菲律宾人MSTs, sut和SWEETs比斯特)可以反映寄主对寄主依赖的不同状态,因为许多与光合作用相关的糖转运体可能在寄主中丢失菲律宾人.寄生虫MST、SUT和SWEET科组成的差异也可能反映了全寄生、专性和兼性半寄生形式之间营养偏好的差异[72].
糖转运体基因家族的系统发育分析
这3个寄生植物转录组包含了植物中所有7个mst分支(即ERD6-like, pGLT/SGB, INT, TMT, PMT, VGT, STP)的代表,与双子叶相关的3个SUT家族分支(即SUT1, SUT2和SUT4),以及之前鉴定的4个SWEETs分支。我们查询了所有三种寄生虫的数据集,以确定Kuhn & Grof定义的SUTs的两个单子叶特定分支是否存在同源性[46]由于它们存在于水平基因转移(HGT)中的存在,因此不存在于此美国hermonthica和其他植物列当科家庭 [73那74那75那76].但是,我们并没有发现被嵌套SUT3或SUT5的成员(见图内的任何SUTs。4.和附加文件8.).
所研究的寄生植物转录组中erd6样分支成员的比例比观察到的低答:芥基因组,有19个成员,占总数的35.8%拟南芥mst [77].因为在非寄生植物中erd6样蛋白将葡萄糖从液泡运输到细胞质[78,并考虑到寄生性植物已被认为是强大的糖吸收器[65, erd6介导的葡萄糖转运可能在寄生植物中受到限制。因为有证据表明一些STPs优先在根和花粉发育中发挥作用[45[推测三种寄生植物中的STP思维尺寸的差异可能反映每种植物中的差异需求并不是不合理。
先前已经报道,玉米的Sweet13同源物在叶脉管系统中具有更强的表达,因此在光合碳运动中可能是重要的,并且Sweet13A,B,C三敲除突变体的光合作用受损[76].在本研究中,我们观察到菲律宾人SWEET枝III在不需要光合作用的生长阶段(即5-2阶段和出苗前的生长阶段)更强(见附加文件)6.).相比之下,斯特和TriphysariaSWEET分支III在出水后6-1阶段(叶和茎)和生殖阶段6-2和花结构发育阶段6-3表现出较强的表达。因为斯特和Triphysaria与Holoparasitic不同,能够光合作用菲律宾人,表达水平之间的差异菲律宾人和偏瘫斯特和Triphysaria似乎是寄生植物之间的糖转运蛋白活性差异的差异,其与它们不同的宿主依赖性相关。
我们也发现了菲律宾人支系I的SWEETs所占比例最高(57.14%)菲律宾人)(表1),菲律宾人和Triphysaria没有任何枝IV的糖果,并且寄生植物的比例比枝III的糖果更小Mimulus,而斯特和Triphysaria有更大比例的支系II糖果比Mimulus.总的来说,这些结果表明;SWEET家族的糖转运体列当科寄生植物科的组织结构可能与其他植物不同。然而,必须注意的是,研究的转录组包含有足够高的转录水平的基因。在这些糖转运蛋白家族中,可能有一些基因转录水平不够高,不足以被纳入转录组研究,但可能会在完整的基因组组装和注释可用时被发现。
三种寄生植物中糖转运体的表达
据图。2和3.和额外的文件1那2那3.那4.和5.和7.,本研究中所有寄生性植物的MST表达在吸器根部前生长阶段普遍增加,在吸器附着和渗透阶段降低,在发育前期和后期显著增加。这一结果与大多数在连接后生长阶段对寄主植物造成的伤害是一致的[1].考虑到碳水化合物在发芽前就积累了p . aegyptiaca[79],糖转运蛋白可以参与在开花期期间动员这些碳水化合物的储存。
一些erd6样蛋白已经被证明参与了糖的液泡外运输[78].在寄生虫后生长和繁殖阶段期间,可能对宿主营养成分有可能需要更高的需求,因此可能预期随着寄生的发展,一些基于个体寄生虫需要差异地需要一些ERD6样蛋白。之前报道,INTS在调色剂中局部化,并在根本发展中发挥重要作用[43].在目前的研究中,非寄生虫Mimulus被发现具有较高比例的int相比,其寄生亲戚,兼性Triphysaria具有特别低的intt比例,这表明寄生植物对intt的要求可能与非寄生植物不同。在斯特,TMT表达更可能在营养生长期6-1期间强烈表达,并在菲律宾人,萌发前的根生长表现出很强的TMT表达的可能性最大(附加文件6.和7.),表明这些植物的液泡腔内有更多的葡萄糖和果糖动员,类似于图中所示拟南芥[80].多元醇的轮廓是主机依赖性[81].例如,p . aegyptiaca在番茄宿主上积累甘露醇[82].PMTS以及VGT,用于长途传输和Phloem Loading [83].本研究中研究的寄生虫都生长在不同的宿主上,因此,PMT基因在不同的寄生植物中有不同的表达谱也就不足为奇了。假设植物代谢不同的多元醇,并在不同的组织中积累不同水平的多元醇[84那么人们可能会认为在整个生命周期中有不同级别的转运体。这项研究的结果(见附加文件)6.)提示PMT分支的成员最有可能在6-1至6-3阶段表现出高水平的表达。在拟南芥,VGT蛋白主要在地上组织中表达[85].VGT基因在植物生长后期,特别是营养生长(6-1期)均有高表达斯特和Triphysaria与这些发现一致。在生长和生殖阶段,特别是在斯特和Triphysaria,与stps一致拟南芥花粉发育和根发育[期间被表达45].
Weise等人[53[报道,Sut4与光合素的运动有关,而Frost等人。[54]报道了SUT4参与了与水分胁迫相关的运输过程。在本研究中,SUT2是寄生植物SUT家族中表达最弱的成员(图。4.额外的文件8.)与Peron等人的结果一致[65,他们报告SUT2转录本在整个过程中以低水平积累p . ramosa生命周期.相反,表达PrSUT1和PrSUT3SUT1的成员p . ramosa),在花芽出露后表达最高[65].我们同样观察到SUT1在三种寄生虫的繁殖过程中表达最强。
在非寄生植物中,SUT1与韧皮部负荷有关[51那52那86]及卸货[50], SUT2已被提议作为蔗糖传感器[52].因此,有可能Triphysaria,一种兼培养物体在自由生活状态中的营养运动机制类似于附着在宿主时的营养运动的机制。在筛子元件的运输过程中也可以参与Sut1s检索蔗糖,并在诸如根和花结构之类的水槽器官中卸载。图2中的表达数据包括:4.和附加文件8.建议蔗糖卸载成花蕾。为了完全理解这是这种情况,还必须做到寄生植物中的Sut1和Sut2的调节研究。
在本研究中,SWEET的表达,尤其是在斯特和Triphysaria,在结束后的生长和特别是生殖阶段期间都是最强的。因此,这些结果与发现甜食已被证明将蔗糖从牙科细胞中排出到Phloem中[35].然而,其中也有SWEET分支II和III的成员Triphysaria在寄主前依附阶段表达更强烈。考虑到这些阶段的根和吸器的生长[28]和给定的进化枝III甜食AtSWEET11和AtSWEET12的根生长的作用[35那64,糖可能在吸器前根的生长中起作用菲律宾人或Triphysaria.
无花果。2那3.那4.和5.和额外的文件6.那7.那8.和9.提示吸器附着时出现少量高表达(3-4阶段)。虽然糖转运蛋白家族成员之间的表达变化可能是重要的,但重要的是要注意,如果它是可用的,仔细注释一个完整的基因组装配可以识别额外的未检测到的同源基因或几乎相同的副同源基因,它们在从头转录组装配中无法区分
据报道,RNAs(转录本和小rna)的移动发生在宿主和寄生植物之间[87那88].因此,利用RNAi转基因表达可以减少或消除寄主-寄主连接附着后发育所必需的特异性SWEETs,而寄主-寄主连接是获取寄主养分所必需的。有人提出利用RNAi更好地防御寄主植物免受寄生植物的侵害[89,并且这种方法可能会成功的建议已经出现,参见参考文献。[90那91].这些方法是否最终也会随着时间的推移而失效,从而使寄生虫绕过对特定靶向转运体的需求,仍然是一个悬而未决的问题[92].
保守基序和正交群分析
在本研究中,MEME分析[93发现了由不同进化支(如ERD6-like和PMT)的基因成员编码的蛋白质的共同和独特的保守基序(见附加文件)10那11那12和13).这些保守的基序可能对编码蛋白的不同功能(例如,它们的细胞靶向或底物利用)至关重要,这些功能对应于这些进化支中基因的发育和时间表达的差异。此外,在SUT和SWEET家族中存在着大量的专为拟南芥,米饭和本研究中的超组基因。这些结果表明,寄生植物糖转运蛋白可能使用来自非寄生植物中的不同图案,表明蛋白质结构差可能已经进化以满足寄生虫中的专用功能。
此外,与预期一致的是,分支定义与正群定义也不同。有的支只有一个正群,有的支则由多个正群组成。在MST家族中,虽然没有一个正交群属于多个分支的实例,但有一个分支具有多个正交群的实例(附加文件16).
在寄生植物SUT家族中,所有的SUT1和SUT4序列都与同一个正群相关,这一结果与Peng et al. [58],其中SUT1和SUT4被归为同一古群(AG1)的成员。糖转运蛋白基因家族的正群组成被用来研究正群是否可以解释一个分支内表达的变化。正如预期的那样,在更大的进化枝中,不同的正群在生命周期的不同阶段表现出不同的表达偏好(例如在STP进化枝中)。然而,这种变异的部分原因可能是不同正群的成员在不同物种中更频繁出现(附加文件17).在SWEET家族中鉴定的7个正群中,只有支II(正群,769)和支IV(正群2089)有单个正群成员16).然而,支I和支II共享一些正群重叠,表明这些支之间可能存在亲缘关系。
上述结果强调,需要进一步研究,以确定不同分支的MST, SUT和SWEET转运体的成员是如何在寄生虫与宿主的相互作用中使用。在检测各种MST、SUT和SWEET转运体中所代表的保守蛋白基序的同时,研究这些不同基因的不同表达的启动子中的保守调控基序也可能是有启发意义的。然而,目前这里研究的寄生植物只能获得转录组数据,因此,在获得全基因组数据之前,这种分析无法完成。
结论
在这项研究中,我们在三种寄生杂草中鉴定了糖转运体的MST、SUT和SWEET家族成员,p . aegyptiaca那美国hermonthica,t .杂色的,并研究了寄生虫生长发育过程中的各种基因家族成员和他们的差异表达之间的亲缘关系。我们表明,MSTS,SUTs和甜食的不同分支的成员差异表达整个寄生植物生命周期和表达谱依赖于寄生植物。我们的观察表明,不同的寄生植物被不同地调节糖转运蛋白表达和推测的一些差异可能是由于在宿主物种和由寄生的植物物种发挥宿主的依赖程度的差异。这与之前的建议是一致的寄生植物可能会改变他们的监管网络内的基因表达,从而最有效地寄生的宿主。如何完成这一步仍不清楚,但正如前面所提出的可能涉及调控糖转运蛋白基因表达的转录因子的成员和转录活性蛋白基因家族的差异表达或活化32那94].然而,这些研究确实确定了定向调控的潜在目标,这将有助于更好地了解营养物质的运输过程,或许还有助于控制这些寄生虫对作物产量的破坏性影响。
材料和方法
组织,转录组库的制备和序列分析
在Westwood等人中发现寄生虫生长和从寄生虫发育阶段的生物材料收集(从吸收的种子,萌发和出血,附着在地面组织上)。[28].Yang等人之前曾对转录组测序进行过描述[31并包含了从物种开始的多个寄生虫发育阶段t .杂色的那美国hermonthica,p . aegyptiaca在列当科所述。
数据源
的转录组组装和表达数据p . aegyptiaca那s . hermonthica和t .杂色的从PPGP网站的PPGP II数据集(http://ppgp.huck.psu.edu/download.php).从头开始的集会与Trinity一起表演[95],后处理成非冗余集,包括使用PlantTribes管道预测的编码序列及其对应的序列(https://github.com/dePamphilis/PlantTribes) [31].清洁的读数被映射到后处理的组装转录物和寄生虫发育阶段的表达丰度[28]估计使用RSEM管道[96]与Bowtie2 [97]读取校准选项。在PPGP II数据集的详细描述可在PPGP网站上。
众所周知拟南芥从NCBI蛋白,核苷酸和EST数据库中检索水稻甜序列[98那99那One hundred.].这拟南芥用于每个进化支的MSTs和SUTs(源自[38那41)也在相同的数据库中被发现。这Mimulus guttatus基因组2.0 [101那102]从Phytozome版本12.1中检索[103那104].
糖转运体的鉴定
这拟南芥利用上述发现的糖转运体序列和水稻SWEET序列作为查询,在寄生植物组装的转录组中搜索潜在的糖转运体p . aegyptiaca那s . hermonthica和t .杂色的,以及相关非寄生植物的注释基因组Mimulus guttatus.在寻找糖转运子序列中,FASTA、FASTX和TFASTX方法[105那106]从FASTA版本36.3.8e(2016年9月30日,从访问https://fasta.bioch.virginia.edu/fasta_www2/fasta_list2.shtml.[107]), e值截止值为1e-3。使用自定义Perl脚本检索潜在序列,该脚本包含来自BioPerl 1.7.1的模块[108那109].任何编码序列(CDS)或核苷酸(NT)序列使用自定义BioPerl脚本在6个阅读框架中翻译成氨基酸序列[110].搜索序列使用SANSPALLEXLE [111那112]查询UniprotKB数据库[113,每个查询显示50个命中序列,并且设置为“非常慢”。对于所有BLAST结果,对每个查询序列的最佳匹配进行检查,以确定一个序列是植物MST、SUT还是SWEET。只有最佳匹配的e值为1e-3或更小的序列被保留以供进一步分析。
多序列比对和系统发育分析
MEME Suite 4.12.0 [93那114]命令系用于发现在所研究的所有糖转运蛋白序列基序,预期任何数量的重复,100点的基序最大,并且每个基元具有宽度范围从25到250个氨基酸长,和最大迭代在所有250种为在相同的MEME运行,以便进行分析,以精确地确定哪个基序糖转运蛋白序列有共同的,并且该基序,如果有的话,可以是糖转运的MST,SUT或SWEET家庭某些进化枝的成员的功能是必需的。此外,所发现的基序被用于策划分析的所有序列和消除在序列集误报,从而确保更精确的下游分析。MEME在本研究中使用了两次,一次作为一个策工具,并且所述第二时间作为对基因家族(以下描述)内比较序列的工具。
使用MAFFT L-ins-i版本7.312进行多序列比对[115那116].
MSTs和SUTs是MFS超家族的成员,包含Sugar_tr或MFS_1 PFAM域,SWEETs包含MtN3_slv PFAM域。因此,具有合适PFAM结构域的序列(MST和SUT的Sugar_tr和MFS_1, SUT的gph_蔗糖,SWEET的MtN3_slv)被用来辅助糖转运蛋白系统发育树的生根;这些序列来自Physcomitrella金属盘基因组组装v3.3 [103),江南卷柏组装v1.0 (117和基部被子植物的基因组Amborella trichopodav1.0 (118].对于MSTs和SUTs,使用Phytozome中的术语“MFS”进行关键词搜索。对于SWEETs,利用BLASTP对Phytozome数据库(Phytozome Database)进行生根分析[103]的e值截止值为1e-5,使用Physcomitrella金属盘sequence from OrthoMCL database (ppat|e_gw1.127.40.1, orthogroup OG5_127038) [119];从三个蛋白质组中搜索到的最佳结果作为序列,作为本研究中SWEETs的外组。
分析序列集蛋白质,并研究了基因的转录本。首先,转录物序列进行比对并检查同种型中,该方法用于将在下面说明。一旦亚型从集合中删除,剩下的转录序列的名字被用来检索其蛋白质同行。然后,将蛋白质进行比对,并检查亚型。对于同一基因的亚型Mimulus那拟南芥在多序列比对之前,先将水稻序列删除。寄生植物序列可能是相同基因的同型被从序列集中删除,如下所述。为了确保系统发育树的准确,trimAl 1.4.1 [120]用于首先修剪对齐,以删除占比小于10%的列,然后消除任何覆盖低于50%对齐的序列(−resoverlap 0.50 -seqoverlap 50)。
转录本和蛋白质水平的比对过程包括使用我们开发的BioPerl脚本消除冗余序列,运行MAFFT,然后运行trimAl。重复这个过程,直到所有序列覆盖至少50%的比对。Yang等人(2015)也使用了类似的方法[31].此外,为了在系统发育数据集中发现潜在的异常点,利用ClustalW2程序构建了一个初步的neighbor-joining (NJ)系统发育树[121],使用未经校正的p距离和无间隙排除。If any non-outgroup branch length for a sequence was shown to be unusually long (i.e., branch length > 0.3 when related branches had lengths of under 0.1), the unaligned, non-trimmed version of that sequence was retrieved from the unedited assembly and then manually curated using information from SANSParallel, MEME or the Conserved Domain Database [60那93那122].在此之后,序列的新编辑版本替换了序列集中要对齐的未编辑版本。在上述初步NJ树序列中,发现了具有以下一种或多种标准的序列,并将其从序列集中剔除:序列相似性高(以分枝长度< 0.01表示),序列长度(太短而被怀疑为基因的截短版本),模因蛋白基序结构的相似性。然后重新排列序列。检测长分支、筛选长分支上的序列、去除潜在的异构体和重新排列的过程不断重复,直到极长的分支和异构体的存在(可能会误导系统发育)被最小化或消除。所得序列用于系统发育分析。系统发育树采用RAxML 8.2.11制作[123那124],使用1000个bootstrap复制,并使用PROTGAMMAAUTO选项,该选项自动包括模型测试,有五个gamma类别,并校正了Akaike信息标准(AICc) [125].图和附加文件中系统发育树上的序列名称为简写名称,并在附加文件中列出18与Fasta文件的相应名称旁边。
守恒基序与正群的分析
序列的序列的名称用于检索序列的未定版版本(即,在策株和对准之前的序列的版本)。这些未经编辑的序列版本通过MEME(使用上述参数)进行。生成的主题包含在其他文件中7.那8.和9..为了避免相同基因副本的存在,这将使分析不那么准确,在筛选和比对过程中被消除的序列没有被包括在分析中。将模因域与它们所属的序列连接,以确定模因基序与哪个分支、生命周期阶段和物种最密切相关。
系统发育分析中使用的未经编辑的序列版本也在OrthoFinder中使用[68]对银河服务器的分析[70],同时使用BLASTP和hmmscan作为蛋白质分类和1E-5的最小E值。
差异基因表达分析
寄生杂草感染寄主时的表达值[31]是基于寄生杂草侵染寄主植物后,以FPKM(单基因长度每千碱基每百万reads的片段数)表达的读计数,FPKM是基于每个物种文库中每个基因的读图谱结果。对于每个基因,这里研究的数据中的每个FPKM值表示给定基因的所有亚型的FPKM值之和。也就是说,后菲律宾人受感染的拟南芥和烟草;后斯特感染高粱;之后,Triphysaria受感染的Medicago Truncatula.[28那32].
Westwood等人(2012)详细描述了寄生虫每个发育阶段的名称。[28Yang et al., (2015) [31].在本研究中,0期代表萌发,1期和2期分别代表胚根伸长和吸器分化[28].第3阶段是寄生植物利用吸器附着在寄主植物上的阶段;第4阶段是寄生植物连接其维管系统[28].第5阶段是出生前组织、根(5.1)和芽(5.2)的生长阶段。第6.1阶段为茎叶萌发后的生长阶段,第6.2阶段为生殖和花蕾发育阶段,第6.3阶段为花的进一步成熟阶段Triphysaria[28].
使用我们开发的自定义Perl脚本,将每个糖传输器序列的表达式值放入文本文件中。使用交互生命树(iTOL) 4版本可视化系统发生、表达数据和保守模因域[126那127].
缩写
- AG1:
-
古代组1
- 银2:
-
古代组2
- CDD:
-
保守域数据库
- cd:
-
编码序列
- cd:
-
编码序列
- EBI:
-
欧洲生物信息研究所
- ERD6-like:
-
对脱水的早期反应
- 英语:
-
对脱水的早期反应
- 美东时间:
-
表达序列标签
- FPKM:
-
单基因每千碱基每百万reads的片段
- 去:
-
基因本体论
- HGT:
-
水平基因转移
- INT(警官):
-
肌醇运输车
- iTOL:
-
互动生命之树
- MAFFT:
-
快速傅里叶变换的多重对齐
- MEME:
-
多重Em Motif Elicitation
- MFS:
-
主要推动者蛋白质
- MST:
-
单糖转运蛋白
- MtN3:
-
Medicago Truncatula.Nodulin 3.
- NT:
-
核苷酸
- NT:
-
核苷酸
- pGLT:
-
Plastidic葡萄糖转运蛋白
- PLT:
-
多元醇运输车
- PMT:
-
多元醇/单糖转运蛋白
- PPGP:
-
寄生植物基因组计划
- RAxML:
-
随机轴轴最大可能性
- RNAi:
-
RNA干扰
- SANSParallel:
-
后缀数组邻域搜索并行
- STP:
-
糖转运蛋白
- Sugar_tr:
-
糖转运蛋白
- SUT:
-
蔗糖运输车
- 甜:
-
糖类最终将成为出口的转运体
- TM:
-
跨膜
- 台湾海陆运输公司:
-
Tonoplastic单糖转运体
- 结核菌素:
-
Tonoplastic糖转运蛋白
- VGT:
-
空泡的葡萄糖转运蛋白
参考文献
- 1.
Ejeta G的斯特非洲的祸害:日益严重的流行病。在:Ejeta G, Gresel J,编辑。整合新技术斯特控制:对结束迫害。新加坡:世界科学;2007. p。3-16。
- 2.
斯科尔斯,JD, Press MC。斯特粮食作物虫害是资源有限农业中尚未解决的问题。植物学报。2008;11(2):180-6。
- 3.
spallek t,utuku m,shirasu K.属斯特:一个女巫的侧写。植物病理学杂志。2013;14(9):861-9。
- 4.
Timko议员,Singh BB。豇豆,一种多功能的豆类植物。在:摩尔PH,明R,编辑。热带作物植物基因组学。纽约:施普林格纽约;2008.227 - 58页。
- 5.
马特维耶科,托雷斯,约德。半寄生植物的转录反应Triphysaria杂色的寄主植物信号。植物杂志。2001;127(1):272 - 82。
- 6.
卡德维尔KF, JA巷。土壤、种植制度和寄主表型对褐飞虱发病和严重程度的影响Striga gesnerioides在西非种植豇豆农业生态学报。1995;53(3):253-62
- 7.
独脚金的寿命(Striga asiatica)种子。杂草科学。2017;32(4):494 - 7。
- 8.
尤德霁。寄生对寄主植物的识别玄参科.植物学报。2001;4(4):359-65。
- 9.
孙志强,王志强,王志强,等斯特和化学信号有关:控制方法的目标。在:Ejeta G, Gressel J,编辑。整合新技术斯特控制:结束政治迫害。新加坡:世界科学;2007. p。47–60.
- 10.
Kokla A, Melnyk CW。形成吸器:寄生植物中吸器的形成。Dev杂志。2018;442(1):53-9。
- 11.
寄生开花植物的生物学特性。伯克利:加州大学出版社;1969.
- 12.
dePamphilis CW, Palmer JD。一种寄生开花植物质体基因组中光合作用和氯呼吸基因的丢失。大自然。1990;348(6299):337 - 9。
- 13.
Wolfe KH, modern CW, Palmer JD。非光合寄生植物最小质体基因组的功能和进化。中国科学(d辑:地球科学)1992;89(22):10648-52。
- 14.
陈志强,陈志强,陈志强,等。植物同工酶变异的初步研究列当籽和Orobanche aegyptiaca来自叙利亚。在:Ter Borg SJ,编辑器。生物学和控制研讨会的诉讼程序奥诺坎普.荷兰瓦赫宁根:农业大学植被科学系、植物生态学和杂草科学系;1986.154 - 9页。
- 15.
全寄生属的种内和种间的关系hy(Orobanchaceae)从ISSR系和核苷酸序列推断出来。SYST BOT。2001; 26(1):120-30。
- 16.
Román B.寄生杂草种群多样性及其动态。在:Joel DM, Gressel J, Musselman LJ,编辑。寄生虫口科:寄生机制与控制策略。柏林:施普林格柏林海德堡;2013.345 - 56页。
- 17.
Katzir N,Portnoy V,Tzuri G,Joel DM,CasteJón-muñozM。在寄生杂草研究中使用随机扩增的多晶型DNA(RAPD)标记奥诺坎普.中国科学(d辑:地球科学)1996;93(3):367-72。
- 18.
飞天扫帚与飞天扫帚之间的变异(奥诺坎普)品种的RAPD分析。遗传。1997; 78:68-74。
- 19.
Young ND, Steiner KE, dePamphilis CW。玄参科/Orobanchaceae寄生的进化:质体基因序列驳斥了进化过渡系列。(1)中国科学(d辑:地球科学);
- 20.
Schneeweiss GM, Colwell A, Park J-M, Jang C-G, Stuessy TF。holoparasitic发展史奥诺坎普从核ITS序列推断(Orobanchaceae)。acta physica sinica . 2004;30(2): 465-78。
- 21.
王志刚,王志刚。植物寄生科植物的系统发育研究进展[J] .植物学报,2006;37(6):739 - 743。
- 22.
红三叶草的抗性研究(三叶草pratense)到根寄生植物Orobanche小被水杨酸盐激活而不是茉莉酸盐。安机器人。2007;100(3):537 - 44。
- 23.
黄锟,刘国栋,板岩J, Press MC, Scholes JD。与寄生植物发生感病或抗性互作的水稻品种的基因表达的全球模式Striga hermonthica.新植醇。2008;179(2):515 - 29。
- 24.
黄K,梅勒KE,保罗SN,劳森MJ,麦基AJ, Timko MP。豇豆亲和和不亲和互作过程中基因表达的全球变化(豇豆属unguiculataL.)与根寄生的AnviospermStriga gesnerioides.BMC基因组学。2012; 13(1):402。
- 25.
托雷斯·乔丹,托米洛夫AA,托米洛娃N,里根RL,约德。Pscroph,一个寄生植物EST数据库,丰富了寄生相关转录本。植物学报。2005;5(1):24。
- 26.
acta botanica yunnanica yunnanica yunnanica yunnanica yunnanica yunnanica yunnanica yunnanica yunnanica yunnanica yunnanica yunnanica yunnanica yunnanica yunnanica yunnanica yunnanica yunnanica yunnanica yunnanica yunnanica yunnanica yunnanica yunnanica yunnanica yunnanica yunnanicaStriga hermonthica.植物学报。2010;10(1):55。
- 27.
Westwood JH, Yoder JI, Timko MP, dePamphilis CW。植物寄生的进化。植物科学进展。2010;15(4):227-35。
- 28.
Westwood JH, dePamphilis CW, Das M, Fernández-Aparicio M, Honaas LA, Timko MP, et al.;寄生植物基因组计画:理解生物学的新工具奥诺坎普和斯特.60杂草科学。2012;(2):295 - 306。
- 29.
寄生性植物基因组计划http://ppgp.huck.psu.edu/.2017年8月12日访问。
- 30.
黄凯,吴斌,等。寄生植物Orobanchaceae的转录组揭示了惊人的叶绿素合成守恒。咕咕叫医学杂志。2011;21(24):2098 - 104。
- 31.
杨志强,张海涛,张海涛,等。比较转录组分析揭示核心寄生基因,并提出基因复制和重新利用作为结构新颖性来源。生物医学进展。2015;32(3):767-90。
- 32.
acta optica sinica, 2010, 31 (4): 551 - 551 . acta optica sinica, 2010, 31(4): 551 - 551。通才寄生植物的功能基因组学:激光显微解剖寄主-寄主界面揭示寄主特有的寄主基因表达模式。植物学报。2013;13(1):9。
- 33.
王志强,王志强,王志强,等。植物中糖转运蛋白的研究进展。植物科学进展,2000;5(7):283-90。
- 34.
Gamas P, de Carvalho Niebel F, Lescure N, Cullimore JV。使用减法杂交方法来识别新的Medicago Truncatula.根瘤发育过程中诱导的基因。植物营养与肥料学报。1996;9(4):233-42。
- 35.
Chen L-Q,曲X-Q,侯B-H,SOSSO D,Osorio S,Fernie Ar等。由甜蛋白介导的蔗糖流出作为韧皮磷酸输送的关键步骤。科学。2012; 335(6065):207-11。
- 36.
陈立强,侯波和,Lalonde S, Takanaga H, Hartung ML,曲晓强,等。病原体细胞间交换和营养的糖转运体。大自然。2010;468:527-32。
- 37.
王志强,王志强,王志强,等。植物糖转运体及其与真菌相互作用的研究进展。植物学报,2012;17(7):413-22。
- 38.
王志强,王志强,王志强,等。番茄糖转运体的全基因组鉴定与表达分析。植物生理学报。2014;55(6):1123-41。
- 39.
yddy vs,shlykov ma,castillo r,sun ei,saier mh。重新审视主要促进者超级家族(MFS)。FEBS J. 2012; 279(11):2022-35。
- 40.
ERD6是一种早期脱水诱导基因的cDNA克隆拟南芥,编码一个假定的糖转运体。生物物理学报。1998;1370(2):187-91。
- 41.
Lalonde S, Frommer W. SUT蔗糖和MST单糖转运体的研究卷柏基因组。植物学报2012;3:24。
- 42.
王志强,王志强,王志强,等拟南芥肌醇转运体1,一种新的肌醇液膜定位转运体。植物细胞。2008;20(4):1073 - 87。
- 43.
Schneider S, Schneidereit A, Udvardi P, Hammes U, Gramann M, Dietrich P, et al.;拟南芥肌醇玩命快递2介导跨质膜不同肌醇差向异构体和衍生物的H +同向转运。植物理性。2007; 145(4):1395-407。
- 44.
Wormit A,Trentmann O,Feifer I,Lohr C,Tjaden J,Meyer S等人。新型单糖转运蛋白的分子鉴定和生理特征拟南芥参与液泡糖运输的。植物细胞。2006;18(12):3476 - 90。
- 45.
BüttnerM.该拟南芥糖转运体(AtSTP)系列:更新。植物BIOL。2010; 12:35-41。
- 46.
Kühn C, Grof cpls .高等植物蔗糖转运体。植物生态学报。2010;13(3):287-97。
- 47.
li H, li H, li H, et al ., et al ., et al ., et al ., et al ., et al ., et al ., et al ., et al . .植物生理学杂志。2011;168(12):1426-33。
- 48.
Bürkle L, Hibberd JM, Quick WP, Kühn C, Hirner B, Frommer WB。H+-蔗糖协同转运体NtSUT1是烟草叶片糖出口的关键。植物杂志。1998;118(1):59 - 68。
- 49.
Slewinski TL,加尔格A,Johal GS,布朗DM。玉米SUT1功能韧皮部装载。植物信号表现。2010; 5(6):687-90。
- 50.
Milne RJ, Grof CPL, Patrick JW。韧皮部卸载机制:由细胞通路、电导和汇功能形成。植物生态学报2018;43:8-15。
- 51.
Barker L,Kühnc,Weise A,Schulz A,Gebhardt C,Hirner B等人。Sut2,筛子元件中的推定蔗糖传感器。植物细胞。2000; 12(7):1153-64。
- 52.
高志强。植物蔗糖转运体的分子生物学特性。2月。2007;581(12):2309 - 17所示。
- 53.
Weise A,Barker L,Kühnc,lalonde s,buschmann h,frommer wb,等。蔗糖转运蛋白的新亚家族,Sut4,具有低亲和力/高容量的植物的筛选元素。植物细胞。2000; 12(8):1345-55。
- 54.
Frost CJ, Nyamdari B, Tsai C-J, Harding SA。液泡体定位的蔗糖转运体杨树(PtaSUT4)调控整株植物的水分关系、对水分胁迫的响应和光合作用。《公共科学图书馆•综合》。2012;7 (8):e44467。
- 55.
李志强,李志强,李志强,等。蔗糖转运体StSUT4的光周期调控影响昼夜节律调控基因的表达和乙烯的产生。植物学报2013;4:26。
- 56.
等。蔗糖转运体LjSUT4在Lotus对虾结节的发展。J Exp Bot. 2003;54(388): 1789-91。
- 57.
杜德和,马立新,张立新,等。碳源-碳汇关系研究进展拟南芥:蔗糖转运体的作用。足底。2018;247(3):587 - 611。
- 58.
彭丹,顾旭,薛立军,李本斯。蔗糖转运体的贝叶斯系统发育:单子叶和双子叶的古老起源、差异扩展和收敛进化。植物科学学报2014;5:615。
- 59.
宣永华,胡玉波,陈立强,索索索,杜凯,侯碧华,等。细菌和植物SWEET糖转运蛋白家族寡聚化的功能作用。中国科学院院刊。2013;110(39):E3685-94。
- 60.
保守域数据库(CDD)和资源。国家生物技术信息中心,贝塞斯达,2017。https://www.ncbi.nlm.nih.gov/structure/cdd/cdd.shtml..修订日期:2017年12月1日
- 61.
Ponting CP, Mott R, Bork P, Copley RR。新的蛋白质结构域和重复果蝇黑胶基:对结构、功能和进化的洞察。基因组研究》2001;11(12):1996 - 2008。
- 62.
植物生物学中的糖转运体。植物学报。1999;2(3):187-91。
- 63.
Lingner U,明希S,Deising HB,一个hemibiotrophic植物病原体的绍尔N.己糖转运:功能的变化和在感染的不同阶段监管差异。J Biol Chem。2011; 286(23):20913-22。
- 64.
陈L-Q。韧皮部运输和病原菌营养的甜糖转运体。新植醇。2014;201(4):1150 - 5。
- 65.
庇隆T,CANDAT A,Montiel的G,韦罗内西C,周永东,刘子藩d,Delavault P,等人。新的见解韧皮部卸和蔗糖转运表达在寄生植物的营养汇Phelipanche ramosal .(球形顶饰)。植物科学学报。2017;7:2048。
- 66.
奥姆斯特德RG,德Pamphilis CW,沃尔夫AD,杨ND,Elisons WJ,Reeves的PA。玄参的解体。我是J机器人。2001; 88(2):348-61。
- 67.
地方检察官约翰逊,马托马斯。单糖转运蛋白基因家族拟南芥和米饭:重复,自适应演化和功能分歧的历史。mol Biol Evol。2007; 24(11):2412-23。
- 68.
袁敏,王胜。水稻MtN3/唾液/SWEET家族基因及其同源性研究。摩尔。2013;6(3):665 - 74。
- 69.
Emms DM, Kelly S. OrthoFinder:解决全基因组比较中的基本偏差极大地提高了orthogroup推理的准确性。基因组医学杂志。2015;16(1):157。
- 70。
Afgan E, Baker D, Batut B, van den Beek M, Bouvier D, Čech M,等。可访问、可复制和协同生物医学分析的银河平台:2018年更新。核酸Res. 2018;46(W1): W537-44。
- 71。
寄生植物在所有三个基因组中都增加了分子进化的速率。BMC Evol Biol. 2013;13(1):126。
- 72.
Těšitel J, Plavcová L, Cameron d .半寄生植物与寄主的相互作用。植物学报。2010;5(9):1072-6。
- 73.
杨Z,张y,Wafula ek,Honaas La,Ralph Pe,Jones S等人。水平基因转移更频繁地随着异营养的增加,有助于寄生虫适应。PROC NATL ACAD SCI。2016; 113(45):E7010-9。
- 74.
利用寄生性植物进行基因转移Striga hermonthica.科学。2010;328(5982):1128。
- 75.
张Y,费尔南德斯-阿帕里西奥男,Wafula EK,达斯男,焦Y,Wickett NJ,等人。水平获得的豆科植物基因的进化,白蛋白1,在植物寄生Phelipanche aegyptiaca和相关的物种。BMC Evol Biol. 2013;13(1):48。
- 76.
杨建平,杨建平,杨建平,等。zmsweet13a, b, c蔗糖转运体三敲除突变体的韧皮部负荷受损Zea Mays..新植醇。2018;218(2):594 - 603。
- 77.
Büttner M.单糖转运体(−like)基因家族拟南芥.2月。2007;581(12):2318 - 24。
- 78.
Weber A, Servaites JC, Geiger DR, Kofler H, Hille D, Gröner F,等。一个假定的可塑葡萄糖转运体的鉴定、纯化和分子克隆。植物细胞。2000;12(5):787 - 801。
- 79.
陈志强,陈志强,陈志强,等Phelipanche aegyptiaca显示其发育阶段和不同器官的显著变化。植物学报,2017;
- 80。
维管植物中单糖转运体及其同源物的不同功能作用:生理学角度。摩尔。2011;4(4):641 - 62。
- 81。
李志强,李志强,李志强,等。环醇在植物体内积累的生理意义槲寄生专辑l . *。新植醇。1992;121(3):431 - 8。
- 82。
Hacham Y,Hershenhorn J,Dor E,Amir R.埃及锦标赛的主要代谢分析(Phelipanche aegyptiaca)与其宿主番茄根相比。J植物理性。2016; 205:11-9。
- 83。
李志刚,李志刚,李志刚。多元醇在高等植物中的迁移。植物生理与生物化学。2001;39(9):717-28。
- 84.
Makinen KK。Söderling E.定量研究甘露醇,山梨醇,木糖醇,和木糖在野生浆果和商业水果。食品科学,1980;45(2):367-71。
- 85.
Aluri S,BüttnerM.识别和功能表达拟南芥液泡葡萄糖转运体1及其在种子萌发和开花中的作用。中国科学院院刊。2007;104(7):2537-42。
- 86.
Kühnc,hajirezaei m-r,fernie ar,roessner-tunali u,czechowski t,hirner b等。蔗糖转运蛋白STSUT1定位于马铃薯块茎骨折中的筛子元素,影响块茎生理学和发育。植物理性。2003; 131(1):102-13。
- 87.
Westwood JH, Roney JK, Khatibi PA, Stromberg VK。寄生植物与寄主之间的RNA易位。中国生物防治学报。2009;65(5):533-9。
- 88.
王峰,王峰,王峰,等。来自寄生植物的microrna五角定目标宿主信使rna。大自然。2018;553:82-5。
- 89.
yoder ji,gunathilake p,wu b,tomilova n,tomilov aa。工程对抗RNA干扰的寄生杂草的抵抗力。害虫管理科学。2009; 65(5):460-6。
- 90。
Frommer WB。蔗糖转运体及培育抗病植物的方法。:谷歌的专利;2014.
- 91。
Bock R,Jiang Z,Heckel DG和Khan SA。“通过在塑性水中表达双链RNA来”从害虫或病原体中植物保护。“美国专利申请15/537,410,于2017年11月30日提交。
- 92。
Fernández-Aparicio M, Reboud X, gibert - leclerc S.扫帚草。寄生的地下机制及其控制策略:综述。植物学报。2016;7:135。
- 93。
贝利,博登,布斯克,弗里斯,格兰特,克莱门提,等。MEME套件:motif发现和搜索工具。核酸Res. 2009;37: W202-8。
- 94。
植物的糖敏感和信号转导:保守的和新颖的机制。植物学报。2006;57(1):675-709。
- 95。
Grabherr MG, Haas BJ, Yassour M, Levin JZ, Thompson DA, Amit I,等。没有参考基因组的RNA-Seq数据的全长度转录组组装。生物科技Nat》。2011;29:644-52。
- 96.
Li B,杜威CN。RSEM:具有或不具有参考基因组的RNA-SEQ数据的准确转录物定量。BMC Bioinf。2011; 12(1):323。
- 97.
Langmead B,Salzberg SL。与Bowtie 2. NAT方法的快速喷射读取对齐。2012; 9:357-9。
- 98.
NCBI蛋白质数据库。国家生物技术信息中心,贝塞斯达,2017。http://www.ncbi.nlm.nih.gov/protein.访问日期:2017年6月1日
- 99.
NCBI核苷酸数据库。国家生物技术信息中心,贝塞斯达,2017。http://www.ncbi.nlm.nih.gov/nicerotide..访问日期:2017年6月1日
- 100。
NCBI EST数据库。国家生物技术信息中心,贝塞斯达,2017。http://www.ncbi.nlm.nih.gov/est.访问日期:2017年6月1日
- 101。
Hellsten U,Wright Km,Jenkins J,Shu S,Yuan Y,Wessler SR等人。减少减数分裂重组的微量变化Mimulus从人口鸟枪测序推断。PROC NATL ACAD SCI。2013; 110(48):19478-82。
- 102。
哈特曼U,视觉T,飞利浦,J.沟酸浆属项目主页。www.mimulusevolution.org/(2010).2017年5月4日。
- 103.
Phytozome v12.1。能源部科学办公室,华盛顿特区。2017.https://phytozome.jgi.doe.gov/pz/portal.html2017年8月12日访问。
- 104.
等。植物群落:绿色植物基因组学的比较平台。核酸学报2012;40:D1178-86。
- 105.
Lipman D,Pearson W.快速和敏感的蛋白质相似性搜索。科学。1985; 227(4693):1435-41。
- 106.
皮尔森WR,李普曼DJ。改良的生物序列比较工具。中国科学(d辑:地球科学)1988;85(8):2444-8。
- 107.
皮尔森WR。UVA FASTA服务器。https://fasta.bioch.virginia.edu/fasta_www2/fasta_list2.shtml..2017年6月3日。
- 108.
Stajich JE, Block D, Boulez K, Brenner SE, Chervitz SA, Dagdigian C,等。Bioperl工具包:用于生命科学的Perl模块。基因组研究》2002;12(10):1611 - 8。
- 109.
CJ字段。BioPerl 1.7.1上。http://search.cpan.org/~cjfields/BioPerl-1.007001/.访问日期:2016年12月3日
- 110。
Misra VA,王Y,Timko MP。豇豆的转录因子和转录活性蛋白质编码基因家族的汇编(豇豆属unguiculataL.)。BMC基因组学。2017; 18(1):898。
- 111。
Somervuo P,Holm L. Sansparelialle:互动同源性搜索uniprot。核酸RES。2015; 43(W1):W24-9。
- 112。
河中沙洲l . SANSparallel。http://ekhidna2.biocenter.helsinki.fi/sans/.于2017年5月4日生效。
- 113。
在如Uniprot联盟。UniProt的:通用蛋白质知识库。核酸RES。2017; 45(D1):D158-69。
- 114。
模因(Multiple Em for Motif Elicitation)。http://meme-suite.org/tools/meme.2017年8月12日生效。
- 115.
Katoh K,Standley DM。Mafft多序列对齐软件版本7:性能和可用性的提高。mol Biol Evol。2013; 30(4):772-80。
- 116.
Katoh K: MAFFT v7.312。http://mafft.cbrc.jp/alignment/software/(2013)。2017年11月1日生效。
- 117.
银行Ja,Nishiyama T,Hasebe M,Bowman JL,Gribskov M,Depamphilis C,等。这卷柏基因组鉴定与维管植物进化相关的遗传变化。科学。2011;332(6032):960 - 3。
- 118.
琥珀基因工程。这Amborella基因组与开花植物的进化。科学。2013;342(6165):1241089。
- 119.
陈飞,麦基AJ, Stoeckert CJ Jr, Roos DS。OrthoMCL-DB:查询一个完整的多物种正交群集合。核酸Res. 2006;34(sup1): D363-8。
- 120。
Capella-Gutiérrez S, Silla-Martínez JM, Gabaldón T. trimAl:用于大规模系统发育分析的自动校准修整工具。生物信息学,2009,25(15):1972 - 3。
- 121.
陈志强,陈志强,陈志强,等。clusteral W和clusteral X 2.0版本。生物信息学。2007;23(21):2947 - 8。
- 122。
Marchler-Bauer A, Derbyshire M, Gonzales N, Lu S, Chitsaz F, Geer L, Geer R, He J, Gwadz M, Hurwitz D. CDD: NCBI的保守域数据库。核酸Res. 2015;43: D222-6。
- 123。
Stamatakis a . RAxML版本8:系统发育分析和大系统发育后期分析的工具。生物信息学。2014;30(9):1312 - 3。
- 124。
Exelexis实验室。8.2.11 RAxML版本。https://sco.h-its.org/exelixis/web/software/raxml/index.html.2017年8月12日生效。
- 125。
Hurvich CM,蔡C-L。小样本的回归和时间序列模型的选择。Biometrika。1989; 76(2):297-307。
- 126。
交互式生命树(iTOL):系统发育树显示和注释的在线工具。生物信息学。2007;23(1):127 - 8。
- 127.
交互式生命之树(iTOL)版本4。http://itol.embl.de.于2017年12月16日通过。
致谢
非常感谢Zhenzhen Yang对分析的建议,并感谢PPGP组生成本研究中使用的转录组数据。
资金
VAM研究和参与,EKW YW,慢性消耗病,和MPT是由美国国家科学基金会支持植物基因组研究项目(dbi - 0701748和ios - 0701748)授予詹姆斯·韦斯特伍德慢性消耗病,约翰·尤达和MPT,额外的资金和支持VAM和MPT来自NSF格兰特(ios - 1213059)授予MPT。
数据和材料的可用性
所有数据和材料可根据要求提供。
作者信息
从属关系
贡献
MPT和CWD构想了这个项目,并指导了所有的研究活动。VAM在YW的帮助下对糖转运体进行了计算分析。EKW创建了meta- assembly和软件,并进行了转录组范围的表达分析,糖转运体的计算分析基于此。所有作者都参与了稿件的撰写,并已阅读并批准了稿件的最终提交版本。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
两位作者宣称他们没有相互竞争的利益。
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
附加文件
额外的文件1:
寄生植物转录组和非寄生植物mst的erd6样分支Mimulus基因组。请注意,TriphysariaERD6-like分支成员在阶段2表达最强,与菲律宾人和斯特.(PDF 30 kb)
额外的文件2:
寄生植物转录组和非寄生植物mst的INT分支Mimulus基因组。值得注意的是,与大多数其他植物寄生糖转运蛋白家族一样,在吸器前生长阶段表达量增加,在吸器连接阶段表达量减少,而在出苗前和出苗后生长和繁殖中表达量增加。(PDF 26 kb)
额外的文件3:
mst的TMT分支来自寄生植物转录组和非寄生植物Mimulus基因组。注意,在连接前和吸器连接阶段,TMT表达轻微增加。(PDF 24 kb)
额外的文件4:
从寄生植物转录组和非寄生MSTS的VGT分支Mimulus基因组。注意6-1和6-2阶段更强烈地表达更强烈的趋势。(PDF 23 KB)
额外的文件5:
来自寄生植物转录om和非寄生的STP的MSTSMimulus基因组。注意期间后附着阶段表达增加Triphysaria.(PDF 44 kb)
额外的文件6:
糖转运蛋白的数量以及它们在表达最强的阶段Phelipanche aegyptiaca。mst、SUTs和SWEETs的每个分支以及所有mst、SUTs和SWEETs的转录组最强表达阶段均被显示p . aegyptiaca那美国hermonthica那t .杂色的.(XLSX 13 KB)
额外的文件7:
MST基因的最大似然树,带有热图和域结构。请注意,随着生命周期的每个连续阶段,表达式的一般增加。(PDF 158 kb)
附加文件8:
在SUT基因的最大似然树,热图和域架构。需要注意的是,在SUT1分支,有一个基因在以后的生命周期阶段更强烈的表达,在阶段6-2在表达急剧增加高潮的倾向。(PDF 43 KB)
额外的文件9:
SWEET基因的最大似然树,带有热图和域架构。注意,在繁殖阶段6-2,除了在分支II和分支III中有一些例外,表达水平有较高的趋势。(PDF 73 kb)
额外的文件10:
模因母题及其与生命周期各阶段的关联。这些关联是通过寻找这些基序所属的基因来确定的,并决定了这些基因最强烈表达的阶段。这是为(A) mst, (B) SUTs和(C) SWEETs做的。最密切相关的主题阶段测定发现阶段出现次数最高的原始的图案在那个阶段,以及代表的主题图案出现在基因的比例显示强烈的表达在这阶段。(XLSX 47 kb)
额外的文件11:
研究了模因基序及其与植物的关系。这些关联是通过寻找包含给定基序的基因来确定的。这是为(A) mst, (B) SUTs和(C) SWEETs做的。与基序联系最紧密的植物种类是通过发现基序出现的原始数量最高的植物,以及该基序在MST、SUT或SWEEET家族中实例的百分比来确定的。(XLSX 33 kb)
额外的文件12:
MEME主题及其与MSTS,SUTS或甜食的曲线的协会。通过找到这些基序所属的哪个基因并确定这些基因所属的疏水的基因来确定这些关联。这是为(A) mst, (B) SUTs和(C) SWEETs做的。通过在该阶段中寻找具有最高原始序列的原始次数的思想而确定基序最强烈相关的思想,以及该基序作为在基因中存在的基因百分比的百分比显示出最强的表达的百分比那个思考。此外,发现并计算了MST,SUT或SWEED CLADES独特的MEME主题。(XLSX 43 KB)
额外的文件13:
(A) MST, (B) SUT和(C) SWEET家族中的模因。对于每个基序,显示了包含这些基序的基因表达最强烈的阶段,以及包含这些基序的基因最常见的植物和分支,以及每个基序的一致序列。(XLSX 24 kb)
额外的文件14:
三各阶段Orthogroups列当科生命周期。数据表明,在整个生命周期的不同阶段,不同的正群表达,尤其是在MST家族中。(XLSX 21 kb)
额外的文件15:
最常与正群相联系的种。注意某一正交群成员的原始数量与属于该正交群成员的物种序列的百分比之间的差异。(XLSX 13 KB)
额外的文件16:
每个正群与之联系最紧密的分支。这些正群在A) MST, B) SUT和C) SWEET家族中被鉴定。注意,许多糖转运子分支至少有一个它们所特有的正群。在SUT家族中,一个正群将所有SUT1和SUT4序列作为成员进行研究。(XLSX 14 kb)
额外的文件17:
每一个糖转运体基因,它们表达最强的阶段,分支和正交群。在A) MST, B) SUT和C) SWEET家族中列出了基因的分支、最强表达阶段和正群。(XLSX 10 kb)
权利和权限
开放获取本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
米斯拉,瓦夫拉,e.k.,王y。et al。根寄生被子植物MST、SUT和SWEET家族糖转运蛋白的全基因组鉴定及其在寄主寄生过程中的表达分析BMC植物杂志19,196(2019)。https://doi.org/10.1186/s12870-019-1786-y
收到了:
公认:
发表:
关键字
- 寄生植物
- 糖转运蛋白
- MST
- SUT
- 甜蜜的
- 表达式
- 列当科